Method Article
大規模混合ステージ カエノハブディティス・エレガンス集団の 文化とアッセイ
要約
オミックス研究でカエノハブディティス・エレガンス(C.エレガンス)を使用するには、比較分析のためにプラットフォーム間で1つのサンプルを測定できるワームの集団を大量に生成する方法が必要です。ここでは、大規模な培養プレート(LSP)上でC.エレガン群集団を培養し、人口増加を記録する方法を紹介する。
要約
カエノハブディティス・エレガンス(C.エレガンス)は、発生生物学、老化、神経生物学、遺伝学を研究するための貴重なモデル生物であり続けています。C.エレガンスの大きな研究体は、複雑な生物学的成分と別の生物との関係を解剖するために、大規模な動物全体の研究に統合する理想的な候補になります。C.エレガンスを共同-omics研究に使用するには、比較分析のために多様なプラットフォームで単一のサンプルを分割してアッセイできる動物の大量集団を生成する方法が必要です。
ここでは、大規模な培養プレート(LSCP)とその後の表述法データ上に豊富な混合ステージ C.エレガン 群集団を培養および収集する方法を提示する。このパイプラインは、オミックス実験に必要なデータ(ゲノミクス、トランスクリプトミクス、プロテオミクス、メタボロミクスなど)と共に、フェノミクスおよび集団データを収集するのに十分な数の動物を産み出します。さらに、LSCP法は動物自身への操作を最小限に抑え、ユーザーの準備時間を減らし、厳しい環境管理を提供し、各サンプルの取り扱いが全体的な再現性のために研究全体で一貫していることを保証します。最後に、所定のLSCPにおける C.エレガンス のライフステージの母集団規模および人口分布を文書化する方法が提示される。
概要
C.エレガンスは、自然の生息地の様々な世界中で発見された小さな自由に生きている線虫1です。その相対的な成長の容易さ、速い生成時間、再生システム、および透明な身体は、発達生物学、老化、神経生物学、および遺伝学2、3で広く研究されている強力なモデル生物を作る。C.エレガンスの豊富な研究は、特定の生物における複雑な生物学的成分とその関係との間でフェノタイプを包括的に結びつけるため、-omics研究で使用する最有力候補となる。
C.エレガンスを共同-omics研究に使用するには、単一のサンプルを分割し、比較分析のための多様なプラットフォームや機器に使用できる動物の大規模な混合ステージ集団を生成する方法が必要です。このようなサンプルを生成するパイプラインを作成するには、食事、環境、ストレス、人口構造、サンプルの取り扱いと収集に対する鋭い意識が必要です。そのため、標準的で再現可能な培養条件を大規模パイプラインに統合することが重要です。C.エレガンスの研究では、2つの伝統的な方法がワームを培養するために使用されている - 寒天ペトリ料理と液体培養4.
歴史的に、大量のC.エレガンが必要な場合、それらは液体培養4で栽培されている。液体培養中に大量のワームを生成するステップは、多くの場合、過剰な成体のキューティクルを破裂させ、所望の集団サイズを達成するために胚を放出する漂白剤の同期を含む複数の処理ステップを必要とする。しかし、漂白剤の同期を使用する場合、人口増加は国勢調査の開始サイズに依存し、その後の増加と人口数に影響を与えます。さらに、C.エレガンス株は、そのキューティクル感受性、暴露時間、および漂白剤同期に対するストレス応答が異なり、一度に多くの株を一度に5、6、7、8、9でアッセイすることが困難になる。
さらに、液体培養におけるワームの増殖は、多世代にわたって増殖すると過密状態が容易に発生し、食物10の存在にもかかわらずダウアー形成につながるため、収穫前に1世代のワームのみを増殖させることが推奨されることが多いため、数世代の移送ステップが必要である。ダウアー形成は、アスカロシドのような小さなシグナル伝達分子を介して起こり、しばしば「ダウアーフェロモン」11、12、13、14と呼ばれ、液体培地中に放出され、集団の成長に影響を及ぼす。さらに、液体培養でのワーム集団の増加は、培養中に過剰な細菌蓄積を引き起こし、下流の表現型アッセイにきれいなサンプルが必要な場合に困難を生み出す。最後に、液体培養が汚染されると、真菌胞子や細菌細胞が培地15全体に分散しやすいように維持することがより困難である。
C.エレガンスを栽培するもう一つの伝統的な方法は、寒天ペトリ料理にあります。市販のペトリ皿は、液体培養物に見られるように過密と高いダウアー形成の急速な影響なしに混合ステージワームの複数の世代を容易に成長することができます。しかし、伝統的な寒天ペトリ皿のワーム増殖の欠点は、最大の市販のペトリ皿が漂白剤同期ステップに加えずに-omics研究のために大きなワーム集団を生み出さないことです。要約すると、寒天ペトリ皿にC.エレガンスの混合ステージ集団を培養することは、-omicsデータを収集するのに適していますが、液体培養なしに非常に大きな集団を生成する方法が必要でした。
ここでは、大規模な培養プレート(LSCP)上で大規模な混合ステージC.エレガンス集団を培養および収集する方法を紹介する。このパイプラインを通じてサンプルを収集すると、オミックス実験に必要なデータ(ゲノミクス、トランスクリプトミクス、プロテオミクス、メタボロミクスなど)と共に、フェノミスティックおよび母集団データを収集するのに十分なサンプルが得られます。さらに、LSCP法は、動物の最小限の操作、より少ないユーザーの準備時間を必要とし、厳しい環境制御を提供し、全体的な再現性のための研究全体で各サンプルの取り扱いが一貫していることを保証します。
プロトコル
1. LSCPおよび機器の殺菌
- 手洗いでガラスLSCを準備し、食器洗い、その後のオートクレーブ処理を行い、実験を開始する前にガラス製品に汚染物質がないことを確認します。オートクレーブLSCは、使用されるまで清潔な乾燥した場所に保管してください。
注: LSC が食器洗い機とオートクレーブの安全であることを確認してください。LSCPの蓋が食器洗い機の安全であることを確認してください。 - 手洗いの後に食器洗いでLSCPのふたを準備します。LSCPの蓋は必要になるまで清潔なビンに保管してください。
- ネマトード成長培地アガロース(NGMA)が準備された日に、LSCPの蓋を10%漂白剤溶液で2回拭き取り、その後70%エタノールを加えます。10%の漂白剤と70%のエタノールで拭き取ったら、NGMAが準備される層流フードのきれいなビンにLSCPのふたを保管してください。
2. 線虫増殖培地アガロース(NGMA)の準備
- 攪拌板に攪拌棒を持つオートクレーブ2 Lエルレンマイヤーフラスコに以下の試薬を組み合わせてNGMAを調製する:2.5gペプトン、3 g NaCl、7 gアガロース、10g寒天、および975 mL滅菌水16。総体積が1 Lに等しいことを確認します。
注: ここで説明する NGMA の準備手順は、2.5 LsPS のための十分な材料を生成します。プロトコルは、特定の実験で必要な LSCP バッチ サイズに合わせて調整できます。 - 121°Cで液体サイクルのオートクレーブ、45分間の午後21時。
- 水浴をオンにし、50°Cに設定します。 オートクレーブしたNGMAを水浴に持ち込み、50°Cに冷却します。
- ボンネットまたはクリーニングされたスペースにNGMAの2 Lエルレンマイヤーフラスコを持参し、攪拌板にセットします。NGMA温度を追跡するには、温度計を使用します。
- NGMAが50°Cに達した後、 フード内または洗浄されたスペースの中に無菌使い捨てピペットを記載した順序で以下を追加します:1 M KH2PO4(Kリン酸バッファー)の25 mL、コレステロール1 mL(エタノール中5mg/mL)、1 mLの 1 M CaCl2,1 M MgSO4の 1 mL, 1 mL のナイスタチン (10 mg/mL), ストレプトマイシン 1 mL (100 mg/mL)16.
- 約1.3cmの深さの無菌ガラスLSCPに400 mLのNGMAを注ぎ込み、LSCPがボンネットの平らな表面に固まり、オートクレーブされたホイルの蓋をLSCPに戻します。
- 寒天をセットしたら、ホイルを取り外し、LSCPにきれいな気密蓋を置き、4°Cに移動して保管します。使用されるまで4°CでLSCにNGMAを保存し、5日以内に使用します。
3. LSCP で NGMA 用 大腸菌 食品を生成する
- 安定した食料源を生成するために、中央限界定理17と一致する小さなバッチ平均化概念を用いてHT115(DE3)大腸菌のバッチを生成する。-80°Cで保管してください。 必要に応じて、大腸菌のストックを-80°Cから解凍18に引っ張ります。
注:このプロトコルでは、大腸菌の細菌ストックはバイオリアクターで栽培されました。培養の成長の終わりに、培養を1:50希釈し、測定されたOD600は0.4であった。したがって、培養物は20の有効OD600を持っていた。細菌をペレット化し、秤量し、0.5g/mL(湿潤重量)の濃度でK培地中に再懸濁し、2mLアリコートに移し、凍結19.
4. NGMAのバクテリア芝生
- NGMA LSCP を室温 (RT) に 4 °C から数時間持ち込み、細菌の芝生を広げ、LSCP 全体が RT に到達できるようにします。
- 必要な 大腸菌 ストックを-80°Cから解凍18に引き出す。
- 希薄な 大腸菌 の細菌ストック(複数可)と2 mLの無菌K培地を有し、NGMA LSCP当たり4mLで0.5g の大腸菌 を達成する。NGMA LSCPの中央に大 腸菌 のピペット4 mLを慎重に。
- 無菌スプレッダーを使用して、NGMA 大腸菌 の縁の周りに約3.8cmの部屋を残して長方形に細菌を広げます。
- ボンネットに 大腸菌 を入れたNGMA LSCPをファンに1時間入れて、 大腸菌 懸濁液が完全に乾燥するようにします。
- バクテリアの芝生が乾いたら、蓋をしっかりと押し、使用するまで4°Cで保管します。
5. チャンクワームは、サンプル間のストレスと年齢変動を軽減します
- 冷凍ワームストックから新たに播種された6 cmプレート4にストリークワーム。このプレートは「マスターチャンク」プレートとして機能します。
注:チャンキングは、ホモ接合株20からワームを転送するための最適な方法です。ひずみがヘテロ接合である場合、またはピッキングと交配によって維持する必要がある場合、チャンクは推奨されません。使用するワーム遺伝子型、成長のために選択された温度、および下流のステップに応じて、チャンク周波数を最適化する必要があります。 - マスターチャンクプレートが健康なグラビッド大人(約3日間)でいっぱいで、大 腸菌 の芝生がまだたくさん残った後、WormBookで説明されているように標準的な C.エレガンス チャンキングガイドラインに従って4つの合計チャンクプレートを生成する。
- 成長のために特に指定されていない限り、すべてのチャンクプレートを20°Cの制御温度(CT)室に保管してください。
注:このプロトコルのユーザーがここで説明するようにCT室にアクセスできない場合は、温度を制御できる小さなインキュベーターまたは環境条件を可能な限り制御できる指定された部屋のいずれかを使用することをお勧めします。これらの代替オプションがどちらも使用できない場合は、サンプルの増加の変動が大きくなる可能性があることに注意してください。 - 多くのグラビッドの成人が4番目 のチャンクプレートで観察されたら、ステップ6に進みます。
6. LSCPにグレーブの大人を漂白スポット
注:この漂白技術は、ほとんどの汚染物質を根絶し、成虫から胚を放出する雌雄同体のキューティクルを溶解するために使用されます。漂白剤溶液は、胚が孵化する前にNGMAに浸漬する。
- 漂白ワームを発見する前に、LSCPsを数時間RTに持ち出します。
- ddH 2 O:漂白剤:5 M NaOHの7:2:1比を準備します。このアルカリ性次亜塩素酸溶液を使用直前に新鮮にします。
注: 漂白剤バッチが影響を受けないように、特定の実験の期間中、同じ漂白剤と NaOH を使用します。このプロトコルで使用される漂白剤は、5-10%次亜塩素酸ナトリウムであった。 - ブンゼンバーナーに火をつけて、続行する前にワームピックを炎上します。LSCPの細菌の芝生の端から無菌ピックに新鮮な 大腸菌 をすくいます。
- スポット漂白のための4番目 のチャンクプレートから単一のグラビッド大人を選びます。
- アルカリ次亜塩素酸溶液のピペット5 μLを大 腸菌 の芝生から離れたLSCPの一角に取り込んだ。
- 選んだグラビッドの大人を5μLのアルカリ性次亜塩素酸溶液に入れる。線虫をタップしてキューティクルを破壊し、卵を放出させます。
- ステップ 6.4 ~ 6.6 を合計 4 倍に繰り返し、5 人の大人を 大腸菌 の芝生の周りに均等に配置します。ほぼ遺伝的に同位体の個体が所定のサンプルに追加されることを確実にするために、同じ4番目 のチャンクプレートからすべての5人のグラビッド成人を選んでください。
- 蓋を LSCP に戻します。
- すべての LSC に対して手順を繰り返します。
7. 制御温度(CT)室でのワームの成長
- スポット漂白に続いて、蓋をLSCPにしっかりと置き、一定の気流と12L:12D光周期(12時間光と12時間の暗闇)で20°Cに設定されたCTルームに置きます。
- CT室にサンプルを置いた時間と位置に注意してください。
注: 部屋の中の位置は、成長中に発生する可能性のあるサンプルが発生する可能性のある環境の違いを記録するために、常に文書化する必要があります。サンプルが CT ルームに入ると、割り当てられた場所に邪魔されずに残る必要があります。汚染の可能性を減らすには、CT室でLSCPの蓋を開けないでください。 - LSCPを顕微鏡に持って行き、CT室の外で、人口増加と密度を観察する。
注:各 C.エレガン株 とサンプルは成長が異なるので、サンプルを注意深く監視してください。CT室でLSCPの成長を妨げないことを推奨するが、LSCPはCT室から輸送され、蓋はサンプルの成長を監視するために2日ごとに開いた。2 日ごとに密封されたカバーを LSCP から取り出す場合も、O2 が LSCP に流れ込みます。 - 収穫前にLSCPがワームの大量の集団でいっぱいになっていることを確認してください。LSCP を収集する準備ができているかどうかを判断するには、次の基準を使用します。
- LSCP が、大人のワームでいっぱいであることを確認します。
- プレートに大きな母集団が含まれていることを確認します (すなわち、 ワームは寒天の表面全体を覆います)。
- プレートが寒天の表面に多くの卵を持たないようにしてください(すなわち、ワームの最大数が孵化しているはずです)。
- プレートが残っている大 腸菌 が最小限に抑えられるようにし、さらに2日間プレートに放置すると、ワームが飢えてダウアー幼虫を生成することを示します。
注: ほとんどの LSCP は、ひずみとサンプルに応じて 10 ~ 20 日の間に収穫する準備ができていますが、このプロトコルを確立する際に各 LSCP を頻繁にチェックして、通常の収穫時間を決定します。
- SSP間の取り扱い間の70%エタノールを用いる手袋および区域は、株間の交差汚染を避ける。
8. LSCP サンプルの収穫
- サンプルを収穫する前に、オンにして遠心分離機を4°Cに冷却します。
- 収穫されるLSCPあたりのM9の解決の50 mLの3つの50 mLの円錐形の管を準備する。
- LSCP ごとに 15 mL 円錐管にラベルを付けます。
注:ワームはこれらの管にペレットを十分にする傾向があるので、すべての遠心分離のステップは、15 mL円錐管で行われます。 - 50 mL の M9 溶液(ステップ 8.2 の 50 mL 円錐管から)を LSCP 表面に注ぎ、旋回して M9 が NGMA 表面全体をカバーするようにします。
- M9はLSCP表面に座っているが、M9と無菌血清学的ピペットをプライム。
注:M9で無菌血清ピペットをプライミングすることにより、これはより少ないワームがプラスチックピペットの内側に付着し、サンプルの損失を防ぐことを保証します。 - LSCP を傾けて M9 とワームの集団が LSCP の一角に集まるようにします。
注: M9 ソリューションと LSCP からのワームの混合は、ダウンストリーム の手順では"ワームの中断"と呼ばれます。 - 自動ピペット、ピペットワームサスペンションとプライミングされた血清学的ピペットを使用して、元の50 mL円錐形チューブに配置します。50 mLのワーム懸濁液が回収されたら、円錐形のチューブをロッカーに置き、細菌の塊や破片を破壊します。
- LSCP あたり 150 mL のワーム懸濁液を収集する手順 8.4 ~ 8.7 を繰り返します。
- ワーム懸濁液の15 mLを、3つの50 mL円錐管のうちの1つから、ステップ8.3で脇に置かれたラベル付き15 mL円錐管に注ぎ込む。遠心分離器は、15 mL円錐管を884 x g で4°Cで1分間用いた。 ワームの大部分は、チューブの下部にペレットになります。
- 上清を吸引し、虫ペレットを乱さないことを保証する。
- 同じ15 mLの円錐管に約13 mLのワームサスペンションを加え続け、150 mLのワームサスペンションがすべて消費されるまで、同じ15 mLの円錐管の繰り返し手順8.9と8.10を繰り返します。チューブを反転し、遠心分離の間のペレットを邪魔し、できるだけ多くの細菌や破片を洗い流し、吸引します。
注:このステップでは、3つの50 mL円錐形の管の内容物は単一の15 mLの管で凝縮される。 - 15 mL円錐形チューブに10mLのクリーンM9を加え、反転してワームペレットを攪拌します。遠心分離器は、15 mL円錐管を884 x g で4°Cで1分間用いた。 上清を吸引し、虫ペレットを乱さないことを保証する。2 回繰り返します。
注:サンプルに大量の破片や細菌が含まれる場合は、サンプルがきれいになるまでステップ8.12を繰り返します。 - サンプルがクリーンになったら、ワームペレットにddH2Oを加え、合計10 mLのddH2Oとワームを加えます。逆にしてワームペレットを攪拌する。ドモティックストレスを避けるために、ワームは5分以下の間ddH2Oに留まる必要がありますので、ステップ9.1に素早く移動します。
注: ddH2O でのウォームペレットのサスペンドは、下流 -omics ステップに推奨される溶媒です。ワームは、特定の実験ワークフローと互換性がある場合、他の溶媒またはバッファに懸濁させることができます。
9. 人口規模の見積もり
注:ステップ9.1から9.7を素早く進んでください。ステップ 8.13 からの ddH2O とワームの混合は、以降のステップで「ワームサンプル」と呼ばれます。
- ワームサンプルをピペット化する前に、M9と一緒に使用するプライムピペットチップは、プラスチックピペットの内側に付着するワームがサンプル損失を防止し、カウントの変動を低減することを避けます。
- 100 μL のワームサンプルのアリコートを取り、M9 の 900 μL に希釈します。よく混ぜて、連続希釈を行います (1:10, 1:100, 1:1000).このステップを 2 回繰り返して、合計 3 組のアリコート複製を達成します。
注: ピペットワームは、サンプルの母集団数に大きく変動を引き起こす可能性があります。望ましいアリコートをピペット化する前に、ワームサンプルが均質であることを確認してください。 - アリコートがカウントされている間、移動培養を続けるためにロッカーの15 mL円錐管をセットします。
- ワームサンプルが十分に混合され、均質であることを確認します。1:10ワームサンプルからピペット5μL、顕微鏡スライドに分配し、ワームの数を数えます。この数が約 50 個未満の場合は、1:100 と 1:1000 の希釈もカウントします。50 を超える場合は、次のシリアル希釈に移動します。
注: 多数のワームを正確にカウントできない場合は、代わりに次のシリアル希釈を使用してください。 - 各希釈3xの各アリコート複製をカウントする。カウントの最後に、ほとんどのカルチャで、合計 9 個のカウントが文書化されます (つまり、各アリコートレプリケートの合計カウント数は 3です)。
- 希釈数を平均して、ワームサンプルの推定母集団サイズを決定します。これらの希釈数は、-omicsステップに必要なアリコートサイズを作成するために必要なワームサンプルの量を決定します。
注: この実験では、約 200,000 個の混合ステージワームのアリコートが生成されました。さらに、約50,000の混合ステージワームの1つのアリコートを、大粒子フローサイトメーターでの選別のために確保した(ステップ10で説明)。 - ワームサンプルが適切なアリコートに分割されたら、液体窒素でフラッシュフリーズし、サンプルを-80°Cで保存します。
注: 大きなパーティクル フロー サイトメトリーを対象としたアリコートをフリーズしないでください。
10. (オプション) 大粒子フローサイトメトリー用のサンプルを準備する
注: ステップ 10、 11、 および 12 は、サンプルの成長を記録する著者の好ましい方法 (すなわち、C. elegansライフサイクル段階の母集団サイズと母集団分布) と、文化の成功を決定する方法です。このプロトコルのユーザーは、オプションのステップ 10、11、および 12 を、成長成功の独自のメトリックに置き換えることができます。手順 10、11、および 12 は、2 つの理由からここに説明されています。第 1 に、手順 10、11、および 12 で使用される機器を持つユーザーは、これらの手順を複製して、2 番目にこの拡張方法の検証を示すことができます。上記のステップ9は、アリコートサイズを決定するためのワームの総数を適切に推定し、ステップ10は、特定のサンプル内のワームの数と集団分布を推定するためのより定量的なメトリックです。
- M9ソリューションで約50,000個の混合ステージワーム(ステップ9.6に取っておいたもの)のアリコートを最大10 mLの総量に持って来てください。
- 1 mg/mLの 大腸菌 と0.5 μM赤色蛍光微小球の1:50希釈液で構成される溶液を作る。
- M9の混合ステージワームの10 mLにこの溶液の200 μLを加え、20分間揺れながらインキュベートします。
- 20分後、15 mL円錐管を884 x g で4°Cで1分間遠心分離する。
- 上清を吸引し、虫ペレットを乱さないことを保証する。
- M9溶液でワームペレットを2回洗浄し、過剰な細菌や赤色蛍光微小球を除去します。
- M9の5 mLをワームペレットに加え、ペレットがきれいに見えるようにします。ペレットがきれいであれば、M9の5 mLを50 mMのアジドナトリウムをストレートに加え、ワームを殺して正確なカウントとサイジング21を行います。
- アジドナトリウムがサンプルに追加された日時を文書化します。
- 大きな粒子フローサイトメトリーに必要になるまで、サンプルをロッカーに置きます。
注:アジドナトリウムは線虫類生理学(すなわち、体長、代謝、および耐熱性)に影響を与える知られている。したがって、これらの生理学的影響の多くが数分22の範囲内で起こるので、ワームがアジ化ナトリウムにさらされる時間に注意することが重要である。ワームに対するアジドナトリウムの既知の生理学的効果のために、この治療は下流の画像品質に影響を与え、考慮する必要があります。
11. (オプション) 人口分布を文書化し、イメージング用の384ウェルプレートを準備する
注: ステップ 11 では、大きなパーティクル フロー サイトメーター(LPFC)を使用します。LPFCの基本的な知識は、このプロトコルで想定されます。他の方法は、サンプルの成長と母集団分布を文書化するために置き換えることができます。ここで説明する手順は、パイプライン23で LPFC を使用する予定のユーザーを対象としています。
- LPFCの電源を入れ、きれいにしてプライムし、サンプルを選別する前にレーザーを1時間温めます。
- レーザーが温まったら、"ヒストグラム" プロファイルを開き、2050 年の飛行時間 (TOF) にスケールします。
- TOF 範囲 100 の 「ヒストグラム」にバー領域を追加します。最初のバー領域は、50-150のTOFをカバーしています。
- 100 の TOF 範囲にまたがる 20 のバー領域を作成し続けます。これらのバー領域は、TOF 範囲全体に 50 ~ 2050 の範囲をまたがります。TOF 分布全体で使用する正確なゲート領域については、 補足表 1 を参照してください。
- このヒストグラムを"実験"として保存し、将来の LPFC 実行で使用します。
- 校正された384ウェルプレートを選択するか、計器を384ウェルプレートにキャリブレーションして、オブジェクトを分配します。
- キャリブレーションされた384ウェルプレートテンプレートに入ると、ステップ11.3-4で作成された20のバー領域のそれぞれに対して、20個のゲートオブジェクトを4つの井戸(各ゲート領域の4つの技術的複製)に分配するテンプレートを設定します。384 ウェル プレートにワームを分配する方法の例のレイアウトについては 、補足表 2 を参照してください。
- ステップ10.9から50 mLの円錐管にサンプルを移し、M9ソリューションを追加して、約40 mLの総容積を達成します。
- ステップ11.7で設定されたパラメータごとにサンプルを自動的にソートし、サンプルを沈降させ、同時にサンプルからキャリブレーションされた384ウェルプレートにオブジェクトを分配するのを防ぎます。
注: LPFC の流量が毎秒 15 ~ 20 オブジェクトの間で動作していることを確認し、並べ替える倍数を指定しないようにします。 - サンプル全体をソートし、ゲート領域の最大数を384ウェルプレートに分配したら、LPFCからサンプルを取り出し、きれいな器具を取り出します。
注: より大きな TOF 領域に達すると、その TOF 領域のイベント数が少ないため、384 ウェル プレートを埋め続けるのが困難になる場合があります。できるだけ多くのゲート領域を埋め、サンプルが不足する前に C.エレガンス のライフステージがLPFC分布内のどこに入るのかを最もよく知ることができます。 - 384ウェルプレートの上にシーリングフィルムを置き、画像化します。
注:サンプルはアジドナトリウム22で処理されるため、ソート後できるだけ早くイメージプレート。赤色蛍光微小球は、各ソートされたオブジェクトに放出される赤色蛍光のレベルに基づいて収集されたLPFCデータファイル(出力 テキストファイルのPHレッドデータ)に見られ、どの物体が生きているワーム、死んだワーム、ダウアー、またはジャンク24を識別するのに役立ちます。
12. (オプション) イメージング 384 ウェルプレート
注:ステップ12は、プレート読み取りマイクロ共焦点顕微鏡を使用します。このプロトコルでは、マイクロ共焦点顕微鏡の基礎知識が前提とされている。他の方法は、サンプルの成長と母集団分布を文書化するために置き換えることができます。
- 20xレンズを用いたプレート読み取りマイクロ共焦点顕微鏡を使用。
- [目標とカメラ] タブを開き、"10xプラン ApoLambda"モードに設定します。
- [カメラビニング] タブを開き、 "2" に設定します。
- [サイトをプレートに表示]タブを開き、ウェルごとに"4"サイトと "オーバーラップ サイト 10%"に設定すると、後で画像をつなぎ合わせます。
- 「波長」タブを開き、「ブライトフィールド1」に設定します。
- 「イルミネーション」タブを開き、「透過光、明るいサンプル」に設定します。
- 384 ウェル プレートを顕微鏡に配置し、"Z スタック" を [オフセットの計算] に設定し、384 ウェル プレートのサンプルに適した焦点面を見つけます。
- マイクロ共焦点顕微鏡で384ウェルプレートを実行し、ウェルごとに4つの画像を収集します。
- 4つの画像を一緒にモンタージュして、井戸ごとに1つの画像を作成します。
結果
LSCP法を用いたC.エレガンスの成長は、12.2日間にわたってサンプルあたり平均約240万個の混合ステージワームを生み出す。LSCP法を用いたC.エレガンスの成長により、動物の取り扱いと操作が少なく、C.エレガンスの大規模な混合ステージ集団を生成することができ、これは大規模なオミックス研究に最適です(図1)。LSCPが成虫のワームでいっぱいになり、人口規模が大きく、細菌が最小限に抑えられると、ユーザーは収穫して人口規模を推定できます。この点は、母集団が -omics パイプラインで使用するのに十分かどうかを評価することによって品質管理としても役立ちます (図 2)。集団動態は、株自体、株の挙動(すなわち、穴あけ菌株は、より低いワーム回復を有する傾向があった)、および成長の成功(すなわち、汚染)に依存する。LSCP法は、カエノールハブディティス遺伝学センター(CGC)変異体とカエノハブディティスエレガンス自然多様性資源(CeNDR)野生株25の混合物を含むC.エレガンスの15株について試験した。ひずみ遺伝子型は補足表3に記載されています。
LSCP法は、人口規模が約94,500から9,290,000に増加しました。基準株内の平均母集団サイズPD1074、及び株間の平均集団サイズは約240万ワームであった(図3)。平均12.2 LSCP増殖日数の間にC.エレガン株間の推定人口サイズに有意な差は認められなかった(図4)。PD1074 LSC は、完全な混合ステージ人口に成長するのに 10 ~ 14 日かかりました。PD1074全体の平均成長時間は10日であった。最も遅い成長株は最大20日間成長し、最も急速に成長している株は最低10日間成長した(図4)。
したがって、このLSCP法を使用すると、ユーザーは、発達のタイミングと背景の専門知識をほとんど知らない研究に興味のある新しい株を簡単に統合することができます。摘み取りによって維持されなければならない株および形型は、胎児性の欠陥を有し、異種性である、または成長欠陥を有するこのパイプラインではうまく機能しない可能性があることに注意してください。
大粒子フローサイトメトリーとサンプルのイメージングにより、人口分布を文書化できます。 多種多様なプラットフォームを使用して、人口増加の成功を測定できます。
再現性のある -omics 測定では、一貫した培養を行うことが重要です。培養再現性の指標は、特定の菌株に対するワーム数と一貫したサイズ分布です。我々は、参照株のサンプル分布を示す, PD1074 – 元のN2ブリストル株の変種, LPFC23,26と成長成功のためのプロキシとしてマイクロ共焦点顕微鏡画像を使用して.LPFC分布(図5)でL1段階からグラビッド成体までワームを測定し、その後のイメージング(図6)、およびサンプル全体の人口分布の変動(図7)を用いて、このパイプラインがC.エレガンスの混合ステージ集団を生成したことがわかります。
混合ステージサンプルの母集団分布を詳しく見るために、飛行時間(TOF)全体にわたって各領域内に入るワームの割合(すなわち、体長)分布(図7A,B)を見て、35のPD1074 LSCの分布を見ました。
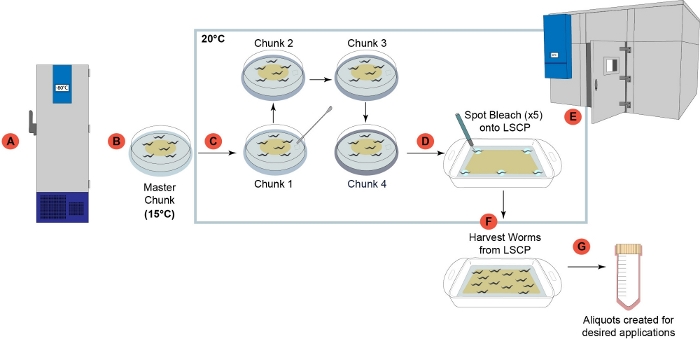
図 1: LSCP ワームの拡張パイプラインの概要(A) ラボで受け取ると、すべての菌株を調製し、-80°C2で長期保存のために凍結した。(B)冷凍ワームストックから「マスターチャンク」プレートを用意し、15°Cで保存し、1ヶ月以内に使用した。(C)各サンプルは、LSCPで成長する前に世代間ストレスを軽減するために、4つの連続したチャンクステップを経た。(D) 5人のグラビッド成人をステップ(D)の「チャンク4」6cmプレートから選び、LSCPの5つの所定の領域で漂白したスポットを採る。(E) LSCPは制御温度室に置かれ、LSCPが成虫の虫でいっぱいになるまで20°Cで成長し、人口規模が大きく、残された細菌は最小限であった。(F) ワーム集団は、下流のステップのために収集され、収集された。(G) アリコートは LSCP から作成され、下流の目的のアプリケーション用にフラッシュ凍結された。この図の大きなバージョンを表示するには、ここをクリックしてください。
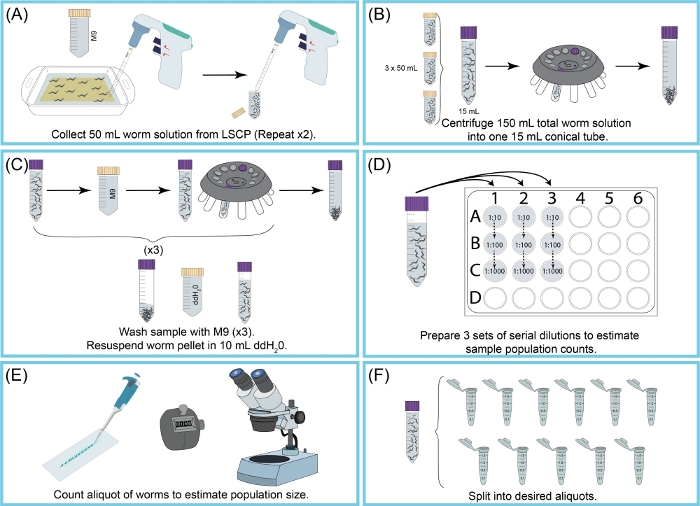
図 2: LSCP の収穫と人口規模の推定の概要(A)50 mLのM9を使用して、NGMA表面からワームを洗浄した。ウォーム懸濁液を50mL円錐管に配管した。工程(A)を2回繰り返した。(B)15 mLのウォーム懸濁液を新しい15 mL円錐管に注いだ。ワームは遠心分離機によってペレット化された。M9+破片は、虫ペレットを乱さずに吸引した。ステップ(B)は、150mLのワーム懸濁液すべてを回収するまで繰り返した。(C)虫ペレットを洗浄し、M9で3回遠心分離し、残りの残骸を除去した。サンプルがクリーンになったら、10 mLのddH2O. (D) サンプルの連続希釈を作成して、ワームの母集団サイズを推定するために、そのサンプルペレットを再懸濁した。ワームを正確に数え込む希釈係数を使用しました。使用される希釈係数はLSCPの母集団サイズによって変化した。(E) 希釈因子が選択されると、その希釈の3つのアリコート複製からのすべてのワームがきれいなスライドにパイプされ、ワームは解剖顕微鏡の下で数えられた。(F)サンプルは適切なサイズのアリコートに分割された。 この図の大きなバージョンを表示するには、ここをクリックしてください。
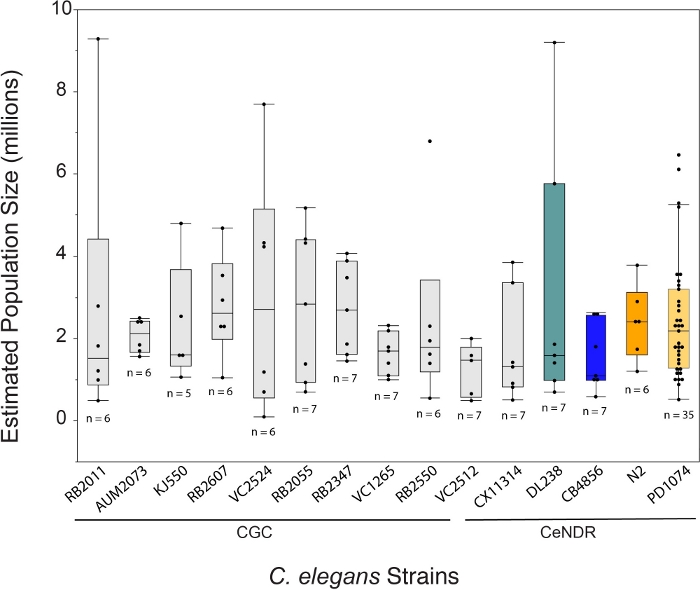
図3:平均240万個の混合ステージワームで生成されたLSCP法。LSCPは、人口増加の最小人口規模は約94,500人で、人口増加率は約9,290,000人と最も大きい。すべての株にわたる平均人口の大きさは240万ワームであった。C.エレガンス株名の下のバーは、株がCGC変異体であるかCeNDR自然分離物であるかを示す。LSCP サンプルサイズは、ひずみごとに表示されます。TukeyのHSDテストを使用してすべてのペアの比較を行いました。C.エレガンス株(F(14,108)=0.7,p = 0.77)にわたる推定集団サイズ間では有意な差は認されなかった。色付きのバーは、それぞれのC.エレガンス歪み表現の標準カラー表示を示します。この図の大きなバージョンを表示するには、ここをクリックしてください。
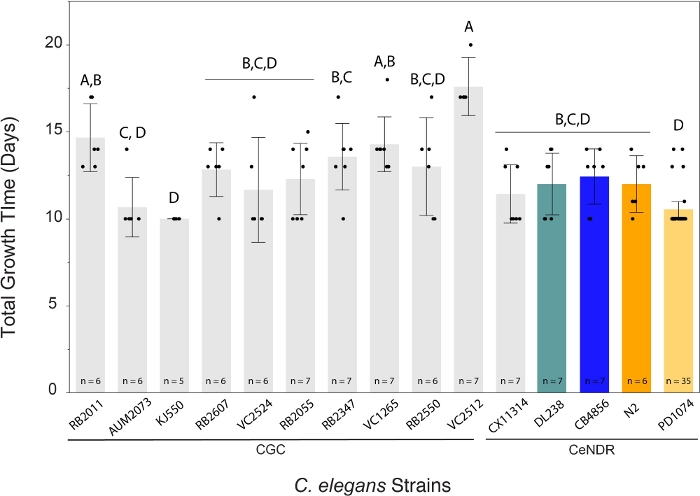
図4:LSCP法は、10~20日間でワームの混合ステージ集団を大量に生成した。与えられたC.エレガンスLSCPは、サンプルが成虫の虫でいっぱいになるまで成長し、大きな人口に達し、最小限の細菌の芝生が残っていました。LSC は、負担に応じて、完全な混合ステージの人口に成長するのに 10 ~ 20 日かかりました。株全体の平均成長時間は12.2日であった。LSCP サンプルサイズは、ひずみごとに表示されます。各誤差範囲は、平均から1標準偏差を用いて構築した。同じ文字で接続されていないレベルは大幅に異なります。TukeyのHSDテストを使用してすべてのペアの比較。C. エレガンス株(F(14,108) = 8.8,p <0.0001*全体で必要なLSCPの成長時間の大きな違いが見つかりました。色付きのバーは、それぞれのC.エレガンス歪み表現の標準カラー表示を示します。この図の大きなバージョンを表示するには、ここをクリックしてください。
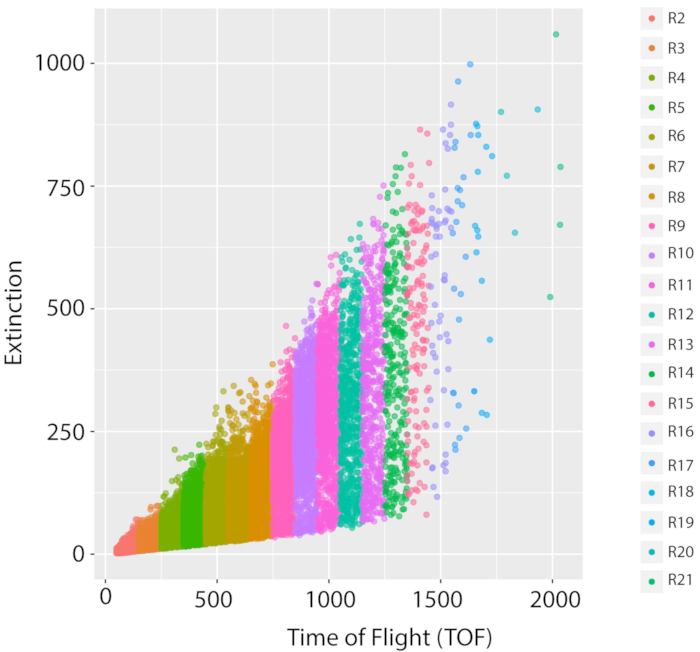
図5:野生型の基準株PD1074の混合集団と増殖測定。野生型の基準株の1つのLSCP成長の代表的なLPFC分布、元のN2ブリストル株の変種、(PD1074)は、混合ステージ集団のサイズ分布および事象数を文書化する。X 軸は、ソートされたワームの長さ (飛行時間、TOF) を表示します。y軸は、ソートされたワームの光学密度(光学的な絶滅、EXT)を表示します。各データ ポイントは、サンプルに記載されたワームです。画像解析に使用された各 TOF 領域は、異なる色で表示されます。TOF 領域が 20 個 (R2 ~ R21) に 20 個作成され、TOF は 50 ~ 2050 に及ぶ。各 TOF 領域の詳細は補足表 1 を参照してください。 この図の大きなバージョンを表示するには、ここをクリックしてください。
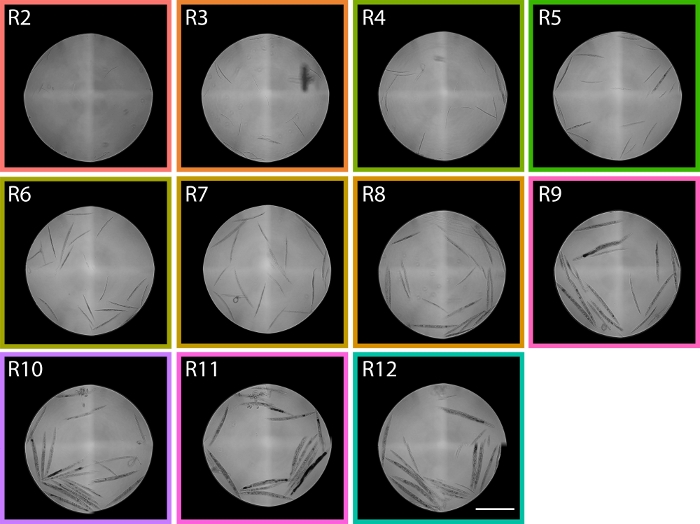
図 6: R2 から R12 までの TOF 領域から分類されたワームのイメージは、PD1074 LPFC 分布を示しています。領域R2では、L1ワームを同定することができ、領域R9では主にグラビッド成人が同定され、2つの発達幼虫の極端にまたがり、分布における段階が予想される場所の流細胞計分布内のおおよその領域を与える。スケールバーは1mmを表します。代表画像は 図5に示すLPFC分布から撮影され、色付きのボックスは 図5の領域に対応している。 この図の大きなバージョンを表示するには、ここをクリックしてください。
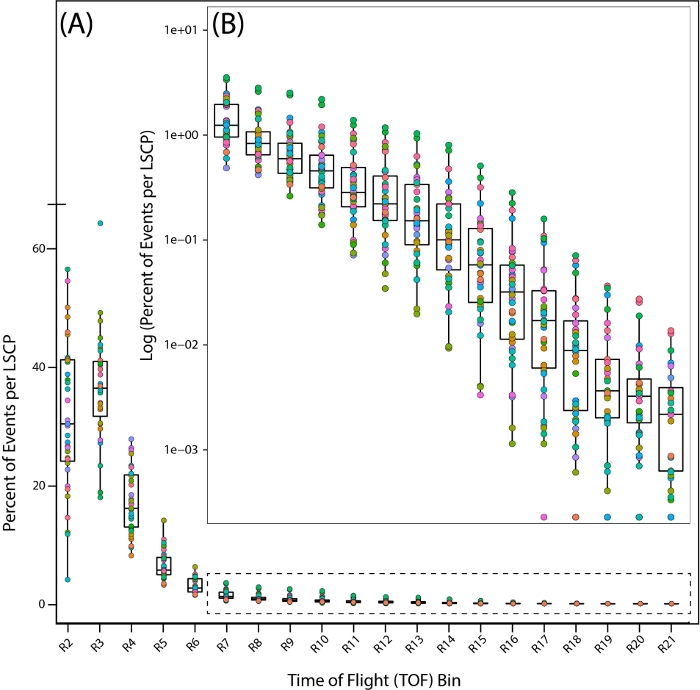
図 7: 野生型参照株 PD1074 における飛行時間 (TOF) 領域全体の母集団分布。ワームが発見された地域を示す TOF 領域全体にわたるワームの配布。各 PD1074 LSCP は、個別の色として表されます。(A) X 軸は、LSCP について観測およびカウントされた 20 の TOF 領域 (R2 ~ R21) を示し、全体のサイズ分布を表示します。y 軸は、所定の TOF 領域に入ったボディ サイズを持つ、与えられた LSCP からのワームのパーセントを示します。(B) ワーム集団の小さな割合がR7-R21領域の間に入ると、各領域内に入ったワームの割合のログが、人口分布を表示するために取られた。X 軸は R7-R21 TOF 領域を表示します。y 軸は、所定の TOF 領域に入ったボディ サイズを持つ、与えられた LSCP のワームのパーセントのログを表示します。 この図の大きなバージョンを表示するには、ここをクリックしてください。
補足図1:LSCPが成長して処理された成長条件の平均日次温度(°C)。制御温度(CT)室の報告された温度は、サンプルの成長および採取の6ヶ月のスパンを通して文書化され、収集された。1日の平均気温はここで報告されます。プロジェクト期間中にLCSPが成長した温度間に有意な差は認められなかった(F(5,24) = 2.59,p = 0.0524)。 全体の温度差は、サンプルの成長と生成の6ヶ月間にわたって0.003 °C以下に及びました。こちらをダウンロードしてください。
補足表1:画像処理のためにワームを384ウェルプレートに分類するために使用されるTOFゲート領域。 ビン分割された領域は、50 ~ 2050 の TOF ディストリビューション全体で 100 の TOF にまたがって作成されました。ゲート領域は、ニーズに合わせて変更および最適化できます。画像解析に使用された各 TOF 領域は、異なる色で表示されます。 こちらの表をダウンロードしてください。
補足表2:TOF領域の384ウェルプレートテンプレートと複製レイアウト。 すべてのサンプルは、イメージング用の384ウェルプレートに選別されました。並べ替え用に選択したリージョンごとに 4 つのレプリケートが作成されました。ゲート領域は、ニーズに合わせて変更および最適化できます。このプロトコルで作成および使用される特定のゲート領域については、補足表 1 を参照してください。画像解析に使用された各 TOF 領域は、異なる色で表示されます。 こちらの表をダウンロードしてください。
補足表3:このプロトコルで使用 されるC.エレガン株 は、CGC株とCeNDR株の混合物を含む。 ひずみ、遺伝子型、ひずみソース、および詳細をこの表に記載します。 こちらの表をダウンロードしてください。
ディスカッション
LSCPとして様々な容器を使用することができます。このプロトコルでは、標準的なガラス焼き皿が使用されました。使用されているLSPCは外側の寸法が35.56 x 20.32 cm、内径は27.94 x 17.78 cm、深さは約4.45cmで、蓋を取り付けました。したがって、ここで使用される細菌の量は、混合ステージワームの大規模な集団を生み出すために上記の寸法を有するLSCPのために最適化されています。細菌の体積および濃度は実験の必要性に合うように調節することができる。
LSCP法の任意のステップでカビ、真菌、または他の細菌源による汚染が発生する可能性があるため、サンプルを慎重に処理します。プロトコルの任意のステップを開始する前に、作業スペースは70%エタノールと10%漂白剤で洗浄されていることを確認してください。可能であれば、30分間UV光で使用領域を扱い、各ステップを開始する30分前にHEPAエアフィルターをオンにします。
制御された設定(すなわち、20°Cに設定されたCT室)でLSCPを成長させることによって、ユーザーはより容易にサンプルの成長を追跡し、潜在的な汚染を文書化することができる。LSCPの表面が汚染された場合は、可能な限り汚染を切り取り、汚染を制御できない場合はサンプルを成長させたり捨てたりします。汚染に迅速に対処して不要な成長を減らし、リソースのワームを上回らないようにすることが不可欠です。
この方法は 、C.エレガンスの大規模な混合人口文化を成長させたい人のためのものです。市販のペトリ皿や液体培養で行われているようにLSCP上のワームの同期集団を成長させることは可能かもしれないが、著者らはこの選択肢をテストしていない。さらに、ユーザーが特定のサンプルで平均で約 240 万個以上のワームを増殖させたい場合は、別の方法を推奨します4.成長の成功は、パイプラインで処理される負担に依存します。著者らは 、15C.エレガン 株の少なくとも5つの生物学的複製において約240万匹のワームの集団を正常に成長させることができ、この方法が堅牢であることを示した。
実験を開始する前に、特定のワームの年齢と健康は、胎児性とその後の人口増加時間に影響を与えることができることに注意してください。このパイプラインで使用する前に、最小限のストレスでワームが健全な状態で維持されるようにしてください。ストックサンプルは、時間の経過とともに遺伝的ドリフトを低減するために、生成され、凍結され、-80°Cに保たれていることを前提としています。
特定の実験のニーズに応じて、LSCP上の開始グラビッド成人の数を変更することができます。LSCP上の開始グラビッド成人の数を変更すると、成長率が変化し、収穫までの時間が変わります。5人のグラビッド成人は、次の理由で各LSCPを播種するために使用されます:(1)一度に多くの C.エレガン 株をLSCPに播種する簡単で迅速で効率的な方法が必要であり、(2)成長不均一性につながる可能性のある選ばれたグラビッド成人の年齢差を減らすために必要でした。
この方法により、ユーザーは、すべてのライフ サイクル ステージが存在するワームの大規模な集団を収穫することができます。現在の方法が利用可能な場合 、C.エレガンス の大規模なサンプルを収集するには、下流の作業に必要なワームの数を得るために漂白剤の同期が必要です。このアプローチを考えると、漂白同期や複数の処理ステップに関連する困難なしに、発酵槽や大規模な液体培養でこれまで可能な限り多くのワームを成長させることができます。当社のプロトコルにより、目的の株を効率的にターゲットにし、サンプル自体を成長させる際に最小の処理時間を使用し、下流パイプラインで必要に応じてワームまたは集団の段階を分離することができます。
LPFCは、特定のLSCPにおける人口分布と規模を文書化するためのツールとして利用されました。LPFCは、ワームのサイズ(TOF)と光密度に基づいてワームを分析、ソート、ディスペンスする連続的なフローシステムです。所定のワームがフローセルを通過すると、軸方向の光損失検出器は、ワームが通過するのにかかる時間の長さのために488 nm-固体レーザーによって遮断された信号光の量をキャプチャし、ユーザーにワームのTOFと光学密度を与えます。蛍光コレクション光学および検出器はまた、各サンプルの蛍光感受性および収集を最大にするために利用することができる。LPFCコレクションパラメータは計測器によって異なります。ユーザーは、さまざまなプラットフォームを使用してワームのサイズをキャプチャでき、LPFC が使用できない場合はこのプロトコルを使用する場合に限定されません。
著者らは、液体クロマトグラフィー(質量分析、NMR分光法、RNAシーケンシング)を介して 、C.エレガン スの様々な株中の未知の代謝産物を同定するために、ここで説明した方法で栽培されたサンプルを使用している。著者らは、このパイプラインを使用して新しい株を容易に処理できるため、さまざまな C.elegans 株を含むこのパイプライン内のサンプルの増殖にこの方法を引き続き使用する予定である。
開示事項
著者らは開示するものは何もない。
謝辞
エイーソンラボのメンバーに、この原稿に関する有益な議論とフィードバックに感謝します。特に、B.Mガルシア。いくつかの株は、研究インフラプログラムのNIHオフィス(P40 OD010440)、およびNSFリビングコレクションCSBR 1930382によって資金提供されているCeNDRによって資金提供されているCGCによって提供されました。この作業は、NIH(U2CES030167)からの助成金によって支えられていました。
資料
| Name | Company | Catalog Number | Comments |
| 10 mL Sterile Serological Pipettes | VWR | 89130-898 | |
| 10 ul pipette tips | VWR | 89079-438 | |
| 100 ul pipette tips | VWR | 89079-442 | |
| 1000 mL Graduated Cylinder | VWR | 10124-380 | |
| 1000 ul pipette tips | VWR | 89079-488 | |
| 15 mL conical tubes | VWR | 89039-668 | |
| 190 Proof Ethanol | VWR | 89125-166 | |
| 2 L Wide Neck Erlenmeyer Flask | VWR | 75804-654 | |
| 50 mL conical tubes | VWR | 75874-294 | |
| Agar | Sigma | 05040-100G | |
| Agarose | Sigma | A9539-500G | |
| BVC Control G Fluid Aspiration System | Vacuubrand | ||
| Calcium Chloride | Sigma | 449709-10G | |
| Cholesterol | Sigma | C3045-25G | |
| Clorox Bleach | VWR | 89414-502 | |
| Conviron Control Temperature Room | Conviron | https://www.conviron.com/environmental-rooms | |
| Corning Low Volume 384 Well Black with Clear Flat Bottom Polystyrene TC-Treated Microplate | VWR | 89089-866 | |
| Fisher Scientific Accuspin 3R | Fisher | ||
| Flat-Bottom 24-Well Plate | VWR | 29443-952 | |
| Honeywell True HEPA Purifier 465 sq ft. | Home Depot | 204390560 | |
| HT115 E. coli (DE3) | CGC | HT115(DE3) | https://cgc.umn.edu/strain/HT115(DE3) |
| Kimwipes | VWR | 470224-038 | |
| Large Scale Culture Plate (LSCP) | Pyrex | 1090948 | Pyrex 2-quart Glass Baking Dish with Red Lid |
| Magnesium Sulfate | Sigma | C86677-25G | |
| MgSO4 | VWR | 97062-998 | |
| Microscope Plain Slides | VWR | 16004-422 | |
| Millipore Filter | Millipore | 1.11727.2500 | |
| Molecular Devices ImageXpress | Molecular Devices | Model Number:IXMConfocal | https://www.moleculardevices.com/products/cellular-imaging-systems/high-content-imaging/imagexpress-micro-confocal#gref , Authors used MetaXpress Software Version 6.5.4.532 |
| Nystatin (10mg/mL) | Sigma | N6261-25MU | |
| Peptone | Sigma | P7750-100G | |
| Petri Dishes (6 cm) | VWR | 25384-092 | |
| Pipette Controller | VWR | 613-4180 | |
| Potassium Chloride | Fisher | P217-3 | |
| Potassium Phosphate Monobasic | VWR | 0781-500G | |
| Potasssium Hydroxide | Fisher | P250-500 | |
| Red Fluroscent Microspheres | Polysciences | 19507-5 | |
| Sodium Chloride | Sigma | 746398-500G | |
| Sodium Hydroxide | Fisher | 111357 | |
| Sodium Phosphate Dibasic Anhydrous | Fisher | BP332-500 | |
| Standard Gilson Pipette Set | Gilson | FA10002M, FA10004M, FA10006M | |
| Streptomycin (100mg/mL) | Sigma | S6501-25G | |
| Union Biometrica COPAS BioSorter | Union Biometrica | https://www.unionbio.com/biosorter/ , authors used: Flow Pilot software version 1.6.1.3. |
参考文献
- Félix, M. A., Braendle, C. The natural history of Caenorhabditis elegans. Current Biology. 20 (22), 965-969 (2010).
- Corsi, A. K. A Transparent window into biology: A primer on Caenorhabditis elegans. WormBook. , 1-31 (2015).
- Brenner, S. The genetics of behaviour. British Medical Bulletin. 29 (3), 269-271 (1973).
- Stiernagle, T. Maintenance of C. elegans. WormBook: The Online Review of C. elegans Biology. , (2006).
- Xiong, H., Pears, C., Woollard, A. An enhanced C. elegans based platform for toxicity assessment. Scientific Reports. 7 (1), 9839 (2017).
- Loer, C. M., et al. Cuticle integrity and biogenic amine synthesis in Caenorhabditis elegans require the cofactor tetrahydrobiopterin (BH4). Genetics. 200 (1), 237-253 (2015).
- Li, Y., Paik, Y. K. A potential role for fatty acid biosynthesis genes during molting and cuticle formation in Caenorhabditis elegans. BMB Reports. 44 (4), 285-290 (2011).
- Meli, V. S., Osuna, B., Ruvkun, G., Frand, A. R. MLT-10 Defines a Family of DUF644 and Proline-rich Repeat Proteins Involved in the Molting Cycle of Caenorhabditis elegans. Molecular Biology of the Cell. 21 (10), 1648-1661 (2010).
- Fritz, J. A., Behm, C. A. CUTI-1: A novel tetraspan protein involved in C. elegans CUTicle formation and epithelial integrity. PloS One. 4 (4), 5117 (2009).
- Golden, J., Riddle, D. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Jeong, P. Y., et al. Chemical structure and biological activity of the Caenorhabditis elegans dauer-inducing pheromone. Nature. 433 (7025), 541-545 (2005).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Kaplan, F., et al. Ascaroside Expression in Caenorhabditis elegans Is Strongly Dependent on Diet and Developmental Stage. PLoS One. 6 (3), 17804 (2011).
- Golden, J., Riddle, D. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Çelen, &. #. 3. 0. 4. ;., Doh, J. H., Sabanayagam, C. R. Effects of liquid cultivation on gene expression and phenotype of C. elegans. BMC Genomics. 19 (1), 562 (2018).
- Andersen, E. C., Bloom, J. S., Gerke, J. P., Kruglyak, L. A Variant in the Neuropeptide Receptor npr-1 is a Major Determinant of Caenorhabditis elegans Growth and Physiology. PLoS Genetics. 10 (2), 1004156 (2014).
- Rosenblatt, M. A central limit theorem and a strong mixing condition. Proceedings of the National Academy of Sciences. 42 (1), 43-47 (1956).
- Boyd, W. A., Smith, M. V., Freedman, J. H. Caenorhabditis elegans as a model in developmental toxicology. Methods in Molecular Biology. 889, 15-24 (2012).
- Nika, L., Gibson, T., Konkus, R., Karp, X. Fluorescent Beads Are a Versatile Tool for Staging Caenorhabditis elegans in Different Life Histories. Genes, Genomes, Genetics. 6 (7), 1923-1933 (2016).
- Denver, D. R., Morris, K., Streelman, J. T., Kim, S. K., Lynch, M., Thomas, W. K. The transcriptional consequences of mutation and natural selection in Caenorhabditis elegans. Nature Genetics. 37 (5), 544-548 (2005).
- Massie, M. R., Lapoczka, E. M., Boggs, K. D., Stine, K. E., White, G. E. Exposure to the metabolic inhibitor sodium azide induces stress protein expression and thermotolerance in the nematode Caenorhabditis elegans. Cell Stress & Chaperones. 8 (1), 1-7 (2003).
- Kevin, S., Pulak, R., Strange, K. Techniques for Analysis, Sorting, and Dispensing of C. elegans on the COPAS Flow-Sorting System. C. elegans. Methods in Molecular Biology. 351, 275-286 (2006).
- Lee, D., et al. Selection and gene flow shape niche-associated variation in pheromone response. Nature Ecology & Evolution. 3 (10), 1455-1463 (2019).
- Cook, D. E., Zdraljevic, S., Roberts, J. P., Andersen, E. C. CeNDR, the Caenorhabditis elegans natural diversity resource. Nucleic Acids Research. 45, 650-657 (2016).
- Nika, L., Gibson, T., Konkus, R., Karp, X. Fluorescent Beads Are a Versatile Tool for Staging Caenorhabditis elegans in Different Life Histories. Genes, Genomes, Genetics. 6 (7), 1923-1933 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved