Method Article
نهج تفكك خلية واحدة للتحليل الجزيئي للمثانة البولية في الماوس بعد إصابة الحبل الشوكي
* These authors contributed equally
In This Article
Summary
الهدف من هذا البروتوكول هو تطبيق بروتوكول تفكك الأنسجة الأمثل لنموذج الماوس من إصابة الحبل الشوكي والتحقق من صحة النهج لتحليل خلية واحدة عن طريق تدفق الخلايا.
Abstract
نحن نصف تنفيذ إصابة الحبل الشوكي في الفئران لإثارة detrusor-العضلة العاصرة dyssynergia، وعرقلة منفذ المثانة الوظيفية، وإعادة عرض جدار المثانة اللاحقة. لتسهيل تقييم التركيب الخلوي للجدار المثانة في السيطرة غير المصابة والفئران المصابة الحبل الشوكي، وضعنا بروتوكول تفكك الأمثل الذي يدعم قابلية الخلية العالية للحياة وتمكن من الكشف عن السكان الفرعية منفصلة عن طريق عملية استئصال الخلايا المتدفقة.
يتم إنشاء إصابة الحبل الشوكي عن طريق النقل الكامل للحبل الشوكي الصدري. في وقت حصاد الأنسجة ، يتم غرس الحيوان مع المالحة المخزنة بالفوسفات تحت التخدير العميق ويتم حصاد المثانة في المخزن المؤقت لـ Tyrode. يتم مفروم الأنسجة قبل الحضانة في العازلة الهضم التي تم تحسينها على أساس محتوى الكولاجين من المثانة الماوس كما يحددها استجواب قواعد بيانات التعبير الجيني المتاحة للجمهور. بعد جيل من تعليق خلية واحدة، يتم تحليل المواد عن طريق تدفق القياس الخلوي لتقييم صلاحية الخلية، وعدد الخلايا والستاترات الفرعية محددة. نبرهن أن الطريقة تعطي مجموعات خلايا ذات قدرة على البقاء تزيد عن 90٪ وتمثيل قوي للخلايا ذات الأصل الظهاري الظهاري. هذه الطريقة ستمكن من تحليل دقيق المصب لأنواع الخلايا المنفصلة في مثانة الماوس والأعضاء الأخرى المحتملة.
Introduction
يمكن أن تؤدي اضطرابات وظيفة المثانة البولية الطبيعية إلى انخفاض نوعية الحياة للعديد من الأفراد. من أجل الحصول على فهم أفضل لكيفية إصابة أو مرض يخرج عن مسارها وظيفة المثانة الطبيعية، من المهم أن التحقيق في الحالة البيولوجية الطبيعية للخلايا داخل المثانة وكيف أنها تتغير تحت الانزعاج التجريبي. حتى الآن، ومع ذلك، فإن مجموعات الخلايا المحددة التي تتواجد داخل المثانة البولية، وكيف تتغير مع الإصابة، قد تم وصفها بشكل غير كامل.
طرق تحديد الخلايا المفردة مثل عملية التدفق الخلوي أو تسلسل الحمض النووي الريبي (scRNA-seq) أحادي الخلية لديه القدرة على إلقاء الضوء على أنواع خلايا معينة داخل المثانة. ومع ذلك، لهذه النهج أن تكون الأنسجة الإعلامية يجب أن يهضم بطريقة لا تؤثر على البقاء، والتعبير الجيني، والنسب المئوية تمثيل عدد الخلايا من الأنسجة المقطوعة. يمكن أن تؤثر البروتوكولات التي تستخدم الإنزيمية في التصنيف على التعبير عن علامة السطح من خلال نشاط البروتياز العشوائي1، وبالتالي التأثير على تحديد الخلية عن طريق قياس التدفق الخلوي ، في حين أن عملية الانفصام نفسها يمكن أن تؤدي إلى تحريض الجينات المبكرة الفورية ، كما وصفها مؤخرًا فان دين برينك وزملاؤه2. أظهر المؤلفون أنه على الرغم من أن السكان الفرعيين المتأثرين بالتفكك كانت صغيرة ، إلا أنه يمكن أن يؤدي إلى إشارة ملوثة قوية في دراسات التعبير السائب بسبب مستويات التعبير العالية للجينات المبكرة الفورية. وبالإضافة إلى ذلك، فإن مدة بروتوكول الانفصام التي أثرت على مستويات التعبير السائب للجينات التي تبين أنها فريدة من نوعها لبعض المستويات الفرعية. وهكذا، فإن مجموعات البيانات التي يتم إنشاؤها من خلايا واحدة دون حساب تأثير بروتوكول الانفصام قد تسفر عن تغيرات في التعبير الجيني الناشئة عن طريقة الانفصام، بدلاً من البيولوجيا الأساسية. وتشير هذه الملاحظات إلى أنه ينبغي تفسير بيانات نسخ الخلية الواحدة المنشورة بحذر، وأن النتائج يجب أن تُثبت بواسطة أساليب مستقلة.
على الرغم من أن, طرق التفكك قاسية وطويلة قد يغير التعبير الجيني في الخلايا2; العزل الفعال للخلايا أمر ضروري للحصول على تمثيل دقيق لأنواع الخلايا الموجودة. منذ المثانة هو جهاز معقد يتألف من أنواع الخلايا المتعددة، قد تكون بعض السكان مثل الخلايا المسالك البولية أو الخلايا الوماضة نسبيا تمثيلا ناقصا في حين أن أنواع الخلايا الأخرى مثل الخلايا الليفية موجودة داخل مصفوفة خارج الخلية ويمكن أن يكون تحديا لعزل. يصبح الانفصام أكثر تحديا إذا كانت المثانة قد خضعت لإعادة عرض كبيرة والتليف مثل تلك التي لوحظت في إصابة الحبل الشوكي3,4 أو انسداد منفذ المثانة5,6.
هنا، نحن وصف طريقة تفكك الأنسجة الأمثل لتحليل الخلايا المفردة المصب في المثانة الماوس المصاب الحبل الشوكي. باستخدام عملية استئصال الخلايا التدفق، قارنا أربعة بروتوكولات الهضم الأنزيمية لقدرتها على إنتاج تعليق خلية واحدة، ودعم جدوى الخلية والحفاظ على النسبة الصحيحة من مجموعات الخلايا. وبناءً على هذا التحليل، نستنتج أن تقليل موت الخلايا، والمجاميع الخلوية، والأحماض النووية غير الخلوية، والمثبطات المحتملة لتحليل المصب، هي أمر بالغ الأهمية لتحقيق بيانات عالية الجودة.
Protocol
وقد تم تنفيذ هذه الإجراءات وفقاً للتوصيات الواردة في دليل رعاية الحيوانات المختبرية واستخدامها التابع للمعاهد الوطنية للصحة. تمت الموافقة على جميع التجارب من قبل لجنة رعاية الحيوان واستخدامه في مستشفى بوسطن للأطفال.
ملاحظة: تم إيواء الفئران في منشأة حيوانية معتمدة من AAALAC مع إمكانية الوصول إلى الطعام والماء. وقد استخدمت الفئران الإناث في 8\u201212 أسابيع من العمر لهذه التجارب. وبالنظر إلى طبيعة الإصابة، تم توفير إثراء غذائي إضافي للفئران لضمان رفاهها.
1. انخفاض في الصدر الحبل الشوكي عن بعد في الفئران
- التحضير قبل نقل الحبل الشوكي
ملاحظة: الأدوات الجراحية اللازمة لهذا الإجراء هي مقص تشريح الربيع الجزئي، ملقط تشريح الدقيقة، صغيرة خياطة إبرة سائق، الهيموستاتات، و 7-0 البوليجلاكتين 910 الغرز. الإمدادات الجراحية الأخرى المطلوبة هي الستائر الجراحية، والأوراق المعقمة للحقل الجراحي، والإسفنج الشاش، والقطن تلميح المحاقن، والمحاقن 1 مل مع 25 G الإبر.- أوتوكلاف الأدوات الجراحية واللوازم قبل الجراحة.
- تنظيف المنطقة الجراحية ومنصات التدفئة مع مناديل الكحول. سيتم استخدام وسادة تسخين واحدة أثناء الجراحة والأخرى لفترة ما بعد الجراحة المباشرة للحفاظ على درجة حرارة جسم الحيوان حتى استعادة النشاط الكامل.
- استخدم اللوب المكبرة (2.5x أو أكثر) لإجراء العملية الجراحية.
- التبديل على منصات التدفئة، ومصدر الضوء، ومعقم حبة الزجاج لتكون جاهزة للاستخدام أثناء الإجراء.
- افتح الستائر الجراحية والأدوات. استخدم قفازات معقمة لثني المجال الجراحي ووضع الأدوات في المجال الجراحي.
- إعداد الحيوانات
- أحضر الفئران إلى غرفة الإجراءات وأحضر أيضًا قفصًا نظيفًا للفئران المصابة في الحبل الشوكي.
- إدارة التخدير عن طريق وضع الماوس في غرفة التعريفي مع تدفق isoflurane تعيين في 3.0٪, تدفق الأكسجين في 1 لتر / دقيقة, والشفط في 20 mm زئبق حتى لا يكون هناك استجابة مخلب قرصة.
- تزن على الفور الحيوان ومن ثم وضع الحيوان في موقف عرضة على وسادة التدفئة.
- ضع المخروط المخدر بشكل مريح فوق أنف الماوس، والتبديل في تدفق الغاز من غرفة الحث إلى مخروط الأنف، وتعيين تدفق الأيزوفلوران إلى 2٪ وتدفق الأكسجين إلى 1 لتر / دقيقة.
- تأكد من أن الحيوان هو تخدير كاف مع عدم وجود استجابة ل paw-قرصة. الشريط أطراف الحيوان إلى وسادة التدفئة. ضع قطعة من إسفنج الشاش المدلفونة تحت الصدر السفلي لرفع وفتح الفقرات الصدرية السفلية والثني.
- تطبيق مواد التشحيم العيون على كلتا العينين. إدارة أدوية الألم (ميلوكسيكام، 10 ملغم/ كغ، تحت الجلد) والمضادات الحيوية (إنروفلوكساسين، 5 ملغم / كجم، تحت الجلد).
ملاحظة: يجب على المستخدمين النهائيين استخدام مسكنات الألم والمضادات الحيوية التي توصي بها لجنة رعاية الحيوانات المحلية واستخدامها. - Palpate العملية العرضية الأبرز في العمود الفقري الصدري الذي يتوافق عادة مع T13 عملية7. حلق منطقة مستطيل طولي على الجزء الخلفي من الماوس من أسفل الرقبة إلى أسفل العملية العرضية الأكثر بروزًا (T13) و 1 سم على كل جانب من خط الوسط.
- إجراء جراحي
- إعداد المنطقة الحل مع 10٪ povidone اليود الحل و 70٪ الإيثانول ثلاث مرات بدلا من ذلك بطريقة دائرية بدءا من موقع شق العمل في الخارج ومن ثم تغطية الحيوان مع العقيمة 4 × 4 الإسفنج الشاش مع نافذة في المركز الإفراط في مجال الجراحة.
- جعل 1.5 cm شق في خط الوسط من الظهر باستخدام مقص غرامة التي تنتهي في عملية شائكة أبرز (T13). يجب أن يشمل الشق الجلد والواجهة السطحية. استخدام مقص فصل الجلد والسطحية على جانبي لفضح العمليات العرضية والعضلات المحيطة بها طفيلي.
- باستخدام تشريح حاد وحاد فصل العضلات من العمليات العرضية ورقم من T9، T10، و T11 الفقرات.
- تقسيم حاد الأربطة بين الدبابيس بين T9 و T10 وبين T10 و T11 باستخدام مقص غرامة ثم استخراج العملية العرضية من T10 وبعناية تنفيذ T10 لامينكومي ثنائيا لفضح الحبل الشوكي. تأكد من أن يتم استئصالها تماما من الصفيح.
- احول الحبل الشوكي باستخدام مقص ناعم. يحدث الحد الأدنى من النزيف عادةً في هذه المرحلة بسبب نقل الأوعية الشوكية. ضغط منطقة النزيف مع القطن العقيمة يميل قضيب لتحقيق الهفات. بعد التأكد من الهباس الكامل، أغلق الجلد مع 7-0 البوليجلاكتين 910 الغرز المستمر.
- إدارة 1 مل من محلول ملحي تحت الجلد لمنع الجفاف بعد الجراحة.
- الرعاية بعد الجراحة
- ضع الحيوان على وسادة التدفئة حتى يحدث الشفاء التام ، ثم نقل إلى قفص للماوس المصابين فقط في الحبل الشوكي.
- وتشمل الرعاية بعد الجراحة مراقبة الحيوانات ووزنها يوميا، ورصد موقع شق لعلامات العدوى لمدة تصل إلى 7 أيام. إدارة 1 مل محلول ملحي, مسكن (ميلوكسيكام 10 ملغ / كغ), والمضادات الحيوية (انروفلوكساسين 5 ملغ / كغ) كل تحت الجلد يوميا لمدة 3 أيام.
ملاحظة: يجب على المستخدمين النهائيين استخدام مسكنات الألم والمضادات الحيوية التي توصي بها لجنة رعاية الحيوانات المحلية واستخدامها. - أداء التعبير اليدوي المثانة (Credé المناورة) كل 12 ساعة حتى الحيوان قادر على التبول من تلقاء نفسها (عادة في 10 إلى 14 يوما). أمسك الحيوان بيد واحدة وتدليك أسفل البطن باليد الأخرى، ثم يشعر وضغط بلطف المثانة البولية المهزّتة مع السبابة والإبهام. وينبغي أن ضغط لطيف عابرة بالتناوب مع الاسترخاء. بعد التعبير اليدوي، اغسل أسفل البطن بماء الصنبور وجففه بلطف بمنشفة ورقية دون فرك مفرط.
ملاحظة: حجم صغير من المثانة قبل بداية التعبير والتبول من أسفل البطن مع البول هي مؤشرات على أن الحيوان قد اكتسبت القدرة على باطلة من تلقاء نفسها. - لتقليل فقدان الوزن ، وتوفير الإثراء الغذائي للفئران في شكل هلام غذائي وغيره من الحلويات المغذية (لحم الخنزير المقدد ، والجرش الفاكهة وعضات الخضار) وضعت على أرضية القفص لسهولة الوصول ملاحظة : في هذه الدراسة ، تم غرس الفئران والمثانة المشتراة في 8 أسابيع بعد SCI.
- مضاعفات ما بعد الجراحة
- تقليل احتمال تمزق المثانة بسبب التعبير اليدوي المفرط للمثانة من خلال عدم التعبير الكامل عن المثانة.
- منع اضحة الجلد من perineal من التعرض المستمر للبول المراوغة من العضلة العاصرة غير كفء من خلال غسل المنطقة بينية مع مياه الصنبور. تقليل الالتهاب من خلال تطبيق مرهم المضادات الحيوية الثلاثي.
ملاحظة: انسداد مجرى البول بسبب تجلط الدم خلال فترة الوَحَرَة أو من النيْنِي coagulum بسبب القذف الرجعي في الفئران الذكور قد يحدث بعد إصابة الحبل الشوكي. انسداد مجرى البول كاملة في الفئران الذكور كثيرا ما يتوج في تمزق المثانة والموت. في تجربتنا تردد انسداد مجرى البول في الفئران الذكور التي أدت إلى الوفاة كان 10٪.
2- الضخ وشراء الأنسجة
ملاحظة: بالنسبة لتحليلات المصب لبعض أنواع الخلايا مثل الخلايا المناعية في الأنسجة الطرفية، من المفيد إزالة الدم عن طريق التسريب في وقت حصاد الأنسجة، كما هو موضح أدناه.
- إدارة التخدير كما ذكر في الإجراء الجراحي (الخطوة 2.2) والتأكد من أن الحيوان مخدر بشكل كاف مع عدم وجود استجابة forepaw قرصة (الحيوان مشلول، وبالتالي فإن hindlimbs قد تضاءل الإحساس واستجابة قرصة هند يصبح غير ذي صلة).
- وضع الحيوان في موقف supine ومسحة البطن والصدر مع 70٪ الإيثانول لتبلل الفراء لمنعه من الدخول في موقع التشغيل.
- إجراء استئصال البطن في منتصف الغشاء من الحوض إلى الحجاب الحاجز. قطع الحجاب الحاجز بعيدا عن الأضلاع.
ملاحظة: بعد هذه الخطوة، السرعة مهمة منذ أن الفرق ضغط الصدر لم يعد موجوداً والرئتين لا يمكن تضخيم، لذلك يبدأ الحيوان في الاختناق. - قطع الصدر مفتوحة على طول الأضلاع على الجانب الأيسر والأيني بعد حدود العظام والغضاريف على خط مواز لقص القص، بدءا من الحجاب الحاجز ومضي حد الضلع الأول.
- وضع كامل جدار الصدر الأمامي فوق رأس الحيوان وإصلاحه في هذا الموقف باستخدام المشابك منشفة. لا تقطع جدار الصدر الأمامي لأن هذا سيسبب نزيفًا حادًا من الشريانين الصدريين الداخليين.
- قطع بعيدا عن الميكارونيوم باستخدام مقص غرامة.
- قم بتوصيل إبرة 23 G بجهاز الضخ، ثم أدخلها في البطين الأيسر وببطء في الشريان الأورطي، مع الحرص على عدم ثقبها.
ملاحظة: جهاز التسريب يتكون من مضخة ضخ وحقنة 50 مل متصلة أنابيب الحقن الوريدي. - بدء ضخ بسرعة وجعل قطع صغيرة مع غيض من مقص غرامة في الأذين الأيمن لتصريف المياه. الحرص على عدم إدخال فقاعات الهواء أثناء ضخ السوائل.
- قم بإجراء التسريب باستخدام محلول الفوسفات المحلى (PBS) المُخزنة في 15 مل/دقيقة. اكتمال perfusion عندما الصرف واضحة ويخفف لون الكبد يتحقق (الشكل 1).
ملاحظة: كان متوسط الوقت للثقب 3.5-4 دقيقة. يظهر الضخ غير الكافي على أنه تقدم بطيء للتبييض للأنسجة وعادة ما يكون بسبب تحديد موضع غير صحيح للإبرة في البطين الأيسر. ضبط الإبرة وتمديد مدة الضخ لمدة 1 إلى 2 دقيقة ضمان perfusion كافية من الأنسجة. - وقف الضخ وتشريح المثانة خالية من الصمامات الوعائية ومجرى البول ووضعها في أنبوب microcentruge التي تحتوي على الجليد الباردة التيرود الحل.
3. هضم المثانة في السيطرة والنخاع الشوكي الفئران المصابة
ملاحظة: من أجل صياغة خليط الهضم الفعال الذي تم تصميمه لمثانة البول الماوس، سعينا لضبط وحدة الإنزيمات المستخدمة في تحلل مكونات المصفوفة خارج الخلية السائدة مثل الكولاجين وحمض الهيالوروني. لذلك، استخدمنا بيانات تسلسل الحمض النووي الريبي المتاحة للجمهور التي تم إنشاؤها بواسطة مشروع Encode Mouse (BioProject: PRJNA66167) لاستخراج القراءة لكل كيلوبيس في المليون (RPKM) وTabula Muris8 لتقييم التعبير المكاني داخل المثانة. كانت الكولاجين 1 و 3 و 6 الجينات الثلاثة الأكثر تعبيرا عن أعلى من بين 42 الكولاجين مختلفة (الشكل 2A). وقد لوحظ التعبير عن تلك الكولاجين وhyaluronan synthase 1 (Has1) في الغالب في خلايا العضلات والليفية من جدار المثانة (الشكل 2B).
- إعداد المخازن المؤقتة والحلول
- إعداد حل تيرود الصوديوم وفقا للجدول 1 في زجاجة نظيفة 500 مل. إضافة 300 مل من ddH2O. الحل الحمضية بعد إعداد. ضبط درجة اله إلى 7.4 باستخدام NaOH. جلب حجم إلى 500 مل باستخدام مزدوجة المقطر H2O، ثم aliquot وتخزينها في -20 درجة مئوية.
ملاحظة: يحافظ هذا المخزن المؤقت على توازن درجة اله PH وosmotic في عازلة الهضم ويوفر الخلايا بالماء والأيونات غير العضوية الأساسية. أنه يحتوي على المغنيسيوم، وكذلك الجلوكوز كمصدر للطاقة. البوتاسيوم في الحل يوفر تأثيرات وقائية على النشاط الكهروميكانيكي في حل الخلية المعزولة. الأملاح المجففة هي الرطوبة وينبغي أن تكون محمية من الرطوبة. وينبغي استخدام محتويات المزيج بالكامل مباشرة بعد إعداد. لا ينصح بإعداد محلول الملح المركز لأن الترسبات قد تتشكل. التعقيم باستخدام الترشيح (0.22 مرشح μm) يمكن أن يتم إذا كانت الخلايا ستكون مثقفة بعد التحليل. - إعداد محلول الهضم الأنزيمي في أنبوب مخروطي 15 مل بإضافة وحدات التخزين والكميات الموصى بها لكل مكون(الجدول 2). إضافة محلول تيرود الصوديوم تصل إلى 2.5 مل. دوامة تماما إلى حل.
ملاحظة: Papain هو بروتياز كبريتيدريل من اللاتكس البابايا كاريكا. Papain لديه خصوصية واسعة وسوف تتحلل معظم ركائز البروتين9. وقد ثبت Papain أقل ضررا وأكثر فعالية من بروتياسات أخرى في بروتوكولات تفكك الخلية10. نحن نقدم تفاصيل حول بروتوكولات الانفصال الأربعة في الجدول 2؛ لاحظنا البروتوكول القسم 3 لدعم أعلى قابلية البقاء (93٪ ) من تعليق الخلية المعدة من مثانة الماوس.
- إعداد حل تيرود الصوديوم وفقا للجدول 1 في زجاجة نظيفة 500 مل. إضافة 300 مل من ddH2O. الحل الحمضية بعد إعداد. ضبط درجة اله إلى 7.4 باستخدام NaOH. جلب حجم إلى 500 مل باستخدام مزدوجة المقطر H2O، ثم aliquot وتخزينها في -20 درجة مئوية.
- إجراء الانفصام وإعداد تعليق الخلية
- جمع المثانة من الفئران بعد الضخ.
- ثقب المثانة للافراج عن محتويات، إن وجدت.
- أضف 100 ميكرولتر من محلول تيرود إلى أنبوب طرد مركزي فارغ 1.5 مل وقطان. ضع المثانة في الأنبوب وازن مرة أخرى لتحديد وزن المثانة الدقيق.
- ضع المثانة على طبق بيتري 10 سم على الجليد وأضف 100 ميكرولتر من محلول Tyrode للفرم.
- باستخدام مقص الجراحية، وقطع صغيرة قدر الإمكان مع التقليل من الوقت المفروم إلى ما لا يزيد عن 2\u20123 دقيقة في المثانة. إذا تجمع أنسجة المثانة من متعددة، فستخرج المثانة في آن واحد.
- نقل نسيج المثانة المفروم باستخدام طرف أنبوبية واسعة الضم إلى 2.5 مل من عازلة الهضم لكل المثانة. اضبط مستوى الصوت إذا تم تجميع عدة مثانات. احتضان الأنسجة في حل الهضم في 37 درجة مئوية في حاضنة على خلاطة نوتاتور لمدة 40 دقيقة.
- في نهاية فترة الحضانة ، قم بإزالة أنبوب الهضم من الحاضنة. Triturate (pipet صعودا وهبوطا) حل الهضم باستخدام ماصة 5 مل لمدة 1 دقيقة.
- جهاز طرد مركزي لمدة 10 دقيقة عند 350 x ز عند 4 درجة مئوية. إزالة افرنح و resuspend بيليه في 1 مل من حل مفرزة الخلية. ضع في حاضنة 37 درجة مئوية على خلاطة المعتونات لمدة 10 دقائق.
- جهاز طرد مركزي لمدة 10 دقيقة عند 350 x ز عند 4 درجة مئوية. إزالة افرنح و resuspend بيليه في 1 مل من العازلة تحلل RBC (1x). احتضان لمدة 1 دقيقة.
- إضافة 9 مل PBS لتخفيف المخزن المؤقت RBC ووقف تحلل RBC.
- تمر الخلايا من خلال 70 ميكرومتر مصفاة الخلية في أنبوب مخروطي 50 مل، وذلك باستخدام المكبس من حقنة لكشط طفيفة مصفاة الخلية لضمان مرور الخلية الكاملة. تأكد من جمع السائل الذي يمر من خلال مصفاة ولكن قد يكون اشتعلت على الجانب السفلي من مصفاة.
- جهاز طرد مركزي لمدة 10 دقيقة عند 350 x ز عند 4 درجة مئوية. إزالة فائقة و resuspend بيليه في 200 ميكرولتر من خلية تلطيخ العازلة (PBS مع 2٪ FBS).
- عد الخلايا.
- علم المناعة لخلايا معينة من أجل تدفق الخلايا
ملاحظة: للكشف عن أنواع مختلفة من الخلايا في المثانة، قمنا بتصميم لوحة قياس الخلايا ذات التدفق المتعدد الألوان. لتنفيذ التعويض ووضع استراتيجية مناسبة للمعالجة، ونحن تشمل غير الملطخة وفلوريسنس ناقص واحد (FMO) الضوابط. ضوابط FMO مهمة للسكان إيجابية بوابة، خاصة عندما يكون الكسر الإيجابي خافت. الإجراء تلطيخ هو كما يلي.-
حظر FcγRII/ III مستقبلات على الخلايا
ملاحظة: نوصي بحجب الربط غير محدد للأجسام المضادة أحادية النسيلة عن طريق حضانة الخلايا مع الأجسام المضادة للمُستقبلات أحادية النسيلة، أو بروتين Fc المؤتلف.- غسل الخلايا عن طريق الطرد المركزي في 350 س ز لمدة 5 دقائق في 4 ° C وإضافة خلية تلطيخ العازلة.
- تجاهل supernatant وكتلة FcγRII / III مستقبلات على الخلايا لمنع تلطيخ الأجسام المضادة غير محددة عن طريق إضافة الأجسام المضادة CD16 وD32 في خلية تلطيخ العازلة في تخفيف 1:100.
- احتضان على الجليد لمدة 10 دقيقة.
ملاحظة: ليس هناك حاجة لغسل الخلايا; يمكن أن تلطخ الخلايا مباشرة بعد هذه المرحلة.
-
تلطيخ لأجسام FM
ملاحظة: إن التحكم في الفلوريسنس ناقص واحد (FMO) هو أنبوب من كل الفلوروكرومات المستخدمة في التجربة التي تحتوي على جميع الفلوروكرومات باستثناء واحد.- على سبيل المثال، إذا كان لدى المرء 4 فلوريات مختلفة (A و B C و D + Annexin V و فوديد البروديوم (PI))، قم بإعداد أنابيب FMO على النحو التالي. FMO أنبوب 1: الأجسام المضادة المقترنة مع B، C، D fluorochromes + (الملحق الخامس وPI)؛ أنبوب FMO 2: الأجسام المضادة المقترنة مع A, C, D fluorochromes + (الملحقين الخامس وPI); أنبوب FMO 3: الأجسام المضادة المقترنة مع A, B, C fluorochromes + (Annexin V و PI); FMO أنبوب 4: الأجسام المضادة المقترنة مع A, B, C, D fluorochromes + (الملحق الخامس); FMO أنبوب 5: الأجسام المضادة المقترنة مع A, B, C, D fluorochromes + (PI).
- النظر في طبيعة الفلوروكرروم المترافق للجسم المضاد Annexin V.
-
تلطيخ الخلايا المسدودة بالأجسام المضادة المرغوبة
- احتضان الخلايا المحظورة مع الخلطات الرئيسية المناسبة من الأجسام المضادة الفلورويور مترافق ضد البروتينات المطلوبة لمدة 20 دقيقة على الجليد المحمية من الضوء. تذكر تضمين FMOs.
- غسل الخلايا مع 1 مل من خلية تل العازلة المضافة إلى كل أنبوب والطرد المركزي ثم مرة أخرى في 350 × ز لمدة 5 دقائق في 10 درجة مئوية.
- تجاهل افرا و resuspend بيليه الخلية في 200 μL من خلية تلطيخ العازلة. الحفاظ على الجليد حتى يمكن الحصول على بيانات الفلوريسين باستخدام جهاز قياس تدفق.
-
تطبيق الملحق الخامس / PI وصمة عار.
- إعداد حل عمل من PI (100 ميكروغرام / مل) في 1x الملحق الملحق ملزم العازلة كما هو موضح في بروتوكول الشركة المصنعة لمجموعة موتى الخلايا المبرمج.
- تحديد كثافة الخلية ولاحظ المخزن المؤقت وحدة التخزين التي يتم تخزينها.
- عينات الطرد المركزي في 350 × ز لمدة 5 دقائق، والتخلص من الخلايا فائقة و resuspend في 1x الملحق الملحق ملزم العازلة إلى كثافة ~ 1 ×10 6 خلايا / مل في حجم 100 ميكرولتر.
- إضافة FITC-Annexin V (5 ميكرولتر) وPI حل العمل (1 ميكرولتر) لكل عينة (100 ميكرولتر)، كما هو موضح في بروتوكول الشركة المصنعة، واحتضان في درجة حرارة الغرفة لمدة 15 دقيقة.
- أضف 400 ميكرولتر من 1x Annexin-ملزمة العازلة للعينات، مزيج من قبل عكس والحفاظ على الجليد حتى تدفق القياسات.
-
حظر FcγRII/ III مستقبلات على الخلايا
- معايرة FACS
-
تدفق قياس الشقوق والتحكم في النقاء
- بدء تحليل قياس الخلايا تدفق عن طريق قياس الخلايا غير المطهوة لتحديد مورفولوجيا الخلية وأحواض الفلوروكرومات.
- ضبط الجانب المبعثر (SSC) وتشتت للأمام (FSC) عن طريق تعديل الفولتية لكل معلمة الفلوريسنس. قياس انبعاث الفلورسينس عند 530 نانومتر (الملحق الخامس) و> 575 نانومتر (PI).
- تحديد السكان السلبية في العقد الأول باستخدام الشبكات على كل مؤامرة نقطة. ضع كل تحكم FMO في مقياس التسارع وتصحيح التداخل الطيفي حتى يتم محاذاة وسيطات السكان السلبية والإيجابية.
- تدبير 100,000 حدث. قياس الخلايا الملطخة بعلامات محددة وإنشاء بوابات لفئات الخلايا ذات الاهتمام.
-
تدفق قياس الشقوق والتحكم في النقاء
- تحليل البيانات
- جمع البيانات من تدفق مقياس المقاييس. افتح البرنامج لتصور مساحة العمل للتحليل.
- إنشاء مساحة عمل
- استيراد ملفات FCS بواسطة سحبها إلى مساحة العمل. ستكون الملفات مرئية في مقطع النموذج والمجموعة في مساحة العمل. انقر نقراً مزدوجاً فوق اسم النموذج لفتح الملف.
- استخدم منطقة التشتت الجانبي (SSC-A) لمنطقة التشتت y-محور ولأمام (FSC-A) للمحور س(الشكل 3A). انقر فوق الرمز لـ اِلَتَمَط المضلع.
- إنشاء بوابة حول مجموعة الخلايا ذات الاهتمام في مؤامرة نقطة عن طريق النقر على جعل عقدة بوابة ثم مواصلة النقر حول مجموعة الخلايا حتى تكتمل؛ انقر نقرا مزدوجا لإغلاق البوابة.
- قم بتسمية البوابة وفقًا للسكان المُسرَعين (مثل "جميع الخلايا") وانقر فوق موافق.
ملاحظة: النقر المزدوج داخل بوابة "كافة الخلايا" سيفتح نافذة رسم بياني جديد يظهر فقط الأحداث الواردة في "كافة الخلايا". - ضبط المحور ص من الرسم نقطة جديدة إلى SSC-H (الجانب ارتفاع مبعثر) عن طريق النقر في السهم الأسود وحدد لتغيير المحور ص.
ملاحظة: هذه البوابات للخلايا المفردة (singlets) ويستبعد المجاميع أو المجاميع أكبر(الشكل 3B). وبما أن الخلايا المفردة لها عرض وطول متناسبان، فينبغي تمثيلها كسكان على القطر. الخلايا التي تقع خارج هذه البوابة القطرية هي مزدوجة أو مجاميع أكبر. - انقر نقرا مزدوجا فوق البوابة لتحليل (PI إيجابية)، المبرمج في وقت مبكر (الملحقين الخامس إيجابية، PI-السلبية) و المبرمج في وقت متأخر (الملحقين الخامس إيجابية، PI-negative) الخلايا(الشكل 3C).
- تسمية المحور س كما الملحق الخامس و y-axis كـ PI.
ملاحظة: في بعض الحالات، حيث تكون كثافة الإشارة منخفضة، قد يبدو أن مجموعات الخلايا لها قيم فلورية سالبة، نتيجة لتصحيح الخلفية. في هذه الحالة، فمن المستحسن إجراء تحويل ثنائية الأسية. للقيام بذلك، انقر على T بجوار المحور y واختر تخصيص المحور. في النافذة الجديدة قم بتغيير المقياس إلى ثنائية الأسية (Biex) ، قم بإضافة قيم سالبة إلى المحاور عن طريق زيادة أساس العرض وانقر فوق تطبيق. وهذا من شأنه أن يحسن من دقة الأحداث مع انخفاض كثافة الإشارة. - إظهار البيانات كرسم حساب. استخدم علامة التبويب الخيار أسفل المحور س وحدد الرسم العداد من القائمة.
- رسم بوابة كوات على المؤامرة لتحديد 4 مجموعات مستهدفة منفصلة.
- انقر في أعلى النافذة لفتح محرر التخطيط، من خلال النقر في محرر التخطيط واسحب السكان إلى كل منطقة منفصلة.
- ضع المخططات في محرر التخطيط عن طريق سحب مجموعات من مساحة العمل وإفلاتها في نافذة محرر التخطيط.
- تصور باستخدام مدرجات التكرار
- اختر مدرجًا بيانيًا من علامة التبويب خيارات.
- تطبيق بوابة لتحديد الملحق الخامس-الخلايا الإيجابية; بدلاً من ذلك، يمكن تعريف السكان الموجبين والسلبيين باستخدام أداة القطاعين. يجب أن يظهر قسم العينة الآن مجموعات مختلفة تم تشكيلها وتسلسلها الهرمي.
- لمقارنة العينات، اسحب كل المدرجات التكرارية فوق بعضها البعض؛ ثم اسحب كل المخططات البيانية فوق بعضها البعض؛ ثم اسحب كل المخططات البيانية فوق بعضها البعض. انقر بزر الماوس الأيمن على الرسم البياني ومن المدرج التكراري اختيار ستاجر أوتدال.
- إضافة تحليلات إحصائية
- افتح علامة التبويب الإحصائيات بالنقر المزدوج على مجموعة الاهتمامات. حدد الدالة المطلوب تطبيقها والمعلمة المتضمنة.
- كرر مع مجموعات سكانية أخرى، عن طريق سحب رمز Sigma إلى اسم المحتوى.
- تطبيق التحليل على جميع العينات عن طريق اختيار استراتيجية الغوات من عينة من الفائدة وسحبها إلى المجموعة المحددة من قبل علامة الفائدة، مثل الملحق الخامس.
- إنشاء بوابات في عينات التحكم FMO وتحديد مجموعات سكانية سلبية وإيجابية؛ سيتم تطبيق هذه الاستراتيجية الغات على التجربة بأكملها (الشكل 3D\u2012F).
ملاحظة: تحقق من كل عينة بشكل فردي للتأكد من أن البوابات صحيحة وتعدل عند الضرورة. - إذا كانت الخلايا ملطخة بالأجسام المضادة علامة (على سبيل المثال، CD45) استخدام FMO المقابلة وبوابة وفقا لذلك.
- لتصدير التخطيط، انقر على ملف | تصدير | صورة حدد تنسيق الملف (على سبيل المثال، jpg، pdf).
- انقر فوق إنشاء جدول لفتح نافذة مع الإصدار النهائي من الجدول.
- تصدير الجدول عن طريق تحديد ملف | حفظ باسم | اسم الملف.
النتائج
إجراء جراحي
يتم تحديد نجاح نقل الحبل الشوكي الصدري من خلال تقييم عدد من المعلمات ، وأكثرها وضوحًا هو الشلل الهادلب. يتحرك الحيوان فقط باستخدام مقابضه الأمامية ، وسحب ه hindlimbs. خلاف ذلك مستويات النشاط، بما في ذلك التغذية، الاستمالة واليقظة عادة ما تكون طبيعية. بالإضافة إلى ذلك، تفقد الحيوانات التحكم في المثانة مما يؤدي إلى الحاجة إلى التعبير اليدوي للمثانة من قبل المحقق كل 12 ساعة حتى عودة الفراغ المنعك في 10 إلى 14 يوما بعد الإصابة. بعد القتل الرحيم، علامات إضافية على نجاح الإصابة تتعلق في المقام الأول إلى زيادة نسبة وزن المثانة إلى الجسم، مما يدل على إعادة عرض الأنسجة. التحليل النسيجي يكشف عن تضخم التنسج داخل كل من مقصورات العضلات العضلية اللوانية والسلسة3.
إعداد تعليق خلية واحدة
باستخدام بيانات التعبير المتاحة للجمهور، تم تحديد إثراء أنسجة المثانة لبروتينات المصفوفة خارج الخلية(الشكل 2)واستخدامها لإعلام صياغة مزيج الهضم. منذ الكولاجين هي المكونات الرئيسية للجدار المثانة11،12، أولا سعينا لتحديد الكولاجين (ق) الأكثر وفرة في المثانة الماوس باستخدام الحمض النووي الريبي مجموعات البيانات التي تم إنشاؤها بواسطة مشروع ماوس ENCODE13. أظهر تحليلنا أن الكولاجين 1A1، الكولاجين 3A1، الكولاجين 1A2 والكولاجين 6A1 هي أنواع الكولاجين الأكثر وفرة داخل المثانة الماوس(الشكل 2A). كما استخدمنا تابولا موريس (خلاصة بيانات نسخة الخلية الواحدة من الماوس (Mus mus musculus))8 لتحديد مستوى التعبير عن الكولاجين 1 و3 و6 و هيالورونان. تسمح البيانات بإجراء مقارنة مباشرة و متحكم بها للتعبير الجيني في أنواع الخلايا المشتركة بين الأنسجة. وكشف هذا التحليل أن التعبير عن هذه المكونات مصفوفة خارج الخلية هو أكثر انتشارا في أنواع الخلايا mesenchymal بدلا من urothelium (الشكل 2B).
تأثير الانفصام على صلاحية الخلايا المعزولة من المثانة
تحليل تدفق قياس الاستئصال أظهر أن الهضم الأنزيمي باستخدام 4 بروتوكولات مختلفة أسفرت عن جدوى 83٪، 86٪، 93٪ أو 90٪، على التوالي. وهكذا، اعتبر البروتوكول الباب 3 أكثر قيمة للحفاظ على صلاحية الخلية. كما لاحظنا أن ما يقرب من 4٪ من الخلايا كانت نخرية (PI+/ Annexin V-) (الشكل 4A). هذه الملاحظات تؤكد على كفاءة بروتوكول الهضم والفائدة المترتبة على جدوى الخلية.
تأثير إصابة الحبل الشوكي على مجموعات مختلفة من الخلايا في المثانة
لاحظنا زيادة كبيرة في العدد الكلي للخلايا في المثانة من الفئران SCI مقارنة بالضوابط. وكان نمط المؤامرات نقطة التي تم الحصول عليها من SCI المثانة أيضا مختلفة قليلا بما يتفق مع إعادة عرض الجهاز الجارية بسبب إصابة الحبل الشوكي(الشكل 4B: العمود الأول). بالمقارنة مع عناصر التحكم ، أظهرت المثانة من SCI زيادة كبيرة في الخلايا إيجابية CD45.
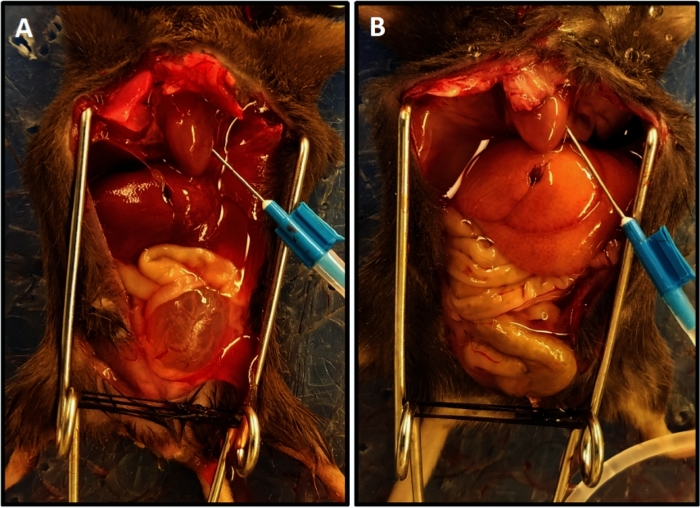
الشكل 1: اكتمال الضخ التمثيلي مع لون مخفّق للكبد. (أ) يوضح لون الكبد في بداية الضخ. (B) يظهر لون الكبد المخفف في نهاية perfusion. وكان الفأر في (A) الترانفير الحبل الشوكي قبل أسبوعين من القذف مما أدى إلى تضخم المثانة وبروزها من الحوض على عكس الماوس في (ب) التي لم يكن لها إصابة الحبل الشوكي; في هذه الحالة المثانة صغيرة ومخبأة في الحوض. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
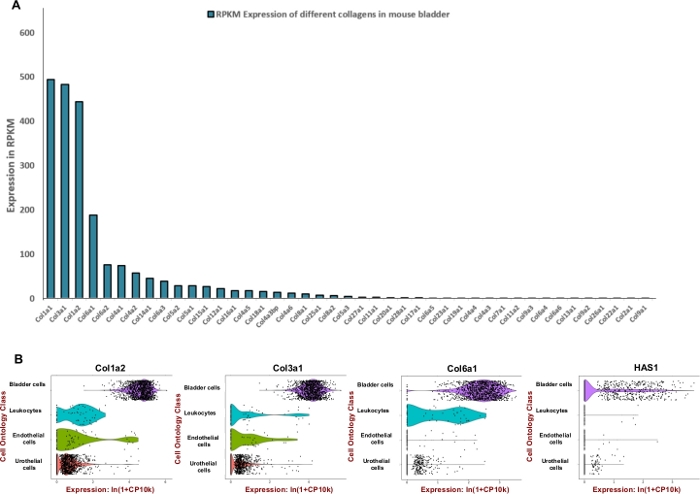
الشكل 2: التعبير النصي لمكونات المصفوفة خارج الخلية (ECM) في مثانة الماوس. (أ) مخطط شريطي من 43 أنواع مختلفة من الكولاجين. التعبير مذكور من قبل يقرأ لكل كيلوبيس من النص، لكل مليون يقرأ معين (RPKM) (يتم جمع البيانات من BioProject: PRJNA66167)14. (ب) كمان المؤامرات من التعبير الجيني في أنواع الخلايا التي تم الحصول عليها من microfluidic قطرات القائم على 3 'نهاية العد في مجموعة من عينات المثانة البولية من الذكور والإناث (الذكور والإناث). تم تسوية الـ 1000 لكل خلية باستخدام اللوغاريتم الطبيعي لكل 1+ عدد لكل مليون لكل ين (CPM+1)8. تمت إضافة عدد زائف من 1 CPM قبل أخذ اللوغاريتمات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
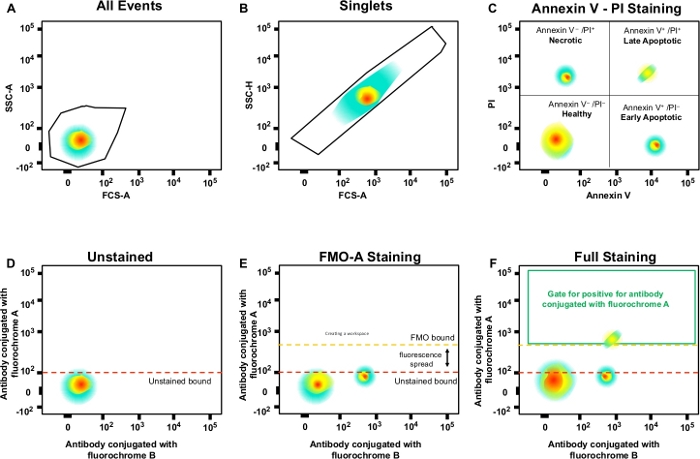
الشكل 3: استراتيجية الغات والضوابط FMO لتحديد انتشار الفلوريسنس. (أ) اختيار عدد الخلايا. (ب) استراتيجية جاتينغ للعزب. (C) ج) جاتينغ لخلو, وخلايا المبرمج في وقت مبكر ومتأخر باستخدام الجسم المضاد PI و Annexin V. (D\u2012F) مخطط نقطي من قياس تدفق متعدد الألوان (على سبيل المثال، الأجسام المضادة المقترنة مع A، B، C، D fluorochromes + (الملحق الخامس و PI). وهذا يدل على انتشار الفلوريس في الجسم المضاد مع قناة الفلوروكروم A التي تظهرها السيطرة FMO مقارنة مع عنصر تحكم غير ملوث. يمثل الخط المنقط البرتقالي حدود البوابات FMO مقارنة مع الحدود غير المُطَوَّر بها باللون الأحمر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
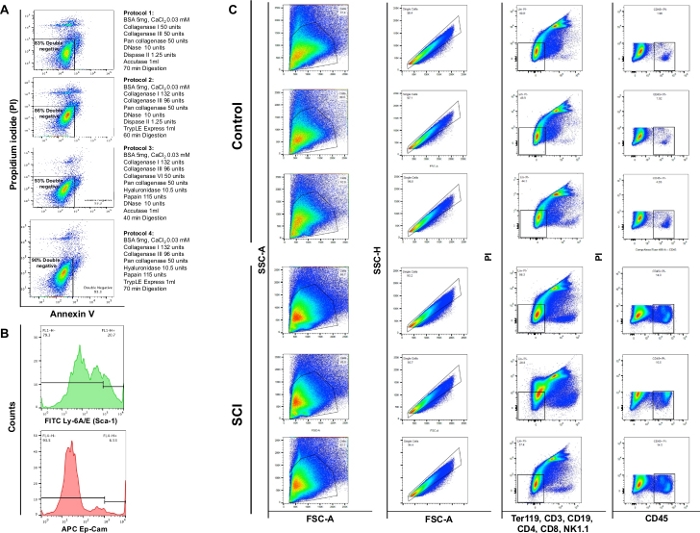
الشكل 4: تدفق الخلايا من أنواع الخلايا المختلفة في المثانة. (A) الملحق V / PI مزدوجة تلوين مخططات التدفق. يتم تمثيل مجموعات مختلفة من الإنزيمات والمواد الكيميائية المستخدمة لكل بروتوكول أمام مؤامرة قابلة للتطبيق المقابلة. وتبين هذه البيانات أن أعلى قابلية للبقاء قد تم الحصول عليها مع القسم 3 من البروتوكول. (ب)مدرجات بيانية تمثيلية توضح شدة Ly-6A/E (Sca-1) و CD326 (Ep-CAM) التي تم اكتشافها في قنوات مفردة. (C) تأثير SCI على مجموعات الخلايا من المثانة الماوس. اللوحة العلوية يظهر نتائج تلطيخ على ثلاث مثانات منفصلة تم الحصول عليها من الفئران غير الجراحية التحكم واللوحة السفلى يظهر نتائج تلطيخ على ثلاثة مع SCI. العمود الأول هو إجمالي عدد الخلايا. يعرض العمود الثاني تحديد البوابات المفردة. يُظهر العمود الثالث المجموعة الفرعية للخلايا الحية التي تكون سالبة للخلايا B والخلايا التائية وخلايا NK. يظهر العمود الرابع تلطيخ للخلايا الحية إيجابية لـ CD45. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| مكون | المبلغ (مقابل 500 مل) | المولاريّة |
| NaCl | 4.091 غرام | 140 mM |
| KCl | 0.186 غ | 5 mM |
| MgCl2 | 0.0476 غ | 1 mM |
| د-جلوكوز | 0.9 غرام | 10 mM |
| HEPES | 1.19 غرام | 10 mM |
الجدول 1: مكونات إعداد حل التيرود. المكونات المشار إليها هي لإعداد حل 500 مل تيرود.
| مكون | المبلغ | القسم 1 من البروتوكول | القسم 2 من البروتوكول | الفرع 3 من البروتوكول | الفرع 4 من البروتوكول |
| جيش صرب البوسنه | 5 ملغ | نعم | نعم | نعم | نعم |
| CaCl2 | 0.03 م م م | نعم | نعم | نعم | نعم |
| كولاجيناز من النوع الأول | 132.5 وحدة | نعم | نعم | نعم | نعم |
| كولاجيناز النوع الثالث | 96.4 وحدة | نعم | نعم | نعم | نعم |
| كولاجيناز من النوع السادس | 50 وحدة | - | - | نعم | - |
| DNase | 10 وحدات | نعم | نعم | نعم | - |
| باباين | 115 وحدة | - | - | نعم | نعم |
| بان كولاجيناز | 50 وحدة | - | - | نعم | نعم |
| هيالورونيداز | 10.5 وحدات | - | - | نعم | نعم |
| Dispase II | 1.25 وحدة | نعم | نعم | - | - |
| حل تفكك الخلية | 1 مل | نعم | - | نعم | - |
| إنزيم المؤتلف | 1 مل | - | نعم | - | نعم |
الجدول 2: مكونات لإعداد العازلة الهضم. المكونات المشار إليها هي لإعداد 2.5 مل مزيج الهضم (1 U يحفز التحلل المائي من 1 ميكرومول الركيزة في الدقيقة الواحدة في 37 درجة مئوية. الرجوع إلى ورقة بيانات المنتج لتعريف وحدة كل إنزيم).
Discussion
نموذج إصابة النخاع الشوكي الماوس الموصوف هنا يوفر طريقة استنساخها لإنشاء انسداد منفذ المثانة الوظيفية بسبب فقدان التنسيق بين انكماش المثانة والاسترخاء العضلة العاصرة مجرى البول الخارجي. وهذا بدوره يثير إعادة عرض عميق من جدار المثانة في وقت مبكر من 2 أسابيع بعد الإصابة التي تتميز بتوسع المقصورات العضلية وناعمة. وتشمل الخطوات الحاسمة في تنفيذ نموذج SCI في القوارض (1) الاهتمام الصارم بتعبير المثانة اليدوي خلال فترة الصدمة الشوكية التي تترتب على ذلك لمدة 10 أيام بعد الإصابة؛ و(ب) التركيز الدقيق على التعبير اليدوي للمثانة خلال فترة الصدمة الشوكية التي تترتب على ذلك؛ و(ب) التركيز على استخدام الأراضي في النخاع الشوكي. '2' الإثراء التغذوي لتقليل فقدان الوزن؛ و (3) التخفيف من احتمالية حرق البول خاصة بالنسبة للتجارب التي تمتد إلى ما بعد عودة الفراغ المنعك. وتشمل القيود على النموذج احتمال انسداد مجرى البول في الفئران من جلطات الدم خلال فترة البيلة الدموية العابرة، وبالإضافة إلى ذلك في الفئران الذكور من النياجولوم بعد القذف الرجعية بعد الجراحة.
يوضح نهج تفكك الأنسجة الموصوف هنا أهمية النظر في التغيرات الهيكلية في الأنسجة التي تنشأ عن الإهانة التجريبية ، وفي هذه الحالة إعادة عرض الأنسجة الهامة بعد SCI التي قد تؤثر على تحليلات المصب. مع الزيادة في تحليلات الخلايا المفردة من المهم التأكد من أن الاختلافات التي لوحظت في التعبير الجيني ليست مجرد نتيجة للأمراض الناجمة عن الانفصام، بل هي تمثل حقا التغيرات البيولوجية الأساسية ذات الصلة لنموذج المرض. استخدام البيانات التعبير المتاحة للجمهور سمح لنا لتعديل صياغة العازلة الهضم لضمان الهضم الفعال للمصفوفة خارج الخلية مع تعظيم الجدوى. وتشمل التعديلات الإضافية التي يمكن النظر في التطبيقات المستقبلية إضافة actinomycin D، لوقف النسخ من الجينات في وقت مبكر الفوري التي هي حساسة لبروتوكول الانفصام15.
تقنية الأنابيب أمر بالغ الأهمية عند فصل الأنسجة أو نقل الخلايا التي هي بالفعل في التعليق. للحد من الأضرار المادية للخلايا من قوات القص، من المهم أن الماصات بلطف وببطء أثناء إعادة دمج الخلايا. من المستحسن عموما لاستخدام نصائح واسعة تتحمل ماصة. إذا كان استخدام النصائح القياسية, من المهم بشكل خاص إلى تعليق الخلية ماص بلطف لتجنب القوى القص التي من شأنها أن تضر الخلايا. استخدام مصافي الخلايا أمر لا مفر منه في هذا البروتوكول، ومع ذلك، يمكن أن ينخفض تركيز الخلية بنسبة 20٪ أو أكثر، يرافقه فقدان حجم 100 ميكرولتر أو أكثر. نوصي بتحديد تركيز الخلايا بعد الإجهاد لضمان عدد الخلايا الدقيق.
في قياس التدفق، توفر عناصر التحكم FMO مقياسًا للخلفية بسبب النزف من خلال الإشارة من قمم الانبعاثات المتداخلة. فهي ليست مقياساً لربط الأجسام المضادة غير المحددة، أو تلطيخ الخلفية الذي قد يكون موجوداً عند تضمين جسم مضاد في تلك القناة. لحساب لاتلّاق الأجسام المضادة غير محددة، يجب على المرء أن يتضمن عناصر تحكم isotype المناسبة؛ لخلفية تلطيخ، يحتاج المرء إلى تضمين الضوابط السلبية. ومع أخذ هذه الضوابط معا، فإن هذه الضوابط تضمن قياس أعداد الخلايا قياسا دقيقا.
Disclosures
لم يُعلن عن تضارب المصالح.
Acknowledgements
وقد دعم هذا العمل منح من المعاهد الوطنية للصحة (R01 DK077195 إلى R.M.A، R01 DK104641 إلى R.M.A وD.R.B). ونحن نقدر على مدخلات قيمة من الدكتور ستيوارت أوركين في قسم أمراض الدم / الأورام، مستشفى بوسطن للأطفال، قسم طب الأطفال، كلية الطب بجامعة هارفارد ومعهد دانا فاربر للسرطان. كما نعترف بالدعم المقدم من كايل كوستا في الرعاية اللاحقة للجراحة للفئران، ماري تاغلينتي والدكتور حبيب الله شوجايساري (مختبر الدكتور يانغ شي، قسم طب الأطفال، قسم طب حديثي الولادة، قسم طب الأطفال، قسم طب حديثي الولادة، مستشفى بوسطن للأطفال، كلية الطب بجامعة هارفارد) للحصول على المساعدة التقنية والمناقشات المفيدة.
Materials
| Name | Company | Catalog Number | Comments |
| 2.5 X Magnifying Loupes | |||
| 7-0 Vicryl suture, 6.5mm needle 3/8 circle | ETHICON | J546 | |
| 70 μm Cell Strainer | Thermofisher | 22363548 | |
| Accutase in BPBS, 0.5mM EDTA | Millipore | SCR005 | |
| Aerosol Filter Wide Orifice Pipettor Tips (1000 µL) | VWR | 89049-168 | |
| Aerosol Filter Wide Orifice Pipettor Tips (1000 µL) | VWR | 89049-168 | |
| APC anti-mouse CD326 (Ep-CAM), rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 118213 | |
| BB515 Rat Anti-Mouse CD45, rat monoclonal, IgG2b, κ, Clone 30-F11 | BD Biosciences | 564590 | |
| BONN Micro Dissecting Forceps, Straight, 1x2 teeth, 3.75" length, 0.3mm tip width, 0.12mm teeth | ROBOZ Surgical Instrument Company, Inc. | RS-5172 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Bovine Serum Albumin | Sigma | A9647-100G | |
| CaCl2 | Sigma | 2115-250ML | |
| CASTROVIEJO Micro Suturing Needle Holder, Straight with lock, 5.75" length | ROBOZ Surgical Instrument Company, Inc. | RS-6412 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Cell Counting Kit, 30 dual-chambered slides, 60 counts, with trypan blue | Biorad | 1450003 | |
| Cell Staining Buffer | BioLegend | 420201 | |
| Collagenase from Clostridium histolyticum | Sigma | C0130-1G | |
| Collagenase Type I | Worthington Biochemical Corporation | LS004196 | |
| Collagenase Type III | Worthington Biochemical Corporation | LS004182 | |
| Collagenase, Type 6 | Worthington Biochemical Corporation | LS005319 | |
| Dead Cell Apoptosis Kit with Annexin V Alexa Fluor 488 & Propidium Iodide (PI) | Thermofisher | V13241 | |
| Dispase II | Sigma | D4693-1G | |
| DNase | Sigma | DN25-1G | |
| Enrofloxacin (Baytril) | Bayer Health Care LLC, | NADA # 140-913 Approved by FDA. Lot No.: AH01CGP | 2.27% Injectable Solution |
| Falcon 15 ml conical centrifuge tubes | Fisher Scientific | 352096 | |
| Falcon 50 ml conical centrifuge tubes | Fisher Scientific | 352070 | |
| FITC anti-mouse Ly-6A/E (Sca-1) Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 122505 | |
| Hyaluronidase from sheep testes, Type II | Sigma | H2126 | |
| MACS SmartStrainers (100 µm) | Miltenyi Biotec, Inc. | 130-110-917 | |
| McPHERSON-VANNAS, Micro Dissecting Spring Scissors, Straight, 4" length, 0.15mm tip width | ROBOZ Surgical Instrument Company, Inc. | RS-5630 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Meloxicam | Patterson Veterinary | 07-891-7959 | |
| Papain | Worthington Biochemical Corporation | LS003119 | |
| PE/Cy5 anti-mouse CD19 Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 115509 | Dump Channel |
| PE/Cy5 anti-mouse CD3ε Antibody, Armenian hamster monoclonal, IgG, affinity purified | BioLegend | 100309 | Dump Channel |
| PE/Cy5 anti-mouse CD4 Antibody, rat monoclonal, IgG2b, κ, affinity purified | BioLegend | 100409 | Dump Channel |
| PE/Cy5 anti-mouse CD8a Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 100709 | Dump Channel |
| PE/Cy5 anti-mouse NK-1.1 Antibody, mouse monoclonal, IgG2a, κ, affinity purified | BioLegend | 108715 | Dump Channel |
| PE/Cy5 anti-mouse TER-119/Erythroid Cells Antibody, IgG2b, κ, affinity purified | BioLegend | 116209 | Dump Channel |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block), rat monoclonal, IgG2b, κ, Clone 2.4G2 | BD Biosciences | 553141 | |
| RBC Lysis Buffer (10X) | BioLegend | 420301 | |
| Red Blood Cell Lysis Buffer 1x | Biolegend | 420201 | |
| Screw-Cap microcentrifuge tubes, 1.5 ml | VWR | 89004-290 | |
| TC20 Automated Cell Counter | Biorad | 1450102 | |
| Triple antibiotic ointment (neomycin/polymyxin B/ bacitracin) | Patterson Veterinary | 07-893-7216 | skin protectant |
| TrypLE Select Enzyme (10X), no phenol red | Thermofisher | A1217701 | |
| Vetropolycin eye ointment | Dechra Veterinary Products | NADA # 065-016. Approved by FDA. | protect eyes during anesthesia |
References
- Grange, C., et al. Phenotypic characterization and functional analysis of human tumor immune infiltration after mechanical and enzymatic disaggregation. Journal of Immunological Methods. 372 (1-2), 119-126 (2011).
- van den Brink, S. C., et al. Single-cell sequencing reveals dissociation-induced gene expression in tissue subpopulations. Nature Methods. 14 (10), 935-936 (2017).
- Seth, A., et al. The impact of discrete modes of spinal cord injury on bladder muscle contractility. BMC Urology. 13, 24 (2013).
- Doyle, C., et al. Inosine attenuates spontaneous activity in the rat neurogenic bladder through an A2B pathway. Scientific Reports. 7, 44416 (2017).
- Gheinani, A. H., et al. Characterization of miRNA-regulated networks, hubs of signaling, and biomarkers in obstruction-induced bladder dysfunction. JCI Insight. 2 (2), 89560 (2017).
- Gheinani, A. H., et al. Concordant miRNA and mRNA expression profiles in humans and mice with bladder outlet obstruction. American Journal of Clinical and Experimental Urology. 6 (6), 219-233 (2018).
- Krishna, V., et al. A contusion model of severe spinal cord injury in rats. Journal of Visualized Experiments. (78), e50111 (2013).
- The Tabula Muris Consortium. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris. Nature. 562 (7727), 367-372 (2018).
- Gray, C. J., Boukouvalas, J., Szawelski, R. J., Wharton, C. W. Benzyloxycarbonylphenylalanylcitrulline p-nitroanilide as a substrate for papain and other plant cysteine proteinases. Biochemical Journal. 219 (1), 325-328 (1984).
- Feodorova, Y., Koch, M., Bultman, S., Michalakis, S., Solovei, I. Quick and reliable method for retina dissociation and separation of rod photoreceptor perikarya from adult mice. MethodsX. 2, 39-46 (2015).
- Aitken, K. J., Bagli, D. J. The bladder extracellular matrix. Part I: architecture, development and disease. Nature Reviews Urology. 6 (11), 596-611 (2009).
- Aitken, K. J., Bagli, D. J. The bladder extracellular matrix. Part II: regenerative applications. Nature Reviews Urology. 6 (11), 612-621 (2009).
- The ENCODE Project Consortium. An integrated encyclopedia of DNA elements in the human genome. Nature. 489 (7414), 57-74 (2012).
- Yue, F., et al. A comparative encyclopedia of DNA elements in the mouse genome. Nature. 515 (7527), 355-364 (2014).
- Wu, Y. E., Pan, L., Zuo, Y., Li, X., Hong, W. Detecting Activated Cell Populations Using Single-Cell RNA-Seq. Neuron. 96 (2), 313-329 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved