Method Article
Un enfoque de disociación de una sola célula para el análisis molecular de la vejiga urinaria en el ratón después de la lesión de la médula espinal
* Estos autores han contribuido por igual
En este artículo
Resumen
El objetivo de este protocolo es aplicar un protocolo de disociación de tejido optimizado a un modelo de ratón de lesión de la médula espinal y validar el enfoque para el análisis de células individuales por citometría de flujo.
Resumen
Describimos la implementación de lesiones de la médula espinal en ratones para provocar disynergia de detrusor-esfínter, una obstrucción funcional de la salida de la vejiga y una posterior remodelación de la pared de la vejiga. Para facilitar la evaluación de la composición celular de la pared de la vejiga en ratones lesionados y de control no lesionados, desarrollamos un protocolo de disociación optimizado que apoya la alta viabilidad celular y permite la detección de subpoblación discreta por citometría de flujo.
La lesión de la médula espinal se crea mediante la transección completa de la médula espinal torácica. En el momento de la cosecha de tejidos, el animal se perfunde con solución salina tamponada por fosfato bajo anestesia profunda y las vejigas se cosechan en el tampón de Tyrode. Los tejidos se pican antes de la incubación en un búfer de digestión que se ha optimizado en función del contenido de colágeno de la vejiga del ratón, según lo determinado por el interrogatorio de bases de datos de expresión génica disponibles públicamente. Después de la generación de una sola suspensión celular, el material es analizado por la citometría de flujo para la evaluación de la viabilidad celular, el número de célula y las subpoblaciones específicas. Demostramos que el método produce poblaciones celulares con mayor viabilidad del 90%, y una sólida representación de células de origen mesenquimal y epitelial. Este método permitirá un análisis preciso aguas abajo de los tipos de células discretas en la vejiga del ratón y potencialmente otros órganos.
Introducción
Perturbaciones de la función normal de la vejiga urinaria pueden conducir a una disminución de la calidad de vida para muchas personas. Con el fin de obtener una mejor comprensión de cómo la lesión o enfermedad descarrila la función normal de la vejiga, es importante sondear el estado biológico normal de las células dentro de la vejiga y cómo cambian bajo perturbación experimental. Hasta la fecha, sin embargo, las poblaciones celulares específicas que residen dentro de la vejiga urinaria, y cómo cambian con lesiones, se han caracterizado incompletamente.
Los métodos de generación de perfiles de células únicas, como la citometría de flujo o la secuenciación de ARN de una sola célula (scRNA-seq), tienen el potencial de arrojar luz sobre tipos de células específicos dentro de la vejiga. Sin embargo, para que estos enfoques sean tejidos informativos deben digerirse de una manera que no afecte la viabilidad, la expresión génica y los porcentajes representativos de población celular del tejido cosechado. Los protocolos que emplean la desagregación enzimática pueden afectar la expresión de marcadores superficiales a través de la actividad de proteasa indiscriminada1,afectando así a la identificación celular por citometría de flujo, mientras que el propio proceso de disociación puede conducir a la inducción de genes tempranos inmediatos, como describieron recientemente Van den Brink y sus colegas2. Los autores mostraron que aunque la subpoblación afectada por la disociación era pequeña, podría desencadenar una fuerte señal contaminante en estudios de expresión a granel debido a los altos niveles de expresión de los genes tempranos inmediatos. Además, la duración del protocolo de disociación afectado detectó niveles de expresión masiva de genes que se demostró que son únicos para algunas subpoblaciones. Por lo tanto, los conjuntos de datos unicelulares generados sin tener en cuenta el impacto del protocolo de disociación pueden producir cambios en la expresión génica derivados del método de disociación, en lugar de la biología subyacente. Estas observaciones sugieren que los datos de transcriptómica de una sola célula publicados deben interpretarse con precaución, y que los resultados deben ser validados por métodos independientes.
Aunque, los métodos de disociación duros y largos pueden alterar la expresión génica en las células2; el aislamiento efectivo de las células es esencial para obtener una representación precisa de los tipos de células presentes. Dado que la vejiga es un órgano complejo que comprende múltiples tipos de células, algunas poblaciones como las células uroteliales o estromales pueden estar relativamente infrarrepresentadas, mientras que otros tipos celulares como los fibroblastos existen dentro de la matriz extracelular y pueden ser difíciles de aislar. La disociación se vuelve aún más difícil si la vejiga ha sido sometida a una remodelación significativa y fibrosis como la observada en la lesión de la médula espinal3,4 u obstrucción de salida de la vejiga5,6.
Aquí, describimos un método de disociación de tejido optimizado para el análisis de células individuales aguas abajo en la vejiga del ratón lesionada de la médula espinal. Usando citometría de flujo, comparamos cuatro protocolos de digestión enzimática por su capacidad para producir una sola suspensión celular, apoyar la viabilidad celular y mantener la proporción correcta de poblaciones celulares. Sobre la base de este análisis, llegamos a la conclusión de que minimizar la muerte celular, agregados celulares, ácidos nucleicos no celulares e inhibidores potenciales del análisis posterior son críticos para lograr datos de alta calidad.
Protocolo
Los procedimientos se realizaron de acuerdo con las recomendaciones de la Guía para el Cuidado y Uso de Animales de Laboratorio de los Institutos Nacionales de Salud. Todos los experimentos fueron aprobados por el Comité de Cuidado y Uso animal del Boston Children's Hospital.
NOTA: Los ratones estaban alojados en una instalación animal acreditada por aaalac con acceso ad libitum a alimentos y agua. Ratones hembra a 8\u201212 semanas de edad se utilizaron para estos experimentos. Dada la naturaleza de la lesión, se proporcionó enriquecimiento nutricional adicional a los ratones para asegurar su bienestar.
1. Transección de la médula espinal baja torácica en ratones
- Preparación antes de la transección de la médula espinal
NOTA: Los instrumentos quirúrgicos necesarios para este procedimiento son tijeras de resorte microsecting, fórceps de micro disección, controlador de aguja micro sutura, hemostats y 7-0 poliglactina 910 suturas. Otros suministros quirúrgicos requeridos son cortinas quirúrgicas, láminas estériles para el campo quirúrgico, esponjas de gasa, aplicadores de punta de algodón y jeringas de 1 ml con agujas de 25 G.- Autoclave los instrumentos quirúrgicos y suministros antes de la cirugía.
- Limpie el área quirúrgica y las almohadillas de calefacción con toallitas de alcohol. Una almohadilla de calentamiento se utilizará durante la cirugía y la otra durante el período postoperatorio inmediato para mantener la temperatura corporal del animal hasta recuperar la actividad completa.
- Utilice loupes de aumento (2,5x o más) para realizar el procedimiento quirúrgico.
- Encienda las almohadillas de calefacción, la fuente de luz y el esterilizador de cuentas de vidrio que se utilizará durante el procedimiento.
- Abra las cortinas quirúrgicas y los instrumentos. Utilice guantes estériles para cubrir el campo quirúrgico y colocar los instrumentos en el campo quirúrgico.
- Preparación de los animales
- Lleve a los ratones a la sala de procedimientos y también traiga una jaula limpia para los ratones lesionados de la médula espinal.
- Administre la anestesia colocando el ratón en la cámara de inducción con flujo de isoflurano establecido en 3,0%, flujo de oxígeno a 1 L/min y succión a 20 mmHg hasta que no haya respuesta de pellizcar la pata.
- Sopese inmediatamente al animal y luego coloque al animal en la posición propensa en la almohadilla de calentamiento.
- Coloque el cono anestésico cómodamente sobre la nariz del ratón, cambie el flujo de gas de la cámara de inducción al cono nasal y establezca el flujo de isoflurano en un 2% y el flujo de oxígeno a 1 L/min.
- Confirme que el animal está adecuadamente anestesiado con la ausencia de respuesta a la pellizco de la pata. Tape las extremidades de los animales en la almohadilla de calefacción. Coloque un trozo enrollado de esponja de gasa debajo del pecho inferior para elevar y flexionar las vértebras torácicas inferiores.
- Aplique lubricante oftálmico en ambos ojos. Administrar analgésicos (Meloxicam, 10 mg/kg, por vía subcutánea) y antibióticos (Enrofloxacino, 5 mg/kg, subcutáneamente).
NOTA: Los usuarios finales deben usar los analgésicos y antibióticos recomendados por su comité local de cuidado y uso de animales. - Palpate el proceso espinoso más prominente en la columna torácica que normalmente corresponde con el proceso espinoso T137. Afeita un área del rectángulo longitudinal en la parte posterior del ratón desde el cuello inferior hasta justo debajo del proceso espinoso más prominente (T13) y durante 1 cm a cada lado de la línea media.
- Procedimiento quirúrgico
- Prepara el área afeitada con solución de yodo povidone al 10% y 70% etanol tres veces alternativamente de una manera circular a partir del sitio de incisión trabajando hacia afuera y luego cubre al animal con esponja estéril de 4 x 4 gasas con una ventana en el centro que cubre el campo quirúrgico.
- Hacer incisión de 1,5 cm en la línea media de la espalda usando tijeras finas que termina en el proceso espinoso más prominente (T13). La incisión debe incluir la piel y la fascia superficial. El uso de tijeras separa la piel y la fascia superficial a ambos lados para exponer los procesos espinosos y los músculos paraspinosos circundantes.
- El uso de disección aguda y contundente separa los músculos de los procesos espinosos y la lámina de las vértebras T9, T10 y T11.
- Divida bruscamente los ligamentos interespiosos entre T9 y T10 y entre T10 y T11 usando tijeras finas y luego excise el proceso espinoso de T10 y realice cuidadosamente laminectomía T10 bilateralmente para exponer la médula espinal. Asegúrese de que las láminas estén completamente excizadas.
- Transecte la médula espinal con tijeras finas. Por lo general, el sangrado mínimo ocurre en este punto debido a la transección de los vasos de la médula espinal. Comprima el área sangrante con un aplicador con punta de algodón estéril para lograr hemostasia. Después de confirmar la hemostasia completa, cierre la piel con suturas continuas de poliglactina 910 7-0.
- Administrar 1 ml de solución salina por vía subcutánea para prevenir la deshidratación postoperatoria.
- Atención postoperatoria
- Coloque al animal en una almohadilla de calefacción hasta que se haya producido la recuperación completa, luego transfiéralo a una jaula solo para ratones lesionados de la médula espinal.
- Los cuidados postoperatorios incluyen observar y pesar a los animales diariamente, y el monitoreo del sitio de incisión en busca de signos de infección durante un tiempo de hasta 7 días. Administrar solución salina de 1 ml, analgésico (meloxicam 10 mg/kg) y antibióticos (enrofloxacino 5 mg/kg) todos subcutáneamente diarios durante 3 días.
NOTA: Los usuarios finales deben usar los analgésicos y antibióticos recomendados por su comité local de cuidado y uso de animales. - Realizar la expresión manual de la vejiga (maniobra de Credé) cada 12 h hasta que el animal sea capaz de orinar por sí solo (generalmente en 10 a 14 días). Sostenga al animal con una mano y masajee la parte inferior del abdomen con la otra mano, luego sienta y comprima suavemente la vejiga urinaria distendida con el dedo índice y el pulgar. La compresión transitoria suave debe alternarse con la relajación. Después de la expresión manual, lave la parte inferior del abdomen con agua del grifo y séquela suavemente con la toalla de papel sin frotar en exceso.
NOTA: Un pequeño tamaño de la vejiga antes del comienzo de la expresión y la humectación del abdomen inferior con orina son indicios de que el animal ha ganado la capacidad de vacío por sí solo. - Para minimizar la pérdida de peso, proporcionar enriquecimiento nutricional a ratones en forma de gel nutritivo y otras golosinas nutritivas (refrescos de tocino, crujientes de frutas y mordeduras vegetales) colocados en el suelo de la jaula para facilitar el acceso NOTA: En este estudio, los ratones fueron perfundidos y las vejigas adquiridas a las 8 semanas siguientes a SCI.
- Complicaciones postoperatorias
- Minimice el potencial de ruptura de la vejiga debido a la expresión manual excesiva de la vejiga al no expresar completamente la vejiga.
- Evitar la excoriación de la piel perineal de la exposición continua al regate de orina de esfínter incompetente a través del lavado de la región perineal con agua del grifo. Minimice la inflamación mediante la aplicación de ungüento triple de antibióticos.
NOTA: La obstrucción uretral debida al coágulo sanguíneo durante el período de hematuria transitoria o de coagulum de semen debido a la eyaculación retrógrada en ratones machos puede ocurrir después de una lesión de la médula espinal. La obstrucción uretral completa en ratones machos con frecuencia culmina en la ruptura de la vejiga y la muerte. En nuestra experiencia, la frecuencia de obstrucción uretral en ratones machos que condujo a la muerte fue del 10%.
2. Perfusión y adquisición de tejidos
NOTA: Para los análisis posteriores de ciertos tipos celulares como las células inmunes en los tejidos periféricos, es beneficioso eliminar la sangre por perfusión en el momento de la cosecha de tejidos, como se describe a continuación.
- Administrar anestesia como se menciona en el procedimiento quirúrgico (paso 2.2) y confirmar que el animal está adecuadamente anestesiado sin respuesta de pellizcar (el animal está parapléjico, por lo tanto las extremidades posteriores han disminuido la sensación y la respuesta de pellizcar trasero se vuelve irrelevante).
- Coloque al animal en posición supina y suba el abdomen y el pecho con un 70% de etanol para mojar el pelaje para evitar que entre en el sitio de operaciones.
- Realice una laparotomía de línea media desde la pelvis hasta el diafragma. Corte el diafragma lejos de las costillas.
NOTA: Siguiendo este paso, la velocidad es importante ya que el diferencial de presión torácica ya no existe y los pulmones no pueden inflarse, por lo que el animal comienza a asfixiarse. - Corte el tórax abierto a lo largo de las costillas en el lado izquierdo y derecho siguiendo el borde del cartílago óseo en una línea paralela al esternón, comenzando en el diafragma y procediendo hasta la primera costilla.
- Coloque la pared torácica anterior completa sobre la cabeza del animal y fijarla en esta posición usando abrazaderas de toallas. No corte la pared torácica anterior, ya que esto causará sangrado severo de las dos arterias torácicas internas.
- Corta el pericardio con tijeras finas.
- Conecte una aguja de 23 G al aparato de perfusión, luego insértela en el ventrículo izquierdo y lentamente en la aorta, teniendo cuidado de no perforarla.
NOTA: El aparato de perfusión comprende una bomba de perfusión y jeringa de 50 ml conectada a tubos intravenosos. - Inicie la perfusión y haga rápidamente un pequeño corte con la punta de tijeras finas en el atrio derecho para el drenaje. No se cuide de introducir burbujas de aire durante la perfusión de líquidos.
- Realice perfusión con solución salina (PBS) tamponada de fosfato a 15 ml/min. La perfusión se completa cuando el drenaje es claro y se alcanza el color aligerado del hígado(Figura 1).
NOTA: El tiempo promedio de perfusión fue de 3,5–4 min. La perfusión inadecuada se manifiesta como una progresión lenta del blanqueamiento de los tejidos y, por lo general, se debe a un posicionamiento incorrecto de la aguja en el ventrículo izquierdo. Ajustar la aguja y extender la duración de la perfusión de 1 a 2 minutos garantizará una perfusión adecuada de los tejidos. - Suspenda la perfusión y disecciona la vejiga libre de pedicles vasculares y uretra y colóquela en un tubo de microcentrífuga que contenga la solución del tiroides helado.
3. Digestión de la vejiga urinaria en control y ratones lesionados en la médula espinal
NOTA: Con el fin de formular una mezcla de digestión eficiente que se adapta a la vejiga urinaria del ratón buscamos ajustar la unidad de enzimas utilizadas para degradar los componentes predominantes de la matriz extracelular como colágenos y ácido hialurónico. Por lo tanto, utilizamos datos de secuenciación de ARN disponibles públicamente generados por el proyecto Mouse ENCODE (BioProject: PRJNA66167) para extraer lecturas por kilobase por millón (RPKM) y Tabula Muris8 para la evaluación de la expresión espacial dentro de la vejiga. Colágenos 1, 3 y 6 fueron los tres genes más expresados entre 42 colágenos diferentes(Figura 2A). La expresión de esos colágenos y sintasa de hialuronano 1 (Has1) se observó principalmente en las células musculares y fibroblastos de la pared de la vejiga (Figura 2B).
- Preparación de buffers y soluciones
- Prepare la solución de tiroides sódico según la Tabla 1 en una botella limpia de 500 ml. Añadir 300 ml de ddH2O. La solución es ácida después de la preparación. Ajuste el pH a 7,4 usando NaOH. Lleve el volumen a 500 ml usando H2O destilado doble, luego aliquot y guárdelo a -20 °C.
NOTA: Este búfer mantiene el equilibrio de pH y osmótico en el búfer de digestión y proporciona a las células agua e iones inorgánicos esenciales. Contiene magnesio, así como glucosa como fuente de energía. El potasio en la solución proporciona efectos protectores sobre la actividad electromecánica en la solución celular aislada. Las sales en polvo son higroscópicas y deben protegerse de la humedad. Todo el contenido de la mezcla debe utilizarse inmediatamente después de la preparación. No se recomienda preparar una solución de sal concentrada, ya que pueden formarse precipitados. La esterilización mediante filtración (filtro de 0,22 μm) se puede realizar si las células se van a cultivar después del análisis. - Prepare la solución de digestión enzimática en un tubo cónico de 15 ml añadiendo volúmenes y cantidades recomendados para cada componente(Tabla 2). Añadir solución de tiroides de sodio hasta 2,5 ml. Vórtice completamente para disolver.
NOTA: La papaína es una proteasa de sulfhidilo del látex de papaya carica. La papaína tiene una amplia especificidad y degradará la mayoría de los sustratos proteicos9. Papaína ha demostrado ser menos dañina y más eficaz que otras proteasas en los protocolos de disociación celular10. Proporcionamos detalles sobre los cuatro protocolos de disociación del Cuadro 2; observamos la sección 3 del protocolo para apoyar la mayor viabilidad (93%) de suspensiones celulares preparadas desde la vejiga del ratón.
- Prepare la solución de tiroides sódico según la Tabla 1 en una botella limpia de 500 ml. Añadir 300 ml de ddH2O. La solución es ácida después de la preparación. Ajuste el pH a 7,4 usando NaOH. Lleve el volumen a 500 ml usando H2O destilado doble, luego aliquot y guárdelo a -20 °C.
- Procedimiento de disociación y preparación de suspensión celular
- Recoge la vejiga de ratones después de la perfusión.
- Perforar la vejiga para liberar contenido, si existe.
- Añadir 100 μL de solución de Tyrode a un tubo de centrífuga y tara vacíos de 1,5 ml. Coloque la vejiga en el tubo y sopese de nuevo para determinar un peso preciso de la vejiga.
- Coloque la vejiga en una placa de Petri de 10 cm sobre hielo y agregue 100 μL de la solución de Tyrode para picar.
- Usando tijeras quirúrgicas, corta piezas lo más pequeñas posible mientras minimizas el tiempo de picar a no más de 2\u20123 min por vejiga. Si agrupa el tejido vesical de varios animales, pica las vejigas a la vez.
- Transfiera el tejido de la vejiga picado con una punta de pipeta de diámetro ancho a 2,5 ml de tampón de digestión para cada vejiga. Ajuste el volumen si hay varias vejigas agrupadas. Incubar el tejido en solución de digestión a 37 °C en una incubadora en una batidora de nutator durante 40 min.
- Al final del período de incubación, retire el tubo de digestión de la incubadora. Triturar (pipete arriba y abajo) solución de digestión utilizando una pipeta de 5 ml durante 1 min.
- Centrífuga durante 10 min a 350 x g a 4 °C. Retire el sobrenadante y vuelva a gastar el pellet en 1 ml de solución de desprendimiento celular. Colocar en una incubadora de 37 °C en la batidora de tuercas durante 10 minutos.
- Centrífuga durante 10 min a 350 x g a 4 °C. Retire el sobrenadante y vuelva a gastar el pellet en 1 ml de búfer de lisis RBC (1x). Incubar durante 1 min.
- Agregue 9 mL PBS para diluir el búfer RBC y detener la lisis RBC.
- Pase las células a través de un colador de células de 70 μm en un tubo cónico de 50 ml, utilizando el émbolo de una jeringa para raspar ligeramente el colador celular para garantizar el paso completo de la célula. Asegúrese de recoger el líquido que pasa a través del colador, pero podría quedar atrapado en la parte inferior del colador.
- Centrífuga durante 10 min a 350 x g a 4 °C. Retire el sobrenadante y vuelva a gastar el pellet en 200 μL de tampone de tinción celular (PBS con 2% FBS).
- Cuenta las células.
- Inmunoetiquetado de células específicas para la citometría de flujo
NOTA: Para detectar diferentes tipos de células en la vejiga, diseñamos un panel de citometría de flujo multicolor. Para llevar a cabo una compensación e idear una estrategia de gating adecuada, incluimos controles sin manchar y fluorescencia menos uno (FMO). Los controles FMO son importantes para la población positiva, particularmente cuando la fracción positiva es tenue. El procedimiento de tinción es el siguiente.-
Bloqueo de receptores FcḥRII/III en las células
NOTA: Recomendamos bloquear la unión inespecífica de anticuerpos monoclonales mediante la pre-incubación de células con anticuerpos monoclonales anti-Receptores Fc, o proteína Fc recombinante.- Lave las células por centrifugación a 350 x g durante 5 minutos a 4 °C y agregue el búfer de tinción celular.
- Deseche los receptores sobrenadantes y bloquee fcḥRII/III en las células para evitar la tinción de anticuerpos no específicos mediante la adición de anticuerpos CD16 y CD32 en el búfer de tinción celular a la dilución de 1:100.
- Incubar en hielo durante 10 minutos.
NOTA: No hay necesidad de lavar las células; las células se pueden manchar directamente después de esta etapa.
-
Tinción para fmos
NOTA: Un control de fluorescencia menos uno (FMO) es un tubo de todos los fluorocromos utilizados en el experimento que contiene todos los fluorocromos excepto uno.- Por ejemplo, si uno tiene 4 fluorocromos diferentes (A, B C y D + Annexin V y yoduro de propidio (PI)), prepare los tubos FMO de la siguiente manera. Tubo FMO 1: Anticuerpos conjugados con B, C, D fluorocromos + (Annexin V y PI); Tubo FMO 2: Anticuerpos conjugados con A, C, D fluorocromos + (Annexin V y PI); FMO Tube 3: Anticuerpos conjugados con A, B, C fluorocromos + (Annexin V y PI); Tubo FMO 4: Anticuerpos conjugados con A, B, C, D fluorocromos + (Annexin V); Tubo FMO 5: Anticuerpos conjugados con A, B, C, D fluorocromos + (PI).
- Considere la naturaleza del fluorocromo conjugado para el anticuerpo Annexin V.
-
Manchar las células bloqueadas con los anticuerpos deseados
- Incubar células bloqueadas con mezclas maestras apropiadas de anticuerpos conjugados con fluoróforo contra las proteínas deseadas durante 20 minutos en hielo protegido de la luz. Recuerde incluir FMOs.
- Lave las células con 1 ml de amortiguador de tinción celular añadido a cada tubo y luego centrífuga de nuevo a 350 x g durante 5 minutos a 10 °C.
- Deseche el sobrenadante y vuelva a gastar el pellet celular en 200 μL de tampone de tinción celular. Conservar el hielo hasta que se puedan adquirir datos de fluorescencia mediante un cytómetro de flujo.
-
Aplique la mancha Anexa V/PI.
- Preparar una solución de trabajo de PI (100 μg/mL) en 1x búfer de unión a Annexin como se describe en el protocolo del fabricante para el kit de apoptosis de células muertas.
- Determine la densidad de la celda y anote el búfer y el volumen en el que se almacenan.
- Las muestras de centrifugadoras a 350 x g durante 5 min, desechan las células de sobrenadante y resuspend en 1x búfer de unión a Annexin a una densidad de ~1 x 106 celdas/ml en un volumen de 100 μL.
- Añada la solución de trabajo FITC-Annexin V (5 μL) y PI (1 μL) a cada muestra (100 μL), como se describe en el protocolo del fabricante, e incubar a temperatura ambiente durante 15 min.
- Añadir 400 μL de 1x tampón de unión a anexos a muestras, mezclar por inversión y mantener el hielo hasta la citometría de flujo.
-
Bloqueo de receptores FcḥRII/III en las células
- Calibración FACS
-
Control de citometría y pureza de flujo
- Inicie el análisis de la citometría de flujo midiendo las células no manchadas para delinear la morfología celular y los valles de los fluorocromos.
- Ajuste la dispersión lateral (SSC) y la dispersión hacia delante (FSC) modificando los voltajes de cada parámetro de fluorescencia. Mida la emisión de fluorescencia a 530 nm (Anexo V) y >575 nm (PI).
- Defina la población negativa en la primera década utilizando las cuadrículas de cada gráfica de puntos. Coloque cada control FMO en el citómetro y corrija la superposición espectral hasta que se alineen las medianas de población negativas y positivas.
- Mida 100.000 eventos. Mida las células manchadas con marcadores específicos y cree puertas para poblaciones celulares de interés.
-
Control de citometría y pureza de flujo
- Análisis de datos
- Recopile los datos del cytómetro de flujo. Abra el software para visualizar el espacio de trabajo para su análisis.
- Creación de un espacio de trabajo
- Importe archivos FCS arrastrándolos al espacio de trabajo. Los archivos estarán visibles en la sección de ejemplo y grupo del espacio de trabajo. Haga doble clic en el nombre del ejemplo para abrir el archivo.
- Utilice el área de dispersión lateral (SSC-A) para el eje y el área de dispersión hacia delante (FSC-A) para el eje x (Figura 3A). Haga clic en el icono de gating poligonal.
- Cree una puerta alrededor de la población de celdas de interés en el gráfico de puntos haciendo clic para crear un nodo de puerta y, a continuación, continúe haciendo clic alrededor de la población de celdas hasta que se complete; haga doble clic para cerrar la puerta.
- Asigne un nombre a la puerta según la población capturada (por ejemplo, "Todas las celdas") y haga clic en Aceptar.
NOTA: Al hacer doble clic dentro de la puerta "Todas las celdas", se abrirá una nueva ventana gráfica que muestra solo los eventos contenidos en "Todas las celdas". - Ajuste el eje y de la nueva gráfica de puntos a SSC-H (altura de dispersión lateral) haciendo clic en la flecha negra y seleccione cambiar el eje y.
NOTA: Esta puerta para celdas individuales (singletes) y excluye dobles o agregados más grandes (Figura 3B). Dado que las celdas individuales tienen anchura y longitud proporcionales, deben representarse como una población en la diagonal. Las celdas que caen fuera de esta puerta diagonal son dobles o agregados más grandes. - Haga doble clic en la puerta para analizar células necróticas (PI-positivas), apoptóticas tempranas (Anexo V positivo, PI negativo) y apoptóticas tardías (Anexo V positivo, PI negativo)(Figura 3C).
- Etiquete el eje x como Anexo V y el eje y como PI.
NOTA: En algunos casos, cuando la intensidad de la señal es baja, las poblaciones celulares pueden parecer tener valores negativos de fluorescencia, como resultado de la corrección de antecedentes. En este caso, se recomienda realizar una transformación bi-exponencial. Para ello, haga clic en la T situada junto al eje y y elija Personalizar eje. En la nueva ventana cambie la escala a bi-exponencial (Biex), agregue valores negativos a los ejes aumentando la base de anchura y haga clic en Aplicar. Esto mejorará la resolución de eventos con baja intensidad de señal. - Mostrar datos como un gráfico de recuento. Utilice la pestaña Opción justo debajo del eje X y seleccione trazado de contador en el menú.
- Dibuje una puerta Quat en el trazado para definir 4 poblaciones objetivo discretas.
- Haga clic en la parte superior de la ventana para abrir el editor de diseño, haciendo clic en el Editor de diseño y arrastre las poblaciones a cada área independiente.
- Coloque trazados en el editor de diseño arrastrando y soltando poblaciones desde el área de trabajo a la ventana del editor de diseño.
- Visualización mediante histogramas
- Elija histograma en la pestaña Opciones.
- Aplique una puerta para seleccionar células V positivas de Annexin; alternativamente, las poblaciones positivas y negativas se pueden definir mediante la herramienta bisector. La sección de ejemplo ahora debe mostrar las diferentes poblaciones que se han ido formando y su jerarquía.
- Para comparar muestras, arrastre todos los histogramas uno encima del otro; haga clic derecho en el histograma y desde histograma elija Desplazamiento escalonado.
- Añadir análisis estadísticos
- Abra la pestaña Estadística haciendo doble clic en la población de interés. Seleccione la función que desea aplicar y el parámetro implicado.
- Repita con otras poblaciones, arrastrando el icono Sigma al nombre de la población.
- Aplique el análisis a todas las muestras seleccionando la estrategia de gating de la muestra de interés y arrastrándola al grupo definido por el marcador de interés, por ejemplo, Anexo V.
- Crear puertas en las muestras de control FMO y definir poblaciones negativas y positivas; esta estrategia de gating se aplicará a todo el experimento (Figura 3D\u2012F).
NOTA: Compruebe cada muestra individualmente para asegurarse de que el gating es correcto y modificar cuando sea necesario. - Si las células se han manchado con anticuerpos marcadores (por ejemplo, CD45) utilice la FMO y la puerta correspondientes en consecuencia.
- Para exportar el diseño, haga clic en Archivo | Exportar | de imagen Seleccione el formato de archivo (por ejemplo, jpg, pdf).
- Haga clic en Crear tabla para abrir una ventana con la versión final de la tabla.
- Exporte la tabla seleccionando Archivo | Guardar como | Nombre de archivo.
Resultados
Procedimiento quirúrgico
El éxito de la transección torácica de la médula espinal está determinado por la evaluación de una serie de parámetros, el más obvio de los cuales es la parálisis del hindlimb. El animal se mueve sólo usando sus extremidades delanteras, arrastrando sus extremidades posteriores. De lo contrario, los niveles de actividad, incluyendo alimentación, aseo y estado de alerta suelen ser normales. Además, los animales pierden el control volicional de la vejiga, lo que resulta en la necesidad de expresión manual de la vejiga por parte del investigador cada 12 h hasta que el anulamiento reflejo vuelve a los 10 a 14 días después de la lesión. Después de la eutanasia, los signos adicionales del éxito de la lesión se relacionan principalmente con el aumento en la relación vejiga-cuerpo de peso, indicativo de la remodelación de tejidos. El análisis histológico revela hiperplasia dentro de los compartimentos musculares uroteliales y lisos3.
Preparación de la suspensión de una sola célula
Utilizando datos de expresión disponibles públicamente, se determinó el enriquecimiento del tejido vesical para proteínas de matriz extracelular(Figura 2)y se utilizó para informar la formulación de la mezcla de digestión. Dado que los colágenos son componentes clave de la pared de la vejiga11,12,primero buscamos determinar los colágenos más abundantes en la vejiga del ratón utilizando conjuntos de datos de perfilado de ARN generados por el proyecto Mouse ENCODE13. Nuestro análisis mostró que el colágeno 1A1, el colágeno 3A1, el colágeno 1A2 y el colágeno 6A1 son los tipos de colágeno más abundantes dentro de la vejiga del ratón (Figura 2A). También usamos el Tabula Muris (un compendio de datos de transcriptoma de una sola célula del ratón (Mus musculus))8 para determinar el nivel de expresión de ARNM de colágenos 1, 3, 6 e hialuronano. Los datos permiten una comparación directa y controlada de la expresión génica en los tipos celulares compartidos entre los tejidos. Este análisis reveló que la expresión de estos componentes de matriz extracelular es más frecuente en los tipos de células mesenquimales en lugar de urotelio (Figura 2B).
Efecto de la disociación sobre la viabilidad de las células aisladas de la vejiga
El análisis de citometría de flujo demostró que la digestión enzimática utilizando los 4 protocolos diferentes produjo viabilidad del 83%, 86%, 93% o 90%, respectivamente. Por lo tanto, la sección 3 del protocolo se consideró más valiosa para la preservación de la viabilidad celular. También observamos que aproximadamente el 4% de las células eran necróticas (PI+/Annexin V-) (Figura 4A). Estas observaciones enfatizan la eficiencia del protocolo de digestión y el consiguiente beneficio en la viabilidad celular.
Efecto de la lesión de la médula espinal en diferentes poblaciones de células de la vejiga
Observamos un aumento significativo en el número total de células en vejigas de ratones SCI en comparación con los controles. El patrón de las gráficas de puntos obtenidos de las vejigas SCI también fue ligeramente diferente consistente con la remodelación continua del órgano debido a una lesión de la médula espinal(Figura 4B: primera columna). En comparación con los controles, las vejigas de los animales SCI mostraron un aumento significativo en las células CD45 positivas.
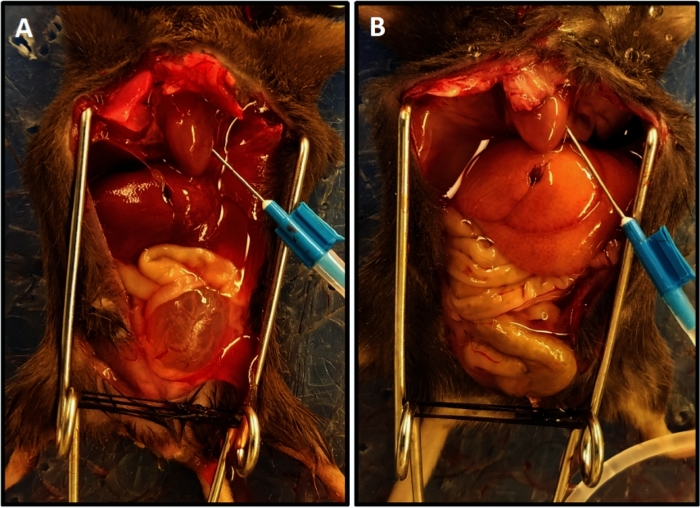
Figura 1: Finalización representativa de perfusión con color aligerado del hígado. (A) Muestra el color del hígado al principio de la perfusión. (B) Muestra el color del hígado aligerado al final de la perfusión. El ratón en (A) tuvo transección de la médula espinal dos semanas antes de la perfusión, lo que resultó en hipertrofia vesical y su protuberancia fuera de la pelvis a diferencia del ratón en (B) que no tenía lesión de la médula espinal; en este caso la vejiga es pequeña y oculta en la pelvis. Haga clic aquí para ver una versión más grande de esta figura.
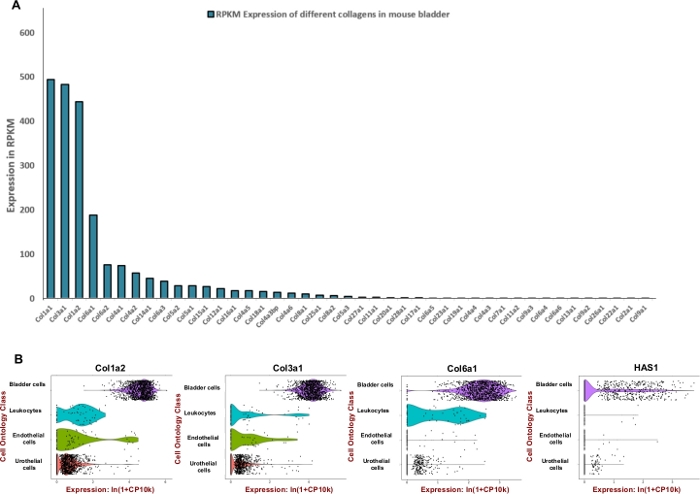
Figura 2: Expresión transcriptómica de componentes de matriz extracelular (ECM) en la vejiga del ratón. (A) Gráfico de barras de 43 tipos diferentes de colágeno. La expresión es indicada por Lecturas por kilobase de transcripción, por millón de lecturas mapeadas (RPKM) (los datos se recopilan de BioProject: PRJNA66167)14. (B) Tramas de violín de expresión génica en los tipos celulares obtenidos a partir de gotas microfluídicas basadas en 3'-end contando en un grupo de muestras de vejiga urinaria disociadas masculinas y femeninas (machos y hembras). Los recuentos se normalizaron de registro para cada celda utilizando el logaritmo natural de más de 1 cuenta por millón de ln(CPM+1)8. Se agregó un pseudoconteo de 1 CPM antes de tomar logaritmos. Haga clic aquí para ver una versión más grande de esta figura.
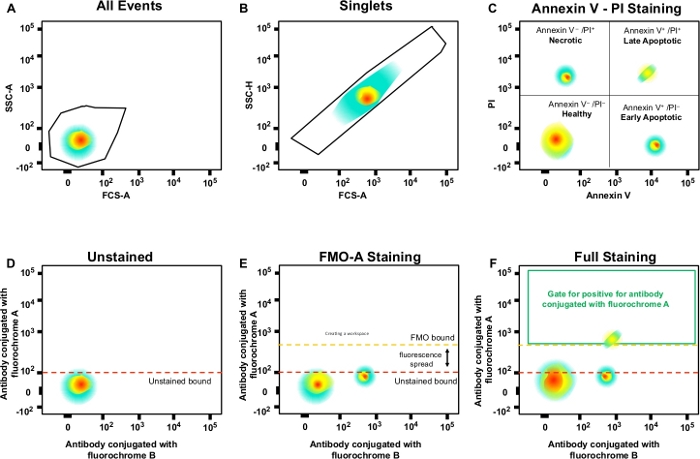
Figura 3: Estrategia de Gating y controles FMO para determinar la propagación de la fluorescencia. (A) Selección de la población celular. (B) Estrategia de Gating para singletes. (C) Gating para células apoptóticas tempranas y tardías utilizando anticuerpo PI y Annexin V. (D\u2012F) Una gráfica esquemática de citometría de flujo multicolor (por ejemplo, anticuerpos conjugados con A, B, C, D fluorochromes + (Annexin V y PI). Esto muestra la fluorescencia extendida en el anticuerpo con el canal fluorocromo A mostrado por el control FMO en comparación con un control sin manchar. La línea punteada naranja representa el límite de gating FMO en comparación con el contorno sin manchar en rojo. Haga clic aquí para ver una versión más grande de esta figura.
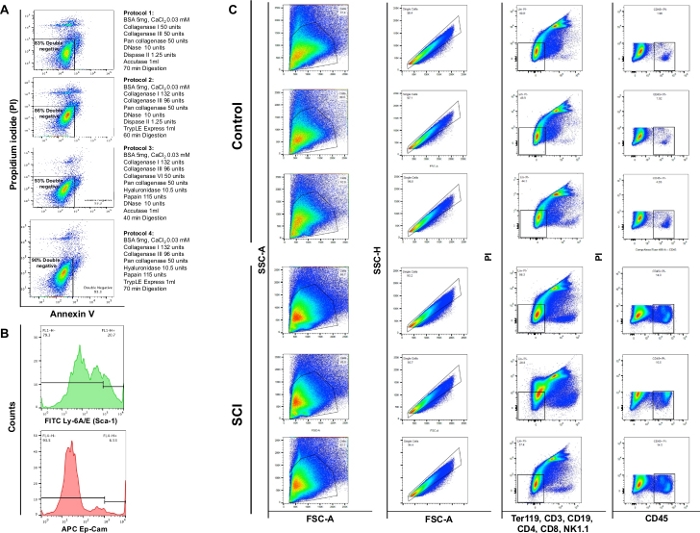
Figura 4: Ciclometría de flujo de diferentes tipos celulares en la vejiga. (A) Anexo gráfico de flujo de tinción doble V/PI. Las diferentes combinaciones de enzimas y productos químicos utilizados para cada protocolo se representan frente a la parcela de viabilidad correspondiente. Estos datos demuestran que la mayor viabilidad se obtuvo con la sección 3 del protocolo. B) Histogramas representativos que ilustran la intensidad de Ly-6A/E (Sca-1) y CD326 (Ep-CAM) detectados en canales individuales. (C) Efecto de SCI en la población celular de la vejiga del ratón. El panel superior muestra los resultados de la tinción en tres vejigas disociadas obtenidas de ratones no quirúrgicos de control y el panel inferior muestra los resultados de la tinción en tres animales con SCI. La primera columna es la población celular total. La segunda columna muestra la selección de gating singlet. La tercera columna muestra la subpoblación de células vivas que son negativas para las células B, las células T y las células NK. La cuarta columna muestra la tinción de las células vivas positivas para CD45. Haga clic aquí para ver una versión más grande de esta figura.
| Componente | Importe (por 500 mL) | Molaridad |
| Nacl | 4.091 g | 140 mM |
| Kcl | 0.186 g | 5 mM |
| MgCl2 | 0.0476 g | 1 mM |
| D-glucosa | 0,9 g | 10 mM |
| HEPES | 1.19 g | 10 mM |
Tabla 1: Componentes para la preparación de la solución de Tyrode. Los componentes indicados son para la preparación de la solución de 500 mL Tyrode.
| Componente | Cantidad | Protocolo sección 1 | Protocolo sección 2 | Protocolo sección 3 | Protocolo sección 4 |
| Bsa | 5 mg | Sí | Sí | Sí | Sí |
| CaCl2 | 0,03 mM | Sí | Sí | Sí | Sí |
| Colágeno tipo I | 132.5 unidades | Sí | Sí | Sí | Sí |
| Colágeno Tipo III | 96.4 unidades | Sí | Sí | Sí | Sí |
| Colágeno Tipo VI | 50 unidades | - | - | Sí | - |
| Adnsa | 10 unidades | Sí | Sí | Sí | - |
| Papaína | 115 unidades | - | - | Sí | Sí |
| Pan Colágenonase | 50 unidades | - | - | Sí | Sí |
| Hialuronidasa | 10.5 unidades | - | - | Sí | Sí |
| Disipar II | 1.25 unidades | Sí | Sí | - | - |
| Solución de disociación celular | 1 ml | Sí | - | Sí | - |
| Enzima recombinante | 1 ml | - | Sí | - | Sí |
Tabla 2: Componentes para la preparación del búfer de digestión. Los componentes indicados son para la preparación de una mezcla de digestión de 2,5 ml (1 U cataliza la hidrólisis de 1 μmol un sustrato por minuto a 37 °C. Consulte la hoja de datos del producto para la definición de unidad de cada enzima).
Discusión
El modelo de lesión de la médula espinal del ratón descrito aquí proporciona un método reproducible para crear una obstrucción funcional de la salida de la vejiga debido a la pérdida de coordinación entre la contracción de la vejiga y la relajación del esfínter uretral externo. Esto a su vez evoca una profunda remodelación de la pared de la vejiga tan pronto como 2 semanas después de la lesión caracterizada por la expansión de los compartimentos musculares uroteliales y lisos. Los pasos críticos en la implementación del modelo SCI en roedores incluyen (i) una atención rigurosa a la expresión manual de la vejiga durante el período de choque espinal que se produce durante 10\u201214 días después de la lesión; (ii) enriquecimiento nutricional para minimizar la pérdida de peso; y (iii) mitigación del potencial de escaldado de orina, particularmente para experimentos que se extienden más allá del retorno de la anulación de reflejos. Las limitaciones del modelo incluyen el potencial de oclusión uretral en ratones a partir de coágulos sanguíneos durante el período de hematuria transitoria, y adicionalmente en ratones machos de coagulum de semen después de la eyaculación retrógrada después de la cirugía.
El enfoque de disociación de tejidos descrito aquí ilustra la importancia de considerar los cambios estructurales en los tejidos que surgen del insulto experimental, en este caso la remodelación significativa de tejidos después de SCI que puede influir en los análisis posteriores. Con el aumento de los análisis unicelulares es fundamental garantizar que las diferencias observadas en la expresión génica no sean simplemente el resultado de perturbaciones inducidas por la disociación, sino que sean verdaderamente representativas de los cambios biológicos subyacentes relevantes para el modelo de enfermedad. El uso de datos de expresión disponibles públicamente nos permitió modificar la formulación de búferes de digestión para garantizar una digestión eficaz de la matriz extracelular al tiempo que maximizamos la viabilidad. Las modificaciones adicionales que podrían considerarse en futuras aplicaciones incluyen la adición de actinomicina D, para detener la transcripción de genes tempranos inmediatos que son sensibles al protocolo de disociación15.
La técnica de pipeteo es crucial a la hora de disociar tejido o transferir células que ya están en suspensión. Para reducir el daño físico a las células de las fuerzas de cizallamiento, es importante pipetear suavemente y lentamente durante la resuspensión celular. Por lo general, se recomienda utilizar puntas de pipeta de diámetro ancho. Si se utilizan puntas estándar, es particularmente importante pipetear las suspensiones celulares suavemente para evitar fuerzas de cizallaje que de otro modo dañarían las células. El uso de coladores celulares es inevitable en este protocolo, sin embargo, la concentración celular puede disminuir en un 20% o más, acompañada de una pérdida de volumen de 100 μL o más. Recomendamos que se determine la concentración celular después del esfuerzo para garantizar un recuento preciso de células.
En la citometría de flujo, los controles FMO proporcionan una medida de fondo debido al sangrado de la señal de los picos de emisión superpuestos. No son una medida de unión de anticuerpos inespecífico, o tinción de fondo que puede estar presente cuando un anticuerpo se incluye en ese canal. Para tener en cuenta el enlace de anticuerpos no específicos, hay que incluir controles de isotipo adecuados; para la tinción de fondo, uno necesita incluir controles negativos. En conjunto, estos controles garantizan una medición precisa de las poblaciones celulares.
Divulgaciones
No se declararon conflictos de intereses.
Agradecimientos
Este trabajo fue apoyado por subvenciones de los Institutos Nacionales de Salud (R01 DK077195 a R.M.A, R01 DK104641 a R.M.A y D.R.B). Reconocemos valiosas aportaciones del Dr. Stuart Orkin en la División de Hematología/Oncología, el Hospital infantil de Boston, el Departamento de Pediatría, la Escuela de Medicina de Harvard y el Dana-Farber Cancer Institute. También reconocemos el apoyo de Kyle Costa en la atención postoperatoria de ratones, Mary Taglienti y el Dr. Habiballah Shojaeisaadi (Laboratorio Dr. Yang Shi, Departamento de Pediatría, División de Medicina del Recién Nacido, Departamento de Pediatría, División de Medicina del Recién Nacido, Hospital infantil de Boston, Escuela de Medicina de Harvard) para asistencia técnica y discusiones útiles.
Materiales
| Name | Company | Catalog Number | Comments |
| 2.5 X Magnifying Loupes | |||
| 7-0 Vicryl suture, 6.5mm needle 3/8 circle | ETHICON | J546 | |
| 70 μm Cell Strainer | Thermofisher | 22363548 | |
| Accutase in BPBS, 0.5mM EDTA | Millipore | SCR005 | |
| Aerosol Filter Wide Orifice Pipettor Tips (1000 µL) | VWR | 89049-168 | |
| Aerosol Filter Wide Orifice Pipettor Tips (1000 µL) | VWR | 89049-168 | |
| APC anti-mouse CD326 (Ep-CAM), rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 118213 | |
| BB515 Rat Anti-Mouse CD45, rat monoclonal, IgG2b, κ, Clone 30-F11 | BD Biosciences | 564590 | |
| BONN Micro Dissecting Forceps, Straight, 1x2 teeth, 3.75" length, 0.3mm tip width, 0.12mm teeth | ROBOZ Surgical Instrument Company, Inc. | RS-5172 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Bovine Serum Albumin | Sigma | A9647-100G | |
| CaCl2 | Sigma | 2115-250ML | |
| CASTROVIEJO Micro Suturing Needle Holder, Straight with lock, 5.75" length | ROBOZ Surgical Instrument Company, Inc. | RS-6412 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Cell Counting Kit, 30 dual-chambered slides, 60 counts, with trypan blue | Biorad | 1450003 | |
| Cell Staining Buffer | BioLegend | 420201 | |
| Collagenase from Clostridium histolyticum | Sigma | C0130-1G | |
| Collagenase Type I | Worthington Biochemical Corporation | LS004196 | |
| Collagenase Type III | Worthington Biochemical Corporation | LS004182 | |
| Collagenase, Type 6 | Worthington Biochemical Corporation | LS005319 | |
| Dead Cell Apoptosis Kit with Annexin V Alexa Fluor 488 & Propidium Iodide (PI) | Thermofisher | V13241 | |
| Dispase II | Sigma | D4693-1G | |
| DNase | Sigma | DN25-1G | |
| Enrofloxacin (Baytril) | Bayer Health Care LLC, | NADA # 140-913 Approved by FDA. Lot No.: AH01CGP | 2.27% Injectable Solution |
| Falcon 15 ml conical centrifuge tubes | Fisher Scientific | 352096 | |
| Falcon 50 ml conical centrifuge tubes | Fisher Scientific | 352070 | |
| FITC anti-mouse Ly-6A/E (Sca-1) Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 122505 | |
| Hyaluronidase from sheep testes, Type II | Sigma | H2126 | |
| MACS SmartStrainers (100 µm) | Miltenyi Biotec, Inc. | 130-110-917 | |
| McPHERSON-VANNAS, Micro Dissecting Spring Scissors, Straight, 4" length, 0.15mm tip width | ROBOZ Surgical Instrument Company, Inc. | RS-5630 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Meloxicam | Patterson Veterinary | 07-891-7959 | |
| Papain | Worthington Biochemical Corporation | LS003119 | |
| PE/Cy5 anti-mouse CD19 Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 115509 | Dump Channel |
| PE/Cy5 anti-mouse CD3ε Antibody, Armenian hamster monoclonal, IgG, affinity purified | BioLegend | 100309 | Dump Channel |
| PE/Cy5 anti-mouse CD4 Antibody, rat monoclonal, IgG2b, κ, affinity purified | BioLegend | 100409 | Dump Channel |
| PE/Cy5 anti-mouse CD8a Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 100709 | Dump Channel |
| PE/Cy5 anti-mouse NK-1.1 Antibody, mouse monoclonal, IgG2a, κ, affinity purified | BioLegend | 108715 | Dump Channel |
| PE/Cy5 anti-mouse TER-119/Erythroid Cells Antibody, IgG2b, κ, affinity purified | BioLegend | 116209 | Dump Channel |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block), rat monoclonal, IgG2b, κ, Clone 2.4G2 | BD Biosciences | 553141 | |
| RBC Lysis Buffer (10X) | BioLegend | 420301 | |
| Red Blood Cell Lysis Buffer 1x | Biolegend | 420201 | |
| Screw-Cap microcentrifuge tubes, 1.5 ml | VWR | 89004-290 | |
| TC20 Automated Cell Counter | Biorad | 1450102 | |
| Triple antibiotic ointment (neomycin/polymyxin B/ bacitracin) | Patterson Veterinary | 07-893-7216 | skin protectant |
| TrypLE Select Enzyme (10X), no phenol red | Thermofisher | A1217701 | |
| Vetropolycin eye ointment | Dechra Veterinary Products | NADA # 065-016. Approved by FDA. | protect eyes during anesthesia |
Referencias
- Grange, C., et al. Phenotypic characterization and functional analysis of human tumor immune infiltration after mechanical and enzymatic disaggregation. Journal of Immunological Methods. 372 (1-2), 119-126 (2011).
- van den Brink, S. C., et al. Single-cell sequencing reveals dissociation-induced gene expression in tissue subpopulations. Nature Methods. 14 (10), 935-936 (2017).
- Seth, A., et al. The impact of discrete modes of spinal cord injury on bladder muscle contractility. BMC Urology. 13, 24 (2013).
- Doyle, C., et al. Inosine attenuates spontaneous activity in the rat neurogenic bladder through an A2B pathway. Scientific Reports. 7, 44416 (2017).
- Gheinani, A. H., et al. Characterization of miRNA-regulated networks, hubs of signaling, and biomarkers in obstruction-induced bladder dysfunction. JCI Insight. 2 (2), 89560 (2017).
- Gheinani, A. H., et al. Concordant miRNA and mRNA expression profiles in humans and mice with bladder outlet obstruction. American Journal of Clinical and Experimental Urology. 6 (6), 219-233 (2018).
- Krishna, V., et al. A contusion model of severe spinal cord injury in rats. Journal of Visualized Experiments. (78), e50111 (2013).
- The Tabula Muris Consortium. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris. Nature. 562 (7727), 367-372 (2018).
- Gray, C. J., Boukouvalas, J., Szawelski, R. J., Wharton, C. W. Benzyloxycarbonylphenylalanylcitrulline p-nitroanilide as a substrate for papain and other plant cysteine proteinases. Biochemical Journal. 219 (1), 325-328 (1984).
- Feodorova, Y., Koch, M., Bultman, S., Michalakis, S., Solovei, I. Quick and reliable method for retina dissociation and separation of rod photoreceptor perikarya from adult mice. MethodsX. 2, 39-46 (2015).
- Aitken, K. J., Bagli, D. J. The bladder extracellular matrix. Part I: architecture, development and disease. Nature Reviews Urology. 6 (11), 596-611 (2009).
- Aitken, K. J., Bagli, D. J. The bladder extracellular matrix. Part II: regenerative applications. Nature Reviews Urology. 6 (11), 612-621 (2009).
- The ENCODE Project Consortium. An integrated encyclopedia of DNA elements in the human genome. Nature. 489 (7414), 57-74 (2012).
- Yue, F., et al. A comparative encyclopedia of DNA elements in the mouse genome. Nature. 515 (7527), 355-364 (2014).
- Wu, Y. E., Pan, L., Zuo, Y., Li, X., Hong, W. Detecting Activated Cell Populations Using Single-Cell RNA-Seq. Neuron. 96 (2), 313-329 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados