Method Article
Omurilik Yaralanmasını Takiben Faredeki İdrar Kesesinin Moleküler Analizi için Tek Hücreli Ayrışma Yaklaşımı
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokolün amacı, omurilik hasarının fare modeline optimize edilmiş bir doku ayrıştırma protokolü uygulamak ve akış sitometrisi ile tek hücre analizi yaklaşımını doğrulamaktır.
Özet
Detrusor-sfinkter disserjisi, fonksiyonel bir mesane çıkış tıkanıklığı ve daha sonra mesane duvarı tadilatı yapmak için farelerde omurilik hasarının uygulanmasını tarif ediyoruz. Yaralanmamış kontrol ve omurilik yaralı farelerde mesane duvarının hücresel bileşiminin değerlendirilmesini kolaylaştırmak için, yüksek hücre canlılığını destekleyen ve akış sitometrisi ile ayrık alt nüfusların tespitini sağlayan optimize edilmiş bir ayrışma protokolü geliştirdik.
Omurilik yaralanması torasik omuriliğin tamamen transeksiyonu ile oluşturulur. Doku hasadı sırasında, hayvan derin anestezi altında fosfat tamponlu salin ile perfüzyona edilir ve mesaneler Tyrode'un tamponuna toplanır. Dokular, halka açık gen ekspresyon veritabanlarının sorgulanmasıyla belirlenen fare mesanesinin kollajen içeriğine göre optimize edilmiş sindirim tamponunda inkübasyondan önce kıyılır. Tek hücreli süspansiyonun üretilmesinden sonra, malzeme hücre canlılığının, hücre sayısının ve spesifik alt nüfusların değerlendirilmesi için akış sitometrisi ile analiz edilir. Yöntemin% 90'dan fazla canlılığa sahip hücre popülasyonları ve mezenkimal ve epitel kökenli hücrelerin sağlam bir şekilde temsilini sağladığını gösteriyoruz. Bu yöntem, fare mesanesinde ve potansiyel olarak diğer organlarda ayrı hücre tiplerinin doğru aşağı akış analizini sağlayacaktır.
Giriş
Normal idrar kesesi fonksiyonunun pertürbasyonları birçok birey için yaşam kalitesinin düşmesine neden olabilir. Yaralanmanın veya hastalığın normal mesane fonksiyonunu nasıl raydan çıkardığını daha iyi anlamak için, mesane içindeki hücrelerin normal biyolojik durumunu ve deneysel pertürbasyon altında nasıl değiştiklerini araştırmak önemlidir. Bununla birlikte, bugüne kadar, idrar kesesi içinde bulunan spesifik hücre popülasyonları ve yaralanma ile nasıl değiştikleri eksik karakterize edilmiştir.
Akış sitometrisi veya tek hücreli RNA dizilimi (scRNA-seq) gibi tek hücreli profil oluşturma yöntemleri mesane içindeki belirli hücre tiplerine ışık tutma potansiyeline sahiptir. Ancak bu yaklaşımların bilgilendirici doku olabilmesi için hasat edilen dokunun canlılığını, gen ekspresyonlarını ve temsili hücre popülasyon yüzdelerini etkilemeyecek şekilde sindirilmesi gerekmektedir. Enzimatik ayrışma kullanan protokoller, ayrımsız proteaz aktivitesi1aracılığıyla yüzey işaretleyici ekspresyonunu etkileyebilir, böylece akış sitometrisi ile hücre tanımlamasını etkileyebilir, ancak ayrışma sürecinin kendisi, van den Brink ve meslektaşları tarafından yakın zamanda açıklandığı gibi, hemen erken genlerin indüksiyona yol açabilir2. Yazarlar, ayrışma etkisindeki alt nüfus küçük olmasına rağmen, hemen erken genlerin yüksek ekspresyon seviyeleri nedeniyle toplu ifade çalışmalarında güçlü bir kontamine sinyali tetikleyebileceğini göstermiştir. Ek olarak, ayrışma protokolünün süresi, bazı alt nüfuslara özgü olduğu gösterilen genlerin algılanan toplu ekspresyon seviyelerini etkiledi. Bu nedenle, ayrışma protokolünün etkisi hesaba katmadan oluşturulan tek hücreli veri kümeleri, alttaki biyolojinin aksine, ayrışma yönteminden kaynaklanan gen ekspresyon değişiklikleri sağlayabilir. Bu gözlemler, yayınlanan tek hücreli transkriptomik verilerin dikkatle yorumlanıp sonuçların bağımsız yöntemlerle doğrulanmış olması gerektiğini göstermektedir.
Her ne kadar sert ve uzun ayrışma yöntemleri hücrelerde gen ekspresyonunu değiştirebilir2; hücrelerin etkili izolasyonu, mevcut hücre tiplerinin doğru temsilini elde etmek için gereklidir. Mesane birden fazla hücre tipinden oluşan karmaşık bir organ olduğundan, ürotelial veya stromal hücreler gibi bazı popülasyonlar nispeten az temsil edilebilirken, fibroblastlar gibi diğer hücre tipleri hücre dışı matris içinde bulunur ve izole edilmesi zor olabilir. Mesane, omurilik yaralanması 3 ,4 veya mesane çıkış tıkanıklığı5,6'dagözlenen gibi önemli bir tadilat ve fibrozis geçirmişse, ayrışma daha da zorlaşır.
Burada, omurilik yaralı fare mesanesinde aşağı akış tek hücre analizi için optimize edilmiş bir doku ayrıştırma yöntemini açıklıyoruz. Akış sitometrisini kullanarak, tek bir hücre süspansiyonu verme, hücre canlılığını destekleme ve hücre popülasyonlarının doğru oranını koruma yetenekleri için dört enzimatik sindirim protokolünü karşılaştırdık. Bu analize dayanarak, hücre ölümünü, hücresel agregaları, hücresel olmayan nükleik asitleri ve aşağı akış analizinin potansiyel inhibitörlerini en aza indirmenin yüksek kaliteli verilere ulaşmak için kritik öneme sahip olduğu sonucuna varıyoruz.
Protokol
Prosedürler, Ulusal Sağlık Enstitüleri Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'ndaki önerilere uygun olarak gerçekleştirildi. Tüm deneyler Boston Çocuk Hastanesi Hayvan Bakım ve Kullanım Komitesi tarafından onaylandı.
NOT: Fareler, yiyecek ve suya ad libitum erişimi olan AAALAC akredite bir hayvan tesisinde barındırıldı. Bu deneyler için 8\u201212 haftalık dişi fareler kullanılmıştır. Yaralanmanın doğası göz önüne alındığında, farelere refahlarını sağlamak için ek besin zenginleştirme sağlandı.
1. Farelerde düşük torasik omurilik transeksiyonu
- Omurilik transeksiyonu öncesi hazırlık
NOT: Bu işlem için gerekli olan cerrahi aletler mikro diseksiyon yay makası, mikro diseksiyon forsepsleri, mikro dikiş iğnesi sürücüsü, hemostatlar ve 7-0 poliglactin 910 dikiştir. Gerekli diğer cerrahi malzemeler cerrahi perdeler, cerrahi alan için steril levhalar, gazlı bez süngerleri, pamuk uçlu aplikatörler ve 25 G iğneli 1 mL şırıngalardır.- Ameliyattan önce cerrahi aletleri ve malzemeleri otoklavlayın.
- Cerrahi bölgeyi ve ısıtma pedlerini alkol mendilleriyle temizleyin. Bir ısıtma yastığı ameliyat sırasında, diğeri ise tam aktiviteyi geri kazanana kadar hayvanın vücut sıcaklığını korumak için ameliyat sonrası dönem için kullanılacaktır.
- Cerrahi işlemi gerçekleştirmek için büyüteçler (2,5x veya daha fazla) kullanın.
- İşlem sırasında kullanıma hazır olması için ısıtma pedlerini, ışık kaynağını ve cam boncuk sterilizatörünü kapatın.
- Cerrahi perdeleri ve aletleri açın. Cerrahi alanı kaplamak ve aletleri cerrahi alana yerleştirmek için steril eldivenler kullanın.
- Hayvanların hazırlanması
- Fareleri işlem odasına getirin ve ayrıca omurilik yaralı fareler için temiz bir kafes getirin.
- Fareyi indüksiyon odasına% 3.0, oksijen akışını 1 L / dak ve emmeyi 20 mmHg'de pençe sıkışması tepkisi olmayana kadar yerleştirerek anestezi verin.
- Hemen hayvanı tartın ve ardından hayvanı ısıtma yastığı üzerinde eğilimli konuma yerleştirin.
- Anestezi konisini farenin burnunun üzerine sıkıca yerleştirin, gaz akışını indüksiyon odasından burun konisine geçirin ve izofluran akışını% 2'ye ve oksijen akışını 1 L / dk'ya ayarlayın.
- Hayvanın pençe sıkışmasına yanıt olmamasıyla yeterince uyuşturuldığını onaylayın. Hayvan uzuvlarını ısıtma yastığına bantla. Alt torasik omurları yükseltmek ve esnemek için alt göğsün altına yuvarlanmış bir gazlı bez süngeri yerleştirin.
- Her iki göze de oftalmik yağ uygulayın. Ağrı kesici (Meloxicam, 10 mg/kg, deri altı) ve antibiyotik (Enrofloksasin, 5 mg/kg, deri altı) uygular.
NOT: Son kullanıcılar, yerel hayvan bakım ve kullanım komiteleri tarafından önerilen ağrı kesici ve antibiyotikleri kullanmalıdır. - Tipik olarak T13 spinous prosesi7ile karşılık gelen torasik omurgadaki en belirgin dikenli süreci palpate edin. Farenin arkasında, alt boyundan en belirgin dikenli işlemin (T13) hemen altına ve orta çizginin her iki tarafında 1 cm boyunca uzunlamasına bir dikdörtgen alanı tıraş edin.
- Cerrahi prosedür
- Tıraş edilen bölgeyi % 10 povidone iyot çözeltisi ve% 70 etanol ile alternatif olarak üç kez kesi bölgesinden başlayarak dışa doğru çalışarak dairesel bir şekilde hazırlayın ve daha sonra hayvanı cerrahi alanın üzerine bir pencere ile steril 4 x 4 gazlı bez sünger ile örtün.
- En belirgin dikenli işlemde (T13) biten ince makas kullanarak sırtın orta hattında 1,5 cm'lik kesi yapın. Kesi cilt ve yüzeysel fasya içermelidir. Makas kullanmak, dikenli süreçleri ve çevresindeki paraspinöz kasları ortaya çıkarmak için cildi ve yüzeysel fasyayı her iki tarafta ayırır.
- Keskin ve künt diseksiyon kullanarak kasları dikenli işlemlerden ve T9, T10 ve T11 omurlarının laminasından ayırır.
- T9 ve T10 arasındaki ve T10 ve T11 arasındaki keskin bağları ince makas kullanarak keskin bir şekilde bölün ve ardından T10'un dikenli işlemini kesin ve omuriliği ortaya çıkarmak için T10 laminektomiyi iki taraflı olarak dikkatlice gerçekleştirin. Laminanın tamamen eks berrak olduğundan emin olun.
- Omuriliği ince makas kullanarak transekte edin. Bu noktada genellikle omurilik damarlarının transeksiyonu nedeniyle minimum kanama meydana gelir. Hemostaz elde etmek için kanama bölgesini steril pamuk uçlu aplikatörle sıkıştırın. Tam hemostazı onayladıktan sonra cildi 7-0 poliglactin 910 sürekli dikiş ile kapatın.
- Ameliyat sonrası dehidrasyonu önlemek için 1 mL salin çözeltisini deri altından yönetin.
- Ameliyat sonrası bakım
- Hayvanı tam iyileşme gerçekleşene kadar bir ısıtma yastığına yerleştirin, ardından sadece omurilik yaralı fareleri için bir kafese aktarın.
- Ameliyat sonrası bakım, hayvanları günlük olarak gözlemlemeyi ve tartılmeyi ve kesi bölgesinin 7 güne kadar enfeksiyon belirtileri için izlenmesini içerir. 3 gün boyunca her gün 1 mL salin çözeltisi, analjezik (meloksikam 10 mg/kg) ve antibiyotik (enrofloksasin 5 mg/kg) kullanın.
NOT: Son kullanıcılar, yerel hayvan bakım ve kullanım komiteleri tarafından önerilen ağrı kesici ve antibiyotikleri kullanmalıdır. - Hayvan kendi başına idrara çıkabilene kadar (genellikle 10 ila 14 gün içinde) her 12 saat manuel mesane ifadesini (Credé manevrası) gerçekleştirin. Hayvanı bir elinizle tutun ve diğer elinizle alt karın bölgesine masaj yapın, ardından şişmiş idrar kesesini işaret parmağı ve başparmakla hissedin ve hafifçe sıkıştırın. Nazik geçici sıkıştırma gevşeme ile değiştirilmelidir. Manuel ifadeyi takiben, alt karnı musluk suyuyla yıkayın ve aşırı ovalamadan kağıt havlu ile hafifçe kurulayın.
NOT: İfade başlamadan önce mesanenin küçük bir boyutu ve alt karın idrarla ıslatılma, hayvanın kendi kendine hükümsüz kılma yeteneğini kazandığının göstergeleridir. - Kilo kaybını en aza indirmek için, kolay erişim için kafesin zeminine yerleştirilen besleyici jel ve diğer besleyici ikramlar (pastırma yumuşakları, meyve gevrekleri ve sebze ısırıkları) şeklinde farelere besinsel zenginleştirme sağlayın NOT: Bu çalışmada, fareler SCI'yı takip eden 8 haftada perfüzyona uğradı ve mesaneler temin edildi.
- Ameliyat sonrası komplikasyonlar
- Mesaneyi tam olarak ifade etmeyerek aşırı hevesli manuel mesane ekspresy hızına bağlı mesanenin yırtılma potansiyelini en aza indirin.
- Perineal bölgenin musluk suyu ile yıkanması yoluyla perineal cildin yetersiz sfinkterden idrar dribblingine sürekli maruz kalmasını önleyin. Üçlü antibiyotik merhem uygulaması ile iltihabı en aza indirin.
NOT: Geçici hematüri döneminde kan pıhtılaşmasına bağlı üretral tıkanıklık veya erkek farelerde retrograd boşalma nedeniyle meni pıhtılaşmasından omurilik yaralanması sonrasında ortaya çıkabilir. Erkek farelerde tam üretral obstrüksiyon sıklıkla mesane yırtılması ve ölümle sonuçlanır. Deneyimlerimize göre erkek farelerde ölüme yol açan üretral tıkanıklık sıklığı% 10 idi.
2. Perfüzyon ve doku temini
NOT: Periferik dokulardaki bağışıklık hücreleri gibi bazı hücre türlerinin aşağı akış analizleri için, aşağıda açıklandığı gibi, doku hasadı zamanında perfüzyon yoluyla kanın çıkarılması faydalıdır.
- Cerrahi prosedürde belirtildiği gibi anestezi uygulayın (adım 2.2) ve hayvanın ön testere-çimdik yanıtı olmadan yeterince uyuşturuldığını onaylayın (hayvan felçli, bu nedenle arka ayakların hissi azaldı ve hindpaw-pinch yanıtı ilgisiz hale geldi).
- Hayvanı sırtüstü pozisyona yerleştirin ve ameliyat yerine girmesini önlemek için kürkü ıslatmak için karnı ve göğsü% 70 etanol ile tarayın.
- Pelvisten diyaframa kadar bir orta hat laparotomi gerçekleştirin. Diyaframı kaburgalardan uzak kes.
NOT: Bu adımı takiben, torasik basınç diferansiyeli artık mevcut olmadığından ve akciğerler şişiremediğinden hız önemlidir, bu nedenle hayvan boğulmaya başlar. - Göğüs kafesine paralel bir çizgide kemik kıkırdak sınırını takip ederek sol ve sağ taraftaki kaburgalar boyunca keserek diyaframdan başlayın ve ilk kaburgaya kadar ilerleyin.
- Ön torasik duvarın tamamını hayvanın başının üzerine yerleştirin ve havlu kelepçeleri kullanarak bu konuma sabitleyin. Ön torasik duvarı kesmeyin, çünkü bu iki iç torasik arterden ciddi kanamaya neden olur.
- Perikardiyumu ince makas kullanarak kesin.
- Perfüzyon cihazına 23 G'lık bir iğne bağlayın, ardından sol ventrikül içine ve yavaşça aort içine yerleştirin, delinmemeye dikkat edin.
NOT: Perfüzyon aparatı bir perfüzyon pompası ve intravenöz boruya bağlı 50 mL şırınnadan oluşur. - Perfüzyonu başlatın ve drenaj için sağ kulakçıkta ince makas ucuyla hızlı bir şekilde küçük bir kesim yapın. Sıvı infüzyonu sırasında hava kabarcıklarını tanıtmamaya dikkat edin.
- 15 mL/dk'da çalışan fosfat tamponlu salin (PBS) çözeltisi ile perfüzyon gerçekleştirin. Drenaj net olduğunda ve karaciğerin açık rengi elde edildiğinde perfüzyon tamamlanır (Şekil 1).
NOT: Perfüzyon için ortalama süre 3.5-4 dk idi. Yetersiz perfüzyon, dokuların blanching'in yavaş ilerlemesi olarak kendini gösterir ve genellikle iğnenin sol ventrikülde yanlış konumlandırılmasından kaynaklanır. İğnenin ayarlanması ve perfüzyon süresinin 1 ila 2 dakika uzatılması dokuların yeterli perfüzyonunu sağlayacaktır. - Perfüzyonu durdurun ve mesaneyi vasküler pediküllerden ve üretradan arındırın ve buz gibi Tyrode çözeltisi içeren bir mikrosantrifüj tüpüne yerleştirin.
3. Kontrolde idrar kesesinin sindirimi ve omurilik yaralanması olan fareler
NOT: Fare idrar kesesi için özel olarak tasarlanmış verimli bir sindirim karışımı formüle etmek için kollajenler ve hyaluronik asit gibi baskın hücre dışı matris bileşenlerini bozmak için kullanılan enzimlerin birimini ayarlamaya çalıştık. Bu nedenle, mesane içindeki mekansal ifadenin değerlendirilmesi için milyonda kilobase başına okuma (RPKM) ve Tabula Muris8'i ayıklamak için Mouse ENCODE projesi (BioProject: PRJNA66167) tarafından oluşturulan kamuya açık RNA sıralama verilerini kullandık. Kollajenler 1, 3 ve 6, 42 farklı kollajen arasında en çok ifade edilen üç gendi (Şekil 2A). Bu kollajenlerin ve hyaluronan sintaz 1'in (Has1) ekspresyoyu çoğunlukla mesane duvarının kas hücrelerinde ve fibroblastlarında gözlenmiştir (Şekil 2B).
- Tamponların ve çözümlerin hazırlanması
- Temiz bir 500 mL şişede Tablo 1'e göre sodyum Tyrode çözeltisi hazırlayın. 300 mL ddH2O ekleyin. Çözelti hazırlık sonrası asidiktir. NaOH kullanarak pH'ı 7,4'e ayarlayın. Çift damıtılmış H2O kullanarak hacmi 500 mL'ye getirin, ardından aliquot ve -20 °C'de saklayın.
NOT: Bu tampon sindirim tamponundaki pH ve ozmotik dengeyi korur ve hücrelere su ve temel inorganik iyonlar sağlar. Magnezyumun yanı sıra bir enerji kaynağı olarak glikoz içerir. Çözeltideki potasyum, izole hücre çözeltisinde elektromekanik aktivite üzerinde koruyucu etkiler sağlar. Toz tuzlar higroskopiktir ve nemden korunmalıdır. Karışımın tüm içeriği hazırlık aşamasından hemen sonra kullanılmalıdır. Çökeltmeler oluşabileceği için konsantre bir tuz çözeltisi hazırlanması önerilmez. Analizden sonra hücreler kültürlenecekse filtrasyon (0,22 μm filtre) kullanılarak sterilizasyon yapılabilir. - Her bileşen için önerilen hacimleri ve miktarları ekleyerek 15 mL konik bir tüpte enzimatik sindirim çözeltisi hazırlayın (Tablo 2). 2,5 mL'ye kadar sodyum Tyrode çözeltisi ekleyin. Girdap iyice çözülür.
NOT: Papain, Carica papaya lateksinden bir sülfhidrit proteazdır. Papain geniş özgüllüke sahiptir ve çoğu protein substratlarını bozacaktır9. Papain hücre ayrışma protokollerinde diğer proteazlardan daha az zarar verici ve daha etkili olduğunu kanıtlamıştır10. Tablo 2'dekidört ayrışma protokolü hakkında ayrıntılı bilgi veriyoruz; En yüksek canlılığı desteklemek için protokol bölüm 3'ü gözlemledik (%93) fare mesanesinden hazırlanan hücre süspansiyonlarının.
- Temiz bir 500 mL şişede Tablo 1'e göre sodyum Tyrode çözeltisi hazırlayın. 300 mL ddH2O ekleyin. Çözelti hazırlık sonrası asidiktir. NaOH kullanarak pH'ı 7,4'e ayarlayın. Çift damıtılmış H2O kullanarak hacmi 500 mL'ye getirin, ardından aliquot ve -20 °C'de saklayın.
- Dissositasyon prosedürü ve hücre süspansiyonunun hazırlanması
- Mesaneyi perfüzyon sonrası farelerden toplayın.
- Varsa, içeriği serbest bırakmak için mesaneyi delin.
- Boş bir 1,5 mL santrifüj tüpüne ve darasına 100 μL Tyrode çözeltisi ekleyin. Mesaneyi tüpe yerleştirin ve doğru bir mesane ağırlığı belirlemek için tekrar tartın.
- Mesaneyi buzun üzerine 10 cm Petri kabına yerleştirin ve kıyma için 100 μL Tyrode çözeltisi ekleyin.
- Cerrahi makas kullanarak, kıyma süresini mesane başına en fazla 2\u20123 dakikaya indirirken parçaları mümkün olduğunca küçük kesin. Birden fazla hayvandan mesane dokusunu birikiyorsa, mesaneleri aynı anda kıymalayın.
- Geniş delikli pipet ucu kullanarak kıyılmış mesane dokusunu her mesane için 2,5 mL sindirim tamponuna aktarın. Birden çok mesane birikmişse ses seviyesini ayarlayın. Dokuyu 37 °C'de sindirme çözeltisinde bir inkübatörde 40 dakika boyunca bir fındık makinesi mikserinde kuluçkaya yatırın.
- Kuluçka süresinin sonunda, sindirim tüpünü inkübatörden çıkarın. 1 dakika boyunca 5 mL pipet kullanarak tritürat (pipet yukarı ve aşağı) sindirim çözeltisi.
- 4 °C'de 350 x g'da 10 dakika santrifüj. Süpernatant çıkarın ve peleti 1 mL hücre ayırma çözeltisinde yeniden kullanın. 10 dakika boyunca fındık makinesi mikserinde 37 °C'lik bir inkübatöre yerleştirin.
- 4 °C'de 350 x g'da 10 dakika santrifüj. Üstnatant çıkarın ve peletin 1 mL RBC liziz tamponunda (1x) yeniden süzülür. 1 dakika kuluçkaya yaslanın.
- RBC tamponu seyreltmek ve RBC lizizini durdurmak için 9 mL PBS ekleyin.
- Hücreleri 70 μm hücre süzgecinden 50 mL konik tüpe geçirin, tam hücre geçişini sağlamak için hücre süzgecini hafifçe kazımak için bir şırınnadan pistonu kullanarak. Süzgeçten geçen ancak süzgecin alt tarafına takılabilecek sıvıyı topladığından emin olun.
- 4 °C'de 350 x g'da 10 dakika santrifüj. Süpernatant çıkarın ve peleti 200 μL hücre boyama tamponunda (%2 FBS'li PBS) yeniden çıkarın.
- Hücreleri sayın.
- Akış sitometrisi için belirli hücrelerin immünoplabeling
NOT: Mesanedeki farklı hücre türlerini tespit etmek için çok renkli bir akış sitometri paneli tasarladık. Telafi gerçekleştirmek ve uygun bir gating stratejisi tasarlamak için, unstained ve floresan eksi bir (FMO) kontrolleri dahil ediyoruz. FDO kontrolleri, özellikle pozitif kesir sönük olduğunda, pozitif popülasyonu kapılamak için önemlidir. Boyama işlemi aşağıdaki gibidir.-
Hücrelerde FcφRII/III reseptörlerinin engellenmesi
NOT: Monoklonal anti-Fc reseptör antikorları veya rekombinant Fc proteini olan hücrelerin ön inkübasyonu ile monoklonal antikorların spesifik olmayan bağlanmasını engellemenizi öneririz.- Hücreleri 4 °C'de 5 dakika boyunca 350 x g'da santrifüjleme ile yıkayın ve hücre boyama tamponu ekleyin.
- 1:100 seyreltmede hücre boyama tamponunda CD16 ve CD32 antikorları ekleyerek spesifik olmayan antikor lekelerini önlemek için süpernatant atın ve hücreler üzerindeki FcφRII/III reseptörlerini engelleyin.
- 10 dakika boyunca buzda kuluçkaya yaslanın.
NOT: Hücreleri yıkamaya gerek yoktur; hücreler bu aşamadan sonra doğrudan boyanabilir.
-
IPO'lar için boyama
NOT: Floresan Eksi Bir (FMO) kontrolü, deneyde kullanılan ve biri hariç tüm florokromları içeren tüm florromların bir tüpüdür.- Örneğin, 4 farklı florokrom (A, B C ve D + Annexin V ve propidium iyodür (PI) varsa, FMO tüplerini aşağıdaki gibi hazırlayın. FMO Tube 1: B, C, D florokrom + (Annexin V ve PI) ile konjuge antikorlar; FMO Tube 2: A, C, D florokromları + (Annexin V ve PI) ile eşleştirilmiş antikorlar; FMO Tube 3: A, B, C florokromları + (Annexin V ve PI) ile eşleştirilmiş antikorlar; FMO Tube 4: A, B, C, D florokromları + (Ek V) ile eşleştirilmiş antikorlar; FMO Tüpü 5: A, B, C, D florokrom + (PI) ile eşleştirilmiş antikorlar.
- Annexin V antikor için konjuge florokromun doğasını düşünün.
-
Tıkalı hücrelerin istenen antikorlarla boyanma
- Tıkalı hücreleri, ışıktan korunan buz üzerinde 20 dakika boyunca istenen proteinlere karşı florofor konjuge antikorların uygun ana karışımları ile kuluçkalayın. IPO'ları eklemeyi unutmayın.
- Her tüpe 1 mL hücre boyama tamponu ekli hücreleri yıkayın ve ardından 10 °C'de 5 dakika boyunca 350 x g'da tekrar santrifüj edin.
- Süpernatant atın ve hücre peletini 200 μL hücre boyama tamponunda yeniden atın. Bir akış sitometresi kullanılarak floresan verileri elde edilene kadar buzda tutun.
-
Annexin V/ PI lekesi uygulayın.
- Ölü hücreli apoptoz kiti için üreticinin protokolünde açıklandığı gibi 1x Annexin bağlayıcı tamponda pi (100 μg/mL) çalışma çözeltisi hazırlayın.
- Hücre yoğunluğunu belirleyin ve depolandıkları arabelleği ve hacmi not edin.
- 5 dakika boyunca 350 x g'da santrifüj örnekleri, 1x Annexin bağlayıcı tampondaki süpernatant ve resuspend hücrelerini 100 μL hacimde ~1 x10 6 hücre/mL yoğunluğa atın.
- Üretici protokolünde açıklandığı gibi her numuneye (100 μL) FITC-Annexin V (5 μL) ve PI çalışma çözeltisi (1 μL) ekleyin ve oda sıcaklığında 15 dakika kuluçkaya yatırın.
- Numunelere 400 μL 1x Annexin bağlayıcı tampon ekleyin, ters çevirme ile karıştırın ve akış sitometrisine kadar buzda tutun.
-
Hücrelerde FcφRII/III reseptörlerinin engellenmesi
- FACS kalibrasyonu
-
Akış sitometrisi ve saflık kontrolü
- Hücre morfolojisini ve florokromların oluklarını tanımlamak için yersiz hücreleri ölçerek akış sitometrisi analizine başlayın.
- Her floresan parametresinin voltajlarını değiştirerek yan dağılım (SSC) ve ileri dağılım (FSC) ayarlayın. Floresan emisyonu 530 nm (Annexin V) ve >575 nm (PI) olarak ölçün.
- Her nokta çiziminde ızgaraları kullanarak ilk on yıldaki negatif popülasyonu tanımlayın. Her FDO kontrolünü sitometreye yerleştirin ve negatif ve pozitif popülasyon ortamları hizalanana kadar spektral çakışmayı düzeltin.
- 100.000 olayı ölçün. Belirli işaretlerle boyanmış hücreleri ölçün ve ilgi çekici hücre popülasyonları için kapılar oluşturun.
-
Akış sitometrisi ve saflık kontrolü
- Veri analizi
- Akış sitometresinden verileri toplayın. Çözümleme için çalışma alanını görselleştirmek için yazılımı açın.
- Çalışma alanı oluşturma
- FCS dosyalarını çalışma alanına sürükleyerek içeri aktarın. Dosyalar çalışma alanının örnek ve grup bölümünde görünür. Dosyayı açmak için örnek adı çift tıklatın.
- X ekseni için y ekseni ve ileri saçılma alanı (FSC-A) için yan dağılım alanı (SSC-A) kullanın (Şekil 3A). Çokgen gating simgesini tıklatın.
- Bir kapı düğümü yapmak için tıklatıp tamamlanana kadar hücre popülasyonunun etrafında tıklatmaya devam ederek nokta çizimine ilgi hücre popülasyonunun etrafında bir kapı oluşturun; kapıyı kapatmak için çift tıklatın.
- Geçidi yakalanan popülasyona göre adlandırın (örneğin, "Tüm hücreler") ve Tamam'ı tıklatın.
NOT: "Tüm hücreler" kapısına çift tıklayarak, yalnızca "Tüm hücreler" içinde bulunan olayları gösteren yeni bir grafik penceresi açılır. - Siyah oku tıklatıp y eksenini değiştirmek için seçerek, yeni nokta çiziminin y eksenini SSC-H 'ye (yan dağılım yüksekliği) ayarlayın.
NOT: Bu kapılar tek hücreler (singlet'lar) içindir ve çiftleri veya daha büyük agregaları hariç tutar (Şekil 3B). Tek hücreler orantılı genişliğe ve uzunluğa sahip olduğundan, diyagonal üzerinde bir popülasyon olarak temsil edilmelidir. Bu çapraz kapının dışına düşen hücreler çiftler veya daha büyük agregalardır. - Nekrotik (PI-pozitif), erken apoptotik (Annexin V-pozitif, PI-negatif) ve geç apoptotik (Ek V-pozitif, PI-negatif) hücreleri analiz etmek için kapıya çift tıklayın (Şekil 3C).
- X eksenini Annexin V ve y eksenini PI olarak etiketle.
NOT: Sinyal yoğunluğunun düşük olduğu bazı durumlarda, arka plan düzeltmesi sonucunda hücre popülasyonları negatif floresan değerlerine sahip görünebilir. Bu durumda, iki üstel bir dönüşüm gerçekleştirmeniz önerilir. Bunu yapmak için, y ekseninin yanındaki T'yi tıklatın ve Ekseni Özelleştir 'iseçin. Yeni pencerede ölçeği iki üstel (Biex) olarak değiştirin, genişlik temelini artırarak eksenlere negatif değerler ekleyin ve Uygula 'yıtıklatın. Bu, düşük sinyal yoğunluğuna sahip olayların çözünürlüğünü artıracaktır. - Verileri sayım çizimi olarak göster. X ekseninin hemen altındaki Seçenek sekmesini kullanın ve menüden sayaç çizimini seçin.
- 4 ayrı hedef popülasyon tanımlamak için çizime bir Quat kapısı çizin.
- Düzen düzenleyicisini tıklatıp popülasyonları her ayrı alana sürükleyerek düzen düzenleyicisini açmak için pencerenin üst kısmını tıklatın.
- Çalışma alanından popülasyonları düzen düzenleyicisi penceresine sürükleyip bırakarak çizimleri düzen düzenleyicisine yerleştirin.
- Histogramları kullanarak görselleştirme
- Seçenekler sekmesinden histogramı seçin.
- Annexin V pozitif hücrelerini seçmek için bir kapı uygulayın; alternatif olarak, pozitif ve negatif popülasyonlar bisector aracı kullanılarak tanımlanabilir. Örnek bölüm artık biçimlendirilmiş farklı popülasyonları ve hiyerarşilerini göstermelidir.
- Örnekleri karşılaştırmak için, tüm histogramları üst üste sürükleyin; histograma sağ tıklayın ve histogramdan Stagger Offset'i seçin.
- İstatistiksel analizler ekleme
- İlgi alanı nüfusuna çift tıklayarak İstatistik sekmesini açın. Uygulanacak işlevi ve ilgili parametreyi seçin.
- Sigma simgesini nüfus adına sürükleyerek diğer popülasyonlarla tekrarlayın.
- İlgi örneğinden gating stratejisini seçerek ve ilgi çekici işaretleyici tarafından tanımlanan gruba sürükleyerek analizi tüm örneklere uygulayın, örneğin Annexin V.
- FDO kontrol örneklerinde kapılar oluşturun ve negatif ve pozitif popülasyonları tanımlayın; bu gating stratejisi denemenin tamamına uygulanacaktır (Şekil 3D\u2012F).
NOT: Gating'in doğru olduğundan emin olmak için her örneği ayrı ayrı kontrol edin ve gerektiğinde değiştirin. - Hücreler marker antikoru (örneğin CD45) ile boyanmışsa, ilgili FDO'yu ve kapıyı buna göre kullanın.
- Düzeni vermek için Dosya | Görüntü | Dışarı Aktar Dosya biçimini seçin (örneğin, jpg, pdf).
- Tablonun son sürümünü içeren bir pencere açmak için Tablo Oluştur'u tıklatın.
- Dosya | seçerek tabloyu dışarı aktarma Farklı Kaydet | Dosya adı.
Sonuçlar
Cerrahi prosedür
Torasik omurilik transeksiyonunun başarısı, en belirgin olanı hindlimb felci olan bir dizi parametrenin değerlendirilmesi ile belirlenir. Hayvan sadece ön ayaklarını kullanarak hareket eder, arka ayaklarını sürükler. Aksi takdirde, beslenme, tımar ve uyanıklık da dahil olmak üzere aktivite seviyeleri genellikle normaldir. Ek olarak, hayvanlar iradesel mesane kontrolünü kaybeder ve bu da yaralanmadan 10 ila 14 gün sonra refleks geçersiz kılma geri dönene kadar her 12 saat içinde araştırmacı tarafından manuel mesane ifadesine ihtiyaç duyar. Ötenazi sonrasında, yaralanmanın başarısının ek belirtileri öncelikle doku tadilatının göstergesi olan mesane-vücut ağırlık oranındaki artışla ilgilidir. Histolojik analiz, hem ürotelial hem de düz kas bölmeleri içinde hiperplaziyi ortaya koymaktadır3.
Tek hücreli süspansiyonun hazırlanması
Halka açık ekspresyon verileri kullanılarak, hücre dışı matris proteinleri için mesane dokusunun zenginleştirilmesi belirlendi (Şekil 2) ve sindirim karışımının formülasyonunu bilgilendirmek için kullanıldı. Kollajenler mesane duvarının anahtar bileşenleri olduğundan11,12, ilk önce Fare ENCODE projesi13tarafından oluşturulan RNA profil oluşturma veri kümelerini kullanarak fare mesanesinde en bol kolajenleri belirlemeye çalıştık. Analizimiz Kollajen 1A1, kollajen 3A1, kollajen 1A2 ve kollajen 6A1'in fare mesanesi içindeki en bol kollajen türleri olduğunu göstermiştir (Şekil 2A). Ayrıca 1,3, 6 ve hyaluronan kollajenlerinin mRNA ekspresyon seviyesini belirlemek için Tabula Muris (fareden (Mus musculus)) 8'den tek hücreli transkriptom verilerinin bir toplamı) kullandık. Veriler, dokular arasında paylaşılan hücre tiplerinde gen ekspresyonunun doğrudan ve kontrollü bir şekilde karşılaştırılmasını sağlar. Bu analiz, bu hücre dışı matris bileşenlerinin ekspresyonunun ürotelyum yerine mezenkimal hücre tiplerinde daha yaygın olduğunu ortaya koydu (Şekil 2B).
Ayrışmanın izole hücrelerin mesaneden yaşayabilirliği üzerindeki etkisi
Akış sitometrisi analizi, 4 farklı protokol kullanılarak enzimatik sindirimin sırasıyla% 83, % 86, % 93 veya% 90 canlılık sağladığını göstermiştir. Bu nedenle, protokol bölüm 3 hücre canlılığının korunması için en değerli görülmüştür. Ayrıca hücrelerin yaklaşık % 4'ünün nekrotik olduğunu gözlemledik (PI+/ Annexin V-) (Şekil 4A). Bu gözlemler sindirim protokolünün verimliliğini ve hücre canlılığı üzerindeki faydayı vurgular.
Omurilik hasarının mesanedeki farklı hücre popülasyonları üzerindeki etkisi
SCI farelerinin mesanelerindeki toplam hücre sayısında kontrollere göre önemli bir artış gözlemledik. SCI mesanelerinden elde edilen nokta çizgilerinin deseni de omurilik yaralanması nedeniyle devam eden organ tadilatı ile biraz farklıydı(Şekil 4B: ilk sütun). Kontrollerle karşılaştırıldığında, SCI hayvanlarından elde edilen mesaneler CD45 pozitif hücrelerde önemli bir artış gösterdi.
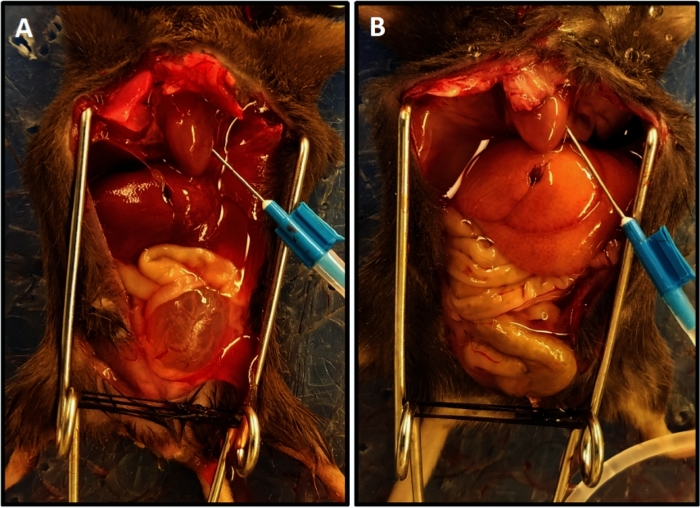
Şekil 1: Karaciğerin hafifletilmiş rengi ile temsili perfüzyon tamamlama. (A) Perfüzyonun başlangıcındaki karaciğer rengini gösterir. (B) Perfüzyon sonunda hafifletilmiş karaciğer rengini gösterir. (A)'daki fare, perfüzyondan iki hafta önce omurilik transeksiyonu geçirdi ve mesane hipertrofisine ve omurilik yaralanması olmayan farenin (B) aksine pelvisten çıkıntısına neden oldu; Bu durumda mesane küçüktür ve pelviste gizlidir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
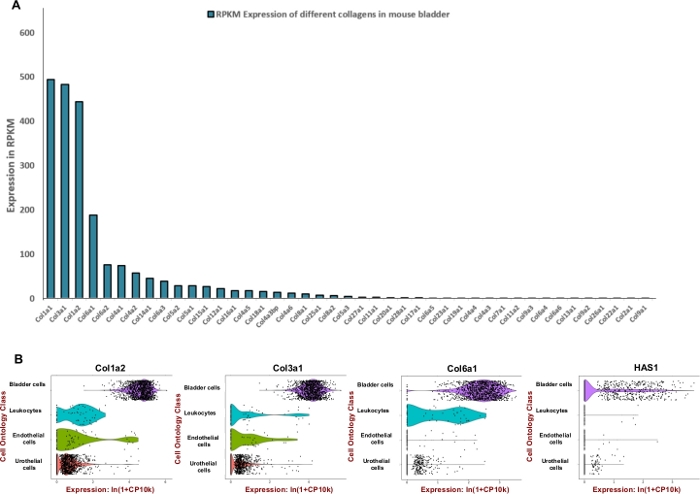
Şekil 2: Fare mesanesinde hücre dışı matris (ECM) bileşenlerinin transkriptomik ekspresyonu. (A) 43 farklı kollajen tipinin çubuk grafiği. İfade, transkriptin Kilobase Başına Okuma, milyon eşlenen okuma başına (RPKM) ile belirtilir (veriler BioProject' ten toplanır: PRJNA66167)14. (B) Erkek ve dişi ayrışmış idrar kesesi örnekleri havuzunda (erkek ve dişi) mikroakışkan damlacık bazlı 3'uç sayımından elde edilen hücre tiplerinde gen ekspresyonunun keman çizimleri. Sayımlar, milyon ln (CPM+1)8başına 1+ sayının doğal logaritmini kullanarak her hücre için günlük normalleştirildi. Logaritma almadan önce 1 CPM'lik bir sözde sayı eklendi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
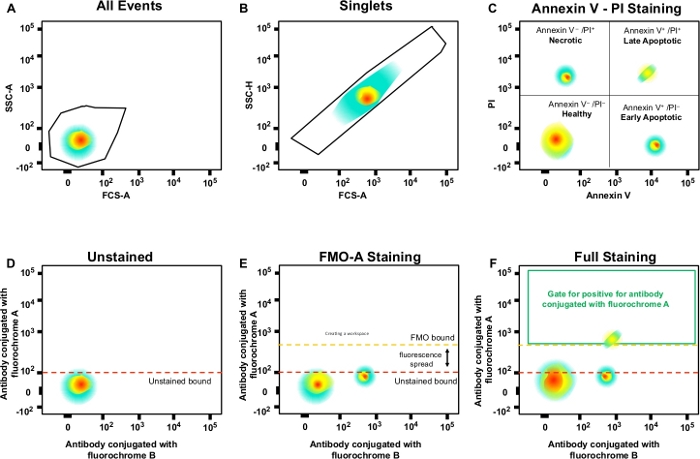
Şekil 3: Floresan yayılımlarını belirlemek için gating stratejisi ve FDO kontrolleri. (A) Hücre popülasyonu seçimi. (B) Singlet'lar için gating stratejisi. (C) PI ve Annexin V antikoru kullanılarak nekrotik ve erken ve geç apoptotik hücreler için gating. (D\u2012F) Çok renkli akış sitometrisinin şematik nokta grafiği (örneğin, A, B, C, D florokromları + (Ek V ve PI) ile eşleştirilmiş antikorlar). Bu, floresanların FDO kontrolü tarafından gösterilen florokrom A kanalı ile antikora yayıldığını gösterir. Turuncu noktalı çizgi, kırmızı renkteki lekesiz sınıra kıyasla FMO geçiş sınırını temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
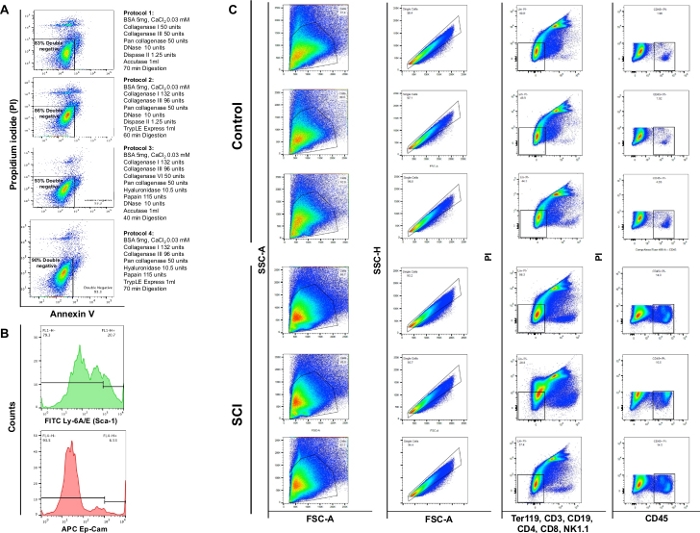
Şekil 4: Mesanede farklı hücre tiplerinin akış sitometrisi. (A) Annexin V/PI çift boyama akış şemaları. Her protokol için kullanılan farklı enzim ve kimyasal kombinasyonları, ilgili canlılık grafiğinin önünde temsil edilir. Bu veriler protokol bölüm 3 ile en yüksek canlılığı göstermektedir. (B) Tek kanallarda tespit edilen Ly-6A/E (Sca-1) ve CD326 (Ep-CAM) yoğunluğunu gösteren temsili histogramlar. (C) SCI'nın fare mesanesinin hücre popülasyonu üzerindeki etkisi. Üst panel, kontrol ameliyatsız farelerden elde edilen üç ayrışmış mesanede lekeleme sonuçlarını gösterir ve alt panel SCI'lı üç hayvanda lekelemenin sonuçlarını gösterir. İlk sütun toplam hücre popülasyonudur. İkinci sütunda singlet gating seçimi gösterilir. Üçüncü sütun, B hücreleri, T hücreleri ve NK hücreleri için negatif olan canlı hücrelerin alt nüfusunu gösterir. Dördüncü sütun, CD45 için pozitif canlı hücreler için boyama gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Bileşen | Tutar (500 mL için) | Azı dişi |
| Nacl | 4.091 g | 140 mM |
| Kartal | 0,186 g | 5 mM |
| MgCl2 | 0,0476 g | 1 mM |
| D-Glikoz | 0,9 g | 10 mM |
| HEPES | 1,19 g | 10 mM |
Tablo 1: Tyrode'un çözeltisinin hazırlanması için bileşenler. Belirtilen bileşenler 500 mL Tyrode çözeltisinin hazırlanması içindir.
| Bileşen | Tutar | Protokol bölüm 1 | Protokol bölüm 2 | Protokol bölüm 3 | Protokol bölüm 4 |
| Bsa | 5 mg | Evet | Evet | Evet | Evet |
| CaCl2 | 0,03 mM | Evet | Evet | Evet | Evet |
| Kollajenaz Tip I | 132,5 adet | Evet | Evet | Evet | Evet |
| Kollajenaz Tip III | 96,4 adet | Evet | Evet | Evet | Evet |
| Kollajenaz Tip VI | 50 adet | - | - | Evet | - |
| DNase | 10 adet | Evet | Evet | Evet | - |
| Papain | 115 adet | - | - | Evet | Evet |
| Pan Kollajenaz | 50 adet | - | - | Evet | Evet |
| Hyaluronidaz | 10,5 adet | - | - | Evet | Evet |
| Dispase II | 1.25 adet | Evet | Evet | - | - |
| Hücre ayrıştırma çözümü | 1 mL | Evet | - | Evet | - |
| Rekombinant enzim | 1 mL | - | Evet | - | Evet |
Tablo 2: Sindirim tamponunun hazırlanması için bileşenler. Belirtilen bileşenler 2,5 mL sindirim karışımının hazırlanması içindir (1 U, dakikada 37 °C'de bir substrat olan 1 μmol'ün hidrolizini kataliz eder. Her enzimin biriminin tanımı için ürün veri sayfasına bakın).
Tartışmalar
Burada açıklanan fare omurilik yaralanması modeli, mesane kasılması ve dış üretral sfinkter gevşemesi arasındaki koordinasyon kaybı nedeniyle fonksiyonel bir mesane çıkış tıkanıklığı oluşturmak için tekrarlanabilir bir yöntem sağlar. Bu da, ürotelial ve düz kas bölmelerinin genişlemesi ile karakterize edilen yaralanmadan 2 hafta sonra mesane duvarının derin tadilatını çağrıştırır. Kemirgenlerde SCI modelinin uygulanmasında kritik adımlar şunlardır: (i) yaralanmadan sonraki 10\u201214 gün boyunca ortaya çıkan omurga şoku döneminde manuel mesane ifadesine titizlikle dikkat etmek; (ii) kilo kaybını en aza indirmek için besin zenginleştirme; ve (iii) özellikle refleks geçersiz kılmanın geri dönüşünün ötesine geçen deneyler için idrar haşlama potansiyelinin azaltılması. Modelin sınırlamaları, geçici hematüri döneminde kan pıhtılarından farelerde üretral tıkanıklık potansiyelini ve ayrıca ameliyattan sonra retrograd boşalmayı takiben meni pıhtısından erkek farelerde bulunur.
Burada açıklanan doku ayrıştırma yaklaşımı, deneysel hakaretten kaynaklanan dokulardaki yapısal değişiklikleri göz önünde bulundurmanın önemini göstermektedir, bu durumda SCI'yı takiben aşağı akış analizlerini etkileyebilecek önemli doku tadilatı. Tek hücreli analizlerdeki artışla, gen ifadesinde gözlenen farklılıkların sadece ayrışmaya bağlı pertürbasyonların bir sonucu olmadığından, hastalık modeliyle ilgili temel biyolojik değişiklikleri gerçekten temsil ettiğinden emin olmak önemlidir. Herkese açık ifade verilerinin kullanımı, canlılığı en üst düzeye çıkarırken hücre dışı matrisin etkili bir şekilde sindirilmesini sağlamak için sindirim tamponlarının formülasyonunu değiştirmemize izin sağladı. Gelecekteki uygulamalarda dikkate alınabilecek ek değişiklikler, ayrışma protokolüne duyarlı acil erken genlerin transkripsiyonunu durdurmak için aktinomycin D eklenmesini içerir15.
Pipetleme tekniği, dokuyu ayrıştırırken veya zaten süspansiyonda olan hücreleri aktarırken çok önemlidir. Kesme kuvvetlerinden hücrelere fiziksel hasarı azaltmak için, hücre resüspensiyonu sırasında yavaşça ve yavaşça pipet yapmak önemlidir. Genellikle geniş delikli pipet uçlarının kullanılması önerilir. Standart uçlar kullanıyorsanız, aksi takdirde hücrelere zarar verecek kesme kuvvetlerini önlemek için hücre süspansiyonlarını yavaşça pipetlamak özellikle önemlidir. Hücre süzgeçlerinin kullanılması bu protokolde kaçınılmazdır, ancak hücre konsantrasyonu 100 μL veya daha fazla hacim kaybı eşliğinde% 20 veya daha fazla azalabilir. Kesin bir hücre sayısı sağlamak için hücre konsantrasyonunun süzüldikten sonra belirlenmesini öneririz.
Akış sitometrisinde, FMO kontrolleri üst üste binen emisyon tepelerinden gelen sinyalin kanaması nedeniyle bir arka plan ölçüsü sağlar. Bunlar spesifik olmayan antikor bağlama veya bu kanala bir antikor dahil edildiğinde bulunabilecek arka plan boyama ölçüsü değildir. Spesifik olmayan antikor bağlamasını hesaba katmak için uygun izotip kontrollerini dahil etmek zorundadır; arka plan boyama için negatif kontroller dahil edilmesi gerekir. Birlikte ele alındığında, bu kontroller hücre popülasyonlarının doğru ölçümünü sağlar.
Açıklamalar
Çıkar çatışması bildirilmedi.
Teşekkürler
Bu çalışma Ulusal Sağlık Enstitüleri'nden (R01 DK077195'ten R.M.A'ya, R01 DK104641'den R.M.A ve D.R.R..B'a) verilen hibelerle desteklendi. Hematoloji/Onkoloji Bölümü, Boston Çocuk Hastanesi, Pediatri Bölümü, Harvard Tıp Fakültesi ve Dana-Farber Kanser Enstitüsü'nde Dr. Stuart Orkin'in değerli katkılarını kabul ediyoruz. Ayrıca Kyle Costa'nın farelerin ameliyat sonrası bakımında, Mary Taglienti ve Dr. Habiballah Shojaeisaadi'nin (Dr. Yang Shi Laboratuvarı, Pediatri Bölümü, Yenidoğan Tıbbı Bölümü, Pediatri Bölümü, Yenidoğan Tıbbı Bölümü, Boston Çocuk Hastanesi, Harvard Tıp Fakültesi) teknik yardım ve yararlı tartışmalar için desteğini kabul ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2.5 X Magnifying Loupes | |||
| 7-0 Vicryl suture, 6.5mm needle 3/8 circle | ETHICON | J546 | |
| 70 μm Cell Strainer | Thermofisher | 22363548 | |
| Accutase in BPBS, 0.5mM EDTA | Millipore | SCR005 | |
| Aerosol Filter Wide Orifice Pipettor Tips (1000 µL) | VWR | 89049-168 | |
| Aerosol Filter Wide Orifice Pipettor Tips (1000 µL) | VWR | 89049-168 | |
| APC anti-mouse CD326 (Ep-CAM), rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 118213 | |
| BB515 Rat Anti-Mouse CD45, rat monoclonal, IgG2b, κ, Clone 30-F11 | BD Biosciences | 564590 | |
| BONN Micro Dissecting Forceps, Straight, 1x2 teeth, 3.75" length, 0.3mm tip width, 0.12mm teeth | ROBOZ Surgical Instrument Company, Inc. | RS-5172 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Bovine Serum Albumin | Sigma | A9647-100G | |
| CaCl2 | Sigma | 2115-250ML | |
| CASTROVIEJO Micro Suturing Needle Holder, Straight with lock, 5.75" length | ROBOZ Surgical Instrument Company, Inc. | RS-6412 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Cell Counting Kit, 30 dual-chambered slides, 60 counts, with trypan blue | Biorad | 1450003 | |
| Cell Staining Buffer | BioLegend | 420201 | |
| Collagenase from Clostridium histolyticum | Sigma | C0130-1G | |
| Collagenase Type I | Worthington Biochemical Corporation | LS004196 | |
| Collagenase Type III | Worthington Biochemical Corporation | LS004182 | |
| Collagenase, Type 6 | Worthington Biochemical Corporation | LS005319 | |
| Dead Cell Apoptosis Kit with Annexin V Alexa Fluor 488 & Propidium Iodide (PI) | Thermofisher | V13241 | |
| Dispase II | Sigma | D4693-1G | |
| DNase | Sigma | DN25-1G | |
| Enrofloxacin (Baytril) | Bayer Health Care LLC, | NADA # 140-913 Approved by FDA. Lot No.: AH01CGP | 2.27% Injectable Solution |
| Falcon 15 ml conical centrifuge tubes | Fisher Scientific | 352096 | |
| Falcon 50 ml conical centrifuge tubes | Fisher Scientific | 352070 | |
| FITC anti-mouse Ly-6A/E (Sca-1) Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 122505 | |
| Hyaluronidase from sheep testes, Type II | Sigma | H2126 | |
| MACS SmartStrainers (100 µm) | Miltenyi Biotec, Inc. | 130-110-917 | |
| McPHERSON-VANNAS, Micro Dissecting Spring Scissors, Straight, 4" length, 0.15mm tip width | ROBOZ Surgical Instrument Company, Inc. | RS-5630 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Meloxicam | Patterson Veterinary | 07-891-7959 | |
| Papain | Worthington Biochemical Corporation | LS003119 | |
| PE/Cy5 anti-mouse CD19 Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 115509 | Dump Channel |
| PE/Cy5 anti-mouse CD3ε Antibody, Armenian hamster monoclonal, IgG, affinity purified | BioLegend | 100309 | Dump Channel |
| PE/Cy5 anti-mouse CD4 Antibody, rat monoclonal, IgG2b, κ, affinity purified | BioLegend | 100409 | Dump Channel |
| PE/Cy5 anti-mouse CD8a Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 100709 | Dump Channel |
| PE/Cy5 anti-mouse NK-1.1 Antibody, mouse monoclonal, IgG2a, κ, affinity purified | BioLegend | 108715 | Dump Channel |
| PE/Cy5 anti-mouse TER-119/Erythroid Cells Antibody, IgG2b, κ, affinity purified | BioLegend | 116209 | Dump Channel |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block), rat monoclonal, IgG2b, κ, Clone 2.4G2 | BD Biosciences | 553141 | |
| RBC Lysis Buffer (10X) | BioLegend | 420301 | |
| Red Blood Cell Lysis Buffer 1x | Biolegend | 420201 | |
| Screw-Cap microcentrifuge tubes, 1.5 ml | VWR | 89004-290 | |
| TC20 Automated Cell Counter | Biorad | 1450102 | |
| Triple antibiotic ointment (neomycin/polymyxin B/ bacitracin) | Patterson Veterinary | 07-893-7216 | skin protectant |
| TrypLE Select Enzyme (10X), no phenol red | Thermofisher | A1217701 | |
| Vetropolycin eye ointment | Dechra Veterinary Products | NADA # 065-016. Approved by FDA. | protect eyes during anesthesia |
Referanslar
- Grange, C., et al. Phenotypic characterization and functional analysis of human tumor immune infiltration after mechanical and enzymatic disaggregation. Journal of Immunological Methods. 372 (1-2), 119-126 (2011).
- van den Brink, S. C., et al. Single-cell sequencing reveals dissociation-induced gene expression in tissue subpopulations. Nature Methods. 14 (10), 935-936 (2017).
- Seth, A., et al. The impact of discrete modes of spinal cord injury on bladder muscle contractility. BMC Urology. 13, 24 (2013).
- Doyle, C., et al. Inosine attenuates spontaneous activity in the rat neurogenic bladder through an A2B pathway. Scientific Reports. 7, 44416 (2017).
- Gheinani, A. H., et al. Characterization of miRNA-regulated networks, hubs of signaling, and biomarkers in obstruction-induced bladder dysfunction. JCI Insight. 2 (2), 89560 (2017).
- Gheinani, A. H., et al. Concordant miRNA and mRNA expression profiles in humans and mice with bladder outlet obstruction. American Journal of Clinical and Experimental Urology. 6 (6), 219-233 (2018).
- Krishna, V., et al. A contusion model of severe spinal cord injury in rats. Journal of Visualized Experiments. (78), e50111 (2013).
- The Tabula Muris Consortium. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris. Nature. 562 (7727), 367-372 (2018).
- Gray, C. J., Boukouvalas, J., Szawelski, R. J., Wharton, C. W. Benzyloxycarbonylphenylalanylcitrulline p-nitroanilide as a substrate for papain and other plant cysteine proteinases. Biochemical Journal. 219 (1), 325-328 (1984).
- Feodorova, Y., Koch, M., Bultman, S., Michalakis, S., Solovei, I. Quick and reliable method for retina dissociation and separation of rod photoreceptor perikarya from adult mice. MethodsX. 2, 39-46 (2015).
- Aitken, K. J., Bagli, D. J. The bladder extracellular matrix. Part I: architecture, development and disease. Nature Reviews Urology. 6 (11), 596-611 (2009).
- Aitken, K. J., Bagli, D. J. The bladder extracellular matrix. Part II: regenerative applications. Nature Reviews Urology. 6 (11), 612-621 (2009).
- The ENCODE Project Consortium. An integrated encyclopedia of DNA elements in the human genome. Nature. 489 (7414), 57-74 (2012).
- Yue, F., et al. A comparative encyclopedia of DNA elements in the mouse genome. Nature. 515 (7527), 355-364 (2014).
- Wu, Y. E., Pan, L., Zuo, Y., Li, X., Hong, W. Detecting Activated Cell Populations Using Single-Cell RNA-Seq. Neuron. 96 (2), 313-329 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır