Method Article
Uma única abordagem de dissociação celular para análise molecular da bexiga urinária no rato após lesão medular
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O objetivo deste protocolo é aplicar um protocolo otimizado de dissociação tecidual a um modelo de camundongo de lesão medular e validar a abordagem para análise de célula única por citometria de fluxo.
Resumo
Descrevemos a implementação de lesão medular em camundongos para provocar dissynergia detrusor-esfíncter, uma obstrução funcional da saída da bexiga e posterior remodelação da parede da bexiga. Para facilitar a avaliação da composição celular da parede da bexiga no controle não ferido e camundongos lesados na medula espinhal, desenvolvemos um protocolo de dissociação otimizado que suporta alta viabilidade celular e permite a detecção de subpopulações discretas por citometria de fluxo.
A lesão medular é criada por transeção completa da medula espinhal torácica. No momento da colheita de tecidos, o animal é perfundido com soro fisiológico tamponado com fosfato sob anestesia profunda e bexigas são colhidas no tampão de Tyrode. Os tecidos são picados antes da incubação no tampão de digestão que foi otimizado com base no conteúdo de colágeno da bexiga do rato, conforme determinado pelo interrogatório de bancos de dados de expressão genética disponíveis publicamente. Após a geração de uma única suspensão celular, o material é analisado por citometria de fluxo para avaliação da viabilidade celular, número celular e subpopulações específicas. Demonstramos que o método produz populações celulares com maior viabilidade de 90%, e representação robusta de células de origem mesenquimal e epitelial. Este método permitirá uma análise precisa a jusante de tipos de células discretas na bexiga do rato e, potencialmente, em outros órgãos.
Introdução
Perturbações da função normal da bexiga urinária podem levar à diminuição da qualidade de vida de muitos indivíduos. Para obter uma melhor compreensão de como lesões ou doenças descarrilam a função normal da bexiga, é importante sondar o estado biológico normal das células dentro da bexiga e como elas mudam sob perturbação experimental. Até hoje, porém, as populações celulares específicas que residem dentro da bexiga urinária, e como mudam com lesões, têm sido incompletamente caracterizadas.
Métodos de criação de perfil de células únicas, como citometria de fluxo ou sequenciamento de RNA de célula única (scRNA-seq) têm o potencial de lançar luz sobre tipos de células específicas dentro da bexiga. No entanto, para que essas abordagens sejam um tecido informativo deve ser digerido de forma que não afete a viabilidade, a expressão genética e os percentuais representativos da população celular do tecido colhido. Protocolos que empregam desagregação enzimática podem impactar a expressão do marcador de superfície através da atividade de protease indiscriminada1, impactando assim a identificação celular por citometria de fluxo, enquanto o processo de dissociação em si pode levar à indução de genes precoces imediatos, como descrito recentemente por Van den Brink e colegas2. Os autores mostraram que, embora a subpopulação afetada pela dissociação fosse pequena, poderia desencadear um forte sinal contaminante em estudos de expressão em massa devido aos altos níveis de expressão de genes precoces imediatos. Além disso, a duração do protocolo de dissociação afetou os níveis de expressão em massa detectados de genes mostrados exclusivos de algumas subpopulações. Assim, conjuntos de dados unicelulares gerados sem contabilizar o impacto do protocolo de dissociação podem produzir alterações na expressão genética decorrentes do método de dissociação, em oposição à biologia subjacente. Essas observações sugerem que os dados de transcrição de células únicas publicados devem ser interpretados com cautela, e que os resultados devem ser validados por métodos independentes.
Embora, métodos de dissociação severos e demorados possam alterar a expressão genética nas células2; o isolamento efetivo das células é essencial para obter uma representação precisa dos tipos celulares presentes. Uma vez que a bexiga é um órgão complexo composto por vários tipos de células, algumas populações como células urteliais ou estromais podem ser relativamente sub-representadas, enquanto outros tipos de células, como os fibroblastos, existem dentro da matriz extracelular e podem ser desafiadoras para se isolar. A dissociação torna-se ainda mais desafiadora se a bexiga tiver sofrido remodelação significativa e fibrose, como a observada na lesão medular3,4 ou obstrução da saída da bexiga5,6.
Aqui, descrevemos um método otimizado de dissociação de tecido para análise de células únicas a jusante na bexiga do rato lesado pela medula espinhal. Usando citometria de fluxo, comparamos quatro protocolos de digestão enzimática por sua capacidade de produzir uma única suspensão celular, suportar a viabilidade celular e manter a proporção correta das populações celulares. Com base nesta análise, concluímos que minimizar a morte celular, os agregados celulares, os ácidos nucleicos não celulares e os potenciais inibidores da análise a jusante são fundamentais para alcançar dados de alta qualidade.
Protocolo
Os procedimentos foram realizados em estrita conformidade com as recomendações do Guia de Cuidado e Uso de Animais de Laboratório dos Institutos Nacionais de Saúde. Todos os experimentos foram aprovados pelo Comitê de Cuidados e Uso de Animais do Hospital Infantil de Boston.
NOTA: Os ratos estavam alojados em uma instalação de animais credenciada pela AAALAC com acesso a ad libitum a alimentos e água. Camundongos fêmeas com 8\u201212 semanas de idade foram usados para esses experimentos. Dada a natureza da lesão, foi fornecido enriquecimento nutricional adicional aos camundongos para garantir seu bem-estar.
1. Transeção da medula espinhal de baixa torácica em camundongos
- Preparação antes da transeção da medula espinhal
NOTA: Os instrumentos cirúrgicos necessários para este procedimento são tesouras de mola de micro dissecação, fórceps de micro dissecação, micro sutura de agulha, hemostatas e suturas de poliglactina 7-0 910. Outros suprimentos cirúrgicos necessários são cortinas cirúrgicas, folhas estéreis para campo cirúrgico, esponjas de gaze, aplicadores de ponta de algodão e seringas de 1 mL com agulhas de 25 G.- Autoclave os instrumentos cirúrgicos e suprimentos antes da cirurgia.
- Limpe a área cirúrgica e as almofadas de aquecimento com lenços umedecidos. Uma almofada de aquecimento será usada durante a cirurgia e a outra para o pós-operatório imediato para manter a temperatura corporal do animal até recuperar a atividade completa.
- Use lupas de lupa (2,5x ou mais) para realizar o procedimento cirúrgico.
- Ligue as almofadas de aquecimento, a fonte de luz e o esterilizador de contas de vidro para estar pronto para uso durante o procedimento.
- Abra as cortinas cirúrgicas e os instrumentos. Use luvas estéreis para cobrir o campo cirúrgico e colocar os instrumentos no campo cirúrgico.
- Preparação dos animais
- Leve os ratos para a sala de procedimento e também traga uma gaiola limpa para os camundongos feridos da medula espinhal.
- Administre a anestesia colocando o rato na câmara de indução com fluxo isoflurane fixado em 3,0%, fluxo de oxigênio a 1 L/min e sucção a 20 mmHg até que não haja resposta de aperto de pata.
- Pesar imediatamente o animal e, em seguida, colocar o animal na posição propensa na almofada de aquecimento.
- Coloque o cone anestésico sobre o nariz do rato, mude o fluxo de gás da câmara de indução para o cone do nariz e ajuste o fluxo isoflurane para 2% e o fluxo de oxigênio para 1 L/min.
- Confirme se o animal está adequadamente anestesiado com a ausência de resposta à pata-pinch. Tape os membros do animal na almofada de aquecimento. Coloque um pedaço enrolado de esponja de gaze sob o peito inferior para elevar e flexionar as vértebras torácicas inferiores.
- Aplique lubrificante oftálmico em ambos os olhos. Administrar medicação para dor (Meloxicam, 10 mg/kg, subcutânea) e antibiótico (Enrofloxacina, 5 mg/kg, subcutânea).
NOTA: Os usuários finais devem usar a medicação para dor e antibióticos recomendados pelo comitê local de cuidados e uso de animais. - Palpate o processo spinous mais proeminente na coluna torácica que normalmente corresponde ao processo spinous T137. Raspe uma área de retângulo longitudinal na parte de trás do mouse do pescoço inferior para um pouco abaixo do processo spinous mais proeminente (T13) e por 1 cm em cada lado da linha média.
- Procedimento cirúrgico
- Prepare a área raspada com solução de iodo povidone 10% e 70% de etanol três vezes alternativamente de forma circular a partir do local de incisão trabalhando para fora e, em seguida, cubra o animal com esponja de gaze estéril 4 x 4 com uma janela no centro sobrepondo o campo cirúrgico.
- Faça incisão de 1,5 cm na linha média da parte de trás usando uma tesoura fina que termina no processo spinous mais proeminente (T13). A incisão deve incluir a pele e a fáscia superficial. O uso de tesoura separa a pele e a fáscia superficial de ambos os lados para expor os processos espinhosos e os músculos paraspinos circundantes.
- O uso de dissecção afiada e contundente separa os músculos dos processos espinhosos e da laminae das vértebras T9, T10 e T11.
- Divida bruscamente os ligamentos interspinos entre T9 e T10 e entre T10 e T11 usando uma tesoura fina e, em seguida, extire o processo espinhoso de T10 e realize cuidadosamente a laminectomia T10 bilateralmente para expor a medula espinhal. Certifique-se de que o laminado está completamente extirpado.
- Transecte a medula espinhal usando uma tesoura fina. O sangramento mínimo geralmente ocorre neste ponto devido à transeção dos vasos da medula espinhal. Comprimir a área de sangramento com um aplicador de algodão estéril para alcançar hemostasia. Após confirmar hemostasia completa, feche a pele com suturas contínuas de poliglactina 7-0 910.
- Administre 1 mL de solução salina subcutânea para evitar a desidratação pós-operatória.
- Cuidados pós-operatórios
- Coloque o animal em uma almofada de aquecimento até que ocorra a recuperação completa, em seguida, transfira para uma gaiola apenas para camundongos feridos da medula espinhal.
- Os cuidados pós-operatórios incluem observar e pesar os animais diariamente, e o monitoramento do local de incisão para sinais de infecção por até 7 dias. Administrar solução salina de 1 mL, analgésico (meloxicam 10 mg/kg) e antibiótico (enrofloxacina 5 mg/kg) todos subcutâneos diariamente durante 3 dias.
NOTA: Os usuários finais devem usar a medicação para dor e antibióticos recomendados pelo comitê local de cuidados e uso de animais. - Realize a expressão manual da bexiga (manobra de Credé) a cada 12 horas até que o animal seja capaz de urinar por conta própria (geralmente em 10 a 14 dias). Segure o animal com uma mão e massageie o abdômen inferior com a outra mão, depois sinta e comprime suavemente a bexiga urinária distendida com o dedo indicador e o polegar. A compressão transitória suave deve alternar com relaxamento. Seguindo a expressão manual, lave o abdômen inferior com água da torneira e seque suavemente com papel toalha sem esfregar excessivamente.
NOTA: Um pequeno tamanho da bexiga antes do início da expressão e molhar o abdômen inferior com urina são indícios de que o animal ganhou a capacidade de anular por conta própria. - Para minimizar a perda de peso, forneça enriquecimento nutricional aos camundongos na forma de gel nutritivo e outras guloseimas nutritivas (macios de bacon, crocantes de frutas e mordidas vegetarianas) colocadas no chão da gaiola para fácil acesso NOTA: Neste estudo, os camundongos foram perfumados e as bexigas adquiridas às 8 semanas após o SCI.
- Complicações pós-operatórias
- Minimizar o potencial de ruptura da bexiga devido à expressão manual excessiva da bexiga por não expressar totalmente a bexiga.
- Evitar a excoriação da pele perineal da exposição contínua ao drible de urina de esfíncter incompetente através da lavagem da região perineal com água da torneira. Minimizar a inflamação através da aplicação de pomada antibiótico tripla.
NOTA: A obstrução uretral devido ao coágulo sanguíneo durante o período de hematuria transitória ou do coágulo do sêmen devido à ejaculação retrógrada em camundongos machos pode ocorrer após lesão medular. A obstrução uretral completa em camundongos machos frequentemente culmina em ruptura da bexiga e morte. Em nossa experiência, a frequência de obstrução uretral em camundongos machos que levou à morte foi de 10%.
2. Perfusão e aquisição de tecidos
NOTA: Para análises a jusante de certos tipos de células, como células imunes em tecidos periféricos, é benéfico remover sangue por perfusão no momento da colheita de tecidos, conforme descrito abaixo.
- Administrar anestesia como mencionado no procedimento cirúrgico (etapa 2.2) e confirmar que o animal é adequadamente anestesiado sem resposta de pressão dianteira (o animal é paraplégico, portanto os preços traseiros diminuíram a sensação e a resposta de pinça traseira torna-se irrelevante).
- Coloque o animal na posição supina e cotonhe o abdômen e o peito com 70% de etanol para molhar a pele para evitar que ele entre no local de operação.
- Faça uma laparotomia midline da pelve até o diafragma. Corte o diafragma longe das costelas.
NOTA: Após este passo, a velocidade é importante, pois o diferencial de pressão torácica não existe mais e os pulmões não podem inflar, por isso o animal começa a sufocar. - Corte o tórax aberto ao longo das costelas do lado esquerdo e direito seguindo a borda osso-cartilagem em uma linha paralela ao esterno, começando no diafragma e prosseguindo até a primeira costela.
- Coloque a parede torácica anterior completa sobre a cabeça do animal e fixe-a nesta posição usando grampos de toalha. Não corte a parede torácica anterior, pois isso causará hemorragia severa das duas artérias torácicas internas.
- Corte o pericárdio usando uma tesoura fina.
- Conecte uma agulha de 23 G ao aparelho de perfusão, depois insira-a no ventrículo esquerdo e lentamente na aorta, tomando cuidado para não perfurá-la.
NOTA: O aparelho de perfusão compreende uma bomba de perfusão e uma seringa de 50 mL conectada à tubulação intravenosa. - Inicie a perfusão e faça rapidamente um pequeno corte com a ponta da tesoura fina no átrio direito para drenagem. Tome cuidado para não introduzir bolhas de ar durante a infusão de fluidos.
- Realize a perfusão com solução salina tamponada de fosfato (PBS) executada a 15 mL/min. A perfusão é completa quando a drenagem é clara e a cor clareada do fígado é alcançada(Figura 1).
NOTA: O tempo médio de perfusão foi de 3,5 a 4 min. A perfusão inadequada se manifesta como progressão lenta do branqueamento dos tecidos e geralmente é devido ao posicionamento incorreto da agulha no ventrículo esquerdo. Ajustar a agulha e estender a duração da perfusão por 1 a 2 min garantirá a perfusão adequada dos tecidos. - Descontinua a perfusão e disseque a bexiga livre dos pedículos vasculares e uretra e coloque-a em um tubo de microcentrífuga contendo a solução de Tyrode gelada.
3. Digestão da bexiga urinária no controle e camundongos feridos pela medula espinhal
NOTA: Para formular uma mistura de digestão eficiente, adaptada para a bexiga urinária do rato, procuramos ajustar a unidade de enzimas utilizadas para degradar os componentes predominantes da matriz extracelular, como collagens e ácido hialurônico. Por isso, utilizamos dados de sequenciamento de RNA disponíveis publicamente gerados pelo projeto Mouse ENCODE (BioProject: PRJNA66167) para extrair leituras por quilobase por milhão (RPKM) e Tabula Muris8 para avaliação da expressão espacial dentro da bexiga. Collagens 1, 3 e 6 foram os três genes mais expressos entre 42 colagens diferentes (Figura 2A). A expressão dessas colagens e sinthase de hialunos 1 (Has1) foram observadas principalmente em células musculares e fibroblastos da parede da bexiga(Figura 2B).
- Preparação de buffers e soluções
- Prepare a solução de tyrode de sódio conforme a Tabela 1 em uma garrafa limpa de 500 mL. Adicione 300 mL de ddH2O. A solução é ácida após a preparação. Ajuste o pH para 7.4 usando NaOH. Leve o volume para 500 mL usando H 2 O destilado duplo,depoisaliquot e armazene a -20 °C.
NOTA: Este buffer mantém o equilíbrio pH e osmótico no tampão de digestão e fornece às células água e íons inorgânicos essenciais. Contém magnésio, bem como glicose como fonte de energia. O potássio na solução fornece efeitos protetores sobre a atividade eletromecânica na solução celular isolada. Os sais em pó são higroscópicos e devem ser protegidos contra umidade. Todo o conteúdo da mistura deve ser usado imediatamente após a preparação. O preparo de uma solução de sal concentrada não é recomendado, pois os precipitados podem se formar. A esterilização utilizando filtração (filtro de 0,22 μm) pode ser realizada se as células forem cultivadas após a análise. - Prepare a solução de digestão enzimática em um tubo cônico de 15 mL adicionando volumes e quantidades recomendadas para cada componente(Tabela 2). Adicione solução de tyrode de sódio até 2,5 mL. Vórtice completamente para dissolver.
NOTA: Papain é um protease sulfhydryl da carica papaya látex. Papain tem ampla especificidade e vai degradar a maioria dos substratos de proteína9. Papain tem se mostrado menos prejudicial e mais eficaz do que outros proteases nos protocolos de dissociaçãocelular 10. Fornecemos detalhes sobre os quatro protocolos de dissociação na Tabela 2; observamos a seção de protocolo 3 para suportar a maior viabilidade (93%) de suspensões celulares preparadas a partir da bexiga do rato.
- Prepare a solução de tyrode de sódio conforme a Tabela 1 em uma garrafa limpa de 500 mL. Adicione 300 mL de ddH2O. A solução é ácida após a preparação. Ajuste o pH para 7.4 usando NaOH. Leve o volume para 500 mL usando H 2 O destilado duplo,depoisaliquot e armazene a -20 °C.
- Procedimento de dissociação e preparação de suspensão celular
- Recolher a bexiga de camundongos após a perfusão.
- Perfure a bexiga para liberar o conteúdo, se houver.
- Adicione 100 μL da solução de Tyrode a um tubo vazio de centrífuga de 1,5 mL e tare. Coloque a bexiga no tubo e pese novamente para determinar um peso preciso da bexiga.
- Coloque a bexiga em uma placa de Petri de 10 cm no gelo e adicione 100 μL da solução de Tyrode para picar.
- Usando tesoura cirúrgica, corte peças o menor possível, minimizando o tempo de picar para no máximo 2\u20123 min por bexiga. Se juntar tecido da bexiga de vários animais, pique as bexigas de uma só vez.
- Transfira o tecido da bexiga picado usando uma ponta de tubulação de furo largo em 2,5 mL de tampão de digestão para cada bexiga. Ajuste o volume se várias bexigas estiverem agrupadas. Incubar o tecido na solução de digestão a 37 °C em uma incubadora em uma batedeira por 40 minutos.
- Ao final do período de incubação, remova o tubo de digestão da incubadora. Solução de digestão triturate (pipeta para cima e para baixo) usando uma pipeta de 5 mL por 1 min.
- Centrifugar por 10 min a 350 x g a 4 °C. Remova o supernatante e resuspense a pelota em 1 mL de solução de descolamento celular. Coloque em uma incubadora de 37 °C na batedeira nutator por 10 minutos.
- Centrifugar por 10 min a 350 x g a 4 °C. Remova o supernatante e resuspense a pelota em 1 mL de tampão de lise RBC (1x). Incubar por 1 min.
- Adicione 9 mL PBS para diluir o buffer RBC e parar a lise RBC.
- Passe as células através do coador de células de 70 μm em tubo cônico de 50 mL, usando o êmbolo de uma seringa para raspar levemente o coador celular para garantir a passagem celular completa. Certifique-se de coletar o líquido que passa pelo filtro, mas pode ser pego na parte inferior do coador.
- Centrifugar por 10 min a 350 x g a 4 °C. Remova o supernascimento e resuspense a pelota em 200 μL de tampão de coloração celular (PBS com 2% de FBS).
- Conte as células.
- Imunolabelamento de células específicas para citometria de fluxo
NOTA: Para detectar diferentes tipos de células na bexiga, projetamos um painel de citometria de fluxo de várias cores. Para executar compensação e elaborar uma estratégia de gating adequada, incluímos controles de gorescência não detidos e fluorescência menos um (FMO). Os controles de FMO são importantes para a população positiva, particularmente quando a fração positiva é fraca. O procedimento de coloração é o seguinte.-
Bloqueando receptores FcγRII/III nas células
NOTA: Recomendamos bloquear a ligação inespecífica de anticorpos monoclonais por pré-incubação de células com anticorpos receptores anti-Fc monoclonais, ou proteína Fc recombinante.- Lave as células por centrifugação a 350 x g por 5 min a 4 °C e adicione o tampão de coloração celular.
- Descarte receptores supernascentes e blocos fcγRII/III nas células para evitar manchas de anticorpos não específicos adicionando anticorpos CD16 e CD32 no tampão de coloração celular na diluição de 1:100.
- Incubar no gelo por 10 minutos.
NOTA: Não há necessidade de lavar as células; as células podem ser manchadas logo após esta fase.
-
Manchas para FMOs
NOTA: Um controle de Fluorescência Menos Um (FMO) é um tubo de todos os fluorochromes usados no experimento que contém todos os fluorochromes, exceto um.- Por exemplo, se alguém tiver 4 fluorochromes diferentes (A, B C e D + Anexo V e iodeto de propídio (PI)), prepare os tubos FMO como seguintes. Tubo FMO 1: Anticorpos conjugados com fluorochromes B, C, D + (Anexo V e PI); Tubo FMO 2: Anticorpos conjugados com fluorochromes A, C, D + (Anexo V e PI); Tubo FMO 3: Anticorpos conjugados com fluorochromes A, B, C + (Anexo V e PI); Tubo FMO 4: Anticorpos conjugados com fluorochromes A, B, C, D + (Anexo V); Tubo FMO 5: Anticorpos conjugados com fluorochromes A, B, C, D + (PI).
- Considere a natureza do fluorocromo conjugado para o anticorpo Anexo V.
-
Manchando as células bloqueadas com anticorpos desejados
- Incubar células bloqueadas com misturas mestre apropriadas de anticorpos conjugados com fluoróforo contra as proteínas desejadas por 20 minutos no gelo protegidos da luz. Lembre-se de incluir FMOs.
- Lave as células com 1 mL de tampão de coloração celular adicionado a cada tubo e, em seguida, centrífuga novamente a 350 x g por 5 min a 10 °C.
- Descarte o supernatante e resuspenque a pelota da célula em 200 μL de tampão de coloração celular. Mantenha-se no gelo até que os dados de fluorescência possam ser adquiridos usando um citómetro de fluxo.
-
Aplique a mancha anexa em V/PI.
- Prepare uma solução de trabalho de PI (100 μg/mL) em 1x tampão de ligação anexa, conforme descrito no protocolo do fabricante para o kit de apoptose de célula morta.
- Determine a densidade celular e observe o buffer e o volume em que são armazenados.
- Amostras de centrífugas a 350 x g por 5 min, descartam as células supernascedoras e resuspendas em 1x tampão de ligação de anexação a uma densidade de ~1 x 106 células/mL em um volume de 100 μL.
- Adicione fitc-annexin V (5 μL) e solução de trabalho PI (1 μL) a cada amostra (100 μL), conforme descrito no protocolo do fabricante, e incubar à temperatura ambiente por 15 minutos.
- Adicione 400 μL de 1x tampão de ligação de anexação às amostras, misture por inversão e mantenha no gelo até que flua a citometria.
-
Bloqueando receptores FcγRII/III nas células
- Calibração FACS
-
Citometria de fluxo e controle de pureza
- Inicie a análise da citometria de fluxo medindo as células não manchadas para delinear a morfologia celular e os cochos dos fluorocromes.
- Ajuste a dispersão lateral (SSC) e a dispersão para a frente (FSC) modificando as tensões de cada parâmetro de fluorescência. Meça a emissão de fluorescência em 530 nm (Anexo V) e >575 nm (PI).
- Defina a população negativa na primeira década usando as grades de cada parcela de ponto. Coloque cada controle de FMO no citômetro e corrija a sobreposição espectral até que as medianas negativas e positivas da população estejam alinhadas.
- Medir 100.000 eventos. Medir células manchadas com marcadores específicos e criar portões para populações de células de interesse.
-
Citometria de fluxo e controle de pureza
- Análise de dados
- Coletar os dados do citómetro de fluxo. Abra o software para visualizar o espaço de trabalho para análise.
- Criando um espaço de trabalho
- Importe arquivos FCS arrastando-os para o espaço de trabalho. Os arquivos serão visíveis na seção de amostra e grupo do espaço de trabalho. Clique duas vezes no nome da amostra para abrir o arquivo.
- Use a área de dispersão lateral (SSC-A) para a área de dispersão do eixo y e da frente (FSC-A) para o eixo x(Figura 3A). Clique no ícone para gating de polígono.
- Crie um portão em torno da população celular de interesse no gráfico de pontos clicando para fazer um nó de portão e, em seguida, continue clicando em torno da população celular até completar; clique duas vezes para fechar o portão.
- Nomeie o portão de acordo com a população capturada (por exemplo, "Todas as células") e clique em OK.
NOTA: Clicar duas vezes no portão "Todas as células" abrirá uma nova janela de gráfico mostrando apenas os eventos contidos em "Todas as células". - Ajuste o eixo y do novo gráfico de pontos para SSC-H (altura de dispersão lateral) clicando na seta preta e selecione para alterar o eixo y.
NOTA: Este portões para células únicas (singlets) exclui doublets ou agregados maiores(Figura 3B). Uma vez que as células únicas têm largura e comprimento proporcionais, elas devem ser representadas como uma população na diagonal. As células que caem fora deste portão diagonal são dobras ou agregados maiores. - Clique duas vezes no portão para analisar células necrosas (PI-positivos), apoptótica precoce (Anexo V-positivo, PI-negativo) e apoptótico tardio (Anexo V-positivo, PI-negativo)(Figura 3C).
- Rotule o eixo x como Anexo V e o eixo y como PI.
NOTA: Em alguns casos, onde a intensidade do sinal é baixa, as populações celulares podem parecer ter valores negativos de fluorescência, como resultado da correção para o fundo. Neste caso, recomenda-se realizar uma transformação bi-exponencial. Para fazer isso, clique no T ao lado do eixo y e escolha Personalizar o Eixo. Na nova janela mude a escala para bi-exponencial (Biex), adicione valores negativos aos eixos aumentando a base de largura e clique em Aplicar. Isso melhorará a resolução de eventos com baixa intensidade de sinal. - Mostre os dados como um gráfico de contagem. Use a guia Opção logo abaixo do eixo x e selecione o plot do contador no menu.
- Desenhe um portão Quat na trama para definir 4 populações-alvo discretas.
- Clique no topo da janela para abrir o editor de layout, clicando no editor de layout e arraste populações para cada área separada.
- Coloque parcelas no editor de layout arrastando e soltando populações do espaço de trabalho para a janela do editor de layout.
- Visualizando usando histogramas
- Escolha histograma na guia Opções.
- Aplique um portão para selecionar células anexas V-positivas; alternativamente, populações positivas e negativas podem ser definidas usando a ferramenta bisetorial. A seção amostral deve agora mostrar as diferentes populações que foram formadas e sua hierarquia.
- Para comparar amostras, arraste todos os histogramas em cima um do outro; clique com o botão direito do mouse no histograma e do histograma escolha Stagger Offset.
- Adicionar análises estatísticas
- Abra a guia Estatística clicando duas vezes na população de interesse. Selecione a função para aplicar e o parâmetro envolvido.
- Repita com outras populações, arrastando o ícone Sigma para o nome da população.
- Aplique a análise a todas as amostras selecionando a estratégia de gating da amostra de interesse e arrastando-a para o grupo definido pelo marcador de interesse, por exemplo, Anexo V.
- Criar portões nas amostras de controle do FMO e definir populações negativas e positivas; esta estratégia de gating será aplicada a todo o experimento (Figura 3D\u2012F).
NOTA: Verifique cada amostra individualmente para garantir que a gating esteja correta e modifique quando necessário. - Se as células tiverem sido manchadas com anticorpo marcador (por exemplo, CD45) use o FMO e o portão correspondentes em conformidade.
- Para exportar o layout, clique em Arquivo | | de imagem de exportação Selecione o formato do arquivo (por exemplo, jpg, pdf).
- Clique em Criar tabela para abrir uma janela com a versão final da tabela.
- Exporte a tabela selecionando arquivo | Salve como | Nome de arquivo.
Resultados
Procedimento cirúrgico
O sucesso da transeção da medula espinhal torácica é determinado pela avaliação de uma série de parâmetros, sendo o mais óbvio a paralisia da medula espinhal. O animal se move apenas usando seus membros dianteiros, arrastando seus traseiros. Caso contrário, os níveis de atividade, incluindo alimentação, preparação e alerta são tipicamente normais. Além disso, os animais perdem o controle volicional da bexiga, resultando na necessidade de expressão manual da bexiga pelo investigador a cada 12 h até que o reflexo anulado retorne em 10 a 14 dias após a lesão. Após a eutanásia, sinais adicionais do sucesso da lesão referem-se principalmente ao aumento da relação peso bexiga-corpo, indicativo de remodelação tecidual. A análise histológica revela a hiperplasia dentro dos compartimentos musculares urotelial e liso3.
Preparação de suspensão de célula única
Utilizando dados de expressão disponíveis publicamente, foi determinado o enriquecimento do tecido da bexiga para proteínas matricias extracelulares(Figura 2) e utilizado para informar a formulação da mistura de digestão. Como as collagens são componentes-chave da parede da bexiga11,12, primeiro procuramos determinar o colágeno mais abundante na bexiga do mouse usando conjuntos de dados de perfil de RNA gerados pelo projeto Mouse ENCODE13. Nossa análise mostrou que o colágeno 1A1, o colágeno 3A1, o colágeno 1A2 e o colágeno 6A1 são os tipos mais abundantes de colágeno dentro da bexiga do rato(Figura 2A). Também usamos o Tabula Muris (um compêndio de dados de transcriptome de célula única do mouse (Mus musculus))8 para determinar o nível de expressão mRNA de collagens 1, 3, 6 e hialuuronan. Os dados permitem a comparação direta e controlada da expressão genética em tipos celulares compartilhados entre tecidos. Esta análise revelou que a expressão desses componentes da matriz extracelular é mais prevalente nos tipos de células mesenquimais do que no urotélio(Figura 2B).
Efeito da dissociação na viabilidade de células isoladas da bexiga
A análise da citometria de fluxo demonstrou que a digestão enzimática utilizando os 4 protocolos diferentes produziu viabilidade de 83%, 86%, 93% ou 90%, respectivamente. Assim, o protocolo seção 3 foi considerado mais valioso para a preservação da viabilidade celular. Observou-se também que aproximadamente 4% das células eram necroséticas (PI+/AnnexinV-) ( Figura4A). Essas observações enfatizam a eficiência do protocolo de digestão e o benefício subsequente na viabilidade celular.
Efeito da lesão medular em diferentes populações de células na bexiga
Observamos um aumento significativo no número total de células nas bexigas de camundongos SCI em comparação com os controles. O padrão das parcelas de pontos obtidas das bexigas SCI também foi ligeiramente diferente consistente com a remodelação contínua do órgão devido à lesão medular(Figura 4B: primeira coluna). Em comparação com os controles, as bexigas dos animais SCI apresentaram um aumento significativo nas células CD45 positivas.
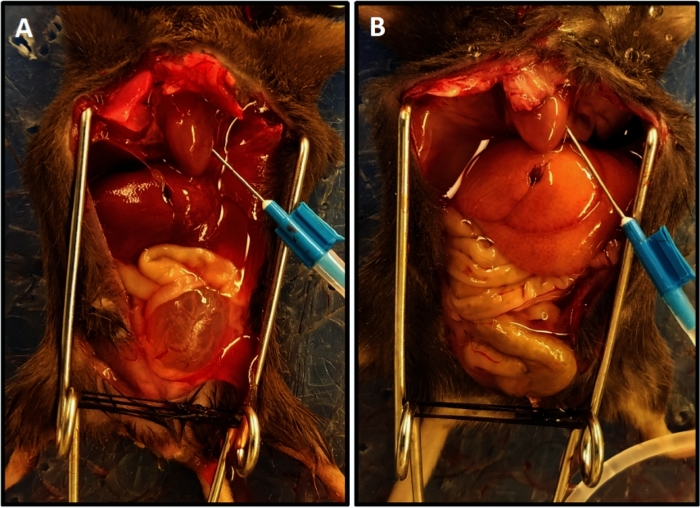
Figura 1: Conclusão representativa da perfusão com cor iluminada do fígado. (A) Demonstra a cor do fígado no início da perfusão. (B) Mostra a cor do fígado clareado no final da perfusão. O camundongo em (A) fez transeção da medula espinhal duas semanas antes da perfusão resultando em hipertrofia da bexiga e sua saliência fora da pelve ao contrário do camundongo em (B) que não tinha lesão medular; neste caso, a bexiga é pequena e escondida na pélvis. Clique aqui para ver uma versão maior desta figura.
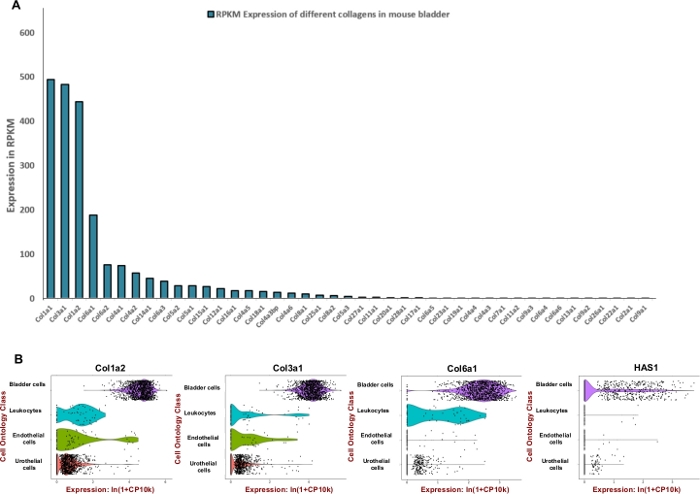
Figura 2: Expressão transcriômica de componentes de matriz extracelular (ECM) na bexiga do rato. (A) Gráfico de barras de 43 tipos diferentes de colágeno. A expressão é indicada por Reads Per Kilobase de transcrição, por milhão de leituras mapeadas (RPKM) (os dados são coletados do BioProject: PRJNA66167)14. (B) Parcelas de violino de expressão genética em tipos celulares obtidas a partir da contagem microfluídica de gotículas 3'-end em um pool de amostras de bexiga urinária dissociada masculina e feminina (macho e fêmea). As contagens foram normalizadas para cada célula usando o logaritmo natural de mais de 1 milhão de ln (CPM+1)8. Uma pseudoconta de 1 CPM foi adicionada antes de tomar logaritmos. Clique aqui para ver uma versão maior desta figura.
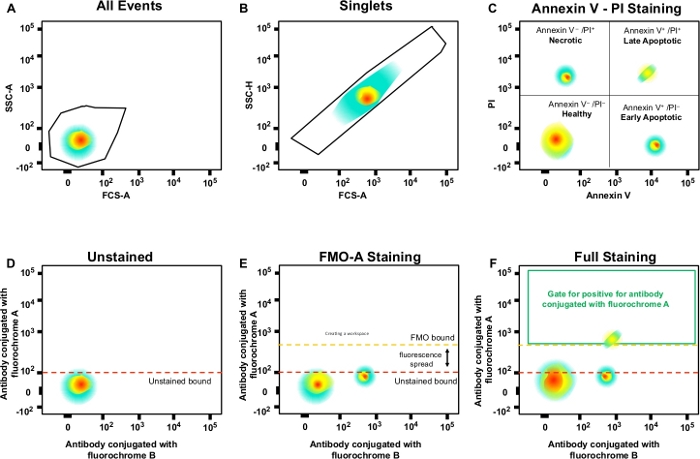
Figura 3: Estratégia de gating e controles FMO para determinar a propagação da fluorescência. (A)Seleção da população celular. (B) Estratégia de gating para singlets. (C) Gating para células apoptóticas necróticas e precoces e tardias usando anticorpo pi e anexo V. (D\u2012F) Um gráfico de ponto esquemático de citometria de fluxo multicolor (por exemplo, anticorpos conjugados com A, B, C, D fluorochromes + (Anexo V e PI). Isso mostra a fluorescência espalhada no anticorpo com fluorocromo um canal mostrado pelo controle FMO em comparação com um controle não manchado. A linha pontilhada laranja representa o limite de ogmização do FMO em comparação com o limite não localizado em vermelho. Clique aqui para ver uma versão maior desta figura.
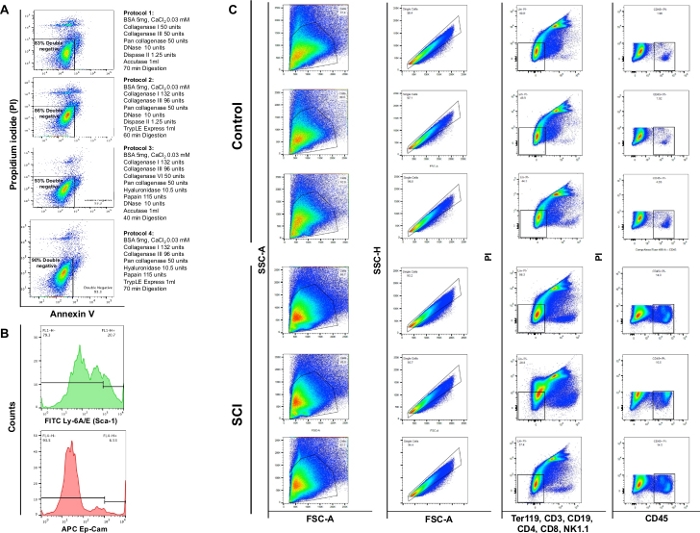
Figura 4: Citometria de fluxo de diferentes tipos de células na bexiga. (A) Anexo V/PI gráficos de fluxo de coloração dupla. As diferentes combinações de enzimas e produtos químicos utilizados para cada protocolo são representadas em frente ao enredo de viabilidade correspondente. Esses dados demonstram que a maior viabilidade foi obtida com a seção de protocolo 3. (B) Histogramas representativos ilustrando a intensidade de Ly-6A/E (Sca-1) e CD326 (Ep-CAM) detectados em canais únicos. (C) Efeito de SCI na população celular da bexiga do rato. O painel superior mostra resultados de coloração em três bexigas dissociadas obtidas a partir do controle de camundongos não cirúrgicos e painel inferior mostra os resultados da coloração em três animais com SCI. A primeira coluna é a população celular total. A segunda coluna mostra a seleção de gating singlet. A terceira coluna mostra a subpopulação de células vivas que são negativas para células B, células T e células NK. A quarta coluna mostra a coloração de células vivas positivas para CD45. Clique aqui para ver uma versão maior desta figura.
| Componente | Quantidade (para 500 mL) | Molarity |
| Nacl | 4.091 g | 140 mM |
| Kcl | 0,186 g | 5 mM |
| MgCl2 | 0,0476 g | 1 mM |
| D-Glicose | 0,9 g | 10 mM |
| HEPES | 1,19 g | 10 mM |
Tabela 1: Componentes para a preparação da solução de Tyrode. Os componentes indicados são para a preparação da solução de 500 mL Tyrode.
| Componente | Quantidade | Protocolo seção 1 | Protocolo seção 2 | Seção de protocolo 3 | Seção de protocolo 4 |
| Bsa | 5 mgs | Sim | Sim | Sim | Sim |
| CaCl2 | 0,03 mM | Sim | Sim | Sim | Sim |
| Colagenase Tipo I | 132,5 unidades | Sim | Sim | Sim | Sim |
| Colagenase Tipo III | 96,4 unidades | Sim | Sim | Sim | Sim |
| Colagenase Tipo VI | 50 unidades | - | - | Sim | - |
| Dnase | 10 unidades | Sim | Sim | Sim | - |
| Papaína | 115 unidades | - | - | Sim | Sim |
| Pan Collagenase | 50 unidades | - | - | Sim | Sim |
| Hialuronidase | 10,5 unidades | - | - | Sim | Sim |
| Dispase II | 1,25 unidades | Sim | Sim | - | - |
| Solução de dissociação celular | 1 mL | Sim | - | Sim | - |
| Enzima recombinante | 1 mL | - | Sim | - | Sim |
Tabela 2: Componentes para a preparação do tampão de digestão. Os componentes indicados são para a preparação de 2,5 mL de mistura de digestão (1 U catalisa a hidrólise de 1 μmol um substrato por minuto a 37 °C. Consulte a folha de dados do produto para definição de unidade de cada enzima).
Discussão
O modelo de lesão medular do camundongo descrito aqui fornece um método reprodutível para criar uma obstrução funcional da saída da bexiga devido à perda de coordenação entre a contração da bexiga e o relaxamento do esfíncter uretral externo. Isso, por sua vez, evoca uma profunda remodelação da parede da bexiga logo após 2 semanas após a lesão caracterizada pela expansão dos compartimentos musculares urotelial e liso. As etapas críticas na implementação do modelo SCI em roedores incluem (i) atenção rigorosa à expressão manual da bexiga durante o período de choque espinhal que se segue para 10\u201214 dias após a lesão; (ii) enriquecimento nutricional para minimizar a perda de peso; e (iii) mitigação do potencial de escaldação de urina particularmente para experimentos que vão além do retorno do vazio reflexo. As limitações do modelo incluem o potencial de oclusão uretral em camundongos a partir de coágulos sanguíneos durante o período de hematuria transitória, e adicionalmente em camundongos machos de coagulo de semen após ejaculação retrógrada após a cirurgia.
A abordagem de dissociação tecidual descrita aqui ilustra a importância de considerar mudanças estruturais nos tecidos decorrentes do insulto experimental, neste caso uma remodelação significativa do tecido após a SCI que pode influenciar as análises a jusante. Com o aumento das análises de células únicas, é fundamental garantir que as diferenças observadas na expressão genética não sejam simplesmente resultado de perturbações induzidas por dissociação, mas sejam verdadeiramente representativas das mudanças biológicas subjacentes relevantes para o modelo da doença. O uso de dados de expressão disponíveis publicamente nos permitiu modificar a formulação de buffers de digestão para garantir uma digestão eficaz da matriz extracelular, maximizando a viabilidade. Modificações adicionais que poderiam ser consideradas em aplicações futuras incluem a adição de actinomicina D, para interromper a transcrição de genes iniciais imediatos sensíveis ao protocolo de dissociação15.
A técnica de pipetação é crucial ao dissociar tecido ou transferir células que já estão em suspensão. Para reduzir os danos físicos às células das forças de tesoura, é importante pipeta suavemente e lentamente durante a ressuspensão celular. É geralmente recomendado usar pontas de pipeta largas. Se usar as pontas padrão, é particularmente importante que as suspensões de células pipetas suavemente evitem forças de tesoura que de outra forma danificariam as células. O uso de filtros celulares é inevitável neste protocolo, no entanto, a concentração celular pode diminuir em 20% ou mais, acompanhada de uma perda de volume de 100 μL ou mais. Recomendamos que a concentração celular seja determinada após o esforço para garantir uma contagem precisa de células.
Na citometria de fluxo, os controles de FMO fornecem uma medida de fundo devido à sangria do sinal de picos de emissões sobrepostos. Eles não são uma medida de ligação de anticorpos inespecíficos, ou coloração de fundo que pode estar presente quando um anticorpo é incluído nesse canal. Para explicar a vinculação de anticorpos nãopecíficos, é preciso incluir controles isótipos apropriados; para a coloração de fundo, é preciso incluir controles negativos. Juntos, esses controles garantem uma medição precisa das populações celulares.
Divulgações
Nenhum conflito de interesses declarado.
Agradecimentos
Este trabalho foi apoiado por subvenções dos Institutos Nacionais de Saúde (R01 DK077195 a R.M.A, R01 DK104641 a R.M.A e D.R.B). Reconhecemos informações valiosas do Dr. Stuart Orkin na Divisão de Hematologia/Oncologia, Hospital Infantil de Boston, Departamento de Pediatria, Harvard Medical School e no Instituto de Câncer Dana-Farber. Também reconhecemos o apoio de Kyle Costa no cuidado pós-operatório de camundongos, Mary Taglienti e Dr. Habiballah Shojaeisaadi (Dr. Yang Shi Laboratory, Departamento de Pediatria, Divisão de Medicina Recém-Nascida, Departamento de Pediatria, Divisão de Medicina Recém-Nascida, Hospital Infantil de Boston, Harvard Medical School) para assistência técnica e discussões úteis.
Materiais
| Name | Company | Catalog Number | Comments |
| 2.5 X Magnifying Loupes | |||
| 7-0 Vicryl suture, 6.5mm needle 3/8 circle | ETHICON | J546 | |
| 70 μm Cell Strainer | Thermofisher | 22363548 | |
| Accutase in BPBS, 0.5mM EDTA | Millipore | SCR005 | |
| Aerosol Filter Wide Orifice Pipettor Tips (1000 µL) | VWR | 89049-168 | |
| Aerosol Filter Wide Orifice Pipettor Tips (1000 µL) | VWR | 89049-168 | |
| APC anti-mouse CD326 (Ep-CAM), rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 118213 | |
| BB515 Rat Anti-Mouse CD45, rat monoclonal, IgG2b, κ, Clone 30-F11 | BD Biosciences | 564590 | |
| BONN Micro Dissecting Forceps, Straight, 1x2 teeth, 3.75" length, 0.3mm tip width, 0.12mm teeth | ROBOZ Surgical Instrument Company, Inc. | RS-5172 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Bovine Serum Albumin | Sigma | A9647-100G | |
| CaCl2 | Sigma | 2115-250ML | |
| CASTROVIEJO Micro Suturing Needle Holder, Straight with lock, 5.75" length | ROBOZ Surgical Instrument Company, Inc. | RS-6412 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Cell Counting Kit, 30 dual-chambered slides, 60 counts, with trypan blue | Biorad | 1450003 | |
| Cell Staining Buffer | BioLegend | 420201 | |
| Collagenase from Clostridium histolyticum | Sigma | C0130-1G | |
| Collagenase Type I | Worthington Biochemical Corporation | LS004196 | |
| Collagenase Type III | Worthington Biochemical Corporation | LS004182 | |
| Collagenase, Type 6 | Worthington Biochemical Corporation | LS005319 | |
| Dead Cell Apoptosis Kit with Annexin V Alexa Fluor 488 & Propidium Iodide (PI) | Thermofisher | V13241 | |
| Dispase II | Sigma | D4693-1G | |
| DNase | Sigma | DN25-1G | |
| Enrofloxacin (Baytril) | Bayer Health Care LLC, | NADA # 140-913 Approved by FDA. Lot No.: AH01CGP | 2.27% Injectable Solution |
| Falcon 15 ml conical centrifuge tubes | Fisher Scientific | 352096 | |
| Falcon 50 ml conical centrifuge tubes | Fisher Scientific | 352070 | |
| FITC anti-mouse Ly-6A/E (Sca-1) Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 122505 | |
| Hyaluronidase from sheep testes, Type II | Sigma | H2126 | |
| MACS SmartStrainers (100 µm) | Miltenyi Biotec, Inc. | 130-110-917 | |
| McPHERSON-VANNAS, Micro Dissecting Spring Scissors, Straight, 4" length, 0.15mm tip width | ROBOZ Surgical Instrument Company, Inc. | RS-5630 | ROBOZ Surgical Instrument Company, Inc., Gaithersburg MD |
| Meloxicam | Patterson Veterinary | 07-891-7959 | |
| Papain | Worthington Biochemical Corporation | LS003119 | |
| PE/Cy5 anti-mouse CD19 Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 115509 | Dump Channel |
| PE/Cy5 anti-mouse CD3ε Antibody, Armenian hamster monoclonal, IgG, affinity purified | BioLegend | 100309 | Dump Channel |
| PE/Cy5 anti-mouse CD4 Antibody, rat monoclonal, IgG2b, κ, affinity purified | BioLegend | 100409 | Dump Channel |
| PE/Cy5 anti-mouse CD8a Antibody, rat monoclonal, IgG2a, κ, affinity purified | BioLegend | 100709 | Dump Channel |
| PE/Cy5 anti-mouse NK-1.1 Antibody, mouse monoclonal, IgG2a, κ, affinity purified | BioLegend | 108715 | Dump Channel |
| PE/Cy5 anti-mouse TER-119/Erythroid Cells Antibody, IgG2b, κ, affinity purified | BioLegend | 116209 | Dump Channel |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block), rat monoclonal, IgG2b, κ, Clone 2.4G2 | BD Biosciences | 553141 | |
| RBC Lysis Buffer (10X) | BioLegend | 420301 | |
| Red Blood Cell Lysis Buffer 1x | Biolegend | 420201 | |
| Screw-Cap microcentrifuge tubes, 1.5 ml | VWR | 89004-290 | |
| TC20 Automated Cell Counter | Biorad | 1450102 | |
| Triple antibiotic ointment (neomycin/polymyxin B/ bacitracin) | Patterson Veterinary | 07-893-7216 | skin protectant |
| TrypLE Select Enzyme (10X), no phenol red | Thermofisher | A1217701 | |
| Vetropolycin eye ointment | Dechra Veterinary Products | NADA # 065-016. Approved by FDA. | protect eyes during anesthesia |
Referências
- Grange, C., et al. Phenotypic characterization and functional analysis of human tumor immune infiltration after mechanical and enzymatic disaggregation. Journal of Immunological Methods. 372 (1-2), 119-126 (2011).
- van den Brink, S. C., et al. Single-cell sequencing reveals dissociation-induced gene expression in tissue subpopulations. Nature Methods. 14 (10), 935-936 (2017).
- Seth, A., et al. The impact of discrete modes of spinal cord injury on bladder muscle contractility. BMC Urology. 13, 24 (2013).
- Doyle, C., et al. Inosine attenuates spontaneous activity in the rat neurogenic bladder through an A2B pathway. Scientific Reports. 7, 44416 (2017).
- Gheinani, A. H., et al. Characterization of miRNA-regulated networks, hubs of signaling, and biomarkers in obstruction-induced bladder dysfunction. JCI Insight. 2 (2), 89560 (2017).
- Gheinani, A. H., et al. Concordant miRNA and mRNA expression profiles in humans and mice with bladder outlet obstruction. American Journal of Clinical and Experimental Urology. 6 (6), 219-233 (2018).
- Krishna, V., et al. A contusion model of severe spinal cord injury in rats. Journal of Visualized Experiments. (78), e50111 (2013).
- The Tabula Muris Consortium. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris. Nature. 562 (7727), 367-372 (2018).
- Gray, C. J., Boukouvalas, J., Szawelski, R. J., Wharton, C. W. Benzyloxycarbonylphenylalanylcitrulline p-nitroanilide as a substrate for papain and other plant cysteine proteinases. Biochemical Journal. 219 (1), 325-328 (1984).
- Feodorova, Y., Koch, M., Bultman, S., Michalakis, S., Solovei, I. Quick and reliable method for retina dissociation and separation of rod photoreceptor perikarya from adult mice. MethodsX. 2, 39-46 (2015).
- Aitken, K. J., Bagli, D. J. The bladder extracellular matrix. Part I: architecture, development and disease. Nature Reviews Urology. 6 (11), 596-611 (2009).
- Aitken, K. J., Bagli, D. J. The bladder extracellular matrix. Part II: regenerative applications. Nature Reviews Urology. 6 (11), 612-621 (2009).
- The ENCODE Project Consortium. An integrated encyclopedia of DNA elements in the human genome. Nature. 489 (7414), 57-74 (2012).
- Yue, F., et al. A comparative encyclopedia of DNA elements in the mouse genome. Nature. 515 (7527), 355-364 (2014).
- Wu, Y. E., Pan, L., Zuo, Y., Li, X., Hong, W. Detecting Activated Cell Populations Using Single-Cell RNA-Seq. Neuron. 96 (2), 313-329 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados