A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إعداد Tunable خارج الخلية مصفوفة microenvironments لتقييم شوان الخلية الظاهري مواصفات
In This Article
Summary
تهدف هذه المنهجية إلى توضيح الآليات التي تقوم بها الإشارات المصفوفة خارج الخلية مثل صلابة الركيزة وتكوين البروتين ومورفولوجيا الخلية بتنظيم النمط الظاهري للخلية Schwann (SC).
Abstract
تفتقر إصابات الجهاز العصبي المحيطي الرضي (PNS) حاليًا إلى العلاجات المناسبة لاستعادة التعافي الوظيفي الكامل. تلعب خلايا Schwann (SCs) ، كخلايا دبقية رئيسية للـ PNS ، دورًا حيويًا في تعزيز تجديد PNS عن طريق إلغاء التنوع في النمط الظاهري للخلية المتجددة بعد الإصابة. ومع ذلك، فإن حالة اللجان SCs غير المتمايزة تشكل تحدياً للحفاظ على الفترة الزمنية اللازمة للتجديد وتتأثر بالتغييرات في المصفوفة المحيطة خارج الخلية (ECM). ولذلك، فإن تحديد التفاعل المعقد بين اللجان الإقليمية واختلاف نظام إدارة المحتوى لتوفير إشارات إلى الإمكانات التجديدية للSCS أمر ضروري. لمعالجة هذا، تم إنشاء استراتيجية حيث تم امتصاص بروتينات ECM مختلفة على الركيزة بوليديميثيلوكسيكان (PDMS) قابلة للتواؤم (PDMS) التي وفرت منصة حيث يمكن تعديل صلابة وتكوين البروتين. تم زرع SCs على ركائز قابلة للتواؤم وتم قياس الوظائف الخلوية الحرجة التي تمثل ديناميات النمط الظاهري SC. لتوضيح التفاعل بين التعبير البروتين SC ومورفولوجيا الخلوية، تم استخدام كثافة البذر المختلفة للSCs بالإضافة إلى أنماط الخلايا المطبوعة الدقيقة الفردية وتتميز بتلوين الفلوروسوس المناعي واللطخة الغربية. وأظهرت النتائج أن الخلايا مع منطقة انتشار أصغر ومدى أعلى من استطالة الخلوية عززت مستويات أعلى من علامات الظهارة التجدد SC. هذه المنهجية لا تبدأ فقط في كشف العلاقة الهامة بين ECM والوظيفة الخلوية للSCs ، ولكنها توفر أيضًا إرشادات لتحسين المواد الحيوية في المستقبل في إصلاح الأعصاب المحيطية.
Introduction
لا تزال إصابات الجهاز العصبي المحيطي (PNS) تشكل تحديًا سريريًا كبيرًا في مجال الرعاية الصحية من خلال المساس بنوعية الحياة للمرضى وخلق تأثير كبير من خلال العديد من العوامل الاجتماعية والاقتصادية1،2. خلايا Schwann (SC)، كالخلايا الدبقية الرئيسية في PNS، وتوفير الإشارات الجزيئية والمادية اللازمة للحث على تجديد PNS والمساعدة في التعافي الوظيفي في إصابات الفجوة قصيرة. ويرجع ذلك إلى قدرة رائعة من SCs على إلغاء التمايز في "إصلاح" الخلية الظاهرية من myelinating أو Remak النمط الظاهري3. الإصلاح SC هو نوع ظاهري خلية مميزة في عدة طرق. بعد الإصابة، يزيد SCs من معدل انتشارها من خلال الدخول من جديد في دورة الخلية والبدء في التعبير عن العديد من العوامل النسخية لتسهيل إعادة التشجير. هذه العوامل، مثل ج يونيو و P75 NTR، هي upregulated في حين أن علامات SC myelinating، مثل البروتين الأساسي myelin (MBP)، هي downregulated4،5. وبالإضافة إلى ذلك، SCs تغيير مورفولوجيا لتصبح ممدود ومحاذية مع بعضها البعض لتشكيل عصابات Büngner عبر موقع الإصابة6. وهذا يوفر آلية التوجيه المادي لمحور عصبي لتمتد إلى الهدف الصحيح7. ومع ذلك، على الرغم من القدرة التي تمتلكها SCs لتعزيز تجديد الأعصاب في إصابات الفجوة القصيرة، لا تزال نتيجة الانتعاش الوظيفي ضعيفة في الإصابات الخطيرة. ويرجع ذلك جزئيا إلى فقدان الإشارات التوجيهية مصفوفة خارج الخلية (ECM)، فضلا عن عدم قدرة SCs للحفاظ على النمط الظاهري التجديدي على مدى فترات طويلة من الوقت8.
ترتبط عملية تجديد العصب والتعافي ارتباطًا وثيقًا بحالة الصفيحة القاعدية بعد الإصابة. لامينا القاعدية هي طبقة من ECM حول العصب الذي يسهل التوجيه ويوفر إشارات ECM ملزمة لaxons وSCs في الحالات التي لا تزال سليمة بعد الإصابة9. حالة ECM وقدرتها على تقديم الإشارات ملزمة مصفوفة للخلايا أمر حيوي ومهم وقد تم استكشافها سابقا في مجموعة متنوعة من سياقات مختلفة10،11،12،13،14. على سبيل المثال، فقد تبين أن صلابة من ECM يمكن أن توجه وظائف الخلية مثل انتشار والتمايز11و15و16. تكوين ECM يمكن أن يؤدي أيضا إلى استجابة خلوية متميزة وتنظيم سلوكيات الخلية مثل الهجرة والتمايز من خلال مسارات الإشارات داخل الخلايا17,18. وعلاوة على ذلك، فإن مورفولوجيا الخلية، بما في ذلك منطقة الانتشار والإطالة الخلوية، تلعب دوراً رئيسياً في تنظيم الوظيفة ويمكن أن تحكمها الإشارات التي تربط ECM19،20. وقد ركزت العديد من الدراسات السابقة على الخلايا الجذعية التي تميز إلى أنساب محددة، ولكن SCs تمتلك قدرة مماثلة لتغيير النمط الظاهري من homeostatic، SC الكبار داخل العصب الصحي، إلى SC إصلاح قادرة على إفراز البروتينات وعوامل النمو مع إعادة عرض ECM بعد إصابة الأعصاب5،21. ولذلك، من الأهمية بمكان تحديد الآليات التي تقوم عليها العلاقة بين القدرة التجديدية الفطرية SC وإشارات ملزمة ECM للبصيرة لتسخير هذه القدرة في نهاية المطاف لتجديد الأعصاب.
لمعالجة هذا، قمنا بتطوير منهجية مفصلة لإنتاج الركيزة ثقافة الخلية حيث يمكن ضبطها بسهولة صلابة الميكانيكية ونوع يغاند في نطاقات ذات الصلة من الناحية الفسيولوجية. تم اختيار البوليديميثيل سيلوكسان (PDMS) كركيزة بسبب ميكانيكاها القابلة للتواؤم للغاية مقارنة بجل polyacrylamide ، حيث يبلغ الحد الأقصى لم ومعامل يونغ حوالي 12 كيلو باسكال على النقيض من PDMS في حوالي 1000 كيلو باسكال22،23،24. وهذا مفيد للعمل في متناول اليد، كما أظهرت الدراسات الحديثة معامل يونغ من العصب الوركي أرنب يمكن أن تتجاوز 50 كيلو باسكال أثناء التنمية، مما يشير إلى أن مجموعة من صلابة الأعصاب داخل PNS أوسع مما سبق فحصها. البروتينات المختلفة قادرة على الامتزاز على ركائز PDMS لتحليل التنظيم الجمعي للميكانيكا والليغانات على سلوك SC. وهذا يسمح للتحقيق في الإشارات البيئة الدقيقة متعددة موجودة في عملية تجديد PNS ومقارنة درجة عالية من سمك التونة للعمل مع التركيز فقط على صلابة الركيزة25. علاوة على ذلك ، تتوافق ركائز ثقافة الخلايا المهندسة هذه مع العديد من طرق التحليل الكمي مثل الكيمياء المناعية ، واللطخة الغربية ، و تفاعل البوليميراز الكمي المتسلسل (q-PCR).
تعد منصة ثقافة الخلايا المهندسة هذه مناسبة للغاية لتحليل المسارات الآلية بسبب ارتفاع مستوى قابلية التونة الفردية لكل إشارة مرتبطة بـ ECM. وبالإضافة إلى ذلك، يمكن تحقيق طرق شعبية لmicropatterning الخلية، بما في ذلك الطباعة microcontact، على ركائز للسماح للالتصاق الخلوية التي تسيطر عليها لتحليل شكل الخلية فيما يتعلق غيرها من الإشارات ECM ملزمة24. وهذا أمر بالغ الأهمية لأن الركائز الخطية المنقوشة، التي تعزز استطالة في مجموعات الخلايا، توفر أداة لمحاكاة ودراسة SCs ممدود وتجديدي داخل نطاقات Büngner أثناء تجديد الأعصاب. علاوة على ذلك، مورفولوجيا الخلوية هو منظم قوي لوظائف الخلايا المتعددة ويمكن أن يحتمل أن يدخل نتائج تجريبية محيرة إذا لم يتم التحكم26،27. ويجري الآن إيلاء اهتمام كبير للآليات التي تحكم النمط الظاهري التجديدي SC كما ينظمها العظة ECM28,29,30. وهذا أمر ضروري لتوفير نظرة ثاقبة في تصميم المواد الحيوية التي يمكن تطبيقها كقناة توجيه الأعصاب للمساعدة في تجديد العصب PNS. ويمكن في نهاية المطاف تطبيق هذه البروتوكولات التفصيلية كأداة محتملة لفك آليات SC ودالة نوع الخلية الأخرى كما تنظمها الإشارات المقيدة في ECM.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. Tunable خلية ثقافة الركيزة إعداد وتوصيف
- إعداد الركيزة
- اخلطي مِن قاعدة PDMS والعوامل المعالجة باستخدام طرف ماصة بقوة عند نسبة تتراوح بين 10:1 و 60:1 حتى يتم تشتيت الفقاعات بشكل متجانس داخل الخليط. إزالة الفقاعات باستخدام الجفاف الفراغ حتى يتم تبديد فقاعات.
ملاحظة: أثناء البلمرة PDMS، يعالج وكيل crosslinks مع مِسِر الأساس لتوفير الخصائص الميكانيكية المرغوبة النهائية للبوليمر. يمكن تعديل نسب التشابك المتقاطعة لتغيير صلابة PDMS. - ضع قطرة (~ 0.2 مل) من خليط PDMS المجفف على غطاء مربع أو دائري (على سبيل المثال، 22 مم × 22 مم) وتناوب الغطاء على معطف دوران في 2500 دورة في الدقيقة لمدة 30 ثانية.
- احتضان الغطاء في فرن إما في 60 درجة مئوية لمدة 1-2 ساعة أو درجة حرارة الغرفة بين عشية وضحاها لPMS لترسيخ.
- علاج الغطاء باستخدام الأشعة فوق البنفسجية الأوزون نظافة لمدة 7 دقائق (الطول الموجي للأشعة فوق البنفسجية: 185 نانومتر و 254 نانومتر) لزيادة المياه السطحية. وضعه في طبق 6-جيدا معقمة.
- قبل استخدام لثقافة الخلية، احتضان ركائز في 70٪ الإيثانول لمدة 30 دقيقة على الأقل.
تنبيه: UV-الأوزون يمكن أن تولد الأوزون الضارة للبشر. العمل في غطاء الدخان الكيميائي أو مع شكل من أشكال التهوية. - غمر الأغطية في محلول البروتين (10 ميكروغرام / مل الكولاجين الأول، فيبرومينكتين، أو لامينين) لمدة 60 دقيقة في حاضنة معقمة في 37 درجة مئوية.
ملاحظة: بعد المعالجة فوق البنفسجية الأوزون، قد لا يزال سطح PDMS مسعور. تدوير لوحة جيدا لضمان تغطية كل غطاء مع محلول البروتين. - استلهم محلول البروتين واغسل الغطاء مع الفوسفات المالحة المخزنة (PBS) 3x.
- إعادة تعليق RT4-D6P2T خط الخلية Schwann (SCs) من طبق passaging باستخدام حل EDTA المتاحة تجاريا (1x) مع 2.5٪ التربسين وعدد الخلايا مع قياس ال hemocytometer. بذور SCs على سطح PDMS قابلة للتواؤم في كثافة الخلية المطلوبة. قد تختلف كثافة البذر SC لكل تطبيق مختلف.
- الحفاظ على الخلايا في المعلمات الخلية ثقافة المطلوب (90٪ الرطوبة، 5٪ CO2،37 درجة مئوية، الخ) لطول التجربة. استخدام Dulbecco معدلة النسر المتوسط (DMEM) تكملها 10٪ مصل الأبقار الجنين (FBS) و 1٪ البنسلين-الستربتوميسين كما المتوسطة ثقافة الخلية.
- اخلطي مِن قاعدة PDMS والعوامل المعالجة باستخدام طرف ماصة بقوة عند نسبة تتراوح بين 10:1 و 60:1 حتى يتم تشتيت الفقاعات بشكل متجانس داخل الخليط. إزالة الفقاعات باستخدام الجفاف الفراغ حتى يتم تبديد فقاعات.
- إعداد الركيزة الصغيرة
- رسم الهندسة المطلوبة ومناطق لاصقة الخلية (900 ميكرومتر2، 1600 ميكرومتر2 و 2500 μm2) باستخدام الكمبيوتر بمساعدة تصميم (CAD) البرمجيات. إنشاء قناع ضوئي كروم على أساس تلك الأنماط من مورد تجاري.
- في غرفة نظيفة أو بيئة خالية من الغبار، واستخدام تقنيات الطباعة الضوئية القياسية لتصنيع رقائق السيليكون (بروتوكولات مفصلة في مكان آخر31). وفيما يلي بارامترات حاسمة لهذا التطبيق الخاص: التصوير الضوئي: SU-8 2010؛ وSS-8 2010؛ وSS-8 2010؛ وSS-8 2010؛ وSS-8 2010؛ وSS-8 20 تدور الصورة الفوتوغرافية لتفريق photoresist: 500 دورة في الدقيقة لمدة 10 s مع تسارع 100 دورة في الدقيقة / ث، ثم 3500 دورة في الدقيقة لمدة 30 s مع تسارع 300 دورة في الدقيقة / الثانية؛ التعرض للطاقة من الأشعة فوق البنفسجية الخفيفة: 130 mJ / سم2.
ملاحظة: ارتفاع الأنماط على رقائق السيليكون هو حوالي 10 ميكرومتر بعد هذه المعلمات. ويمكن رؤية الشقوق المحتملة حول الحافة خارج الأنماط المستطيلة أو الثلاثية باستخدام مجهر خفيف بعد الخطوة 1.2.2. الخبز رقاقة السيليكون في 190 درجة مئوية لمدة 30 دقيقة يساعد على القضاء على الشقوق. - ضع رقاقة السيليكون المنقوشة داخل قطر دائري 150 مم × 15 مم إرتفاع طبق بيتري وصب دي غازسد PDMS (نسبة الخلط 10:1) كما هي معدة في الخطوة 1.1.1 على رقاقة السيليكون.
ملاحظة: تأكد من أن سمك PDMS لا يقل عن 5 مم لسهولة المعالجة أثناء خطوات الطباعة الدقيقة. - ترسيخ PDMS على رقاقة السيليكون في فرن في 60 درجة مئوية بين عشية وضحاها. السماح لـ PDMS بتبريد درجة حرارة الغرفة. قطع الطوابع بدقة من 30 مم × 30 ملم المربعات التي تحتوي على أنماط الصحيح من رقاقة السيليكون باستخدام مشرط الجراحية. لا تضر رقاقة السيليكون.
ملاحظة: يمكن إعادة استخدام رقائق السيليكون عدة مرات في هذه المرحلة لإنتاج المزيد من الطوابع بعد التنظيف مع ايزوبروبانول. - تعقيم الطوابع PDMS وأغطية قابلة للتوابل (أعدت في الخطوة 1.1.1 إلى 1.1.3) عن طريق غمرها في 70٪ الإيثانول لمدة 30 دقيقة.
- لتأكيد فعالية micropattern من قبل الطوابع PDMS بعد الطباعة الدقيقة ، وتجفيف سطح الطوابع PDMS باستخدام تيار الهواء المصفاة والماصات 50 ميكروغرام / مل BSA (تكساس الأحمر مترافق) حل لتغطية الجانب الكامل منقوشة من ختم PDMS.
- احتضان الطوابع PDMS مع حل BSA لمدة 1 ساعة في درجة حرارة الغرفة للسماح لامتزاز البروتين.
- جفف سطح الأغطية القابلة للتواؤم باستخدام تيار هواء مصفّاً، وزيادة ماء السطح كما هو موضح في الخطوة 1.1.5.
- الهواء الجافة الطوابع PDMS لإزالة الحل المتبقية BSA.
ملاحظة: تأخذ عناية أن يتم إزالة حل BSA تماماً من الطابع لأن أي حل المتبقية سيؤدي الطوابع إلى الشريحة على الأغطية أثناء الطباعة microcontact. - جلب الجانب منقوشة من الطابع في اتصال المطابقة مع غطاء tunable لSA الامتزاز على سطح غطاء. اضغط بلطف على الطابع ضد غطاء لمدة 5 دقائق.
ملاحظة: لا تطبق القوة المفرطة على الطابع لأنه سوف ينحني ويسبب اتصال غير محدد بين ختم و coverlip. الكمية المناسبة من القوة المطبقة على الطابع ضروري لنجاح الطباعة الدقيقة. - فحص micropattern باستخدام المجهر الفلوري مع FITC (الفلوريسين ايزوثيوسايانات) مرشح.
- لطباعة مناطق لاصقة الخلية بدلاً من أنماط الفلورسنت، استبدل اللامينيين ببروتين BSA وكرر الخطوة 1.2.5 إلى 1.2.10.
- إزالة الطوابع من الأغطية، ونقل الأغطية في لوحة 6-جيدا معقمة. إضافة 2 مل من 0.2٪ ث / v حل F-127 Pluronic في كل بئر لتغطية سطح غطاء واحتضان لمدة 1 ساعة في درجة حرارة الغرفة.
ملاحظة: يمكن أن تكون مُزَمّة Puronic F-127 إلى سطح PDMS زيادة في التحلل المائي لسطح PDMS لمنع الخلايا من الالتصاق. - الطامح Pluronic F-127 حل وغسل 5X مع برنامج تلفزيوني و1x مع خلية ثقافة المتوسطة قبل خلايا البذر. كثافة البذر نموذجية لCS هو 1000 خلية / سم2.
- 45 دقيقة بعد بذر الخلية، وإزالة خلية ثقافة المتوسطة وغسل الأغطية مع برنامج تلفزيوني 2x لمنع متعددة SCs من الالتزام بنفس النمط. الحفاظ على الخلايا في بيئة ثقافة الخلية المطلوبة لمدة 48 ساعة قبل القياس الكمي.
- لإنشاء ركائز ثقافة الخلية منقوشة بخط لفحص الخلايا المحاذية اتبع الخطوة 1.2.1 إلى 1.2.4 لإنشاء الطوابع للطباعة microcontact.
ملاحظة: أبعاد الأخدود/التل من الأنماط المصطف على ختم هو 50 ميكرومتر × 50 ميكرومتر للخلايا المبينة. ويبلغ إجمالي أبعاد الطابع 10 مم × 10 ملم. - قص الطوابع إلى أبعاد تحتوي على أنماط الخط المطلوب فقط.
ملاحظة: عند إنشاء الطوابع في CAD، فإن المنطقة غير المُعاد ة من الطابع حول أنماط الخطوط سوف تتوافق مع منطقة لاصقة الخلية التالية للطباعة الدقيقة. وبالتالي، فمن الضروري للقضاء على المناطق غير الخاضعة للمعالجة عند الاستغناء عن ختم لضمان كل SC البذور على السطح يتبع أنماط. - اتبع الخطوة 1.1.1 إلى 1.1.3 لإعداد طلاء سطح PDMS قابل للاستخدام طبقين من الأطباق بيتري.
ملاحظة: هذا سيكون PDMS تغطي سطح طبق بيتري نفسه وليس على غطاء. - اتبع الخطوة 1.2.5 إلى 1.2.10 لإجراء الطباعة الدقيقة لطباعة مناطق لاصقة خلية منقوشة بخط على أحد أطباق Petri المغلفة PDMS.
ملاحظة: يمكن أن تحتوي مساحة طبق بيتري مقاس 60 مم × 15 مم على مناطق منقوشة بخط من 6 طوابع PDMS. - إزالة الطوابع وملء طبق بيتري مع 4 مل من 0.2٪ ث / v Pluronic F-127 حل واحتضان لمدة 1 ساعة.
- بعد الطباعة الدقيقة، شطف كل جانب من الطوابع PDMS مع 70٪ الإيثانول 3x وجافة مع الهواء. تدوير الطوابع PDMS واتبع الخطوة 1.2.5 إلى 1.2.10 لطباعة منطقة لاصقة خلية unpatterned باستخدام الجانب unpatterned من الطابع على طبق بيتري الثاني. كرر الخطوة 1.2.13.
- حل اسبيرات F-127 من الأطباق، 3X غسل مع برنامج تلفزيوني تليها مع 1x غسل باستخدام خلية جديدة ثقافة المتوسطة. بذور SCs على الأطباق.
ملاحظة: كثافة البذر لطبق خط منقوشة هو 5000 خلية / سم2 ولطبق unpatterned هو 10،000 الخلايا / سم2. - الحفاظ على SCs في الظروف المطلوبة ل 48 ساعة واتبع بروتوكولات لإعداد SC lysates32.
ملاحظة: كثافة بذر الخلايا للأطباق غير المُتَرَكّرة أعلى بـ 2x من تلك الخاصة بالأطباق المنقوشة بالخط، حيث أن الطبق المنقوش على الخط لا يحتوي إلا على نصف مساحة الزنزانة اللاصقة من الطبق غير المصفّد.- لإعداد اللوّي، نقل مخزن التشريب المناعي الإشعاعي الملائم (RIPA) إلى أنبوب مركزي مخروطي 10 مل. تخفيف البروتياز ومثبطات الفوسفاتاز (100x) بنسبة 1:100 في العازلة RIPA، مزيج جيدا عن طريق الأنابيب.
- غسل الخلايا مع الثلج البارد برنامج تلفزيوني (1x) لمدة 2 دقيقة، إضافة 80 ميكرولتر من الحل المعدة من الخطوة 1.2.23.1 على كل منطقة لاصقة الخلية (المنطقة التي اتصلت مع الطوابع PDMS والبروتين الممتز) داخل أطباق بتري. احتضان الخلايا مع الحل على كتلة الجليد لمدة 15 دقيقة.
ملاحظة: الحل سيبقى فقط على منطقة لاصقة الخلية بسبب hydrophobicity من الممتزة F-127 Pluronic في مكان آخر. هذه الميزة تمكن من استخراج البروتين ناجحة وكافية للخط منقوشة SCs. - كشط SCs مع مكشطة الخلية لمدة 5 دقائق. جمع lysate في أنبوب microcentrifuge 1.5 مل المسمى.
- microcentrifuge lysate في 12، 000 س ز لمدة 15 دقيقة في 4 °C. جمع فائق مع ماصة 1000 ميكرولتر ونقلها إلى أنبوبrifuge صغيرة نظيفة. تخزين الخلية في -20 درجة مئوية.
- توصيف الركيزة
ملاحظة: لتوصيف ميكانيكا البوليمر على غطاء، تستخدم أساليب متعددة عموما بما في ذلك اختبار ضغطالسائبة 11،,33 أو اختبار مجهرية القوة الذرية34. هذا البروتوكول سوف تفصيلي اختبار ضغط مجمع.- صب السلائف PDMS من نسبة الخلط المطلوب (الخطوة 1.1) في طبق بيتري 30 مم، وضمان سمك طبقة PDMS داخل طبق بيتري هو على الأقل 20 ملم.
- يُرفع طبق بيتري مع متانة بي إم بي إم من الفرن 60 درجة مئوية بعد ساعة والسماح بتبريده في درجة حرارة الغرفة. قطع البوليمر إلى 10 مم × 10 مم الساحات. قياس سمك PDMS باستخدام الفرجار.
- ضع PDMS على خشبة المسرح من قوة الضغط قياس الجهاز. سد في استشعار قوة الضغط (نموذج: 112C) لمنفذ الاستشعار وإصلاح جهاز استشعار لمحور آلة الاختبار.
- ضبط ارتفاع أجهزة الاستشعار إلى ما يقرب من 0.5 سم فوق طابع PDMS باستخدام "هرول" التحكم على اللوحة الأمامية من الصك.
- فتح البرامج المرتبطة باستخدام"اختبار الإعداد"نافذة، حدد"ملف تعريف Servo"، وفتح نافذة"الجزء". في "الجزء" نافذة الإدخال المطلوب "معدل التحكم" و " نهايةالمبلغ" للاختبار.
ملاحظة: يحدد معدل التحكم معدل انتقال المستشعر لأسفل باتجاه PDMS. يحدد المبلغ النهائي المسافة الإجمالية التي يقطعها المستشعر. - استخدم الزر"Z"الموجود على لوحة التحكم في البرنامج لإعادة ضبط جميع القياسات في هذه المرحلة.
- نقل الاستشعار إلى أسفل للاتصال برفق PDMS حتى يتم تحميل 1-2 نيوتن (N). سيتم عرض التحميل والمسافة التي يسافر بها المستشعر في البرنامج.
- بعد الاستفادة من "Z" زر ، وقياس تشغيل باستخدام "اللعب" ، وحفظ قوة تسجيل الملف والمسافة.
- كرر الخطوات من 1.3.3 إلى 1.3.8 لكل حالة تجريبية من PDMS.
- افتح الملف واستخدم الصيغة التالية لحساب معامل يونغ (E) من PDMS لكل نسبة. (F = قوة ضغط، أ = مساحة طابع PDMS، ستامبX L = المسافة المقطوعة من أجهزة الاستشعار، و L0 = السمة الأصلية لختم PDMS).
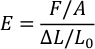
2. القياس الكمي للخصائص الخلوية على ركائز قابلة للتواؤم
- انتشار التشايس
- بذور SCs على ركائز أعدت من الخطوة 1.1.9 في كثافة 5000 الخلايا / سم2 في لوحة 6-جيدا. السماح SCs لاحتضان لمدة 48 ساعة في ظروف ثقافة الخلية القياسية (37 درجة مئوية و 5٪ CO2).
- تمييع 12 ميكرولتر من 10 mM Bromodeoxyuridine (BrdU) حل الأسهم في 12 مل من 37 درجة مئوية خلية ثقافة المتوسطة، اخلط جيدا مع ماصة لجعل 10 μM BrdU حل التسمية.
- إزالة ثقافة الخلية المتوسطة وغسل SCs 2X مع برنامج تلفزيوني.
- إضافة 2 مل من BrdU وضع العلامات الحل في كل بئر واحتضان SCs لمدة 2 ساعة.
ملاحظة: وقت حضانة حل وضع العلامات BrdU يعتمد على معدل انتشار الخلايا المحددة. خط RT4-D6P2T SC لديه معدل انتشار عالية لذلك تم استخدام 2 ساعة من وقت الحضانة. - إزالة BrdU وضع العلامات الحل وغسل SCs 3X مع برنامج تلفزيوني. إضافة 1 مل من 3.7٪ الفورمالديهايد في برنامج تلفزيوني إلى كل بئر واحتضان في درجة حرارة الغرفة لمدة 15 دقيقة لتثبيت الخلية.
تنبيه: الفورمالديهايد مادة مسرطنة للإنسان؛ لذلك، تنفيذ جميع الأعمال داخل غطاء محرك الدخان الكيميائية مع الحماية المناسبة.
ملاحظة: عند الغسيل مع برنامج تلفزيوني، لا يوجد خلية ثقافة المتوسطة في البئر، وبالتالي قد يكون سطح PDMS مسعور. اتخاذ الاحتياطات اللازمة لعدم تجفيف سطح الركيزة تماما لمنع تلف الخلايا. - محلول الفورمالديهايد السبيرات وغسل 3x مع برنامج تلفزيوني (3 دقائق لكل من). إزالة برنامج تلفزيوني وإضافة 1 مل من 0.2٪ تريتون X-100 في برنامج تلفزيوني لكل بئر لغشاء الخلية permeabilize. احتضان SCs مع تريتون X-100 حل لمدة 20 دقيقة في درجة حرارة الغرفة.
- إزالة تريتون X-100 حل وغسل SCS 3x مع برنامج تلفزيوني (3 دقائق لكل من).
- إضافة 1 مل من 1 HCl ن في كل بئر واحتضان على الجليد لمدة 10 دقيقة. إزالة 1 N HCl وإضافة 1 مل من 2 N HCl في كل بئر واحتضان في درجة حرارة الغرفة لمدة 10 دقيقة. HCl العلاج هو للتحلل المائي DNA.
- مزيج 182 مل من 0.2 mM نا2HPO4 و 18 مل من 0.1 mM حمض الستريك لإنتاج الفوسفات / حمض الستريك العازلة لاسترجاع المستضد. إزالة 2 N HCl وإضافة 1 مل الفوسفات / حمض الستريك العازلة في كل بئر واحتضان في درجة حرارة الغرفة لمدة 10 دقيقة.
- غسل SCs 3x مع 0.2٪ تريتون X-100 في برنامج تلفزيوني. إضافة 2 مل من 3٪ الألبومين مصل البقر (BSA) في برنامج تلفزيوني في كل بئر واحتضان لمدة 30 دقيقة في درجة حرارة الغرفة على مدار الساعة غير محددة ملزمة من الجسم المضاد.
- تمييع الجسم المضاد الرئيسي BrdU المقترنة مع اليكسا فلور 488 في 3٪ BSA الحل بنسبة 1:300 لBrdU تلطيخ الحل. احتضان SCs مع حل تلطيخ بين عشية وضحاها في درجة حرارة الغرفة في حين يتم تغطية لوحة في رقائق الألومنيوم.
- لقياس الانتشار، صور SCs باستخدام قناة FITC و DAPI من المجهر الفلوري للكشف عن BrdU والنوية، على التوالي. حفظ الصور كملفات "nd.2".
- افتح ملفات "nd.2" لكل صورة مأخوذة في مواضع مكانية متطابقة.
- افتح برنامج تحليل الصور. انقر بزر الماوس الأيمن فوق الخلفية لفتح النافذة "نتائج القياس الآلي" و " القياسالآلي" في قسم "مراقبة التحليل".
- في "عدد وتصنيف" القائمة ، حدد "عدد". على صورة FITC، انقر على كل نواة تظهر الفلوريسين الخضراء (ردو إيجابية) وانقر بزر الماوس الأيمن على الصورة.
ملاحظة: يتم عرض عدد الخلايا الإيجابية BrdU في نافذة"الأتمتة والقياسات". - بالنسبة لصور DAPI، كرر الخطوة 2.1.14 لحساب عدد النوى الإجمالية. حساب النسبة المئوية للخلايا الموجبة BrdU لهذه الصورة.
- كرر الخطوة 2.1.13 إلى 2.1.16 للصور الأخرى للأغراض الإحصائية وحساب متوسط النسبة المئوية للخلايا الإيجابية BrdU لكل حالة الركيزة.
- القياس الكمي للتعبير c-Jun من خلال تحليل الصور المناعية
- يتم إصلاح الخلايا المعدة داخل 6 آبار من الخطوة 1.1.9 و 1.2.23 و permeabilized مع الإجراءات الموصوفة سابقا (الخطوة 2.1.5-2.1.7).
ملاحظة: لإجراء مقارنات دقيقة من كثافة الفلورسنت عبر الخلايا من شروط ECM مختلفة، تطبيق إعدادات الكاميرا بشكل متطابق عبر كافة العينات مع جميع العينات لها نفس المعلمات. - حفظ الصور كملفات .nd2.
- افتح برنامج تحليل الصور. انقر بزر الماوس الأيمن فوق الخلفية لفتح النافذة "نتائج القياس الآلي" و " القياسالآلي" في قسم "مراقبة التحليل".
- في "نتائج القياس الآلي"، حدد " بياناتالكائن". تنشيط "مواصلة تحديث القياس" زر.
- في اللوحة العلوية من البرنامج، حدد"قياس"متبوعاً بـ"ميزات الكائن". إضافة "متوسط كثافة" إلى قسم "مختارة للقياس".
- فتح ودمج اثنين من ملفات الصور nd2 "التي تحتوي على صور من ج يونيو والنوى.
- في اللوحة العلوية، حدد"ROI"وحدد"رسم عائد الاستثمار مستطيل". رسم منطقة مستطيلة تحتوي على المنطقة النووية من خلية واحدة.
ملاحظة: c-يونيو التعبير يتركز داخل النوى35. - في اللوحة العلوية من البرامج، حدد"ثنائي"و "تعريف عتبة" ، ستظهر نافذة جديدة لتحديد منطقة الفلورسنت c-Jun بدقة.
- في نافذة جديدة، انقر فوق "صورة كاملة / استخدام العائد على الاستثمار" للتبديل البرنامج من نموذج الصورة الكاملة إلى نموذج ROI. استخدم"كثافة"لضبط جدول البحث الموجود على الجانب الأيسر من الإطار لتعديل حجم/شكل المنطقة المميزة ضمن عائد الاستثمار المستطيل.
ملاحظة: احرص على التأكد من أن حجم/شكل المنطقة المميزة مطابق للنواة. - انقر فوق الزر "موافق" ، للحصول على متوسط كثافة FITC في إطار "نتائج القياس الآلي" ثم انقر فوق " بياناتالمتجر".
- في نافذة "القياس الآلي" ،"حذف الكائن" لإزالة المنطقة الحمراء المميزة. على الجانب الأيسر، استخدم"أداة الإشارة"لتحديد العائد على الاستثمار مستطيلة وحذف.
- كرر الخطوة 2.2.6 إلى 2.2.11 لقياس شدة FITC المتوسط لكل خلية إضافية.
- في منطقة النافذة من "نتائج القياس الآلي" ، حدد "مخزن" وسيتم تقديم جميع البيانات المخزنة. استخدم"تصدير"وظيفة وحدد"البيانات إلى Excel"لحفظ جدول البيانات المصدرة وإجراء عمليات حسابية إضافية.
- يتم إصلاح الخلايا المعدة داخل 6 آبار من الخطوة 1.1.9 و 1.2.23 و permeabilized مع الإجراءات الموصوفة سابقا (الخطوة 2.1.5-2.1.7).
- تحديد كمي للاتم بـاطالة نووية
- إصلاح و permeabilize من الخطوة 1.2.22 التالية الخطوات 2.1.5-2.1.7. تنفيذ تلطيخ نووي باستخدام تركيب متوسط مع DAPI.
- باستخدام قناة DAPI وعدسة الهدف 40x، الحصول على صور من العينة وحفظ الملفات كما ".nd2".
- اتبع الخطوة 2.2.3 و 2.2.4 لفتح"نتائج القياس الآلي"و "القياس الآلي" نافذة في برنامج تحليل الصور.
- في "نتائج القياس الآلي"، استخدم"الخيار"وظيفة متبوعة "حدد ميزة الكائن". في العمود"ميزة"،حدد"التهطال"وإضافة إلى "المحدد للقياسات" العمود. استخدم "استمر في تحديث القياس" لتنشيط هذه الوظيفة.
- افتح ملف الصورة "nd.2" الذي يحتوي على الصور النووية. في "القياس الآلي" نافذة ، حدد "الكشف التلقائي" وظيفة وحدد نواة. انقر بزر الماوس الأيمن على الصورة وقياس نسبة الجانب النووي سيتم عرضها في "نتائج القياس الآلي".
- كرر الخطوة 2.3.5 لتحديد نسب الارتقاء النووية للنيات الأخرى داخل الصورة. حدد "بيانات المتجر" في نافذة " نتائجالقياس الآلي".
- كرر 2.3.5 إلى 2.3.6 للصور الإضافية. تصدير البيانات إلى ملف جدول بيانات كما تم في 2.2.13 من قبل للتحليل.
- لطخة غربية لتحديد تعبير البروتين
- اتبع البروتوكولات القياسية لتحليل البقع الغربية مفصلة في مكان آخر32. وترد أدناه عمليات تخفيف الأجسام المضادة المستخدمة في الدراسة: الأرانب المضادة لـ c-Jun 1:2,000؛ الأرانب المضادة لـ C-Jun 1:2,000؛ الأرانب المضادة لـ C-Jun 1:2,000؛ الأرانب المضادة لـ 1:2,000؛ الأرانب المضادة لـ 1:2, الماوس المضادة β-actin 1:1,000; أرنب المضادة p75NTR 1:1,000; الأرانب المضادة myelin البروتين الأساسي 1:1,000; المضادة للماوس / أرنب IgG، HRP المرتبطة الأجسام المضادة 1:10،000.
Access restricted. Please log in or start a trial to view this content.
النتائج
لتحليل وقياس التفاعل بين صلابة الركيزة وتكوين البروتين على النمط الظاهري SC، تم تطوير الركيزة الوراثية لثقافة الخلايا PDMS(الشكل 1A). اختبار ضغط البوليمر في قاعدة مختلفة: تم استخدام نسب عامل المعالجة لتحديد معامل يونغ (E) من الركيزة (الشكل 1B). يمثل النطاق الناتج ...
Access restricted. Please log in or start a trial to view this content.
Discussion
يمكن أن تعزز SCs تجديد الأعصاب بسبب تحولها الظاهري وإمكانات التجدد بعد إصابة الأعصاب. ومع ذلك، فإن كيفية تنظيم الإشارات في إدارة المحتوى في الميكون هذه القدرة التجديدية لا تزال غير واضحة في معظمها، مما قد يعوق ليس فقط تطوير المواد الحيوية التي تهدف إلى تعزيز تجديد الأعصاب ولكن أيضا فهم الآ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ولم يبلغ أصحاب البلاغ عن أي تضارب محتمل في المصالح.
Acknowledgements
ويعترف المؤلفون بامتنان بالدعم التمويلي المقدم من جامعة سينسيناتي. كما يشكر المؤلفون رون فلنينكين من مختبر توصيف المواد المتقدمة بجامعة سينسيناتي على الدعم.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Albumin from Bovine Serum (BSA), Texas Red conjugate | Thermo Fisher Scientific | A23017 | BSA staining to show micropatterns |
| Anti-mouse IgG, HRP-linked Antibody | Cell Signaling Technology | 7076S | Antibody used for western blot analysis |
| Anti-rabbit IgG, HRP-linked Antibody | Cell Signaling Technology | 7074S | Antibody used for western blot analysis |
| BrdU | Thermo Fisher Scientific | B23151 | Reagent used to measure cell proliferation |
| BrdU primary antibody conjugated with Alexa Fluor 488 | Thermo Fisher Scientific | B35130 | Used to visualize BrdU in cell proliferation assays |
| Collagen I | Thermo Fisher Scientific | A10483-01 | Protein used to coat coverslips |
| Compression force test machine | TestResources | Instrument to quantify mechanical properties of polymers | |
| Dulbecco's Modified Eagle Medium | Thermo Fisher Scientific | 11965092 | Cell culture medium |
| Fetal Bovine Serum | Thermo Fisher Scientific | 16000044 | Cell culture medium supplemental |
| Fibronectin | Thermo Fisher Scientific | 33010-018 | Protein used to coat coverslips |
| Fluorescence microscope | Nikon | Eclipse Ti2 | Fluorescence microscope |
| Halt Protease and Phosphatase Inhibitor Cocktail (100X) | Thermo Fisher Scientific | 78440 | Protease and Phosphatase Inhibitor |
| Laminin | Thermo Fisher Scientific | 23017015 | Protein used to coat coverslips |
| Mounting medium with DAPI | Thermo Fisher Scientific | P36971 | Coverslip mountant and nuclei staining |
| Mouse c-Jun primary antibody | Thermo Fisher Scientific | 711202 | Primary antibody to visualize c-Jun protein |
| Mouse β-Actin primary antibody | Cell Signaling Technology | 3700S | Loading control for western blot experiments |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | Cell culture medium supplemental |
| Photoresist SU 2010 | KAYAKU | SU8-2010 | Photoresist |
| Pluronic F-127 | Sigma Aldrich | P-2443 | Block non-specific protein binding |
| Rabbit c-Jun primary antibody | Cell Signaling Technology | 9165S | Primary antibody for visualization of c-Jun protein |
| Rabbit myelin basic protein primary antibody | Abcam | ab40390 | Primary antibody for visualization of MBP |
| Rabbit p75NTR primary antibody | Cell Signaling Technology | 8238S | Primary antibody for visualization of p75NTR |
| Rhodamine phalloidin | Thermo Fisher Scientific | R415 | Visualization of cell cytoskeleton |
| RIPA buffer | Abcam | ab156034 | Cell lysis buffer |
| RT4-D6P2T Schwann cell line | ATCC | CRL-2768 | Cell line used in experiments |
| SYLGARD 184 PDMS base and curing agent | Sigma Aldrich | 761036 | Tunable polymer used to coat coverslips |
| Trypsin | Thermo Fisher Scientific | 15090-046 | Cell dissociation reagent |
| UV-Ozone cleaner | Novascan | Increase hydrophicility of PDMS | |
| Versene (1x) | Thermo Fisher Scientific | 15040066 | Cell dissociation reagent |
References
- Taylor, C. A., Braza, D., Rice, J. B., Dillingham, T. The Incidence of Peripheral Nerve Injury in Extremity Trauma. American Journal of Physical Medicine & Rehabilitation. 87, 381-385 (2008).
- Noble, J., Munro, C. A., Prasad, V. S. S. V., Midha, R. Analysis of Upper and Lower Extremity Peripheral Nerve Injuries in a Population of Patients with Multiple Injuries. Journal of Trauma and Acute Care Surgery. 45, 116-122 (1998).
- Jessen, K. R., Mirsky, R. The repair Schwann cell and its function in regenerating nerves. Journal of Physiology. 594, 3521-3531 (2016).
- Arthur-Farraj, P. J., et al. c-Jun Reprograms Schwann Cells of Injured Nerves to Generate a Repair Cell Essential for Regeneration. Neuron. 75, 633-647 (2012).
- Jessen, K. R., Mirsky, R. The Success and Failure of the Schwann Cell Response to Nerve Injury. Frontiers in Cell Neurosciences. 13, 33(2019).
- Gomez-Sanchez, J. A., et al. After Nerve Injury, Lineage Tracing Shows That Myelin and Remak Schwann Cells Elongate Extensively and Branch to Form Repair Schwann Cells, Which Shorten Radically on Remyelination. Journal of Neuroscience. 37 (37), 9086-9099 (2017).
- Deumens, R., et al. Repairing injured peripheral nerves: Bridging the gap. Progress in Neurobiology. 92, 245-276 (2010).
- Höke, A., Gordon, T., Zochodne, D. W., Sulaiman, O. A. R. A decline in glial cell-line-derived neurotrophic factor expression is associated with impaired regeneration after long-term Schwann cell denervation. Experimental Neurology. 173, 77-85 (2002).
- Jones, S., Eisenberg, H. M., Jia, X. Advances and future applications of augmented peripheral nerve regeneration. International Journal of Molecular Sciences. 17, 1-17 (2016).
- Harris, G. M., et al. Nerve Guidance by a Decellularized Fibroblast Extracellular Matrix. Matrix Biology. 60-61, 176-189 (2017).
- Harris, G. M., Piroli, M. E., Jabbarzadeh, E. Deconstructing the Effects of Matrix Elasticity and Geometry in Mesenchymal Stem Cell Lineage Commitment. Advanced Function Mater. 24 (16), 2396-2403 (2014).
- Pryzhkova, M. V., Harris, G. M., Ma, S., Jabbarzadeh, E. Patterning pluripotent stem cells at a single cell level. Journal of Biomaterials and Tissue Engineering. 3 (4), 461-471 (2013).
- Engler, A. J., Sweeney, H. L., Discher, D. E., Schwarzbauer, J. E. Extracellular matrix elasticity directs stem cell differentiation. Journal of Musculoskeleton and Neuronal Interaction. 7 (4), 335(2007).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric control of cell life and death. Science. 276 (5317), 1425-1428 (1997).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix Elasticity Directs Stem Cell Lineage Specification. Cell. 126, 677-689 (2006).
- Pickup, M. W., Mouw, J. K., Weaver, V. M. The extracellular matrix modulates the hallmarks of cancer. EMBO Reports. 15, 1243-1253 (2014).
- Chernousov, M. A., Carey, D. J. Schwann cell extracellular matrix molecules and their receptors. Histology and Histopathology. 15, 593-601 (2000).
- Shibata, S., et al. Selective Laminin-Directed Differentiation of Human Induced Pluripotent Stem Cells into Distinct Ocular Lineages. Cell Reports. 25 (6), 1668-1679 (2018).
- Mcbeath, R., Pirone, D. M., Nelson, C. M., Bhadriraju, K., Chen, C. S. Cell Shape, Cytoskeletal tenstion and RhoA regulate stem cell lineage committment. Developmental Cell. 6, 483-495 (2004).
- Halder, G., Dupont, S., Piccolo, S. Transduction of mechanical and cytoskeletal cues by YAP and TAZ. Nature Reviews Molecular Cell Biology. 13, 591-600 (2012).
- Jessen, K. R., Mirsky, R. The repair Schwann cell and its function in regenerating nerves. Journal of Physiology. 594 (13), 3521-3531 (2016).
- Lopez-Fagundo, C., Bar-Kochba, E., Livi, L. L., Hoffman-Kim, D., Franck, C. Three-dimensional traction forces of Schwann cells on compliant substrates. Journal of The Royal Society Interface. 11, 20140247(2014).
- Gu, Y., et al. The influence of substrate stiffness on the behavior and functions of Schwann cells in culture. Biomaterials. 33, 6672-6681 (2012).
- Xu, Z. Y., Orkwis, J. A., DeVine, B. M., Harris, G. M. Extracellular matrix cues modulate Schwann cell morphology, proliferation, and protein expression. Journal of Tissue Engineering and Regenerative. , (2019).
- Urbanski, M. M., et al. Myelinating glia differentiation is regulated by extracellular matrix elasticity. Scientific Reports. 6, 1-12 (2016).
- Sun, Y., et al. Tunable stiffness of graphene oxide/polyacrylamide composite scaffolds regulates cytoskeleton assembly. Chemical Sciences. 9 (31), 6516-6522 (2018).
- Hwang, J. H., et al. Extracellular matrix stiffness regulates osteogenic differentiation through MAPK activation. PLoS One. 10, 1-16 (2015).
- Ryan, A. J., et al. A Physicochemically Optimized and Neuroconductive Biphasic Nerve Guidance Conduit for Peripheral Nerve Repair. Advanced Healthcare Materials. 6, 1-13 (2017).
- Du, J., et al. Prompt peripheral nerve regeneration induced by a hierarchically aligned fibrin nanofiber hydrogel. Acta Biomaterialia. 55, 296-309 (2017).
- Huang, L., et al. A compound scaffold with uniform longitudinally oriented guidance cues and a porous sheath promotes peripheral nerve regeneration in vivo. Acta Biomaterialia. 68, 223-236 (2018).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step Variable Height Photolithography for Valved Multilayer Microfluidic Devices. Jouranl of Visualized Experiments. (119), e55276(2017).
- Gupta, R., et al. Shear stress alters the expression of myelin-associated glycoprotein (MAG) and myelin basic protein (MBP) in Schwann cells. Journal of Orthopaedic Research : Official Publication of the Orthopaedic Research Society. 23, 1232-1239 (2005).
- Harris, G. M., Shazly, T., Jabbarzadeh, E. Deciphering the combinatorial roles of geometric, mechanical, and adhesion cues in regulation of cell spreading. PLoS One. 8 (11), (2013).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Schreck, I., et al. C-Jun localizes to the nucleus independent of its phosphorylation by and interaction with JNK and vice versa promotes nuclear accumulation of JNK. Biochemical and Biophysical Research Communications. 407, 735-740 (2011).
- Shen, K., Qi, J., Kam, L. C. Microcontact printing of proteins for cell biology. Journal Visualized Experiments. (22), e1065(2008).
- Treter, J., et al. Washing-resistant surfactant coated surface is able to inhibit pathogenic bacteria adhesion. Applied Surface Science. 303, 147-154 (2014).
- Lutz, J. F. Polymerization of oligo(ethylene glycol) (meth)acrylates: Toward new generations of smart biocompatible materials. Journal of Polymer Science Part A: Polymer Chemistry. 46 (11), 3459-3470 (2008).
- Marcus, M., et al. Interactions of Neurons with Physical Environments. Advanced Healthcare Materials. 6, (2017).
- Pu, J. Golgi polarization in a strong electric field. Journal of Cell Science. 118, 1117-1128 (2005).
- Blaker, J. J., et al. Bioactive Silk-Based Nerve Guidance Conduits for Augmenting Peripheral Nerve Repair. Advanced Healthcare Materials. 7, 1800308(2018).
- Daly, W., Yao, L., Zeugolis, D., Windebank, A., Pandit, A. A biomaterials approach to peripheral nerve regeneration : bridging the peripheral nerve gap and enhancing functional recovery. Journal of the Royal Society of Interface. 9 (67), 202-221 (2012).
- Xia, H., et al. Directed neurite growth of rat dorsal root ganglion neurons and increased colocalization with Schwann cells on aligned poly(methyl methacrylate) electrospun nanofibers. Brain Research. 1565, 18-27 (2014).
- Wang, H. B., Mullins, M. E., Cregg, J. M., McCarthy, C. W., Gilbert, R. J. Varying the diameter of aligned electrospun fibers alters neurite outgrowth and Schwann cell migration. Acta Biomaterialia. 6, 2970-2978 (2010).
- Carvalho, C. R., Oliveira, J. M., Reis, R. L. Modern Trends for Peripheral Nerve Repair and Regeneration: Beyond the Hollow Nerve Guidance Conduit. Frontiers in Bioengineering and Biotechnology. 7, 337(2019).
- Yang, Y., Wang, K., Gu, X., Leong, K. W. Biophysical Regulation of Cell Behavior - Cross Talk between Substrate Stiffness and Nanotopography. Engineering. 3, 36-54 (2017).
- Tan, J. L., Liu, W., Nelson, C. M., Raghavan, S., Chen, C. S. Simple Approach to Micropattern Cells on Common Culture Substrates by Tuning Substrate Wettability. Tissue Engineering. 10, 865-872 (2004).
- Grove, M., et al. YAP/TAZ initiate and maintain schwann cell myelination. Elife. 6, 1-27 (2017).
- Poitelon, Y., et al. YAP and TAZ control peripheral myelination and the expression of laminin receptors in Schwann cells. Nature Neuroscience. 19, 879-887 (2016).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved