JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
슈완 세포 표현형 사양을 평가하기 위한 튜블드 세포 외 세포 매트릭스 미세 환경의 준비
요약
이 방법론은 기판 강성, 단백질 조성 및 세포 형태와 같은 세포 외 매트릭스 큐가 슈완 세포 (SC) 표현형을 조절하는 메커니즘을 설명하는 것을 목표로합니다.
초록
외상성 말초 신경계 (PNS) 부상은 현재 완전한 기능 적 회복을 회복하기위해 적절한 치료가 부족합니다. 슈완 세포 (SCs), PNS의 주요 신경교 세포로, 부상 다음 재생 세포 표현형으로 분화하여 PNS 재생을 촉진에 중요한 역할을한다. 그러나, SC의 차별화된 상태는 재생에 필요한 기간을 통해 유지하기 가 어렵고 주변 세포외 매트릭스(ECM)의 변화에 의해 영향을 받고 있다. 따라서 SC와 ECM 간의 복잡한 상호 작용을 결정하여 SC의 재생 잠재력에 대한 단서를 제공하는 것이 필수적입니다. 이를 해결하기 위해, 다른 ECM 단백질이 강성과 단백질 조성물을 조절할 수 있는 플랫폼을 제공하는 튜닝 가능한 폴리디메틸실록산(PDMS) 기판에 흡착된 전략이 만들어졌습니다. SC는 SC 표현형의 역학을 나타내는 튜닝 가능한 기판 및 중요한 세포 기능에 시드되었다. SC 단백질 발현과 세포 형태 사이의 상호 작용을 설명하기 위해 개별 마이크로접촉 인쇄 세포 패턴 이외에 SC의 다른 종자 밀도가 면역 형광 염색 및 서부 얼룩을 특징으로하고 활용되었습니다. 결과는 더 작은 퍼설리고 세포 신장의 더 높은 넓이를 가진 세포가 SC 재생 현상관 마커의 상부를 승진시켰다는 것을 보여주었습니다. 이 방법론은 SC의 ECM과 세포 기능 사이의 중요한 관계를 해명하기 시작할뿐만 아니라 말초 신경 수리에서 생체 재료의 미래 최적화에 대한 지침을 제공합니다.
서문
말초 신경계(PNS) 부상은 환자의 삶의 질을 손상시키고 다양한 사회경제적 인자를 통해 상당한 영향을 미치게 함으로써 헬스케어의 주요 임상과제로남아 있다1,2. Schwann 세포 (SC), PNS에 있는 주요 신경교 세포로, PNS 재생을 유도하고 짧은 간격 상해에 있는 기능적인 복구에 있는 원조에 필요한 분자 및 물리적 단서를 제공합니다. 이는 SC가 골수성 또는 Remak 표현형3으로부터"수리" 세포 표현형으로 분화하는 놀라운 능력 때문입니다. 수리 SC는 여러 가지 면에서 독특한 세포 표현형입니다. 부상 후, SC는 세포 주기를 다시 입력하여 증식 속도를 증가시키고 재인교정을 용이하게하기 위해 여러 전사 적 요인의 발현을 시작합니다. c-Jun 및 p75 NTR과 같은 이러한 요인은 미엘린 기본 단백질(MBP)과 같은 골수화 SC 마커를 증가시키는 동안4,,5로조절된다. 또한, SC는 형태학을 변경하여 길어지고 서로 정렬하여 부상 부위6을가로질러 Büngner 밴드를 형성한다. 이것은 축축이 올바른 탈모 표적7로확장하기 위한 물리적 지도 메커니즘을 제공한다. 그러나, SC가 짧은 간격 부상에서 신경 재생을 촉진하기 위하여 소유하는 능력에도 불구하고, 기능적인 회복의 결과는 가혹한 상해에 있는 가난한 남아 있습니다. 이는 세포외 매트릭스(ECM) 유도 단서의 손실뿐만 아니라 오랜 기간 동안 재생 형형을 유지하기 위한 SC의무능력8에기인한다.
신경 재생 및 회복 과정은 부상 후 기저 라미나 상태에 밀접하게 묶여 있습니다. 기저 라미나는 지도를 용이하게하고 부상 후 그대로 남아있는 경우 축축및 SC에 대한 ECM 바인딩 큐를 제공하는 신경 주위ECM의층입니다 9. ECM의 상태와 세포에 행렬 바운드 큐를 전달하는 능력은 매우 중요하며 이전에는 다양한컨텍스트(10,,11,,12,,13,,14)에서탐구되었다. 예를 들어, ECM의 강성은 증식 및 분화(11,,15,,16)와같은 세포 기능을 유도할 수 있는 것으로 나타났다.15 ECM의 조성물은 또한 세포내 신호 전달 경로를 통해 이동 및 분화와 같은 세포 행동을 뚜렷한 세포 반응으로 이끌어 내고17,,18을조절할 수 있다. 더욱이, 세포 형태학은, 확산 영역 및 세포 신장을 포함하여, 기능을 조절하는 데 중요한 역할을 하며, ECM-바운드큐(19,,20)에의해 지배될 수 있다. 많은 이전 연구는 정의된 혈통으로 분화하는 줄기 세포에 초점을 맞추었지만, SC는 신경 부상5,,21에따라 ECM을 리모델링하면서 단백질과 성장 인자를 분비할 수 있는 수리 SC로, 건강한 신경 내에서 숙성, 성인 SC로부터 표현형을 변경하는 유사한 능력을 가지고 있다. 따라서, 본질적으로 신경 재생을 위한 이 용량을 이용하기 위하여 통찰력에 대한 선천적인 SC 재생 능력 과 ECM 바운드 단서 사이 관계의 근본적인 기계장치를 확인하는 것이 특히 중요합니다.
이를 해결하기 위해, 우리는 기계적 강성과 리간드 유형이 생리학적으로 관련된 범위에서 쉽게 조정할 수있는 세포 배양 기판을 생산하는 상세한 방법론을 개발했습니다. 폴리디메틸 실록산(PDMS)은 폴리아크릴아미드 젤과 비교하여 고도의 튜닝 역학으로 인해 기판으로 선택되었으며, 최대 영의 계수는 약 1000kPa22,,23,,24에서PDMS와 대조된다. 이것은 손에 작업에 도움이, 최근 연구는 토끼 sciatic 신경의 영의 계수를 초과 할 수 있음을 보여 주었다으로 50 kPa 개발 하는 동안, 따라서 PNS 내신경의 강성의 범위가 이전에 검사 보다 넓은 제안. 상이한 단백질은 SC 행동에 역학 및 리간드의 조합 조절을 분석하기 위해 PDMS 기판에 흡착할 수 있습니다. 이를 통해 PNS 재생 공정에 존재하는 다중 미세환경 적 단서를 조사하고기판(25)의강성에만 초점을 맞춘 작업과 높은 수준의 튜닝성을 비교할 수 있다. 또한, 이러한 엔지니어링 된 세포 배양 기판은 면역 조직 화학, 서부 블롯 및 정량 중합효소 연쇄 반응 (q-PCR)과 같은 다양한 정량 적 분석 방법과 호환됩니다.
이 엔지니어링 된 세포 배양 플랫폼은 각 ECM 바인딩 신호의 높은 수준의 개별 튜닝성으로 인해 기계화 경로를 분석하는 데 매우 적합합니다. 또한, 마이크로접촉 인쇄를 포함한 세포 마이크로패싱에 대한 인기 있는 방법은 다른 ECM 바운드큐(24)와관련하여 세포 형상을 분석하기 위해 조절된 세포 접착을 허용하기 위해 기판상에서 달성될 수 있다. 이는 세포 집단의 신장을 촉진하는 선 패턴 기판이 신경 재생 중에 Büngner 대역 내에서 길쭉한 재생 식 SC를 모방하고 연구하는 도구를 제공하기 때문에 매우 중요합니다. 또한, 세포 형태는 다중 세포 기능의 강력한 레귤레이터이며,26,,27을제어하지 않으면 잠재적으로 혼란스러운 실험 결과를 도입할 수 있다. 현재 ECM cues28,,29,,30에의해 조절되는 SC 재생 표현형을 지배하는 메커니즘에 상당한 주의가 제공되고 있다. 이것은 PNS 신경 재생에 있는 원조를 위한 신경 지도 도관으로 적용될 수 있는 생물 물질의 디자인에 통찰력을 제공하기 위하여 필수적입니다. 이러한 상세한 프로토콜은 궁극적으로 ECM 바운드 큐에 의해 조절되는 SC 및 기타 세포 유형 함수의 메커니즘을 해독하는 잠재적 인 도구로 적용 될 수 있습니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 튜닝 셀 배양 기판 준비 및 특성화
- 기판 준비
- 10:1과 60:1 사이의 비율로 파이펫 팁을 사용하여 PDMS 베이스 엘라스토머 및 경화 제고제는 혼합물 내에서 균일하게 분산될 때까지 격렬하게 혼합한다. 거품이 사라질 때까지 진공 건조를 사용하여 거품을 제거합니다.
참고: PDMS 중합화 하는 동안, 경화 제는 최종 폴리머 원하는 기계적 특성을 제공하기 위해 기본 엘라스토머와 교차링크. 상호 연결 비율을 조정하여 PDMS 강성을 변경할 수 있습니다. - 정사각형 또는 원형 커버슬립(예: 22mm x 22mm)에 건조된 PDMS 혼합물을 떨어뜨리고 30초에 2500rpm의 스핀 코터에 커버슬립을 회전시다.
- 60°C에서 오븐에서 커버슬립을 1-2시간 또는 실온으로 배양하여 PDMS가 고화시화합니다.
- UV-오존 클리너를 사용하여 7분(UV 파장: 185nm 및 254nm)을 사용하여 커버슬립을 처리하여 표면 친성성을 높입니다. 살균 된 6 웰 접시에 넣습니다.
- 세포 배양을 위해 사용하기 전에, 기판을 70% 에탄올에서 적어도 30분 동안 배양한다.
주의: UV-오존 클리너는 인간에게 유해한 오존을 생성할 수 있습니다. 화학 연기 후드 또는 환기의 일종으로 작동합니다. - 37°C의 멸균 인큐베이터에서 60분 동안 단백질 용액(10μg/mL 콜라겐 I, fibronectin 또는 라미닌)에 커버립을 담급니다.
참고: UV-오존 처리에 이어 PDMS 표면은 여전히 소수성일 수 있습니다. 각 커버슬립이 단백질 용액으로 덮여 있는지 확인하기 위해 웰 플레이트를 회전합니다. - 단백질 용액을 흡인시키고 인산염 완충식염(PBS) 3배로 커버슬립을 세척합니다.
- 2.5% 트립신을 이용한 시판식 EDTA 용액(1x)을 이용한 패싱 식기에서 RT4-D6P2T 슈완 세포주(SC)를 다시 중단하고 혈변계를 사용한 세포를 계산한다. 원하는 세포 밀도에서 조정 가능한 PDMS 표면에 시드 SCs. SC 시드 밀도는 각 다른 응용 프로그램에 따라 다를 수 있습니다.
- 실험 기간 동안 원하는 세포 배양 파라미터(습도 90%, CO2,37°C 등)에서 세포를 유지한다. 덜벡코의 변형된 이글 배지(DMEM)를 10% 태아소 혈청(FBS)과 1% 페니실린-연쇄절제술을 세포 배양 배지로 보충한다.
- 10:1과 60:1 사이의 비율로 파이펫 팁을 사용하여 PDMS 베이스 엘라스토머 및 경화 제고제는 혼합물 내에서 균일하게 분산될 때까지 격렬하게 혼합한다. 거품이 사라질 때까지 진공 건조를 사용하여 거품을 제거합니다.
- 미세 패턴 기판 준비
- 컴퓨터 지원 설계(CAD) 소프트웨어를 사용하여 원하는 형상 및 셀 접착제 영역(900 μm2,1,600 μm2 및 2,500 μm2)을그립니다. 상용 공급업체의 패턴을 기반으로 크롬 포토마스크를 만듭니다.
- 깨끗한 방이나 먼지가 없는 환경에서는 표준 포토리소그래피 기술을 사용하여 실리콘 웨이퍼를 제작합니다(프로토콜은 다른 곳에서31개에자세히 설명되어 있음). 이 특정 응용 프로그램에 대한 중요한 매개 변수는 다음과 같습니다 : Photoresist: SU-8 2010; 포토레지스트를 분산하는 스핀 프로파일: 100rpm/s의 가속이 있는 10s용 500rpm, 300rpm/s의 가속이 있는 30s의 경우 3500rpm; 자외선의 노출 에너지: 130 mJ/cm2.
참고: 실리콘 웨이퍼의 패턴 높이는 이러한 매개 변수에 따라 약 10μm입니다. 직사각형 또는 삼각형 패턴의 외부 가장자리 주위잠재적 균열은 단계 1.2.2 후 광 현미경을 사용하여 볼 수 있습니다. 실리콘 웨이퍼를 190°C에서 30분 동안 굽면 균열을 제거하는 데 도움이 됩니다. - 패턴 실리콘 웨이퍼를 원형 150mm 직경 x 15mm 높이 페트리 접시 안에 넣고 실리콘 웨이퍼에 1.1.1 단계에서 준비된 변질 PDMS(혼합 비율 10:1)를 붓습니다.
참고: 마이크로컨택 인쇄 단계에서 PDMS의 두께가 5mm 이상인지 확인합니다. - 하룻밤 사이에 60°C의 오븐에서 실리콘 웨이퍼에 PDMS를 고형화합니다. PDMS가 실온으로 냉각되도록 허용합니다. 30mm x 30mm 사각형의 스탬프를 정밀하게 잘라 외과 메스를 사용하여 실리콘 웨이퍼의 올바른 패턴을 포함합니다. 실리콘 웨이퍼를 손상시키지 마십시오.
참고: 실리콘 웨이퍼는 이 시점에서 여러 번 재사용하여 이소프로판놀로 청소한 후 더 많은 우표를 생성할 수 있습니다. - PDMS 스탬프와 튜닝 커버립(1.1.1~ 1.1.3단계)을 30분 동안 70%에탄올에 담그어 살균합니다.
- 마이크로컨택 트린 인쇄 후 PDMS 우표에 의한 마이크로패턴의 효능을 확인하기 위해 여과된 공기 스트림 및 파이펫 50 μg/mL BSA(텍사스 레드 컨쥬게이트) 용액을 사용하여 PDMS 스탬프의 표면을 건조시켜 PDMS 스탬프의 전체 패턴 측면을 덮습니다.
- 단백질 흡착을 허용하기 위해 실온에서 1시간 동안 BSA 용액을 사용하여 PDMS 스탬프를 배양합니다.
- 여과된 공기 스트림을 사용하여 튜닝 가능한 커버립의 표면을 건조하고, 1.1.5 단계에서 설명된 바와 같이 표면 친성성을 증가시다.
- 나머지 BSA 솔루션을 제거하기 위해 PDMS 스탬프를 공기 건조합니다.
참고: 나머지 솔루션으로 인해 마이크로컨택 인쇄 중에 스탬프가 덮개 슬립에 미끄러지기 때문에 BSA 솔루션이 스탬프에서 완전히 제거됩니다. - 스탬프의 패턴 측면을 커버슬립 표면의 BSA 흡착에 대한 튜닝 가능한 커버슬립과 상체접촉하여 결합합니다. 5분 동안 뚜껑에 스탬프를 부드럽게 누릅니다.
참고: 스탬프와 커버슬립 사이에 는 과도한 접촉을 유발하기 때문에 스탬프에 과도한 힘을 바르지 마십시오. 스탬프에 적용되는 적절한 양의 힘은 성공적인 마이크로컨택 인쇄에 필수적입니다. - FITC(플루오레세인 이소티오카네이트) 필터를 사용하여 형광 현미경을 사용하여 마이크로패턴을 검사합니다.
- 형광 패턴이 아닌 세포 접착제 부위를 인쇄하려면 BSA 단백질을 위해 라미닌을 대체하고 1.2.5 ~ 1.2.10 단계를 반복하십시오.
- 커버립에서 우표를 제거하고 커버립을 멸균 된 6 웰 플레이트로 옮습니다. 0.2%의 2mL/v 플루론 F-127 용액을 각 웰에 추가하여 커버슬립의 표면을 덮고 실온에서 1시간 동안 배양합니다.
참고: 플루론 F-127은 PDMS 표면의 소수성을 증가시켜 접착으로부터 세포를 차단할 수 있다. - Aspirate Pluronic F-127 용액 및 세척 5 X PBS와 셀 배양 배지와 함께 1 배 파 종 전 세포. SC에 대한 일반적인 파종 밀도는 1,000셀/cm2입니다.
- 세포 파종 후 45분, 세포 배양 배지를 제거하고 PBS 2x로 커버립을 세척하여 여러 SC가 동일한 패턴을 준수하지 못하도록 합니다. 정량화 하기 전에 48 h에 대 한 원하는 세포 배양 환경에서 세포를 유지 합니다.
- 정렬된 세포를 검사하기 위해 선 패턴 세포 배양 기판을 만들려면 1.2.1 에서 1.2.4 단계를 수행하여 마이크로접촉 인쇄를 위한 스탬프를 만듭니다.
참고: 스탬프에 줄 지어 패턴의 홈 /능선의 치수는 설명 된 셀에 대한 50 μm x 50 μm입니다. 스탬프의 총 크기는 10mm x 10mm입니다. - 스탬프를 원하는 선 패턴만 포함하는 치수로 잘라냅니다.
참고: CAD에서 스탬프를 만들 때 선 패턴 주위의 스탬프의 패턴이 없는 영역은 마이크로접촉 인쇄 후 셀 접착 영역에 해당합니다. 따라서, 표면에 시드된 모든 SC가 패턴을 따르도록 스탬프를 절단할 때 무패턴 영역을 제거할 필요가 있다. - 1.1.1 에서 1.1.3 단계를 따라 조정 가능한 PDMS 표면 코팅 두 페트리 접시를 준비하십시오.
참고: 이것은 페트리 접시 표면 자체를 덮고 커버 슬립에 PDMS가 될 것입니다. - 1.2.5 ~ 1.2.10 단계를 수행하여 PDMS 코팅 페트리 접시 중 하나에 라인 패턴 셀 접착 영역을 인쇄하기 위해 마이크로 접촉 인쇄를 수행하십시오.
참고: 60mm x 15mm 페트리 접시의 표면적에는 6개의 PDMS 스탬프의 라인 패턴 영역이 포함될 수 있습니다. - 스탬프를 제거하고 페트리 접시를 0.2% w/v 플루론 F-127 용액으로 채우고 1시간 동안 배양합니다.
- 마이크로컨택트 인쇄 후 PDMS 우표의 각 면을 70% 에탄올 3x로 헹구고 공기로 건조시다. PDMS 스탬프를 회전시키고 1.2.5 ~ 1.2.10 단계를 따라 두 번째 페트리 접시에 스탬프의 패턴이 없는 면을 사용하여 패턴이 없는 셀 접착제 영역을 인쇄합니다. 반복 단계 1.2.13.
- 접시에서 F-127 용액을 흡입하고 PBS로 3배 세척한 후 신선한 세포 배양 매체를 사용하여 1배 세척을 합니다. 요리에 씨앗 SC.
참고: 라인 패턴 접시의 파종 밀도는 5,000셀/cm2이며 무패턴 요리의 경우 10,000세포/cm2입니다. - 48h에 대해 원하는 조건에서 SC를 유지하고 프로토콜을 따라 SC lysates32를준비합니다.
참고: 패턴이 없는 요리의 세포 파종 밀도는 라인 패턴 요리의 경우 보다 2배 더 높으며, 라인 패턴 요리에는 패턴이 없는 요리의 세포 접착제 영역의 절반에 불과합니다.- lysates를 준비하려면, 10 mL 원심 분리기 튜브에 적절한 방사선 면역 침전 분석 (RIPA) 버퍼를 전송합니다. RIPA 버퍼에서 1:100의 비율로 프로테아제 및 인산 억제제(100x)를 희석시키고 파이펫팅으로 잘 섞습니다.
- 얼음 차가운 PBS (1x)로 세포를 2 분 동안 세척하고, 페트리 접시 내에서 각 세포 접착제 영역 (PDMS 우표 및 흡착 단백질과 접촉 한 영역)에 1.23.1 단계에서 준비 된 용액의 80 μL을 추가하십시오. 15 분 동안 얼음 블록에 용액으로 세포를 배양합니다.
참고: 이 솔루션은 다른 곳에서만 푸론 F-127 흡착의 소수성으로 인해 세포 접착제 영역에 머물러 있습니다. 이 기능을 통해 라인 패턴 의 SC에 성공적이고 충분한 단백질 추출이 가능합니다. - 5 분 동안 셀 스크레이퍼로 SC를 긁어. 1.5 mL 마이크로 센트 심분리기 튜브로 용액을 수집합니다.
- 마이크로원심 분리기는 4°C에서 15분 동안 12, 000 x g에서 lysate. 1,000 μL 파이펫으로 상체를 수집하고 깨끗한 미세 원심 분리기 튜브로 옮김합니다. 셀 용해를 -20 °C에 저장합니다.
- 기판 특성화
참고: 커버슬립상 폴리머의 역학을 특성화하기 위해, 일반적으로 벌크 압축테스트(11,,33 또는 원자력 현미경 검사34)를포함하는 여러 가지 방법이 사용된다. 이 프로토콜은 대량 압축 테스트를 간략하게 설명합니다.- 원하는 혼합 비(Step 1.1)의 PDMS 전구체를 30mm 페트리 접시에 붓고 페트리 접시 내의 PDMS 층의 두께가 적어도 20mm인지 확인합니다.
- 1 시간 후 60 °C 오븐에서 고형 PDMS와 페트리 접시를 제거하고 실온에서 냉각 할 수 있습니다. 폴리머를 10mm x 10mm 사각형으로 자른다. 캘리퍼를 사용하여 PDMS의 두께를 측정합니다.
- 압축 력 측정 기의 무대에 PDMS를 배치합니다. 압축 력 센서(모델: 112C)를 센서 포트에 연결하고 센서를 테스트 기의 축으로 고정합니다.
- 센서의 높이를 계기전면 패널의 "조깅" 컨트롤을 사용하여 PDMS 스탬프보다 약 0.5cm 높이로 조정합니다.
- "테스트설정"창을 사용하여 관련 소프트웨어를 열고 "서보 프로파일"을선택하고"세그먼트" 창을 엽니다. "세그먼트"창에서, 입력 원하는 "제어 속도" 및"최종 금액"테스트에 대 한.
참고: 제어 속도는 센서가 PDMS로 이동하는 속도를 결정합니다. 끝 양은 센서가 이동하는 총 거리를 결정합니다. - 소프트웨어 의 제어판에 있는"Z"버튼을 사용하여 이 시점에서 모든 측정값을 재설정합니다.
- 센서를 아래로 이동하여 1-2 뉴턴(N)이 로드될 때까지 PDMS에 가볍게 접촉합니다. 로딩 및 센서가 이동하는 거리가 소프트웨어에 표시됩니다.
- "Z"버튼을 활용한 후""재생"을사용하여 측정을 실행하고 파일 기록력과 거리를 저장합니다.
- PDMS의 각 실험 조건에 대해 1.3.3 ~ 1.3.8 단계를 반복합니다.
- 파일을 열고 다음 수식을 사용하여 각 비율에 대해 PDMS의 영의 계수(E)를 계산합니다. (F = 압축력, PDMS 스탬프의 A = 영역, □L = 센서의 이동 거리, 및 L0 = PDMS 스탬프의 원래 두께).
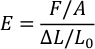
2. 튜닝 가능한 기판에 대한 세포 특성의 정량화
- 확산 분석
- 6웰 플레이트에서 5,000셀/cm2의 밀도로 1.1.9단계부터 제조된 기판에 종자 SC. 표준 세포 배양 조건에서 48h에 대한 SC배양비를 허용한다(37°C 및 5%CO2).
- 10m Bromodeoxyuridine (BrdU) 스톡 용액의 12 μL을 37 °C 세포 배양 배지의 12 mL로 희석하고 파이펫과 잘 섞어 10 μM BrdU 라벨링 솔루션을 만듭니다.
- 세포 배양 배지를 제거하고 PBS로 SC 2배 세척합니다.
- BrdU 라벨링 솔루션 2mL을 각 웰에 추가하고 2시간 동안 SC를 인큐베이션합니다.
참고: BrdU 라벨링 솔루션의 인큐베이션 시간은 특정 세포 증식속도에 따라 다릅니다. RT4-D6P2T SC 라인은 확산율이 높기 때문에 2h의 배양 시간이 사용되었습니다. - BrdU 라벨링 솔루션을 제거하고 PBS로 SC를 3배 세척합니다. PBS에 3.7%의 포름알데히드 1mL을 각 우물에 넣고 실온에서 세포 고정을 위해 15분 동안 배양합니다.
주의: 포름알데히드는 인간의 발암물질입니다. 따라서 적절한 보호 기능을 갖춘 화학 연기 후드 내부에서 모든 작업을 수행하십시오.
참고: PBS로 세척할 때, 우물에는 세포 배양 배지가 없으므로 PDMS 표면은 소수성일 수 있다. 세포 손상을 방지하기 위해 기판표면을 완전히 건조시키지 않도록 주의하십시오. - 포름알데히드 용액을 흡면하고 PBS (각 3 분)로 3 배 세척하십시오. PBS를 제거하고 PBS에 0.2% 트리톤 X-100의 1mL을 각 웰에 추가하여 세포막을 투과화합니다. 실온에서 20분 동안 트리톤 X-100 솔루션으로 SC를 인큐베이션합니다.
- Triton X-100 용액을 제거하고 PBS(각 3분)로 SC를 3배 세척합니다.
- 각 우물에 1ML의 N HCl을 추가하고 10 분 동안 얼음에 배양하십시오. 1 N HCl을 제거하고 각 우물에 2 N HCl의 1 mL을 추가하고 10 분 동안 실온에서 배양하십시오. HCl 치료는 DNA 가수분해를위한 것입니다.
- 182mL의 0.2mM Na2HPO4 및 18mL의 0.1 mM 구연산을 혼합하여 항원 회수를 위한 인산/구연산 완충제를 생성한다. N HCl 2개를 제거하고 mL 인산/구연산 버퍼1개를 각 우물에 넣고 실온에서 10분 동안 배양합니다.
- PBS에서 0.2% 트리톤 X-100으로 SC 3배 세척. PBS에 3% 소 혈청 알부민(BSA)의 2mL을 각 우물에 넣고 실온에서 30분 동안 배양하여 항체의 비특이적 결합을 클럭한다.
- BrdU 염색 용액에 대해 1:300의 비율로 3% BSA 용액에서 알렉사 플루어 488과 결합된 BrdU 1차 항체를 희석한다. 플레이트가 알루미늄 호일로 덮여있는 동안 실온에서 밤새 염색 용액으로 SC를 인큐베이션하십시오.
- 증식을 정량화하기 위해, 형광 현미경의 FITC 및 DAPI 채널을 이용한 이미지 SC는 각각 BrdU와 핵을 검출한다. 이미지를 "nd.2" 파일로 저장합니다.
- 동일한 공간 위치에서 촬영한 각 이미지에 대해 "nd.2" 파일을 엽니다.
- 이미지 분석 소프트웨어를 엽니다. "분석 제어"의 섹션에서 창"자동화된 측정 결과"및"자동화된 측정"을열려면 배경을 마우스 오른쪽으로클릭합니다.
- 에서 "카운트 & 분류 "메뉴, 선택 "카운트". FITC 이미지에서 녹색 형광(BrdU 긍정)을 보여주는 각 핵을 클릭하고 이미지를 마우스 오른쪽 단추로 클릭합니다.
참고: BrdU 양수 셀의 수는"자동화 및 측정"의창에 표시됩니다. - DAPI 이미지의 경우, 총 핵 수를 계산하기 위해 2.1.14 단계를 반복한다. 이 이미지에 대한 BrdU 양수 셀의 백분율을 계산합니다.
- 통계적 목적을 위해 다른 이미지에 대해 2.1.13~2.16을 반복하고 각 기판 조건에 대한 BrdU 양성 세포의 평균 백분율을 계산한다.
- 면역형광이미지 분석을 통한 C-Jun 발현의 정량화
- 1.1.9 단계 및 1.2.23 단계에서 6웰 플레이트 내부에 제조된 세포는 이전에 설명된 절차(단계 2.1.5-2.1.7)로 고정및 투과성된다.
참고: 서로 다른 ECM 조건의 셀에서 형광 강도의 정확한 비교를 수행하려면 동일한 매개 변수를 가진 모든 샘플과 모든 샘플에 카메라 설정을 동일하게 적용합니다. - 이미지를 ".nd2" 파일로 저장합니다.
- 이미지 분석 소프트웨어를 엽니다. "분석 제어"의 섹션에서 창"자동화 된 측정 결과" 및"자동화 된 측정"을열 배경을 마우스 오른쪽 버튼으로클릭합니다.
- "자동측정 결과"에서"개체 데이터"를 선택합니다. 활성화 "측정을 업데이트 유지" 버튼.
- 소프트웨어의 상단 패널에서"측정"을선택하고" 객체 기능"을 선택합니다. 측정을 위해 선택한"평균 강도"를"의 섹션에 추가합니다."
- C-Jun 및 핵 의 이미지를 포함하는 두 개의 ".nd2" 이미지 파일을 열고 병합합니다.
- 상단 패널에서"ROI"를선택하고"직사각형 ROI 그리기"를 선택합니다. 단일 셀의 핵 영역을 포함하는 직사각형 영역을 그립니다.
참고: c-Jun 발현은핵(35)내에 농축된다. - 소프트웨어의 상단 패널에서"바이너리"및"임계값 정의"를선택하면 새 창이 c-Jun 형광 영역을 정확하게 정의하는 것처럼 보입니다.
- 새 창에서"전체 이미지/ROI 사용"을클릭하여 프로그램을 전체 이미지 모델에서 ROI 모델로 전환합니다. "강도"를사용하여 창 왼쪽에 있는 조회 테이블을 조정하여 직사각형 ROI 내에서 강조 표시된 영역의 크기/모양을 조정합니다.
참고: 강조 표시된 영역의 크기/모양이 핵과 동일한지 확인하십시오. - "OK"버튼을 클릭하여"자동 측정 결과"의창에서 평균 FITC 강도를 얻고"데이터 저장"을클릭합니다.
- "자동측정","개체 삭제"의창에서 빨간색 강조 표시된 영역을 제거합니다. 왼쪽 패널에서"포인팅 도구"를사용하여 직사각형 ROI를 선택하고 삭제합니다.
- 각 추가 셀에 대한 FITC 강도를 측정하기 위해 2.2.6 ~ 2.2.11을 반복합니다.
- "자동 측정결과"의창 영역에서"저장된"을선택하고 저장된 모든 데이터가 표시됩니다. "내보내기"함수를 사용하여"Excel에 "데이터를선택합니다" 내보낸 스프레드시트를 저장하고 추가 계산을 수행합니다.
- 1.1.9 단계 및 1.2.23 단계에서 6웰 플레이트 내부에 제조된 세포는 이전에 설명된 절차(단계 2.1.5-2.1.7)로 고정및 투과성된다.
- 핵 연신율 정량화
- 2.1.5-2.1.7 단계에 따라 1.2.22 단계에서 준비된 SC를 수정하고 permeabilize합니다. DAPI를 사용하여 장착 매체를 사용하여 핵 염색을 수행합니다.
- DAPI 채널과 40x 목표 렌즈를 사용하여 샘플 이미지를 획득하고 ".nd2" 파일로 저장합니다.
- 단계 2.2.3 및 2.2.4를 따라 이미지 분석 소프트웨어에서"자동 측정 결과"와"자동화된 측정"창을 엽니다.
- "자동 측정 결과","옵션" 기능을 사용 하 여 "객체 기능 선택". "피쳐"열에서"신장"을선택하고 측정"열에 대해 선택된"에 추가합니다. "이 기능을 활성화하려면 "계속 업데이트 측정"을사용합니다.
- 핵 이미지가 포함된 "nd.2" 이미지 파일을 엽니다. "자동 측정" 창에서 "자동 감지" 기능을 선택하고 핵을 선택합니다. 이미지를 마우스 오른쪽 버튼으로 클릭하면 측정된 핵 종횡비는"자동 측정 결과"에표시됩니다.
- 반복 단계 2.3.5 는 이미지 내의 다른 핵에 대한 핵 종횡비를 정량화한다. "자동 측정 결과"의 창에"데이터 저장"을선택합니다.
- 추가 이미지를 보려면 2.3.5에서 2.3.6으로 반복합니다. 분석을 위해 2.2.13에서 이전과 같이 데이터를 스프레드시트 파일로 내보냅니다.
- 단백질 발현을 정량화하는 서양 얼룩
- 다른 곳에서 자세히 설명 된 서부 얼룩 분석에 대한 표준 프로토콜을 따르십시오32. 연구에 사용되는 항체의 희석은 다음과 같습니다: 토끼 항 c-Jun 1:2,000; 마우스 항 β-actin 1:1,000; 토끼 안티 p75NTR 1:1,000; 토끼 항 myelin 기본 단백질 1:1,000; 항 마우스/토끼 IgG, HRP 연결 항체 1:10,000.
Access restricted. Please log in or start a trial to view this content.
결과
SC 표현형에 대한 기판 강성과 단백질 조성간의 상호작용을 분석하고 정량화하기 위해, 튜닝 가능한 PDMS 세포 배양 기판(도1A)이개발되었다. 서로 다른 기지에서 중합체의 압축 테스트: 경화제 비율은 기판의 영의 계수(E)를 정량화하기 위해 활용되었다(도1B). 계수 값의 결과 범위는 생리학적으로 관련된 기판 조건을 나타냅니다. 기판의 준비에 따라, SC?...
Access restricted. Please log in or start a trial to view this content.
토론
SC는 신경 손상 에 따라 그들의 표현성 변환 및 재생 잠재력으로 인해 신경 재생을 촉진할 수 있습니다. 그러나, ECM 큐가 이 재생 능력을 통제하는 방법은 신경 재생을 승진시키는 것을 목표로 하는 생체 재료의 발달뿐 아니라 신경 재생에 관련되었던 기계장치의 이해를 잠재적으로 방해하는, 주로 불분명남아 있습니다. 이러한 상호 작용을 조사하기 시작하기 위해, 세포 배양 기질은 강성, 단백질 ...
Access restricted. Please log in or start a trial to view this content.
공개
저자에 의해 잠재적 이해 상충이 보고되지 않았습니다.
감사의 말
저자는 감사 신시내티 대학의 자금 지원을 인정합니다. 저자는 또한 지원을 신시내티 대학 고급 재료 특성화 연구소의 론 Flenniken 감사.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Albumin from Bovine Serum (BSA), Texas Red conjugate | Thermo Fisher Scientific | A23017 | BSA staining to show micropatterns |
| Anti-mouse IgG, HRP-linked Antibody | Cell Signaling Technology | 7076S | Antibody used for western blot analysis |
| Anti-rabbit IgG, HRP-linked Antibody | Cell Signaling Technology | 7074S | Antibody used for western blot analysis |
| BrdU | Thermo Fisher Scientific | B23151 | Reagent used to measure cell proliferation |
| BrdU primary antibody conjugated with Alexa Fluor 488 | Thermo Fisher Scientific | B35130 | Used to visualize BrdU in cell proliferation assays |
| Collagen I | Thermo Fisher Scientific | A10483-01 | Protein used to coat coverslips |
| Compression force test machine | TestResources | Instrument to quantify mechanical properties of polymers | |
| Dulbecco's Modified Eagle Medium | Thermo Fisher Scientific | 11965092 | Cell culture medium |
| Fetal Bovine Serum | Thermo Fisher Scientific | 16000044 | Cell culture medium supplemental |
| Fibronectin | Thermo Fisher Scientific | 33010-018 | Protein used to coat coverslips |
| Fluorescence microscope | Nikon | Eclipse Ti2 | Fluorescence microscope |
| Halt Protease and Phosphatase Inhibitor Cocktail (100X) | Thermo Fisher Scientific | 78440 | Protease and Phosphatase Inhibitor |
| Laminin | Thermo Fisher Scientific | 23017015 | Protein used to coat coverslips |
| Mounting medium with DAPI | Thermo Fisher Scientific | P36971 | Coverslip mountant and nuclei staining |
| Mouse c-Jun primary antibody | Thermo Fisher Scientific | 711202 | Primary antibody to visualize c-Jun protein |
| Mouse β-Actin primary antibody | Cell Signaling Technology | 3700S | Loading control for western blot experiments |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | Cell culture medium supplemental |
| Photoresist SU 2010 | KAYAKU | SU8-2010 | Photoresist |
| Pluronic F-127 | Sigma Aldrich | P-2443 | Block non-specific protein binding |
| Rabbit c-Jun primary antibody | Cell Signaling Technology | 9165S | Primary antibody for visualization of c-Jun protein |
| Rabbit myelin basic protein primary antibody | Abcam | ab40390 | Primary antibody for visualization of MBP |
| Rabbit p75NTR primary antibody | Cell Signaling Technology | 8238S | Primary antibody for visualization of p75NTR |
| Rhodamine phalloidin | Thermo Fisher Scientific | R415 | Visualization of cell cytoskeleton |
| RIPA buffer | Abcam | ab156034 | Cell lysis buffer |
| RT4-D6P2T Schwann cell line | ATCC | CRL-2768 | Cell line used in experiments |
| SYLGARD 184 PDMS base and curing agent | Sigma Aldrich | 761036 | Tunable polymer used to coat coverslips |
| Trypsin | Thermo Fisher Scientific | 15090-046 | Cell dissociation reagent |
| UV-Ozone cleaner | Novascan | Increase hydrophicility of PDMS | |
| Versene (1x) | Thermo Fisher Scientific | 15040066 | Cell dissociation reagent |
참고문헌
- Taylor, C. A., Braza, D., Rice, J. B., Dillingham, T. The Incidence of Peripheral Nerve Injury in Extremity Trauma. American Journal of Physical Medicine & Rehabilitation. 87, 381-385 (2008).
- Noble, J., Munro, C. A., Prasad, V. S. S. V., Midha, R. Analysis of Upper and Lower Extremity Peripheral Nerve Injuries in a Population of Patients with Multiple Injuries. Journal of Trauma and Acute Care Surgery. 45, 116-122 (1998).
- Jessen, K. R., Mirsky, R. The repair Schwann cell and its function in regenerating nerves. Journal of Physiology. 594, 3521-3531 (2016).
- Arthur-Farraj, P. J., et al. c-Jun Reprograms Schwann Cells of Injured Nerves to Generate a Repair Cell Essential for Regeneration. Neuron. 75, 633-647 (2012).
- Jessen, K. R., Mirsky, R. The Success and Failure of the Schwann Cell Response to Nerve Injury. Frontiers in Cell Neurosciences. 13, 33(2019).
- Gomez-Sanchez, J. A., et al. After Nerve Injury, Lineage Tracing Shows That Myelin and Remak Schwann Cells Elongate Extensively and Branch to Form Repair Schwann Cells, Which Shorten Radically on Remyelination. Journal of Neuroscience. 37 (37), 9086-9099 (2017).
- Deumens, R., et al. Repairing injured peripheral nerves: Bridging the gap. Progress in Neurobiology. 92, 245-276 (2010).
- Höke, A., Gordon, T., Zochodne, D. W., Sulaiman, O. A. R. A decline in glial cell-line-derived neurotrophic factor expression is associated with impaired regeneration after long-term Schwann cell denervation. Experimental Neurology. 173, 77-85 (2002).
- Jones, S., Eisenberg, H. M., Jia, X. Advances and future applications of augmented peripheral nerve regeneration. International Journal of Molecular Sciences. 17, 1-17 (2016).
- Harris, G. M., et al. Nerve Guidance by a Decellularized Fibroblast Extracellular Matrix. Matrix Biology. 60-61, 176-189 (2017).
- Harris, G. M., Piroli, M. E., Jabbarzadeh, E. Deconstructing the Effects of Matrix Elasticity and Geometry in Mesenchymal Stem Cell Lineage Commitment. Advanced Function Mater. 24 (16), 2396-2403 (2014).
- Pryzhkova, M. V., Harris, G. M., Ma, S., Jabbarzadeh, E. Patterning pluripotent stem cells at a single cell level. Journal of Biomaterials and Tissue Engineering. 3 (4), 461-471 (2013).
- Engler, A. J., Sweeney, H. L., Discher, D. E., Schwarzbauer, J. E. Extracellular matrix elasticity directs stem cell differentiation. Journal of Musculoskeleton and Neuronal Interaction. 7 (4), 335(2007).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric control of cell life and death. Science. 276 (5317), 1425-1428 (1997).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix Elasticity Directs Stem Cell Lineage Specification. Cell. 126, 677-689 (2006).
- Pickup, M. W., Mouw, J. K., Weaver, V. M. The extracellular matrix modulates the hallmarks of cancer. EMBO Reports. 15, 1243-1253 (2014).
- Chernousov, M. A., Carey, D. J. Schwann cell extracellular matrix molecules and their receptors. Histology and Histopathology. 15, 593-601 (2000).
- Shibata, S., et al. Selective Laminin-Directed Differentiation of Human Induced Pluripotent Stem Cells into Distinct Ocular Lineages. Cell Reports. 25 (6), 1668-1679 (2018).
- Mcbeath, R., Pirone, D. M., Nelson, C. M., Bhadriraju, K., Chen, C. S. Cell Shape, Cytoskeletal tenstion and RhoA regulate stem cell lineage committment. Developmental Cell. 6, 483-495 (2004).
- Halder, G., Dupont, S., Piccolo, S. Transduction of mechanical and cytoskeletal cues by YAP and TAZ. Nature Reviews Molecular Cell Biology. 13, 591-600 (2012).
- Jessen, K. R., Mirsky, R. The repair Schwann cell and its function in regenerating nerves. Journal of Physiology. 594 (13), 3521-3531 (2016).
- Lopez-Fagundo, C., Bar-Kochba, E., Livi, L. L., Hoffman-Kim, D., Franck, C. Three-dimensional traction forces of Schwann cells on compliant substrates. Journal of The Royal Society Interface. 11, 20140247(2014).
- Gu, Y., et al. The influence of substrate stiffness on the behavior and functions of Schwann cells in culture. Biomaterials. 33, 6672-6681 (2012).
- Xu, Z. Y., Orkwis, J. A., DeVine, B. M., Harris, G. M. Extracellular matrix cues modulate Schwann cell morphology, proliferation, and protein expression. Journal of Tissue Engineering and Regenerative. , (2019).
- Urbanski, M. M., et al. Myelinating glia differentiation is regulated by extracellular matrix elasticity. Scientific Reports. 6, 1-12 (2016).
- Sun, Y., et al. Tunable stiffness of graphene oxide/polyacrylamide composite scaffolds regulates cytoskeleton assembly. Chemical Sciences. 9 (31), 6516-6522 (2018).
- Hwang, J. H., et al. Extracellular matrix stiffness regulates osteogenic differentiation through MAPK activation. PLoS One. 10, 1-16 (2015).
- Ryan, A. J., et al. A Physicochemically Optimized and Neuroconductive Biphasic Nerve Guidance Conduit for Peripheral Nerve Repair. Advanced Healthcare Materials. 6, 1-13 (2017).
- Du, J., et al. Prompt peripheral nerve regeneration induced by a hierarchically aligned fibrin nanofiber hydrogel. Acta Biomaterialia. 55, 296-309 (2017).
- Huang, L., et al. A compound scaffold with uniform longitudinally oriented guidance cues and a porous sheath promotes peripheral nerve regeneration in vivo. Acta Biomaterialia. 68, 223-236 (2018).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step Variable Height Photolithography for Valved Multilayer Microfluidic Devices. Jouranl of Visualized Experiments. (119), e55276(2017).
- Gupta, R., et al. Shear stress alters the expression of myelin-associated glycoprotein (MAG) and myelin basic protein (MBP) in Schwann cells. Journal of Orthopaedic Research : Official Publication of the Orthopaedic Research Society. 23, 1232-1239 (2005).
- Harris, G. M., Shazly, T., Jabbarzadeh, E. Deciphering the combinatorial roles of geometric, mechanical, and adhesion cues in regulation of cell spreading. PLoS One. 8 (11), (2013).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Schreck, I., et al. C-Jun localizes to the nucleus independent of its phosphorylation by and interaction with JNK and vice versa promotes nuclear accumulation of JNK. Biochemical and Biophysical Research Communications. 407, 735-740 (2011).
- Shen, K., Qi, J., Kam, L. C. Microcontact printing of proteins for cell biology. Journal Visualized Experiments. (22), e1065(2008).
- Treter, J., et al. Washing-resistant surfactant coated surface is able to inhibit pathogenic bacteria adhesion. Applied Surface Science. 303, 147-154 (2014).
- Lutz, J. F. Polymerization of oligo(ethylene glycol) (meth)acrylates: Toward new generations of smart biocompatible materials. Journal of Polymer Science Part A: Polymer Chemistry. 46 (11), 3459-3470 (2008).
- Marcus, M., et al. Interactions of Neurons with Physical Environments. Advanced Healthcare Materials. 6, (2017).
- Pu, J. Golgi polarization in a strong electric field. Journal of Cell Science. 118, 1117-1128 (2005).
- Blaker, J. J., et al. Bioactive Silk-Based Nerve Guidance Conduits for Augmenting Peripheral Nerve Repair. Advanced Healthcare Materials. 7, 1800308(2018).
- Daly, W., Yao, L., Zeugolis, D., Windebank, A., Pandit, A. A biomaterials approach to peripheral nerve regeneration : bridging the peripheral nerve gap and enhancing functional recovery. Journal of the Royal Society of Interface. 9 (67), 202-221 (2012).
- Xia, H., et al. Directed neurite growth of rat dorsal root ganglion neurons and increased colocalization with Schwann cells on aligned poly(methyl methacrylate) electrospun nanofibers. Brain Research. 1565, 18-27 (2014).
- Wang, H. B., Mullins, M. E., Cregg, J. M., McCarthy, C. W., Gilbert, R. J. Varying the diameter of aligned electrospun fibers alters neurite outgrowth and Schwann cell migration. Acta Biomaterialia. 6, 2970-2978 (2010).
- Carvalho, C. R., Oliveira, J. M., Reis, R. L. Modern Trends for Peripheral Nerve Repair and Regeneration: Beyond the Hollow Nerve Guidance Conduit. Frontiers in Bioengineering and Biotechnology. 7, 337(2019).
- Yang, Y., Wang, K., Gu, X., Leong, K. W. Biophysical Regulation of Cell Behavior - Cross Talk between Substrate Stiffness and Nanotopography. Engineering. 3, 36-54 (2017).
- Tan, J. L., Liu, W., Nelson, C. M., Raghavan, S., Chen, C. S. Simple Approach to Micropattern Cells on Common Culture Substrates by Tuning Substrate Wettability. Tissue Engineering. 10, 865-872 (2004).
- Grove, M., et al. YAP/TAZ initiate and maintain schwann cell myelination. Elife. 6, 1-27 (2017).
- Poitelon, Y., et al. YAP and TAZ control peripheral myelination and the expression of laminin receptors in Schwann cells. Nature Neuroscience. 19, 879-887 (2016).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유