A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הכנת למימדי מיקרותאי מטריצה מטריצות להערכת Schwann מפרט Cell
In This Article
Summary
מתודולוגיה זו שואפת להמחיש את המנגנונים שבהם מדובר ברמזים של מטריקס כגון קשיות המצע, הרכב החלבון ומורפולוגיה התא ויסות התא Schwann (SC) פנוטיפים.
Abstract
מערכת העצבים ההיקפית טראומטית (היקפית) פציעות כרגע חסר טיפולים מתאימים כדי להחזיר התאוששות תפקודית מלאה. תאים schwann (ה scs), כמו התאים העיקריים גליה של היקפית, לשחק תפקיד חיוני בקידום התחדשות היקפית על ידי הבחנה לתוך תא התחדשות פניטיפ לאחר הפציעה. עם זאת, המצב הה scs של המדינה מאתגרת לשמור דרך תקופת הזמן הדרושה להתחדשות והיא מושפע משינויים במטריצה שמסביב (ECM). לכן, קביעת הגומלין המורכבים בין ה scs לבין ECM שונות כדי לספק רמזים של פוטנציאל משובי של ה scs הוא חיוני. כדי להתייחס לכך, אסטרטגיה נוצרה כאשר חלבונים ecm שונים היו נספחת על המצע polydiמתיל siloxane (pdms) אשר סיפק פלטפורמה שבה נוקשות והרכב חלבון יכול להיות מאופנן. ה scs היו הנזרע על מצעים התאים הקריטיים פונקציות הסלולר המייצגים את הדינמיקה של SC פנוטיפים נמדדו. כדי להמחיש את הגומלין בין ביטוי חלבון SC לבין מורפולוגיה הסלולר, שונים צפיפות הזריעה של ה scs בנוסף מיקרומגע בודדים מודפס דפוסים סלולריים היו מנוצלים ומאופיין על ידי immunofluorescence כתמי והאבן המערבית אבן. תוצאות הראו כי תאים עם שטח התפשטות קטן יותר ובהיקף גבוה יותר של התארכות הסלולר לקדם רמות גבוהות יותר של סמנים משובי התחדשות של SC. מתודולוגיה זו לא רק מתחילה לפענח את הקשר המשמעותי בין הפונקציה ECM והסלולר של ה scs, אבל גם מספק הנחיות לאופטימיזציה עתידית של ביואטילים בתיקון עצבי היקפי.
Introduction
מערכת העצבים ההיקפית (היקפית) פציעות להישאר אתגר קליני גדול בטיפול רפואי על ידי התפשרות על איכות החיים עבור חולים ויצירת השפעה משמעותית באמצעות המון גורמים סוציואקונומיים1,2. התאים schwann (SC), כמו תאים גליה העיקריים ב היקפית, לספק רמזים מולקולריים הדרושים כדי לגרום התחדשות היקפית וסיוע שחזורים תפקודית בפציעות פער קצר. זה בגלל היכולת המדהימה של ה scs להפריד לתוך "תיקון" תא מושגים מתוך מיאלואידית או מיפוי פניטיפ3. התיקון SC הוא התאים הייחודיים הפנוטיפ במספר דרכים. לאחר הפציעה, ה scs להגדיל את שיעור ההתפשטות שלהם על ידי הזנה מחדש של מחזור התא ולהתחיל ביטוי של מספר גורמים משתנים כדי להקל על שימור. גורמים אלה, כגון c-Jun ו p75 ntr, הם upregulated בעוד סמנים מיאלווניים, כמו חלבון מיאלין בסיסי (mbp), הם מוסדרות4,5. בנוסף, ה scs שינוי מורפולוגיה להיות מוארך ומיושר אחד עם השני כדי ליצור להקות Büngner על פני הפגיעה באתר6. הדבר מספק מנגנון הנחיה פיזי עבור האקסונים כדי להאריך את המטרה הנכונה7. עם זאת, למרות היכולת כי ה scs יש לקדם התחדשות העצב בפציעות פער קצר, התוצאה של התאוששות תפקודית נשאר עני בפציעות חמורות. זה נובע בחלקו לאובדן של מטריקס מטריצה (ECM) רמזים הדרכה, כמו גם את חוסר היכולת של ה scs לשמור על פניטיפים משובי על פרקי זמן ארוכים של זמן8.
התחדשות העצב ותהליך ההחלמה קשורים באופן אינטימי למצב של לינה הבסיס לאחר הפציעה. טרף הבסיס היא שכבה של ecm סביב העצב המקל הדרכה ומספק הרמזים ecm מאוגד עבור אקסונים ו ה scs במקרים שבהם הוא נשאר שלם לאחר הפציעה9. מצב ה-ecm והיכולת שלה לספק רמזים מאוגדים במטריקס לתאים הוא חיוני ובעבר בחנו במגוון הקשרים שונים10,11,12,13,14. לדוגמה, זה הוכח כי הנוקשות של ecm יכול להנחות פונקציות תא כגון התפשטות ובידול11,15,16. הרכב של ecm יכול גם להוביל לתגובה סלולרית ברורה לווסת התנהגויות תא כגון הגירה בידול באמצעות מסלולים מאותת תאיים17,18. יתר על כן, מורפולוגיה התא, כולל שטח התפשטות והתארכות הסלולר, לשחק תפקיד מרכזי בוויסות הפונקציה והוא יכול להיות נשלט על ידי הרמזים ecm19מאוגד 19,20. מחקרים קודמים רבים התמקדו בתאי גזע המבדילים לתוך ליננים מוגדרים, עדיין ה scs בעלי יכולת דומה לשנות פנוטיפ מן הומסטטי, מבוגר SC בתוך עצב בריא, כדי תיקון SC מסוגל הפרשה חלבונים וגורמי גדילה תוך שיפוץ של ecm פציעה העצבים הבאה5,21. לכן, זה חיוני במיוחד כדי לזהות מנגנונים הנמצאים בבסיס היחסים בין הקיבולת הטבועה של משובי SC ו ECM מאוגד רמזים עבור התובנה בסופו של דבר לרתום את היכולת הזו להתחדשות העצב.
כדי לענות על כך, פיתחנו מתודולוגיה מפורטת כדי לייצר מצע של תרבות התא שבו נוקשות מכנית, ליגנד סוג ניתן לכוונן בקלות בטווחים הרלוונטיים פיזיולוגית. Polydimethyl תיל siloxane (pdms) נבחרה כמצע בשל המכניקה שלה מאוד מאוד מאוד משלה לעומת polyאקרילאמיד ג'ל, שם מודולוס הצעיר המרבי הוא סביב 12 kpa בניגוד pdms בסביבות 1000 kpa22,23,24. זה מועיל לעבודה בהישג יד, כפי שמחקרים שנעשו לאחרונה הראו את מודולוס של הצעיר של עצב הארנב יכול לעלות על 50 kPa במהלך הפיתוח, ובכך מציע כי טווח הנוקשות של העצבים בתוך היקפית הוא רחב יותר מאשר נבדק בעבר. חלבונים שונים מסוגלים ספיחה על מצעים pdms לנתח את הרגולציה קומבינטורית של מכניקה וליגטים על התנהגות SC. זה מאפשר את החקירה של מספר רמזים מיקרו סביבתיים בתהליך התחדשות היקפית והשוואה של רמה גבוהה של היכולת לעבוד התמקדות אך ורק על נוקשות של מצע25. יתר על כן, אלה מהונדסים התרבות תאים מצעים תואמים עם ריבוי של שיטות ניתוח כמותי כגון אימונוהיסטוכימיה, כתם מערבי, ואת תגובת שרשרת פולימראז כמותי (q-PCR).
פלטפורמה זו של תרבות התא מהונדסים מתאים מאוד לניתוח מסלולים מכניסטיים עקב רמה גבוהה של מנהרה בודדים של כל אות ECM מאוגד. בנוסף לכך, ניתן להשיג שיטות נפוצות למיקרו-תאים, כולל הדפסת מיקרו-מגעים, על מנת לאפשר הדבקה תאית מבוקרת כדי לנתח את צורת התא ביחס לרמזים אחרים המאוגדים ב-ECM24. זה קריטי כי קו מצעים השורה, אשר לקדם התארכות באוכלוסיות תאים, לספק כלי לחקות וללמוד מוארך ומשובי ה scs בתוך להקות Büngner במהלך התחדשות העצב. יתרה מזאת, מורפולוגיה סלולרית היא מווסת חזק של פונקציות תא מרובות והוא עלול להחדיר תוצאות נסיוניות אם לא נשלט26,27. תשומת לב משמעותית מסופק כעת למנגנון המסדירים את משובי SC פנוטיפ מוסדר על ידי המקלות ecm28,29,30. זה חיוני כדי לספק תובנה לתוך העיצוב של ביואטילים כי ניתן להחיל כתעלות הדרכה עצבים לסיוע התחדשות העצב היקפית. אלה פרוטוקולים מפורטים יכול בסופו של דבר להיות מיושם ככלי פוטנציאלי כדי לפענח את המנגנונים של SC ותפקוד סוג תא אחר כפי מוסדר על ידי רמזים מאוגדים ECM.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. הכנה ואפיון של תרבות תא מטונתן
- הכנת מצע
- מערבבים את בסיס האלסטומר של PDMS ומאשפדים את הסוכנים באמצעות טיפ פיפטה במרץ ביחס בין 10:1 ל-60:1 עד שבועות הינם מפוזרים באופן הומוגנטי בתוך התערובת. להסיר בועות באמצעות התייבשות ואקום עד מתפוגג בועות.
הערה: במהלך PDMS פולימור, ריפוי הסוכן crosslinks עם אלסטומר בסיס כדי לספק את התכונות הסופיות פולימר הרצוי. יחס crosslink ניתן לכוונן כדי לשנות את נוקשות PDMS. - מניחים טיפה (~ 0.2 mL) של תערובת PDMS מיובש על ריבוע או כיסוי מעגלי (למשל, 22 מ"מ x 22 מ"מ) ולסובב את coverslip על משטח ספין ב 2500 rpm עבור 30 s.
- דגירה את הכיסויים בתנור ב 60 ° c עבור 1-2 h או טמפרטורת החדר לילה עבור PDMS לגבש.
- לטפל coverslip באמצעות מנקה UV-אוזון עבור 7 דקות (UV גל: 185 nm ו 254 nm) כדי להגדיל את פני השטח hydrophilicity. מניחים אותו לתוך צלחת מחוטאת 6-היטב.
- לפני השימוש עבור תרבות התא, המיסטראט מצעים ב 70% אתנול לפחות 30 דקות.
התראה: מנקה UV-אוזון יכול ליצור אוזון כי הוא מזיק לבני אדם. תעבוד בתוך מכסה כימי. או עם סוג של אוורור - שמיכות לטבול בתמיסה חלבון (10 μg/mL קולגן אני, fibronectin, או למינציה) עבור 60 דקות בחממה סטרילית ב 37 ° c.
הערה: בעקבות טיפול UV-אוזון, משטח PDMS עדיין יכול להיות הידרופובי. לסובב את צלחת הבאר כדי להבטיח כל coverslip מכוסה בתמיסת חלבון. - מחית את תמיסת החלבון ולשטוף את שמיכות עם מלוחים באגירה פוספט (PBS) 3x.
- Re-להשעות RT4-D6P2T Schwann קו התאים (ה scs) מתוך מאכל העברה באמצעות פתרון EDTA מסחרית זמין (1x) עם 2.5% טריפסין ולספור תאים עם הומוציטוטומטר. Seed ה scs על פני השטח של PDMS מסוגל להתאים את צפיפות התא הרצויה. באפשרותך לשנות את הצפיפויות השונות עבור כל יישום אחר.
- שמור על תאים בפרמטרים הרצויים של תרבות התא (90% לחות, 5% CO2, 37 ° c, וכו ') למשך הניסוי. השתמש מדיום הנשר שונה של Dulbecco (DMEM ע) שיושלם עם 10% סרום של שור עוברי (FBS) ו 1% פניצילין-סטרפטומיצין כמדיום תרבות התא.
- מערבבים את בסיס האלסטומר של PDMS ומאשפדים את הסוכנים באמצעות טיפ פיפטה במרץ ביחס בין 10:1 ל-60:1 עד שבועות הינם מפוזרים באופן הומוגנטי בתוך התערובת. להסיר בועות באמצעות התייבשות ואקום עד מתפוגג בועות.
- הכנה למצע מיקרותבנית
- צייר את הגיאומטריה הרצויה ואת אזורי הדבק תא (900 יקרומטר2, 1,600 יקרומטר2 ו 2,500 יקרומטר2) באמצעות תוכנת עיצוב בעזרת מחשב (CAD). צור מגוון כרום המבוסס על דפוסים אלה מספק מסחרי.
- בחדר נקי או בסביבה נקייה מאבק, השתמש בטכניקות הפוטוליגרפיה סטנדרטיות להרכיבו מוצרי סיליקון (פרוטוקולים מפורטים במקומות אחרים31). פרמטרים קריטיים עבור יישום מסוים זה הם כדלקמן: Photoresist: SU-8 2010; ספין פרופיל לפזר את photoresist: 500 rpm עבור 10 s עם האצה של 100 rpm/s, ואז 3500 rpm עבור 30 s עם האצה של 300 rpm/s; אנרגיה חשיפה של אור UV: 130 mJ/cm2.
הערה: גובה הדפוסים על מוצרי הסיליקון הוא כ -10 יקרומטר לאחר הפרמטרים הבאים. ניתן לראות סדקים אפשריים סביב הקצה מחוץ לתבניות המלבנית או המשולש, בעזרת מיקרוסקופ קל לאחר שלב 1.2.2. אפיית וופל סיליקון ב 190 ° c עבור 30 דקות עוזר לחסל את הסדקים. - מניחים את הסיליקון בדוגמת וופל בתוך מעגלי 150 מ"מ בקוטר x 15 מ"מ צלחת פטרי ויוצקים דה מתודלק PDMS (ערבוב יחס 10:1) כפי שהוכן בשלב 1.1.1 על וופל סיליקון.
הערה: ודא שעובי PDMS הוא לפחות 5 מ"מ עבור נוחות הטיפול במהלך שלבי ההדפסה של microcontact. - לחזק PDMS על סיליקון וופל בתנור ב 60 ° c בלילה. אפשר ל-PDMS להתקרר לטמפרטורת החדר. בדיוק לחתוך בולים של 30 מ"מ x 30 ריבועים המכילים את הדפוסים הנכונים של וופל סיליקון באמצעות אזמל כירורגי. אין לפגוע בפרוסת הסיליקון.
הערה: הסיליקון יכול להיות מחוזר פעמים רבות בשלב זה כדי לייצר חותמות יותר בעקבות ניקוי עם איזופנול. - לחטא בולים PDMS ואת coverslips מחליק (מוכן בשלב 1.1.1 כדי 1.1.3) על ידי המקילים אותם לתוך 70% אתנול עבור 30 דקות.
- כדי לאשר את היעילות של מיקרודפוס על ידי בולים PDMS לאחר הדפסה micropattern, יבש את פני השטח של בולים PDMS באמצעות זרם האוויר מסוננים ו פיפטה 50 μg/mL BSA (טקסס אדום מצופנים) פתרון כדי לכסות את הצד בתבנית כולה של חותמת PDMS.
- דגירה בולים PDMS עם פתרון BSA עבור 1 h בטמפרטורת החדר כדי לאפשר ספיחה חלבון.
- יבש את פני השטח של הכיסויים שמיכות באמצעות זרם אוויר מסונן, להגדיל את פני השטח hydrophilicity כפי שמתואר בשלב 1.1.5.
- האוויר מתייבש את חותמות ה-PDMS כדי להסיר את פתרון BSA הנותר.
הערה: שימו לב כי פתרון BSA מוסר לחלוטין מהחותמת, מכיוון שהפתרון הנותר יגרום לחותמות להחליק על הכיסויים במהלך הדפסת מיקרו-מגע. - להביא את הצד של התבנית של החותמת לתוך מגע קשר עם הכיסויים להחליק של bsa ספיחה על משטח coverslip. לחץ בעדינות על החותמת כנגד הכיסויים במשך 5 דקות.
הערה: אל תחיל כוח מופרז על החותמת מאז שהוא לכופף ולגרום ליצירת קשר לא ספציפי בין חותמת ו coverslip. כמות הכוח המתאימה המוחלת על החותמת חיונית להדפסה מוצלחת של מיקרואנשי קשר. - בדוק את מיקרודפוס באמצעות מיקרוסקופ הזריחה עם מסנן FITC (Fluorescein isothiocate).
- כדי להדפיס אזורים הדבקים בתאים במקום דפוסי פלורסנט, החלף את הלימיסות עבור חלבון BSA וחזור על שלב 1.2.5 כדי ל1.2.10.
- הסרת בולים מתוך כיסוי, העברת כיסוי לתוך צלחת מחוטאת 6-היטב. הוסף 2 מ ל של 0.2% w/v משנה את הפתרון F-127 לתוך כל טוב כדי לכסות את פני השטח של שמיכות ו דגירה עבור 1 h בטמפרטורת החדר.
הערה: הצורות F-127 יכול להיות נספחת כדי pdms פני השטח הגדלת הhydrophobicity של משטח pdms כדי לחסום את התאים הדבקה. - מנושף את התמיסה F-127 ומכבסת 5x עם PBS ו-1x עם מדיום תרבות התא לפני זריעת תאים. צפיפות הזריעה האופיינית עבור ה scs היא 1,000 תאים/cm2.
- 45 דקות לאחר זריעת תאים, להסיר את התרבות התא בינונית ולשטוף כיסוי עם PBS 2x כדי למנוע ה scs מרובים מתוך שמירה על אותה תבנית. שמור על תאים בסביבה הרצויה של תרבות התא עבור 48 h לפני הכמת.
- כדי ליצור מצעים של תרביות תאים בתבנית שורה כדי לבחון תאים מיושרים, בצע את השלבים 1.2.1 כדי ל1.2.4 כדי ליצור חותמות עבור הדפסת אנשי קשר מיקרו.
הערה: ממדי החריץ/הרכס של דפוסי השורה על החותמת הוא 50 יקרומטר x 50 יקרומטר עבור התאים המתוארים. הממדים הכולל של החותמת הם 10 מ"מ x 10 מ"מ. - גזור חותמות לממדים המכילים רק את תבניות השורה הרצויות.
הערה: בעת יצירת חותמות ב-CAD, האזור שאינו ניתן לתבנית של החותמת סביב תבניות הקו יתאים לאזור הדבקה בתאים הבאים להדפסת מיקרו-אנשי קשר. כך, יש צורך לחסל אזורים בלתי מתבנית כאשר חותכים את החותמת כדי להבטיח כל SC הנזרע על פני השטח מלווה את דפוסי. - בצע את הצעד 1.1.1 כדי ל1.1.3 להכין ציפוי משטח של PDMS משני מנות פטרי.
הערה: זה יהיה PDMS כיסוי משטח צלחת פטרי עצמו ולא על שמיכות. - בצע את השלבים 1.2.5 כדי 1.2.10 לבצע הדפסה מיקרואיש קשר כדי להדפיס שורה באזורים הדבק תא באחד מנות מצופה PDMS מצופי פטרי.
הערה: שטח המשטח של 60 mm x 15 מ"מ צלחת פטרי יכול להכיל שורה אזורים בתבנית של 6 בולים PDMS. - הסירו בולים ומלאו את צלחת הפטרי עם 4 מ ל של 0.2% w/v לפתרון הריבוי של F-127 ו-מודטה עבור 1 h.
- לאחר הדפסה microcontact, לשטוף כל צד של בולים PDMS עם 70% אתנול 3x ויבש עם אוויר. סובב בולים PDMS ובצע את הצעד 1.2.5 כדי ל1.2.10 להדפסת משטח הדבקה ללא תבנית של תא באמצעות הצד הבלתי מתבנית של החותמת על צלחת הפטרי השנייה. חזור על שלב ה1.2.13.
- להוריד את התמיסה F-127 מצלחות, לשטוף 3x עם PBS ואחריו כביסה 1x באמצעות מדיום תרבות התא טרי. זרעים ה scs על מנות.
הערה: צפיפות הזריעה של צלחת קו היא 5,000 תאים/cm2 ועבור צלחת בלתי מתבנית הוא 10,000 תאים/cm2. - לשמור על ה scs בתנאים הרצויים עבור 48 h ולעקוב אחר הפרוטוקולים כדי להכין SC lysates32.
הערה: צפיפות התא של מנות בלתי מקושטות היא 2 x גבוה יותר מזה עבור מנות בדוגמת קו, כמו המנה בדוגמת השורה יש רק חצי אזור דבק התא של המנה ללא תבנית.- כדי להכין ליסביטים, העבר את מאגר הradioimmunoprecipitation המתאים (ריפה) לשפופרת צנטריפוגה של 10 מ"ל. לדלל פרוטאז ו פוספספטאז מעכבי (100x) ביחס של 1:100 במאגר ריפה, מערבבים היטב על ידי ליטוף.
- לשטוף תאים עם קרח קר PBS (1x) עבור 2 דקות, להוסיף 80 μl של הפתרון המוכן משלב 1.2.23.1 על כל אזור דבק תא (האזור שיצר קשר עם בולים pdms וחלבון נספחת) בתוך מנות פטרי. דגירה תאים עם הפתרון על בלוק קרח עבור 15 דקות.
הערה: הפתרון יישאר רק באזור הדבק בגלל ההידרופוטביניטי של F-127 ספיחה במקום אחר. תכונה זו מאפשרת חילוץ חלבון מוצלח ומספיק עבור בדוגמת קו ה scs. - לגרד ה scs עם מגרד התא עבור 5 דקות. לאסוף את ליפוסט לתוך שפופרת מיקרוצנטריפוגה 1.5 mL מתויג.
- מיקרוצנטריפוגה למטה ב 12, 000 x g עבור 15 דקות ב 4 ° c. אסוף סופרנטאנט עם פיפטה 1,000 μL והעבר לצינור מיקרוצנטריפוגה נקי. תא האחסון למטה ב-20 ° c.
- אפיון מצע
הערה: כדי לאפיין את המכניקה של הפולימר על הכיסויים, שיטות מרובות מועסקים בדרך כלל כולל בדיקות דחיסה בצובר11,33 או מיקרוסקופ כוח אטומי בדיקות34. פרוטוקול זה יתאר בדיקות דחיסה בצובר.- יוצקים את הדבר המבוקש PDMS של יחס ערבוב הרצוי (שלב 1.1) לתוך צלחת פטרי 30 מ"מ, להבטיח את עובי שכבת PDMS בתוך צלחת פטרי הוא לפחות 20 מ"מ.
- הסר את צלחת פטרי עם PDMS מתחזק מ 60 ° c תנור אחרי 1 h ולאפשר קריר בטמפרטורת החדר. לחתוך פולימר לתוך 10 מ"מ x 10 מילימטר ריבועים. למדוד את עובי PDMS באמצעות מחוגות.
- מניחים את PDMS על הבמה של מכונת מדידת כוח הדחיסה. הכנס חיישן כוח הדחיסה (דגם: 112C) ליציאת חיישן ולתקן את החיישן לציר של מכונת הבדיקה.
- להתאים את גובה החיישן כ 0.5 ס מ מעל החותמת PDMS באמצעות "לרוץ" בלוח הקדמי של המכשיר.
- פתח את התוכנה המשויכת באמצעות "בדיקת הגדרות" חלון, בחר "פרופיל סרוו", ופתח את "מקטע" חלון. בחלון "פלח", הקלט הרצוי "קצב בקרה" ו-"הסכום הסופי" עבור הבדיקה.
הערה: קצב הבקרה קובע את קצב הנסיעה של החיישן לכיוון ה-PDMS. סכום הסיום קובע את המרחק הכולל שהחיישן עובר. - השתמש בלחצן "Z" הממוקם בלוח הבקרה של התוכנה כדי לאפס את כל המדידות בשלב זה.
- הזז את החיישן למטה כדי ליצור קשר עם pdms בקלות עד 1-2 ניוטון (N) נטענים. הטעינה ואת המרחק כי החיישן נוסע יוצגו בתוכנה.
- לאחר ניצול "Z" כפתור, להריץ מדידה באמצעות "Play", ולשמור את כוח ההקלטה הקובץ ומרחק.
- חזור על שלבים ה1.3.3 ל1.3.8 עבור כל תנאי ניסיוני של PDMS.
- פתח את הקובץ והשתמש בנוסחה הבאה כדי לחשב את מודולוס של יאנג (E) של PDMS עבור כל יחס. (F = כוח הדחיסה, A = אזור של החותמת PDMS, ∆L = מרחק נסיעה של חיישן, ו- L0 = העובי המקורי של החותמת pdms).
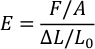
2. כימות של נכסים סלולריים על מצעים מוקצפים
- שיטת ההפצה
- ה scs Seed על מצעים המוכנים משלב 1.1.9 בצפיפות של 5,000 תאים/cm2 בצלחת 6-היטב. אפשר ה scs ב-48 h בתנאים הסטנדרטיים של תרבות התא (37 ° צ' ו 5% CO2).
- לדלל 12 μL של 10 מילימטר ברומואודאוקסידודין (BrdU) פתרון מניות לתוך 12 מ מ של 37 בינונית התרבות תא ° c, מערבבים היטב עם הפיפטה כדי להפוך את הפתרון של 10 μM BrdU תיוג.
- הסר את המדיום של תרבות התא ושטוף את ה scs 2x עם PBS.
- הוסף 2 מ ל של פתרון BrdU תיוג לתוך כל טוב, מה scs השנייה עבור 2 h.
הערה: זמן הדגירה של הפתרון BrdU תיוג תלוי בקצב הפצת התא הספציפי. קו RT4-D6P2T SC יש שיעור התפשטות גבוהה כל כך 2 h של זמן דגירה שימש. - הסר את הפתרון BrdU תיוג ולשטוף ה scs 3x עם PBS. הוסף 1 mL של 3.7% פורמלדהיד ב-PBS לכל היטב, מודקרת בטמפרטורת החדר עבור 15 דקות עבור קיבוע התא.
התראה: פורמלדהיד הוא גורם מסרטן אנושי; לפיכך, לבצע את כל העבודה בתוך כיסוי כימי עם הגנה מתאימה.
הערה: כאשר שוטף עם PBS, אין מדיום תרבות התא בבאר, ולכן משטח PDMS יכול להיות הידרופובי. נקוט אמצעי זהירות כדי לא לייבש לחלוטין את פני השטח של המצע כדי למנוע נזק לתאים. - מנושף פתרון פורמלדהיד ולשטוף 3x עם PBS (3 דקות כל אחד). הסרת PBS ולהוסיף 1 mL של 0.2% טריטון X-100 ב PBS לכל טוב כדי לחלחל קרום התא. דגירה ה scs עם טריטון X-100 פתרון עבור 20 דקות בטמפרטורת החדר.
- הסרת טריטון X-100 פתרון ולשטוף ה scs 3x עם PBS (3 דקות כל אחד).
- להוסיף 1 מ ל של 1 N HCl לתוך כל טוב ומכל מודטה על הקרח 10 דקות. הסר 1 N HCl ולהוסיף 1 mL של 2 N HCl לתוך כל טוב, מודטה בטמפרטורת החדר עבור 10 דקות הטיפול HCl הוא עבור הידרוליזה DNA.
- מערבבים 182 mL של 0.2 mM Na2hpo4 ו 18 מ ל של 0.1 מילימטר חומצת לימון כדי לייצר מאגר פוספט/לימון חומצה לאיחזור אנטיגן. הסר 2 N HCl ולהוסיף 1 mL פוספט/חומצת לימון מאגר לתוך כל טוב דגירה בטמפרטורת החדר עבור 10 דקות.
- לשטוף ה scs 3x עם 0.2% טריטון X-100 ב PBS. הוסף 2 מ ל של 3% בסרום שור (BSA) ב PBS לתוך היטב, מודלת עבור 30 דקות בטמפרטורת החדר לשעון מחייב לא ספציפי של הנוגדן.
- לדלל את הנוגדן BrdU הראשי מצועם עם אלקסה Fluor 488 ב 3% BSA פתרון ביחס של 1:300 עבור פתרון BrdU צביעת. דגירה ה scs עם פתרון מכתים לילה בטמפרטורת החדר בעוד הצלחת מכוסה רדיד אלומיניום.
- כדי לכמת התפשטות, התמונה ה scs באמצעות הערוץ FITC ו-DAPI של מיקרוסקופ פלורסנט כדי לזהות BrdU ו גרעינים, בהתאמה. שמור תמונות כקבצי "nd .2".
- פתח את הקבצים "nd .2" עבור כל תמונה שצולמה במיקומים מרחביים זהים.
- פתח את תוכנת ניתוח התמונה. לחץ לחיצה ימנית על הרקע כדי לפתוח את החלון "תוצאות מדידה אוטומטיות" ו-"מדידה אוטומטית" בסעיף "בקרת ניתוח".
- בתפריט "ספירת &Amp; טקסונומיה", בחר באפשרות "count". על התמונה FITC, לחץ על כל גרעין מראה זריחה ירוקה (BrdU חיובי) ולחץ לחיצה ימנית על התמונה.
הערה: מספר התאים החיוביים של BrdU מוצגים בחלון "אוטומציות ומדידות". - עבור תמונות DAPI, חזור על שלב 2.1.14 כדי לספור את מספר הגרעינים הכולל. חשב את אחוזי התאים החיוביים של BrdU עבור תמונה זו.
- חזור על שלב 2.1.13 באמצעות 2.1.16 עבור תמונות אחרות למטרות סטטיסטיות ולחשב את אחוז ממוצע של תאים חיוביים BrdU עבור כל תנאי מצע.
- כימות הביטוי של c-Jun באמצעות ניתוח מוחיסורמיאואלי
- תאים שהוכנו בתוך 6-טוב צלחות משלב 1.1.9 ו 1.2.23 הם קבועים, החדיר עם ההליכים שתוארו בעבר (שלב 2.1.5-2.1.7).
הערה: כדי לבצע השוואות מדויקות של עוצמת פלורסנט על פני תאים של תנאי ECM שונים, להחיל הגדרות מצלמה זהה על פני כל הדגימות עם כל הדגימות שיש אותם פרמטרים. - שמור תמונות כקבצי ". nd2".
- פתח את תוכנת ניתוח התמונה. לחץ לחיצה ימנית כדי לפתוח את החלון "תוצאות מדידה אוטומטיות" ו-"מדידה אוטומטית" בסעיף "בקרת ניתוח".
- ב"תוצאותמדידה אוטומטיות", בחר באפשרות "נתוני אובייקט". הפעל את הלחצן "המשך לעדכן מדידה".
- בלוח העליון של התוכנה, בחר "מדידה" ואחריו "תכונות אובייקט". הוסף "עוצמה ממוצע" למקטע "נבחר למדידה".
- פתח ומזג nd2 קבצי תמונה המכילים תמונות של c-Jun וגרעינים.
- בלוח העליון, בחר "roi" ובחר "לצייר ROI מלבני". צייר אזור מלבני המכיל את האזור הגרעיני של תא בודד.
הערה: ביטוי c-Jun מרוכז בתוך גרעין35. - בפאנל העליון של התוכנה, בחר "בינארי" ו "להגדיר הסף", חלון חדש יופיע בדיוק להגדיר את אזור פלורסנט c-Jun.
- בחלון חדש, לחץ על "התמונה המלאה/השתמש ROI" כדי לעבור תוכנית ממודל התמונה המלאה למודל ROI. השתמשב"עוצמה" כדי לכוונן את טבלת בדיקת המידע הממוקמת בצד שמאל של החלון להתאמת גודל/צורה של האזור המסומן בתוך ההחזר המלבני.
הערה: הקפידו לוודא שהגודל/הצורה של האזור המסומן זהים לגרעין. - לחץ על "אישור" כפתור, כדי לקבל את עוצמת ה-fitc ממוצע בחלון של "תוצאות מדידה אוטומטית" ולאחר מכן לחץ על "אחסן נתונים".
- בחלון "מדידה אוטומטית", "מחק אובייקט" כדי להסיר את האזור המסומן באדום. בלוח השמאלי הימני, השתמשבכלי הצבעהכדי לבחור את ההחזר המלבני ולמחוק.
- חזור על שלב 2.2.6 כדי ל2.2.11 למדוד עוצמת FITC ממוצע עבור כל תא נוסף.
- באזור החלון של "תוצאות מדידה אוטומטיות", בחר "מאוחסן" ואת כל הנתונים המאוחסנים יוצגו. השתמש בפונקציה "Export" ובחר "נתונים ל-Excel" כדי לשמור את הגיליון האלקטרוני המיוצא ולבצע חישובים נוספים.
- תאים שהוכנו בתוך 6-טוב צלחות משלב 1.1.9 ו 1.2.23 הם קבועים, החדיר עם ההליכים שתוארו בעבר (שלב 2.1.5-2.1.7).
- כימות התארכות גרעינית
- לתקן ולחדירות ה scs מוכן משלב 1.2.22 בשלבים הבאים 2.1.5-2.1.7. בצע מכתים גרעיני באמצעות מדיום הרכבה עם DAPI.
- באמצעות ערוץ DAPI ועדשת המטרה 40x, לרכוש תמונות של המדגם ולשמור כמו ". nd2" קבצים.
- בצע את שלב 2.2.3 ו-2.2.4 כדי לפתוח את "תוצאות מדידה אוטומטית" ו "מדידה אוטומטית" חלון בתוכנת ניתוח התמונה.
- ב"תוצאותמדידה אוטומטיות", השתמש בפונקציה "Option" ואחריו "בחר תכונת אובייקט". בעמודה "תכונה", בחר באפשרות "התארכות" והוסף לעמודת "נבחר עבור מדידות". השתמש באפשרות 'המשך לעדכן מדידה' כדי להפעיל פונקציה זו.
- פתח את קובץ התמונה "nd .2" המכיל את התמונות הגרעיניות. בחלון "מדידה אוטומטית", בחר בפונקציה "זיהוי אוטומטי" ובחר בגרעין. קליק ימני על התמונה ואת יחס הגובה הגרעיני נמדד "תוצאות מדידה אוטומטית".
- חזור על שלב 2.3.5 לכמת יחסי גודל גרעיניים עבור גרעינים אחרים בתוך התמונה. בחר "אחסן נתונים" בחלון "תוצאות מדידה אוטומטיות".
- חזור על ה2.3.5 כדי ל2.3.6 לקבלת תמונות נוספות. יצא את הנתונים לקובץ גיליון אלקטרוני כפי שנעשה בעבר ב2.2.13 לצורך ניתוח.
- כתם מערבי לביטוי חלבון בכמת
- עקוב אחר פרוטוקולים סטנדרטיים עבור ניתוח כתמי אבן מערבית מפורט במקום אחר32. הדילול של נוגדנים המשמשים במחקר מוצגים להלן: ארנב נגד c-יוני 1:2000; עכבר נגד β-actin 1:1000; ארנב נגד p75NTR 1:1000; ארנב נגד חלבון בסיסי מאלין 1:1000; אנטי-עכבר/ארנב IgG, נוגדן מקושר 1:10000.
Access restricted. Please log in or start a trial to view this content.
תוצאות
כדי לנתח ולכמת את הגומלין בין קשיות המצע ואת הרכב החלבון ב-SC פניטיפ, המצע לתרבות תא PDMS של מנהרה פותחה (איור 1A). בדיקות דחיסה של פולימר בבסיס שונה: ריפוי יחסי הסוכן היה מנוצל לכמת את המודולריות של צעירים (E) של המצע (איור 1B). הטווח המתקבל של ערכי מודולוס מייצג תנא?...
Access restricted. Please log in or start a trial to view this content.
Discussion
ה scs יכול לקדם התחדשות העצב בשל הטרנספורמציה פנוטימית שלהם פוטנציאל התחדשות לאחר פגיעה בעצב. עם זאת, איך הרמזים ECM לווסת את יכולת ההתחדשות הזו נותרת בלתי ברורה ברובו, באופן פוטנציאלי לא רק את ההתפתחות של ביואטילים כי המטרה לקדם התחדשות עצבים, אלא גם את ההבנה של המנגנונים המעורבים התחדשות הע...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים לא דיווחו על ניגוד אינטרסים פוטנציאלי.
Acknowledgements
המחברים מודים בהכרת התמיכה מאוניברסיטת סינסינטי. המחברים גם מודים לרון פלמוזיקן מתוך המעבדה לאפיון חומרים מתקדמים של אוניברסיטת סינסינטי לצורך תמיכה.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Albumin from Bovine Serum (BSA), Texas Red conjugate | Thermo Fisher Scientific | A23017 | BSA staining to show micropatterns |
| Anti-mouse IgG, HRP-linked Antibody | Cell Signaling Technology | 7076S | Antibody used for western blot analysis |
| Anti-rabbit IgG, HRP-linked Antibody | Cell Signaling Technology | 7074S | Antibody used for western blot analysis |
| BrdU | Thermo Fisher Scientific | B23151 | Reagent used to measure cell proliferation |
| BrdU primary antibody conjugated with Alexa Fluor 488 | Thermo Fisher Scientific | B35130 | Used to visualize BrdU in cell proliferation assays |
| Collagen I | Thermo Fisher Scientific | A10483-01 | Protein used to coat coverslips |
| Compression force test machine | TestResources | Instrument to quantify mechanical properties of polymers | |
| Dulbecco's Modified Eagle Medium | Thermo Fisher Scientific | 11965092 | Cell culture medium |
| Fetal Bovine Serum | Thermo Fisher Scientific | 16000044 | Cell culture medium supplemental |
| Fibronectin | Thermo Fisher Scientific | 33010-018 | Protein used to coat coverslips |
| Fluorescence microscope | Nikon | Eclipse Ti2 | Fluorescence microscope |
| Halt Protease and Phosphatase Inhibitor Cocktail (100X) | Thermo Fisher Scientific | 78440 | Protease and Phosphatase Inhibitor |
| Laminin | Thermo Fisher Scientific | 23017015 | Protein used to coat coverslips |
| Mounting medium with DAPI | Thermo Fisher Scientific | P36971 | Coverslip mountant and nuclei staining |
| Mouse c-Jun primary antibody | Thermo Fisher Scientific | 711202 | Primary antibody to visualize c-Jun protein |
| Mouse β-Actin primary antibody | Cell Signaling Technology | 3700S | Loading control for western blot experiments |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | Cell culture medium supplemental |
| Photoresist SU 2010 | KAYAKU | SU8-2010 | Photoresist |
| Pluronic F-127 | Sigma Aldrich | P-2443 | Block non-specific protein binding |
| Rabbit c-Jun primary antibody | Cell Signaling Technology | 9165S | Primary antibody for visualization of c-Jun protein |
| Rabbit myelin basic protein primary antibody | Abcam | ab40390 | Primary antibody for visualization of MBP |
| Rabbit p75NTR primary antibody | Cell Signaling Technology | 8238S | Primary antibody for visualization of p75NTR |
| Rhodamine phalloidin | Thermo Fisher Scientific | R415 | Visualization of cell cytoskeleton |
| RIPA buffer | Abcam | ab156034 | Cell lysis buffer |
| RT4-D6P2T Schwann cell line | ATCC | CRL-2768 | Cell line used in experiments |
| SYLGARD 184 PDMS base and curing agent | Sigma Aldrich | 761036 | Tunable polymer used to coat coverslips |
| Trypsin | Thermo Fisher Scientific | 15090-046 | Cell dissociation reagent |
| UV-Ozone cleaner | Novascan | Increase hydrophicility of PDMS | |
| Versene (1x) | Thermo Fisher Scientific | 15040066 | Cell dissociation reagent |
References
- Taylor, C. A., Braza, D., Rice, J. B., Dillingham, T. The Incidence of Peripheral Nerve Injury in Extremity Trauma. American Journal of Physical Medicine & Rehabilitation. 87, 381-385 (2008).
- Noble, J., Munro, C. A., Prasad, V. S. S. V., Midha, R. Analysis of Upper and Lower Extremity Peripheral Nerve Injuries in a Population of Patients with Multiple Injuries. Journal of Trauma and Acute Care Surgery. 45, 116-122 (1998).
- Jessen, K. R., Mirsky, R. The repair Schwann cell and its function in regenerating nerves. Journal of Physiology. 594, 3521-3531 (2016).
- Arthur-Farraj, P. J., et al. c-Jun Reprograms Schwann Cells of Injured Nerves to Generate a Repair Cell Essential for Regeneration. Neuron. 75, 633-647 (2012).
- Jessen, K. R., Mirsky, R. The Success and Failure of the Schwann Cell Response to Nerve Injury. Frontiers in Cell Neurosciences. 13, 33(2019).
- Gomez-Sanchez, J. A., et al. After Nerve Injury, Lineage Tracing Shows That Myelin and Remak Schwann Cells Elongate Extensively and Branch to Form Repair Schwann Cells, Which Shorten Radically on Remyelination. Journal of Neuroscience. 37 (37), 9086-9099 (2017).
- Deumens, R., et al. Repairing injured peripheral nerves: Bridging the gap. Progress in Neurobiology. 92, 245-276 (2010).
- Höke, A., Gordon, T., Zochodne, D. W., Sulaiman, O. A. R. A decline in glial cell-line-derived neurotrophic factor expression is associated with impaired regeneration after long-term Schwann cell denervation. Experimental Neurology. 173, 77-85 (2002).
- Jones, S., Eisenberg, H. M., Jia, X. Advances and future applications of augmented peripheral nerve regeneration. International Journal of Molecular Sciences. 17, 1-17 (2016).
- Harris, G. M., et al. Nerve Guidance by a Decellularized Fibroblast Extracellular Matrix. Matrix Biology. 60-61, 176-189 (2017).
- Harris, G. M., Piroli, M. E., Jabbarzadeh, E. Deconstructing the Effects of Matrix Elasticity and Geometry in Mesenchymal Stem Cell Lineage Commitment. Advanced Function Mater. 24 (16), 2396-2403 (2014).
- Pryzhkova, M. V., Harris, G. M., Ma, S., Jabbarzadeh, E. Patterning pluripotent stem cells at a single cell level. Journal of Biomaterials and Tissue Engineering. 3 (4), 461-471 (2013).
- Engler, A. J., Sweeney, H. L., Discher, D. E., Schwarzbauer, J. E. Extracellular matrix elasticity directs stem cell differentiation. Journal of Musculoskeleton and Neuronal Interaction. 7 (4), 335(2007).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric control of cell life and death. Science. 276 (5317), 1425-1428 (1997).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix Elasticity Directs Stem Cell Lineage Specification. Cell. 126, 677-689 (2006).
- Pickup, M. W., Mouw, J. K., Weaver, V. M. The extracellular matrix modulates the hallmarks of cancer. EMBO Reports. 15, 1243-1253 (2014).
- Chernousov, M. A., Carey, D. J. Schwann cell extracellular matrix molecules and their receptors. Histology and Histopathology. 15, 593-601 (2000).
- Shibata, S., et al. Selective Laminin-Directed Differentiation of Human Induced Pluripotent Stem Cells into Distinct Ocular Lineages. Cell Reports. 25 (6), 1668-1679 (2018).
- Mcbeath, R., Pirone, D. M., Nelson, C. M., Bhadriraju, K., Chen, C. S. Cell Shape, Cytoskeletal tenstion and RhoA regulate stem cell lineage committment. Developmental Cell. 6, 483-495 (2004).
- Halder, G., Dupont, S., Piccolo, S. Transduction of mechanical and cytoskeletal cues by YAP and TAZ. Nature Reviews Molecular Cell Biology. 13, 591-600 (2012).
- Jessen, K. R., Mirsky, R. The repair Schwann cell and its function in regenerating nerves. Journal of Physiology. 594 (13), 3521-3531 (2016).
- Lopez-Fagundo, C., Bar-Kochba, E., Livi, L. L., Hoffman-Kim, D., Franck, C. Three-dimensional traction forces of Schwann cells on compliant substrates. Journal of The Royal Society Interface. 11, 20140247(2014).
- Gu, Y., et al. The influence of substrate stiffness on the behavior and functions of Schwann cells in culture. Biomaterials. 33, 6672-6681 (2012).
- Xu, Z. Y., Orkwis, J. A., DeVine, B. M., Harris, G. M. Extracellular matrix cues modulate Schwann cell morphology, proliferation, and protein expression. Journal of Tissue Engineering and Regenerative. , (2019).
- Urbanski, M. M., et al. Myelinating glia differentiation is regulated by extracellular matrix elasticity. Scientific Reports. 6, 1-12 (2016).
- Sun, Y., et al. Tunable stiffness of graphene oxide/polyacrylamide composite scaffolds regulates cytoskeleton assembly. Chemical Sciences. 9 (31), 6516-6522 (2018).
- Hwang, J. H., et al. Extracellular matrix stiffness regulates osteogenic differentiation through MAPK activation. PLoS One. 10, 1-16 (2015).
- Ryan, A. J., et al. A Physicochemically Optimized and Neuroconductive Biphasic Nerve Guidance Conduit for Peripheral Nerve Repair. Advanced Healthcare Materials. 6, 1-13 (2017).
- Du, J., et al. Prompt peripheral nerve regeneration induced by a hierarchically aligned fibrin nanofiber hydrogel. Acta Biomaterialia. 55, 296-309 (2017).
- Huang, L., et al. A compound scaffold with uniform longitudinally oriented guidance cues and a porous sheath promotes peripheral nerve regeneration in vivo. Acta Biomaterialia. 68, 223-236 (2018).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step Variable Height Photolithography for Valved Multilayer Microfluidic Devices. Jouranl of Visualized Experiments. (119), e55276(2017).
- Gupta, R., et al. Shear stress alters the expression of myelin-associated glycoprotein (MAG) and myelin basic protein (MBP) in Schwann cells. Journal of Orthopaedic Research : Official Publication of the Orthopaedic Research Society. 23, 1232-1239 (2005).
- Harris, G. M., Shazly, T., Jabbarzadeh, E. Deciphering the combinatorial roles of geometric, mechanical, and adhesion cues in regulation of cell spreading. PLoS One. 8 (11), (2013).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Schreck, I., et al. C-Jun localizes to the nucleus independent of its phosphorylation by and interaction with JNK and vice versa promotes nuclear accumulation of JNK. Biochemical and Biophysical Research Communications. 407, 735-740 (2011).
- Shen, K., Qi, J., Kam, L. C. Microcontact printing of proteins for cell biology. Journal Visualized Experiments. (22), e1065(2008).
- Treter, J., et al. Washing-resistant surfactant coated surface is able to inhibit pathogenic bacteria adhesion. Applied Surface Science. 303, 147-154 (2014).
- Lutz, J. F. Polymerization of oligo(ethylene glycol) (meth)acrylates: Toward new generations of smart biocompatible materials. Journal of Polymer Science Part A: Polymer Chemistry. 46 (11), 3459-3470 (2008).
- Marcus, M., et al. Interactions of Neurons with Physical Environments. Advanced Healthcare Materials. 6, (2017).
- Pu, J. Golgi polarization in a strong electric field. Journal of Cell Science. 118, 1117-1128 (2005).
- Blaker, J. J., et al. Bioactive Silk-Based Nerve Guidance Conduits for Augmenting Peripheral Nerve Repair. Advanced Healthcare Materials. 7, 1800308(2018).
- Daly, W., Yao, L., Zeugolis, D., Windebank, A., Pandit, A. A biomaterials approach to peripheral nerve regeneration : bridging the peripheral nerve gap and enhancing functional recovery. Journal of the Royal Society of Interface. 9 (67), 202-221 (2012).
- Xia, H., et al. Directed neurite growth of rat dorsal root ganglion neurons and increased colocalization with Schwann cells on aligned poly(methyl methacrylate) electrospun nanofibers. Brain Research. 1565, 18-27 (2014).
- Wang, H. B., Mullins, M. E., Cregg, J. M., McCarthy, C. W., Gilbert, R. J. Varying the diameter of aligned electrospun fibers alters neurite outgrowth and Schwann cell migration. Acta Biomaterialia. 6, 2970-2978 (2010).
- Carvalho, C. R., Oliveira, J. M., Reis, R. L. Modern Trends for Peripheral Nerve Repair and Regeneration: Beyond the Hollow Nerve Guidance Conduit. Frontiers in Bioengineering and Biotechnology. 7, 337(2019).
- Yang, Y., Wang, K., Gu, X., Leong, K. W. Biophysical Regulation of Cell Behavior - Cross Talk between Substrate Stiffness and Nanotopography. Engineering. 3, 36-54 (2017).
- Tan, J. L., Liu, W., Nelson, C. M., Raghavan, S., Chen, C. S. Simple Approach to Micropattern Cells on Common Culture Substrates by Tuning Substrate Wettability. Tissue Engineering. 10, 865-872 (2004).
- Grove, M., et al. YAP/TAZ initiate and maintain schwann cell myelination. Elife. 6, 1-27 (2017).
- Poitelon, Y., et al. YAP and TAZ control peripheral myelination and the expression of laminin receptors in Schwann cells. Nature Neuroscience. 19, 879-887 (2016).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved