Method Article
ثلاثي الأبعاد موتور العصب الجهازية جيل
In This Article
Summary
يوفر هذا البروتوكول إجراءً شاملاً لتلفيق الجهاز العضوي العصبي الحركي المشتق من الخلايا البشرية من خلال التجميع التلقائي لحزمة قوية من المحاور المُمددة من الزفير في شريحة ثقافة الأنسجة.
Abstract
إنّ كَرَسَة المحاور هي واحدة من الزخارف الهيكلية الرئيسية التي لوحظت في الجهاز العصبي. يمكن أن يسبب اضطراب كراسات المحاور الرئيسية أمراضًا تنموية وعصبية تنكسية. على الرغم من أن العديد من الدراسات التي أجريت على محاور عصبية قد أجريت، فهمنا لتشكيل والخلل الوظيفي من كراسات محور عصبي لا يزال محدودا بسبب عدم وجود نماذج قوية ثلاثية الأبعاد في المختبر. هنا، نحن وصف بروتوكول خطوة بخطوة للجيل السريع من الجهاز العضوي العصب الحركي (MNO) من الخلايا الجذعية متعددة القدرات (iPS) المستحثة من الإنسان في رقاقة زراعة الأنسجة القائمة على ميكروفلويديك. أولا ، يتم وصف تصنيع رقائق المستخدمة في الطريقة. من خلايا iPS البشرية ، يتم تشكيل الخلايا العصبية الحركية (MNS). بعد ذلك، يتم نقل MNS متمايزة في رقاقة. بعد ذلك ، تنمو المحاور تلقائيًا من الزنجي وتتجمع في كراسة داخل قناة صغيرة مجهزة في الشريحة ، والتي تولد أنسجة MNO تحمل حزمة من المحاور الممتدة من الزفير. لتحليل المصب، يمكن إخراج MNOs من الشريحة ليتم إصلاحها للتحليلات المورفولوجية أو تشريحها للتحليلات الكيميائية الحيوية، وكذلك تصوير الكالسيوم وتسجيلات صفيف متعدد الأقطاب. ويمكن أن تيسر المنظمات غير الحكومية التي تولدت بهذا البروتوكول اختبار المخدرات وفحصها، ويمكن أن تسهم في فهم الآليات الكامنة في تطوير والأمراض الناجمة عن كراسات المحاور.
Introduction
الخلايا العصبية الحركية الشوكية (MN) توسيع محاورها إلى عضلات الهيكل العظمي للسيطرة على حركة الجسم. ومساراتها المحورية منظمة ومنظمة تنظيماً عالياً في العملية الإنمائية. على الرغم من العديد من الدراسات على تمديد محور عصبي والتوجيه1، لا تزال آليات تشكيل حزمة محور عصبي منظمة قيد التحقيق. غالبًا ما تتضرر أكسونات الخلايا العصبية الحركية بسبب الأمراض العصبية التنكسية مثل التصلب الجانبي الضموري (ALS)2، ولكن الآليات الفسيولوجية للأمراض المرضية للضرر على كراسات المحاور غير مفهومة بشكل جيد. وهكذا ، هناك حاجة إلى نموذج فسيولوجي والمرضي لتكخيم تشكيل حزمة المحاور والتراجع في هذا المجال.
الخلايا العصبية الحركية المشتقة من الخلايا الجذعية البشرية هي منصة واعدة لفهم التنمية والأمراض مثل ALS3. يمكن استخدام الخلايا الجذعية المتعددة القدرات التي يسببها الإنسان (خلايا iPS) في نمذجة الأمراض باستخدام الخلايا المشتقة من المريض. حتى الآن، تم الإبلاغ عن طرق مختلفة من الخلايا الجذعية متعددة القدرات إلى MN4و5و6. ومع ذلك، محاور عصبية في ثقافة ثنائية الأبعاد موجهة بشكل عشوائي ولا تتكخي في بيئة حيوية في داخل الأعصاب النامية التي يتم تجميعها محاور عصبية أحادية من خلال التفاعلات المحورية الكثيفة7. للتغلب على هذه المسألة، قمنا بتطوير تقنية لتوليد نسيج ثلاثي الأبعاد يشبه العصب الحركي من خلايا iPSالبشرية 8، وسمى الأنسجة كعضوي العصب الحركي (MNO). و MNO يتكون من خلايا الهيئات الموجودة في الخلايا العصبية الحركية spheroid (MNS) وملوسمية محور عصبي تمتد من spheroid. المحاور في الكروسة موجهة نحو اتجاه أحادي الاتجاه ، والتي تشبه المحاور في تطوير الأعصاب الحركية. ومن ثم، توفر MNOs بيئة مجهرية فيزيولوجية فريدة، وهو ما لم يتم من قبل أي أساليب أخرى لثقافة الخلايا العصبية تم تطويرها سابقًا.
في هذا البروتوكول، ونحن وصف أساليب لرقائق زراعة الأنسجة تلفيق، وتمايز الخلايا العصبية الحركية السريعة، وتشكيل الجهاز العصبية الحركية في رقائق المتقدمة. لدينا رقاقة ثقافة الأنسجة بسيطة جدا، وأنه يحتوي على مقصورة فقط لقبول spheroid، وميكنانيل لتشكيل حزمة محور عصبي، ومقصورة لمحطات محور عصبي الإسكان. لا يحتوي الجهاز على هياكل معقدة بما في ذلك ميكروغروف أو مرشحات micropore التي غالباً ما تستخدم لفصل المحاور والهيئات الخلية من الحجم9،10. ومن ثم أجهزتنا يمكن أن تكون ملفقة بسهولة باتباع الخطوات الموضحة في هذا البروتوكول إذا كان إعداد التصوير الضوئي متاحًا.
يتم تحقيق التمايز السريع من خلايا iPS البشرية مع مزيج الأمثل من عوامل الحث والنقش (SB431542، LDN-193189، حمض الريتينويك (RA)، والمجانى الممهدة (SAG)) وعوامل التسارع (SU5402 وDAPT). وقد أفيد أن الجمع بين SU5402 وDAPT يسرع تمايز الخلايا العصبية الطرفية والخلايا العصبية11. في هذا البروتوكول، نقدم ثلاث طرق مختلفة لتوليد MNOs، بحيث يمكن للقراء أن يقرروا طريقة أكثر ملاءمة لاحتياجاتهم. نوصي بإجراء تمايز خلايا iPS البشرية بعد تشكيل spheroid (طريقة 3D) ، حيث يمكن نقل MNS المتمايزة مباشرة إلى شريحة ثقافة الأنسجة. بدلا من ذلك، يمكن تمييز الخلايا iPS الإنسان في الخلايا العصبية الحركية في ثقافة monolayer (2D)، ومن ثم خلق في الخلايا العصبية الحركية ثلاثية الأبعاد spheroids كما أبلغنا سابقا8. لقد قمنا بتحديث البروتوكول، ومع طريقة التمايز ثلاثي الأبعاد الموصوفة في هذا البروتوكول، يمكن تجنب الانتقال من ثنائية الأبعاد إلى ثلاثية الأبعاد ويمكن الحصول على MNOs بوقت تمايز أقصر، وخطوات أقل، وتقليل المخاطر التقنية دون خطوة الانفصام. ويمكن أيضا أن الخلايا العصبية المتاحة تجاريا يمكن استخدامها لتوليد MNS لتقليل الوقت للتمايز.
لتوليد MNO، نحن مثقف MNS في رقاقة ثقافة الأنسجة. تتمدد المحاور من الزاوي وتمتد إلى القناة الدقيقة التي تتجمع فيها المحاور وتحاذي أحادي الاتجاه. وهذا يسهل التفاعل المحوري وتشكيل عفوي من مجموعة مجمعة بإحكام نسيج من المحاور في القنوات الدقيقة، والتي تتحقق بشكل فريد من قبل هذا البروتوكول، في حين إما تشكيل حزمة عفوية أو توجيه محور عصبي التوجه وحده يمكن تحقيقه من قبل بروتوكولات أخرى12،13،14. في تجربة نموذجية، تنتقل خلايا قليلة من الـ spheroids إلى القنوات الدقيقة، وتبقى معظم الخلايا على شكل خلايا سفيرية قريبة. تسمح هذه الطريقة بعزل المحاور بشكل عفوي عن الزائر دون استخدام حواجز مادية تعتمد على الحجم (مثل ميكروغروف أو مرشحات ميكروبور) لفصل المحاور عن أجسام الخلايا.
يمكن أن تخضع MNO الناتجة إلى فحوصات مختلفة، بما في ذلك التحليلات المورفولوجية والبيوكيميائية والفيزيائية. يمكن عزل جسم الخلية وحزمة المحور الموسعة من الناحية الجسدية عن طريق القطع ويمكن تحليلها بشكل منفصل للتجارب المصب، على سبيل المثال، الميكيميا الحيوية. المواد البيولوجية بما في ذلك الحمض النووي الريبي والبروتين يمكن عزلها من مجرد حزم محور عصبي قليلة للمقايس الكيميائية الحيوية العادية بما في ذلك RT-PCR وغرب النشاف. هنا ، نحن وصف بروتوكول لتوليد الجهاز العصبية الحركية من خلايا iPS ، والذي يقدم نموذجًا فسيولوجيًا ومرضيًا جذابًا لدراسة الآلية الكامنة في التطور ومرض كراسات المحاور.
Protocol
1. SU-8 تصنيع العفن عن طريق التصوير الضوئي
ملاحظة: يشمل هذا الإجراء مواد كيميائية خطرة. استخدام غطاء الدخان وPPE في جميع أنحاء.
- تنظيف رقاقة السيليكون (4 بوصة في القطر، 1 ملم سمك، مصقول) مع الأسيتون وضربة مع غاز النيتروجين. ثم خبز في 180 درجة مئوية لمدة 3 دقائق لتجف.
- الاستغناء 3 مل من SU-8 2100 على الرقاقة تنظيفها.
- معطف SU-8 بشكل موحد على رقاقة باستخدام اللفف في 500 دورة في الدقيقة لمدة 10 ق ثم, تدور بالتسلسل في 1500 دورة في الدقيقة لمدة 30 ثانية مع تسارع 300 دورة في الدقيقة / ثانية للحصول على طبقة سميكة 150 ميكرومتر من SU-8.
ملاحظة: تأكد من أن رقاقة السيليكون يتم وضعها في مركز المغطي تدور وثابتة بشكل صحيح عن طريق فراغ. - خبز ناعم الرقاقة على لوحة ساخنة في 50 درجة مئوية لمدة 10 دقائق، في 65 درجة مئوية لمدة 7 دقائق، وعند 95 درجة مئوية لمدة 45 دقيقة.
- تعيين قناع ضوئي (الشكل 1) إلى قناع مصفح وفضح الأشعة فوق البنفسجية (365 نانومتر) لمدة 60 s.
ملاحظة: يجب تحسين وقت التعرض بجرعة مناسبة من الأشعة فوق البنفسجية. - بعد التعرض، خبز رقاقة في 65 درجة مئوية لمدة 6 دقائق، وعند 95 درجة مئوية لمدة 13 دقيقة على لوحة ساخنة.
- تطوير رقاقة لمدة 10-20 دقيقة في SU-8 المطور مع الانفعالات باستخدام شاكر المدارية، وتغيير الحل النامية مرة واحدة أثناء العملية.
ملاحظة: تمديد الوقت النامي عندما يبقى حطام SU-8. - شطف رقاقة في الايزوبروبانول وتجفيف بلطف رقاقة مع غاز النيتروجين.
- قياس ارتفاع SU-8 المودعة بواسطة مجهر قياس وتأكد من أن سمكها حوالي 150 ميكرومتر. ويمكن تخزينها إلى أجل غير مسمى في درجة حرارة الغرفة.
2. PDMS microfluidic المستندة إلى الأنسجة ثقافة رقاقة التصنيع
- إصلاح رقاقة SU-8 المودعة في حاوية (على سبيل المثال، 15 سم طبق بيتري البلاستيك) عن طريق الشريط الجانبي المزدوج.
- انفخ الغبار عن الرقاقة باستخدام غاز النيتروجين.
- لseanize، ووضع رقاقة SU-8 المودعة في غرفة فراغ جنبا إلى جنب مع حاوية صغيرة (على سبيل المثال، 35 مم الطبق). قطرة 10 μL من (tridecafluoro-1،1،2،2-tetrahydrooctyl)-1-trichlorosilane في حاوية صغيرة. لا تطبق مباشرة في (tridecafluoro-1،1،2،2-tetrahydrooctyl)-1-trichlorosilane إلى رقاقة SU-8.
- إغلاق غرفة فراغ بإحكام وتشغيل مضخة فراغ لمدة 2 ساعة على الأقل.
- خذ كوبًا بلاستيكيًا وصب سترومر السيليكون (على سبيل المثال، Silpot 184 أو ما يعادلها Sylgard 184) وعامل المعالجة بنسبة وزن 10:1. ثم، مزيج جيدا باستخدام ملعقة وديغا في غرفة فراغ حتى يتم إزالة فقاعات تماما.
- صب خليط PDMS في الحاوية مع رقاقة SU-8 إلى سمك المطلوب (3-4 مم) وإزالة الغاز مرة أخرى لإزالة الفقاعات.
- خبز PDMS في فرن في 60 درجة مئوية لمدة 3 ساعات على الأقل لعلاج كامل PDMS.
- بعد التبريد، وقطع PDMS الشفاء من رقاقة باستخدام مشرط أو شفرة حلاقة.
- لإنشاء غرفتين من رقاقة ثقافة الأنسجة، لكمة اثنين من الثقوب حيث تقع حجرتين باستخدام لكمة خزعة قطرها 1.5 مم.
- لإنشاء خزان متوسط، قم بإعداد خليط PDMS آخر (مِلْغ السيليكون وعامل المعالجة بنسبة وزن 10:1) وسكبه في طبق بيتري جديد يبلغ 10 سم. ضبط حجم صب إلى 5 مم من سمك PDMS.
- خبز PDMS في فرن في 60 درجة مئوية لمدة 3 ساعات على الأقل لعلاج كامل PDMS.
- بعد تبريد PDMS، وقطع PDMS الشفاء مع مشرط للحصول على حلقة مستطيلة.
- السندات الطبقة السفلى مع الخزان المتوسط عن طريق تطبيق PDMS uncured بينهما والخبز طبقات PDMS تجميعها. هذه التركيبة المستعبدة ينتج عنها شريحة ثقافة أنسجة PDMS.
- تنظيف رقاقة ثقافة الأنسجة PDMS بواسطة شريط سكوتش لإزالة الغبار والجسيمات الصغيرة من السطح. يمكن تخزين رقائق زراعة الأنسجة PDMS في درجة حرارة الغرفة إذا كانت محمية من الغبار والأشعة فوق البنفسجية.
3- إعداد الثقافة
- متوسط الثقافة
ملاحظة: يجب تصفية جميع الوسائط المذكورة أدناه للتعقيم ما لم ينص على خلاف ذلك. قد يتم تخزين الوسائط المعدة عند 4 درجة مئوية واستخدامها في غضون شهر.- لإعداد mTeSR زائد المتوسطة: الجمع بين زجاجة واحدة من 100 مل mTeSR زائد 5x الملحق مع زجاجة واحدة من 400 مل من mTeSR زائد متوسطة القاعدية.
- لإعداد 100 مل من KSR المتوسطة: في 85 مل من DMEM/F12، إضافة 15 مل من استبدال مصل خروج المغلوب (KSR، 15٪)، 1 مل من الملحق الجلوتامين التجاري (1٪) و 1 مل من الأحماض الأمينية غير الأساسية (NEAA، 1٪).
- لإعداد 100 مل من N2 المتوسطة: في 100 مل من المتوسط العصبي، إضافة 1 مل من N2 (100x)، 1 مل من الملحق الجلوتامين التجاري، و 1 مل من NEAA.
- لإعداد 250 مل من متوسط النضج: في 250 مل من المتوسط العصبي، إضافة 5 مل من B27 (2٪)، 2.5 مل من الملحق الجلوتامين التجارية (1٪)، و 2.5 مل من البنسلين / ستريبتوميسين (1٪).
- Resuspend المركبات (حمض الريتينويك (RA)، SB431542، LDN-193189، SU5402، DAPT، SAG، Y-27632) في الخلية ثقافة- الصف DMSO إلى التركيز المطلوب. إعداد aliquots وتخزينها في -20 درجة مئوية لمدة تصل إلى 6 أشهر. وتستخدم حلول الأسهم التالية: 1 M RA، 10 mM SB431542، 100 μM LDN-193189، 10 mM SU5402، 10 mM DAPT، 1 mM SAG، 10 mM Y-27632.
- طلاء
ملاحظة: لمنع البلمرة من مصفوفة غشاء الطابق السفلي عن طريق الحرارة، وتجنب دورات التجميد ذوبان المتكررة. التعامل مع جميع الإجراءات طلاء مع ما قبل تبريد النصائح الأنابيب والميصات إذا كان ذلك ممكنا. وينبغي أن ذاب مصفوفة غشاء الطابق السفلي بين عشية وضحاها في 4 درجة مئوية و aliquoted باستخدام ما قبل النصائح المهدئات الأنابيب. يمكن تجميد aliquots عند -20 درجة مئوية أو -80 درجة مئوية.- اذيب aliquot المجمدة عند 4°C على الجليد. وينبغي أن تبقى aliquot الباردة أثناء إجراء الطلاء. باستخدام طرف ماصة مسبق التبريد، تمييع مصفوفة غشاء الطابق السفلي مع الجليد البارد DMEM/F12 بنسبة 1:40. يمكن تخزين مصفوفة غشاء الطابق السفلي المخفف غير المستخدمة في 4 درجة مئوية لمدة 2-3 أيام بالنظر إلى أنه لم يحدث البلمرة.
- إضافة 1 مل من مصفوفة غشاء الطابق السفلي/ DMEM-F12 حل لمعطف واحد جيدا من 6 لوحة جيدا.
- احتضان لوحة في درجة حرارة الغرفة لمدة ساعة على الأقل، أو 4 درجة مئوية بين عشية وضحاها. يمكن تخزين اللوحات المغلفة عند 4 درجات مئوية لمدة أقصاها أسبوع واحد.
4. صيانة خلايا iPS
ملاحظة: يتم الاحتفاظ بالخلايا iPS غير المتمايزة في mTeSR Plus متوسطة وشبه مثقفة عند ملاحظة التقاء ≥ 90٪ في لوحة 6 بئر في هذا البروتوكول. قد تكون هناك حاجة إلى تعديلات ثانوية لخلايا iPS التي يتم استزراعها في وسائط أخرى.
- إعداد الأطباق المغلفة بالغشاء السفلي المصفوفية كما ذكر سابقا في الخطوة 3.2.
- pirate تماما المتوسطة mTeSR زائد. غسل البئر مرة واحدة مع برنامج تلفزيوني وإضافة 0.5 مل من كاشف passaging (انظر جدول المواد). انتظر بضع ثوانٍ و استلهم الحل.
- احتضان لوحة في 37 درجة مئوية في الحاضنة لمدة 5 دقائق أو حتى تصبح الخلايا جولة.
ملاحظة: قد يختلف وقت الحضانة بين خطوط خلايا iPS المختلفة والتقاء. يرجى التحقق بشكل دوري تحت المجهر لتحديد وقت الانفصال أثناء الحضانة. - إضافة 1 مل من mTeSR زائد المتوسطة والاستفادة من لوحة لمدة 30-60 S لفصل المستعمرات.
- مزيج بلطف 1 مل من حل تعليق الخلية مع 7 مل من mTeSR الطازجة بالإضافة إلى المتوسطة. لا pipette أكثر من 5 مرات.
- لوحة بنسبة 1:8. عادة إضافة 1 مل من التعليق من الخطوة 4.5 وإضافة 1 مل من mTeSR بالإضافة إلى وسائل الإعلام تكملها 5-10 μM من Y-27632 (المانع روك). تعتمد نسبة تخفيف المرور على خط iPSC.
- وضع الخلية في 5٪ ثاني أكسيد الكربون/37 درجة مئوية حاضنة. في اليوم التالي، قم بإزالة Y-27632 عن طريق إضافة mTeSR Plus المتوسطة الطازجة. بعد ذلك، تغيير وسائل الإعلام كل يومين في البداية، وكل يوم كما الخلية تصل إلى أعلى التقاء.
5. التمايز من الخلايا iPS في الخلايا العصبية الحركية
ملاحظة: تنتج كافة الخيارات أدناه (5.2 و5.3 و5.4) MNOs بـ > 90٪ من الكفاءة.
- تمرير iPSC لتمايز الخلايا العصبية الحركية
ملاحظة: يمكن إجراء التمايز بنجاح في بروتوكولات 3D (5.2) أو 2D (5.3).- السماح لخلايا iPS غير المتمايزة بالنمو حتى تصل إلى التقاء 80٪ تقريبًا في mTeSR Plus المتوسط في لوحة 6 بئر.
- pirate تماما المتوسطة. غسل على الفور جيدا مرة واحدة مع برنامج تلفزيوني عقيمة وإضافة 0.5 مل من حل تفكك الخلية إلى الخلايا.
- احتضان لوحة في 37 درجة مئوية في الحاضنة لحوالي 2-3 دقيقة، أو حتى تصبح الخلايا منفصلة ومستديرة ولكن تبقى تعلق على البئر.
- إضافة 1 مل من الماصات المتوسطة وبلطف صعودا وهبوطا عدة مرات باستخدام ماصة المصلية 5 مل. نقل تعليق الخلية إلى أنبوب 15 مل تتكون من 4 مل من المتوسطة.
- جهاز طرد مركزي في 200 × ز لمدة 3 دقائق.
- التعرق بعناية، وترك بيليه دون عائق، وإعادة تعليق الخلايا في 1 مل من المتوسطة تكمل مع 10 μM من Y-27632.
- عد الخلايا باستخدام مقياس الهيموسيت والمضي قدما إما 5.2 (تمايز 3D)، أو 5.3 (تمايز 2D).
- تشكيل الخلايا العصبية الحركية spheroid (MNS) في تمايز 3D ("بروتوكول 3D")
ملاحظة: يتم إجراء تغيير متوسط كامل يوميًا من أيام 0-12 من التمايز(الشكل 2).- بذور الخلايا iPS من الخطوة 5.1.7 إلى 96 جيدا يو لوحة القاع في 40،000 الخلايا / جيدا في 100 ميكرولتر من mTeSR زائد تكملها 10 μM من Y -27632.
- في اليوم التالي، استبدل كل بئر بـ 100 ميكرولتر من الوسيلة الطازجة.
- في أيام 0 و 1: التعرق المتوسط الثقافة واستبدالها مع 100 ميكرولتر من متوسطة KSR (3.1.2) تكمل مع 10 μM SB431542 و 100 NM LDN-193189.
- في الأيام 2 و 3: استشعير المتوسطة الثقافة واستبدالها ب 100 ميكرولتر من متوسط KSR مكمّل بـ 10 ميكرومتر SB431542، 100 nM LDN-193189، 5 ميكرومتر DAPT، 5 ميكرومتر SU5402، 1 ميكرومتر RA و1 ميكرومتر SAG.
- في الأيام 4 و 5: إعداد وسيلة مختلطة تتكون من 75٪ متوسط KSR و 25٪ N2 المتوسطة (3.1.3). ثم، الطامح المتوسطة الثقافة واستبدالها مع 100 ميكرولتر من المتوسطة المختلطة تستكمل مع 10 ميكرومتر SB431542، 100 NM LDN-193189، 5 μM DAPT، 5 μM SU5402، 1 μM RA، و 1 μM SAG.
- في أيام 6 و 7: إعداد وسيلة مختلطة تتكون من 50٪ متوسط KSR و 50٪ N2 المتوسطة. ثم، متوسطة التعرق الثقافة واستبدالها ب 100 ميكرولتر من المتوسط المختلط مع 5 μM DAPT، 5 μM SU5402، 1 μM حمض الريتينويك و 1 μM SAG.
- في أيام 8 و 9: إعداد وسيلة مختلطة تتكون من 25٪ متوسط KSR و 75٪ N2 المتوسطة. ثم، متوسطة التعرق والاستعاضة عن 100 ميكرولتر من المتوسط المختلط مع 5 μM DAPT، 5 μM SU5402، 1 μM RA و 1 μM SAG.
- في الأيام 10 و 11: استبدال المتوسطة مع 100 ميكرولتر من N2 المتوسطة تكملها 5 μM DAPT، 5 μM SU5402، 1 μM RA و 1 μM SAG.
- في اليوم 12: المضي قدما لنقل MNs إلى رقاقة زراعة الأنسجة (الخطوة 6) أو استبدال المتوسطة مع 100 ميكرولتر من المتوسطة النضج (3.1.4) تكملها 20 نانوغرام / مل العامل العصبي المشتق من الدماغ (BDNF).
ملاحظة: يمكن نقل MNS إلى شريحة الثقافة الأنسجة بدءاً من يوم 12 حتى يوم 19. وينبغي أن تبقى الإسفنجات التي لا يتم نقلها مثقفا في 96 جيدا يو لوحات القاع في متوسطة النضج تستكمل مع 20 نانوغرام / مل BDNF حتى نقل.
- (الخيار البديل) تمايز ثنائي الأبعاد والانتقال إلى MNS ثلاثي الأبعاد ("البروتوكول الثنائي الأبعاد")
- استلهم محلول الطلاء من لوحة 12 بئر مغلفة مسبقًا.
- بذور الخلايا iPS من الخطوة 5.1.7 في كثافة 100،000 - 200،000 الخلايا في البئر في mTeSR زائد المتوسطة مع 10 μM من Y-27632.
ملاحظة: متابعة زراعة خلايا iPS غير متمايزة في mTeSR Plus متوسطة دون Y-27632 حتى الخلايا تصل إلى 80٪ التقاء إذا كانت الخلايا متفرقة جداً عن الخطوة التالية (5.3.3). - في أيام 0 و 1: متوسطة الثقافة السبيرات واستبدالها مع 1 مل من متوسطة KSR (3.1.2) تكملها 10 μM SB431542 و 100 NM LDN-193189.
- في أيام 2 و 3: متوسطة ثقافة التعرق واستبدالها مع 1 مل من متوسط KSR تكملها 10 ميكرومتر SB431542، 100 NM LDN-193189، 5 μM DAPT، 5 ميكرومتر SU5402، 1 μM RA و 1 ميكرومتر SAG.
- في الأيام 4 و 5: إعداد وسيلة مختلطة تتكون من 75٪ متوسط KSR و 25٪ N2 المتوسطة (3.1.3). متوسطة لثقافة التعرق واستبدالها بـ 1 مل من المتوسط المختلط المكمل بـ 10 ميكرومتر SB431542 و100 nM LDN-193189 و5 ميكرومتر DAPT و5 ميكرومتر SU5402 و1 ميكرومتر RA و1 ميكرومتر SAG.
- في أيام 6 و 7: إعداد وسيلة مختلطة تتكون من 50٪ متوسط KSR و 50٪ N2 المتوسطة. استلهم الوسط من الاستزراع واستبدله بـ 1 مل من المتوسط المختلط مكمّل بـ 5 ميكرومتر DAPT و5 ميكرومتر SU5402 و1 ميكرومتر حمض الريتينويك و1 ميكرومتر SAG.
- في أيام 8 و 9: إعداد وسيلة مختلطة تتكون من 25٪ متوسط KSR و 75٪ N2 المتوسطة. استلهم متوسطة الثقافة واستبدالها بـ 1 مل من المتوسط المختلط المكمل بـ 5 ميكرومتر DAPT و5 ميكرومتر SU5402 و1 ميكرومتر RA و1 ميكرومتر SAG.
- في الأيام 10 و 11: استبدال المتوسطة مع 1 مل من N2 المتوسطة تكملها 5 μM DAPT، 5 μM SU5402، 1 μM RA و 1 μM SAG.
- في اليوم 12: التعرق المتوسطة التمايز، وغسل بسرعة جيدا مرة واحدة مع برنامج تلفزيوني وإضافة 0.5 مل من المتوسطة مفرزة الخلية. ضع اللوحة في حاضنة 37 درجة مئوية لمدة 1-3 دقائق (على سبيل المثال، إذا كنت تستخدم TrypLE Express) أو 20-30 دقيقة (على سبيل المثال، إذا كان استخدام Accutase).
- باستخدام ماصة P1000، وجمع بلطف الخلايا ونقل الخلايا إلى أنبوب مخروطي 15 مل مع المتوسطة النضج الطازجة والطرد المركزي في 200 × ز لمدة 3 دقائق. إذا كانت الخلايا مكمّلة، فإنّها مُصّة برفق صعوداً وهبوطاً عدة مرات. لا الماصات كثيرا لأن هذا قد يسبب ضررا للخلايا.
- استلهمت من فوق و resuspend بيليه في 1 مل من متوسط النضج (3.1.4) تكمل مع 20 نانوغرام / مل BDNF.
- عد الخلية باستخدام مقياس الهيموسيت. لوحة الخلايا في 10،000-40،000 الخلايا في بئر في 96 بئر يو لوحة القاع في متوسطة النضج تكملها 20 نانوغرام / مل من BDNF. وينبغي تحسين كثافة البذر الأولية اعتمادا على خط الخلية iPS وحالة الخلايا بحيث يكون قطر الزفير 800-900 μm عندما أدخلت في رقاقة ثقافة الأنسجة. في معظم الحالات، تبدأ في 20،000 الخلايا في كل بئر في البداية، ومن ثم زيادة أو نقصان عدد الخلايا وفقا لحجم.
- ثقافة إضافية لمدة 3-10 أيام حتى تشكل الخلايا spheroid مع حافة ناعمة.
- (الخيار البديل): تشكيل MNS من الخلايا العصبية الحركية
ملاحظة: يمكن استخدام الخلايا العصبية الحركية المشتقة من الخلايا iPS البشرية المتاحة تجاريًا (انظر جدول المواد)لتوليد MNOs بدلاً من التمييز عن خلايا iPS البشرية.- بعد ذوبان cry الخلايا العصبية الحركية، بسرعة إعادة تعليق الخلايا مع 9 مل من الخلايا العصبية الحركية المتوسطة. تدور أسفل في 400 × ز لمدة 5 دقائق في درجة حرارة الغرفة.
- التعرق وssuspend بيليه مع وسط الخلايا العصبية الحركية.
- اتبع نفس الخطوات كما أعلاه (5.3.12-5.3.13) لإنتاج MNSs.
6. إعداد رقاقة ثقافة الأنسجة لتشكيل الجهاز العصبية الحركية (MNO)
- تعقيم PDMS المعدة (من الخطوة 2.13) عن طريق غمره في 70٪ الإيثانول في طبق بيتري لمدة 1 ساعة على الأقل.
ملاحظة: يجب معالجة كافة الخطوات التالية في خزانة السلامة الحيوية. - تعقيم الزجاج المجهر (76 × 52 ملم) عن طريق غمره في 70٪ الإيثانول في طبق بيتري.
- أثناء عملية التجفيف من الزجاج المجهر، ووضع الجهاز PDMS على الزجاج نصف الرطب المجهر والسماح لها تجف تماما عن طريق الانتظار بين عشية وضحاها. وبمجرد أن يتم تجفيفها تماما، يجب أن الجهاز PDMS التمسك الزجاج.
ملاحظة: هذا الترابط غير دائم للسماح فصل أجهزة PDMS من زجاج المجهر بعد الثقافة لجمع الأنسجة. يمكن استخدام الترابط الدائم بواسطة بلازما الأكسجين لتعظيم التصاق بين PDMS والزجاج ، ولكنه يحظر تفكيك الرقائق وجمع الأنسجة. - معطف سطح microchannel في الجهاز PDMS والزجاج المجهر مع 30 ميكرولتر من مصفوفة غشاء الطابق السفلي المخفف في DMEM /F12 (1:40) عن طريق جعل قطرة على جانب واحد من مدخل القناة ومن ثم التعرق الحل من الجانب الآخر من مدخل مع مضخة ماصة أو شفط(الشكل 3A). لا تتبخر الكثير من حجم الحل لتجنب التلوث الفقاعي.
- ثم، احتضان جهاز PDMS لمدة 1 ساعة في درجة حرارة الغرفة أو بين عشية وضحاها في 4 درجة مئوية في حاوية ثانوية (على سبيل المثال، طبق بيتري).
7. تشكيل الجهاز الجهازي العصبي (MNO)
- استبدال حل الطلاء مع ما قبل warmed 150 ميكرولتر من متوسطة النضج تكملها 20 نانوغرام / مل من BDNF قبل الاستخدام.
- ثم ضع MNS من الخطوة 5.2.9 أو 5.3.13 في مدخل القناة الدقيقة باستخدام ميكروسيبيت مع طرف واسع تتحمل. يمكن أن تستقر MNS تلقائيا في الجزء السفلي من الجهاز عن طريق الجاذبية. لا تطبق الكثير من الضغط عند حقن MNS (الشكل 3B).
ملاحظة: إذا كان MNS عالقًا على الجدار الجانبي لثقب في شريحة ثقافة الأنسجة، قم بتحويل الحل بلطف من جانب آخر من مدخل. - ملء خزان صغير (على سبيل المثال، قبعة من 15 مل أنبوب) مع الماء المعقم ووضعها في مكان قريب رقاقة ثقافة الأنسجة في حاوية ثانوية لمنع التبخر المتوسط. ثم، وضعه في 5٪ CO2/37 درجة مئوية حاضنة.
- لتغيير متوسط ، الطامح المتوسط ثقافة استنفدت من وسط الخزان المتوسط(الشكل 3C). لا تتبخر جميع المتوسطة والأنسجة.
- إضافة بلطف نضوج المتوسطة الطازجة (مع BDNF). يجب تغيير الوسيلة كل 2-3 أيام. لا تجف الثقافة المتوسطة في أي وقت خلال الثقافة. أكسونز تنمو من MNS إلى القناة وتجميعها تلقائيا في حزمة واحدة في 2-3 أسابيع، مما يؤدي إلى تشكيل MNO. يمكن أن تكون مثقفة MNO لأكثر من 1 شهر إضافي في الجهاز.
8. التحليل المصب ل MNO
- كامل جبل مناعية
- أحضر الجهاز أو الأطباق إلى غطاء أبخرة كيميائي. إصلاح MNO عن طريق إضافة حجم يساوي تقريبا من 8٪ شبهformaldehyde (PFA) إلى وسائل الإعلام لتحقيق تركيز نهائي من 4٪ PFA. قشر قبالة جهاز PDMS من الزجاج واحتضان لمدة 15-20 دقيقة في درجة حرارة الغرفة.
- غسل MNO مع برنامج تلفزيوني ثم كرر PBS غسل 2x.
- Permeabilize MNO مع 0.2٪ من تريتون X-100 في برنامج تلفزيوني واحتضان لمدة 5 دقائق في درجة حرارة الغرفة.
- غسل MNO مع برنامج تلفزيوني ثم كرر PBS غسل 2x. ثم، كتلة MNO مع برنامج تلفزيوني يحتوي على 1٪ BSA واحتضان لمدة 1 ساعة في درجة حرارة الغرفة.
- تمييع الأجسام المضادة الأولية في برنامج تلفزيوني تحتوي على 0.1٪ BSA و MNO احتضان مع حل الأجسام المضادة الأولية بين عشية وضحاها في 4 درجة مئوية. غسل MNO مع برنامج تلفزيوني ثلاث مرات.
- تخفيف الأجسام المضادة الثانوية في برنامج تلفزيوني مع 0.1٪ BSA و MNO احتضان مع حل الأجسام المضادة الثانوية لمدة 2 ساعة في درجة حرارة الغرفة. ثم غسل MNO ثلاث مرات مع برنامج تلفزيوني.
- وصمة عار مع MNO Hoechst في برنامج تلفزيوني يحتوي على 0.2٪ تريتون X واحتضان لمدة 5 دقائق في درجة حرارة الغرفة.
- غسل MNO ثلاث مرات مع برنامج تلفزيوني. MNO المثبطة للمناعة جاهزة للتصوير باستخدام مجاهر الليزر الفلورسنت أو النقوش.
- جمع الأنسجة وعزل حزمة محور عصبي
- صب 10 مل من حل HBSS في طبق بيتري 10 سم. ثم، غمر جهاز PDMS بأكمله في حل HBSS.
- قم بفصل PDMS بعناية من زجاج المجهر تحت منظار مجسم. عندما تلتصق الأنسجة بجهاز PDMS، قم بتطبيق محلول HBSS برفق من أعلى الثقب باستخدام ماصة.
- بمجرد أن يأتي النسيج من PDMS ، قم بتطبيق 1 مل من HBSS بلطف على زجاج المجهر لفصل PDMS تمامًا عن زجاج المجهر.
- لعزل حزمة محور عصبي من الزاوي، قطع حزمة محور عصبي بسكين جراحية أو ملاقط تحت المجهر. قطع حزمة محور عصبي بعيدا قليلا (> 1 مم) من spheroid لتجنب تلوث الخلايا المهاجرة.
- ويمكن تحليل حزم المحاور المعزولة وs تنفر من خلال تحليلات مختلفة المصب مثل RT-PCR وRNA-seq و التنقيط الغربي.
- يمكن إعادة استخدام شريحة الثقافة PDMS. لتنظيف رقاقة الثقافة، sonicate رقاقة الثقافة داخل الماء المقطر لمدة 15 دقيقة. ثم، سونيكات رقاقة في الماء المقطر تكمل مع 1٪ المنظفات. غسل رقاقة الثقافة بالماء المقطر 5 مرات.
- تصوير الكالسيوم
ملاحظة: يمكن قياس نشاط الخلايا العصبية بمؤشر الكالسيوم قبل وبعد جمع الأنسجة من شريحة زراعة الأنسجة (من 8.2). ويستند البروتوكول على مجموعة تجارية محددة (انظر جدول المواد). بدلاً من ذلك، يمكن استخدام مجموعات تصوير الكالسيوم الأخرى أو ما يعادلها من الأساليب.- غسل MNO مع برنامج تلفزيوني (بدون كاليفورنيا2+ و Mg2+) لمدة ثلاث مرات.
- احتضان الأنسجة مع 5 ميكرومتر من Fluo-4AM في تسجيل المتوسطة (20 mM HEPES، 115 mM NaCl، 5.4 mM KCl، 0.8 mM MgCl2، 1.8 mM، CaCl2، 13.8 M الجلوكوز) لمدة 30-60 دقيقة عند 37 درجة مئوية. إضافة 0.01-0.02 ٪ من Pluronic F-127 يمكن أن تساعد في امتصاص فلوو-4 صباحا في الخلايا.
- ثم، وغسل الأنسجة مع برنامج تلفزيوني (بدون كاليفورنيا2+ و Mg2 +) واستبدالها مع تسجيل المتوسطة.
- احصل على صور الفاصل الزمني باستخدام المجهر الفلورسنت مع مجموعة مرشح GFP/Cy2. تعيين وقت التعرض أقل من 20 مللي ثانية لكل إطار.
- افتح ملف الفيلم المكتسب كتسلسل صورة باستخدام Image J.
- إذا كنت تستخدم كاميرا CCD أو CMOS ملونة، قم بتحويل صور RGB إلى صور أحادية 16 بت. فتح "تحليل | | الأدوات مدير ROI"، رسم المنطقة ذات الاهتمام وانقر فوق"إضافة". انقر فوق "متعدد القياس". سيتم عرض متوسط الكثافة في عائد الاستثمار المتعدد في النتيجة.
- رسم تغيير كثافة الإشارة باستخدام برنامج تحليل البيانات العامة.
- قياس نشاط الخلايا العصبية من قبل مجموعة متعددة الأقطاب الكهربائية
ملاحظة: يمكن التقاط نشاط الخلايا العصبية الحركية بواسطة مجموعة متعددة الأقطاب الكهربائية (MEA).- بعد إنشاء MNO، نقله إلى مصفوفة غشاء الطابق السفلي المغلفة MEA التحقيق. ضع النسيج على الأقطاب الكهربائية.
- أضف 200 ميكرولتر من متوسط النضوج واحتضان 1-2 ساعة عند 37 درجة مئوية للسماح لـ MNO بالتصاقه بالسطح.
- يستعاض عن الوسيطة بوسيلة تسجيل (8.3.2). ضع شبكة ووزن بشكل اختياري فوق MNO لزيادة العقد مع الأقطاب الكهربائية.
- تعيين مسبار MEA إلى مرحلة الرأس التسجيل. امسح الاتصال بين مسبار MEA والمرحلة الرأسية مع الإيثانول بنسبة 70٪.
- بدء تسجيل نشاط الخلايا العصبية باتباع تعليمات من الشركات المصنعة ل MEA.
النتائج
تم تمييز الخلايا العصبية الحركية في غضون 12-14 يوما في إجراءات التمايز 3D(الشكل 4 والشكل 5). الأهم من ذلك, أكثر من 60٪ من الخلايا أعرب علامة الخلايا العصبية الحركية HB9 خلال التمايز. كشفت الكيمياء المناعية أن ما يقرب من 80٪ من الخلايا في MNS كانت الخلايا العصبية الحركية الإيجابية SMI32. HB9 و SMI32 هي المنشأة في مرحلة مبكرة علامات الخلايا العصبية الحركية15,16. التعبير عن HB9 وSMI32 هي المعايير الرئيسية التي تحتاج إلى تأكيد لضمان الهوية الخلوية للخلايا العصبية الحركية. بعد إدخال MNS في رقاقة الثقافة ، تمتد المحاور إلى القناة ونماذج حزمة محور عصبي. بسبب microchannels بمثابة أدلة المادية، axons الإطالة من MNS وتشكيل حزمة من التفاعل محور عصبي(الشكل 6A). من الضروري التأكد من تشكيل حزمة محور عصبي من خلال المراقبة المجهرية لتأكيد توليد MNO. ويحمل MNO الناجح حزمة محور عصبي أوسع من 50 ميكرومتر وعدد قليل من المحاور المعزولة من الحزمة في القناة. ويمكن ملاحظة الإطالة الأولية للمحور بعد 24 ساعة من إدخال الزفير. في غضون 3-4 أيام القادمة ، وصلت المحاور إلى مركز القناة الدقيقة ثم تصل إلى الطرف الآخر في غضون 10 أيام إضافية (الشكل 6A). وبالتالي، جمعت محاور عصبية وشكلت حزمة مستقيمة و أحادية الاتجاه في 2-3 أسابيع في رقاقة، ولوحظت الأنشطة العصبية بعد ذلك.
يمكن جمع الأعضاء العصبية الحركية من رقاقة عن طريق فصل PDMS من الزجاج المجهر للتحليل البيولوجي(الشكل 6B). يمكن تشريح حزم أكسون والهيئات الخلية وعزلها عن طريق قطع باستخدام سكين جراحية أو ملاقط تحت المجهر (الشكل 6B). ويمكن استخدام هذه المواد البيولوجية بما في ذلك الحمض النووي الريبي والبروتين للمقايس الكيميائية الحيوية العادية مثل RT-PCR وغرب النشاف. في حزم محور عصبي من MNOs، لا يتم الكشف عن البروتينات صانع النووية أو التشعب في النشاف الغربية(الشكل 6C).
في تركيبة مع مؤشر الكالسيوم (Fluo-4 AM), يمكن التقاط نشاط الخلايا العصبية في رقاقة ثقافة الأنسجة. لوحظ النشاط التلقائي للخلايا العصبية الحركية في spheroid وحزمة محور عصبي داخل MNO. أيضا، لوحظت الأنشطة العصبية باستخدام نظام صفيف متعدد الأقطاب.
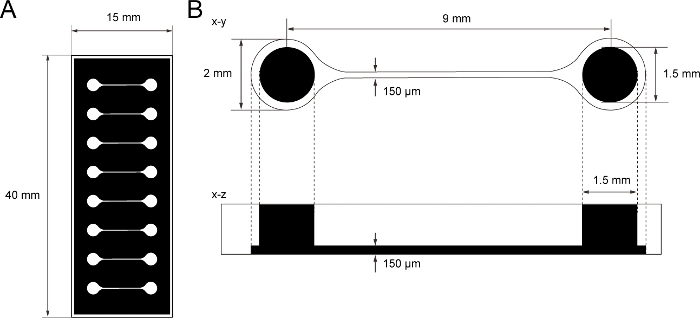
الشكل 1: البعد من رقاقة ثقافة الأنسجة PDMS.
(أ) Photomask من رقاقة ثقافة الأنسجة. (ب) أبعاد microchannel في رقاقة ثقافة الأنسجة. قطر الغرفة الأساسية لعقد الخلايا العصبية الحركية spheroid هو 2 مم وثقب PDMS فوق الغرفة هو 1.5 ملم. العرض والارتفاع من microchannel سد غرفتين كلاهما 150 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
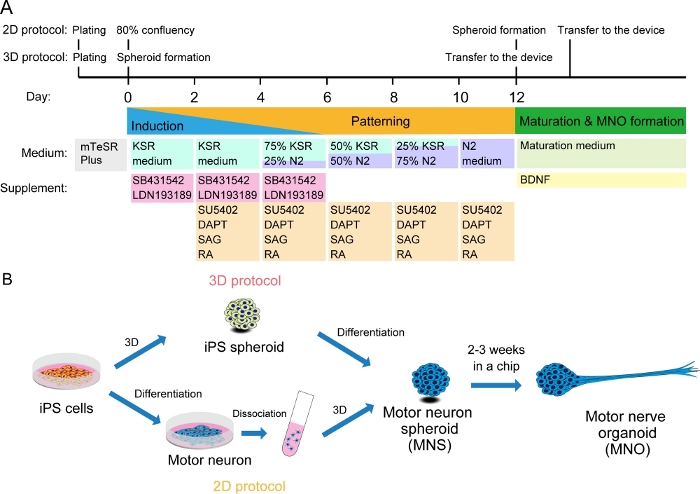
الشكل 2: رسم تخطيطي لتمايز الخلايا العصبية الحركية.
(أ)وشملت خطوات التمايز التعريفي العصبي، والنقش في سلالة الخلايا العصبية الحركية، ونضج الخلايا العصبية الحركية. (ب) خيارين لإنشاء الخلايا العصبية الحركية spheroid (MNS) من خلايا iPS: بروتوكول 3D، وبروتوكول 2D مع خطوة تفكك الخلايا العصبية الحركية. يمكن الحصول على الجهاز العضوي العصبية الحركية (MNO) بواسطة كلا البروتوكولين. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
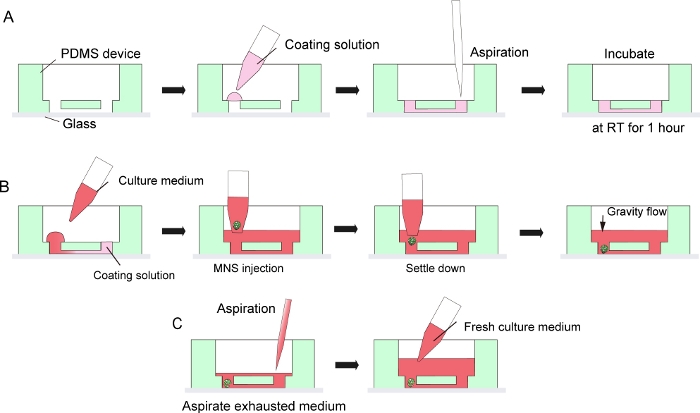
الشكل 3: خطوة بخطوة بروتوكول لطلاء مصفوفة غشاء الطابق السفلي والخلايا العصبية الحركية spheroid مقدمة.
(A) الطابق السفلي غشاء مصفوفة الطلاء في قناة رقاقة ثقافة الأنسجة. (B) MNS إدخال في ثقب الرقاقة. (ج)الثقافة متوسطة التغير من خلال طموح المتوسط المنهك. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
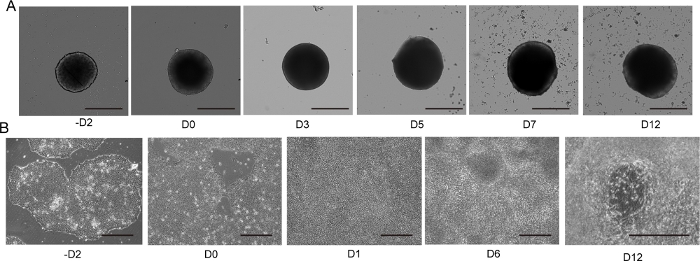
الشكل 4: 2D و 3D تمايز الخلايا العصبية الحركية.
(أ) المسار الزمني للتمايز MNS 3D التمثيلي (بروتوكول ثلاثي الأبعاد). ازداد حجم MNS تدريجيا مع مرور الوقت. شريط مقياس: 500 μm. (ب) المسار الزمني للتمايز 2D على -D2, D0, D1, D6, D12 (بروتوكول 2D). شريط مقياس: 500 μm. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
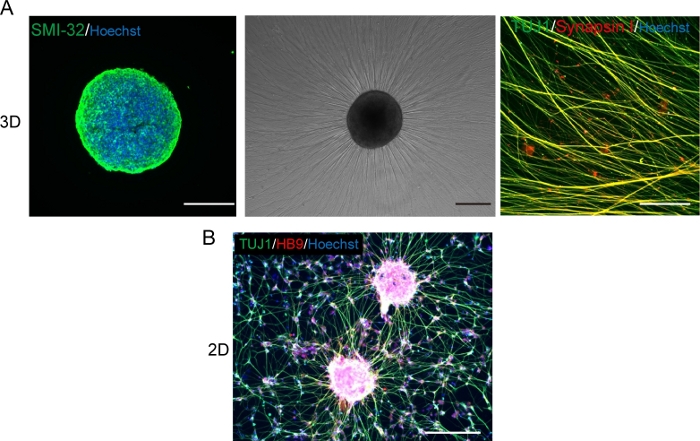
الشكل 5: توصيف الخلايا العصبية الحركية.
(A) (يسار) اكشن من MNS ملطخة بالأجسام المضادة SMI-32 و DAPI. (وسط) صورة على النقيض من المرحلة من MNS أعيد طلائها على سطح مكسو بالغشاء السفلي. لوحظت اطالة أكسونال. (يمين) أكسونات من MNS إعادة طلاء ملطخة مع الأجسام المضادة سينابسين الأول و Tuj1. شريط مقياس: 500 ميكرومتر (يسار ووسط) و50μm (يمين). (B) صورة تمثيلية من الخلايا العصبية الحركية 2D المثبطة مع الأجسام المضادة Tuj و HB9. مقياس شريط: 200 μm. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
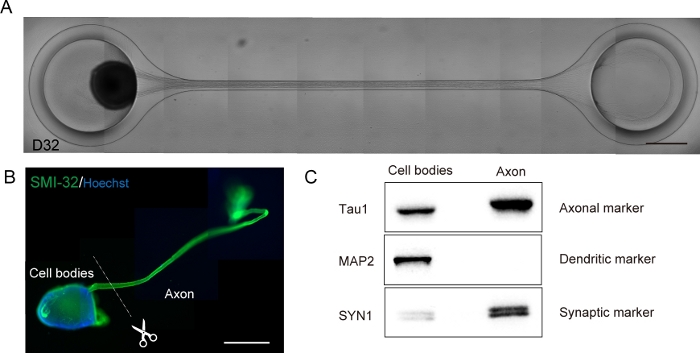
الشكل 6: توصيف الجهاز العضوي العصبي الحركي (MNO) الذي تم إنشاؤه في شريحة الثقافة.
(أ)صور تمثيلية من مُزَمّة المحاور ومحور التركيز السميك على D32. شريط مقياس: 500 μm. (ب) المناعة من الجهاز العضوي العصبية الحركية (MNO) بواسطة SMI-32 و DAPI. يمكن عزل أجهزة أكسون وأجساد الخلايا عن طريق القطع الجسدي. شريط مقياس: 1 مم . (C) نقاء البروتين من محاور والهيئات الخلية كميا بواسطة النشاف الغربية. لم يتم اكتشاف MAP2، وهو علامة تشعبية، في بروتين محور عصبي، في حين أن علامة الـ Tau1 المحورية غنية في بروتين محور المحور. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يصف هذا البروتوكول تشكيل الجهاز العضوي العصبي الحركي (MNO) الذي يحتوي على حزمة محور عصبي ممتدة من الخلايا العصبية الحركية التي تم إنشاؤها من خلايا iPS البشرية. حزمة محور عصبي شكلت سميكة، مرنة، ومنظمة تنظيما جيدا في هياكل أحادي الاتجاه. عن طريق تشريح حزمة محور عصبي، يمكن الحصول على البروتين المحوري عالية النقاوة والرنا بما فيه الكفاية للتحليلات الكيميائية الحيوية. يمكن قياس نشاط الخلايا العصبية في حزم المحاور وspheroids مع تصوير الكالسيوم. لم يتم اكتشاف تلوث البروتينات النووية والتشعبية في lysate محور عصبي من قبل النشاف الغربي ، مما يدل على أن طريقتنا فصل المحاور بكفاءة من أجسام الخلايا والتشعبات.
واحدة من مزايا هذا البروتوكول هو التمايز السريع وتوليد MNO مجهزة حزمة محور عصبي، والتي يمكن أن يتم كل العمليات في 4 أسابيع مع بروتوكول 3D و 5-6 أسابيع باستخدام بروتوكول 2D. هذا هو قصيرة بالمقارنة مع بروتوكولات أخرى والتي عادة ما يستغرق 3-4 أسابيع لمجرد التفريق في MN من الخلايا الجذعية الجنينية والخلايا iPS17 ويستغرق إضافية 2-4 أسابيع للحصول على استطالة محور عصبي. ويفضل البروتوكول ثلاثي الأبعاد عموماً على البروتوكول الثاني الأبعاد بسبب قصر وقت التمايز، والخطوات الأقل، وتقليل المخاطر التقنية دون خطوة الانفصام مقارنة بالبروتوكول الثاني. تم تصميم رقاقة زراعة الأنسجة القائمة على microfluidic بطريقة بحيث يمكن لمحور عصبي MNS الإطالة نحو المقصورة الأخرى من خلال القناة الدقيقة ، مما يسهل تشكيل حزمة من المحاور عن طريق تحفيز التفاعلات المحورية والتقارب بين المحاور. بسبب مجموعة تجريبية بسيطة، وجميع البروتوكولات المذكورة هنا لا يمكن أن يؤديها فقط من قبل الهندسة الحيوية، الذين هم على دراية التلاعب من رقاقة ثقافة الأنسجة، ولكن أيضا علماء الأحياء وعلماء الأعصاب الذين ليسوا على دراية microfluidics وتقنيات microfabrication. وتجدر الإشارة إلى أن الخطوات 1 و 2 يمكن أيضا أن تنفذ باستخدام خدمة تصنيع خارجي.
إحدى الخطوات الهامة لإنجاز البروتوكول هو تغيير تسلسلي من الوسيطة الثقافة. ينصح بتغيير الوسط الثقافي بشكل كامل في كل خطوة أثناء التمايز بحيث لا تخل العوامل في الوسط المستهلك بتمايز MN. نقطة أخرى هامة من هذا البروتوكول هو الحفاظ على خلايا iPS غير متمايزة في نوعية جيدة. جودة ثقافة خلية iPS الأولية تؤثر بشكل كبير على كفاءة الحصول على الخلايا العصبية الحركية و MNO. نقطة أخرى هي أن قطر MNS يجب أن يكون أصغر من حجم ثقب الرقاقة (1.5 ملم). لا يمكن أن يدخل الزفير الكبير الغرفة ، ويحتمل أن تواجه نخر نقص الأكسجة الشديد في الجزء الأوسط. يمكن التحكم في حجم MNSs عن طريق تغيير عدد البذر الأولي من خلايا iPS (في بروتوكول 3D) أو الخلايا العصبية الحركية (في بروتوكول 2D). يجب تحسين كثافة البذر من الخلايا لكل خط خلية iPS.
وقد استخدمت على نطاق واسع أجهزة microfluidic مجزأة مع microgrooves ومرشحات المسام الصغيرة لفصل المحاور من الهيئات الخلوية dendrites. ويمكن لهذه التقنية أيضا فصل محاور من الأجسام الخلوية وdendrite، مع وفرة متفوقة من المحاور في الأنسجة المجمعة. بالمقارنة مع الأساليب الأخرى ، أحد القيود الرئيسية لهذه الطريقة هو أنه لا يمكن فصل اثنين من وسائل الإعلام ثقافة مختلفة في التصميم الحالي لرقاقة ثقافة الأنسجة ، مما يعوق القدرة على الثقافة المشتركة من خليتين مختلفتين تتطلب اثنين من وسائل الإعلام المتميزة. وثمة قيد آخر هو أن رقاقة PDMS وضع قيود محددة سلفا على حجم الأنسجة. لا يمكن أن يدخل الزفير أكبر من الثقب الغرفة ، ولا يمكن أن تنمو حزمة محور عصبي أكثر سمكًا من عرض قناة microfluidic.
يمكن تطبيق هذه الطريقة على أنواع أخرى من الخلايا العصبية. وقد أظهرت مجموعتنا القدرة على نموذج الجهاز الدماغي باستخدام طريقة معدلة جنبا إلى جنب مع تقنيات organoid الدماغية18. تم إدخال كرويات القشرية في كل من المقصورات والمحاور الممدود تلقائياً نحو كل كروية، وبعد ذلك حزمة محور عصبي شكلت تلقائياً. ونتيجة لذلك، يمكن توصيل اثنين من كرويات القشرية من خلال حزمة محور عصبي، ويمكن الحصول على الأنسجة كقطعة واحدة. وهذا يدل على أن النهج هو تنوعا للغاية لتشكيل أنسجة حزمة محور عصبي بغض النظر عن أنواع الخلايا العصبية. في هذا البروتوكول، تم استخدام الخلايا iPS البشرية، ومع ذلك، يمكن استخدام الخلايا الجذعية الأخرى بما في ذلك الخلايا ES البشرية والخلايا الجذعية العصبية البشرية مع تعديلات على البروتوكول المقدم. يمكن توليد 3D spheroids من الخلايا العصبية من بروتوكولات متنوعة19,20. هذه الطريقة لصنع الأنسجة مع حزمة محور عصبي يمكن أن يكون من المحتمل أن تكون مجتمعة في المستقبل مع بروتوكولات التمايز الأخرى لصنع 3D MN spheroid. وبالإضافة إلى ذلك، يمكن التحكم في سمك وطول حزمة محور عصبي ببساطة عن طريق تغيير عرض وارتفاع microchannels من رقاقة ثقافة الأنسجة للتطورات المستقبلية.
ونعتقد أن هذا البروتوكول يمكن استخدامه لاختبار المخدرات وفحصها ويمكن أن يسهم في فهم الآليات التي تقوم عليها عملية تطوير والأمراض في إطار إطار منابع المحاور.
Disclosures
في جزء من هذا البروتوكول، تم ترخيص براءة اختراع لشركة Jiksak للهندسة الحيوية، Inc. التي أسسها جيرو كاوادا.
Acknowledgements
وقد دعمت هذه الدراسة من قبل الجمعية اليابانية لتعزيز العلوم (JSPS) المنح في المعونة للبحث العلمي 17H05661 و 18K19903 ، Core-2- الأساسية ، و ما وراء معهد الذكاء الاصطناعي.
Materials
| Name | Company | Catalog Number | Comments |
| (Tridecafluoro-1,1,2,2-tetrahydrooctyl)-1-trichlorosilane | Sigma | 440302 | |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | Electron Microscopy Sciences | 15710 | |
| 200µl Wide Bore Pipet Tips | BMBio | BMT-200WRS | |
| 6-well plates | Violamo | 2-8588-01 | |
| Accutase | ICT | AT104 | |
| B-27 Supplement (50X) | Gibco | 17504044 | |
| Bovine serum albumin | Sigma | A6003 | |
| Brain-derived neurotrophic factor (BDNF) | Wako | 020-12913 | |
| CO2 incubator | Panasonic | MCO-18AIC | |
| Cryostor CS10 | Stem Cell Technologies | 07959 | |
| DAPT | Sigma | D5942 | |
| DMEM/F12 | Sigma | D8437 | |
| Fluo-4 AM | Dojindo Laboratories | CS22 | |
| GlutaMAX Supplement | Gibco | 35050-061 | |
| Growth factor reduced Matrigel (basement membrane matrix) | Corning | 354230 | |
| HB9 Antibody | Santa Cruz | sc-22542 | |
| HBSS | Wako | 085-09355 | |
| Hoechst 33342 | Sigma | 14533 | |
| iCell motor neuron (commercially available human iPS cell-derived motor neurons) | Cellular Dynamics | R1051 | |
| Isopropyl alcohol (IPA) | Wako | 166-04836 | |
| Knock Out Serum Replacement | Gibco | 10828028 | |
| LDN193189 | Sigma | SML0559 | |
| MEA probe | Alpha MED Scientific inc | MED-P5004A | |
| MEM Non-essential Amino Acid Solution (100x) (NEAA) | Sigma | M7145 | |
| Microscope Glass | Matsunami | S9111 | |
| mTeSR Plus | Stem Cell Technologies | 05825 | |
| N2 supplement | Wako | 141-08941 | |
| Neurobasal medium | Gibco | 21103049 | |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Photoresist SU-8 2100 | Microchem | #SU-8 2100 | |
| Prime surface 96U | Sumitomo Bakelite | MS-9096U | |
| ReLeSR (passaging reagent) | Stem Cell Technologies | 05872 | |
| Retinoic acid | Wako | 186-01114 | |
| SAG | Sigma | SML1314 | |
| SB431542 | Wako | 192-16541 | |
| Silicon wafer | SUMCO | PW-100-100 | |
| Silpot 184 w/c kit | Dow Toray | Silpot 184 w/c kit | |
| Smi32 Antibody | Biolegend | 801701 | |
| SU5402 | Sigma | SML0443 | |
| SU-8 Developer | Microchem | Y020100 | |
| Synapsin I Antibody | Millipore | Ab1543 | |
| TrypLE Express liquid without phenol red (dissociation solution) | Gibco | 12604-021 | |
| Tuj1 Antibody | Biolegend | 801202 | |
| Y-27632 | Wako | 030-24021 |
References
- Raper, J., Mason, C. Cellular strategies of axonal pathfinding. Cold Spring Harbor Perspective Biology. 2 (9), 001933(2010).
- Ito, Y., et al. RIPK1 mediates axonal degeneration by promoting inflammation and necroptosis in ALS. Science. 353 (6299), 603-608 (2016).
- Fujimori, K., et al. Modeling sporadic ALS in iPSC-derived motor neurons identifies a potential therapeutic agent. Nature Medicine. 24 (10), 1579-1589 (2018).
- Chen, H., et al. Modeling ALS with iPSCs Reveals that Mutant SOD1 Misregulates Neurofilament Balance in Motor Neurons. Cell Stem Cell. 14 (6), 796-809 (2014).
- Osaki, T., Uzel, S. G. M., Kamm, R. D. Microphysiological 3D model of amyotrophic lateral sclerosis (ALS) from human iPS-derived muscle cells and optogenetic motor neurons. Science Advances. 4 (10), (2018).
- Imamura, K., et al. The Src/c-Abl pathway is a potential therapeutic target in amyotrophic lateral sclerosis. Science Translational Medicine. 9 (391), (2017).
- Wang, L., Marquardt, T. What axons tell each other: axon-axon signaling in nerve and circuit assembly. Current Opinion in Neurobiology. 23 (6), 974-982 (2013).
- Kawada, J., et al. Generation of a Motor Nerve Organoid with Human Stem Cell-Derived Neurons. Stem Cell Reports. 9 (5), 1441-1449 (2017).
- Nagendran, T., Poole, V., Harris, J., Taylor, A. M. Use of Pre-Assembled Plastic Microfluidic Chips for Compartmentalizing Primary Murine Neurons. JoVE. (141), e58421(2018).
- Paranjape, S. R., Nagendran, T., Poole, V., Harris, J., Taylor, A. M. Compartmentalization of Human Stem Cell-Derived Neurons within Pre-Assembled Plastic Microfluidic Chips. JoVE. (147), e59250(2019).
- Chambers, S. M., et al. Combined small-molecule inhibition accelerates developmental timing and converts human pluripotent stem cells into nociceptors. Nature Biotechnology. 30 (7), 715-720 (2012).
- Rimington, R. P., Fleming, J. W., Capel, A. J., Wheeler, P. C., Lewis, M. P. Bioengineered model of the human motor unit with physiologically functional neuromuscular junctions. bioRxiv. , (2020).
- Cullen, D. K., et al. Bundled Three-Dimensional Human Axon Tracts Derived from Brain Organoids. iScience. 21, 57-67 (2019).
- Giandomenico, S. L., et al. Cerebral organoids at the air-liquid interface generate diverse nerve tracts with functional output. Nature Neurosciences. 22 (4), 669-679 (2019).
- Egawa, N., et al. Drug screening for ALS using patient-specific induced pluripotent stem cells. Science Translational Medicine. 4 (145), (2012).
- Sances, S., et al. Modeling ALS with motor neurons derived from human induced pluripotent stem cells. Nature Neurosciences. 19 (4), 542-553 (2016).
- Qu, Q., et al. High-efficiency motor neuron differentiation from human pluripotent stem cells and the function of Islet-1. Nature Communications. 5 (1), 3449(2014).
- Kirihara, T., et al. A Human Induced Pluripotent Stem Cell-Derived Tissue Model of a Cerebral Tract Connecting Two Cortical Regions. iScience. 14, 301-311 (2019).
- Rigamonti, A., et al. Large-Scale Production of Mature Neurons from Human Pluripotent Stem Cells in a Three-Dimensional Suspension Culture System. Stem Cell Reports. 6 (6), 993-1008 (2016).
- Yan, Y., Song, L., Madinya, J., Ma, T., Li, Y. Derivation of Cortical Spheroids from Human Induced Pluripotent Stem Cells in a Suspension Bioreactor. Tissue Engineering Part A. 24 (5-6), 418-431 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved