Method Article
Üç Boyutlu Motor Sinir Organoid Üretimi
Bu Makalede
Özet
Bu protokol, bir doku kültürü çipinde bir sferoidden uzatılan sağlam bir akson demetinin kendiliğinden montajı yoluyla insan iPS hücre türevi motor sinir organoidini imal etmek için kapsamlı bir prosedür sağlar.
Özet
Akson fasikülleri sinir sisteminde gözlenen başlıca yapısal motiflerden biridir. Akson fasiküllerinin bozulması gelişimsel ve nörodejeneratif hastalıklara neden olabilir. Her ne kadar çok sayıda akson çalışması yapılmış olsa da, sağlam üç boyutlu in vitro modellerin eksikliği nedeniyle akson fasiküllerinin oluşumu ve işlev bozukluğu anlayışımız hala sınırlıdır. Burada, mikroakışkan tabanlı bir doku kültürü çipinde insan kaynaklı pluripotent sap (iPS) hücrelerinden bir motor sinir organoidinin (MNO) hızlı üretimi için adım adım bir protokol açıklıyoruz. İlk olarak, yöntem için kullanılan çiplerin imalatı açıklanmaktadır. İnsan iPS hücrelerinden motor nöron sferoid (MNS) oluşur. Daha sonra, farklılaştırılmış MNS çipe aktarılır. Bundan sonra, aksonlar kendiliğinden küreselden büyür ve çipte bulunan bir mikrokanal içinde bir fasikül haline gelir ve bu da küreselden uzatılmış bir akson demeti taşıyan bir MNO dokusu oluşturur. Aşağı akış analizi için, MNO'lar morfolojik analizler için sabitlenecek çipten çıkarılabilir veya biyokimyasal analizlerin yanı sıra kalsiyum görüntüleme ve çoklu elektrot dizi kayıtları için incelenebilir. Bu protokol ile oluşturulan MNO'lar ilaç testini ve taramasını kolaylaştırabilir ve aksion fasiküllerinin gelişiminin ve hastalıklarının altında kalan mekanizmaların anlaşılmasına katkıda bulunabilir.
Giriş
Spinal motor nöronlar (MN), vücut hareketini kontrol etmek için aksonları iskelet kaslarına uzatır. Aksonal yörüngeleri gelişim sürecinde son derece organize ve düzenlenmiştir. Axon uzatma ve rehberlik1ile ilgili birçok çalışmaya rağmen, organize akson demeti oluşumu için mekanizmalar hala incelenmektedir. Motor nöronların aksonları genellikle amyotrofik lateral skleroz (ALS)2gibi nörodejeneratif hastalıklardan zarar görür, ancak akson fasiküllerindeki hasarın patofizyolojik mekanizmaları iyi anlaşılmaz. Bu nedenle, alanda akson demeti oluşumunu ve gerilemesini rekapitüle etmek için fizyolojik ve patolojik bir model gereklidir.
İnsan kök hücre türevi motor nöron, ALS3gibi gelişimi ve hastalıkları anlamak için umut verici bir platformdur. İnsan kaynaklı pluripotent kök hücreler (iPS hücreleri) hasta kaynaklı hücreler kullanılarak hastalıkları modellemek için kullanılabilir. Bugüne kadar pluripotent kök hücrelerden MN'ye çeşitli farklılaşma yöntemleribildirilmiştir 4,5,6. Bununla birlikte, iki boyutlu kültürdeki nöronların aksonları rastgele yönlendirilir ve aksonların yoğun axo-aksonal etkileşimler yoluyla tek yönlü olarak bir araya getirildiği gelişen sinirler içinde in vivo mikroçevriciliği rekapitüle etmez7. Bu sorunun üstesinden gelmek için, insan iPS hücrelerinden motor sinire benzeyen üç boyutlu bir doku oluşturmak için bir teknik geliştirdik8ve dokuyu motor sinir organoidi (MNO) olarak adlandırdık. MNO, bir motor nöron sferoidinde (MNS) bulunan hücre gövdelerinden ve sferoidden uzatılmış bir aksonal fasikülden oluşur. Fasiküldeki aksonlar, motor sinirlerin gelişimindeki aksonlara benzeyen tek yönlüdür. Bu nedenle, MNO'lar benzersiz olarak, daha önce geliştirilen diğer nöronal kültür yöntemleri tarafından yapılmayan fizyolojik bir aksonal mikroçevronment sağlar.
Bu protokolde, geliştirilen çiplerde doku kültürü yongaları imalatı, hızlı motor nöron farklılaşması ve motor sinir organoid oluşumu için yöntemler açıklanmaktadır. Doku kültürü çipimiz çok basittir ve sadece bir küresel kabul etmek için bir bölme, bir akson demeti oluşturmak için bir mikro kanal ve axon terminallerini muhafaza etmek için bir bölme içerir. Cihaz, genellikle aksonları ve hücre gövdelerini9,10boyutuna göre ayırmak için kullanılan mikrogroovlar veya mikropor filtreleri de dahil olmak üzere karmaşık yapılar içermez. Bu nedenle, bir fotolithografi kurulumu mevcutsa, cihazlarımız bu protokolde açıklanan adımları izleyerek kolayca üretilebilir.
İnsan iPS hücrelerinin hızlı farklılaşması, indükleme ve desenleme faktörlerinin (SB431542, LDN-193189, retinoik asit (RA) ve yumuşatılmış agonist (SAG)) ve ivme faktörlerinin (SU5402 ve DAPT) optimize edilmiş bir kombinasyonu ile elde edilir. SU5402 ve DAPT kombinasyonunun periferik nöronların ve nöral kret hücrelerinin farklılaşmasını hızlandırdığı bildirilmiştir11. Bu protokolde, okuyucuların ihtiyaçlarına en uygun bir yönteme karar verebilmeleri için MNO'lar oluşturmak için üç farklı yöntem sunuyoruz. Farklılaştırılmış MNS doğrudan bir doku kültürü çipine aktarılabildiğinden, bir küresel (3D yöntem) oluşturduktan sonra insan iPS hücrelerinin farklılaştırılmasını öneririz. Alternatif olarak, insan iPS hücreleri monolayer (2D) kültüründe motor nöronlara ayırt edilebilir ve daha önce bildirdiğimiz gibi üç boyutlu motor nöron küresellere oluşturulabilir8. Protokolü güncelledik ve bu protokolde açıklanan üç boyutlu farklılaşma yöntemi ile 2D'den 3D'ye geçiş önlenebilir ve MNO'lar ayrışma adımı olmadan daha kısa farklılaşma süresi, daha az adım ve azaltılmış teknik risklerle elde edilebilir. Piyasada bulunan nöronlar, farklılaşma süresini azaltmak için MNS üretmek için de kullanılabilir.
Bir MNO oluşturmak için, doku kültürü çipinde bir MNS kültürü yaptık. Aksonlar küreselden uzaklaşır ve aksonların tek yönlü olarak toplandığı ve hizalandığı mikro kanala uzanır. Bu, mikrokanalde sıkıca monte edilmiş tek yönlü akson demet dokusunun axo-aksonal etkileşimini ve kendiliğinden oluşumunu kolaylaştırır, bu protokolle benzersiz bir şekilde elde edilirken, spontan demet oluşumu veya kılavuzlu aksonal yönelim tek başına diğer protokoller12 , 13,14ile elde edilebilir. Tipik bir deneyde, çok az hücre küresellerden mikro kanallara göç eder ve çoğu hücre sferoidlerin yakınında kalır. Bu yöntem, aksonları hücre gövdelerinden ayırmak için boyuta bağımlı fiziksel bariyerler (örneğin, mikrogroovlar veya mikropore filtreleri) kullanmadan aksonların sferoidlerden kendiliğinden ayrılmasını sağlar.
Ortaya çıkan MNO morfolojik, biyokimyasal ve fiziksel analizler de dahil olmak üzere çeşitli incelemelere tabi tutulabilir. Hücre gövdesi ve genişletilmiş akson demeti kesilerek fiziksel olarak izole edilebilir ve biyokimyasal tahliller gibi aşağı akış deneyleri için ayrı ayrı analiz edilebilir. RNA ve protein gibi biyolojik malzemeler, RT-PCR ve batı şişkinliği de dahil olmak üzere düzenli biyokimyasal tahliller için sadece birkaç akson demetinden izole edilebilir. Burada, akson fasiküllerinin gelişiminin ve hastalığının altında kalan mekanizmayı incelemek için çekici bir fizyolojik ve patolojik model sunan iPS hücrelerinden motor sinir organoidi üretmek için bir protokol açıklıyoruz.
Protokol
1. Fotolithografi ile SU-8 kalıp imalatı
NOT: Bu prosedür tehlikeli kimyasallar içerir. Boyunca duman başlığı ve KKD kullanın.
- Silikon gofreti (4 inç çapında, 1 mm kalınlığında, cilalı) asetonla temizleyin ve azot gazı ile üfleyin. Daha sonra kurumak için 3 dakika boyunca 180 °C'de pişirin.
- Temizlenmiş bir gofrete 3 mL SU-8 2100 dağıtın.
- SU-8'i 10 s için 500 rpm'de bir spin kaplayıcı kullanarak gofretin üzerine düzgün bir şekilde kaplayın ve ardından 150 μm kalınlığında bir SU-8 tabakası elde etmek için 300 rpm / s hızlanma ile 30 s için 1500 rpm'de sırayla döndürün.
NOT: Silikon gofretin spin kaplayıcının ortasına yer olduğundan ve vakumla doğru şekilde sabitlediğinden emin olun. - Gofretleri 50 °C'de 10 dakika, 65 °C'de 7 dakika ve 95 °C'de 45 dakika pişirin.
- Fotokütleyi (Şekil 1) maske hizalayıcısına ayarlayın ve 60 s için UV ışığını (365 nm) maruz bırakın.
NOT: Maruz kalma süresinin uygun dozda UV ışığı ile optimize edilmesi gerekir. - Pozlamadan sonra, gofredi 65 °C'de 6 dakika ve 95 °C'de sıcak plakada 13 dakika pişirin.
- Gofreti, yörüngesel bir çalkalayıcı kullanarak ajitasyon ile SU-8 geliştiricisinde 10-20 dakika geliştirin ve işlem sırasında gelişen çözümü bir kez değiştirin.
NOT: SU-8'in enkazı kaldığında gelişen süreyi uzatın. - Gofreti izopropanolde durulayın ve gofreti azot gazı ile hafifçe kurulayın.
- Biriken SU-8'in yüksekliğini bir ölçüm mikroskobu ile ölçün ve yaklaşık 150 μm kalınlığında olduğundan emin olun. Oda sıcaklığında süresiz olarak saklanabilir.
2. PDMS mikroakışkan bazlı doku kültürü çip imalatı
- SU-8 biriken gofreti çift yan bantla bir kaba (örneğin, 15 cm plastik Petri kabı) sabitleyin.
- Azot gazı kullanarak gofretin tozunu üfleyin.
- Silikize etmek için, SU-8 biriken gofreti küçük bir kapla (örneğin, 35 mm'lik bir tabak) birlikte bir vakum odasına koyun. Küçük kaba 10 μL (tridecafluoro-1,1,2,2-tetrahidrooctyl)-1-triklorosilane bırakın. Su-8 gofretine doğrudan (tridecafluoro-1,1,2,2-tetrahidrooctyl)-1-triklorosilane uygulamayın.
- Vakum haznesini sıkıca kapatın ve bir vakum pompasını en az 2 saat açın.
- Plastik bir bardak alın ve silikon elastomer (örneğin, Silpot 184 veya eşdeğeri Sylgard 184) ve kürleyiciyi 10:1 ağırlık oranında dökün. Daha sonra, kabarcıklar tamamen çıkarılana kadar vakum odasında bir spatula ve degas kullanarak iyice karıştırın.
- PDMS karışımını SU-8 gofret ile kabın içine istenen kalınlığa (3-4 mm) dökün ve kabarcıkları çıkarmak için tekrar gaz çıkarın.
- PDMS'yi tam olarak iyileştirmek için PDMS'yi 60 °C'de bir fırında en az 3 saat pişirin.
- Soğuduktan sonra, neşter veya jilet kullanarak kürlenmiş PDMS'yi gofretten kesin.
- Doku kültürü çipinin iki odasını oluşturmak için, 1,5 mm çapında biyopsi zımbası kullanarak iki bölmenin bulunduğu iki deliği yumrukleyin.
- Orta bir rezervuar oluşturmak için, başka bir PDMS karışımı (silikon elastomer ve kürleyici madde 10:1 ağırlık oranında) hazırlayın ve yeni bir 10 cm Petri kabına dökün. Dökme hacmini 5 mm PDMS kalınlığına ayarlayın.
- PDMS'yi tam olarak iyileştirmek için PDMS'yi 60 °C'de bir fırında en az 3 saat pişirin.
- PDMS'yi soğuttumktan sonra, dikdörtgen bir halka elde etmek için kürlenmiş PDMS'yi neşterle kesin.
- Alt tabakayı, aralarında kesilmemiş PDMS uygulayarak ve monte edilmiş PDMS katmanlarını pişirerek orta rezervuarla birleştirin. Bu bağlı yapı PDMS doku kültürü çipi ile sonuçlanır.
- Pdms doku kültürü çipini bir viski bandı ile temizleyerek yüzeydeki toz ve küçük parçacıkları temizleyin. PDMS doku kültürü çipleri toz ve UV'den korunduğu takdirde oda sıcaklığında saklanabilir.
3. Kültürün hazırlanması
- Kültür ortamı
NOT: Aşağıda listelenen tüm ortamlar, aksi belirtilmedikçe sterilizasyon için filtrelenmelidir. Hazırlanan ortam 4 °C'de saklanabilir ve bir ay içinde kullanılabilir.- mTeSR Plus ortamını hazırlamak için: bir şişe 100 mL mTeSR Plus 5x takviyesini bir şişe 400 mL mTeSR Plus Bazal Medium ile birleştirin.
- 100 mL KSR ortamı hazırlamak için: 85 mL DMEM/F12'de, 15 mL Nakavt serum replasmanı (KSR, %15), 1 mL ticari glutamin takviyesi (%1) ekleyin ve 1 mL esansiyel olmayan amino asit (NEAA, %1).
- 100 mL N2 ortamı hazırlamak için: 100 mL Nörobakal ortamda, 1 mL N2 (100x), 1 mL ticari glutamin takviyesi ve 1 mL NEAA ekleyin.
- 250 mL Olgunlaşma ortamı hazırlamak için: 250 mL Nörobakal ortamda, 5 mL B27 (%2), 2,5 mL ticari glutamin takviyesi (%1) ve 2,5 mL Penisilin/Streptomisin (%1) ekleyin.
- Hücre kültürü sınıfı DMSO'daki bileşikleri (retinoik asit (RA), SB431542, LDN-193189, SU5402, DAPT, SAG, Y-27632) istenen konsantrasyona yeniden reçete edin. Aliquots hazırlayın ve 6 aya kadar -20 ° C'de saklayın. Aşağıdaki stok çözümleri kullanılmaktadır: 1 mM RA, 10 mM SB431542, 100 μM LDN-193189, 10 mM SU5402, 10 mM DAPT, 1 mM SAG, 10 mM Y-27632.
- Kaplama
NOT: Bodrum membran matrisinin ısı ile polimerizasyonunu önlemek için tekrarlayan donma-çözülme döngülerinden kaçının. Mümkünse tüm kaplama prosedürlerini önceden soğutulmuş pipet uçları ve tüplerle uygulayın. Bodrum membran matrisi 4 °C'de bir gecede çözülmeli ve önceden soğutulmuş pipet uçları ve tüpler kullanılarak aliquoted edilmelidir. Aliquots -20 °C veya -80 °C'de dondurulabilir.- Donmuş aliquot'ı buz üzerinde 4°C'de çözün. Kaplama işlemi sırasında aliquot soğuk tutulmalıdır. Önceden soğutulmuş bir pipet ucu kullanarak, bodrum membran matrisini buz gibi DMEM / F12 ile 1:40 oranında seyreltin. Kullanılmayan seyreltilmiş bodrum membran matrisi, polimerizasyon gerçekleşmediği göz önüne alındığında 2-3 gün boyunca 4 °C'de saklanabilir.
- 6 kuyu plakasının bir kuyusunu kaplamak için bodrum membran matrisi / DMEM-F12 çözeltisinin 1 mL'lik kısmını ekleyin.
- Plakayı oda sıcaklığında en az bir saat veya gece boyunca 4 °C kuluçkaya yatırın. Kaplamalı plakalar en fazla bir hafta boyunca 4 °C'de saklanabilir.
4. iPS hücrelerinin bakımı
NOT: Bu protokolde 6 kuyu plakasında %90'≥ konflüens gözlendiğinde, farklılaşmamış iPS hücreleri mTeSR Plus orta ve alt kültürlü olarak tutulur. Diğer ortamlarda kültürlenen iPS hücreleri için küçük ayarlamalar gerekebilir.
- Daha önce adım 3.2'de belirtildiği gibi bodrum membran matris kaplı yemekler hazırlayın.
- mTeSR Plus ortamını tamamen aspire edin. Kuyuyu PBS ile bir kez yıkayın ve 0,5 mL pasaj reaktifi ekleyin (bkz. Malzeme Tablosu). Birkaç saniye bekleyin ve çözümü emişli.
- Plakayı 37 °C'de inkübatörde 5 dakika veya hücreler yuvarlanana kadar kuluçkaya yatırın.
NOT: Kuluçka süresi farklı iPS hücre hatları ve iklüzum arasında değişebilir. Kuluçka sırasında ayrışma süresini belirlemek için lütfen mikroskop altında periyodik olarak kontrol edin. - 1 mL mTeSR Plus orta ekleyin ve kolonileri ayırmak için plakaya 30-60 s dokunun.
- Hücre süspansiyon çözeltisinin 1 mL'lik kısmını 7 mL taze mTeSR artı orta ile hafifçe karıştırın. Pipetle 5 defadan fazla boru yapmayın.
- Plaka 1:8 oranında. Genellikle adım 4.5'ten süspansiyonun 1 mL'sini ekleyin ve 1 mL mTeSR artı 5-10 μM Y-27632 (ROCK inhibitörü) ile desteklenmiş ortam ekleyin. Pasaj seyreltme oranı iPSC hattına bağlıdır.
- Hücreyi % 5 CO2/37 °C inkübatöre yerleştirin. Ertesi gün, taze mTeSR Plus ortamı ekleyerek Y-27632'yi çıkarın. Bundan sonra, başlangıçta iki günde bir ve hücre daha yüksek izdiah süresine ulaştığında her gün ortam değiştirin.
5. iPS hücrelerinin motor nöronlara farklılaştırılması
NOT: Aşağıdaki tüm seçenekler (5.2, 5.3 ve 5.4) %90 verimlilikle MNO'lar üretir.
- Motor nöron farklılaşması için geçen iPSC
NOT: Farklılaşma 3D (5.2) veya 2D (5.3) protokollerinde başarıyla gerçekleştirilebilir.- 6 kuyu plakasında mTeSR Plus ortamında yaklaşık %80'lik bir iPS'ye ulaşana kadar farklılaşmamış iPS hücrelerinin büyümesine izin verin.
- Ortamı tamamen aspire edin. Kuyuyu steril PBS ile hemen bir kez yıkayın ve hücrelere 0,5 mL hücre ayrıştırma çözeltisi ekleyin.
- Plakayı inkübatörde 37 °C'de yaklaşık 2-3 dakika veya hücreler ayrılıp yuvarlanana ancak kuyuya bağlı kalana kadar kuluçkaya yatırın.
- 1 mL orta ve hafifçe pipet 5 mL serolojik pipet kullanarak birkaç kez yukarı ve aşağı ekleyin. Hücre süspansiyonu, ortamın 4 mL'lerinden oluşan 15 mL'lik bir tüpe aktarın.
- 3 dakika boyunca 200 x g'da santrifüj.
- Peletin bozulmadan bırakılarak süpernatantı dikkatlice emiş ve hücreleri 10 μM Y-27632 ile desteklenmiş ortamın 1 mL'sinde yeniden biriktirin.
- Hemositometre kullanarak hücreleri sayın ve 5,2 (3B farklılaşma) veya 5,3 (2B farklılaşma) işlemine geçin.
- 3D farklılaşmada motor nöron sferoid (MNS) oluşumu ("3D protokol")
NOT: Farklılaşmanın 0-12. günlerinden itibaren her gün tam bir orta değişiklik yapılır (Şekil 2).- 10 μM Y-27632 ile desteklenmiş 100 μL mTeSR Plus'ta iPS hücrelerini adım 5.1.7'den 96 kuyu U alt plakasına 40.000 hücrede / kuyuda tohumla.
- Ertesi gün, her kuyuyu 100 μL taze ortamla değiştirin.
- 0 ve 1. günlerde: Kültür ortamını aspire edin ve 10 μM SB431542 ve 100 nM LDN-193189 ile birlikte 100 μL KSR ortamı (3.1.2) ile değiştirin.
- 2. ve 3. günlerde: Kültür ortamını aspire edin ve 10 μM SB431542, 100 nM LDN-193189, 5 μM DAPT, 5 μM SU5402, 1 μM RA ve 1 μM SAG ile desteklenmiş 100 μL KSR ortamı ile değiştirin.
- 4. ve 5. günlerde: %75 KSR orta ve %25 N2 orta (3.1.3) oluşan karışık bir ortam hazırlayın. Ardından, kültür ortamını epire edin ve 10 μM SB431542, 100 nM LDN-193189, 5 μM DAPT, 5 μM SU5402, 1 μM RA ve 1 μM SAG ile desteklenmiş 100 μL karışık ortamla değiştirin.
- 6. ve 7. günlerde: %50 KSR orta ve %50 N2 orta boydan oluşan karışık bir ortam hazırlayın. Daha sonra, kültür ortamını aspire edin ve 5 μM DAPT, 5 μM SU5402, 1 μM retinoik asit ve 1 μM SAG ile desteklenmiş 100 μL karışık ortamla değiştirin.
- 8 ve 9. günlerde: %25 KSR orta ve %75 N2 ortadan oluşan karışık bir ortam hazırlayın. Daha sonra, kültür ortamını epire edin ve 5 μM DAPT, 5 μM SU5402, 1 μM RA ve 1 μM SAG ile desteklenmiş 100 μL karışık ortamla değiştirin.
- 10 ve 11. günlerde: Ortamı 5 μM DAPT, 5 μM SU5402, 1 μM RA ve 1 μM SAG ile desteklenmiş 100 μl N2 ortamı ile değiştirin.
- 12. günde: MN'leri doku kültürü çipine aktarmaya devam edin (Adım 6) veya ortamı 20 ng/mL beyin kaynaklı nörotrofik faktör (BDNF) ile birlikte 100 μL Olgunlaşma ortamı (3.1.4) ile değiştirin.
NOT: MNS, 12 günden başlayarak 19. güne kadar doku kültürü çipine aktarılabilir. Transfer edilemeyen küreseller, transfere kadar 20 ng/mL BDNF ile desteklenmiş Olgunlaşma ortamında 96 kuyu U alt plakada kültürlü tutulmalıdır.
- (Alternatif seçenek) 2D farklılaşma ve 3D MNS'ye geçiş ("2D protokol")
- Kaplama çözeltisini önceden kaplanmış 12 kuyu plakasından epire edin.
- 10 μM Y-27632 ile mTeSR Plus ortamında iPS hücrelerini adım 5.1.7'den kuyu başına 100.000 - 200.000 hücre yoğunluğunda tohumlayın.
NOT: Hücreler bir sonraki adım için çok seyrekse (5.3.3) hücreler% 80 izdiah edene kadar mTeSR Plus ortamındaki farklılaşmamış iPS hücrelerini Y-27632 olmadan kültleştirmeye devam edin. - 0 ve 1. günlerde: Kültür ortamını aspire edin ve 10 μM SB431542 ve 100 nM LDN-193189 ile birlikte 1 mL KSR ortamı (3.1.2) ile değiştirin.
- 2. ve 3. günlerde: Kültür ortamını aspire edin ve yerine 10 μM SB431542, 100 nM LDN-193189, 5 μM DAPT, 5 μM SU5402, 1 μM RA ve 1 μM SAG ile desteklenmiş 1 mL KSR ortamı ile değiştirin.
- 4. ve 5. günlerde: %75 KSR orta ve %25 N2 orta (3.1.3) oluşan karışık bir ortam hazırlayın. Kültür ortamını aspire edin ve 10 μM SB431542, 100 nM LDN-193189, 5 μM DAPT, 5 μM SU5402, 1 μM RA ve 1 μM SAG ile desteklenmiş 1 mL karışık ortamla değiştirin.
- 6. ve 7. günlerde: %50 KSR orta ve %50 N2 orta boydan oluşan karışık bir ortam hazırlayın. Kültür ortamını aspire edin ve 5 μM DAPT, 5 μM SU5402, 1 μM retinoik asit ve 1 μM SAG ile desteklenmiş 1 mL karışık ortamla değiştirin.
- 8 ve 9. günlerde: %25 KSR orta ve %75 N2 ortadan oluşan karışık bir ortam hazırlayın. Kültür ortamını epire edin ve 5 μM DAPT, 5 μM SU5402, 1 μM RA ve 1 μM SAG ile desteklenmiş 1 mL karışık ortamla değiştirin.
- 10 ve 11. günlerde: Ortamı 5 μM DAPT, 5 μM SU5402, 1 μM RA ve 1 μM SAG ile desteklenmiş 1 mL N2 ortamı ile değiştirin.
- 12. günde: Ayırma ortamını epire edin, PBS ile bir kez hızlıca yıkayın ve hücre ayırma ortamının 0,5 mL'lik kısmını ekleyin. Plakayı 37 °C'lik bir inkübatöre 1-3 dakika (örneğin, TrypLE Express kullanıyorsanız) veya 20-30 dakika (örneğin, Accutase kullanıyorsanız) yerleştirin.
- Bir P1000 pipet kullanarak, hücreleri yavaşça toplayın ve hücreleri taze Olgunlaşma ortamına sahip 15 mL konik bir tüpe aktarın ve 3 dakika boyunca 200 x g'da santrifüj. Hücreler sakarsa, birkaç kez yavaşça yukarı ve aşağı pipet. Hücrelere zarar verebileceği için çok fazla pipet yapmayın.
- Süpernatantı aspire edin ve peletin 20 ng/mL BDNF ile birlikte 1 mL Olgunlaşma ortamına (3.1.4) yeniden harcayın.
- Hemositometre kullanarak hücreyi sayın. Hücreleri kuyu başına 10.000-40.000 hücrede, Olgunlaşma ortamında 20 ng/ml BDNF ile desteklenmiş 96 kuyu U alt plakasında plakalar. İlk tohumlama yoğunluğu, iPS hücre hattına ve hücrelerin durumuna bağlı olarak optimize edilmelidir, böylece doku kültürü çipine girdiğinde küreselin çapı 800-900 μm'dir. Çoğu durumda, başlangıçta kuyu başına 20.000 hücreden başlayın ve daha sonra boyuta göre hücre sayısını artırın veya azaltın.
- Hücreler pürüzsüz kenarlı bir küresel oluşturana kadar 3-10 gün daha kültür.
- (Alternatif Seçenek): Motor nöronlardan MNS oluşumu
NOT: Ticari olarak kullanılabilen insan iPS hücre türevi motor nöronlar (bkz. Malzeme Tablosu),insan iPS hücrelerinden ayırt etmek yerine MNO'lar oluşturmak için kullanılabilir.- Motor nöronların cryovial'ını çözdükten sonra, hücreleri motor nöronların ortamının 9 mL'si ile hızlı bir şekilde yeniden depolar. Oda sıcaklığında 5 dakika boyunca 400 x g'da aşağı çevirin.
- Süpernatantı aspire edin ve peletin motor nöron ortamı ile yeniden dirildi.
- MNS üretmek için yukarıdaki adımları izleyin (5.3.12- 5.3.13).
6. Motor sinir organoidi (MNO) oluşumu için doku kültürü çipinin hazırlanması
- Hazırlanan PDMS'yi (adım 2.13'ten itibaren) Petri kabında% 70 etanol içine en az 1 saat batırarak sterilize edin.
NOT: Aşağıdaki tüm adımlar bir biyogüvenlik kabininde manipüle edilmelidir. - Mikroskop camını (76 x 52 mm) Petri kabına % 70 etanol içine batırarak sterilize edin.
- Mikroskop camının kuruma işlemi sırasında PDMS cihazını yarım ıslak mikroskop camına yerleştirin ve gece boyunca bekleyerek tamamen kurumasına izin verin. Tamamen kuruduktan sonra, PDMS cihazı cama yapışmalıdır.
NOT: Bu yapıştırma, pdms cihazlarının doku toplama kültüründen sonra mikroskop camından ayrılmasına izin vermek için kalıcı değildir. Oksijen plazması ile kalıcı yapıştırma, PDMS ve cam arasındaki yapışıklıkları en üst düzeye çıkarmak için kullanılabilir, ancak çiplerin ve doku toplanmasının sökülmasını yasaklar. - Mikrokanal yüzeyini PDMS cihazında ve mikroskop camında, kanalın giriş kısmının bir tarafına damlacık yaparak DMEM/F12'de (1:40) 30 μL seyreltilmiş bodrum membran matrisi ile kaplayın ve ardından çözeltiyi girişin diğer tarafından pipet veya emme pompası ile emiş edin (Şekil 3A). Kabarcık kirlenmesini önlemek için çok fazla çözelti hacmi emiş etmeyin.
- Ardından, PDMS cihazını oda sıcaklığında 1 saat veya ikincil bir kapta (örneğin Petri kabı) 4 °C'de bir gece kuluçkaya yatırın.
7. Motor sinir organoidi (MNO) oluşumu
- Kaplama solüsyonunu, kullanımdan hemen önce 20 ng/mL BDNF ile desteklenmiş önceden ısıtılmış 150 μL Olgunlaşma ortamı ile değiştirin.
- Ardından, MNS'yi adım 5.2.9 veya 5.3.13'ten geniş delikli bir ucu olan bir mikropipette kullanarak mikrokananın girişine yerleştirin. MNS, yerçekimi ile cihazın altına kendiliğinden yerleşebilir. MNS enjekte ederken çok fazla basınç uygulamayın (Şekil 3B).
NOT: MNS bir doku kültürü çipinde bir deliğin yan duvarına sıkışmışsa, çözeltiyi girişin başka bir tarafından hafifçe emiş edin. - Küçük bir rezervuarı (örneğin, 15 mL'lik bir tüp kapağı) steril suyla doldurun ve orta buharlaşmayı önlemek için doku kültürü çipinin yanına ikincil kabın yakınlarına yerleştirin. Ardından% 5 CO2/ 37 ° C inkübatöre yerleştirin.
- Orta bir değişiklik için, tükenmiş kültür ortamını orta rezervuarın merkezinden epire edin (Şekil 3C). Tüm ortamı ve dokuyu aspire etmeyin.
- Hafifçe taze Olgunlaşma ortamı ekleyin (BDNF ile). Ortam her 2-3 günde bir değiştirilmelidir. Kültür ortamı, kültür sırasında herhangi bir zamanda kurutmayın. Axonlar bir MNS'den kanala büyür ve 2-3 hafta içinde kendiliğinden tek bir demet halinde birleşir ve bu da bir MNO oluşumuna neden olan. MNO cihazda 1 aydan fazla kültürlenebilir.
8. MNO'nun aşağı akış analizi
- Tam montajlı immünostaining
- Cihazı veya bulaşıkları kimyasal duman kaputuna getirin. Son %4 PFA konsantrasyonuna ulaşmak için ortama yaklaşık %8 paraformaldehit (PFA) hacmi ekleyerek MNO'yu düzeltin. PDMS cihazını camdan soyun ve oda sıcaklığında 15-20 dakika kuluçkaya yatırın.
- MNO'yu PBS ile yıkayın ve ardından PBS yıkamayı 2x tekrarlayın.
- PBS'de Triton X-100'ün %0,2'si ile MNO'yu permeabilize edin ve oda sıcaklığında 5 dakika kuluçkaya yatırın.
- MNO'yu PBS ile yıkayın ve ardından PBS yıkamayı 2x tekrarlayın. Ardından, MNO'yu % 1 BSA içeren PBS ile engelleyin ve oda sıcaklığında 1 saat kuluçkaya yatırın.
- PBS'de %0,1 BSA içeren primer antikorları seyreltin ve MNO'yu 4 °C'de bir gecede primer antikor çözeltisi ile kuluçkaya yatırın. MNO'yu PBS ile üç kez yıkayın.
- PBS'deki ikincil antikorları % 0.1 BSA ile seyreltin ve oda sıcaklığında 2 saat boyunca ikincil antikor çözeltisi ile MNO'yu kuluçkaya yatırın. Ardından MNO'yu PBS ile üç kez yıkayın.
- MNO'yu %0,2 Triton-X içeren PBS'de Hoechst ile lekelenin ve oda sıcaklığında 5 dakika kuluçkaya yatırın.
- MNO'yu PBS ile üç kez yıkayın. İmmünostainli MNO floresan veya konfokal lazer mikroskoplarla görüntülemeye hazırdır.
- Axon demetinin doku toplanması ve izolasyonu
- 10 cm Petri kabına 10 mL HBSS çözeltisi dökün. Ardından, tüm PDMS cihazını HBSS çözümüne daldırın.
- PDMS'yi mikroskop camından stereomikroskop altında dikkatlice ayırın. Dokular PDMS cihazına yapıştığında, bir pipet kullanarak deliğin üstünden 1 mL HBSS çözeltisini hafifçe uygulayın.
- Doku PDMS'den çıktıktan sonra, PDMS'yi mikroskop camından tamamen ayırmak için mikroskop camına hafifçe 1 mL HBSS uygulayın.
- Bir akson demetini bir küreselden izole etmek için, mikroskop altında bir cerrahi bıçak veya cımbızla akson demetini kesin. Göç eden hücrelerin kirlenmesini önlemek için akson demetini küreselden biraz uzağa (> 1 mm) kesin.
- İzole akson demetleri ve küreseller, RT-PCR, RNA-seq ve batı şişkinliği gibi çeşitli aşağı akış analizleri ile daha fazla analiz edilebilir.
- PDMS kültür yongası yeniden kullanılabilir. Kültür çipini temizlemek için, kültür çipini damıtılmış su içinde 15 dakika boyunca sonicate edin. Daha sonra, çipi% 1 deterjanla desteklenmiş damıtılmış suda sonicate edin. Kültür çipini damıtılmış suyla 5 kez yıkayın.
- Kalsiyum görüntüleme
NOT: Nöronal aktivite, doku kültürü çipinden doku toplanmasından önce ve sonra kalsiyum göstergesi ile ölçülebilir (8.2'den itibaren). Protokol belirli bir ticari kite dayanmaktadır (bkz. Malzeme Tablosu). Alternatif olarak, diğer Kalsiyum görüntüleme kitleri veya eşdeğer yöntemler kullanılabilir.- MNO'yu PBS (Ca2+ ve Mg2+olmadan) ile üç kez yıkayın.
- 37 °C'de 30-60 dk boyunca kayıt ortamında (20 mM HEPES, 115 mM NaCl, 5,4 mM KCl, 0,8 mM MgCl2, 1,8 mM, CaCl2, 13,8 mM glikoz) 5 μM Fluo-4AM ile dokuyu kuluçkaya yatırın. Pluronic F-127'nin % 0.01-0.02'lik bir ilavesi Fluo-4 AM'nin hücrelere alınmasına yardımcı olabilir.
- Ardından, dokuyu PBS ile yıkayın (Ca2+ ve Mg2+olmadan) ve kayıt ortamı ile değiştirin.
- GFP/Cy2 filtre seti ile floresan mikroskopi kullanarak hızlandırılmış görüntüler elde edin. Pozlama süresini kare başına 20 ms'den az ayarlayın.
- Alınan film dosyasını Resim J'i kullanarak görüntü dizisi olarak açın.
- Renkli bir CCD veya CMOS kamera kullanıyorsanız, RGB görüntüleri 16 bit mono görüntülere dönüştürün. Aç "Analiz | Araçlar | Yatırım GetiriSi Yöneticisi", İlgi çekici bölgeyi çizin ve " Ekle "yitıklatın. "Çok Ölçü "yetıklayın. Birden çok yatırım getirislerindeki yoğunluk ortalaması Sonuç'ta gösterilir.
- Genel veri analizi yazılımını kullanarak sinyal yoğunluğunun değişimini çizin.
- Multi-elektrot dizisi ile nöronal aktivitenin ölçümü
NOT: Motor nöronların aktivitesi çoklu elektrot dizisi (MEA) ile yakalanabilir.- Bir MNO oluşturduktan sonra, bir bodrum membran matrisi kaplı MEA probuna aktarın. Dokuyu elektrotlara yerleştirin.
- MNO'nun yüzeye yapışmasını sağlamak için 200 μL Olgunlaşma ortamı ekleyin ve 37 °C'de 1-2 saat kuluçkalayın.
- Ortamı kayıt ortamıyla değiştirin (8.3.2). İsteğe bağlı olarak, elektrotlarla sözleşmeyi artırmak için bir MNO'nun üzerine ağ ve ağırlık yerleştirin.
- MEA prob'ını kayıt kafası aşamasına ayarlayın. MEA probu ile baş sahne arasındaki teması %70 etanol ile silin.
- MEA üreticilerinin talimatlarını izleyerek nöronal aktiviteyi kaydetmeye başlayın.
Sonuçlar
Motor nöronlar 3D farklılaşma işlemlerinde 12-14 gün içinde farklılaştırılmıştır (Şekil 4 ve Şekil 5). Daha da önemlisi, hücrelerin% 60'ından fazlası farklılaşma sırasında motor nöron belirteci HB9'ı ifade etti. İmmünohistokimya, MNS'deki hücrelerin yaklaşık% 80'inin SMI32 pozitif motor nöronlar olduğunu ortaya koydu. HB9 ve SMI32, kurulan erken aşama motor nöron belirteçleridir15,16. HB9 ve SMI32 ifadesi, motor nöronların hücresel kimliğini sağlamak için onaylanması gereken temel parametrelerdir. Kültür yongasına bir MNS girdikten sonra, aksonlar kanala uzanır ve bir akson demeti oluşur. Fiziksel kılavuz olarak hizmet veren mikrokanaller nedeniyle, aksonlar MNS'den uzaktır ve axo-axonal etkileşim ile bir demet oluşturur (Şekil 6A). Bir MNO'nun oluşumunu doğrulamak için mikroskobik gözlemle akson demetinin oluşumunu onaylamak önemlidir. Başarılı bir MNO, kanaldaki demetin dışında 50 μm'den daha geniş bir akson demeti ve birkaç izole akson taşır. Aksonların ilk uzaması, sferoidin girişinden 24 saat sonra gözlemlenebilir. Sonraki 3-4 gün içinde, aksonlar mikrokananın merkezine ulaştı ve daha sonra ek 10 gün içinde diğer uca ulaşır (Şekil 6A). Sonuç olarak, aksonlar bir çipte 2-3 hafta içinde düz ve tek yönlü bir demet oluşturdular ve bundan sonra nöronal aktiviteler gözlendi.
Motor sinir organoidleri biyolojik analiz için PDMS'yi mikroskop camından ayırarak çipten toplanabilir (Şekil 6B). Akson demetleri ve hücre gövdeleri mikroskop altında cerrahi bıçak veya cımbız kullanılarak kesilerek izole edilebilir (Şekil 6B). RNA ve protein de dahil olmak üzere bu biyolojik malzemeler RT-PCR ve batı şişkinliği gibi düzenli biyokimyasal tahliller için kullanılabilir. MNO'ların akson demetlerinde, batı şişkinliğinde nükleer veya dendritik yapıcı proteinler tespit edilmemiştir (Şekil 6C).
Bir kalsiyum göstergesi (Fluo-4 AM) ile birlikte, doku kültürü çipinde nöronal aktivite yakalanabilir. MNO içinde sferoid ve akson demetinde motor nöronların spontan aktivitesi gözlendi. Ayrıca, sinirsel aktiviteler çok elektrotlu bir dizi sistemi kullanılarak gözlendi.
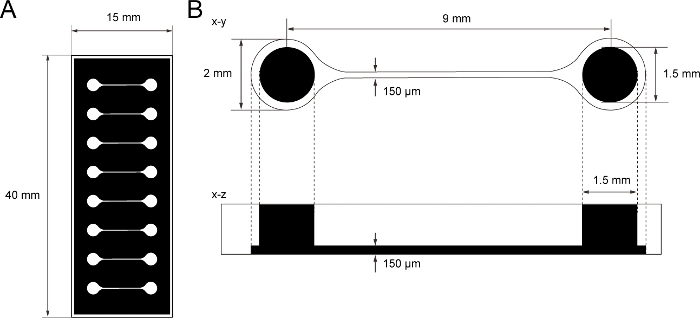
Şekil 1: PDMS doku kültürü çipinin boyutu.
(A) Doku kültürü çipinin fotomask. (B) Doku kültürü çipinde mikrokanel boyutları. Motor nöron sferoidini tutmak için taban odasının çapı 2 mm ve odanın üzerindeki PDMS deliği 1,5 mm'dir. İki odacık arasında köprü kuran bir mikrokananın genişliği ve yüksekliği 150 μm'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
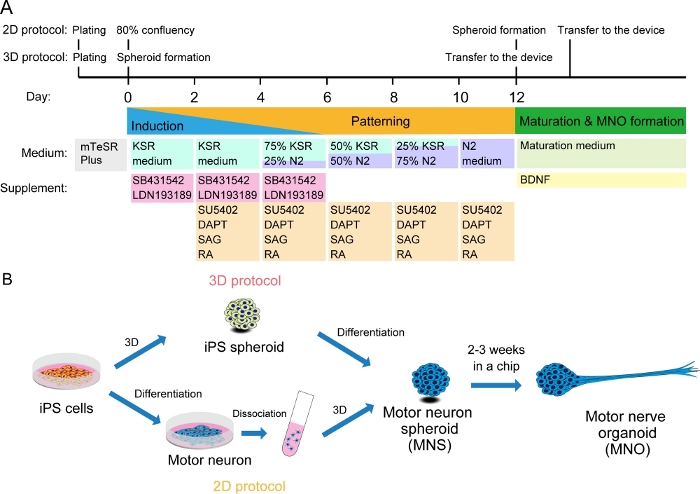
Şekil 2: Motor nöron farklılaşması şematik illüstrasyonu.
(A) Farklılaşma adımları nöral indüksiyon, motor nöron soyuna desenleme ve motor nöronların olgunlaşmasını içeriyordu. (B) iPS hücrelerinden motor nöron küresel (MNS) oluşturmak için iki seçenek: 3D protokol ve motor nöronların ayrışma adımına sahip bir 2D protokol. Motor sinir organoidi (MNO) her iki protokolle de elde edilebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
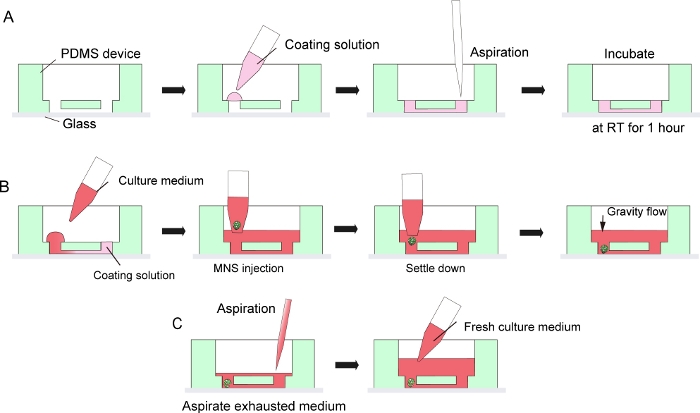
Şekil 3: Bodrum membran matrisi kaplaması ve motor nöron küresel tanıtımı için adım adım protokol.
(A) Doku kültürü çipinin kanalında bodrum membran matrisi kaplaması. (B) Çipin deliğine MNS girişi. (C) Tükenmiş ortamın aspirasyonu ile kültür orta değişimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
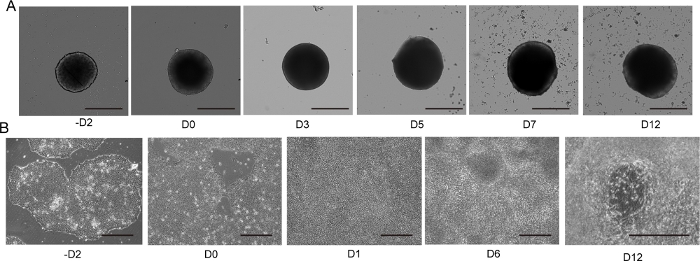
Şekil 4: 2D ve 3D motor nöron farklılaşması.
(A) Temsili 3D MNS farklılaşma süresi (3D protokolü). MNS'nin boyutu zamanla kademeli olarak arttı. Ölçek çubuğu: 500 μm. (B) -D2, D0, D1, D6, D12 (2D protokolü) üzerinde 2D farklılaşma süresi. Ölçek çubuğu: 500 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
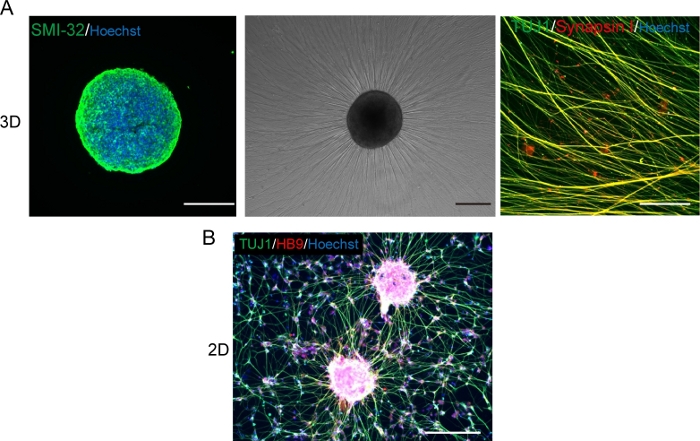
Şekil 5: Motor nöronların karakterizasyonu.
(A) (Sol) SMI-32 antikor ve DAPI ile boyanmış bir MNS kriyoseksiyon. (Orta) Bodrum membran matrisi kaplı bir yüzeyde replated MNS faz kontrast görüntüsü. Aksonal uzama gözlendi. (Sağ) Sinapsin I ve Tuj1 antikorları ile boyanmış replated MNS aksonları. Ölçek çubuğu: 500 μm (Sol ve Orta) ve 50μm (Sağ). (B) Tuj ve HB9 antikorları ile bağışıklık sistemi baskılanmış 2D motor nöronların temsili bir görüntüsü. Ölçek çubuğu: 200 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
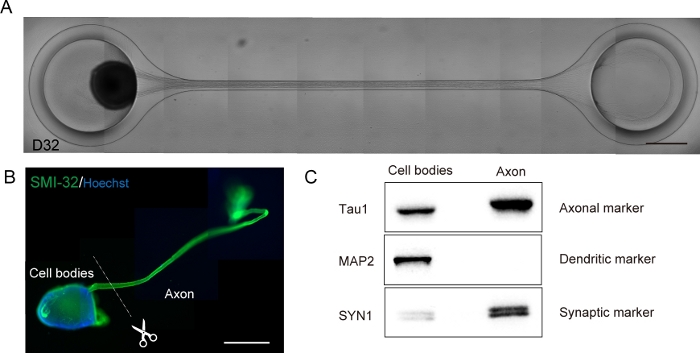
Şekil 6: Bir kültür çipinde üretilen bir motor sinir organoidinin (MNO) karakterizasyonu.
(A) D32'de akson uzama ve kalın akson demeti oluşumunun temsili görüntüleri. Ölçek çubuğu: 500 μm. (B) Motor sinir organoidinin (MNO) SMI-32 ve DAPI tarafından immünostainingi. Aksonlar ve hücre gövdeleri fiziksel olarak kesilerek izole edilebilir. Ölçek çubuğu: 1 mm. (C) Batı şişkinliği ile ölçülen aksonlardan ve hücre gövdelerinden proteinin saflığı. Bir dendritik belirteç olan MAP2, aksonal proteinde tespit edilmedi, aksional işaretleyici Tau1 ise aksonal proteinde zenginleştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, insan iPS hücrelerinden üretilen bir motor nöron küreselden uzatılmış bir akson demetine sahip bir motor sinir organoidinin (MNO) oluşumunu açıklar. Oluşan akson demeti kalın, esnek ve tek yönlü yapılarda iyi organize edilmiş. Akson demetinin diseksiyonu ile biyokimyasal analizler için yüksek saflıkta aksonal protein ve RNA elde edilebilir. Nöronal aktivite kalsiyum görüntüleme ile akson demetleri ve sferoidlerde ölçülebilir. Aksonal lisattaki nükleer ve dendritik proteinlerin kirlenmesi batı şişkinliği ile tespit edilmedi ve yöntemimizin aksonları hücre gövdelerinden ve dendritlerden verimli bir şekilde ayırdığını gösterdi.
Bu protokolün avantajlarından biri, tüm işlemlerin 3D protokol ile 4 haftada ve 2D protokol kullanılarak 5-6 haftada yapılabileceği bir akson demeti ile donatılmış MNO'nun hızlı farklılaşması ve üretilmesidir. Bu, embriyonik kök hücrelerden ve iPS hücrelerinden 17'ye MN'ye ayırt edilmesi tipik olarak3-4 hafta süren diğer protokollere kıyasla kısadır ve aksonal uzama elde etmek 2-4 hafta daha sürer. 3D protokolü, 2D protokolüne kıyasla ayrışma adımı olmadan daha kısa farklılaşma süresi, daha az adım ve azaltılmış teknik riskler nedeniyle genellikle 2D protokole göre tercih edilir. Mikroakışkan tabanlı doku kültürü çipi, MNS'nin aksonlarının mikrokanal aracılığıyla diğer bölmeye doğru uzaması için tasarlanmıştır, bu da aksonlar arasında akson etkileşimleri ve benzeşimi teşvik ederek bir akson demetinin oluşumunu kolaylaştırır. Basit deneysel kurulum nedeniyle, burada açıklanan tüm protokoller sadece bir doku kültürü çipinin manipülasyonuna aşina olan biyomühendisler tarafından değil, aynı zamanda mikroakışkanlara ve mikrofabrikasyon tekniklerine aşina olmayan biyologlar ve sinirbilimciler tarafından da gerçekleştirilebilir. Adım 1 ve 2'nin harici bir imalat hizmeti kullanılarak da gerçekleştirilebileceği unutulmamalıdır.
Protokolü gerçekleştirmek için kritik adımlardan biri, kültür ortamının sıralı bir değişimidir. Harcanan ortamdaki faktörlerin MN farklılaşmasını bozmaması için farklılaşma sırasında her adımda kültür ortamının tamamen değiştirilmesi önerilir. Bu protokolün bir diğer kritik noktası, farklılaşmamış iPS hücrelerini iyi kalitede tutmaktır. İlk iPS hücre kültürünün kalitesi, motor nöronlar ve MNO elde etme verimliliğini önemli ölçüde etkiler. Başka bir nokta, MNS çapının talaşın deliğinin boyutundan (1,5 mm) daha küçük olması gerektiğidir. Daha büyük küreseller odaya giremez ve potansiyel olarak orta kısımda şiddetli hipoksik nekroz yaşarlar. MNS'lerin boyutu, iPS hücrelerinin (3D protokolde) veya motor nöronların (2D protokolde) ilk tohumlama sayısı değiştirilerek kontrol edilebilir. Hücrelerin tohumlama yoğunluğu her iPS hücre hattı için optimize edilmelidir.
Mikrogroovlar ve küçük gözenek filtreleri ile bölmeli mikroakışkan cihazlar, aksonları hücre gövdelerinden ve dendritlerden ayırmak için yaygın olarak kullanılmıştır. Bu teknik ayrıca aksonları hücre gövdelerinden ve dendritten ayırabilir, demetlenmiş dokularda üstün akson bolluğu ile. Diğer yöntemlerle karşılaştırıldığında, bu yöntemin önemli bir sınırlaması, doku kültürü çipinin mevcut tasarımında iki farklı kültür medyasını ayıramamasıdır, bu da iki farklı ortam gerektiren iki farklı hücrenin ortak kültür yeteneğini engeller. Diğer bir sınırlama, PDMS çipinin dokunun boyutuna önceden belirlenmiş bir kısıtlama koymasıdır. Delikten daha büyük bir küresel odaya giremez ve akson demeti mikroakışkan kanalın genişliğinden daha kalın büyüyemez.
Bu yöntem diğer nöron türlerine de uygulanabilir. Grubumuz serebral organoid teknikleri ile birlikte modifiye bir yöntem kullanarak serebral sistemi modelleme yeteneği göstermiştir18. Kortikal sferoidler her iki bölmeye de sokuldu ve aksonlar her bir küreseloide doğru karşılıklı olarak kendiliğinden uzadı ve daha sonra kendiliğinden bir akson demeti oluştu. Sonuç olarak, iki kortikal sferoid bir akson demeti ile bağlanabilir ve doku tek parça olarak elde edilebilir. Bu, nöronal hücre türlerinden bağımsız olarak akson demet dokuları oluşturmak için yaklaşımın çok yönlü olduğunu göstermektedir. Bu protokolde insan iPS hücreleri kullanılmıştır, ancak sunulan protokolde yapılan değişikliklerle insan ES hücreleri ve insan sinir kök hücreleri de dahil olmak üzere diğer kök hücreler kullanılabilir. Nöronların 3D sferoidleri çeşitli protokoller19,20ile üretilebilir. Bir akson demeti ile doku yapma bu yöntem potansiyel olarak gelecekte 3D MN sferoid yapmak için diğer farklılaşma protokolleri ile kombine edilebilir. Ek olarak, akson demetinin kalınlığı ve uzunluğu, gelecekteki gelişmeler için doku kültürü çipinin mikrokanellerinin genişliği ve yüksekliği değiştirilerek kontrol edilebilir.
Bu protokolün ilaç testi ve taraması için kullanılabileceğine ve akson fasiküllerinin gelişiminin ve hastalıklarının altında kalan mekanizmaların anlaşılmasına katkıda bulunabileceğine inanıyoruz.
Açıklamalar
Bu protokolün bir parçası olarak, Jiro Kawada tarafından kurulan Jiksak Bioengineering, Inc.'e bir patent lisanslanmıştır.
Teşekkürler
Bu çalışma, Japonya Bilimi Teşvik Derneği (JSPS) Bilimsel Araştırmalar için Yardım Hibeleri 17H05661 ve 18K19903, Core-2-core programı ve Beyond AI enstitüsü tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| (Tridecafluoro-1,1,2,2-tetrahydrooctyl)-1-trichlorosilane | Sigma | 440302 | |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | Electron Microscopy Sciences | 15710 | |
| 200µl Wide Bore Pipet Tips | BMBio | BMT-200WRS | |
| 6-well plates | Violamo | 2-8588-01 | |
| Accutase | ICT | AT104 | |
| B-27 Supplement (50X) | Gibco | 17504044 | |
| Bovine serum albumin | Sigma | A6003 | |
| Brain-derived neurotrophic factor (BDNF) | Wako | 020-12913 | |
| CO2 incubator | Panasonic | MCO-18AIC | |
| Cryostor CS10 | Stem Cell Technologies | 07959 | |
| DAPT | Sigma | D5942 | |
| DMEM/F12 | Sigma | D8437 | |
| Fluo-4 AM | Dojindo Laboratories | CS22 | |
| GlutaMAX Supplement | Gibco | 35050-061 | |
| Growth factor reduced Matrigel (basement membrane matrix) | Corning | 354230 | |
| HB9 Antibody | Santa Cruz | sc-22542 | |
| HBSS | Wako | 085-09355 | |
| Hoechst 33342 | Sigma | 14533 | |
| iCell motor neuron (commercially available human iPS cell-derived motor neurons) | Cellular Dynamics | R1051 | |
| Isopropyl alcohol (IPA) | Wako | 166-04836 | |
| Knock Out Serum Replacement | Gibco | 10828028 | |
| LDN193189 | Sigma | SML0559 | |
| MEA probe | Alpha MED Scientific inc | MED-P5004A | |
| MEM Non-essential Amino Acid Solution (100x) (NEAA) | Sigma | M7145 | |
| Microscope Glass | Matsunami | S9111 | |
| mTeSR Plus | Stem Cell Technologies | 05825 | |
| N2 supplement | Wako | 141-08941 | |
| Neurobasal medium | Gibco | 21103049 | |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Photoresist SU-8 2100 | Microchem | #SU-8 2100 | |
| Prime surface 96U | Sumitomo Bakelite | MS-9096U | |
| ReLeSR (passaging reagent) | Stem Cell Technologies | 05872 | |
| Retinoic acid | Wako | 186-01114 | |
| SAG | Sigma | SML1314 | |
| SB431542 | Wako | 192-16541 | |
| Silicon wafer | SUMCO | PW-100-100 | |
| Silpot 184 w/c kit | Dow Toray | Silpot 184 w/c kit | |
| Smi32 Antibody | Biolegend | 801701 | |
| SU5402 | Sigma | SML0443 | |
| SU-8 Developer | Microchem | Y020100 | |
| Synapsin I Antibody | Millipore | Ab1543 | |
| TrypLE Express liquid without phenol red (dissociation solution) | Gibco | 12604-021 | |
| Tuj1 Antibody | Biolegend | 801202 | |
| Y-27632 | Wako | 030-24021 |
Referanslar
- Raper, J., Mason, C. Cellular strategies of axonal pathfinding. Cold Spring Harbor Perspective Biology. 2 (9), 001933(2010).
- Ito, Y., et al. RIPK1 mediates axonal degeneration by promoting inflammation and necroptosis in ALS. Science. 353 (6299), 603-608 (2016).
- Fujimori, K., et al. Modeling sporadic ALS in iPSC-derived motor neurons identifies a potential therapeutic agent. Nature Medicine. 24 (10), 1579-1589 (2018).
- Chen, H., et al. Modeling ALS with iPSCs Reveals that Mutant SOD1 Misregulates Neurofilament Balance in Motor Neurons. Cell Stem Cell. 14 (6), 796-809 (2014).
- Osaki, T., Uzel, S. G. M., Kamm, R. D. Microphysiological 3D model of amyotrophic lateral sclerosis (ALS) from human iPS-derived muscle cells and optogenetic motor neurons. Science Advances. 4 (10), (2018).
- Imamura, K., et al. The Src/c-Abl pathway is a potential therapeutic target in amyotrophic lateral sclerosis. Science Translational Medicine. 9 (391), (2017).
- Wang, L., Marquardt, T. What axons tell each other: axon-axon signaling in nerve and circuit assembly. Current Opinion in Neurobiology. 23 (6), 974-982 (2013).
- Kawada, J., et al. Generation of a Motor Nerve Organoid with Human Stem Cell-Derived Neurons. Stem Cell Reports. 9 (5), 1441-1449 (2017).
- Nagendran, T., Poole, V., Harris, J., Taylor, A. M. Use of Pre-Assembled Plastic Microfluidic Chips for Compartmentalizing Primary Murine Neurons. JoVE. (141), e58421(2018).
- Paranjape, S. R., Nagendran, T., Poole, V., Harris, J., Taylor, A. M. Compartmentalization of Human Stem Cell-Derived Neurons within Pre-Assembled Plastic Microfluidic Chips. JoVE. (147), e59250(2019).
- Chambers, S. M., et al. Combined small-molecule inhibition accelerates developmental timing and converts human pluripotent stem cells into nociceptors. Nature Biotechnology. 30 (7), 715-720 (2012).
- Rimington, R. P., Fleming, J. W., Capel, A. J., Wheeler, P. C., Lewis, M. P. Bioengineered model of the human motor unit with physiologically functional neuromuscular junctions. bioRxiv. , (2020).
- Cullen, D. K., et al. Bundled Three-Dimensional Human Axon Tracts Derived from Brain Organoids. iScience. 21, 57-67 (2019).
- Giandomenico, S. L., et al. Cerebral organoids at the air-liquid interface generate diverse nerve tracts with functional output. Nature Neurosciences. 22 (4), 669-679 (2019).
- Egawa, N., et al. Drug screening for ALS using patient-specific induced pluripotent stem cells. Science Translational Medicine. 4 (145), (2012).
- Sances, S., et al. Modeling ALS with motor neurons derived from human induced pluripotent stem cells. Nature Neurosciences. 19 (4), 542-553 (2016).
- Qu, Q., et al. High-efficiency motor neuron differentiation from human pluripotent stem cells and the function of Islet-1. Nature Communications. 5 (1), 3449(2014).
- Kirihara, T., et al. A Human Induced Pluripotent Stem Cell-Derived Tissue Model of a Cerebral Tract Connecting Two Cortical Regions. iScience. 14, 301-311 (2019).
- Rigamonti, A., et al. Large-Scale Production of Mature Neurons from Human Pluripotent Stem Cells in a Three-Dimensional Suspension Culture System. Stem Cell Reports. 6 (6), 993-1008 (2016).
- Yan, Y., Song, L., Madinya, J., Ma, T., Li, Y. Derivation of Cortical Spheroids from Human Induced Pluripotent Stem Cells in a Suspension Bioreactor. Tissue Engineering Part A. 24 (5-6), 418-431 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır