Method Article
三维运动神经器官生成
摘要
该协议提供了一个全面的程序,通过自发组装从组织培养芯片中的球形延伸的强健的轴突束来制造人类iPS细胞衍生的运动神经器官。
摘要
轴突的筋膜是神经系统中观察到的主要结构图案之一。轴感筋膜的破坏可能导致发育和神经退行性疾病。虽然已经对轴突进行了大量研究,但由于缺乏坚固的体外模型,我们对轴突筋膜的形成和功能障碍的理解仍然有限。在这里,我们描述了一个循步骤的协议,从微流体为基础的组织培养芯片中从人类诱导的多能干细胞(iPS)细胞中快速生成运动神经器官(MNO)。首先,描述了用于该方法的芯片的制造。从人类iPS细胞中,形成运动神经元球形(MNS)。接下来,区分的 MNS 将传输到芯片中。此后,轴突自发地从球形中长出来,在芯片中装备的微通道内组装成一个圆柱体,从而产生一个MNO组织,携带一束从球形延伸的轴突。对于下游分析,MNO 可以从芯片中取出,用于形态分析或剖析以进行生化分析,以及钙成像和多极阵列记录。通过该协议产生的多国机构可以促进药物测试和筛选,并有助于了解轴位筋膜发育和疾病的基本机制。
引言
脊髓运动神经元 (MN) 将轴突扩展到骨骼肌肉以控制身体运动。它们的轴突轨迹在发展过程中具有高度的组织性和规范性。尽管对轴承扩展和指导1进行了许多研究,但组织轴束形成机制仍在调查中。运动神经元的轴突经常受到肌萎缩性侧索硬化症(ALS)2等神经退行性疾病的损害,但对轴突筋膜损伤的病理生理机理知之甚少。因此,需要一个生理和病理模型来回顾轴束的形成和回归。
人类干细胞源性运动神经元是了解ALS3等发育和疾病的有希望的平台。人类诱导的多能干细胞(iPS细胞)可用于使用患者衍生细胞模拟疾病。迄今为止,从多能干细胞到MN的各种分化方法已报告4,5,6。然而,二维培养中神经元的轴突是随机定向的,在发育中的神经中,轴突通过密集的轴突-轴位相互作用7进行单向组装,不能在体内微环境中重述。为了克服这个问题,我们开发了一种技术,从人类iPS细胞8中产生类似于运动神经的三维组织,并将组织命名为运动神经器官(MNO)。MNO由位于运动神经元球形(MNS)中的细胞体和从球形延伸出去的轴状筋膜组成。圆柱体中的轴突是单向方向的,类似于发展运动神经的轴突。因此,MNOs独特地提供了一种生理轴突微环境,这是任何其他以前开发的神经元培养方法所没有的。
在此协议中,我们描述了已开发芯片中组织培养芯片制造、快速运动神经元分化和运动神经器官形成的方法。我们的组织培养芯片非常简单,它只包含一个接受球形的隔间,一个用于形成轴束的微通道,以及一个用于安装轴星终端的隔间。该设备不包含复杂的结构,包括微流道或微孔过滤器,通常用于分离轴突和细胞体的大小9,10。因此,如果有光刻设置,则可以通过遵循本协议中描述的步骤轻松制造我们的设备。
通过诱导和模式因子(SB431542、LDN-193189、转录剂酸(RA)和平滑激动剂(SAG)和加速因子(SU5402 和 DAPT)的优化组合,实现了人类 iPS 细胞的快速分化。据报道,SU5402和DAPT的结合加速了外周神经元和神经峰细胞11的分化。在此协议中,我们提供了三种不同的方法来生成 MNO,以便读者可以决定最适合其需求的方法。我们建议在形成球形(3D方法)后对人体iPS细胞进行分化,因为分化的MNS可以直接转移到组织培养芯片中。或者,人类iPS细胞可以在单层(2D)培养中分化成运动神经元,然后创建成三维运动神经元球形,正如我们之前报道的8。我们更新了协议,通过本协议中描述的三维分化方法,可以避免从 2D 到 3D 的过渡,并且无需分离步骤即可以更短的分化时间、更少的步骤和更低的技术风险获得 MNO。商业上可用的神经元也可用于生成 MNS 以减少分化时间。
为了生成 MNO,我们在组织培养芯片中培养了 MNS。轴突从球体拉长,并延伸到轴突聚集和单向对齐的微通道。这有利于斧轴相互作用和在微通道中自发形成紧密组装的轴突单向束组织,这是本协议所独有的,而无论是自发捆绑形成还是引导轴突定向单独可以通过其他协议12、13、14来实现。在一个典型的实验中,很少有细胞从球体迁移到微通道,而且大多数细胞都留在球形附近。这种方法允许轴突自发地从球体中分离出来,而无需使用依赖大小的物理屏障(例如微沟或微孔过滤器)将轴突与细胞体分离。
由此产生的 MNO 可接受各种检查,包括形态学、生化和物理分析。细胞体和扩展轴束可以通过切割进行物理分离,并可单独分析以进行下游实验,例如生化检测。生物材料,包括RNA和蛋白质,可以从几个轴成束中分离,用于常规生化检测,包括RT-PCR和西方印迹。在这里,我们描述了从iPS细胞中生成运动神经器官的协议,它提供了一个有吸引力的生理和病理模型来研究轴心筋膜发育和疾病的机制。
研究方案
1. 通过光刻制作 SU-8 模具
注:此程序涉及危险化学品。在整个过程中使用烟雾罩和PPE。
- 用丙酮清洁硅晶圆(直径4英寸,厚度1毫米,抛光),用氮气吹。然后在180°C下烘烤3分钟晾干。
- 将 SU-8 2100 的 3 mL 分配到清洁的晶圆上。
- 将SU-8均匀地涂在晶圆上,在500 rpm的10下使用旋转涂层,然后,在1500 rpm的30下连续旋转,加速度为300 rpm/s,以获得150μm厚的SU-8层。
注意:确保硅晶圆位于旋转涂层的中心,并通过真空正确固定。 - 在 50 °C 下软烤 10 分钟的热板上的晶圆,在 65 °C 下烘烤 7 分钟,在 95 °C 下烘烤 45 分钟。
- 将光罩 (图 1) 设置为面膜对齐器,并将紫外线 (365 nm) 暴露在 60 s。
注意:曝光时间需要通过适当剂量的紫外线来优化。 - 暴露后,在 65 °C 下烘烤晶圆 6 分钟,在热板上烤 95 °C 13 分钟。
- 在SU-8开发人员使用轨道摇床搅拌下开发晶圆10-20分钟,在此过程中改变一次开发溶液。
注:延长SU-8残骸的研制时间。 - 用异丙醇冲洗晶圆,用氮气轻轻干燥晶圆。
- 通过测量显微镜测量沉积的SU-8的高度,并确保其厚度约为150μm。它可以无限期地储存在室温下。
2. PDMS微流体组织培养芯片制造
- 用双侧带将 SU-8 沉积晶圆固定在容器(例如 15 厘米塑料培养皿)上。
- 使用氮气吹掉晶圆上的灰尘。
- 要进行西兰化,将 SU-8 沉积晶圆与一个小容器(例如 35 毫米盘)一起放入真空室中。将 10 μL(三氯氟-1,1,2,2-四氢细胞)-1-三氯西兰放入小容器中。不要将(三氯氟-1,1,2,2-四氢细胞)-1-三氯西兰直接应用于SU-8晶圆。
- 关闭真空室并打开真空泵至少2小时。
- 拿一个塑料杯,倒硅胶弹性体(例如,Silpot 184 或等效西尔加德 184)和固化剂,重量比为 10:1。然后,在真空室中使用铲子和脱气混合好,直到气泡完全去除。
- 将 PDMS 混合物与 SU-8 晶圆一起倒入容器中,达到所需的厚度(3-4 mm),然后再次脱气以去除气泡。
- 在 60 °C 的烤箱中烘烤 PDMS 至少 3 小时,以完全治愈 PDMS。
- 冷却后,使用手术刀或剃须刀刀片切断晶圆中固化的 PDMS。
- 要创建组织培养芯片的两个腔室,使用直径为 1.5 mm 的活检冲孔打两个孔,两个腔室位于其中。
- 要创建一个中等储层,准备另一个 PDMS 混合物(硅胶弹性体和固化剂,重量比为 10:1),然后倒入新的 10 厘米培养皿中。将倾泻体积调整为 5 mm 的 PDMS 厚度。
- 在 60 °C 的烤箱中烘烤 PDMS 至少 3 小时,以完全治愈 PDMS。
- 冷却 PDMS 后,用手术刀切断固化的 PDMS 以获得矩形环。
- 通过在中型储层之间应用未加密的 PDMS 和烘烤组装的 PDMS 层,将底层与介质储层粘合在一起。这种粘合结构可产生 PDMS 组织培养芯片。
- 用苏格兰胶带清洁 PDMS 组织培养芯片,以去除表面的灰尘和小颗粒。PDMS组织培养芯片可以储存在室温下,如果防止灰尘和紫外线。
3. 文化准备
- 培养基
注:除非另有说明,否则应过滤以下所有介质进行灭菌。准备好的介质可存储在4°C,并在一个月内使用。- 准备 mTeSR 加介质: 结合一瓶 100 mL mTeSR 加 5 倍补充与一瓶 400 mL 的 mTeSR 加基础介质。
- 准备 100 mL 的 KSR 介质:在 85 mL 的 DMEM/F12 中,添加 15 mL 的清点血清置换 (KSR, 15%), 1 mL 的商业谷氨酰胺补充剂 (1%)和1 mL的非必需氨基酸(NEAA,1%)。
- 要准备 100 mL 的 N2 介质: 在 100 mL 的神经底介质中, 添加 1 mL 的 N2 (100x), 1 mL 的商业谷氨酰胺补充剂, 和 1 ml 的 NEAA.
- 准备250 mL的成熟介质:在250 mL的神经基质介质中,加入5 mL的B27(2%),2.5 mL的商业谷氨酰胺补充剂(1%)和2.5mL的青霉素/链霉素(1%)。
- 将细胞培养级DMSO中的化合物(葡萄干酸(RA)、SB431542、LDN-193189、SU5402、DAPT、SAG、Y-27632)重新悬存到所需的浓度。准备别名并将其存储在-20°C,最长达6个月。使用以下库存解决方案:1 mM RA、10 mM SB431542、100 μM LDN-193189、10 mM SU5402、10 mM DAPT、1 mM SAG、10 mM Y-27632。
- 衣
注意:要防止地下室膜基质因热而聚合,请避免重复冻结-结冰周期。如果可能,用预冷却移液器提示和管处理所有涂层程序。地下室膜矩阵应在 4 °C 下通宵解冻,并使用预冷移液器提示和管子进行引用。阿里引用可以冻结在 -20 °C 或 -80 °C。- 在冰上以4°C解冻冰冻的点名。在涂装过程中,应保持冷点。使用预冷却移液器尖端,以 1:40 的比例用冰冷的 DMEM/F12 稀释地下室膜矩阵。未使用的稀释地下室膜矩阵可在 4 °C 下存储 2-3 天,因为未发生聚合。
- 添加 1 mL 的地下室膜矩阵/DMEM-F12 溶液,以覆盖 6 个井板中的一口井。
- 在室温下孵化盘子至少一小时,或4°C过夜。涂层板可在 4 °C 下存放最多一周。
4. 维护 iPS 细胞
注:当在此协议中的 6 个井板中观察到 90% 的≥的汇合时,在 mTeSR Plus 介质和亚培养中保持未分化的 iPS 细胞。在其他介质中培养的 iPS 细胞可能需要稍有调整。
- 准备第 3.2 步中前面提到的地下室膜矩阵涂层菜肴。
- 充分吸气的mTeSR加介质。用PBS清洗一次井,并添加0.5 mL的传递试剂(见 材料表)。等待几秒钟,并渴望解决方案。
- 在孵化器中以 37 °C 将板孵育 5 分钟,或直到细胞变圆。
注意:不同 iPS 细胞系和汇合点的孵化时间可能有所不同。请在显微镜下定期检查,以确定孵化过程中的分离时间。 - 添加 1 ml 的 mTesr 加介质, 轻点 30 - 60 s 的盘子, 以分离殖民地。
- 轻轻地将1mL的细胞悬浮液与7mL的新鲜mTeSR加介质混合。移液器不超过 5 次。
- 板的比例为1:8。通常从步骤 4.5 中添加 1 mL 的悬架,并添加 1 mL 的 mTeSR 加介质,并辅以 5-10 μM 的 Y-27632 (ROCK 抑制剂)。通过稀释比取决于iPSC线。
- 将电池放置在 5% CO2/37 °C 孵化器中。第二天,通过添加新的 mTeSR 加介质来删除 Y-27632。此后,最初每隔一天更换一次介质,并且随着细胞达到更高的汇合度,每天都更换媒体。
5. 将iPS细胞分化为运动神经元
注:以下所有选项(5.2、5.3 和 5.4) 均以 +90% 的效率生成 MNO。
- 用于运动神经元分化的通过 iPSC
注:差异化可以在 3D (5.2) 或 2D (5.3) 协议中成功进行。- 允许未分化的 iPS 细胞生长,直到它在 6 井板中的 mTeSR Plus 介质中达到大约 80% 的汇合度。
- 完全吸气的媒介。立即用无菌PBS清洗一次井,并在细胞中加入0.5 mL的细胞分离溶液。
- 在孵化器中以37°C孵育板约2-3分钟,或直到细胞分离和圆形,但保持附着在油井上。
- 使用 5 mL 血清学移液器添加 1 mL 的介质和轻轻移液器上下几次。将细胞悬架转移到由介质 4 mL 组成的 15 mL 管中。
- 离心机在200 x g 3分钟。
- 小心地吸附超纳坦,使颗粒不受干扰,并在介质的1 mL中重新悬浮细胞,并辅以10μM的Y-27632。
- 使用血细胞计计算细胞,然后进行 5.2(3D 分化)或 5.3(2D 分化)。
- 3D 分化中运动神经元球形 (MNS) 的形成("3D 协议")
注:从分化第0-12天(图2)起,每天进行完全的中等变化。- 种子 iPS 细胞从步骤 5.1.7 到 96 井 U 底板在 40,000 细胞/井在 100 μL 的 mTeSR Plus 补充 10 μM Y-27632.
- 第二天,用100μL的新鲜介质替换每口油井。
- 第 0 天和第 1 天:吸气培养基,代之以 100μL 的 KSR 介质(3.1.2),辅以 10 μM SB431542 和 100 nM LDN-193189。
- 第 2 天和第 3 天:吸气培养基,代之以 100 μL 的 KSR 介质,辅以 10 μM SB431542、100 nM LDN-193189、5 μM DAPT、5 μM SU5402、1 μM RA 和 1 μM SAG。
- 第 4 天和第 5 天:准备由 75% KSR 介质和 25% N2 介质(3.1.3) 组成的混合介质。然后,吸气培养介质,代之以 100μL 混合介质,辅以 10 μM SB431542、100 nM LDN-193189、5 μM DAPT、5 μM SU5402、1 μM RA 和 1 μM SAG。
- 第 6 天和第 7 天:准备由 50% KSR 介质和 50% N2 介质组成的混合介质。然后,吸气培养基,代之以100μL的混合介质,辅以5微米DAPT、5微米SU5402、1微米网膜酸和1微米SAG。
- 第 8 天和第 9 天:准备由 25% KSR 介质和 75% N2 介质组成的混合介质。然后,吸气培养介质,代之以 100μL 的混合介质,辅以 5 μM DAPT、5 μM SU5402、1 μM RA 和 1 μM SAG。
- 第 10 天和第 11 天:用 100 μl 的 N2 介质替换介质,辅以 5 μm DAPT、5 μm SU5402、1 μM RA 和 1 μM SAG。
- 第12天:继续将MN转移到组织培养芯片(步骤6),或用100μL的成熟介质(3.1.4)替换介质,辅以20 ng/mL脑源性神经营养因子(BDNF)。
注:MNS 可以从第 12 天到第 19 天传输到组织培养芯片。未转移的球体应保存在 96 井 U 底部板中,在成熟介质中补充 20 ng/mL BDNF,直到转移。
- (替代选项) 2D 差异化和过渡到 3D MNS("2D 协议")
- 将涂层溶液从预涂层的 12 口井板中吸气。
- 以每口井 100,000 - 200,000 个细胞的密度从步骤 5.1.7 中播种 iPS 细胞,在 mTeSR Plus 介质中以 10 μM 的 Y-27632 播种。
注:在没有Y-27632的情况下,继续培养mTeSR Plus介质中未分化的iPS细胞,直到当细胞太稀疏而无法下一步(5.3.3)时,细胞达到80%的汇合度。 - 在第 0 天和第 1 天:吸气培养基,代之以 1 mL 的 KSR 介质 (3.1.2), 辅以 10 μM SB431542 和 100 nM LDN-193189。
- 在第 2 天和第 3 天: 吸气培养介质, 代之以 1 ml 的 Ksr 介质, 辅以 10 μm SB431542, 100 nm LDN- 193189, 5 μm DAPT, 5μm SU5402, 1 Mμ RA 和 1 Mμ Sag 。
- 第 4 天和第 5 天:准备由 75% KSR 介质和 25% N2 介质(3.1.3) 组成的混合介质。吸气培养介质,代之以 1 mL 的混合介质,辅以 10 μM SB431542、100 nM LDN-193189、5 μM DAPT、5 μM SU5402、1 μM RA 和 1μM SAG。
- 第 6 天和第 7 天:准备由 50% KSR 介质和 50% N2 介质组成的混合介质。吸气培养基,代之以 1 mL 的混合介质,辅以 5 μM DAPT、5 μM SU5402、1 μM 转子酸和 1 μM SAG。
- 第 8 天和第 9 天:准备由 25% KSR 介质和 75% N2 介质组成的混合介质。吸气培养介质,代之以 1 mL 的混合介质,辅以 5 μM DAPT、5 μm SU5402、1 μM RA 和 1 μM SAG。
- 第 10 天和第 11 天:用 1 mL 的 N2 介质替换介质,辅以 5 μM DAPT、5 μm SU5402、1 μM RA 和 1 μM SAG。
- 第12天:吸气分化介质,用PBS快速清洗一次,并加入0.5 mL的细胞分离介质。将盘子放在 37 °C 的孵化器中 1-3 分钟(例如,如果使用 TrypLE 快车)或 20-30 分钟(例如,如果使用 Accutase)。
- 使用 P1000 移液器,轻轻收集细胞并将细胞转移到 15 mL 圆锥管中,采用新鲜的成熟介质,离心机在 200 x g 下加热 3 分钟。如果细胞笨重,轻轻移液器上下几次。不要移液器太多,因为这可能会对细胞造成损害。
- 吸附超纳坦,在1 mL的成熟介质(3.1.4)中重新悬浮颗粒,并辅以20 ng/mL BDNF。
- 用血细胞计数细胞。在成熟介质的96口井U底板中,以每口井10,000-40,000个细胞平板细胞,并辅以20 ng/ml的BDNF。初始播种密度应根据 iPS 细胞系和细胞状况进行优化,以便球体的直径在引入组织培养芯片时为 800-900μm。在大多数情况下,最初从每口井 20,000 个单元开始,然后根据大小增加或减少细胞数量。
- 培养额外的3-10天,直到细胞形成一个球体与光滑的边缘。
- (替代选项):运动神经元的MNS形成
注:商业上可用的人类iPS细胞源性运动神经元(见 材料表)可用于生成MINO,而不是与人类iPS细胞分化。- 解冻运动神经元的低温后,用9 mL的运动神经元介质迅速重新悬念细胞。在室温下以 400 x g 旋转 5 分钟。
- 吸食超纳坦,用运动神经元介质重新悬浮颗粒。
- 按照上述步骤(5.3.12-5.3.13)生产多国公司。
6. 运动神经器官(MNO)形成组织培养芯片的准备
- 将制备的 PDMS(从步骤 2.13 开始)浸入 Petri 菜中 70% 的乙醇中至少 1 小时,对已制备的 PDMS 进行消毒。
注:所有以下步骤都应在生物安全柜中操作。 - 将显微镜玻璃(76 x 52 mm)浸入培养皿中 70% 的乙醇中,对玻璃进行消毒。
- 在显微镜玻璃的干燥过程中,将 PDMS 设备放在半湿显微镜玻璃上,通过等待过夜使其完全干燥。一旦完全干燥,PDMS 设备应粘附在玻璃上。
注:此粘合不是永久性的,允许 PDMS 设备从显微镜玻璃分离后,组织收集培养。氧气等离子体的永久粘合可以用于最大限度地提高 PDMS 和玻璃之间的粘附性,但它将禁止拆解芯片和组织收集。 - 在 PDMS 设备和显微镜玻璃中涂上 30 μL 的稀释地下室膜矩阵,在 DMEM/F12 (1:40) 中通过在通道入口的一侧制作液滴,然后用移液器或吸气泵从入口的另一侧吸出溶液(图 3A)。不要吸气过多的溶液,以避免泡沫污染。
- 然后,在室温下或在 4 °C 下在次要容器(例如 Petri 菜)中孵育 PDMS 设备 1 小时。
7. 运动神经器官(MNO)形成
- 在使用前用预热的 150μL 成熟介质以 20 ng/mL 的 BDNF 补充来更换涂层溶液。
- 然后,使用带宽孔尖端的微点,将 MNS 从步骤 5.2.9 或 5.3.13 放入微通道的入口。MNS 可以通过重力自发地在设备底部安顿下来。注射 MNS 时不要施加太大的压力(图3B)。
注意:如果 MNS 卡在组织培养芯片孔的侧壁上,请从入口的另一侧轻轻吸气溶液。 - 用无菌水填充一个小储层(例如15mL管的盖子),并将其放置在次要容器中的组织培养芯片附近,以防止中等蒸发。然后,将其放置在 5%CO 2/37 °C 孵化器中。
- 对于介质变化,从中储层中心吸气耗尽的文化介质(图3C)。不要吸气所有的介质和组织。
- 轻轻添加新鲜的成熟介质(带BDNF)。媒体应每 2-3 天更换一次。在文化过程中,任何时候都不要烘干文化媒介。轴突从 MNS 成长为通道,并在 2-3 周内自发组装成单个捆绑包,从而形成 MNO。MNO 可以在设备中培养超过 1 个月。
8. MNO下游分析
- 全安装免疫染色
- 将设备或餐具带入化学烟雾罩。通过在媒体上添加大约 8% 的准甲醛 (PFA) 的体积来修复 MNO,以实现 4% PFA 的最终浓度。从玻璃上剥下 PDMS 设备,在室温下孵育 15-20 分钟。
- 用PBS清洗MNO,然后重复PBS清洗2倍。
- 在PBS中用0.2%的Triton X-100来渗透MNO,并在室温下孵育5分钟。
- 用PBS清洗MNO,然后重复PBS清洗2倍。然后,用含有 1% BSA 的 PBS 阻止 MNO,并在室温下孵育 1 小时。
- 稀释PBS中含有0.1%BSA的原发性抗体,并在4°C下用原发性抗体溶液在一夜之间孵育MNO。 用PBS清洗MNO三次。
- 用 0.1% BSA 稀释 PBS 中的二次抗体,并在室温下用二次抗体溶液孵育 MNO 2 小时。然后用 PBS 洗 MNO 三次。
- 在PBS中用霍赫斯特染色MNO,含有0.2%的三顿-X,并在室温下孵育5分钟。
- 用PBS清洗MNO三次。免疫染色 MNO 已准备好使用荧光或共生激光显微镜进行成像。
- 轴件捆绑的组织收集和隔离
- 将 10 mL 的 HBSS 溶液倒入 10 厘米的培养皿中。然后,将整个 PDMS 设备浸入 HBSS 解决方案中。
- 在立体显微镜下小心地将 PDMS 从显微镜玻璃中分离。当组织粘在 PDMS 设备上时,使用移液器从孔顶部轻轻应用 1 mL 的 HBSS 溶液。
- 一旦组织从 PDMS 脱落,请在显微镜玻璃上轻轻涂抹 1 毫升的 HBS,以将 PDMS 与显微镜玻璃完全分离。
- 要将轴束与球体分离,在显微镜下用手术刀或钳子切割轴束。将轴束切离球体稍远(+1毫米),以避免迁移细胞受到污染。
- 通过各种下游分析,如RT-PCR、RNA-seq和西方印迹,可以进一步分析孤立的轴束和球形。
- PDMS 文化芯片可以重复使用。要清洁培养芯片,请在蒸馏水中将培养芯片声化 15 分钟。然后,在蒸馏水中将芯片声波化,并辅以1%的洗涤剂。用蒸馏水清洗培养芯片5次。
- 钙成像
注:神经元活性可以用钙指示器从组织培养芯片(从8.2)收集组织之前和之后进行测量。该协议基于特定的商业工具包(见 材料表)。或者,也可以使用其他钙成像套件或等效方法。- 用 PBS(无 Ca2+ 和 Mg2+)清洗 MNO 三次。
- 在记录介质(20 m M HEPES、115 mM NaCl、5.4 mM KCl、0.8 mM MgCl 2、1.8 mM、CaCl2、13.8mM 葡萄糖)中孵化组织,30-60 分钟,37 °C。 增加0.01-0.02%的多音速F-127可以帮助吸收Fluo-4 AM进入细胞。
- 然后,用PBS(无Ca2+ 和Mg2+)清洗组织,代之以录音介质。
- 使用荧光显微镜与 GFP/Cy2 滤镜集获取延时图像。设置每帧不到 20 毫秒的曝光时间。
- 使用图像 J 将收购的电影文件打开作为图像序列。
- 如果使用彩色 CCD 或 CMOS 相机,则将 RGB 图像转换为 16 位单声道图像。打开"分析 | 工具|投资回报率经理",绘制感兴趣的区域,然后单击"添加"。单击"多重测量"。结果将显示多个投资回报率的强度平均值。
- 使用一般数据分析软件绘制信号强度变化图。
- 多极阵列对神经元活动的测量
注:运动神经元的活动可以通过多极阵列(MEA)捕获。- 创建 MNO 后,将其转移到涂有 MEA 探头的地下室膜矩阵上。将组织放置在电极上。
- 添加 200 μL 的成熟介质,并在 37 °C 下孵育 1-2 小时,使 MNO 能够连接到表面。
- 用录音介质(8.3.2)替换介质。可选地将网格和重量放在 MNO 上,以增加与电极的收缩。
- 将 MEA 探头设置为录制头阶段。用 70% 乙醇擦拭 MEA 探头和头部阶段之间的接触。
- 开始记录神经元活动,按照 MEA 制造商的说明操作。
结果
在3D分化程序中,运动神经元在12-14天内被分化(图4和图5)。重要的是,超过60%的细胞在分化过程中表示运动神经元标记HB9。免疫化学显示,MNS中大约80%的细胞是SMI32阳性运动神经元。HB9和SMI32是已建立的早期运动神经元标记15,16。HB9 和 SMI32 的表达是需要确认以确保运动神经元细胞识别的关键参数。在将 MNS 引入培养芯片后,轴突扩展到通道和轴突捆绑形式。由于微通道充当物理导引,轴突从 MNS 拉长,并通过轴突交互(图 6A)形成捆绑。必须通过微观观察确认轴束的形成,以确认MNO的生成。成功的 MNO 承载一个宽于 50μm 的轴突捆绑包,通道中的捆绑包中几乎没有分离的轴突。在引入球体24小时后,可以观察到轴突的初始拉长。在接下来的3-4天内,轴突到达微通道的中心,然后在10天内到达另一端(图6A)。因此,轴突在芯片的2-3周内组装并形成了一个直线和单向束,之后观察到神经元活动。
运动神经器官可以通过将 PDMS 从显微镜玻璃中分离以进行生物分析(图 6B)从芯片中收集。在显微镜下使用手术刀或钳子切割,可以解剖和分离轴束和细胞体(图6B)。这些生物材料,包括RNA和蛋白质,可用于常规生化检测,如RT-PCR和西方印迹。在多核子的轴突束中,在西方印迹(图6C)中未检测到核蛋白或对气质制造蛋白。
结合钙指标(Fluo-4 AM),神经元活性可以在组织培养芯片中捕获。在MNO中观察到球形和轴束中运动神经元的自发活动。此外,还使用多极阵列系统观察到神经活动。
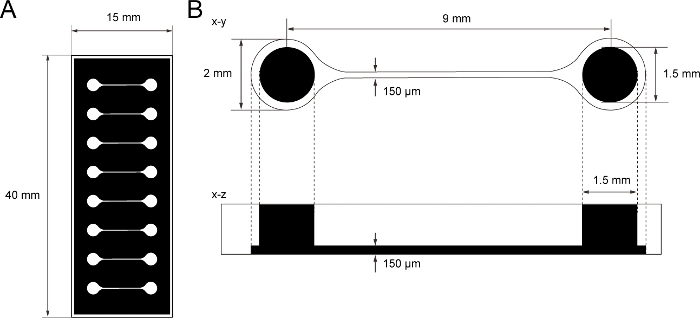
图1:PDMS组织培养芯片的尺寸。
(A) 组织培养芯片的光面具。(B) 组织培养芯片中微通道的尺寸。支撑运动神经元球形的基室直径为2毫米,腔体上方的PDMS孔为1.5毫米。微通道桥接两个腔室的宽度和高度均为 150 μm。 请点击这里查看此数字的较大版本。
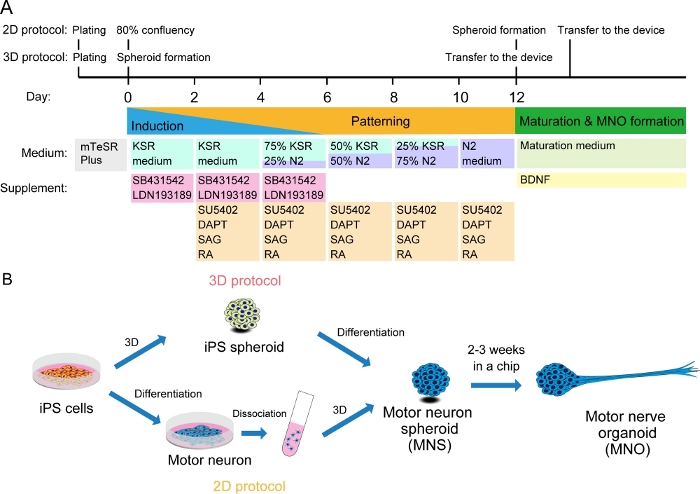
图2:运动神经元分化的示意图。
(A) 分化步骤涉及神经诱导、运动神经元血统的模式以及运动神经元的成熟。(B) 从iPS细胞中创建运动神经元球形(MNS)的两种选择:3D协议和具有运动神经元分离步骤的二维协议。运动神经器官 (MNO) 可以通过这两种协议获得。请点击这里查看此数字的较大版本。
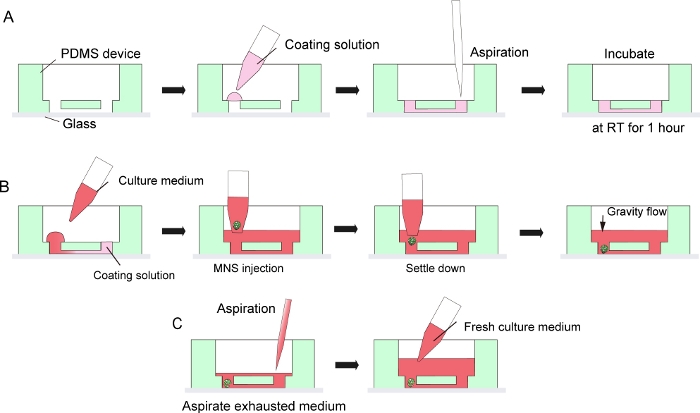
图3:地下室膜基质涂层和运动神经元球形引入的分步协议。
(A) 组织培养芯片通道中的地下室膜基质涂层。(B) MNS 引入芯片的孔。(C) 文化媒介因耗尽媒介的愿望而改变。 请点击这里查看此数字的较大版本。
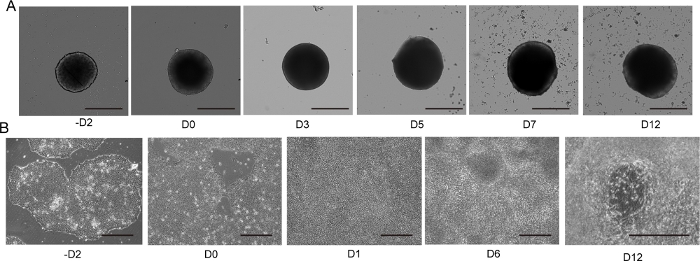
图4:2D和3D运动神经元分化。
(A) 具有代表性的 3D MNS 分化(3D 协议)的时间过程。随着时间的推移,MNS 的大小逐渐增加。比例:500μm。(B) -D2、D0、D1、D6、D12(2D协议)的2D分化时间过程。比例:500μm。请点击这里查看此数字的较大版本。
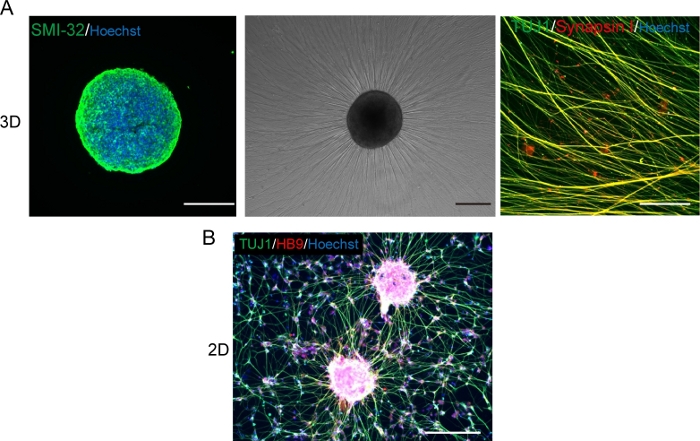
图5:运动神经元的特征。
(A) (左) 沾有SMI-32抗体和DAPI的MNS的低温剖析。(中)在地下室膜矩阵涂层表面上重镀 MNS 的相位对比图像。观察到轴拉伸。(右)重镀 Mns 的轴染色为 Synapsin I 和 Tuj1 抗体。刻度条:500μm(左、中)和50μm(右)。(B) 二维运动神经元免疫与 Tuj 和 HB9 抗体的代表性图像。比例:200μm。 请点击这里查看此数字的较大版本。
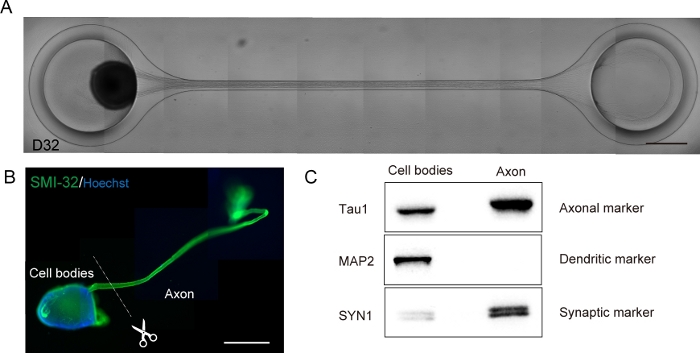
图6:培养芯片中产生的运动神经器官(MNO)的特征。
(A) D32 上轴伸长和厚轴束形成的代表性图像。比例:500μm。(B) SMI-32和DAPI对运动神经器官(MNO)进行免疫。轴突和细胞体可以通过物理切割进行分离。刻度条:1毫米(C)来自轴突和细胞体的蛋白质纯度,由西方印迹量化。MAP2,一种树突标记物,没有在轴蛋白中检测到,而轴蛋白Tau1富含轴蛋白。 请点击这里查看此数字的较大版本。
讨论
此协议描述了运动神经器官 (MNO) 的形成,该有机体具有从人类 iPS 细胞生成的运动神经元球体中延伸的轴束。形成的轴束厚、灵活,在单向结构中组织良好。通过解剖轴突束,可以充分获得高纯度轴蛋白和RNA进行生化分析。神经元活性可以通过钙成像在轴突束和球形中测量。西方的污点没有检测到轴突利酸盐中核蛋白和树突蛋白的污染,这表明我们的方法有效地将轴突与细胞体和树突分离出来。
此协议的优点之一是 MNO 配备轴成捆绑包的快速分化和生成,其中所有流程均可在 4 周内使用 3D 协议完成,使用 2D 协议可在 5-6 周内完成。与其他通常需要 3-4 周才能从胚胎干细胞和 iPS 细胞17 中分化成 MN 的协议相比,这很短,并且需要额外的 2-4 周才能获得轴突拉伸。与 2D 协议相比,3D 协议通常优先于 2D 协议,因为与 2D 协议相比,没有分离步骤的分化时间更短、步骤更少、技术风险更小。基于微流体的组织培养芯片的设计方式使MNS的轴突可以通过微通道向另一个腔室拉长,从而通过诱导轴突的相互作用和轴突之间的亲和力,促进轴突束的形成。由于简单的实验设置,这里描述的所有方案不仅可以由生物工程师执行,他们熟悉组织培养芯片的操作,而且生物学家和神经科学家也不熟悉微流体和微压造技术。需要注意的是,第 1 步和第 2 步也可以使用外部制造服务执行。
完成协议的关键步骤之一是文化媒介的连续变化。建议在分化过程中每一步彻底改变文化介质,使乏力介质中的因素不干扰MN分化。此协议的另一个关键点是保持未分化的 iPS 细胞质量良好。初始 iPS 细胞培养物的质量显著影响获得运动神经元和 MNO 的效率。另一点是MNS的直径应该小于芯片孔的大小(1.5毫米)。较大的球体无法进入腔室,并有可能在中心部分经历严重的缺氧坏死。MNS 的大小可以通过更改 iPS 细胞的初始播种数量(在 3D 协议中)或运动神经元(在 2D 协议中)来控制。应针对每个 iPS 细胞线优化细胞的播种密度。
带微胶和小孔滤镜的分体微流体设备已被广泛用于将轴突与细胞体和树突分离。这种技术还可以将轴突与细胞体和树突分离出来,在捆绑组织中具有超强的轴突丰度。与其他方法相比,该方法的一个主要局限性是,在组织培养芯片的当前设计中,它不能分离两种不同的培养基,这妨碍了需要两种不同介质的两种不同细胞的共生能力。另一个限制是 PDMS 芯片对组织大小施加了预先确定的限制。大于孔的球体不能进入腔室,轴束不能比微流道的宽度更厚。
这种方法可以应用于其他类型的神经元。我们小组已经显示出使用修改的方法结合脑器官技术18对脑路进行建模的能力。皮质球体被引入舱室,轴突自发地向每个球体相互拉长,随后自发形成轴突束。因此,两个皮质球体可以通过轴束连接,组织可以作为一块获得。这表明,无论神经元细胞类型如何,这种方法都具有高度的多功能性,可以形成轴突束组织。在此协议中,使用了人类iPS细胞,但是,其他干细胞,包括人类ES细胞和人类神经干细胞,可以与修改提出的协议。神经元的3D球形可以通过不同的协议19,20产生。这种用轴束制作组织的方法将来有可能与其他分化方案相结合,用于制造3D MN球形。此外,只需改变组织培养芯片微通道的宽度和高度,即可控制轴束的厚度和长度,以备将来发展之用。
我们相信,这一协议可用于药物测试和筛选,并有助于了解轴感筋膜发育和疾病背后的机制。
披露声明
在该协议的一部分中,一项专利已授权给吉克萨克生物工程公司,该公司是由川田吉罗创立的。
致谢
这项研究得到了日本科学促进会(JSPS)17H05661和18K19903、核心-2核心项目和超越人工智能研究所的支持。
材料
| Name | Company | Catalog Number | Comments |
| (Tridecafluoro-1,1,2,2-tetrahydrooctyl)-1-trichlorosilane | Sigma | 440302 | |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | Electron Microscopy Sciences | 15710 | |
| 200µl Wide Bore Pipet Tips | BMBio | BMT-200WRS | |
| 6-well plates | Violamo | 2-8588-01 | |
| Accutase | ICT | AT104 | |
| B-27 Supplement (50X) | Gibco | 17504044 | |
| Bovine serum albumin | Sigma | A6003 | |
| Brain-derived neurotrophic factor (BDNF) | Wako | 020-12913 | |
| CO2 incubator | Panasonic | MCO-18AIC | |
| Cryostor CS10 | Stem Cell Technologies | 07959 | |
| DAPT | Sigma | D5942 | |
| DMEM/F12 | Sigma | D8437 | |
| Fluo-4 AM | Dojindo Laboratories | CS22 | |
| GlutaMAX Supplement | Gibco | 35050-061 | |
| Growth factor reduced Matrigel (basement membrane matrix) | Corning | 354230 | |
| HB9 Antibody | Santa Cruz | sc-22542 | |
| HBSS | Wako | 085-09355 | |
| Hoechst 33342 | Sigma | 14533 | |
| iCell motor neuron (commercially available human iPS cell-derived motor neurons) | Cellular Dynamics | R1051 | |
| Isopropyl alcohol (IPA) | Wako | 166-04836 | |
| Knock Out Serum Replacement | Gibco | 10828028 | |
| LDN193189 | Sigma | SML0559 | |
| MEA probe | Alpha MED Scientific inc | MED-P5004A | |
| MEM Non-essential Amino Acid Solution (100x) (NEAA) | Sigma | M7145 | |
| Microscope Glass | Matsunami | S9111 | |
| mTeSR Plus | Stem Cell Technologies | 05825 | |
| N2 supplement | Wako | 141-08941 | |
| Neurobasal medium | Gibco | 21103049 | |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Photoresist SU-8 2100 | Microchem | #SU-8 2100 | |
| Prime surface 96U | Sumitomo Bakelite | MS-9096U | |
| ReLeSR (passaging reagent) | Stem Cell Technologies | 05872 | |
| Retinoic acid | Wako | 186-01114 | |
| SAG | Sigma | SML1314 | |
| SB431542 | Wako | 192-16541 | |
| Silicon wafer | SUMCO | PW-100-100 | |
| Silpot 184 w/c kit | Dow Toray | Silpot 184 w/c kit | |
| Smi32 Antibody | Biolegend | 801701 | |
| SU5402 | Sigma | SML0443 | |
| SU-8 Developer | Microchem | Y020100 | |
| Synapsin I Antibody | Millipore | Ab1543 | |
| TrypLE Express liquid without phenol red (dissociation solution) | Gibco | 12604-021 | |
| Tuj1 Antibody | Biolegend | 801202 | |
| Y-27632 | Wako | 030-24021 |
参考文献
- Raper, J., Mason, C. Cellular strategies of axonal pathfinding. Cold Spring Harbor Perspective Biology. 2 (9), 001933(2010).
- Ito, Y., et al. RIPK1 mediates axonal degeneration by promoting inflammation and necroptosis in ALS. Science. 353 (6299), 603-608 (2016).
- Fujimori, K., et al. Modeling sporadic ALS in iPSC-derived motor neurons identifies a potential therapeutic agent. Nature Medicine. 24 (10), 1579-1589 (2018).
- Chen, H., et al. Modeling ALS with iPSCs Reveals that Mutant SOD1 Misregulates Neurofilament Balance in Motor Neurons. Cell Stem Cell. 14 (6), 796-809 (2014).
- Osaki, T., Uzel, S. G. M., Kamm, R. D. Microphysiological 3D model of amyotrophic lateral sclerosis (ALS) from human iPS-derived muscle cells and optogenetic motor neurons. Science Advances. 4 (10), (2018).
- Imamura, K., et al. The Src/c-Abl pathway is a potential therapeutic target in amyotrophic lateral sclerosis. Science Translational Medicine. 9 (391), (2017).
- Wang, L., Marquardt, T. What axons tell each other: axon-axon signaling in nerve and circuit assembly. Current Opinion in Neurobiology. 23 (6), 974-982 (2013).
- Kawada, J., et al. Generation of a Motor Nerve Organoid with Human Stem Cell-Derived Neurons. Stem Cell Reports. 9 (5), 1441-1449 (2017).
- Nagendran, T., Poole, V., Harris, J., Taylor, A. M. Use of Pre-Assembled Plastic Microfluidic Chips for Compartmentalizing Primary Murine Neurons. JoVE. (141), e58421(2018).
- Paranjape, S. R., Nagendran, T., Poole, V., Harris, J., Taylor, A. M. Compartmentalization of Human Stem Cell-Derived Neurons within Pre-Assembled Plastic Microfluidic Chips. JoVE. (147), e59250(2019).
- Chambers, S. M., et al. Combined small-molecule inhibition accelerates developmental timing and converts human pluripotent stem cells into nociceptors. Nature Biotechnology. 30 (7), 715-720 (2012).
- Rimington, R. P., Fleming, J. W., Capel, A. J., Wheeler, P. C., Lewis, M. P. Bioengineered model of the human motor unit with physiologically functional neuromuscular junctions. bioRxiv. , (2020).
- Cullen, D. K., et al. Bundled Three-Dimensional Human Axon Tracts Derived from Brain Organoids. iScience. 21, 57-67 (2019).
- Giandomenico, S. L., et al. Cerebral organoids at the air-liquid interface generate diverse nerve tracts with functional output. Nature Neurosciences. 22 (4), 669-679 (2019).
- Egawa, N., et al. Drug screening for ALS using patient-specific induced pluripotent stem cells. Science Translational Medicine. 4 (145), (2012).
- Sances, S., et al. Modeling ALS with motor neurons derived from human induced pluripotent stem cells. Nature Neurosciences. 19 (4), 542-553 (2016).
- Qu, Q., et al. High-efficiency motor neuron differentiation from human pluripotent stem cells and the function of Islet-1. Nature Communications. 5 (1), 3449(2014).
- Kirihara, T., et al. A Human Induced Pluripotent Stem Cell-Derived Tissue Model of a Cerebral Tract Connecting Two Cortical Regions. iScience. 14, 301-311 (2019).
- Rigamonti, A., et al. Large-Scale Production of Mature Neurons from Human Pluripotent Stem Cells in a Three-Dimensional Suspension Culture System. Stem Cell Reports. 6 (6), 993-1008 (2016).
- Yan, Y., Song, L., Madinya, J., Ma, T., Li, Y. Derivation of Cortical Spheroids from Human Induced Pluripotent Stem Cells in a Suspension Bioreactor. Tissue Engineering Part A. 24 (5-6), 418-431 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。