Method Article
Geração organoide do nervo motor tridimensional
Neste Artigo
Resumo
Este protocolo fornece um procedimento abrangente para fabricar organoide nervoso motor derivado de células iPS humanas através da montagem espontânea de um robusto feixe de axônios estendidos de um esferoide em um chip de cultura tecidual.
Resumo
Um fascicle de axônios é um dos principais motivos estruturais observados no sistema nervoso. A interrupção dos fascicles de axônio pode causar doenças desenvolvitórias e neurodegenerativas. Embora inúmeros estudos de axônios tenham sido conduzidos, nosso entendimento da formação e disfunção de fascicles de axônio ainda é limitado devido à falta de modelos in vitro tridimensionais robustos. Aqui, descrevemos um protocolo passo-a-passo para a rápida geração de um organoide nervoso motor (MNO) a partir de células-tronco pluripotentes induzidas por humanos (iPS) em um chip de cultura de tecido baseado em microfluidic. Em primeiro lugar, descreve-se a fabricação de chips usados para o método. A partir de células iPS humanas, forma-se um esferoide de neurônio motor (MNS). Em seguida, o MNS diferenciado é transferido para o chip. A partir daí, os axônios crescem espontaneamente do esferoide e se reúnem em um fascículo dentro de um microcanal equipado no chip, o que gera um tecido MNO carregando um feixe de axônios estendidos do esferoide. Para a análise a jusante, os MNOs podem ser retirados do chip para serem fixados para análises morfológicas ou dissecados para análises bioquímicas, bem como imagens de cálcio e gravações de matriz de vários eletrodos. Os MNOs gerados com este protocolo podem facilitar o teste e rastreamento de medicamentos e podem contribuir para a compreensão dos mecanismos de desenvolvimento subjacente e doenças dos fascicles de axônio.
Introdução
Os neurônios motores espinhais (MN) estendem os axônios aos músculos esqueléticos para controlar o movimento corporal. Suas trajetórias axonal são altamente organizadas e reguladas no processo de desenvolvimento. Apesar de muitos estudos sobre extensão de axônio e orientação1,os mecanismos de formação organizada de axônio ainda estão sendo investigados. Axônios de neurônios motores são frequentemente danificados por doenças neurodegenerativas, como a esclerose lateral amiotrófica (ELA)2, mas mecanismos fisiopatológicos dos danos nos fascicles de axônio são mal compreendidos. Assim, é necessário um modelo fisiológico e patológico para recapitular a formação e regressão do feixe de axônio no campo.
Um neurônio motor derivado de células-tronco humanas é uma plataforma promissora para entender o desenvolvimento e doenças como a ALS3. Células-tronco pluripotentes induzidas pelo homem (células iPS) podem ser usadas para modelar doenças usando células derivadas do paciente. Até o momento, vários métodos de diferenciação de células-tronco pluripotentes em MN foram relatados4,5,6. No entanto, os axônios dos neurônios na cultura bidimensional são orientados aleatoriamente e não recapitulam o microambiente in vivo dentro dos nervos em desenvolvimento nos quais os axônios são montados unidiretamente através de densas interações axo-axonanas7. Para superar essa questão, desenvolvemos uma técnica para gerar um tecido tridimensional semelhante ao nervo motor a partir das células iPS humanas8, e nomeamos o tecido como organoide do nervo motor (MNO). O MNO consiste em corpos celulares localizados em um esferoide de neurônio motor (MNS) e um fascicle axonal estendido do esferoide. Os axônios no fascicle são unidiretamente orientados, que se assemelha a axônios no desenvolvimento de nervos motores. Assim, os MNOs fornecem exclusivamente um microambiente axonal fisiológico, o que não foi feito por nenhum outro método de cultura neuronal previamente desenvolvido.
Neste protocolo, descrevemos métodos para fabricação de chips de cultura tecidual, rápida diferenciação de neurônios motores e formação organoide do nervo motor em chips desenvolvidos. Nosso chip de cultura tecidual é muito simples, e contém apenas um compartimento para aceitar um esferoide, um microcanal para formar um feixe de axônio, e um compartimento para abrigar terminais de axônio. O dispositivo não contém estruturas complexas, incluindo microvalhões ou filtros de microporos que muitas vezes são usados para separar axônios e corpos celulares pelo tamanho9,10. Assim, nossos dispositivos podem ser facilmente fabricados seguindo as etapas descritas neste protocolo se uma configuração de fotolitografia estiver disponível.
A rápida diferenciação das células iPS humanas é alcançada com uma combinação otimizada de fatores de indução e padronização (SB431542, LDN-193189, ácido retinóico (RA) e agonista suavizada (SAG)) e fatores de aceleração (SU5402 e DAPT). Foi relatado que a combinação de SU5402 e DAPT acelera a diferenciação de neurônios periféricos e células de crista neural11. Neste protocolo, oferecemos três métodos diferentes para gerar MNOs, para que os leitores possam decidir sobre um método mais adequado às suas necessidades. Recomendamos a realização da diferenciação das células iPS humanas após a formação de um esferoide (o método 3D), uma vez que o MNS diferenciado pode ser transferido diretamente para um chip de cultura tecidual. Alternativamente, as células iPS humanas podem ser diferenciadas em neurônios motores na cultura monocamada (2D) e, em seguida, criadas em esferoides de neurônio motor tridimensional, como relatamos anteriormente8. Atualizamos o protocolo, e com o método de diferenciação tridimensional descrito neste protocolo, a transição do 2D para o 3D pode ser evitada e os MNOs podem ser obtidos com menor tempo de diferenciação, menos etapas e riscos técnicos reduzidos sem a etapa de dissociação. Neurônios disponíveis comercialmente também podem ser usados para gerar MNS para reduzir o tempo de diferenciação.
Para gerar um MNO, nós cultuamos um MNS no chip de cultura de tecidos. Os axônios alongam-se do esferoide e estendem-se para o microcanal no qual os axônios se reúnem e se alinham unidiretamente. Isso facilita a interação axonal e a formação espontânea de um tecido de axônio unidirecional bem montado no microcanal, que é alcançado exclusivamente por este protocolo, enquanto a formação espontânea do feixe ou a orientação axonal guiada por si só pode ser alcançada por outros protocolos12,13,14. Em um experimento típico, poucas células migram de esferoides para o microcanal e a maioria das células permanece nas proximidades. Este método permite que os axônios sejam espontaneamente separados dos esferoides sem o uso de barreiras físicas dependentes de tamanho (por exemplo, microgrooves ou filtros de microporos) para separar axônios dos corpos celulares.
O MNO resultante pode ser submetido a diversos exames, incluindo análises morfológicas, bioquímicas e físicas. O corpo celular e o feixe de axônio estendido podem ser fisicamente isolados pelo corte e podem ser analisados separadamente para experimentos a jusante, por exemplo, ensaios bioquímicos. Materiais biológicos, incluindo RNA e proteína, podem ser isolados de apenas alguns feixes de axônio para ensaios bioquímicos regulares, incluindo RT-PCR e manchas ocidentais. Aqui, descrevemos um protocolo para a geração de organoide nervoso motor a partir de células iPS, que oferece um modelo fisiológico e patológico atraente para estudar o mecanismo de desenvolvimento subjacente e doença dos fascicles de axônio.
Protocolo
1. Fabricação de molde SU-8 por fotolitografia
NOTA: Este procedimento envolve produtos químicos perigosos. Use capô de fumaça e EPI por toda parte.
- Limpe o wafer de silício (4 polegadas de diâmetro, 1 mm de espessura, polido) com acetona e sopre com gás nitrogênio. Em seguida, asse a 180 °C por 3 minutos para secar.
- Dispense 3 mL de SU-8 2100 em um wafer limpo.
- Cubra o SU-8 uniformemente no wafer usando um reveste de spin a 500 rpm para 10 s e, em seguida, gire sequencialmente a 1500 rpm por 30 s com uma aceleração de 300 rpm/s para obter uma camada de 150 μm de espessura de SU-8.
NOTA: Certifique-se de que o wafer de silício está posicionado no centro do revestimento de giro e corretamente fixado por vácuo. - Leve a assade o wafer na placa quente a 50 °C por 10 minutos, a 65 °C por 7 min, e a 95 °C por 45 min.
- Defina a máscara(Figura 1)ao alinhador da máscara e exponha a luz UV (365 nm) para 60 s.
NOTA: O tempo de exposição precisa ser otimizado por uma dose apropriada de luz UV. - Após a exposição, asse o wafer a 65 °C por 6 min, e a 95 °C por 13 min na placa quente.
- Desenvolva o wafer para 10-20 min no desenvolvedor SU-8 com agitação usando um agitador orbital, alterando a solução em desenvolvimento uma vez durante o processo.
NOTA: Estenda o tempo de desenvolvimento quando os detritos do SU-8 permanecerem. - Enxágüe o wafer em isopropanol e seque suavemente o wafer com gás nitrogênio.
- Meça a altura do SU-8 depositado por um microscópio de medição e certifique-se de que ele tem aproximadamente 150 μm de espessura. Pode ser armazenado indefinidamente à temperatura ambiente.
2. Fabricação de chips de cultura de tecido à base microfluida PDMS
- Fixar o wafer depositado SU-8 em um recipiente (por exemplo, placa de Petri de plástico de 15 cm) por fita lateral dupla.
- Tire a poeira do wafer usando gás nitrogênio.
- Para silanizar, coloque o wafer depositado SU-8 em uma câmara de vácuo junto com um recipiente pequeno (por exemplo, prato de 35 mm). Queda de 10 μL de (tridecafluoro-1,1,2,2-tetrahidrooctil)-1-triclorosilano no pequeno recipiente. Não aplique diretamente o (tridecafluoro-1,1,2,2-tetrahidrooctil)-1-triclorosilano ao wafer SU-8.
- Feche bem a câmara de vácuo e ligue uma bomba de vácuo por pelo menos 2 h.
- Pegue um copo de plástico e despeje o elastômero de silicone (por exemplo, Silpot 184 ou equivalentemente Sylgard 184) e o agente de cura em uma relação de peso de 10:1. Em seguida, misture bem usando uma espátula e degas na câmara de vácuo até que as bolhas sejam totalmente removidas.
- Despeje a mistura de PDMS no recipiente com o wafer SU-8 até a espessura desejada (3-4 mm) e desgas novamente para remover bolhas.
- Asse o PDMS em forno a 60 °C por pelo menos 3 h para curar totalmente o PDMS.
- Após o resfriamento, corte o PDMS curado do wafer usando um bisturi ou uma lâmina de barbear.
- Para criar as duas câmaras do chip de cultura tecidual, faça dois furos onde os dois compartimentos estão localizados usando um soco de biópsia de 1,5 mm de diâmetro.
- Para criar um reservatório médio, prepare outra mistura de PDMS (elastômero de silicone e o agente de cura em uma relação de peso de 10:1) e despeje-o em uma nova placa de Petri de 10 cm. Ajuste o volume de derramamento para 5 mm de espessura de PDMS.
- Asse o PDMS em forno a 60 °C por pelo menos 3 h para curar totalmente o PDMS.
- Depois de resfriar o PDMS, corte o PDMS curado com um bisturi para obter um anel retangular.
- Conecte a camada inferior com o reservatório médio aplicando PDMS nãocurados entre eles e assando as camadas PDMS montadas. Esta estrutura ligada resulta no chip de cultura de tecido PDMS.
- Limpe o chip de cultura de tecido PDMS por uma fita adesiva para remover poeira e pequenas partículas da superfície. Os chips de cultura de tecido PDMS podem ser armazenados à temperatura ambiente se protegidos contra poeira e UV.
3. Preparação da cultura
- Meio de cultura
NOTA: Todos os meios de comunicação listados abaixo devem ser filtrados para esterilização, a menos que seja indicado de outra forma. A mídia preparada pode ser armazenada a 4 °C e usada dentro de um mês.- Para preparar o mTeSR Plus médio: combine uma garrafa de 100 mL mTeSR Plus 5x suplemento com uma garrafa de 400 mL de mTeSR Plus Basal Medium.
- Para preparar 100 mL de meio KSR: Em 85 mL de DMEM/F12, adicione 15 mL de substituição de soro knockout (KSR, 15%), 1 mL de suplemento comercial de glutamina (1%) e 1 mL de aminoácido não essencial (NEAA, 1%).
- Para preparar 100 mL de n2 médio: Em 100 mL de meio neurobásal, adicione 1 mL de N2 (100x), 1 mL de suplemento comercial de glutamina e 1 mL de NEAA.
- Para preparar 250 mL de maturação média: Em 250 mL de meio neurobásal, adicione 5 mL de B27 (2%), 2,5 mL de suplemento comercial de glutamina (1%) e 2,5 mL de Penicilina/Estreptomicina (1%).
- Resuspend os compostos (ácido retinóico (RA), SB431542, LDN-193189, SU5402, DAPT, SAG, Y-27632) em DMSO de cultura celular à concentração desejada. Prepare as alíquotas e armazene-as a -20 °C por até 6 meses. São utilizadas as seguintes soluções de estoque: RA de 1 mM, 10 mM SB431542, 100 μM LDN-193189, 10 mM SU5402, 10 mM DAPT, 1 mM SAG, 10 mM Y-27632.
- revestimento
NOTA: Para evitar a polimerização da matriz de membrana do porão pelo calor, evite ciclos repetitivos de congelamento. Manuseie todos os procedimentos de revestimento com pontas e tubos de pipeta pré-resfriados, se possível. A matriz de membrana do porão deve ser descongelada durante a noite a 4 °C e aliquoed usando pontas e tubos de pipeta pré-refrigerados. As alíquotas podem ser congeladas a -20 °C ou -80 °C.- Descongele a alíquota congelada a 4°C no gelo. A alíquota deve ser mantida fria durante o procedimento de revestimento. Usando uma ponta de pipeta pré-resfriada, diluir a matriz de membrana do porão com DMEM/F12 gelado a uma proporção de 1:40. A matriz de membrana diluída nãoutilizado pode ser armazenada a 4 °C por 2-3 dias, dado que não ocorreu polimerização.
- Adicione 1 mL da matriz de membrana do porão/solução DMEM-F12 para revestir um poço da placa de 6 poços.
- Incubar a placa em temperatura ambiente por pelo menos uma hora, ou 4 °C durante a noite. As placas revestidas podem ser armazenadas a 4 °C durante a máxima de uma semana.
4. Manutenção de células iPS
NOTA: As células iPS indiferenciadas são mantidas em mTeSR Plus média e subculturada quando a confluência de ≥ 90% é observada em uma placa de 6 poços neste protocolo. Pequenos ajustes podem ser necessários para células iPS cultivadas em outras mídias.
- Prepare pratos revestidos de matriz de membrana do porão, como mencionado anteriormente na etapa 3.2.
- Aspire totalmente o meio mTeSR Plus. Lave o poço uma vez com PBS e adicione 0,5 mL de reagente de passagem (ver Tabela de Materiais). Espere alguns segundos e aspire a solução.
- Incubar a placa a 37 °C na incubadora por 5 minutos ou até que as células fiquem redondas.
NOTA: O tempo de incubação pode variar entre diferentes linhas celulares iPS e a confluência. Verifique periodicamente sob o microscópio para determinar o tempo de dissociação durante a incubação. - Adicione 1 mL de mTeSR Plus médio e toque na placa por 30-60 s para desprender as colônias.
- Misture suavemente 1 mL da solução de suspensão celular com 7 mL de mTeSR fresco mais médio. Não encode mais de 5 vezes.
- Placa a uma proporção de 1:8. Normalmente adicione 1 mL da suspensão da etapa 4.5 e adicione 1 mL de mTeSR mais mídia suplementada com 5-10 μM de Y-27632 (inibidor de ROCHA). A taxa de diluição de passagem depende da linha iPSC.
- Coloque a célula em uma incubadora de 5% de CO2/37 °C. No dia seguinte, remova o Y-27632 adicionando um mTeSR Plus médio fresco. Depois disso, mude a mídia a cada dois dias inicialmente, e todos os dias à medida que a célula atinge maior confluência.
5. Diferenciação das células iPS em neurônios motores
NOTA: Todas as opções abaixo (5,2, 5,3 e 5,4) produzem MNOs com > 90% de eficiência.
- Passaging iPSC para diferenciação de neurônio motor
NOTA: A diferenciação pode ser realizada com sucesso nos protocolos 3D (5.2) ou 2D (5.3).- Permita que células iPS indiferenciadas cresçam até atingir a confluência de aproximadamente 80% no mTeSR Plus médio em uma placa de 6 poços.
- Aspire completamente o meio. Lave imediatamente o poço uma vez com PBS estéril e adicione 0,5 mL de solução de dissociação celular às células.
- Incubar a placa a 37 °C na incubadora por aproximadamente 2-3 min, ou até que as células se separem e redondas, mas permaneçam presas ao poço.
- Adicione 1 mL de pipeta média e suavemente para cima e para baixo algumas vezes usando uma pipeta sorológica de 5 mL. Transfira a suspensão celular para um tubo de 15 mL consistindo de 4 mL do meio.
- Centrifugar a 200 x g por 3 min.
- Aspire cuidadosamente o supernasce, deixando a pelota intacta, e resuspense as células em 1 mL do meio suplementado com 10 μM de Y-27632.
- Conte as células usando um hemócito e prossiga para 5,2 (diferenciação 3D) ou 5,3 (diferenciação 2D).
- Formação de esferoide de neurônio motor (MNS) em diferenciação 3D ("protocolo 3D")
NOTA: Uma mudança média completa é feita diariamente a partir dos dias 0-12 de diferenciação(Figura 2).- Semente as células iPS da etapa 5.1.7 para uma placa inferior U de 96 poços a 40.000 células/poço em 100 μL de mTeSR Plus complementado com 10 μM de Y-27632.
- No dia seguinte, substitua cada poço por 100 μL do meio fresco.
- Nos dias 0 e 1: Aspire o meio de cultura e substitua por 100 μL de meio KSR (3.1.2) complementado com 10 μM SB431542 e 100 nM LDN-193189.
- Nos dias 2 e 3: Aspire o meio de cultura e substitua por 100 μL de meio KSR suplementado por 10 μM SB431542, 100 nM LDN-193189, 5 μM DAPT, 5 μM SU5402, 1 μM RA e 1 μM SAG.
- Nos dias 4 e 5: Prepare um meio misto composto por 75% de KSR médio e 25% médio N2 (3,1,3). Em seguida, aspire o meio de cultura e substitua por 100 μL de médio misto suplementado por 10 μM SB431542, 100 nM LDN-193189, 5 μM DAPT, 5 μM SU5402, 1 μM RA e 1 μM SAG.
- Nos dias 6 e 7: Prepare um meio misto composto por 50% de média KSR e 50% médio N2. Em seguida, aspirar o meio de cultura e substituí-lo por 100 μL de médio misto suplementado com 5 μM DAPT, 5 μM SU5402, 1 μM de ácido retinóico e 1 μM SAG.
- Nos dias 8 e 9: Prepare um meio misto composto por 25% de média KSR e 75% médio N2. Em seguida, aspirar o meio de cultura e substituir por 100 μL de médio misto suplementado com 5 μM DAPT, 5 μM SU5402, 1 μM RA e 1 μM SAG.
- Nos dias 10 e 11: Substitua o meio por 100 μl de N2 médio suplementado com 5 μM DAPT, 5 μM SU5402, 1 μM RA e 1 μM SAG.
- No dia 12: Proceder para transferir as MNs para o chip de cultura tecidual (Passo 6) ou substituir o meio por 100 μL do meio de Maturação (3.1.4) complementado com fator neurotrófico derivado do cérebro de 20 ng/mL (BDNF).
NOTA: O MNS pode ser transferido para o chip de cultura tecidual a partir do dia 12 até o dia 19. Os spheróides que não são transferidos devem ser mantidos cultivados em 96 placas inferiores bem U em meio de Maturação complementados com 20 ng/mL BDNF até a transferência.
- (Opção alternativa) diferenciação 2D e transição para MNS 3D ("protocolo 2D")
- Aspire a solução de revestimento a partir de uma placa pré-revestida de 12 poços.
- Sementes as células iPS do Passo 5.1.7 a uma densidade de 100.000 - 200.000 células por poço no mTeSR Plus médio com 10 μM de Y-27632.
NOTA: Continue a cultivar as células iPS indiferenciadas no meio mTeSR Plus sem Y-27632 até que as células atinjam 80% de confluência se as células forem muito escassas para o próximo passo (5.3.3). - Nos dias 0 e 1: Aspirar cultura média e substituir por 1 mL de KSR médio (3.1.2) complementado com 10 μM SB431542 e 100 nM LDN-193189.
- Nos dias 2 e 3: Aspirar o meio de cultura e substituí-lo por 1 mL de meio KSR suplementado com 10 μM SB431542, 100 nM LDN-193189, 5 μM DAPT, 5 μM SU5402, 1 μM RA e 1 μM SAG.
- Nos dias 4 e 5: Prepare um meio misto composto por 75% de KSR médio e 25% médio N2 (3,1,3). Aspirar média de cultura e substituir por 1 mL de médio misto suplementado por 10 μM SB431542, 100 nM LDN-193189, 5 μM DAPT, 5 μM SU5402, 1 μM RA e 1 μM SAG.
- Nos dias 6 e 7: Prepare um meio misto composto por 50% de média KSR e 50% médio N2. Aspire o meio de cultura e substitua-o por 1 mL de médio misto suplementado com 5 μM DAPT, 5 μM SU5402, 1 μM de ácido retinóico e 1 μM SAG.
- Nos dias 8 e 9: Prepare um meio misto composto por 25% de média KSR e 75% médio N2. Aspire o meio de cultura e substitua por 1 mL do meio misto suplementado por 5 μM DAPT, 5 μM SU5402, 1 μM RA e 1 μM SAG.
- Nos dias 10 e 11: Substitua o meio por 1 mL de N2 médio suplementado por 5 μM DAPT, 5 μM SU5402, 1 μM RA e 1 μM SAG.
- No dia 12: Aspire o meio de diferenciação, lave rapidamente bem uma vez com PBS e adicione 0,5 mL do meio de descolamento celular. Coloque a placa em uma incubadora de 37 °C por 1-3 min (por exemplo, se usar o TrypLE Express) ou 20-30 min (por exemplo, se usar Accutase).
- Usando uma pipeta P1000, colete suavemente as células e transfira as células para um tubo cônico de 15 mL com meio de Maturação fresco e centrífuga a 200 x g por 3 min. Se as células são desajeitadas, delicadamente pipeta para cima e para baixo algumas vezes. Não encoram muito, pois isso pode causar danos às células.
- Aspire o supernasal e resuspense a pelota em 1 mL de meio de Maturação (3.1.4) complementado com 20 ng/mL BDNF.
- Conte a célula usando um hemócito. Aplaque as células a 10.000-40.000 células por poço em uma placa inferior de 96 poços U em maturação média suplementada com 20 ng/ml de BDNF. A densidade inicial de semeadura deve ser otimizada dependendo da linha celular iPS e condição das células de modo que o diâmetro do esferoide seja de 800-900 μm quando introduzido no chip de cultura tecidual. Na maioria dos casos, comece em 20.000 células por poço inicialmente, e depois aumente ou diminua o número de células de acordo com o tamanho.
- Cultura por mais 3-10 dias até que as células formem um esferoide com uma borda lisa.
- (Opção alternativa): formação de MNS a partir de neurônios motores
NOTA: Os neurônios motores humanos derivados de células iPS (ver Tabela de Materiais)podem ser usados para gerar MNOs em vez de diferenciar-se das células iPS humanas.- Depois de descongelar o criovial dos neurônios motores, rapidamente resuspensar as células com 9 mL do meio dos neurônios motores. Gire a 400 x g por 5 min a temperatura ambiente.
- Aspire o supernasal e resuspense a pelota com o meio do neurônio motor.
- Siga os mesmos passos de cima (5.3.12- 5.3.13) para produzir MNSs.
6. Preparação do chip de cultura tecidual para formação organoide do nervo motor (MNO)
- Esterilize o PDMS preparado (a partir do passo 2,13) imergindo-o em 70% de etanol na placa de Petri por pelo menos 1h.
NOTA: Todas as etapas a seguir devem ser manipuladas em um gabinete de biossegurança. - Esterilize o vidro do microscópio (76 x 52 mm) imergindo-o em 70% de etanol na placa de Petri.
- Durante o processo de secagem do vidro do microscópio, coloque o dispositivo PDMS no vidro meio microscópio molhado e deixe secar completamente esperando durante a noite. Uma vez completamente seco, o dispositivo PDMS deve aderir ao vidro.
NOTA: Esta ligação não é permanente para permitir o descolamento dos dispositivos PDMS do vidro do microscópio após a cultura para coleta de tecidos. A ligação permanente pelo plasma de oxigênio pode ser usada para maximizar a adesão entre PDMS e vidro, mas proibiria a desmontagem dos chips e da coleta de tecidos. - Cubra a superfície do microcanal no dispositivo PDMS e vidro de microscópio com 30 μL de matriz de membrana de porão diluída em DMEM/F12 (1:40) fazendo uma gotícula em um lado da entrada do canal e, em seguida, aspire a solução do outro lado da entrada com uma pipeta ou bomba de sucção(Figura 3A). Não aspire muito volume de solução para evitar contaminação por bolhas.
- Em seguida, incubar o dispositivo PDMS por 1 hora em temperatura ambiente ou durante a noite a 4 °C em um recipiente secundário (por exemplo, placa de Petri).
7. Formação organoide do nervo motor (MNO)
- Substitua a solução de revestimento por 150 μL pré-aquecido de meio de maturação complementado por 20 ng/mL de BDNF pouco antes de usar.
- Em seguida, coloque o MNS da etapa 5.2.9 ou 5.3.13 na entrada do microcanal usando uma micropipette com uma ponta larga. MNS pode se estabelecer espontaneamente na parte inferior do dispositivo pela gravidade. Não aplique muita pressão ao injetar o MNS(Figura 3B).
NOTA: Se o MNS estiver preso na parede lateral de um orifício em um chip de cultura de tecido, aspire suavemente a solução de outro lado da entrada. - Encha um pequeno reservatório (por exemplo, uma tampa de tubo de 15 mL) com água estéril e coloque-o nas proximidades do chip de cultura tecidual no recipiente secundário para evitar a evaporação média. Em seguida, coloque-o em uma incubadora de 5% de CO2/37 °C.
- Para uma mudança média, aspire o meio de cultura exausto a partir do centro do reservatório médio (Figura 3C). Não aspire todo o meio e o tecido.
- Adicione suavemente o meio de maturação fresco (com BDNF). O meio deve ser trocado a cada 2-3 dias. Não seque o meio de cultura em nenhum momento durante a cultura. Os axônios crescem de um MNS para o canal e se reúnem espontaneamente em um único pacote em 2-3 semanas, o que resulta na formação de um MNO. MNO pode ser cultivado por mais de 1 mês adicional no dispositivo.
8. Análise a jusante do MNO
- Imunostaining de montagem inteira
- Leve o dispositivo ou pratos para um capô de fumaça química. Corrija o MNO adicionando aproximadamente o mesmo volume de 8% de paraformaldeído (PFA) à mídia para alcançar uma concentração final de 4% de PFA. Retire o dispositivo PDMS do vidro e incuba por 15-20 min em temperatura ambiente.
- Lave o MNO com PBS e repita a lavagem pbs 2x.
- Permeabilize o MNO com 0,2% de Triton X-100 na PBS e incubar por 5 min a temperatura ambiente.
- Lave o MNO com PBS e repita a lavagem pbs 2x. Em seguida, bloqueie o MNO com PBS contendo 1% de BSA e incubar por 1h à temperatura ambiente.
- Diluir anticorpos primários em PBS contendo 0,1% de BSA e incubar MNO com a solução primária de anticorpos durante a noite a 4 °C. Lave o MNO com PBS três vezes.
- Diluir anticorpos secundários em PBS com 0,1% de BSA e incubar MNO com a solução de anticorpos secundários por 2 h à temperatura ambiente. Em seguida, lave o MNO três vezes com PBS.
- Manche o MNO com Hoechst em PBS contendo 0,2% Triton-X e incubar por 5 min a temperatura ambiente.
- Lave o MNO três vezes com PBS. O MNO imunossundo está pronto para imagens com microscópios a laser fluorescentes ou confocal.
- Coleta de tecidos e isolamento do pacote de axônio
- Despeje 10 mL de solução HBSS em uma placa de Petri de 10 cm. Em seguida, mergulhe todo o dispositivo PDMS na solução HBSS.
- Retire cuidadosamente o PDMS do vidro do microscópio sob um estereótipo. Quando os tecidos grudam no dispositivo PDMS, aplique suavemente 1 mL de solução HBSS a partir da parte superior do orifício usando uma pipeta.
- Uma vez que o tecido saia do PDMS, aplique suavemente 1 mL de HBSS no vidro do microscópio para desconectar completamente o PDMS do vidro do microscópio.
- Para isolar um feixe de axônio de um esferoide, corte o feixe de axônio com uma faca cirúrgica ou uma pinça sob o microscópio. Corte o feixe de axônio ligeiramente longe (> 1 mm) do esferoide para evitar a contaminação das células migradas.
- Pacotes de axônios isolados e esferoides podem ser analisados por várias análises a jusante, como RT-PCR, RNA-seq e manchas ocidentais.
- O chip de cultura PDMS pode ser reutilizado. Para limpar o chip de cultura, sonicate o chip de cultura dentro de água destilada por 15 minutos. Em seguida, sonicar o chip em água destilada suplementada com 1% de detergente. Lave o chip de cultura com água destilada 5 vezes.
- Imagem de cálcio
NOTA: A atividade neuronal pode ser medida com indicador de cálcio antes e depois da coleta de tecido do chip de cultura tecidual (a partir de 8,2). O protocolo é baseado em um kit comercial específico (ver Tabela de Materiais). Alternativamente, outros kits de imagem de cálcio ou métodos equivalentes podem ser usados.- Lave o MNO com PBS (sem Ca2+ e Mg2+) por três vezes.
- Incubar o tecido com 5 μM de Fluo-4AM em meio de gravação (20 mM HEPES, 115 mM NaCl, 5,4 mM KCl, 0,8 mM MgCl2, 1,8 mM, CaCl2, 13,8 mM de glicose) para 30-60 min a 37 °C. Uma adição de 0,01-0,02 % de Pluronic F-127 pode auxiliar a absorção de Fluo-4 AM nas células.
- Em seguida, lave o tecido com PBS (sem Ca2+ e Mg2+) e substitua-o por meio de gravação.
- Adquira imagens de lapso de tempo usando microscopia fluorescente com um conjunto de filtroS GFP/Cy2. Ajuste o tempo de exposição inferior a 20 ms por quadro.
- Abra o arquivo de filme adquirido como uma sequência de imagem usando a imagem J.
- Se usar uma câmera CCD ou CMOS colorida, converta imagens RGB em imagens mono de 16 bits. Abra "Analisar | Ferramentas | Gerenciador de ROI", Desenhe a região de interesse e clique em "Adicionar". Cliqueem" Multi Measure ". A média de intensidade em vários ROI será mostrada no Resultado.
- Plote a mudança da intensidade do sinal usando o software geral de análise de dados.
- Medição da atividade neuronal por matriz multi-eletrodo
NOTA: A atividade dos neurônios motores pode ser capturada por uma matriz multi-eletrodo (MEA).- Depois de criar um MNO, transfira-o para uma matriz de membrana de porão revestida de sonda MEA. Posicione o tecido sobre eletrodos.
- Adicione 200 μL de meio de Maturação e incubar 1-2 h a 37 °C para permitir que o MNO se conecte à superfície.
- Substitua o meio por meio de gravação (8.3.2). Opcionalmente coloque malha e peso em cima de um MNO para aumentar o contrato com os eletrodos.
- Coloque a sonda MEA no estágio da cabeça da gravação. Limpe o contato entre a sonda MEA e o estágio da cabeça com 70% de etanol.
- Comece a registrar a atividade neuronal seguindo as instruções dos fabricantes do MEA.
Resultados
Os neurônios motores foram diferenciados dentro de 12-14 dias em procedimentos de diferenciação 3D(Figura 4 e Figura 5). É importante ressaltar que mais de 60% das células expressaram o marcador de neurônio motor HB9 durante a diferenciação. A imunohistoquímica revelou que aproximadamente 80% das células no MNS eram neurônios motores SMI32 positivos. HB9 e SMI32 são os marcadores de neurônio motor em estágio inicial estabelecidos15,16. A expressão de HB9 e SMI32 são os parâmetros-chave que precisam ser confirmados para garantir a identidade celular dos neurônios motores. Após a introdução de um MNS no chip de cultura, os axônios se estendem para o canal e um pacote de axônio se forma. Devido aos microcanais que servem como guias físicos, os axônios alongam-se do MNS e formam um pacote por interação axo-axonal(Figura 6A). É essencial confirmar a formação do feixe de axônio por observação microscópica para confirmar a geração de um MNO. Um MNO bem sucedido carrega um pacote de axônio maior que 50 μm e poucos axônios isolados fora do feixe no canal. O alongamento inicial dos axônios pode ser observado 24 horas após a introdução do esferoide. Nos próximos 3-4 dias, os axônios chegaram ao centro do microcanal e, em seguida, chegam à outra extremidade dentro de mais 10 dias(Figura 6A). Consequentemente, os axônios montaram e formaram um feixe reto e unidirecional em 2-3 semanas em um chip, e atividades neuronais foram observadas posteriormente.
Organoides do nervo motor podem ser coletados do chip desvinculando o PDMS do vidro do microscópio para análise biológica(Figura 6B). Pacotes de axônio e corpos celulares podem ser dissecados e isolados cortando usando uma faca cirúrgica ou pinça sob um microscópio(Figura 6B). Esses materiais biológicos, incluindo RNA e proteína, podem ser usados para ensaios bioquímicos regulares, como RT-PCR e mancha ocidental. Em feixes de Axônio de MNOs, proteínas fabricantes nucleares ou dendríticas não são detectadas em manchas ocidentais(Figura 6C).
Em combinação com um indicador de cálcio (Fluo-4 AM), a atividade neuronal pode ser capturada no chip de cultura tecidual. A atividade espontânea dos neurônios motores no esferoide e no feixe de axônio foram observadas dentro do MNO. Além disso, as atividades neurais foram observadas utilizando-se um sistema de matriz multi-eletrodo.
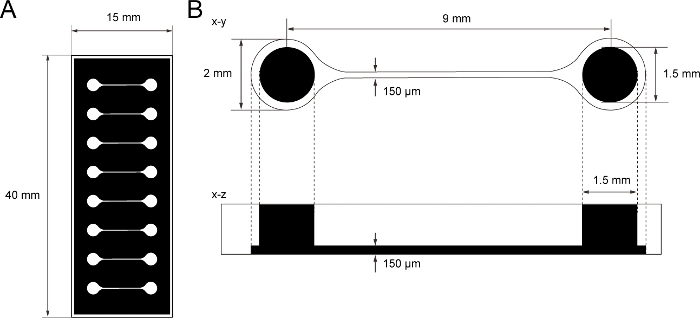
Figura 1: A dimensão do chip de cultura tecidual PDMS.
(A) Fotomask do chip de cultura tecidual. (B) Dimensões do microcanal no chip de cultura tecidual. O diâmetro da câmara base para segurar o esferoide do neurônio motor é de 2 mm e o orifício de PDMS acima da câmara é de 1,5 mm. A largura e a altura de um microcanal de duas câmaras são de 150 μm. Clique aqui para ver uma versão maior desta figura.
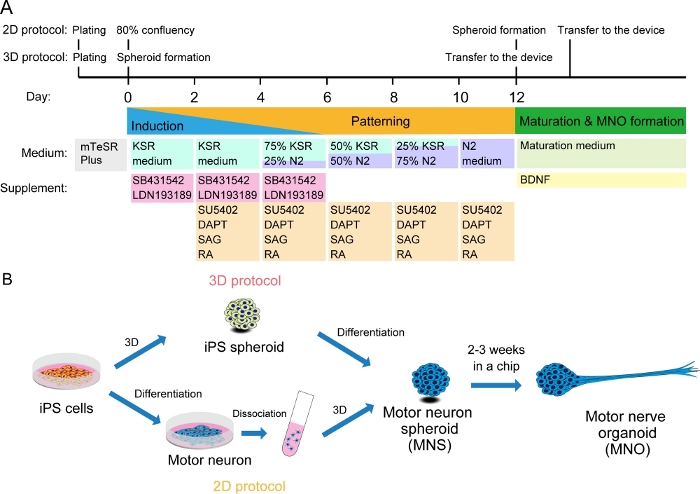
Figura 2: Ilustração esquemática da diferenciação do neurônio motor.
(A) As etapas de diferenciação envolveram indução neural, padronização na linhagem de neurônios motores e maturação de neurônios motores. (B) Duas opções para criar esferoide de neurônio motor (MNS) a partir de células iPS: protocolo 3D, e um protocolo 2D com etapa de dissociação de neurônios motores. Organoide do nervo motor (MNO) pode ser obtido por ambos os protocolos. Clique aqui para ver uma versão maior desta figura.
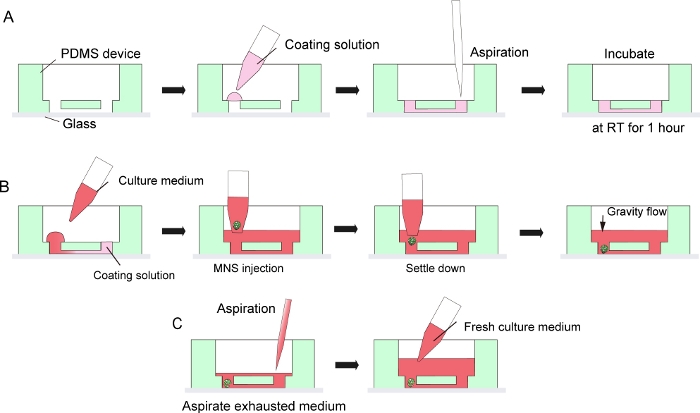
Figura 3: Protocolo passo a passo para revestimento da matriz da membrana do porão e introdução de esferoides de neurônios motores.
(A) Revestimento da matriz de membrana do porão no canal do chip de cultura tecidual. (B) Introdução MNS no orifício do chip. (C) Cultura média de mudança por aspiração de meio exausto. Clique aqui para ver uma versão maior desta figura.
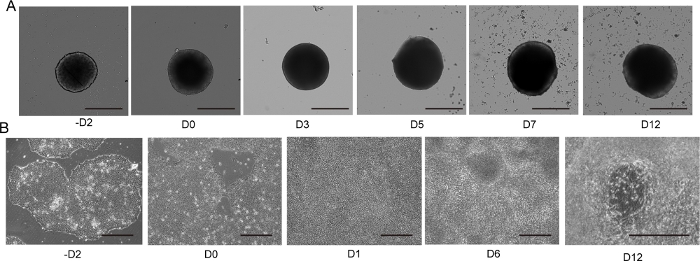
Figura 4: Diferenciação de neurônio motor 2D e 3D.
(A) Curso de tempo de diferenciação 3D MNS representativa (protocolo 3D). O tamanho do MNS aumentou gradualmente ao longo do tempo. Barra de escala: 500 μm. (B) Curso de tempo de diferenciação 2D em -D2, D0, D1, D6, D12 (protocolo 2D). Barra de escala: 500 μm. Clique aqui para ver uma versão maior desta figura.
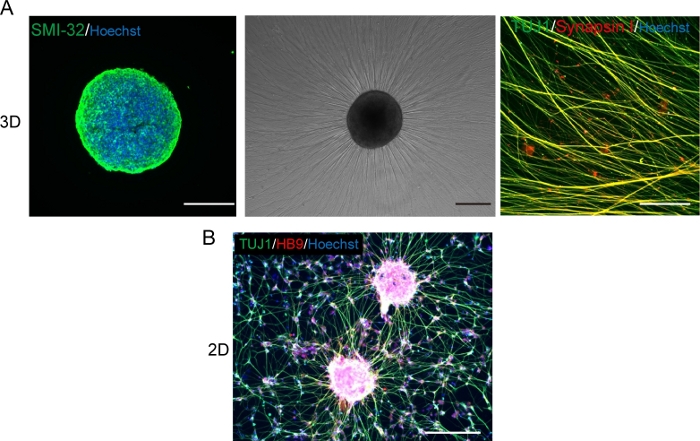
Figura 5: Caracterização dos neurônios motores.
(A) (Esquerda) Uma crioseção de um MNS manchado com anticorpo SMI-32 e DAPI. (Meio) Uma imagem de contraste de fase de MNS replalado em uma superfície revestida de matriz de membrana do porão. Observou-se alongamento axonal. (À direita) Axons de MNS repladados manchados com anticorpos Synapsin I e Tuj1. Barra de escala: 500 μm (Esquerda e Médio) e 50μm (Direita). (B) Uma imagem representativa de neurônios motores 2D imunossuou com anticorpos Tuj e HB9. Barra de escala: 200 μm. Clique aqui para ver uma versão maior desta figura.
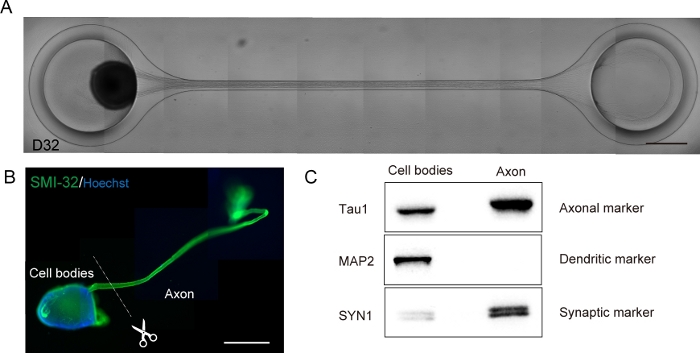
Figura 6: Caracterização de um organoide nervoso motor (MNO) gerado em um chip de cultura.
(A) Imagens representativas do alongamento do axônio e da formação de feixe de axônio espesso na D32. Barra de escala: 500 μm. (B) Imunostaining de organoide nervoso motor (MNO) por SMI-32 e DAPI. Axônios e corpos celulares podem ser isolados cortando fisicamente. Barra de escala: 1 mm. (C) Pureza da proteína de axônios e corpos celulares quantificado por mancha ocidental. MAP2, um marcador dendrático, não foi detectado em proteína axonal, enquanto o marcador axonal Tau1 é enriquecido na proteína axonal. Clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo descreve a formação de um organoide nervoso motor (MNO) que tem um feixe de axônio estendido a partir de um esferoide de neurônio motor gerado a partir de células iPS humanas. O pacote de axônio formado é espesso, flexível e bem organizado em estruturas unidirecionais. Ao dissecar o feixe de axônio, a proteína axonal de alta pureza e o RNA podem ser obtidos suficientemente para análises bioquímicas. A atividade neuronal pode ser medida em feixes de axônio e esferoides com imagem de cálcio. A contaminação de proteínas nucleares e dendríticas no liseto axonal não foi detectada pela mancha ocidental, demonstrando que nosso método separou eficientemente os axônios dos corpos celulares e dendritos.
Uma das vantagens deste protocolo é a rápida diferenciação e geração de MNO equipado com um pacote de axônio, no qual todos os processos podem ser feitos em 4 semanas com o protocolo 3D e 5-6 semanas usando o protocolo 2D. Isso é curto em comparação com outros protocolos que normalmente levam de 3 a 4 semanas para simplesmente se diferenciar em MN de células-tronco embrionárias e células iPS17 e leva mais 2-4 semanas para obter alongamento axonal. O protocolo 3D é geralmente preferido em relação ao protocolo 2D devido ao menor tempo de diferenciação, menos etapas e riscos técnicos reduzidos sem a etapa de dissociação em comparação com o protocolo 2D. O chip de cultura tecidual baseado em microfluidic foi projetado de forma que os axônios de MNS possam alongar em direção ao outro compartimento através do microcanal, o que facilita a formação de um feixe de axônios induzindo interações axo-axonanas e afinidade entre axônios. Por causa da simples configuração experimental, todos os protocolos descritos aqui podem não apenas ser realizados por bioengenheiros, que estão familiarizados com a manipulação de um chip de cultura tecidual, mas também biólogos e neurocientistas que não estão familiarizados com microfluidos e técnicas de microfabúcia. Deve-se notar que as etapas 1 e 2 também podem ser realizadas utilizando um serviço de fabricação externa.
Um dos passos críticos para a realização do protocolo é uma mudança sequencial do meio cultural. Aconselhável mudar completamente o meio de cultura a cada etapa durante a diferenciação para que fatores no meio gasto não perturbem a diferenciação de MN. Outro ponto crítico deste protocolo é manter células iPS indiferenciadas em boa qualidade. A qualidade da cultura celular iPS inicial afeta significativamente a eficiência para a obtenção de neurônios motores e MNO. Outro ponto é que o diâmetro do MNS deve ser menor do que o tamanho do orifício do chip (1,5 mm). Esferoides maiores não podem entrar na câmara, e potencialmente experimentam necrose hipóxica grave na parte central. O tamanho dos MNSs pode ser controlado alterando um número inicial de semeadura de células iPS (em protocolo 3D) ou neurônios motores (em protocolo 2D). A densidade de semeadura das células deve ser otimizada para cada linha celular iPS.
Dispositivos microfluidos compartimentados com microgrooves e pequenos filtros de poros têm sido amplamente utilizados para separar axônios de corpos celulares e dendritos. Esta técnica também pode separar axônios de corpos celulares e dendrite, com abundância superior de axônios em tecidos empacotados. Em comparação com os outros métodos, uma das principais limitações deste método é que ele não pode separar duas mídias culturais diferentes no desenho atual do chip de cultura tecidual, o que dificulta a capacidade de co-cultura de duas células diferentes que requerem duas mídias distintas. Outra limitação é que o chip PDMS colocou restrição predeterminada no tamanho do tecido. Um esferoide maior que o orifício não pode entrar na câmara, e o feixe de axônio não pode crescer mais grosso do que a largura do canal microfluido.
Este método pode ser aplicado a outros tipos de neurônios. Nosso grupo mostrou capacidade para modelar um trato cerebral usando um método modificado combinado com técnicas organoides cerebrais18. Esferoides corticais foram introduzidos em ambos os compartimentos e os axônios espontaneamente alongados reciprocamente em direção a cada esferoide, e posteriormente um feixe de axônio formado espontaneamente. Como resultado, dois esferoides cortical podem ser conectados através de um feixe de axônio, e o tecido poderia ser obtido como uma peça. Isso demonstra que a abordagem é altamente versátil para formar tecidos de feixe de axônio, independentemente dos tipos de células neuronais. Neste protocolo, foram utilizadas células iPS humanas, no entanto, outras células-tronco, incluindo células-tronco humanas e células-tronco neurais humanas, podem ser usadas com modificações no protocolo apresentado. Esferoides 3D de neurônios podem ser gerados por diversos protocolos19,20. Este método de fabricação de tecidos com um feixe de axônio pode potencialmente ser combinado no futuro com os outros protocolos de diferenciação para fazer esferoide 3D MN. Além disso, a espessura e o comprimento do feixe de axônio podem ser controlados simplesmente alterando a largura e a altura dos microcanais do chip de cultura tecidual para desenvolvimentos futuros.
Acreditamos que este protocolo pode ser usado para testes e rastreamento de drogas e pode contribuir para a compreensão dos mecanismos subjacentes ao desenvolvimento e doenças dos fascicles de axônio.
Divulgações
Em parte deste protocolo, uma patente foi licenciada para jiksak bioengenharia, Inc. que foi fundada por Jiro Kawada.
Agradecimentos
Este estudo foi apoiado pela Japan Society for the Promotion of Science (JSPS) Grants-in-Aid for Scientific Research 17H05661 e 18K19903, Core-2-core e Beyond AI institute.
Materiais
| Name | Company | Catalog Number | Comments |
| (Tridecafluoro-1,1,2,2-tetrahydrooctyl)-1-trichlorosilane | Sigma | 440302 | |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | Electron Microscopy Sciences | 15710 | |
| 200µl Wide Bore Pipet Tips | BMBio | BMT-200WRS | |
| 6-well plates | Violamo | 2-8588-01 | |
| Accutase | ICT | AT104 | |
| B-27 Supplement (50X) | Gibco | 17504044 | |
| Bovine serum albumin | Sigma | A6003 | |
| Brain-derived neurotrophic factor (BDNF) | Wako | 020-12913 | |
| CO2 incubator | Panasonic | MCO-18AIC | |
| Cryostor CS10 | Stem Cell Technologies | 07959 | |
| DAPT | Sigma | D5942 | |
| DMEM/F12 | Sigma | D8437 | |
| Fluo-4 AM | Dojindo Laboratories | CS22 | |
| GlutaMAX Supplement | Gibco | 35050-061 | |
| Growth factor reduced Matrigel (basement membrane matrix) | Corning | 354230 | |
| HB9 Antibody | Santa Cruz | sc-22542 | |
| HBSS | Wako | 085-09355 | |
| Hoechst 33342 | Sigma | 14533 | |
| iCell motor neuron (commercially available human iPS cell-derived motor neurons) | Cellular Dynamics | R1051 | |
| Isopropyl alcohol (IPA) | Wako | 166-04836 | |
| Knock Out Serum Replacement | Gibco | 10828028 | |
| LDN193189 | Sigma | SML0559 | |
| MEA probe | Alpha MED Scientific inc | MED-P5004A | |
| MEM Non-essential Amino Acid Solution (100x) (NEAA) | Sigma | M7145 | |
| Microscope Glass | Matsunami | S9111 | |
| mTeSR Plus | Stem Cell Technologies | 05825 | |
| N2 supplement | Wako | 141-08941 | |
| Neurobasal medium | Gibco | 21103049 | |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Photoresist SU-8 2100 | Microchem | #SU-8 2100 | |
| Prime surface 96U | Sumitomo Bakelite | MS-9096U | |
| ReLeSR (passaging reagent) | Stem Cell Technologies | 05872 | |
| Retinoic acid | Wako | 186-01114 | |
| SAG | Sigma | SML1314 | |
| SB431542 | Wako | 192-16541 | |
| Silicon wafer | SUMCO | PW-100-100 | |
| Silpot 184 w/c kit | Dow Toray | Silpot 184 w/c kit | |
| Smi32 Antibody | Biolegend | 801701 | |
| SU5402 | Sigma | SML0443 | |
| SU-8 Developer | Microchem | Y020100 | |
| Synapsin I Antibody | Millipore | Ab1543 | |
| TrypLE Express liquid without phenol red (dissociation solution) | Gibco | 12604-021 | |
| Tuj1 Antibody | Biolegend | 801202 | |
| Y-27632 | Wako | 030-24021 |
Referências
- Raper, J., Mason, C. Cellular strategies of axonal pathfinding. Cold Spring Harbor Perspective Biology. 2 (9), 001933(2010).
- Ito, Y., et al. RIPK1 mediates axonal degeneration by promoting inflammation and necroptosis in ALS. Science. 353 (6299), 603-608 (2016).
- Fujimori, K., et al. Modeling sporadic ALS in iPSC-derived motor neurons identifies a potential therapeutic agent. Nature Medicine. 24 (10), 1579-1589 (2018).
- Chen, H., et al. Modeling ALS with iPSCs Reveals that Mutant SOD1 Misregulates Neurofilament Balance in Motor Neurons. Cell Stem Cell. 14 (6), 796-809 (2014).
- Osaki, T., Uzel, S. G. M., Kamm, R. D. Microphysiological 3D model of amyotrophic lateral sclerosis (ALS) from human iPS-derived muscle cells and optogenetic motor neurons. Science Advances. 4 (10), (2018).
- Imamura, K., et al. The Src/c-Abl pathway is a potential therapeutic target in amyotrophic lateral sclerosis. Science Translational Medicine. 9 (391), (2017).
- Wang, L., Marquardt, T. What axons tell each other: axon-axon signaling in nerve and circuit assembly. Current Opinion in Neurobiology. 23 (6), 974-982 (2013).
- Kawada, J., et al. Generation of a Motor Nerve Organoid with Human Stem Cell-Derived Neurons. Stem Cell Reports. 9 (5), 1441-1449 (2017).
- Nagendran, T., Poole, V., Harris, J., Taylor, A. M. Use of Pre-Assembled Plastic Microfluidic Chips for Compartmentalizing Primary Murine Neurons. JoVE. (141), e58421(2018).
- Paranjape, S. R., Nagendran, T., Poole, V., Harris, J., Taylor, A. M. Compartmentalization of Human Stem Cell-Derived Neurons within Pre-Assembled Plastic Microfluidic Chips. JoVE. (147), e59250(2019).
- Chambers, S. M., et al. Combined small-molecule inhibition accelerates developmental timing and converts human pluripotent stem cells into nociceptors. Nature Biotechnology. 30 (7), 715-720 (2012).
- Rimington, R. P., Fleming, J. W., Capel, A. J., Wheeler, P. C., Lewis, M. P. Bioengineered model of the human motor unit with physiologically functional neuromuscular junctions. bioRxiv. , (2020).
- Cullen, D. K., et al. Bundled Three-Dimensional Human Axon Tracts Derived from Brain Organoids. iScience. 21, 57-67 (2019).
- Giandomenico, S. L., et al. Cerebral organoids at the air-liquid interface generate diverse nerve tracts with functional output. Nature Neurosciences. 22 (4), 669-679 (2019).
- Egawa, N., et al. Drug screening for ALS using patient-specific induced pluripotent stem cells. Science Translational Medicine. 4 (145), (2012).
- Sances, S., et al. Modeling ALS with motor neurons derived from human induced pluripotent stem cells. Nature Neurosciences. 19 (4), 542-553 (2016).
- Qu, Q., et al. High-efficiency motor neuron differentiation from human pluripotent stem cells and the function of Islet-1. Nature Communications. 5 (1), 3449(2014).
- Kirihara, T., et al. A Human Induced Pluripotent Stem Cell-Derived Tissue Model of a Cerebral Tract Connecting Two Cortical Regions. iScience. 14, 301-311 (2019).
- Rigamonti, A., et al. Large-Scale Production of Mature Neurons from Human Pluripotent Stem Cells in a Three-Dimensional Suspension Culture System. Stem Cell Reports. 6 (6), 993-1008 (2016).
- Yan, Y., Song, L., Madinya, J., Ma, T., Li, Y. Derivation of Cortical Spheroids from Human Induced Pluripotent Stem Cells in a Suspension Bioreactor. Tissue Engineering Part A. 24 (5-6), 418-431 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados