Method Article
Generación de organoides nerviosos motores tridimensionales
En este artículo
Resumen
Este protocolo proporciona un procedimiento integral para fabricar organoide nervioso motor derivado de células iPS humanas a través del montaje espontáneo de un robusto conjunto de axones extendidos a partir de un esferoide en un chip de cultivo de tejido.
Resumen
Un fascículo de axones es uno de los principales motivos estructurales observados en el sistema nervioso. La interrupción de los fascículos de axón podría causar enfermedades del desarrollo y neurodegenerativas. Aunque se han realizado numerosos estudios de axones, nuestra comprensión de la formación y disfunción de los fascículos de axón sigue siendo limitada debido a la falta de modelos in vitro tridimensionales robustos. Aquí, describimos un protocolo paso a paso para la rápida generación de un organoide nervioso motor (MNO) a partir de células madre pluripotentes inducidas por humanos (iPS) en un chip de cultivo de tejido a base de microfluídico. En primer lugar, se describe la fabricación de chips utilizados para el método. A partir de células iPS humanas, se forma un esferoide de neuronas motoras (MNS). A continuación, el MNS diferenciado se transfiere al chip. A partir de entonces, los axones crecen espontáneamente a partir del esferoide y se ensamblan en un fascículo dentro de un microcanal equipado en el chip, que genera un tejido MNO que lleva un paquete de axones extendidos desde el esferoide. Para el análisis posterior, los MNO se pueden sacar del chip para que se fije para análisis morfológicos o se diseccione para análisis bioquímicos, así como imágenes de calcio y grabaciones de matrices multi-electrodos. Las MNO generadas con este protocolo pueden facilitar las pruebas y el cribado de fármacos y pueden contribuir a comprender los mecanismos subyacentes al desarrollo y las enfermedades de los fascículos de axón.
Introducción
Las neuronas motoras espinales (MN) extienden los axones a los músculos esqueléticos para controlar el movimiento corporal. Sus trayectorias axoales están altamente organizadas y reguladas en el proceso de desarrollo. A pesar de muchos estudios sobre la extensión del axón y la orientación1,los mecanismos para la formación de paquetes de axones organizados todavía están siendo investigados. Los axones de las neuronas motoras a menudo son dañados por enfermedades neurodegenerativas como la esclerosis lateral amiotrófica (ELA)2,pero los mecanismos fisiofisiológicos del daño en los fascículos del axón son mal entendidos. Por lo tanto, se requiere un modelo fisiológico y patológico para recapitular la formación y regresión del haz axón en el campo.
Una neurona motora derivada de células madre humanas es una plataforma prometedora para entender el desarrollo y enfermedades como la ELA3. Las células madre pluripotentes inducidas por el hombre (células iPS) se pueden utilizar para modelar enfermedades utilizando células derivadas del paciente. Hasta la fecha, se han notificado varios métodos de diferenciación de células madre pluripotentes en MN4,5,6. Sin embargo, los axones de las neuronas en el cultivo bidimensional están orientados aleatoriamente y no recapitulan el microambiente vivo dentro de los nervios en desarrollo en los que los axones se ensamblan unidireccionalmente a través de interacciones axo-axoales densas7. Para superar este problema, hemos desarrollado una técnica para generar un tejido tridimensional que se asemeja al nervio motor de las células iPS humanas8,y hemos nombrado el tejido como organoide nervioso motor (MNO). El MNO consiste en cuerpos celulares ubicados en un esferoide de neuronas motoras (MNS) y un fascículo axonal extendido desde el esferoide. Los axones en la fascículo están orientados unidireccionalmente, que se asemeja a los axones en el desarrollo de nervios motores. Por lo tanto, los MNO proporcionan de forma única un microambiente axonal fisiológico, que no fue realizado por ningún otro método de cultivo neuronal previamente desarrollado.
En este protocolo, describimos métodos para la fabricación de chips de cultivo de tejidos, la diferenciación rápida de las neuronas motoras y la formación de organoides nerviosos motores en chips desarrollados. Nuestro chip de cultivo de tejidos es muy simple, y sólo contiene un compartimento para aceptar un esferoide, un microcanal para formar un paquete de axones y un compartimento para albergar terminales de axón. El dispositivo no contiene estructuras complejas incluyendo microgrooves o filtros de micropore que se utilizan a menudo para separar axones y cuerpos celulares por tamaño9,10. Por lo tanto, nuestros dispositivos se pueden fabricar fácilmente siguiendo los pasos descritos en este protocolo si hay una configuración de fotolitografía disponible.
La rápida diferenciación de las células iPS humanas se logra con una combinación optimizada de factores de inducción y patrón (SB431542, LDN-193189, ácido retinoico (AR) y agonista suavizado (SAG)) y factores de aceleración (SU5402 y DAPT). Se ha informado que la combinación de SU5402 y DAPT acelera la diferenciación de las neuronas periféricas y las células de cresta neural11. En este protocolo, ofrecemos tres métodos diferentes para generar MNOs, para que los lectores puedan decidir sobre un método más adecuado a sus necesidades. Recomendamos realizar la diferenciación de las células iPS humanas después de formar un esferoide (el método 3D), ya que el MNS diferenciado se puede transferir directamente a un chip de cultivo de tejido. Alternativamente, las células iPS humanas se pueden diferenciar en neuronas motoras en cultivo monocapa (2D), y luego se crean en esferoides de neuronas motoras tridimensionales como informamos previamente8. Hemos actualizado el protocolo, y con el método de diferenciación tridimensional descrito en este protocolo, se puede evitar la transición de 2D a 3D y se pueden obtener MNO con un tiempo de diferenciación más corto, menos pasos y riesgos técnicos reducidos sin el paso de disociación. Las neuronas disponibles comercialmente también se pueden utilizar para generar MNS para reducir el tiempo de diferenciación.
Para generar un MNO, cultivamos un MNS en el chip de cultivo de tejidos. Los axones se alargan del esferoide y se extienden hasta el microcanal en el que los axones se reúnen y se alinean unidireccionalmente. Esto facilita la interacción axo-axonal y la formación espontánea de un tejido de haz unidireccional estrechamente montado de axones en el microcanal, que se logra de forma única mediante este protocolo, mientras que la formación espontánea de paquetes o la orientación axonal guiada por sí sola se puede lograr mediante otros protocolos12,13,14. En un experimento típico, pocas células migran de esferoides al microcanal y la mayoría de las células permanecen cerca de los esferoides. Este método permite separar espontáneamente los axones de los esferoides sin utilizar barreras físicas dependientes del tamaño (por ejemplo, microgrooves o filtros de micropobras) para separar los axones de los cuerpos celulares.
El MNO resultante puede ser sometido a varios exámenes, incluyendo análisis morfológicos, bioquímicos y físicos. El cuerpo celular y el paquete de axón extendido se pueden aislar físicamente mediante el corte y se pueden analizar por separado para experimentos posteriores, por ejemplo, ensayos bioquímicos. Los materiales biológicos, incluyendo ARN y proteínas, pueden aislarse de sólo unos pocos haces de axón para ensayos bioquímicos regulares, incluyendo RT-PCR y hinchazón occidental. Aquí, describimos un protocolo para generar organoide nervioso motor a partir de células iPS, que ofrece un modelo fisiológico y patológico atractivo para estudiar el mecanismo subyacente al desarrollo y la enfermedad de los fascículos de axón.
Protocolo
1. Fabricación de moldes SU-8 por fotolitografía
NOTA: Este procedimiento involucra productos químicos peligrosos. Utilice campana de humo y PPE en todas partes.
- Limpie la oblea de silicio (4 pulgadas de diámetro, 1 mm de espesor, pulida) con acetona y soplar con gas nitrógeno. A continuación, hornee a 180 °C durante 3 minutos para secar.
- Dispensar 3 ml de SU-8 2100 en una oblea limpiada.
- Recubre el SU-8 uniformemente en la oblea usando una capa de espín a 500 rpm durante 10 s y luego, gira secuencialmente a 1500 rpm durante 30 s con una aceleración de 300 rpm/s para obtener una capa de 150 μm de espesor de SU-8.
NOTA: Asegúrese de que la oblea de silicio esté colocada en el centro de la capa de espín y fijada correctamente por vacío. - Hornee suavemente la oblea en el plato caliente a 50 °C durante 10 minutos, a 65 °C durante 7 minutos y a 95 °C durante 45 min.
- Ajuste la fotomasa(Figura 1)al alineador de máscaras y exponga la luz UV (365 nm) durante 60 s.
NOTA: El tiempo de exposición debe optimizarse mediante una dosis adecuada de luz UV. - Después de la exposición, hornee la oblea a 65 °C durante 6 minutos, y a 95 °C durante 13 minutos en el plato caliente.
- Desarrolle la oblea durante 10-20 minutos en el desarrollador SU-8 con agitación utilizando una agitadora orbital, cambiando la solución en desarrollo una vez durante el proceso.
NOTA: Alargue el tiempo de desarrollo cuando permanezcan los restos del SU-8. - Enjuague la oblea en isopropanol y seque suavemente la oblea con gas nitrógeno.
- Mida la altura del SU-8 depositado mediante un microscopio de medición y asegúrese de que tiene aproximadamente 150 μm de espesor. Se puede almacenar indefinidamente a temperatura ambiente.
2. Fabricación de chips de cultivo de tejidos basados en microfluídicos PDMS
- Fije la oblea depositada en su-8 a un recipiente (por ejemplo, placa de Petri de plástico de 15 cm) mediante cinta lateral doble.
- Sopla el polvo de la oblea usando gas nitrógeno.
- Para silanizar, coloque la oblea su-8 depositada en una cámara de vacío junto con un recipiente pequeño (por ejemplo, plato de 35 mm). Caiga 10 μL de (tridecafluoro-1,1,2,2-tetrahidroooctyl)-1-triclorosilano en el recipiente pequeño. No aplique directamente la oblea (tridecafluoro-1,1,2,2-tetrahidroooctyl)-1-triclorosilane al SU-8.
- Cierre bien la cámara de vacío y encienda una bomba de vacío durante al menos 2 h.
- Tome una taza de plástico y vierta el elastómero de silicona (por ejemplo, Silpot 184 o equivalentemente Sylgard 184) y el agente de curado a una relación de peso de 10:1. Luego, mezcle bien usando una espátula y degas en la cámara de vacío hasta que las burbujas se retiren por completo.
- Vierta la mezcla PDMS en el recipiente con la oblea SU-8 al espesor deseado (3-4 mm) y vuelva a desgasar para eliminar burbujas.
- Hornee el PDMS en un horno a 60 °C durante al menos 3 h para curar completamente el PDMS.
- Después de enfriar, corte el PDMS curado de la oblea usando un bisturí o una cuchilla de afeitar.
- Para crear las dos cámaras del chip de cultivo tisular, perfora dos agujeros donde se encuentran los dos compartimentos mediante un punzón de biopsia de 1,5 mm de diámetro.
- Para crear un depósito mediano, prepare otra mezcla PDMS (elastómero de silicona y el agente de curado a una relación de peso de 10:1) y vierte en una nueva placa Petri de 10 cm. Ajuste el volumen de vertido a 5 mm de espesor de PDMS.
- Hornee el PDMS en un horno a 60 °C durante al menos 3 h para curar completamente el PDMS.
- Después de enfriar el PDMS, corte el PDMS curado con un bisturí para obtener un anillo rectangular.
- Ate la capa inferior con el depósito medio aplicando PDMS no seguros entre ellos y horneando las capas PDMS montadas. Esta estructura unida da como resultado el chip de cultivo de tejido PDMS.
- Limpie el chip de cultivo de tejido PDMS mediante una cinta escocesa para eliminar el polvo y las pequeñas partículas de la superficie. Los chips de cultivo de tejido PDMS se pueden almacenar a temperatura ambiente si están protegidos contra el polvo y los rayos UV.
3. Preparación de la cultura
- medio de cultivo
NOTA: Todos los medios enumerados a continuación deben filtrarse para la esterilización a menos que se indique lo contrario. Los medios preparados pueden almacenarse a 4 °C y utilizarse en el plazo de un mes.- Para preparar el medio mTeSR Plus: combine una botella de suplemento de 100 ml mTeSR Plus 5x con una botella de 400 ml de mTeSR Plus Basal Medium.
- Para preparar 100 ml de KSR medio: En 85 ml de DMEM/F12, añadir 15 ml de reemplazo sérico Knockout (KSR, 15%), 1 ml de suplemento comercial de glutamina (1%) y 1 ml de aminoácido no esencial (NEAA, 1%).
- Para preparar 100 mL de N2 medio: En 100 mL de medio Neurobasal, añadir 1 mL de N2 (100x), 1 mL de suplemento comercial de glutamina, y 1 mL de NEAA.
- Para preparar 250 ml de medio de maduración: En 250 ml de medio neurobasal, añadir 5 ml de B27 (2%), 2,5 ml de suplemento comercial de glutamina (1%), y 2,5 ml de penicilina/estreptomicina (1%).
- Resuspend los compuestos (ácido retinoico (RA), SB431542, LDN-193189, SU5402, DAPT, SAG, Y-27632) en DMSO de grado de cultivo celular a la concentración deseada. Prepare alícuotas y guárdelos a -20 °C durante un tiempo de hasta 6 meses. Se utilizan las siguientes soluciones de stock: 1 mM RA, 10 mM SB431542, 100 μM LDN-193189, 10 mM SU5402, 10 mM DAPT, 1 mM SAG, 10 mM Y-27632.
- capa
NOTA: Para evitar la polimerización de la matriz de membrana del sótano por calor, evite los ciclos repetitivos de congelación-deshielo. Manipule todos los procedimientos de recubrimiento con puntas y tubos de pipeta preenfriados si es posible. La matriz de membrana del sótano debe descongelarse durante la noche a 4 °C y alicuarse utilizando puntas y tubos de pipeta preenfriados. Las alícuotas se pueden congelar a -20 °C o -80 °C.- Descongele la alicuota congelada a 4°C sobre hielo. La alícuota debe mantenerse fría durante el procedimiento de recubrimiento. Usando una punta de pipeta preenfriada, diluya la matriz de membrana del sótano con DMEM/F12 helado a una proporción de 1:40. Matriz de membrana de sótano diluida no utilizada se puede almacenar a 4 °C durante 2-3 días dado que no se produjo polimerización.
- Agregue 1 ml de la matriz de membrana del sótano/solución DMEM-F12 para recubrir un pozo de la placa de 6 pozos.
- Incubar la placa a temperatura ambiente durante al menos una hora, o 4 °C durante la noche. Las placas recubiertas se pueden almacenar a 4 °C durante un máximo de una semana.
4. Mantenimiento de células iPS
NOTA: Las células iPS indiferenciadas se mantienen en mTeSR Plus medianas y subculturadas cuando se observa la confluencia de ≥ el 90% en una placa de 6 pozos en este protocolo. Es posible que se requieran ajustes menores para las celdas iPS cultivadas en otros medios.
- Prepare platos recubiertos de matriz de membrana del sótano como se mencionó anteriormente en el paso 3.2.
- Aspirar completamente el medio mTeSR Plus. Lave el pozo una vez con PBS y agregue 0,5 ml de reactivo de passaging (consulte Tabla de materiales). Espere unos segundos y aspire la solución.
- Incubar la placa a 37 °C en la incubadora durante 5 minutos o hasta que las células se vuelvan redondas.
NOTA: El tiempo de incubación puede variar entre diferentes líneas de celda iPS y la confluencia. Por favor, compruebe periódicamente bajo el microscopio para determinar el tiempo de disociación durante la incubación. - Añadir 1 mL de mTeSR Plus medio y toque la placa para 30-60 s para separar las colonias.
- Mezcle suavemente 1 ml de la solución de suspensión celular con 7 ml de mTeSR fresco más medio. No pipetee más de 5 veces.
- Placa a una proporción de 1:8. Por lo general, añadir 1 ml de la suspensión del paso 4.5 y añadir 1 ml de mTeSR más medios complementados con 5-10 μM de Y-27632 (inhibidor de ROCA). La relación de dilución de paso depende de la línea iPSC.
- Coloque la célula en una incubadora de CO2/37 °C al 5%. Al día siguiente, retire Y-27632 añadiendo el medio mTeSR Plus fresco. A partir de entonces, cambie de medio cada dos días inicialmente, y todos los días a medida que la célula alcanza una mayor confluencia.
5. Diferenciación de las células iPS en las neuronas motoras
NOTA: Todas las opciones siguientes (5,2, 5,3 y 5,4) producen MNO con > 90% de eficiencia.
- IPSC de passaging para diferenciación de neuronas motoras
NOTA: La diferenciación se puede llevar a cabo con éxito en protocolos 3D (5.2) o 2D (5.3).- Permitir que las células iPS indiferenciadas crezcan hasta que alcance la confluencia de aproximadamente el 80% en el medio mTeSR Plus en una placa de 6 pozos.
- Aspirar completamente el medio. Lave inmediatamente el pozo una vez con PBS estéril y agregue 0,5 ml de solución de disociación celular a las células.
- Incubar la placa a 37 °C en la incubadora durante aproximadamente 2-3 min, o hasta que las células se separen y redondeen, pero permanezcan unidas al pozo.
- Agregue 1 ml de pipeta mediana y suavemente hacia arriba y hacia abajo unas cuantas veces usando una pipeta serológica de 5 ml. Transfiera la suspensión celular a un tubo de 15 ml que consta de 4 ml del medio.
- Centrífuga a 200 x g durante 3 min.
- Aspirar cuidadosamente el sobrenadante, dejando el pellet sin perturbar, y resuspend las células en 1 ml del medio complementado con 10 μM de Y-27632.
- Cuente las células utilizando un hemociclo y proceda a 5,2 (diferenciación 3D) o 5,3 (diferenciación 2D).
- Formación de esferoide de neuronas motoras (MNS) en diferenciación 3D ("protocolo 3D")
NOTA: Un cambio medio completo se realiza diariamente a partir de los días 0-12 de diferenciación (Figura 2).- Sembrar las células iPS de paso 5.1.7 a una placa inferior de 96 pozo U a 40,000 células/pozo en 100 μL de mTeSR Plus complementado con 10 μM de Y-27632.
- Al día siguiente, reemplace cada pozo por 100 μL del medio fresco.
- Los días 0 y 1: Aspirar el medio de cultivo y sustituirlo por 100 μL de medio KSR (3.1.2) complementado con 10 μM SB431542 y 100 nM LDN-193189.
- Los días 2 y 3: Aspirar el medio de cultivo y sustituirlo por 100 μL de medio KSR complementado con 10 μM SB431542, 100 nM LDN-193189, 5 μM DAPT, 5 μM SU5402, 1 μM RA y 1 μM SAG.
- Los días 4 y 5: Preparar un medio mixto compuesto por 75% KSR medio y 25% N2 medio (3.1.3). A continuación, aspirar el medio de cultivo y sustituirlo por 100 μL de medio mixto suplementado con 10 μM SB431542, 100 nM LDN-193189, 5 μM DAPT, 5 μM SU5402, 1 μM RA y 1 μM SAG.
- Los días 6 y 7: Preparar un medio mixto compuesto por 50% medio KSR y 50% N2 medio. A continuación, aspirar el medio de cultivo y sustituirlo por 100 μL de medio mixto suplementado con 5 μM DAPT, 5 μM SU5402, 1 μM de ácido retinoico y 1 μM SAG.
- Los días 8 y 9: Preparar un medio mixto compuesto por 25% medio KSR y 75% N2 medio. A continuación, aspirar el medio de cultivo y sustituirlo por 100 μL de medio mixto suplementado con 5 μM DAPT, 5 μM SU5402, 1 μM RA y 1 μM SAG.
- Los días 10 y 11: Reemplace el medio por 100 μl de N2 medio complementado con 5 μM DAPT, 5 μM SU5402, 1 μM RA y 1 μM SAG.
- El día 12: Proceda a transferir los MN en el chip de cultivo de tejido (Paso 6) o reemplace el medio con 100 μL del medio de maduración (3.1.4) complementado con 20 ng/mL de factor neurotrófico derivado del cerebro (BDNF).
NOTA: El MNS se puede transferir al chip de cultivo de tejidos a partir del día 12 hasta el día 19. Los esferoides que no se transfieren deben mantenerse cultivados en placas inferiores de 96 pozo U en medio de maduración complementado con BDNF de 20 ng/ml hasta su transferencia.
- (opción alternativa) Diferenciación 2D y transición a MNS 3D ("protocolo 2D")
- Aspirar la solución de recubrimiento de una placa de 12 pozos pre-recubierta.
- Sembrar las células iPS del paso 5.1.7 a una densidad de 100.000 – 200.000 células por pozo en el medio mTeSR Plus con 10 μM de Y-27632.
NOTA: Continúe culturando las células iPS indiferenciadas en el medio mTeSR Plus sin Y-27632 hasta que las células alcancen el 80% de confluencia si las células son demasiado escasas para el siguiente paso (5.3.3). - Los días 0 y 1: Aspirar el medio de cultivo y sustituirlo por 1 ml de medio KSR (3.1.2) complementado con 10 μM SB431542 y 100 nM LDN-193189.
- Los días 2 y 3: Aspirar el medio de cultivo y sustituirlo por 1 ml de medio KSR complementado con 10 μM SB431542, 100 nM LDN-193189, 5 μM DAPT, 5 μM SU5402, 1 μM RA y 1 μM SAG.
- Los días 4 y 5: Preparar un medio mixto compuesto por 75% KSR medio y 25% N2 medio (3.1.3). Aspirar el medio de cultivo y sustituirlo por 1 ml de medio mixto complementado con 10 μM SB431542, 100 nM LDN-193189, 5 μM DAPT, 5 μM SU5402, 1 μM RA y 1 μM SAG.
- Los días 6 y 7: Preparar un medio mixto compuesto por 50% medio KSR y 50% N2 medio. Aspirar el medio de cultivo y reemplazarlo con 1 ml de medio mixto complementado con 5 μM DAPT, 5 μM SU5402, 1 μM de ácido retinoico y 1 μM SAG.
- Los días 8 y 9: Preparar un medio mixto compuesto por 25% medio KSR y 75% N2 medio. Aspirar el medio de cultivo y sustituirlo por 1 ml del medio mixto complementado con 5 μM DAPT, 5 μM SU5402, 1 μM RA y 1 μM SAG.
- Los días 10 y 11: Reemplace el medio por 1 ml de N2 medio complementado con 5 μM DAPT, 5 μM SU5402, 1 μM RA y 1 μM SAG.
- El día 12: Aspirar el medio de diferenciación, lavarse rápidamente bien una vez con PBS y añadir 0,5 ml del medio de desprendimiento celular. Coloque la placa en una incubadora de 37 °C durante 1-3 min (por ejemplo, si utiliza TrypLE Express) o 20-30 min (por ejemplo, si utiliza Accutase).
- Usando una pipeta P1000, recoge suavemente las células y transfiere las células a un tubo cónico de 15 ml con medio de maduración fresco y centrífuga a 200 x g durante 3 minutos. Si las células son torpes, pipetear suavemente hacia arriba y hacia abajo unas cuantas veces. No pipetee demasiado, ya que esto puede causar daños en las células.
- Aspirar el sobrenadante y resuspend el pellet en 1 ml de medio de maduración (3.1.4) complementado con 20 ng/mL BDNF.
- Cuente la celda usando un hemociclo. Platee las células a 10.000-40.000 células por pozo en una placa inferior de 96 pozos U en medio de maduración complementado con 20 ng/ml de BDNF. La densidad inicial de siembra debe optimizarse dependiendo de la línea celular iPS y la condición de las células para que el diámetro del esferoide sea de 800-900 μm cuando se introduzca en el chip de cultivo de tejido. En la mayoría de los casos, comenzar en 20.000 células por pozo inicialmente, y luego aumentar o disminuir el número de células de acuerdo con el tamaño.
- Cultivo durante 3-10 días adicionales hasta que las células forman un esferoide con un borde liso.
- (Opción alternativa): Formación de MNS a partir de neuronas motoras
NOTA: Las neuronas motoras derivadas de células iPS humanas disponibles comercialmente (ver Tabla de Materiales)se pueden utilizar para generar MNOs en lugar de diferenciarse de las células iPS humanas.- Después de descongelar el criovial de las neuronas motoras, rápidamente resuspendó las células con 9 ml del medio de las neuronas motoras. Baja a 400 x g durante 5 minutos a temperatura ambiente.
- Aspirar el sobrenadante y resuspend el pellet con el medio de la neurona motora.
- Siga los mismos pasos que los anteriores (5.3.12- 5.3.13) para producir MNSs.
6. Preparación del chip de cultivo de tejido para la formación de organoides nerviosos motores (MNO)
- Esterilizar el PDMS preparado (a partir del paso 2.13) sumergiéndolo en un 70% de etanol en la placa de Petri durante al menos 1 h.
NOTA: Todos los pasos siguientes deben manipularse en un armario de bioseguridad. - Esterilizar el vidrio del microscopio (76 x 52 mm) sumergiéndolo en un 70% de etanol en la placa Petri.
- Durante el proceso de secado del vidrio del microscopio, coloque el dispositivo PDMS en el vidrio medio húmedo del microscopio y déjelo secar completamente esperando durante la noche. Una vez que se seca por completo, el dispositivo PDMS debe adherirse al vidrio.
NOTA: Esta unión no es permanente para permitir el desprendimiento de los dispositivos PDMS del vidrio del microscopio después del cultivo para la recolección de tejidos. La unión permanente por plasma de oxígeno se puede utilizar para maximizar la adherencia entre PDMS y vidrio, pero prohibiría el desmontaje de los chips y la recolección de tejidos. - Cubra la superficie del microcanal en el dispositivo PDMS y el vidrio del microscopio con 30 μL de matriz de membrana del sótano diluido en DMEM/F12 (1:40) haciendo una gota en un lado de la entrada del canal y luego aspire la solución desde el otro lado de la entrada con una pipeta o bomba de succión (Figura 3A). No aspire demasiado volumen de solución para evitar la contaminación por burbujas.
- A continuación, incubar el dispositivo PDMS durante 1 hora a temperatura ambiente o durante la noche a 4 °C en un recipiente secundario (por ejemplo, placa Petri).
7. Formación de organoide nervioso motor (MNO)
- Reemplace la solución de recubrimiento por 150 μL pre-calentado del medio de maduración complementado con 20 ng/ml de BDNF justo antes de su uso.
- A continuación, coloque el MNS del paso 5.2.9 o 5.3.13 en la entrada del microcanal usando un micropipette con una punta de agujero ancho. El MNS puede establecerse espontáneamente en la parte inferior del dispositivo por gravedad. No aplique demasiada presión al inyectar el MNS (Figura 3B).
NOTA: Si el MNS está atascado en la pared lateral de un agujero en un chip de cultivo de tejido, a aspire suavemente la solución desde otro lado de la entrada. - Llene un pequeño depósito (por ejemplo, una tapa de tubo de 15 ml) con agua estéril y colóquelo cerca del chip de cultivo tisular en el recipiente secundario para evitar la evaporación media. Luego, colóquelo en una incubadora de CO2/37 °C al 5%.
- Para un cambio medio, aspirar el medio de cultivo agotado desde el centro del depósito medio(Figura 3C). No aspire todo el medio y el tejido.
- Agregue suavemente el medio de maduración fresco (con BDNF). El medio debe cambiarse cada 2-3 días. No seque el medio de cultivo en ningún momento durante el cultivo. Los axones crecen a partir de un MNS en el canal y se ensamblan espontáneamente en un solo paquete en 2-3 semanas, lo que resulta en la formación de un MNO. MNO se puede cultivar durante más de 1 mes adicional en el dispositivo.
8. Análisis intermedio de MNO
- Inmunostaining de montaje completo
- Lleve el dispositivo o los platos a una campana química. Fijar MNO mediante la adición de aproximadamente el mismo volumen de 8% paraformaldehído (PFA) a los medios de comunicación para lograr una concentración final de 4% PFA. Retire el dispositivo PDMS del vidrio e incuba durante 15-20 minutos a temperatura ambiente.
- Lave el MNO con PBS y luego repita el lavado PBS 2x.
- Permeabilizar el MNO con el 0,2% de Tritón X-100 en PBS e incubar durante 5 min a temperatura ambiente.
- Lave el MNO con PBS y luego repita el lavado PBS 2x. A continuación, bloquee el MNO con PBS que contenga un 1% de BSA e incuba durante 1 h a temperatura ambiente.
- Diluir anticuerpos primarios en PBS que contengan 0.1% BSA e incubar MNO con la solución principal de anticuerpos durante la noche a 4 °C. Lave el MNO con PBS tres veces.
- Diluir anticuerpos secundarios en PBS con 0,1% BSA e incubar MNO con la solución secundaria de anticuerpos durante 2 h a temperatura ambiente. A continuación, lave el MNO tres veces con PBS.
- Manchar el MNO con Hoechst en PBS que contiene 0.2% Tritón-X e incubar durante 5 minutos a temperatura ambiente.
- Lave el MNO tres veces con PBS. El MNO inmunodeprimido está listo para la toma de imágenes con microscopios láser fluorescentes o confocales.
- Recolección de tejidos y aislamiento del paquete de axones
- Vierta 10 ml de solución HBSS en una placa Petri de 10 cm. A continuación, sumerja todo el dispositivo PDMS en la solución HBSS.
- Desvincula cuidadosamente el PDMS del vidrio del microscopio bajo un estereomicroscopio. Cuando los tejidos se adhieren al dispositivo PDMS, aplique suavemente 1 ml de solución HBSS desde la parte superior del agujero mediante el uso de una pipeta.
- Una vez que el tejido sale del PDMS, aplique suavemente 1 ml de HBSS en el vidrio del microscopio para separar completamente el PDMS del vidrio del microscopio.
- Para aislar un paquete de axón de un esferoide, corta el paquete de axón con un cuchillo quirúrgico o pinza debajo del microscopio. Corte el paquete de axones ligeramente lejos (> 1 mm) del esferoide para evitar la contaminación de las células migradas.
- Los haces de axones aislados y los esferoides pueden ser analizados más a fondo mediante varios análisis posteriores como RT-PCR, ARN-seq y hinchazón occidental.
- El chip de referencia cultural PDMS se puede reutilizar. Para limpiar el chip de cultivo, sonicar el chip de cultivo dentro del agua destilada durante 15 minutos. A continuación, sonicar el chip en agua destilada complementada con 1% detergente. Lave el chip de cultivo con agua destilada 5 veces.
- Imágenes de calcio
NOTA: La actividad neuronal se puede medir con el indicador de calcio antes y después de la recolección de tejido del chip de cultivo de tejido (a partir de 8,2). El protocolo se basa en un kit comercial específico (véase tabla de materiales). Alternativamente, se pueden utilizar otros kits de imágenes de calcio o métodos equivalentes.- Lave el MNO con PBS (sin Ca2+ y Mg2+)durante tres veces.
- Incubar el tejido con 5 μM de Fluo-4AM en medio de grabación (20 mM HEPES, 115 mM NaCl, 5,4 mM KCl, 0,8 mM MgCl2,1,8 mM, CaCl2,13,8 mM de glucosa) durante 30-60 min a 37 °C. Una adición de 0.01-0.02 % de Pluronic F-127 puede ayudar a la absorción de Fluo-4 AM en las células.
- A continuación, lave el tejido con PBS (sin Ca2+ y Mg2+)y reemplácelo con el medio de grabación.
- Adquiera imágenes de lapso de tiempo mediante microscopía fluorescente con un conjunto de filtros GFP/Cy2. Establezca el tiempo de exposición inferior a 20 ms por fotograma.
- Abra el archivo de película adquirido como una secuencia de imágenes utilizando la imagen J.
- Si utiliza una cámara CCD o CMOS a color, convierta imágenes RGB en imágenes mono de 16 bits. Abrir "Analizar | Herramientas | ROI Manager", Dibuje la región de interés y haga clic en"Agregar". Haga clic en "Multi Measure". La media de intensidad en el ROI múltiple se mostrará en el resultado.
- Trace el cambio de intensidad de la señal utilizando el software de análisis de datos general.
- Medición de la actividad neuronal por matriz multielecda
NOTA: La actividad de las neuronas motoras puede ser capturada por una matriz multi-electrodos (MEA).- Después de crear un MNO, transfiéralo a una matriz de membrana del sótano recubierta de sonda MEA. Coloque el tejido en electrodos.
- Añadir 200 μL de medio de maduración e incubar 1-2 h a 37 °C para permitir que el MNO se adhieran a la superficie.
- Reemplace el medio por medio de grabación (8.3.2). Opcionalmente coloque malla y peso encima de un MNO para aumentar el contrato con los electrodos.
- Ajuste la sonda MEA a la etapa de cabezal de grabación. Limpie el contacto entre la sonda MEA y la etapa de la cabeza con un 70% de etanol.
- Comience a registrar la actividad neuronal siguiendo las instrucciones de los fabricantes del MEA.
Resultados
Las neuronas motoras se diferenciaron en un plazo de 12-14 días en procedimientos de diferenciación 3D(Figura 4 y Figura 5). Es importante destacar que más del 60% de las células expresaron marcador de neurona motorA HB9 durante la diferenciación. La inmunohistoquímica reveló que aproximadamente el 80% de las células en el MNS eran neuronas motoras SMI32 positivas. HB9 y SMI32 son los marcadores de neuronas motoras de etapa temprana establecidos15,16. La expresión de HB9 y SMI32 son los parámetros clave que deben confirmarse para garantizar la identidad celular de las neuronas motoras. Después de la introducción de un MNS en el chip de referencia cultural, los axones se extienden en el canal y se forma un paquete de axones. Debido a los microcanales que sirven como guías físicas, los axones se alargan del MNS y forman un paquete por interacción axo-axonal (Figura 6A). Es esencial confirmar la formación del paquete de axón mediante observación microscópica para confirmar la generación de un MNO. Un MNO exitoso lleva un paquete de axones de más de 50 μm y pocos axones aislados fuera del paquete en el canal. La alargamiento inicial de los axones se puede observar 24 horas después de la introducción del esferoide. En los siguientes 3-4 días, los axones llegaron al centro del microcanal y luego llegan al otro extremo dentro de 10 días adicionales(Figura 6A). En consecuencia, los axones ensamblaron y formaron un paquete recto y unidireccional en 2-3 semanas en un chip, y las actividades neuronales se observaron a partir de entonces.
Los organoides nerviosos motores se pueden recoger del chip desvinculando el PDMS del vidrio del microscopio para su análisis biológico(Figura 6B). Los haces de axón y los cuerpos celulares se pueden diseccionar y aislar cortando con un cuchillo quirúrgico o pinza bajo un microscopio(Figura 6B). Estos materiales biológicos, incluyendo ARN y proteínas, se pueden utilizar para ensayos bioquímicos regulares como RT-PCR y hinchazón occidental. En los paquetes de axones de MNO, las proteínas nucleares o dendriticas no se detectan en la hinchazón occidental (Figura 6C).
En combinación con un indicador de calcio (Fluo-4 AM), la actividad neuronal se puede capturar en el chip de cultivo de tejido. Se observó actividad espontánea de las neuronas motoras en el esferoide y el haz de axón dentro de la MNO. Además, las actividades neuronales se observaron mediante el uso de un sistema de matriz multi-electrodos.
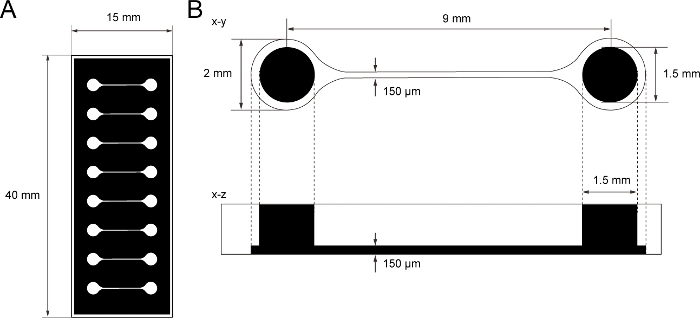
Figura 1: La dimensión del chip de cultivo de tejido PDMS.
(A) Fotomasa del chip de cultivo de tejido. (B) Dimensiones del microcanal en el chip de cultivo de tejido. El diámetro de la cámara base para sostener esferoide de neurona motora es de 2 mm y el agujero de PDMS por encima de la cámara es de 1,5 mm. La anchura y la altura de un microcanal que puentea dos cámaras son de 150 μm. Haga clic aquí para ver una versión más grande de esta figura.
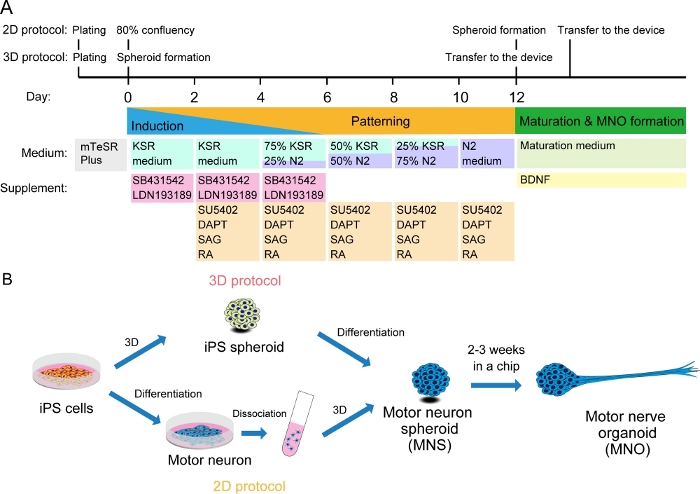
Figura 2: Ilustración esquemática de la diferenciación de las neuronas motoras.
(A) Los pasos de diferenciación implicaron inducción neuronal, patrón en linaje de neuronas motoras, y maduración de las neuronas motoras. (B) Dos opciones para crear esferoides de neuronas motoras (MNS) a partir de células iPS: protocolo 3D, y un protocolo 2D con paso de disociación de las neuronas motoras. El organoide nervioso motor (MNO) se puede obtener mediante ambos protocolos. Haga clic aquí para ver una versión más grande de esta figura.
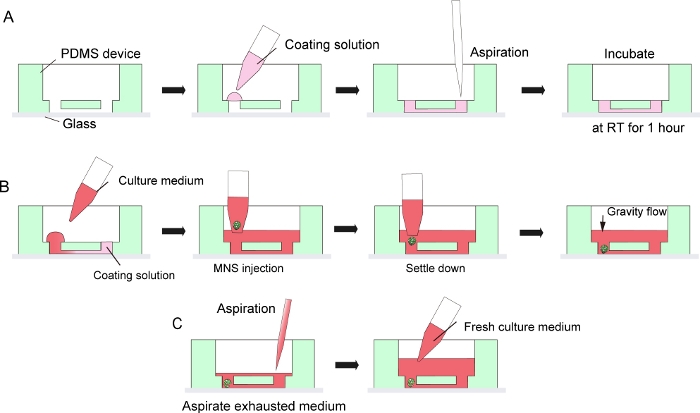
Figura 3: Protocolo paso a paso para el recubrimiento de matriz de membrana del sótano y la introducción de esferoides de neuronas motoras.
(A) Recubrimiento de matriz de membrana del sótano en el canal del chip de cultivo de tejido. (B) Introducción MNS en el agujero del chip. (C) Cultura medio cambio por aspiración de medio agotado. Haga clic aquí para ver una versión más grande de esta figura.
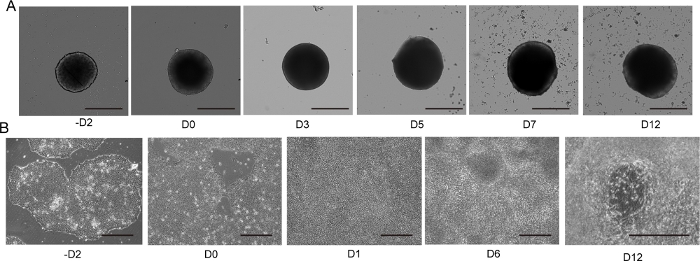
Figura 4: Diferenciación de neuronas motoras 2D y 3D.
(A) Curso de tiempo de diferenciación 3D MNS representativa (protocolo 3D). El tamaño del MNS aumentó gradualmente con el tiempo. Escala: 500 μm. (B) Curso de tiempo de diferenciación 2D en -D2, D0, D1, D6, D12 (protocolo 2D). Escala: 500 μm. Haga clic aquí para ver una versión más grande de esta figura.
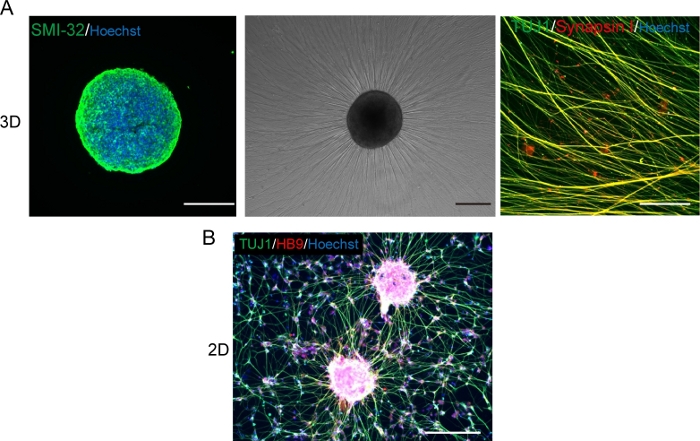
Figura 5: Caracterización de las neuronas motoras.
(A) (Izquierda) Una criosección de un MNS manchado con anticuerpos SMI-32 y DAPI. (Medio) Imagen de contraste de fase del MNS recabierto en una superficie recubierta de matriz de membrana del sótano. Se observó alargamiento axonal. (Derecha) Axones de MNS recaídos manchados con anticuerpos Synapsin I y Tuj1. Barra de escala: 500 μm (izquierda y media) y 50μm (derecha). B) Una imagen representativa de las neuronas motoras 2D inmunodeprimido con anticuerpos Tuj y HB9. Escala: 200 μm. Haga clic aquí para ver una versión más grande de esta figura.
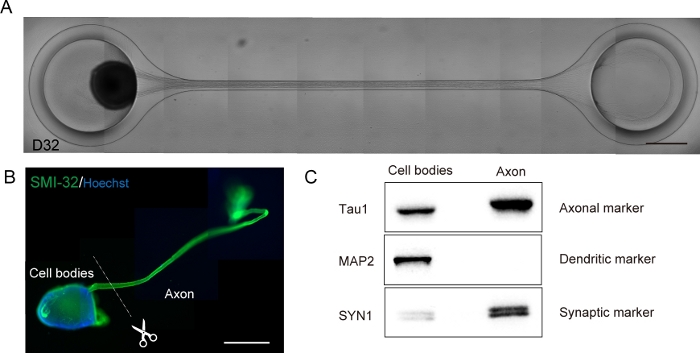
Figura 6: Caracterización de un organoide nervioso motor (MNO) generado en un chip de cultivo.
(A) Imágenes representativas de alargamiento de axón y formación gruesa de paquetes de axón en D32. Escala: 500 μm. (B) Inmunodetención del organoide nervioso motor (MNO) por SMI-32 y DAPI. Los axones y los cuerpos celulares pueden aislarse cortando físicamente. Barra de escala: 1 mm. (C) Pureza de la proteína de axones y cuerpos celulares cuantificados por la hinchazón occidental. MAP2, un marcador dendrítico, no se detectó en la proteína axonal, mientras que el marcador axonal Tau1 se enriquece en la proteína axonal. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo describe la formación de un organoide nervioso motor (MNO) que tiene un paquete de axón extendido a partir de un esferoide de neuronas motora generado a partir de células iPS humanas. El paquete axon formado es grueso, flexible y bien organizado en estructuras unidireccionales. Al diseccionar el paquete de axones, la proteína axonal de alta pureza y el ARN se pueden obtener lo suficiente para análisis bioquímicos. La actividad neuronal se puede medir en haces de axones y esferoides con imágenes de calcio. La contaminación de proteínas nucleares y dendríticas en el lisato axonal no fue detectada por la hinchazón occidental, lo que demuestra que nuestro método separó eficientemente los axones de los cuerpos celulares y los dendritas.
Una de las ventajas de este protocolo es la rápida diferenciación y generación de MNO equipado con un paquete de axones, en el que todos los procesos se pueden realizar en 4 semanas con el protocolo 3D y 5-6 semanas utilizando el protocolo 2D. Esto es corto en comparación con otros protocolos que normalmente tardan 3-4 semanas en diferenciarse simplemente en MN de células madre embrionarias y células iPS17 y toma 2-4 semanas adicionales para obtener alargamiento axonal. El protocolo 3D es generalmente preferido durante el protocolo 2D debido al menor tiempo de diferenciación, menos pasos y menores riesgos técnicos sin el paso de disociación en comparación con el protocolo 2D. El chip de cultivo de tejidos a base de microfluídico fue diseñado de una manera para que los axones de MNS puedan alargar hacia el otro compartimiento a través del microcanal, lo que facilita la formación de un haz de axones induciendo interacciones axo-axoales y afinidad entre axones. Debido a la simple configuración experimental, todos los protocolos descritos aquí no sólo pueden ser realizados por bioingenieros, que están familiarizados con la manipulación de un chip de cultivo de tejidos, sino también biólogos y neurocientíficos que no están familiarizados con microfluídicos y técnicas de microfabricación. Cabe señalar que los pasos 1 y 2 también se pueden realizar mediante un servicio de fabricación externo.
Uno de los pasos críticos para lograr el protocolo es un cambio secuencial del medio de referencia cultural. Se aconseja cambiar por completo el medio de cultivo en cada paso durante la diferenciación para que los factores en el medio gastado no perturben la diferenciación MN. Otro punto crítico de este protocolo es mantener las células iPS indiferenciadas en buena calidad. La calidad del cultivo celular iPS inicial afecta significativamente la eficiencia para obtener neuronas motoras y MNO. Otro punto es que el diámetro de MNS debe ser menor que el tamaño del agujero del chip (1,5 mm). Los esferoides más grandes no pueden entrar en la cámara, y potencialmente experimentan necrosis hipoxica grave en la parte central. El tamaño de los MNS se puede controlar cambiando un número inicial de semillas de células iPS (en protocolo 3D) o neuronas motoras (en protocolo 2D). La densidad de siembra de las celdas debe optimizarse para cada línea de celda iPS.
Los dispositivos microfluídicos compartimentados con microgrooves y filtros de poros pequeños se han utilizado ampliamente para separar axones de cuerpos celulares y dendritas. Esta técnica también puede separar axones de cuerpos celulares y dendrita, con abundancia superior de axones en tejidos agrupados. En comparación con los otros métodos, una limitación importante de este método es que no puede separar dos medios de cultivo diferentes en el diseño actual del chip de cultivo de tejido, lo que dificulta la capacidad de co-cultivo de dos células diferentes que requieren dos medios distintos. Otra limitación es que el chip PDMS puso la restricción predeterminada en el tamaño del tejido. Un esferoide más grande que el agujero no puede entrar en la cámara, y el paquete axón no puede crecer más grueso que el ancho del canal microfluídico.
Este método se puede aplicar a otros tipos de neuronas. Nuestro grupo ha demostrado capacidad para modelar un tracto cerebral mediante el uso de un método modificado combinado con técnicas organoides cerebrales18. Los esferoides corticales se introdujeron en ambos compartimentos y los axones se alargaron espontáneamente recíprocamente hacia cada esferoide, y posteriormente se formó espontáneamente un haz de axón. Como resultado, dos esferoides corticales se pueden conectar a través de un paquete de axón, y el tejido se puede obtener como una sola pieza. Esto demuestra que el enfoque es altamente versátil para formar tejidos de paquete de axón independientemente de los tipos de células neuronales. En este protocolo, se utilizaron células iPS humanas, sin embargo, otras células madre incluyendo células ES humanas y células madre neuronales humanas pueden ser utilizadas con modificaciones al protocolo presentado. Esferoides 3D de neuronas pueden ser generados por diversos protocolos19,20. Este método de fabricación de tejidos con un paquete de axón se puede combinar potencialmente en el futuro con los otros protocolos de diferenciación para hacer esferoide 3D MN. Además, el espesor y la longitud del paquete de axón se pueden controlar simplemente cambiando la anchura y la altura de los microcanales del chip de cultivo de tejidos para futuros desarrollos.
Creemos que este protocolo puede utilizarse para pruebas y pruebas de detección de fármacos y puede contribuir a la comprensión de los mecanismos subyacentes al desarrollo y las enfermedades de los fascículos de axón.
Divulgaciones
En parte de este protocolo, se ha autorizado una patente a Jiksak Bioengineering, Inc., fundada por Jiro Kawada.
Agradecimientos
Este estudio fue apoyado por las Subvenciones en Ayuda para la Investigación Científica de la Sociedad japonesa para la Promoción de la Ciencia (JSPS) 17H05661 y 18K19903, el programa Core-2-core y el Instituto Beyond AI.
Materiales
| Name | Company | Catalog Number | Comments |
| (Tridecafluoro-1,1,2,2-tetrahydrooctyl)-1-trichlorosilane | Sigma | 440302 | |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | Electron Microscopy Sciences | 15710 | |
| 200µl Wide Bore Pipet Tips | BMBio | BMT-200WRS | |
| 6-well plates | Violamo | 2-8588-01 | |
| Accutase | ICT | AT104 | |
| B-27 Supplement (50X) | Gibco | 17504044 | |
| Bovine serum albumin | Sigma | A6003 | |
| Brain-derived neurotrophic factor (BDNF) | Wako | 020-12913 | |
| CO2 incubator | Panasonic | MCO-18AIC | |
| Cryostor CS10 | Stem Cell Technologies | 07959 | |
| DAPT | Sigma | D5942 | |
| DMEM/F12 | Sigma | D8437 | |
| Fluo-4 AM | Dojindo Laboratories | CS22 | |
| GlutaMAX Supplement | Gibco | 35050-061 | |
| Growth factor reduced Matrigel (basement membrane matrix) | Corning | 354230 | |
| HB9 Antibody | Santa Cruz | sc-22542 | |
| HBSS | Wako | 085-09355 | |
| Hoechst 33342 | Sigma | 14533 | |
| iCell motor neuron (commercially available human iPS cell-derived motor neurons) | Cellular Dynamics | R1051 | |
| Isopropyl alcohol (IPA) | Wako | 166-04836 | |
| Knock Out Serum Replacement | Gibco | 10828028 | |
| LDN193189 | Sigma | SML0559 | |
| MEA probe | Alpha MED Scientific inc | MED-P5004A | |
| MEM Non-essential Amino Acid Solution (100x) (NEAA) | Sigma | M7145 | |
| Microscope Glass | Matsunami | S9111 | |
| mTeSR Plus | Stem Cell Technologies | 05825 | |
| N2 supplement | Wako | 141-08941 | |
| Neurobasal medium | Gibco | 21103049 | |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Photoresist SU-8 2100 | Microchem | #SU-8 2100 | |
| Prime surface 96U | Sumitomo Bakelite | MS-9096U | |
| ReLeSR (passaging reagent) | Stem Cell Technologies | 05872 | |
| Retinoic acid | Wako | 186-01114 | |
| SAG | Sigma | SML1314 | |
| SB431542 | Wako | 192-16541 | |
| Silicon wafer | SUMCO | PW-100-100 | |
| Silpot 184 w/c kit | Dow Toray | Silpot 184 w/c kit | |
| Smi32 Antibody | Biolegend | 801701 | |
| SU5402 | Sigma | SML0443 | |
| SU-8 Developer | Microchem | Y020100 | |
| Synapsin I Antibody | Millipore | Ab1543 | |
| TrypLE Express liquid without phenol red (dissociation solution) | Gibco | 12604-021 | |
| Tuj1 Antibody | Biolegend | 801202 | |
| Y-27632 | Wako | 030-24021 |
Referencias
- Raper, J., Mason, C. Cellular strategies of axonal pathfinding. Cold Spring Harbor Perspective Biology. 2 (9), 001933(2010).
- Ito, Y., et al. RIPK1 mediates axonal degeneration by promoting inflammation and necroptosis in ALS. Science. 353 (6299), 603-608 (2016).
- Fujimori, K., et al. Modeling sporadic ALS in iPSC-derived motor neurons identifies a potential therapeutic agent. Nature Medicine. 24 (10), 1579-1589 (2018).
- Chen, H., et al. Modeling ALS with iPSCs Reveals that Mutant SOD1 Misregulates Neurofilament Balance in Motor Neurons. Cell Stem Cell. 14 (6), 796-809 (2014).
- Osaki, T., Uzel, S. G. M., Kamm, R. D. Microphysiological 3D model of amyotrophic lateral sclerosis (ALS) from human iPS-derived muscle cells and optogenetic motor neurons. Science Advances. 4 (10), (2018).
- Imamura, K., et al. The Src/c-Abl pathway is a potential therapeutic target in amyotrophic lateral sclerosis. Science Translational Medicine. 9 (391), (2017).
- Wang, L., Marquardt, T. What axons tell each other: axon-axon signaling in nerve and circuit assembly. Current Opinion in Neurobiology. 23 (6), 974-982 (2013).
- Kawada, J., et al. Generation of a Motor Nerve Organoid with Human Stem Cell-Derived Neurons. Stem Cell Reports. 9 (5), 1441-1449 (2017).
- Nagendran, T., Poole, V., Harris, J., Taylor, A. M. Use of Pre-Assembled Plastic Microfluidic Chips for Compartmentalizing Primary Murine Neurons. JoVE. (141), e58421(2018).
- Paranjape, S. R., Nagendran, T., Poole, V., Harris, J., Taylor, A. M. Compartmentalization of Human Stem Cell-Derived Neurons within Pre-Assembled Plastic Microfluidic Chips. JoVE. (147), e59250(2019).
- Chambers, S. M., et al. Combined small-molecule inhibition accelerates developmental timing and converts human pluripotent stem cells into nociceptors. Nature Biotechnology. 30 (7), 715-720 (2012).
- Rimington, R. P., Fleming, J. W., Capel, A. J., Wheeler, P. C., Lewis, M. P. Bioengineered model of the human motor unit with physiologically functional neuromuscular junctions. bioRxiv. , (2020).
- Cullen, D. K., et al. Bundled Three-Dimensional Human Axon Tracts Derived from Brain Organoids. iScience. 21, 57-67 (2019).
- Giandomenico, S. L., et al. Cerebral organoids at the air-liquid interface generate diverse nerve tracts with functional output. Nature Neurosciences. 22 (4), 669-679 (2019).
- Egawa, N., et al. Drug screening for ALS using patient-specific induced pluripotent stem cells. Science Translational Medicine. 4 (145), (2012).
- Sances, S., et al. Modeling ALS with motor neurons derived from human induced pluripotent stem cells. Nature Neurosciences. 19 (4), 542-553 (2016).
- Qu, Q., et al. High-efficiency motor neuron differentiation from human pluripotent stem cells and the function of Islet-1. Nature Communications. 5 (1), 3449(2014).
- Kirihara, T., et al. A Human Induced Pluripotent Stem Cell-Derived Tissue Model of a Cerebral Tract Connecting Two Cortical Regions. iScience. 14, 301-311 (2019).
- Rigamonti, A., et al. Large-Scale Production of Mature Neurons from Human Pluripotent Stem Cells in a Three-Dimensional Suspension Culture System. Stem Cell Reports. 6 (6), 993-1008 (2016).
- Yan, Y., Song, L., Madinya, J., Ma, T., Li, Y. Derivation of Cortical Spheroids from Human Induced Pluripotent Stem Cells in a Suspension Bioreactor. Tissue Engineering Part A. 24 (5-6), 418-431 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados