Method Article
Génération organoïde tridimensionnelle de nerf moteur
Dans cet article
Résumé
Ce protocole fournit une procédure complète pour fabriquer l’organoïde humain de nerf moteur iPS cellule-dérivée par l’assemblage spontané d’un faisceau robuste d’axones étendus d’un sphéroïde dans une puce de culture de tissu.
Résumé
Un fascicle d’axones est l’un des principaux motifs structurels observés dans le système nerveux. La perturbation des fascicles d’axon pourrait causer des maladies développementales et neurodégénératives. Bien que de nombreuses études d’axones aient été menées, notre compréhension de la formation et du dysfonctionnement des fascicles d’axon est encore limitée en raison de l’absence de modèles in vitro tridimensionnels robustes. Ici, nous décrivons un protocole étape par étape pour la génération rapide d’un organoïde de nerf moteur (MNO) des cellules pluripotentes induites par l’homme de tige (iPS) dans une puce microfluidique de culture de tissu. Tout d’abord, la fabrication des puces utilisées pour la méthode est décrite. À partir de cellules iPS humaines, un sphéroïde de neurone moteur (MNS) est formé. Ensuite, le MNS différencié est transféré dans la puce. Par la suite, les axones se développent spontanément à partir du sphéroïde et s’assemblent en un fascicle dans un microcanal équipé de la puce, qui génère un tissu MNO transportant un faisceau d’axones étendus à partir du sphéroïde. Pour l’analyse en aval, les ONM peuvent être retirés de la puce pour être fixés pour des analyses morphologiques ou disséqués pour des analyses biochimiques, ainsi que pour l’imagerie calcique et les enregistrements de réseaux d’électrodes multiples. Les ONN générés par ce protocole peuvent faciliter le dépistage et le dépistage des drogues et contribuer à la compréhension des mécanismes sous-jacents au développement et aux maladies des fascicles d’axon.
Introduction
Les neurones moteurs rachidiens (MN) étendent les axones aux muscles squelettiques pour contrôler le mouvement du corps. Leurs trajectoires axonales sont très organisées et réglementées dans le processus de développement. En dépit de beaucoup d’études sur l’extension d’axon et laconduite 1,des mécanismes pour la formation organisée de faisceau d’axon sont toujours à l’étude. Les axones des motoneurones sont souvent endommagés par des maladies neurodégénératives telles que la sclérose latérale amyotrophique (SLA)2, mais les mécanismes pathophysiologiques des dommages sur les fascicles d’axone sont mal compris. Ainsi, un modèle physiologique et pathologique pour récapituler la formation et la régression des faisceaux d’axons est nécessaire sur le terrain.
Un neurone moteur dérivé de cellules souches humaines est une plate-forme prometteuse pour comprendre le développement et les maladies telles que laSLA 3. Les cellules souches pluripotentes induites par l’homme (cellules iPS) peuvent être utilisées pour modéliser les maladies à l’aide de cellules dérivées du patient. À ce jour, diverses méthodes de différenciation des cellules souches pluripotentes en MN ont étésignalées 4,5,6. Cependant, les axones des neurones dans la culture bidimensionnelle sont aléatoirement orientés et ne récapitulent pas le microenvironnement in vivo dans les nerfs en développement dans lesquels les axones sont unidirectionnelment assemblés par des interactions axo-axonales denses7. Pour surmonter ce problème, nous avons développé une technique pour générer un tissu tridimensionnel ressemblant au nerf moteur des cellules humaines d’iPS8,et avons nommé le tissu comme organoïde de nerf moteur (MNO). Le MNO se compose de corps cellulaires situés dans un sphéroïde de neurone moteur (MNS) et d’un fascicle axonal étendu hors du sphéroïde. Les axones du fascicle sont orientés de façon unidirectionnelle, ce qui ressemble à des axones dans le développement des nerfs moteurs. Par conséquent, les MNOs fournissent uniquement un microenvironnement axonal physiologique, qui n’a pas été fait par d’autres méthodes précédemment développées de culture neuronale.
Dans ce protocole, nous décrivons des méthodes pour la fabrication de puces de culture de tissu, la différenciation rapide de neurone moteur, et la formation organoïde de nerf moteur dans les puces développées. Notre puce de culture tissulaire est très simple, et elle ne contient qu’un compartiment pour accepter un sphéroïde, un microcanal pour former un faisceau d’axons, et un compartiment pour loger les terminaux axons. L’appareil ne contient pas de structures complexes, y compris des microgrooves ou des filtres micropore qui sont souvent utilisés pour séparer les axones et les corps cellulaires partaille 9,10. Par conséquent, nos appareils peuvent être facilement fabriqués en suivant les étapes décrites dans ce protocole si une configuration de photolithographie est disponible.
La différenciation rapide des cellules iPS humaines est obtenue grâce à une combinaison optimisée de facteurs d’induction et de modelage (SB431542, LDN-193189, acide rétinoïque (RA) et de facteurs agonistes lissés (SAG)) et d’accélération (SU5402 et DAPT). Il a été rapporté que la combinaison de SU5402 et DAPT accélère la différenciation des neurones périphériques et des cellules de crêteneurale 11. Dans ce protocole, nous offrons trois méthodes différentes pour générer des MNOs, afin que les lecteurs puissent décider d’une méthode la plus adaptée à leurs besoins. Nous recommandons d’effectuer la différenciation des cellules iPS humaines après la formation d’un sphéroïde (la méthode 3D), puisque le MNS différencié peut être transféré directement dans une puce de culture tissulaire. Alternativement, les cellules iPS humaines peuvent être différenciées en neurones moteurs dans la culture monocouche (2D), puis créées en sphéroïdes tridimensionnels de neurone moteur comme nous l’avonsprécédemment rapporté 8. Nous avons mis à jour le protocole, et avec la méthode de différenciation tridimensionnelle décrite dans ce protocole, la transition de la 2D à la 3D peut être évitée et les MNOs peuvent être obtenus avec un temps de différenciation plus court, moins d’étapes et des risques techniques réduits sans l’étape de dissociation. Les neurones disponibles dans le commerce peuvent également être utilisés pour générer du MNS afin de réduire le temps de différenciation.
Pour générer un MNO, nous avons cultivé un MNS dans la puce de culture tissulaire. Les axones s’allongent du sphéroïde et s’étendent dans le microcanal dans lequel les axones se rassemblent et s’alignent unidirectionnellement. Ceci facilite l’interaction axo-axonal et la formation spontanée d’un tissu unidirectionnel étroitement assemblé de faisceau des axones dans le microcanal, qui est particulièrement réalisé par ce protocole, alors que la formation spontanée de faisceau ou l’orientation axonale guidée seule peut être réaliséepar d’autres protocoles 12,13,14. Dans une expérience typique, peu de cellules migrent des sphéroïdes vers le microcanal et la plupart des cellules restent à proximité des sphéroïdes. Cette méthode permet aux axones d’être séparés spontanément des sphéroïdes sans utiliser de barrières physiques dépendantes de la taille (p. ex., microgrooves ou filtres à micropore) pour séparer les axones des corps cellulaires.
Le MNO qui en résulte peut faire l’objet de divers examens, y compris des analyses morphologiques, biochimiques et physiques. Le corps cellulaire et le faisceau étendu d’axons peuvent être physiquement isolés en coupant et peuvent être analysés séparément pour des expériences en aval, par exemple, des analyses biochimiques. Les matériaux biologiques, y compris l’ARN et les protéines, peuvent être isolés de quelques faisceaux d’axons pour des analyses biochimiques régulières, y compris la RT-PCR et le ballonnement occidental. Ici, nous décrivons un protocole pour générer des organoïdes de nerf moteur des cellules d’iPS, qui offre un modèle physiologique et pathologique attrayant pour étudier le mécanisme sous-jacent au développement et à la maladie des fascicles d’axon.
Protocole
1. Fabrication de moules SU-8 par photolithographie
REMARQUE : Cette procédure implique des produits chimiques dangereux. Utilisez hotte de fumée et PPE partout.
- Nettoyez la gaufrette de silicium (4 pouces de diamètre, épaisseur de 1 mm, polie) avec de l’acétone et soufflez avec du gaz azoté. Cuire ensuite à 180 °C pendant 3 min pour sécher.
- Distribuez 3 mL de SU-8 2100 sur une gaufrette nettoyée.
- Enduire le SU-8 uniformément sur la gaufrette à l’aide d’un revêtement spin à 500 tours pendant 10 s, puis, tourner séquentiellement à 1500 rpm pendant 30 s avec une accélération de 300 tours/s pour obtenir une couche de 150 μm d’épaisseur de SU-8.
REMARQUE : Assurez-vous que la plaquette de silicium est positionnée au centre du revêtement de spin et correctement fixée par vide. - Cuire doucement la gaufrette sur l’assiette chaude à 50 °C pendant 10 min, à 65 °C pendant 7 min et à 95 °C pendant 45 min.
- Réglez le photomask (Figure 1) sur le gouttière du masque et exposez la lumière UV (365 nm) pendant 60 s.
REMARQUE : Le temps d’exposition doit être optimisé par une dose appropriée de lumière UV. - Après exposition, cuire la gaufrette à 65 °C pendant 6 min et à 95 °C pendant 13 minutes dans l’assiette chaude.
- Développez la gaufrette pendant 10-20 min en développeur SU-8 avec agitation à l’aide d’un shaker orbital, en changeant la solution de développement une fois pendant le processus.
REMARQUE : Prolongez le temps de développement lorsque les débris du SU-8 restent. - Rincer la gaufrette à l’isopropanol et sécher délicatement la gaufrette avec du gaz azoté.
- Mesurez la hauteur du SU-8 déposé au microscope à mesurer et assurez-vous qu’il est d’environ 150 μm d’épaisseur. Il peut être stocké indéfiniment à température ambiante.
2. Fabrication de puces de culture tissulaire à base de microfluidique PDMS
- Fixer la gaufrette déposée su-8 dans un récipient (p. ex., boîte de Pétri en plastique de 15 cm) par du ruban latéral double.
- Faire sauter la poussière de la gaufrette à l’aide de gaz azoté.
- Pour silanize, mettez la gaufrette su-8-déposée dans une chambre à vide avec un petit récipient (par exemple, plat de 35 millimètres). Déposer 10 μL de (tridecafluoro-1,1,2,2-tétrahydrooctyl)-1-trichlorosilane dans le petit récipient. N’appliquez pas directement le (tridecafluoro-1,1,2,2-tetrahydrooctyl)-1-trichlorosilane à la gaufrette SU-8.
- Fermez fermement la chambre à vide et allumez une pompe à vide pendant au moins 2 h.
- Prenez une tasse en plastique et versez l’élastomer en silicone (p. ex., Silpot 184 ou équivalent Sylgard 184) et l’agent de séchage à un rapport de poids de 10:1. Ensuite, bien mélanger à l’aide d’une spatule et dégazer dans la chambre à vide jusqu’à ce que les bulles soient complètement enlevées.
- Verser le mélange PDMS dans le récipient avec la gaufrette SU-8 à l’épaisseur désirée (3-4 mm) et dégazer à nouveau pour enlever les bulles.
- Cuire le PDMS au four à 60 °C pendant au moins 3 h pour guérir complètement le PDMS.
- Après refroidissement, couper le PDMS durci de la gaufrette à l’aide d’un scalpel ou d’une lame de rasoir.
- Pour créer les deux chambres de la puce de culture tissulaire, percer deux trous où les deux compartiments sont situés à l’aide d’un poinçon de biopsie de 1,5 mm de diamètre.
- Pour créer un réservoir moyen, préparer un autre mélange PDMS (élastomer de silicone et agent curatif à un rapport de poids de 10:1) et le verser dans une nouvelle boîte de Pétri de 10 cm. Réglez le volume de coulée à 5 mm d’épaisseur de PDMS.
- Cuire le PDMS au four à 60 °C pendant au moins 3 h pour guérir complètement le PDMS.
- Après refroidissement du PDMS, couper le PDMS durci avec un scalpel pour obtenir un anneau rectangulaire.
- Lier la couche inférieure avec le réservoir moyen en appliquant des PDMS non durcis entre eux et en faisant cuire les couches PDMS assemblées. Cette structure collée a comme résultat la puce de culture de tissu de PDMS.
- Nettoyez la puce de culture des tissus PDMS à l’aide d’un ruban adhésif pour éliminer la poussière et les petites particules de la surface. Les puces de culture tissulaire PDMS peuvent être stockées à température ambiante si elles sont protégées de la poussière et des UV.
3. Préparation de la culture
- milieu de culture
REMARQUE : Tous les supports énumérés ci-dessous doivent être filtrés pour la stérilisation, sauf indication contraire. Les supports préparés peuvent être stockés à 4 °C et utilisés dans un délai d’un mois.- Pour préparer mTeSR Plus moyen: combiner une bouteille de 100 mL mTeSR Plus supplément 5x avec une bouteille de 400 mL de mTeSR Plus Basal Medium.
- Pour préparer 100 mL de KSR moyen: Dans 85 mL de DMEM/F12, ajouter 15 mL de remplacement de sérum Knockout (KSR, 15%), 1 mL de supplément de glutamine commerciale (1%) et 1 mL d’acides aminés non essentiels (NEAA, 1 %).
- Pour préparer 100 mL de N2 moyen: Dans 100 mL de milieu neurobasal, ajouter 1 mL de N2 (100x), 1 mL de supplément de glutamine commerciale, et 1 mL de NEAA.
- Pour préparer 250 mL de milieu de maturation : Dans 250 mL de milieu neurobasal, ajouter 5 mL de B27 (2 %), 2,5 mL de supplément commercial de glutamine (1 %) et 2,5 mL de pénicilline/streptomycine (1 %).
- Resuspendez les composés (acide rétinoïque (RA), SB431542, LDN-193189, SU5402, DAPT, SAG, Y-27632) dans le DMSO de qualité culture cellulaire à la concentration désirée. Préparer les aliquots et les conserver à -20 °C jusqu’à 6 mois. Les solutions de stock suivantes sont utilisées : 1 mM RA, 10 mM SB431542, 100 μM LDN-193189, 10 mM SU5402, 10 mM DAPT, 1 mM SAG, 10 mM Y-27632.
- revêtement
REMARQUE : Pour prévenir la polymérisation de la matrice membranaire du sous-sol par la chaleur, évitez les cycles répétitifs gel-dégel. Manipulez toutes les procédures de revêtement avec des pointes et des tubes de pipette pré-refroidis si possible. La matrice membranaire du sous-sol doit être décongelée pendant la nuit à 4 °C et aliquoted à l’aide de pointes et de tubes de pipette pré-réfrigérés. Les aliquots peuvent être congelés à -20 °C ou -80 °C.- Décongeler l’aliquot congelé à 4°C sur la glace. L’aliquot doit être maintenu au froid pendant la procédure de revêtement. À l’aide d’une pointe de pipette pré-refroidie, diluer la matrice membranaire du sous-sol avec du DMEM/F12 glacé à un rapport de 1:40. La matrice de membrane diluée inutilisée du sous-sol peut être stockée à 4 °C pendant 2 à 3 jours étant donné qu’aucune polymérisation ne s’est produite.
- Ajouter 1 mL de la matrice membranaire du sous-sol/solution DMEM-F12 pour enrober un puits de la plaque de puits 6.
- Incuber la plaque à température ambiante pendant au moins une heure, ou 4 °C pendant la nuit. Les plaques enduites peuvent être conservées à 4 °C pendant un maximum d’une semaine.
4. Entretien des cellules iPS
REMARQUE : Les cellules iPS indifférenciées sont maintenues dans mTeSR Plus moyen et sous-cultivé lorsque la confluence de ≥ 90% est observée dans une plaque de puits de 6 dans ce protocole. Des ajustements mineurs peuvent être nécessaires pour les cellules iPS cultivés dans d’autres médias.
- Préparez des plats enduits de matrice membranaire du sous-sol comme mentionné précédemment à l’étape 3.2.
- Aspirez entièrement le milieu mTeSR Plus. Lavez le puits une fois avec PBS et ajoutez 0,5 mL de reagent de passage (voir tableau des matériaux). Attendez quelques secondes et aspirez la solution.
- Incuber la plaque à 37 °C dans l’incubateur pendant 5 minutes ou jusqu’à ce que les cellules deviennent rondes.
REMARQUE : Le temps d’incubation peut varier entre les différentes lignées cellulaires iPS et la confluence. Veuillez vérifier périodiquement au microscope pour déterminer le temps de dissociation pendant l’incubation. - Ajouter 1 mL de mTeSR Plus moyen et appuyez sur la plaque pendant 30-60 s pour détacher les colonies.
- Mélanger délicatement 1 mL de la solution de suspension cellulaire avec 7 mL de mTeSR frais plus moyen. Ne pas pipette plus de 5 fois.
- Plaque à un ratio de 1:8. Ajoutez généralement 1 mL de suspension de l’étape 4.5 et ajoutez 1 mL de mTeSR plus les supports complétés par 5-10 μM de Y-27632 (inhibiteur de ROCHE). Le rapport de dilution de passage dépend de la ligne iPSC.
- Placer la cellule dans un incubateur 5% CO2/37 °C. Le lendemain, retirez Y-27632 en ajoutant du mTeSR Plus frais moyen. Par la suite, changez de média tous les deux jours au départ, et tous les jours à mesure que la cellule atteint une confluence plus élevée.
5. Différenciation des cellules iPS en neurones moteurs
REMARQUE: Toutes les options ci-dessous (5,2, 5,3 et 5,4) produisent des MNOs avec > 90% d’efficacité.
- Passer iPSC pour la différenciation des neurones moteurs
REMARQUE : La différenciation peut être effectuée avec succès dans les protocoles 3D (5.2) ou 2D (5.3).- Permettre aux cellules iPS indifférenciées de croître jusqu’à ce qu’elles atteignent une confluence d’environ 80 % dans le milieu mTeSR Plus dans une plaque de 6 puits.
- Aspirez complètement le milieu. Lavez immédiatement le puits une fois avec du PBS stérile et ajoutez 0,5 mL de solution de dissociation cellulaire aux cellules.
- Incuber la plaque à 37 °C dans l’incubateur pendant environ 2-3 minutes, ou jusqu’à ce que les cellules soient séparées et rondes, mais restent attachées au puits.
- Ajouter 1 mL de pipette moyenne et doucement de haut en bas à quelques reprises à l’aide d’une pipette sérologique de 5 mL. Transférer la suspension cellulaire dans un tube de 15 mL composé de 4 mL du milieu.
- Centrifugeuse à 200 x g pendant 3 min.
- Aspirez soigneusement le supernatant, en laissant la pastille intacte, et resuspendez les cellules dans 1 mL du milieu complété avec 10 μM de Y-27632.
- Comptez les cellules à l’aide d’un hémocytomètre et passez soit à 5,2 (différenciation 3D), soit 5,3 (différenciation 2D).
- Formation de sphéroïdes des neurones moteurs (MNS) en différenciation 3D (« protocole 3D »)
REMARQUE : Un changement moyen complet est effectué quotidiennement à partir des jours 0 à 12 de différenciation (figure 2).- Ensemencer les cellules iPS de l’étape 5.1.7 à une plaque inférieure de 96 puits U à 40.000 cellules/puits dans 100 μL de mTeSR Plus complétée par 10 μM de Y-27632.
- Le lendemain, remplacer chaque puits par 100 μL de milieu frais.
- Les jours 0 et 1 : Aspirer le milieu de culture et remplacer par 100 μL de milieu KSR (3,1,2) complété par 10 μM SB431542 et 100 nM LDN-193189.
- Les jours 2 et 3 : Aspirer le milieu de culture et remplacer par 100 μL de milieu KSR complété par 10 μM SB431542, 100 nM LDN-193189, 5 μM DAPT, 5 μM SU5402, 1 μM RA et 1 μM SAG.
- Les jours 4 et 5 : Préparer un milieu mixte composé de 75 % de KSR moyen et de 25 % de N2 moyen (3,1,3). Ensuite, aspirez le milieu de culture et remplacez-le par 100 μL de milieu mixte complété par 10 μM SB431542, 100 nM LDN-193189, 5 μM DAPT, 5 μM SU5402, 1 μM RA et 1 μM SAG.
- Les jours 6 et 7: Préparer un milieu mixte composé de 50% KSR moyen et 50% N2 moyen. Ensuite, aspirez le milieu de culture et remplacez-le par 100 μL de milieu mélangé complété par 5 μM DAPT, 5 μM SU5402, 1 acide rétinoïque μM et 1 μM SAG.
- Les jours 8 et 9: Préparer un milieu mixte composé de 25% KSR moyen et 75% N2 moyen. Ensuite, aspirer le milieu de culture et remplacer par 100 μL de milieu mixte complété par 5 μM DAPT, 5 μM SU5402, 1 μM RA et 1 μM SAG.
- Les jours 10 et 11 : Remplacer le milieu par 100 μl de N2 moyen complété par 5 μM DAPT, 5 μM SU5402, 1 μM RA et 1 μM SAG.
- Le jour 12 : Procéder au transfert des MNs dans la puce de culture tissulaire (étape 6) ou remplacer le milieu par 100 μL du milieu de maturation (3,1,4) complété par un facteur neurotrophique dérivé du cerveau de 20 ng/mL (BDNF).
REMARQUE : Le MNS peut être transféré à la puce de culture tissulaire à partir du jour 12 jusqu’au jour 19. Les sphéroïdes qui ne sont pas transférés doivent être conservés cultivés dans 96 plaques inférieures en U bien dans le milieu de maturation complétées par 20 ng/mL BDNF jusqu’au transfert.
- (Option alternative) différenciation 2D et transition vers le MNS 3D (« protocole 2D »)
- Aspirer la solution de revêtement à partir d’une plaque pré-enduite de 12 puits.
- Ensemencer les cellules iPS de l’étape 5.1.7 à une densité de 100.000 - 200.000 cellules par puits dans le milieu mTeSR Plus avec 10 μM de Y-27632.
REMARQUE : Continuer à culturer les cellules iPS indifférenciées dans le milieu mTeSR Plus sans Y-27632 jusqu’à ce que les cellules atteignent 80 % de confluence si les cellules sont trop clairsemées pour l’étape suivante (5,3,3). - Les jours 0 et 1 : Aspirer le milieu de culture et remplacer par 1 mL de milieu KSR (3,1,2) complété par 10 μM SB431542 et 100 nM LDN-193189.
- Les jours 2 et 3 : Aspirer le milieu de culture et le remplacer par 1 mL de milieu KSR complété par 10 μM SB431542, 100 nM LDN-193189, 5 μM DAPT, 5 μM SU5402, 1 μM RA et 1 μM SAG.
- Les jours 4 et 5 : Préparer un milieu mixte composé de 75 % de KSR moyen et de 25 % de N2 moyen (3,1,3). Aspirer le milieu de culture et remplacer par 1 mL de milieu mixte complété par 10 μM SB431542, 100 nM LDN-193189, 5 μM DAPT, 5 μM SU5402, 1 μM RA et 1 μM SAG.
- Les jours 6 et 7: Préparer un milieu mixte composé de 50% KSR moyen et 50% N2 moyen. Aspirer le milieu de culture et le remplacer par 1 mL de milieu mélangé complété par 5 μM DAPT, 5 μM SU5402, 1 μM d’acide rétinoïque et 1 μM SAG.
- Les jours 8 et 9: Préparer un milieu mixte composé de 25% KSR moyen et 75% N2 moyen. Aspirer le milieu de culture et remplacer par 1 mL de milieu mixte complété par 5 μM DAPT, 5 μM SU5402, 1 μM RA et 1 μM SAG.
- Les jours 10 et 11 : Remplacer le milieu par 1 mL de N2 moyen complété par 5 μM DAPT, 5 μM SU5402, 1 μM RA et 1 μM SAG.
- Le jour 12: Aspirer le milieu de différenciation, bien laver rapidement une fois avec PBS et ajouter 0,5 mL du milieu de détachement cellulaire. Placez la plaque dans un incubateur de 37 °C pendant 1 à 3 minutes (p. ex., si vous utilisez TrypLE Express) ou de 20 à 30 min (p. ex., si vous utilisez Accutase).
- À l’aide d’une pipette P1000, recueillir délicatement les cellules et transférer les cellules dans un tube conique de 15 mL avec un milieu de maturation frais et une centrifugeuse à 200 x g pendant 3 min. Si les cellules sont agglutinées, pipette doucement de haut en bas à quelques reprises. Ne pas pipette trop que cela peut causer des dommages aux cellules.
- Aspirer le supernatant et resuspendre la pastille en 1 mL de milieu de maturation (3,1,4) complétée par 20 ng/mL BDNF.
- Comptez la cellule à l’aide d’un hémocytomètre. Plaquez les cellules à 10.000-40.000 cellules par puits dans une plaque inférieure de 96 puits U dans le milieu de maturation complété avec 20 ng/ml de BDNF. La densité initiale d’ensemencement devrait être optimisée en fonction de la lignée cellulaire iPS et de l’état des cellules de sorte que le diamètre du sphéroïde soit de 800 à 900 μm lorsqu’il est introduit dans la puce de culture tissulaire. Dans la plupart des cas, commencer à 20.000 cellules par puits d’abord, puis augmenter ou diminuer le nombre de cellules en fonction de la taille.
- Culture pendant 3-10 jours supplémentaires jusqu’à ce que les cellules forment un sphéroïde avec un bord lisse.
- (Option alternative) : Formation de MNS à partir de neurones moteurs
REMARQUE : Les neurones moteurs humains dérivés des cellules iPS disponibles dans le commerce (voir tableau des matériaux)peuvent être utilisés pour générer des MNOs au lieu de se différecier des cellules iPS humaines.- Après avoir décongelé le cryovial des motoneurones, résuspendez rapidement les cellules avec 9 mL des neurones moteurs moyens. Faire tourner à 400 x g pendant 5 min à température ambiante.
- Aspirer le supernatant et réutiliser la pastille avec le milieu des neurones moteurs.
- Suivez les mêmes étapes que ci-dessus (5.3.12- 5.3.13) pour produire des MNS.
6. Préparation de la puce de culture tissulaire pour la formation d’organoïdes nerveux moteurs (MNO)
- Stériliser le PDMS préparé (à partir de l’étape 2.13) en l’immergeant dans 70% d’éthanol dans la boîte de Petri pendant au moins 1 h.
REMARQUE : Toutes les étapes suivantes doivent être manipulées dans un cabinet de biosécurité. - Stériliser le verre microscope (76 x 52 mm) en l’immergeant dans 70% d’éthanol dans la boîte de Petri.
- Pendant le séchage du verre microscope, placez le dispositif PDMS sur le verre demi-microscope humide et laissez-le sécher complètement en attendant toute la nuit. Une fois complètement séché, l’appareil PDMS doit adhérer au verre.
REMARQUE : Ce collage n’est pas permanent pour permettre le détachement des dispositifs PDMS du verre microscope après la culture pour la collecte des tissus. Le collage permanent par plasma d’oxygène peut être employé pour maximiser l’adhérence entre PDMS et verre, mais il interdirait le démontage des puces et de la collecte de tissu. - Enduire la surface du microcanal dans le dispositif PDMS et le verre microscope avec 30 μL de matrice de membrane diluée du sous-sol dans DMEM/F12 (1:40) en faisant une gouttelette d’un côté de l’entrée du canal, puis aspirer la solution de l’autre côté de l’entrée avec une pipette ou une pompe d’aspiration (Figure 3A). N’aspirez pas trop de volume de solution pour éviter la contamination par les bulles.
- Ensuite, incuber l’appareil PDMS pendant 1 heure à température ambiante ou pendant la nuit à 4 °C dans un récipient secondaire (p. ex., boîte de Pétri).
7. Formation organoïde de nerf moteur (MNO)
- Remplacer la solution de revêtement par un milieu de maturation préchauffé de 150 μL complété par 20 ng/mL de BDNF juste avant utilisation.
- Ensuite, placez le MNS de l’étape 5.2.9 ou 5.3.13 dans l’entrée du microcanal à l’aide d’une micropipette avec une pointe à alésage large. MNS peut s’installer spontanément au bas de l’appareil par gravité. N’appliquez pas trop de pression lors de l’injection du MNS( Figure 3B).
REMARQUE : Si le MNS est collé sur la paroi latérale d’un trou dans une puce de culture tissulaire, aspirez doucement la solution d’un autre côté de l’entrée. - Remplissez un petit réservoir (p. ex., un bouchon de tube de 15 mL) d’eau stérile et placez-le à proximité de la puce de culture tissulaire dans le récipient secondaire pour éviter l’évaporation moyenne. Ensuite, placez-le dans un incubateur de 5% de CO2/37°C.
- Pour un changement moyen, aspirez le milieu de culture épuisé du centre du réservoir moyen (Figure 3C). N’aspirez pas tout le milieu et le tissu.
- Ajouter délicatement le milieu de maturation frais (avec bdnf). Le support doit être changé tous les 2-3 jours. Ne séchez pas le milieu de culture à tout moment pendant la culture. Les axones poussent d’un MNS dans le canal et s’assemblent spontanément en un seul faisceau en 2-3 semaines, ce qui entraîne la formation d’un MNO. MNO peut être cultivé pendant plus d’un mois supplémentaire dans l’appareil.
8. Analyse en aval du MNO
- Immunostaining de montage entier
- Apportez l’appareil ou la vaisselle à une hotte de fumée chimique. Fixez MNO en ajoutant un volume à peu près égal de 8% de paraformaldéhyde (PFA) aux médias pour atteindre une concentration finale de 4% de PFA. Peler l’appareil PDMS du verre et incuber pendant 15-20 min à température ambiante.
- Laver le MNO avec PBS, puis répéter le lavage PBS 2x.
- Perméabilizez le MNO avec 0,2% de Triton X-100 en PBS et incubez pendant 5 min à température ambiante.
- Laver le MNO avec PBS, puis répéter le lavage PBS 2x. Ensuite, bloquer le MNO avec PBS contenant 1% BSA et incuber pendant 1 h à température ambiante.
- Diluer les anticorps primaires dans le PBS contenant 0,1 % de BSA et incuber le MNO avec la solution d’anticorps primaire pendant la nuit à 4 °C. Lavez le MNO avec PBS trois fois.
- Diluer les anticorps secondaires dans pbs avec 0,1% BSA et incuber MNO avec la solution d’anticorps secondaire pour 2 h à température ambiante. Ensuite, lavez le MNO trois fois avec PBS.
- Tacher le MNO avec Hoechst en PBS contenant 0,2% de Triton-X et incuber pendant 5 min à température ambiante.
- Lavez le MNO trois fois avec PBS. Le MNO immuno taché est prêt pour l’imagerie avec des microscopes laser fluorescents ou confocaux.
- Collecte de tissus et isolement du faisceau d’axons
- Verser 10 mL de solution HBSS dans une boîte de Pétri de 10 cm. Ensuite, plongez l’ensemble de l’appareil PDMS dans la solution HBSS.
- Détachez soigneusement le PDMS du verre microscope sous un stéréomicroscope. Lorsque les tissus collent à l’appareil PDMS, appliquez doucement 1 mL de solution HBSS du haut du trou à l’aide d’une pipette.
- Une fois que le tissu se détache du PDMS, appliquez doucement 1 mL de HBSS sur le verre microscope pour détacher complètement le PDMS du verre microscope.
- Pour isoler un faisceau d’axoès d’un sphéroïde, coupez le faisceau d’axons à l’aide d’un couteau chirurgical ou d’une pince à épiler au microscope. Couper le faisceau d’axons légèrement loin (> 1 mm) du sphéroïde pour éviter la contamination des cellules migrées.
- Les faisceaux isolés d’axons et les sphéroïdes peuvent être analysés plus en détail par diverses analyses en aval telles que rt-PCR, ARN-seq, et ballonnement occidental.
- La puce de culture PDMS peut être réutilisée. Pour nettoyer la puce de culture, sonicate la puce de culture dans l’eau distillée pendant 15 min. Puis, sonicate la puce dans de l’eau distillée complétée par 1% de détergent. Laver la puce de culture avec de l’eau distillée 5 fois.
- Imagerie calcique
REMARQUE : L’activité neuronale peut être mesurée à l’aide d’un indicateur de calcium avant et après la collecte des tissus de la puce de culture tissulaire (à partir de 8,2). Le protocole est basé sur un kit commercial spécifique (voir tableau des matériaux). Alternativement, d’autres kits d’imagerie calcium ou des méthodes équivalentes peuvent être utilisés.- Lavez le MNO avec PBS (sans Ca2+ et Mg2+) pendant trois fois.
- Incuber le tissu avec 5 μM de Fluo-4AM en milieu d’enregistrement (20 mM HEPES, 115 mM NaCl, 5,4 mM KCl, 0,8 mM MgCl2, 1,8 mM, CaCl2, 13,8 mM de glucose) pendant 30-60 min à 37 °C. Un ajout de 0,01-0,02 % de Pluronic F-127 peut aider à l’absorption de Fluo-4 AM dans les cellules.
- Ensuite, lavez le tissu avec PBS (sans Ca2+ et Mg2+) et remplacez-le par un support d’enregistrement.
- Obtenez des images en accéléré à l’aide d’une microscopie fluorescente à l’aide d’un ensemble de filtres GFP/Cy2. Réglez le temps d’exposition inférieur à 20 ms par image.
- Ouvrez le fichier de film acquis sous forme de séquence d’image à l’aide de l’image J.
- Si vous utilisez une caméra CCD ou CMOS couleur, convertissez les images RVB en images mono 16 bits. Ouvrir "Analyser | Outils | ROI Manager ", Dessiner la région d’intérêt et cliquez sur "Ajouter« . Cliquez sur "Multi Measure« . La moyenne d’intensité dans le retour sur investissement multiple sera indiquée dans le résultat.
- Tracez le changement d’intensité du signal à l’aide d’un logiciel général d’analyse des données.
- Mesure de l’activité neuronale par tableau multi-électrodes
REMARQUE : L’activité des motoneurones peut être captée par un réseau multi-électrodes (MEA).- Après la création d’un MNO, transférez-le sur une matrice membranaire du sous-sol recouverte de sonde MEA. Placez le tissu sur les électrodes.
- Ajouter 200 μL de milieu de maturation et incuber de 1 à 2 h à 37 °C pour permettre au MNO de s’attacher à la surface.
- Remplacer le support par un support d’enregistrement (8,3,2). Placez en option le maillage et le poids sur le dessus d’un MNO pour augmenter le contrat avec les électrodes.
- Réglez la sonde MEA à l’étage de tête d’enregistrement. Essuyez le contact entre la sonde MEA et le stade de tête avec 70% d’éthanol.
- Commencez à enregistrer l’activité neuronale en suivant les instructions des fabricants de l’AE.
Résultats
Les neurones moteurs ont été différenciés dans les 12 à 14 jours dans les procédures de différenciation 3D (figure 4 et figure 5). Fait important, plus de 60% des cellules ont exprimé le marqueur de neurone moteur HB9 pendant la différenciation. L’immunohistochimie a indiqué qu’approximativement 80% des cellules dans le MNS étaient des neurones moteurs SMI32-positifs. HB9 et SMI32 sont les marqueurs établis de neurones moteurs à un stadeprécoce 15,16. L’expression de HB9 et SMI32 sont les paramètres clés qui doivent être confirmés pour assurer l’identité cellulaire des neurones moteurs. Après l’introduction d’un MNS dans la puce de culture, les axones s’étendent dans le canal et un faisceau d’axons se forme. En raison de microcanaux servant de guides physiques, les axones s’allongent du MNS et forment un faisceau par interaction axo-axonale (Figure 6A). Il est essentiel de confirmer la formation du faisceau d’axons par observation microscopique pour confirmer la génération d’un MNO. Un MNO réussi porte un faisceau d’axons plus large que 50 μm et peu d’axones isolés hors du faisceau dans le canal. L’allongement initial des axones peut être observé 24 heures après l’introduction du sphéroïde. Dans les 3 à 4 jours suivants, les axones ont atteint le centre du microcanal, puis atteignent l’autre extrémité dans un délai supplémentaire de 10 jours (figure 6A). Par conséquent, les axones se sont assemblés et ont formé un faisceau droit et unidirectionnel en 2-3 semaines dans une puce, et des activités neuronales ont été observées par la suite.
Les organoïdes nerveux moteurs peuvent être prélevés sur la puce en détachant le PDMS du verre microscope pour analyse biologique (figure 6B). Les faisceaux d’axoons et les corps cellulaires peuvent être disséqués et isolés en coupant à l’aide d’un couteau chirurgical ou d’une pince à épiler au microscope (figure 6B). Ces matériaux biologiques, y compris l’ARN et les protéines, peuvent être utilisés pour des analyses biochimiques régulières telles que la RT-PCR et le ballonnement occidental. Dans les faisceaux d’axons d’ONN, les protéines nucléaires ou dendritiques ne sont pas détectées dans les ballonnements occidentaux (figure 6C).
En combinaison avec un indicateur de calcium (Fluo-4 AM), l’activité neuronale peut être capturée dans la puce de culture tissulaire. L’activité spontanée des neurones moteurs dans le sphéroïde et le faisceau d’axone ont été observées dans le MNO. En outre, les activités neuronales ont été observées à l’aide d’un système de réseau multi-électrodes.
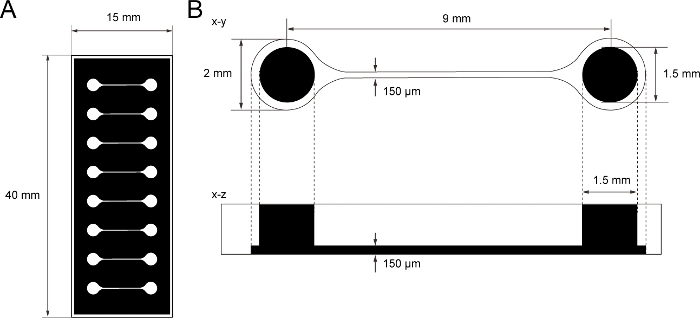
Figure 1 : La dimension de la puce de culture tissulaire PDMS.
(A) Photomask de la puce de culture tissulaire. (B) Dimensions du microcanal dans la puce de culture tissulaire. Le diamètre de la chambre de base pour tenir le sphéroïde de neurone moteur est de 2 mm et le trou de PDMS au-dessus de la chambre est de 1,5 mm. La largeur et la hauteur d’un microcanal faisant le pont entre deux chambres sont toutes deux de 150 μm. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
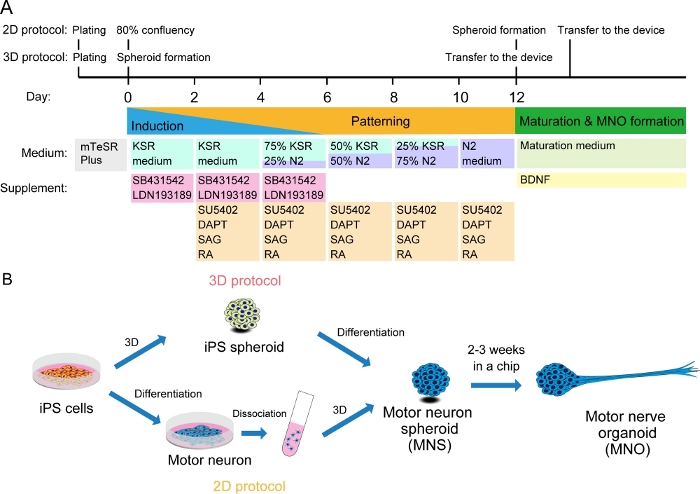
Figure 2 : Illustration schématique de la différenciation des neurones moteurs.
(A) Les étapes de différenciation ont impliqué l’induction neuronale, le modelage dans la lignée de neurone moteur, et la maturation des neurones moteurs. (B) Deux options pour créer des sphéroïdes neurones moteurs (MNS) à partir de cellules iPS: protocole 3D, et un protocole 2D avec étape de dissociation des neurones moteurs. Organoïde nerveux moteur (MNO) peut être obtenu par les deux protocoles. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
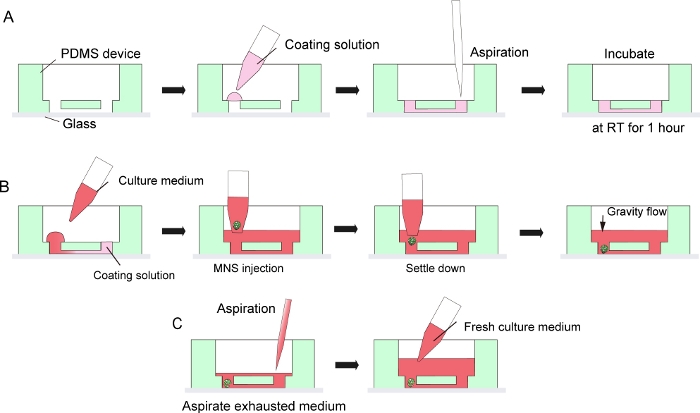
Figure 3 : Protocole étape par étape pour le revêtement matriciel membranaire du sous-sol et l’introduction sphéroïde des neurones moteurs.
(A) Revêtement matricielle membranaire du sous-sol dans le canal de la puce de culture tissulaire. (B) Introduction MNS dans le trou de la puce. (C) Changement de milieu culturel par aspiration de médium épuisé. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
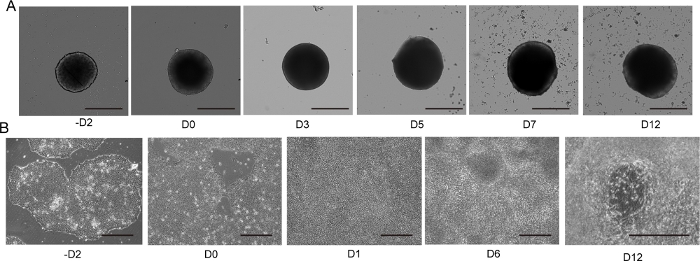
Figure 4 : Différenciation des neurones moteurs 2D et 3D.
(A) Cours du temps de différenciation représentative 3D MNS (protocole 3D). La taille du MNS a progressivement augmenté au fil du temps. Barre d’échelle : 500 μm. (B) Cours du temps de différenciation 2D sur -D2, D0, D1, D6, D12 (protocole 2D). Barre d’échelle : 500 μm. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
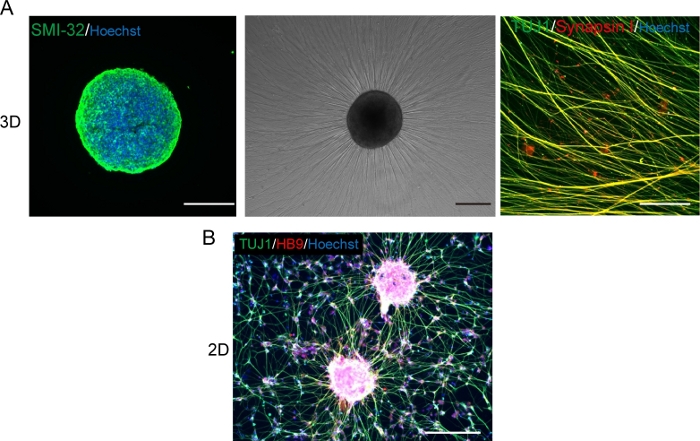
Figure 5 : Caractérisation des motoneurones.
(A) (Gauche) Une cryosection d’un MNS taché d’anticorps SMI-32 et de DAPI. (Milieu) Une image de contraste de phase de MNS replaqué sur une surface matricielle de membrane de sous-sol- enduite. L’allongement axonal a été observé. (Droite) Axones de MNS replaqué souillés avec des anticorps Synapsin I et Tuj1. Barre d’échelle : 500 μm (gauche et milieu) et 50μm (droite). (B) Une image représentative des neurones moteurs 2D immunotachés avec des anticorps Tuj et HB9. Barre d’échelle : 200 μm. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
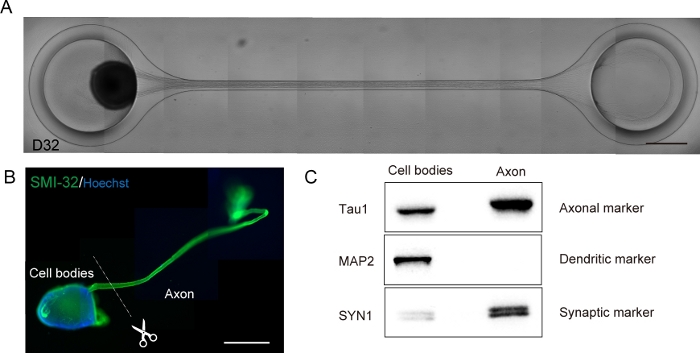
Figure 6 : Caractérisation d’un organoïde nerveux moteur (MNO) généré dans une puce de culture.
(A) Images représentatives de l’allongement de l’axon et de la formation épaisse de faisceaux d’axons sur D32. Barre d’échelle : 500 μm. (B) Immunostaining de l’organoïde de nerf moteur (MNO) par SMI-32 et DAPI. Les axones et les corps cellulaires peuvent être isolés en coupant physiquement. Barre d’échelle : 1 mm. (C) Pureté de la protéine des axones et des corps cellulaires quantifiés par ballonnement occidental. MAP2, un marqueur dendritique, n’a pas été détecté dans la protéine axonale, tandis que le marqueur axonal Tau1 est enrichi en protéine axonale. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
Ce protocole décrit la formation d’un organoïde de nerf moteur (MNO) qui a un faisceau d’axone étendu à partir d’un sphéroïde de neurone moteur généré à partir des cellules humaines d’iPS. Le faisceau d’axons formé est épais, flexible et bien organisé dans les structures unidirectionnelles. En disséquant le faisceau d’axones, la protéine axonale et l’ARN de haute pureté peuvent être obtenus suffisamment pour des analyses biochimiques. L’activité neuronale peut être mesurée en faisceaux d’axone et en sphéroïdes avec imagerie calcique. La contamination des protéines nucléaires et dendritiques dans le lysate axonal n’a pas été détectée par le ballonnement occidental, démontrant que notre méthode séparait efficacement les axones des corps cellulaires et des dendrites.
Un des avantages de ce protocole est la différenciation rapide et la génération de MNO équipé d’un faisceau d’axons, dans lequel tous les processus peuvent être effectués en 4 semaines avec le protocole 3D et 5-6 semaines en utilisant le protocole 2D. Ceci est court par rapport à d’autres protocoles qui prennent généralement 3-4 semaines pour simplement différencier en MN des cellules souches embryonnaires et des cellules iPS17 et il faut 2-4 semaines supplémentaires pour obtenir l’allongement axonal. Le protocole 3D est généralement préféré au protocole 2D en raison du temps de différenciation plus court, de la diminution des étapes et de la réduction des risques techniques sans l’étape de dissociation par rapport au protocole 2D. La puce de culture tissulaire microfluidique a été conçue de manière à ce que les axones de MNS puissent s’allonger vers l’autre compartiment par le microcanal, ce qui facilite la formation d’un faisceau d’axones en induisant des interactions axo-axonales et des affinités entre les axones. En raison de la simple mise en place expérimentale, tous les protocoles décrits ici peuvent non seulement être exécutés par des bioingénieurs, qui sont familiers avec la manipulation d’une puce de culture tissulaire, mais aussi des biologistes et des neuroscientifiques qui ne sont pas familiers avec les microfluidiques et les techniques de microfabrication. Il convient de noter que les étapes 1 et 2 peuvent également être effectuées à l’aide d’un service de fabrication externe.
Une des étapes critiques pour accomplir le protocole est un changement séquentiel de milieu culturel. Il est conseillé de changer complètement le milieu de culture à chaque étape de la différenciation afin que les facteurs dans le milieu dépensé ne perturbent pas la différenciation MN. Un autre point critique de ce protocole est de maintenir les cellules iPS indifférenciées de bonne qualité. La qualité de la culture cellulaire iPS initiale affecte considérablement l’efficacité d’obtenir des neurones moteurs et MNO. Un autre point est que le diamètre du MNS doit être plus petit que la taille du trou de la puce (1,5 mm). Les sphéroïdes plus grands ne peuvent pas entrer dans la chambre, et éprouvent potentiellement la nécrose hypoxique grave dans la partie centrale. La taille des MNS peut être contrôlée en modifiant un nombre initial d’ensemencement de cellules iPS (en protocole 3D) ou de neurones moteurs (en protocole 2D). La densité d’ensemencement des cellules doit être optimisée pour chaque lignée cellulaire iPS.
Des dispositifs microfluidiques compartimentés avec des microgrooves et de petits filtres à pores ont été largement utilisés pour séparer les axones des corps cellulaires et des dendrites. Cette technique peut également séparer les axones des corps cellulaires et le dendrite, avec une abondance supérieure d’axones dans les tissus groupés. Par rapport aux autres méthodes, une limitation majeure de cette méthode est qu’elle ne peut pas séparer deux médias culturels différents dans la conception actuelle de la puce de culture tissulaire, ce qui entrave la capacité de co-culture de deux cellules différentes qui nécessitent deux médias distincts. Une autre limitation est que la puce PDMS mis restriction prédéterminée sur la taille du tissu. Un sphéroïde plus grand que le trou ne peut pas entrer dans la chambre, et le faisceau d’axons ne peut pas devenir plus épais que la largeur du canal microfluidique.
Cette méthode peut être appliquée à d’autres types de neurones. Notre groupe a montré la capacité de modéliser un tractus cérébral en utilisant une méthode modifiée combinée avec des techniques organoïdescérébrales 18. Des sphéroïdes corticals ont été introduits dans les deux compartiments et les axones se sont spontanément allongés réciproquement vers chaque sphéroïde, et plus tard un faisceau d’axon s’est formé spontanément. En conséquence, deux sphéroïdes corticals peuvent être reliés par un faisceau d’axons, et le tissu pourrait être obtenu comme une seule pièce. Ceci démontre que l’approche est fortement polyvalente pour former des tissus de faisceau d’axone indépendamment des types neuronaux de cellules. Dans ce protocole, les cellules humaines d’iPS ont été employées, cependant, d’autres cellules souches comprenant les cellules humaines d’ES et les cellules souches neurales humaines peuvent être employées avec des modifications au protocole présenté. Les sphéroïdes 3D des neurones peuvent être générés par divers protocoles19,20. Cette méthode de fabrication de tissus avec un faisceau d’axons peut potentiellement être combinée à l’avenir avec les autres protocoles de différenciation pour la fabrication de sphéroïdes MN 3D. En outre, l’épaisseur et la longueur du faisceau d’axons peuvent être contrôlées en changeant simplement la largeur et la hauteur des microcanaux de la puce de culture tissulaire pour les développements futurs.
Nous croyons que ce protocole peut être utilisé pour le dépistage et le dépistage des drogues et peut contribuer à la compréhension des mécanismes sous-jacents au développement et aux maladies des fascicles d’axon.
Déclarations de divulgation
Dans le cadre de ce protocole, un brevet a été autorisé à Jiksak Bioengineering, Inc. qui a été fondée par Jiro Kawada.
Remerciements
Cette étude a été soutenue par la Japan Society for the Promotion of Science (JSPS) Grants-in-Aid for Scientific Research 17H05661 et 18K19903, Core-2-core program, et Beyond AI institute.
matériels
| Name | Company | Catalog Number | Comments |
| (Tridecafluoro-1,1,2,2-tetrahydrooctyl)-1-trichlorosilane | Sigma | 440302 | |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | Electron Microscopy Sciences | 15710 | |
| 200µl Wide Bore Pipet Tips | BMBio | BMT-200WRS | |
| 6-well plates | Violamo | 2-8588-01 | |
| Accutase | ICT | AT104 | |
| B-27 Supplement (50X) | Gibco | 17504044 | |
| Bovine serum albumin | Sigma | A6003 | |
| Brain-derived neurotrophic factor (BDNF) | Wako | 020-12913 | |
| CO2 incubator | Panasonic | MCO-18AIC | |
| Cryostor CS10 | Stem Cell Technologies | 07959 | |
| DAPT | Sigma | D5942 | |
| DMEM/F12 | Sigma | D8437 | |
| Fluo-4 AM | Dojindo Laboratories | CS22 | |
| GlutaMAX Supplement | Gibco | 35050-061 | |
| Growth factor reduced Matrigel (basement membrane matrix) | Corning | 354230 | |
| HB9 Antibody | Santa Cruz | sc-22542 | |
| HBSS | Wako | 085-09355 | |
| Hoechst 33342 | Sigma | 14533 | |
| iCell motor neuron (commercially available human iPS cell-derived motor neurons) | Cellular Dynamics | R1051 | |
| Isopropyl alcohol (IPA) | Wako | 166-04836 | |
| Knock Out Serum Replacement | Gibco | 10828028 | |
| LDN193189 | Sigma | SML0559 | |
| MEA probe | Alpha MED Scientific inc | MED-P5004A | |
| MEM Non-essential Amino Acid Solution (100x) (NEAA) | Sigma | M7145 | |
| Microscope Glass | Matsunami | S9111 | |
| mTeSR Plus | Stem Cell Technologies | 05825 | |
| N2 supplement | Wako | 141-08941 | |
| Neurobasal medium | Gibco | 21103049 | |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Photoresist SU-8 2100 | Microchem | #SU-8 2100 | |
| Prime surface 96U | Sumitomo Bakelite | MS-9096U | |
| ReLeSR (passaging reagent) | Stem Cell Technologies | 05872 | |
| Retinoic acid | Wako | 186-01114 | |
| SAG | Sigma | SML1314 | |
| SB431542 | Wako | 192-16541 | |
| Silicon wafer | SUMCO | PW-100-100 | |
| Silpot 184 w/c kit | Dow Toray | Silpot 184 w/c kit | |
| Smi32 Antibody | Biolegend | 801701 | |
| SU5402 | Sigma | SML0443 | |
| SU-8 Developer | Microchem | Y020100 | |
| Synapsin I Antibody | Millipore | Ab1543 | |
| TrypLE Express liquid without phenol red (dissociation solution) | Gibco | 12604-021 | |
| Tuj1 Antibody | Biolegend | 801202 | |
| Y-27632 | Wako | 030-24021 |
Références
- Raper, J., Mason, C. Cellular strategies of axonal pathfinding. Cold Spring Harbor Perspective Biology. 2 (9), 001933(2010).
- Ito, Y., et al. RIPK1 mediates axonal degeneration by promoting inflammation and necroptosis in ALS. Science. 353 (6299), 603-608 (2016).
- Fujimori, K., et al. Modeling sporadic ALS in iPSC-derived motor neurons identifies a potential therapeutic agent. Nature Medicine. 24 (10), 1579-1589 (2018).
- Chen, H., et al. Modeling ALS with iPSCs Reveals that Mutant SOD1 Misregulates Neurofilament Balance in Motor Neurons. Cell Stem Cell. 14 (6), 796-809 (2014).
- Osaki, T., Uzel, S. G. M., Kamm, R. D. Microphysiological 3D model of amyotrophic lateral sclerosis (ALS) from human iPS-derived muscle cells and optogenetic motor neurons. Science Advances. 4 (10), (2018).
- Imamura, K., et al. The Src/c-Abl pathway is a potential therapeutic target in amyotrophic lateral sclerosis. Science Translational Medicine. 9 (391), (2017).
- Wang, L., Marquardt, T. What axons tell each other: axon-axon signaling in nerve and circuit assembly. Current Opinion in Neurobiology. 23 (6), 974-982 (2013).
- Kawada, J., et al. Generation of a Motor Nerve Organoid with Human Stem Cell-Derived Neurons. Stem Cell Reports. 9 (5), 1441-1449 (2017).
- Nagendran, T., Poole, V., Harris, J., Taylor, A. M. Use of Pre-Assembled Plastic Microfluidic Chips for Compartmentalizing Primary Murine Neurons. JoVE. (141), e58421(2018).
- Paranjape, S. R., Nagendran, T., Poole, V., Harris, J., Taylor, A. M. Compartmentalization of Human Stem Cell-Derived Neurons within Pre-Assembled Plastic Microfluidic Chips. JoVE. (147), e59250(2019).
- Chambers, S. M., et al. Combined small-molecule inhibition accelerates developmental timing and converts human pluripotent stem cells into nociceptors. Nature Biotechnology. 30 (7), 715-720 (2012).
- Rimington, R. P., Fleming, J. W., Capel, A. J., Wheeler, P. C., Lewis, M. P. Bioengineered model of the human motor unit with physiologically functional neuromuscular junctions. bioRxiv. , (2020).
- Cullen, D. K., et al. Bundled Three-Dimensional Human Axon Tracts Derived from Brain Organoids. iScience. 21, 57-67 (2019).
- Giandomenico, S. L., et al. Cerebral organoids at the air-liquid interface generate diverse nerve tracts with functional output. Nature Neurosciences. 22 (4), 669-679 (2019).
- Egawa, N., et al. Drug screening for ALS using patient-specific induced pluripotent stem cells. Science Translational Medicine. 4 (145), (2012).
- Sances, S., et al. Modeling ALS with motor neurons derived from human induced pluripotent stem cells. Nature Neurosciences. 19 (4), 542-553 (2016).
- Qu, Q., et al. High-efficiency motor neuron differentiation from human pluripotent stem cells and the function of Islet-1. Nature Communications. 5 (1), 3449(2014).
- Kirihara, T., et al. A Human Induced Pluripotent Stem Cell-Derived Tissue Model of a Cerebral Tract Connecting Two Cortical Regions. iScience. 14, 301-311 (2019).
- Rigamonti, A., et al. Large-Scale Production of Mature Neurons from Human Pluripotent Stem Cells in a Three-Dimensional Suspension Culture System. Stem Cell Reports. 6 (6), 993-1008 (2016).
- Yan, Y., Song, L., Madinya, J., Ma, T., Li, Y. Derivation of Cortical Spheroids from Human Induced Pluripotent Stem Cells in a Suspension Bioreactor. Tissue Engineering Part A. 24 (5-6), 418-431 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon