A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
منهجية النهج لتحديد رواية مضادات الميكروبات وجزيئات مضادة للبيريو فيلم من مقتطفات النباتات وكسور لمنع تسوس الأسنان
* These authors contributed equally
In This Article
Summary
المنتجات الطبيعية تمثل نقاط انطلاق واعدة لتطوير الأدوية الجديدة والعوامل العلاجية. ومع ذلك، ونظراً للتنوع الكيميائي العالي، فإن العثور على مركبات علاجية جديدة من النباتات مهمة صعبة وتستغرق وقتاً طويلاً. نحن نصف نهجا مبسطا لتحديد جزيئات مضادات الميكروبات ومضادات الحيوية من مستخلصات نباتية وكسور.
Abstract
توفر المنتجات الطبيعية مواد مختلفة هيكليا، مع عدد لا يحصى من الأنشطة البيولوجية. غير أن تحديد المركبات النشطة وعزلها عن النباتات أمر صعب بسبب مصفوفة النباتات المعقدة وإجراءات العزل والتحديد التي تستغرق وقتا طويلا. ولذلك، يتم عرض نهج متدرج لفحص المركبات الطبيعية من النباتات، بما في ذلك عزل وتحديد الجزيئات التي يحتمل أن تكون نشطة. ويشمل جمع المواد النباتية؛ إعداد وتجزئة مقتطفات الخام؛ نهج الكروماتوغرافيا وقياس الطيف (UHPLC-DAD-HRMS و NMR) لتحليل وتحديد المركبات؛ bioassays (الأنشطة المضادة للميكروبات ومضادات الحيوية؛ البكتيرية "قوة التصاق" إلى pellicle اللعابية ومصفوفة جلوكان الأولية تعامل مع علاجات مختارة)؛ وتحليل البيانات. النموذج بسيط، قابل للتكرار، ويسمح بالفحص عالي الإنتاجية للمركبات المتعددة، يمكن التحكم في التركيزات، والخطوات العلاجية بشكل مستمر. وتوفر البيانات التي تم الحصول عليها الأساس للدراسات المستقبلية، بما في ذلك التركيبات ذات أنشط المقتطفات و/أو الكسور، وعزل الجزيئات، والنمذجة الجزئية لأهداف محددة في الخلايا الميكروبية والأغشية الحيوية. على سبيل المثال، أحد الأهداف للسيطرة على بيو فيلم الكاريوجيني هو تثبيط نشاط المكورات العقدية الطفرات الجلوكوزية التي تجمع الجلوكان المصفوفة خارج الخلية. تثبيط تلك الإنزيمات يمنع تراكم البيوفيلم، مما يقلل من فوعته.
Introduction
وكانت أقدم نماذج الطب المستخدمة في المجتمعات تستند إلى المنتجات الطبيعية. ومنذ ذلك الحين، يبحث البشر عن مواد كيميائية جديدة في الطبيعة يمكن تحويلها إلى أدوية1. هذا البحث تسبب في التحسين المستمر للتقنيات والأساليب للفحص الاثنوباتي1,2,3. توفر مصادر القدرة النووية مصدرًا غنيًا للمواد المتنوعة هيكليًا ، مع مجموعة واسعة من الأنشطة البيولوجية المفيدة لتطوير علاجات بديلة أو مساعدة. ومع ذلك، فإن مصفوفة النباتات المعقدة المتأصلة تجعل من عزل وتحديد المركبات النشطة مهمة صعبة وتستغرق وقتا طويلا4.
يمكن استخدام الأدوية أو التركيبات القائمة على NPs لمنع و / أو علاج العديد من الحالات التي تؤثر على الفم ، بما في ذلك تسوس الأسنان4. تسوس الأسنان، أحد أكثر الأمراض المزمنة انتشاراً عالمياً، مستمد من تفاعل النظام الغذائي الغني بالسكر والأغشية الحيوية الميكروبية (البلاك السني) التي تشكلت على سطح الأسنان الذي يؤدي إلى إزالة الألغام الناجمة عن الأحماض العضوية المستمدة من التمثيل الغذائي الميكروبي، وإذا لم يتم علاجه، يؤدي إلى فقدان الأسنان5،6. على الرغم من أن الكائنات الحية الدقيقة الأخرى قد تكون مرتبطة7، العقديات المطّع هو بكتيريا خطيرة cariogenic لأنه حمضي ، حمض ، وباني مصفوفة خارج الخلية. هذا النوع ترميز exoenzymes متعددة (على سبيل المثال، جليكوسيل ترانسفيراديس أو جفوس) التي تستخدم السكروز كركيزة8 لبناء مصفوفة خارج الخلية الغنية exopolysaccharides، والتي هي المحدد1. أيضا ، يمكن للفطر المبيضات albicans دفع ما يصل إنتاج تلك المصفوفة خارج الخلية7. على الرغم من الفلورايد, تدار في مختلف الطرائق, لا يزال الأساس لمنع تسوس الأسنان10,هناك حاجة إلى نهج جديدة كما adjuvants لزيادة فعاليتها. وبالإضافة إلى ذلك، تستند الطرائق المضادة للبلاك المتاحة على استخدام عوامل الإبادة الميكروبية واسعة الطيف (مثل الكلورهيكسيدين)11. كبديل, NPs هي العلاجات المحتملة للسيطرة على الأغشية الحيوية ومنع تسوس الأسنان12,13.
11- ويشمل التقدم الإضافي في اكتشاف مركبات جديدة نشطة بيولوجياً من النباتات الخطوات أو النهج اللازمة مثل: '1' استخدام بروتوكولات موثوقة وقابلة للتكرار لأخذ العينات، مع مراعاة أن النباتات كثيراً ما تظهر تبايناً داخل خصوصياً؛ و'2' استخدام بروتوكولات موثوقة وقابلة للتكرار لأخذ العينات؛ '2' استخدام المكونات الصناعية في المصانع؛ '3' استخدام المكونات غير القابلة للتكرار؛ '3' استخدام المكونات غير القابلة للتكرار؛ '2' استخدام المكونات الصناعية في المصانع؛ '3' استخدام بروتوكولات موثوقة وقابلة للتكرار في العينات؛ '2' استخدام المكونات غير القابلة للتحلل؛ '3' '2' إعداد مقتطفات شاملة وكسورها على نطاق صغير؛ '3' كان وصف و/أو عدم تجديد ملفاتها الكيميائية التي كانت تعتقد الحصول على بيانات متعددة الأبعاد مثل GC-MS أو LC-DAD-MS أو NMR مثلاً؛ '٤' استخدام نماذج مجدية وعالية الغلة لتقييم النشاط البيولوجي؛ '5' اختيار عدد الزيارات الجديدة المحتملة استنادا إلى تحليل البيانات المتعددة المتغيرات أو الأدوات الإحصائية الأخرى؛ '6' القيام بعزل وتنقية المركبات المستهدفة أو المرشحين الواعدين؛ و "7" التحقق من الأنشطة البيولوجية المقابلة باستخدام المركبات المعزولة2،14.
إزالة replication هو عملية تحديد بسرعة المركبات المعروفة في استخراج الخام ويسمح تمييز المركبات الجديدة من تلك التي سبق أن درست. وعلاوة على ذلك، فإن هذه العملية تمنع العزلة عندما يوصف النشاط البيولوجي بالفعل لبعض المركبات، ومن المفيد بشكل خاص الكشف عن "الضاربين المتكررين". وقد استخدم في مختلف عمليات سير العمل غير المستهدفة التي تتراوح بين تحديد المركبات الرئيسية أو التعجيل بالتجزئة الموجهة من الأنشطة حتى التصنيف الكيميائي لمجموعات المقتطفات. ويمكن دمجها تماما مع الدراسات الأيضية لتحديد الملامح الكيميائية غير المستهدفة من CE أو تحديد استهداف الأيض. كل هذا يؤدي في نهاية المطاف إلى إعطاء الأولوية مقتطفات قبل إجراءات العزل1،15،16،17.
لذلك، في هذه المخطوطة، نحن وصف نهجا منهجيا لتحديد جزيئات مضادات الميكروبات ومضادات الحيوية من مقتطفات نباتية وكسور. ويشمل أربع خطوات متعددة التخصصات: (1) جمع المواد النباتية؛ (2) و(2) جمع المواد النباتية؛ (2) و(3) جمع المواد النباتية؛ (2) و(3) (2) إعداد مستخلصات الخام (CE) وكسور (CEF)، تليها تحليلها للملامح الكيميائية؛ (3) bioassays؛ و (4) تحليل البيانات البيولوجية والكيميائية (الشكل 1). وهكذا، نقدم البروتوكول وضعت لتحليل الأنشطة المضادة للميكروبات ومضادات الحيوية من مستخلصات Sylvestris كاسيريا والكسور ضد المكورات العقدية والمونات المبيضات ألبيكان13، فضلا عن إجراءات التوصيف الكيميائي النباتي وتحليل البيانات. للبساطة، التركيز هنا هو إظهار نهج لفحص المركبات الطبيعية باستخدام البكتيريا.
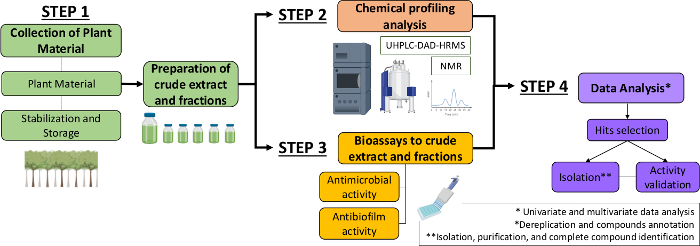
الشكل 1: مخطط تدفقي للنهج المنهجي لتحديد الجزيئات النشطة من مستخلصات النباتات والكسور. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
1. جمع المواد النباتية
- المواد النباتية
- تسجيل الوصول إلى المواد النباتية على المنصات الإلكترونية التي تنظم الوصول إلى التراث الوراثي في البلد الذي سيتم فيه جمعها. على سبيل المثال، في البرازيل، سجل في النظام الوطني لإدارة التراث الوراثي والمعارف التقليدية المرتبطة به - SisGen (الموقع https://sisgen.gov.br/paginas/login.aspx).
- جمع عينات من المواد النباتية ذات الأهمية (على سبيل المثال، أوراق الشجر، والسيقان، والجذور، والزهور، والفواكه). تسجيل إذا تم جمع المواد خلال مرحلة الإنجاب أو الطور الخضري.
- تسجيل معلمات الجمع (التاريخ، وادرج الجغرافية، ومتوسط درجة الحرارة السنوية، ومتوسط نسبة الرطوبة).
- تحديد العينات بدقة، ويجب على التصنيف تأكيد صحة.
- تثبيت عينات النباتات وتخزينها
- منفصلة الأجهزة النباتية في أكياس بلاستيكية فردية أو قارورة مباشرة بعد المجموعات.
- تعطيل التفاعلات الأنزيمية المحتملة عن طريق (1) التجميد الفوري في النيتروجين السائل، (2) الجفاف في فرن الهواء المتداول (40 درجة مئوية)، أو (3) تجميد تجفيف العينات عن طريق الجفاف.
- تخزين المواد استقرت في أكياس مختومة بإحكام في درجة حرارة الغرفة أو في الثلاجة حتى الاستخدام (-20 أو -80 درجة مئوية، اعتمادا على فترة التخزين أو الاستخدام المقصود).
- طحن العينات في طاحونة تحليلية (سكين أو الكرة، اعتمادا على نوع الأنسجة أو توافر) وتوحيد حجم الجسيمات باستخدام الغربال القياسية.
- وزن العينات بشكل فردي لخطوات الاستخراج اللاحقة.
2. إعداد مقتطفات الخام (CE) وكسور (CEF) لتحليل الملف التعريفي الكيميائي و Bioassays
- إعداد المستخلصات الخام (CE)
ملاحظة: يتم توضيح الخطوات في مخطط التدفق في الشكل 2A.- إعداد مذيب استخراج مع خليط الهيدرولكووليك (مثل الإيثانول (EtOH) 70٪ أو خلائط غير ية من الماء، EtOH، وغيرها من المعدلات، التي يحددها التصميم التجريبي وفقا لتقارير سابقة).
- استخدام نسبة وزن العينة (الوزن الجاف، ملغ)/ استخراج المذيبات (مل) تتراوح بين 50 إلى 100 ملغ لكل مل من المذيبات.
- للاستخراج السريع والقابل للتكرار، استخدم عمليات الاستخراج الدفعي باستخدام الأنابيب الدقيقة.
ملاحظة: يجب استخدام ثلاثة نسخ متماثلة على الأقل في هذه المرحلة للسماح للتحليل الإحصائي. - إجراء عمليات استخراج بمساعدة الموجات فوق الصوتية (الإمارات العربية المتحدة) لجعلها سريعة وسهلة ورخيصة.
- كرر الإجراء ثلاث مرات (15 دقيقة لكل من هذه الاجراءات) للحصول على أفضل كفاءة.
- بعد كل خطوة استخراج، وdedeant بقايا الصلبة عن طريق الطرد المركزي وإزالة عظمى.
- الجمع بين super بشكل فردي، تصفية، وحفظ aliquots لتحليل الكيميائية في وقت واحد وbioassays. إذا لزم الأمر، وإزالة المذيب المستخرج تحت فراغ، وتدفق النيتروجين، أو التجميل، وتسجيل الوزن والعائد.
- يُخزن في -20 درجة مئوية محمي من الضوء.
ملاحظة: يمكن أن يكون مؤقتاً البروتوكول هنا إلى شاشة CE وتحديد تلك التي تقدم النشاط المطلوب.
- تجزئة مستخلصات النفط الخام (CEF)
ملاحظة: يتم توضيح الخطوات في المخطط التدفقي في الشكل 2B.- استخدم الخراطيش التي بها 1 غرام على الأقل من الامتزاز. إذا قلويدات يحتمل أن تكون موجودة في CE، استخدم المذيبات التي تحتوي على 0.1٪ من حمض الفورميك (FA).
- تمييع العينة في المذيبات الأكثر ملاءمة (أو خليط المذيبات) للحصول على حل عينة 100 ملغ / مل. ثم، نقل 1 مل من حل عينة لخراطيش استخراج مرحلة صلبة مكيفة مسبقة - SPE (1 غرام من الامتزاز، 6 مل من القدرة).
- تنفيذ تجزئة باستخدام حوالي ثلاثة مجلدات ميتة من كل استخراج eluent (لخراطيش من 1 ز، وسوف تتوافق مع 2 مل من كل مذيب). إذا قلويدات يحتمل أن تكون موجودة في CE، استخدم المذيبات التي تحتوي على 0.1٪ من FA.
- جمع كسر واحد من تكوين مُمَرَد وحفظ aliquots للتحليل الكيميائي المتزامن والسامية الحيوية.
- إزالة المذيبات تحت فراغ، وتدفق النيتروجين، أو التجميل وتسجيل الوزن والعائد.
ملاحظة: إذا كان من الصعب CE للذوبان في خليط elution الأولي، تشتت CE في مرحلة صلبة (على سبيل المثال، C18 أو السيليت) في 1:1 (ث / ث) نسبة قبل تحميل المواد على الجزء العلوي من خرطوشة.
تنبيه: وزن microtubes مقدما لحساب العائد الشامل من مقتطفات وكسور.
- تحليل التنميط الكيميائي
ملاحظة: بالنظر إلى أن كل نوع من أنواع النباتات يتطلب أساليب محسنة ومحددة لتحليله الكيميائي، فإننا في الأقسام التالية، نُصف أكثر الأساليب التحليلية شيوعاً المستخدمة في تحليل المواد النباتية. وكمثال عملي، تم تطوير كلوغرافيا سائلة من المرحلة العكسية والتحقق من صحتها من أجل التحليل المتزامن للمركبات الفينولية والدايترية من نوع كليرودان الأحيائية بشكل تفاضلي بواسطة نوعين من الكاشاريا سيلفسترينسيس شوارتز (Salicaceae). وقد تم تجهيز جهاز UPLC-DAD مع ديجاسر، ومضخة رباعية، وعينات أوتوماتيكية، كاشف صفيف ضوئي للأشعة فوق البنفسجية-فيس، وفرن (انظر التفاصيل في Bueno وآخرون. 201518). ويمكن تحسين النهج المماثلة الوارد وصفها في الأمثلة التالية وفقا لأنواع نباتية أخرى و/أو مواد نباتية.- تحليل الكروماتوغرافي وإمكانيات الواصلة
- في حالة الفواصل التي تستخدم اللوني السائل فائق الأداء (UPLC)، استخدم عمود C18 كروماتوغرافي (على سبيل المثال، 150 × 2.1 مم، 2.6 ميكرومتر، 100 Å) محمياً بعمود مسبق متوافق.
ملاحظة: يمكن استخدام مراحل العمود الأخرى أو الأوضاع الكروماتوغرافية اعتمادا على الأنواع النباتية / المواد. ويمكن أيضا أن تستخدم التقليدية HPLC; في هذه الحالة، يجب اختيار عمود كروماتوغرافي مناسب. لتحقيق فصل ممتاز، ضبط الظروف الكروماتوغرافية بالنظر إلى معدل التدفق (μL / دقيقة)، درجة حرارة العمود (°C)، وحجم الحقن (μL). تتكون المرحلة المتنقلة عادة من الماء (A) والأسيتونيتريل أو الميثانول (B) باستخدام تدرجات الإلطوانات الخطية أو متعددة المستويات أو الإيلاء الأيزوكراتي. يمكن أيضاً استخدام المعدلات مثل المخازن المؤقتة أو الأحماض أو القواعد أو غيرها. - إجراء تحليل المواد النباتية (CE و / أو CEF) وتسجيل جميع البيانات ذات الصلة، مثل البيانات الطيفية (باستخدام الأشعة فوق البنفسجية فيس و / أو، بشكل تفضيلي، أجهزة الكشف عن مرض التصلب العصبي المتعدد)، ووقت الاحتفاظ (دقيقة)، وغيرها، اعتمادا على الواصلة المتاحة.
ملاحظة: عادة ما يتم الواصلة اللونية السائلة (LC) (مقرونة) مع قياس الطيف الكتلي عالي الدقة (HRMS) ، كـ LC-HRMS ، ويستخدم عادة للشروح السريعة من المستقلب في CE ou CEF15. - إذا كانت البيانات النوعية مطلوبة والبيانات الكمية ضرورية، إعداد بعناية وحقن منحنيات المعايرة، اتباع نفس البروتوكول.
ملاحظة: يمكن تنفيذ تطوير أفضل الظروف الكروماتوغرافية بمساعدة تصميم التجارب، كما وصفها بوينو وآخرون 201518، أو ما شابه ذلك من الأدب. من المهم النظر في إدراج المعايير الداخلية أثناء تطوير الأسلوب. هم جداً محل تقدير كبير لأنها تسمح الانحرافات التقنية الصحيحة أثناء إعداد العينة والحقن، ومزيد من التطبيع لتحليل البيانات.
- في حالة الفواصل التي تستخدم اللوني السائل فائق الأداء (UPLC)، استخدم عمود C18 كروماتوغرافي (على سبيل المثال، 150 × 2.1 مم، 2.6 ميكرومتر، 100 Å) محمياً بعمود مسبق متوافق.
- تحليل الكروماتوغرافي وإمكانيات الواصلة
- تحليل بيانات أحادية المتغيرة ومتعددة المتغيرات
- تصدير الكروماتوجرامات المسجلة في شكل مناسب (على سبيل المثال، ASCII، .txt أو شكل .csv). يمكن تعيين مصفوفة بيانات واحدة عن طريق الانضمام إلى الكروماتوجرامات ومحاذاتها إذا كان يجري تحليل عدة عينات، ومطلوب إجراء مقارنات. يجب تطبيع المصفوفات الناتجة الكروماتوجرامات وفقا للمعيار الداخلي المستخدم.
- تحليل بيانات المستقلب النباتية باستخدام أساليب متعددة المتغيرات و univariate. استكشاف وتصور مجموعات بيانات المستقلب من خلال التحليل المتزامن لمتغيرات متعددة باستخدام أساليب إحصائية متعددة المتغيرات، بما في ذلك تحليل المكون الرئيسي غير الخاضع للرقابة (PCA) وتحليل المجموعات الهرمية (HCA)، أو التحليل الجزئي الأقل المربعات الخاضعة للإشراف (مثل PLS، OPLS، PLS-DA). أساليب أحادية المتغيرات، مثل ANOVA، الطالب، توكي ويلش t اختبار، هي مثيرة للاهتمام خاصة لتحليل دقيق للاختلافات الكمية بين العينات19.
- التعليق التوضيحي للاناء والمركبات
ملاحظة: يتم تخصيص الهدف من هذه الخطوة لتعريف السريع على الخط من NPs المعروفة لتجنب العزلة tedious التي يمكن تنفيذها في نفس الوقت إلى أحادي أو تحليل البيانات متعددة المتغيرات.- تنفيذ مستويات تحديد المركبات المكتشفة أو المستهدفة:
- مركب محدد، بما في ذلك الهيكل ثلاثي الأبعاد الكامل والكيمياء المجسمة (المستوى 0)؛
- (أ) تحديد الهوية الذي تحقق بواسطة المعلمات متعامدتين، مثل وقت الاحتفاظ بالمواصفات الطيفية للتصلّد MS/MS (المستوى 1)؛
- مركبات مشروحة على نحو مُنَهَدٍ ومركب (المستويين 2 و3)؛
- الأيض غير معروف أو غير مصنف يمكن تمييزه على أساس البيانات التحليلية (المستوى 4)19،20.
- ميز المركبات المعروفة باستخدام قواعد البيانات التجارية أو العامة. ومن بين أهم قواعد البيانات، يمكن تسليط الضوء عليها: NIST (https://www.nist.gov)، وايلي (https://www.sisweb.com/software/ms/wiley.htm)، MassBank (https://massbank.eu/MassBank/)، GMD (http://gmd.mpimp-golm.mpg.de/)، METLIN (https://metlin.scripps.edu)، والمنتجات الطبيعية العالمية الشبكات الجزيئية الاجتماعية - قاعدة بيانات GNPS (https://gnps.ucsd.edu)19.
ملاحظة: هناك مستويات مختلفة من الشروح وهي تعتمد على تقنية واصلة المستخدمة أثناء الدراسة ويمكن أن تشمل: مساعدة MS- (أو NMR) قواعد البيانات الطيفية القائمة، وفي الخوارزميات التكهن الطيفية silico. - العزل، والتنقية، واستكمال تحديد هوية المركب
ملاحظة: إذا كان مركب معين (الذي كان يشتبه في هويته من قبل الأساليب الإحصائية) يحتاج إلى تحديد هيكلي كامل، فإن الخطوة الأولى لإنجاز هذه المهمة هي عزل وتنقية المركبات المطلوبة في نطاق أكبر. ويمكن تحقيق ذلك من خلال توسيع نطاق البروتوكولات التي سبق وضعها.- تنفيذ العزلة السريعة والمباشرة للمجمع الهدف (ق) من خلال تقنيات الكروماتوغرافية إعداد راسخة ومحسنة. يمكن استخدام HPLC شبه إعداد مع حقن الحمولة الجافة لتجنب التنازلات التي تحتاج عموما إلى أن يتم بين التحميل العالي وعينة solubilization1.
- إنجاز التوصيف الهيكلي الكامل وتحديد المركبات المعزولة. ويمكن إجراء ذلك من خلال الجمع بين تقنيات مختلفة:
- الرنين المغناطيسي النووي (NMR);
- القياس الطيفي الكتلي (MS)؛
- كما أن تقنيات القياس الطيفي في المناطق فوق البنفسجية والأشعة تحت الحمراء مفيدة جداً في توصيف المجموعات الوظيفية؛
- استخدام التحليل الطيفي بتقويم العمود الفقري مثل الدق اللوني الدائري الإلكتروني والذبذبات (ECD وVCD على التوالي)، والنشاط البصري رامان (ROA)، والأشعة السينية البلورية هي تقنيات هامة لتوصيف التكوين المطلق.
- تنفيذ مستويات تحديد المركبات المكتشفة أو المستهدفة:
3. الـ Bioassays
ملاحظة: الفحص البيولوجي: من أجل تقييم النشاط البيولوجي المحتمل لـ CE وCEF، ينبغي أن يكون الفحص الأولي للمواد الطبيعية منظماً ومباشراً.
- إعداد CE وCEF للـ bioassays
- إعادة تكوين المادة الجافة مع أفضل المذيبات الممكنة (والتي يمكن تحديد تجريبيا). تصميمالتجريبية 21،22 تحديد حل الأسهم وتركيز المذيبات.
- حساب تركيز المذيبات من محلول الأسهم. للقيام بذلك، استخدم الصيغة: C1 x V1 = C2 x V2، حيث يمثل C1 حل المخزون (ملغ) من CE و / أو CEF؛ V1 يمثل حجم المذيبات; C2 هو وزن CE و / أو CEF; V2 هو الحجم النهائي (مل) من حل الأسهم.
ملاحظة: على سبيل المثال، اخترنا 84.15٪ EtOH و 15٪ ثنائي الفينيل ثنائي أكسيد (DMSO) كتركيز المذيبات من محلول الأسهم. أعددنا تركيز الأسهم من CE إلى 6 ملغ / مل وCEF إلى 1 ملغ / مل13. المذيب لتخفيف CE وCEF تعتمد على طريقة تقييم النشاط البيولوجي. يجب أن المذيب المستخدم كوسيلة لا تتداخل مع النشاط البيولوجي والسمي. عادة، يتم استخدام المياه، DMSO، EtOH، أو المذيبات المائية على أساس EtOH ل solubilize مستخلصات نباتية أو مشتقات نباتية4،13.
- إعداد الكائنات الحية الاختبارية
- إعادة تنشيط سلالة ميكروبية، على سبيل المثال S. mutans UA159 على أجار الدم (48 ساعة، 37 درجة مئوية، 5٪ CO2، والثقافة في الوسط ثقافة السائل (على سبيل المثال، التربتون الخميرة استخراج مرق [TYE: 2.5٪ (ث / الخامس) tryptone مع 1.5٪ (ث / الخامس) استخراج الخميرة) التي تحتوي على 1٪ الجلوكوز (ث / الخامس) (TYEg) لمدة 16 ساعة، 37 درجة مئوية، 5٪CO2.
- تنفيذ 1:20 تخفيف من الثقافة الأولية للكائنات الحية الدقيقة في نفس الوسط ثقافة (قد تتغير نسبة التخفيف من الثقافة الأولية وفقا للتصميم التجريبي).
- احتضان حتى تصل إلى مرحلة النمو منتصف السجل.
- إعداد inoculum ل bioassays مع عدد محدد من السكان (على سبيل المثال، 2x106 وحدات تشكيل مستعمرة لكل ملليلتر - CFU / مل) في TYEg لمقايس مضادات الميكروبات و TYE مع 1٪ السكروز (ث / الخامس) (TYEs) لمقايسات الأغشية الحيوية.
ملاحظة: سوف تعتمد ظروف النمو على الكائنات الحية الدقيقة التي تم اختبارها.
- نشاط مضاد للميكروبات
ملاحظة: يتم توضيح الخطوات في الشكل 3.- في لوحة 96-well، إضافة aliquot (μL) من CE و / أو CEF حل الأسهم (العلاجات). يتم تعريف حجم aliquot من قبل تركيز الاختبار، والتي يجب أن يتم اختيارها على أساس الدراسات السابقة. على سبيل المثال، لاختبار CE في تركيز اختبار 0.5 ملغ/مل، استخدم 16.67 ميكروغرام من محلول المخزون عند 6 ملغ/مل. لهذا الحساب، استخدم الصيغة: C1 x V1 = C2 x V2،حيث C1 هو تركيز المخزون، والخامس1 هو حجم aliquot حل المخزون، C2 هو تركيز الاختبار، والخامس2 هو حجم لوحة 96-well (الذي يتوافق مع 200 ميكرولتر). في هذه الحالة التجريبية، سيكون تركيز اختبار المذيبات (المركبة) 7٪ ETOH و 1.25٪ DMSO.
- وتشمل مجموعة من الضوابط لكل لوحة: عمود مع العلاجات، دون inoculum (تحكم فارغة لكل علاج، وتساعد على التمييز بين التعكر من قبل العلاج المستخدمة نفسها من النمو الميكروبي)؛ عمود مع السيارة وentoculum (diluent من CE أو CEF أو 0 ملغ / مل السيطرة)؛ عمود مع الثقافة فقط المتوسطة (ثقافة التحكم المتوسط) وعمود مع inoculum فقط (مراقبة النمو الميكروبي).
- باستخدام TYEg، ضبط مستوى الصوت إلى 100 μL. المقبل، احتضان، على سبيل المثال، 24 ساعة، 37 درجة مئوية، 5٪ CO2 (اعتمادا على الكائنات الحية الدقيقة اختبار).
- تلقيح 100 μL من الكائنات الحية الدقيقة inoculum (1x 106 CFU / مل) في لوحة 96 جيدا.
- تحليل النمو البكتيري وفقا ل عكارة عن طريق الفحص البصري للآبار (واضحة أو غائمة). واضح: يعني أنه لا يوجد نمو بصري للكائنات الحية الدقيقة. غائم: يعني أن هناك نمو البصرية من الكائنات الحية الدقيقة.
- قياس الامتصاص (الكثافة البصرية أو O.D.) من الثقافة البكتيرية في كل بئر (قارئ ELISA باستخدام 540 نانومتر). بعد ذلك، نقل 100 ميكرولتر من الثقافات إلى الأنابيب الدقيقة التي تحتوي على 900 ميكرولتر من محلول ملحي (0.89٪ NaCl)، اخلط جيدا من خلال دوامة. بعد ذلك، استمر في تنفيذ تخفيف تسلسلي عشرة أضعاف حتى القيمة المطلوبة.
- تلقيح aliquot من التخفيف المطلوب في لوحات agar محددة (في مكررة). على سبيل المثال، 10 ميكرولتر من تخفيف معين على لوحات أجار الدم.
- احتضان. يمكن أن تتغير الظروف بين الكائنات الدقيقة ، على سبيل المثال ، S. mutans: 48 h ، 37 °C ، 5 ٪ CO2.
- تنفيذ حساب مستعمرة على لوحات لتحويل لاحق إلى CFU / مل كما(عدد من المستعمرات x 10 ن)/q. في هذه الصيغة،n يساوي القيمة المطلقة لتخفيف (0، 1، 2، أو 3)، وQ يساوي المبلغ، في مل، pipetted لكل تخفيف مطلي على لوحة أجار. أيضاً، يمكن تحويل CFU/mL إلى قيم السجل.
ملاحظة: عندما تضاف مستخلصات نباتية إلى الوسط الثقافي، قد يحدث هطول للجسيمات من المستخلصات. وهذه الحقيقة قد تجعل من الصعب تفسير النتائج. ويحدث الشيء نفسه عندما يقيس قارئ اللوح الدقيق التعكر، حيث تتجمع الخلايا في بعض الحالات في الجزء السفلي من اللوح الصغير. وبالإضافة إلى ذلك، اعتمادا على استخراج المستخدمة، يمكن أن لون المستخلصات ورقة النبات تجعل من الصعب تحديد التعكر23،24. وهناك طريقة بديلة تستخدم الأصباغ التي تكشف ما إذا كانت الخلايا الميكروبية نشطة الأيضية أو لا24.
- نشاط مضاد biofilm
ملاحظة: خطوات تقييم تأثير العلاجات على تكوين بيو فيلم موضحة في الشكل 4.- تشكيل وتجهيز الأغشية الحيوية
- تخفيف العلاجات في الوسط الثقافة (TYEs) في لوحة 96-well كما هو موضح في خطوات بروتوكول النشاط المضاد للميكروبات.
- احتضان لوحة. في المثال مع S. الطفرات, يتم تنفيذ حضانة خلال 24 ح, في 37 درجة مئوية, و 5٪ CO2.
- بعد الحضانة، ضع اللوحات على شاكر مداري (5 دقائق، 37 درجة مئوية، 75 دورة في الدقيقة) لتخفيف الخلايا التي لم تلتزم بالبيوفيلم. ثم، تجاهل الوسط ثقافة تحتوي على الخلايا غير الملتزم بها، وغسل الأغشية الحيوية المتبقية ثلاث مرات مع 0.89٪ NaCl لإزالة الخلايا غيرالمنضمة.
- القياس الكمي للكتلة الحيوية من الأغشية الحيوية المعالجة
ملاحظة: يتم توضيح الخطوات في المخطط التدفقي في الشكل 4A.- الحفاظ على الأغشية الحيوية غسلها على لوحة وإضافة 50 μL من 1٪ الكريستال البنفسجي محلول مائي لكل بئر.
- احتضان لوحة في درجة حرارة الغرفة لمدة 35 دقيقة.
- اغسل الآبار الملطخة بالماء المليك (ثلاث مرات) ثم جففها الهواء لمدة 60-90 دقيقة.
- إلوت البنفسجي البلوري من الآبار الملطخة مع 200 ميكرولتر من EtOH 99٪ عن طريق احتضان اللوحة في شاكر المدارية (5 دقائق، 37 درجة مئوية، 75 دورة في الدقيقة).
- نقل aliquot 150 ميكرولتر من كل بئر مع صبغة مائل إلى لوحة أخرى وتحديد الكتلة الحيوية عينة (ELISA القارئ 570 نانومتر).
- القياس الكمي للسكان الميكروبيات القابلة للحياة (CFU/mL) من الأغشية الحيوية المعالجة
ملاحظة: يتم توضيح الخطوات في المخطط التدفقي في الشكل 4B.- إزالة الأغشية الحيوية غسلها من لوحة مع ماصة و 200 ميكرولتر من 0.89٪ NaCl ونقل التعليق الناتجة بشكل فردي إلى الأنابيب الدقيقة العقيمة.
- استخدم 200 ميكرولتر إضافي من NaCl 0.89٪ لكل بئر ونقلها إلى الأنبوب المقابل ، الذي يحتوي بالفعل على 200 ميكرولتر من تعليق البيو فيلم الأولي. تنفيذ هذه العملية حتى تصل إلى تعليق إجمالي 1 مل بيو فيلم لكل بئر الأصلي.
- استخدام aliquot من كل أنبوب لأداء تخفيف المسلسل عشرة أضعاف.
- تلقيح aliquot من التخفيف المطلوب في لوحات agar محددة (في مكررة). على سبيل المثال، 10 ميكرولتر من تخفيف معين على لوحات أجار الدم.
- احتضان لوحات أجار (على سبيل المثال، 48 ساعة، 37 درجة مئوية، 5٪ CO2)،ثم عد المستعمرات لتحديد CFU / مل كما هو موضح أعلاه.
- تشكيل وتجهيز الأغشية الحيوية
- مرحلة التحقق من النشاط البيولوجي
- تشكيل البليكل اللعابي
- استخدام Hydroxyapatite (HA) الخرز (ماكرو الإعدادية سيراميك هيدروكسيباتيت نوع I 80 μm) كسطح لتشكيل فيلم اللعاب25. هذه الخرز سطح تقليد المينا الأسنان.
- وزن الخرز HA (على سبيل المثال، 10 ملغ) في الأنابيب الدقيقة وتعقيم. ثم، استخدام العازلة الامتزاز (AB العازلة: 50 MM KCl، 1 mM KPO4, 1 mM CaCl2, 1 mM MgCl2, في dd-H2O, pH 6.5]25 تحتوي على 0.1 mm phenylmethylsulfonyl Fluoride (PMSF) و 0.02٪ أزيم الصوديوم (NaN3) لغسل الخرز.
- جمع وإعداد اللعاب البشري26. ومن الضروري الحصول على موافقة لجنة الأخلاقيات المؤسسية.
- إضافة 500 ميكرولتر من اللعاب إلى الأنابيب الدقيقة واحتضان (40 دقيقة، 37 درجة مئوية، 24 دورة في الدقيقة).
- بعد ذلك ، قم بإزالة اللعاب المابير وغسل الخرز (ثلاث مرات مع AB العازلة التي تحتوي على PMSF و NaN3). حبات sHA (حبة HA مع البليكل اللعابي) هي الآن جاهزة للمنافقات المصب.
ملاحظة: يتم جمع اللعاب من متطوعين أصحاء. بعد جمع، وتمييع اللعاب (1: 1 v/v) مع AB العازلة والطرد المركزي (1699 × ز، 20 دقيقة، 4 درجة مئوية). تعقيم عن طريق الترشيح (فلتر غشاء البولي إيثرسولفون مع انخفاض الربط إلى 0.22 ميكرومتر البروتينات)26. ويجب أن توافق لجنة الأخلاقيات المؤسسية على الدراسة. في حالتنا، وافقت لجنة الأخلاقيات في المؤسسة على الدراسة (CAAE: 68161417.0.0000.5416).
- مفرزة من S. mutans بعد الالتصاق إلى الفيلم اللعابي وglucans تعامل مع مقتطفات مختارة
- زراعة الكائنات الحية الدقيقة حتى منتصف مرحلة النمو سجل، كما هو موضح أعلاه.
- عندما وصلت الثقافات إلى O.D. المطلوبة، الطرد المركزي (4000 × ز لمدة 20 دقيقة)، وغسل مع 0.89٪ محلول كلوريد الزرع وإعادة تعليق بيليه مع 0.89٪ ناCl باستخدام نفس الحجم الأولي من المتوسطة الثقافة.
- إذا كان استخدام العقدية، مثل S. mutans، سونيكات الثقافات مع مسبار ل dechain (30 ق، 7 ث، ثلاث مرات). إذا كان استخدام كائن حي وحيد الخلية، يمكن تخطي هذه الخطوة.
- تحقق من O.D. (540 نانومتر) لضبط التركيز إلى 2 × 106 CFU / مل.
- التصاق S. الطفرات إلى البليكل اللعابي (sHA) وانفصال الخلايا الملتزم بها
ملاحظة: يتم توضيح الخطوات في المخطط التدفقي في الشكل 5.- الحصول على عينات sHA كما هو موضح أعلاه.
- إضافة aliquot (في المثال، نضيف 500 ميكرولتر) من العلاجات المختارة (في تركيز الاختبار؛ على سبيل المثال، 0.5 ملغ /مليلتر) أو عناصر التحكم في الأنابيب الدقيقة التي تحتوي على عينات من sha.
- احتضان عينات sHA مع العلاجات أو الضوابط (30 دقيقة، 37 درجة مئوية، 24 دورة في الدقيقة)؛ ثم، وغسل الخرز ثلاث مرات مع AB العازلة (التي تحتوي على PMSF وNaN3).
- إضافة ثقافة الكائنات الحية الدقيقة. في المثال، نضيف 500 ميكرولتر من ثقافة S. mutans (2 × 106 CFU / مل) إلى كل microtube.
- احتضان (1 ساعة، 37 درجة مئوية، 24 دورة في الدقيقة) ثم إزالة الخلايا غير المنضمة عن طريق غسل ثلاث مرات مع AB العازلة.
- Resuspend كل عينة مع aliquot (في المثال، ونحن إضافة 1000 μL) من AB العازلة و sonicate مع مسبار (30 ث، 7 W).
- استخدام aliquot من كل تعليق لتخفيف المسلسل عشرة أضعاف لتحديد عدد المستعمرات قابلة للحياة عن طريق الطلاء على لوحات آجار محددة (48 ح، 37 درجة مئوية، 5٪ CO2). بعد ذلك، عد المستعمرات لتحديد CFU/mL كما هو موضح أعلاه.
ملاحظة: يتم تنفيذ خطوة sonicate لفصل الخلايا الملتزمة sHA.
- التصاق S. الطفرات إلى مصفوفة جلوكان الأولية (gsHA) ومفرزة من الخلايا الملتزم بها
ملاحظة: يتم توضيح الخطوات في المخطط التدفقي في الشكل 6. تم تنقية إنزيم GtfB من المكورات العقدية فائقة الثقافة ميليلي KSB8 هندسيا لإنتاج GtfB. تم إجراء عملية تنقية مع عمود الكروماتوغرافيا التي تحتوي على الخرز هيدروكسيباتيت باستخدام مخازن تحتوي على اثنين من مثبطات protease (0.1 mM PMSF و 0.02٪ NaN3)27،28. ثم تم فحص الإنزيم على جل الأكريلاميد (SDS-PAGE) وملطخة بنترات الفضة. تم تخزين Aliquots من الانزيم في -80 درجة مئوية حتى الاستخدام.- الحصول على عينات sHA كما هو موضح أعلاه. بعد ذلك، أضف aliquot (في المثال، نضيف 500 ميكرولتر) من إنزيم GtfB إلى كل أنبوب واحتضان في التجانس (40 دقيقة، 37 درجة مئوية، 24 دورة في الدقيقة). ثم، غسل ثلاث مرات مع AB العازلة (التي تحتوي على PMSF و NaN3).
- إضافة aliquot (على سبيل المثال، 500 ميكرولتر) من الركيزة السكروز (100 مليمول من السكروز) التي تحتوي على العلاجات (أو عناصر التحكم في تركيز الاختبار، على سبيل المثال، 0.5 ملغ/مل) لكل ميكروتيتوب.
- احتضان العينات في التجانس (4 ساعة، 37 درجة مئوية، 24 دورة في الدقيقة). ثم, أداء ثلاثة يغسل مع AB العازلة (مع PMSF وNaN3) لإزالة العلاجات والفائض من السكروز لم تدرج في glucans توليفها (عينات من gsHA).
- إضافة aliquot (في المثال، نضيف 500 ميكرولتر) من s. الطفرات inoculum (2 × 106 CFU / مل) إلى كل microtube.
- احتضان في التجانس (1 ساعة، 37 درجة مئوية، 24 دورة في الدقيقة) وغسل ثلاث مرات مع AB العازلة (مع PMSF وNaN3) لإزالة الخلايا غير المنضمة.
- Resuspend كل عينة مع aliquot (على سبيل المثال، 1000 ميكرولتر) من AB العازلة (مع PMSF وNaN3)و sonicate مع مسبار لفصل الخلايا انضمت إلى gsHA (30 ث، 7 W).
- استخدام aliquot من كل تعليق لتخفيف المسلسل عشرة أضعاف لتحديد عدد المستعمرات قابلة للحياة عن طريق الطلاء على لوحات آجار محددة (48 ح، 37 درجة مئوية، 5٪ CO2). بعد ذلك، عد المستعمرات لتحديد CFU/mL كما هو موضح أعلاه.
- تشكيل البليكل اللعابي
4- تحليل البيانات البيولوجية
- بيانات الـ Bioassays
- إدخال البيانات الأولية للbiosassays في جدول البيانات. حساب سجل من مثبطات النمو الميكروبي من قبل كل علاج(A CFU / مل من العلاجات + 1) × سجل10. ثم، وحساب نسبة سجل من تثبيط النمو الميكروبي، مقارنة مع التحكم في السيارة باستخدام(a log10 CFU/mL من العلاج/ يعنيA log10 CFU/mL من التحكم في السيارة)x 100٪.
- O.D. الصحيح من الثقافات planktonic والكتلة الحيوية المعالجة من قبل العلاجات (CE ومجموعات CEF المعالجة) والتحكم في السيارة (التحكم السلبي). للتصويب، طرح امتصاص الآبار المعالجة من تلك التي تم الحصول عليها في الآبار التي تحتوي على الثقافة فقط المتوسطة (AA المجموعات المعالجة المتوسطة / A وسيط التحكمالسلبي)x 100٪.
- بعد هذا التصحيح، حساب النسبة المئوية من تثبيط الكتلة الحيوية، مقارنة مع مراقبة المركبات(A الكتلة الحيوية المعالجة/ يعنيالتحكم في السيارة)x 100٪.
- تقديم البيانات الأولية التي تم إنشاؤها للتحليل الإحصائي للبيانات باستخدام برامج محددة.
ملاحظة: يتم تحديد تفسير فعالية معالجة معينة باستخدام نقاط التوقف، مثل IC50/IC90. وتعرف هذه القيم على أنها الحد الأدنى لتركيز العلاج قادرة على تثبيط 50٪ و 90٪ على التوالي، من النمو البكتيري أو تكوين بيو فيلم24. يمكن لهذه المعلمات أن تساعد في تفسير البيانات وتوفر أساسًا لتحديد المركبات ذات النشاط الأفضل13،29.
النتائج
ونحن نقدم مثالا على استخدام نهج منهجي لفحص النشاط البيولوجي من مستخلصات وكسور النباتات لتحديد الجزيئات التي يحتمل أن تكون نشطة للعلاجات المضادة للسوس الجديدة المحتملة: أنشطة مضادات الميكروبات ومضادات الحيوية من مستخلصات الكاشاريا Sylvestris من المناطق الحيوية البرازيلية المتميزة ضد
Discussion
التحديات الرئيسية المتعلقة بالعمل مع مقتطفات الخام الطبيعية تشمل تكوينها المعقدة وأوجه القصور في دراسات العزل الكلاسيكية الموجهة بيولوجيا. وعلى الرغم من أن هذه العملية بطيئة، فإنها فعالة وأدت إلى نتائج رئيسية في بحوث NP. وترشيداً، يلزم إجراء دراسات تستند إلى الأولويات من أجل الترشيد. وهك...
Disclosures
لم يُعلن عن تضارب المصالح.
Acknowledgements
ونعبر عن امتناننا لـ Núcleo de Bioensaios، وBiosíntese e Ecofisiologia de Produtos Naturais (NuBBE) التابع لمعهد الكيمياء التابع لبرنامج الأمم المتحدة للبيئة والأمن، Araraquara/SP، لتوفير مختبرات لإعداد المواد النباتية. كما نشكر مختبر الميكروبيولوجيا التطبيقية التابع لقسم مواد الأسنان والأطراف الصناعية الاصطناعية، UNESP، Araraquara/SP. وقد تم دعم هذا البحث من خلال منحة بحثية من مؤسسة ساو باولو للبحوث (FAPESP #2013/07600-3 إلى AJC) والمنح الدراسية بالإضافة إلى الأموال العامة (FAPESP #2017/07408-6 وFAPESP #2019/23175-7 إلى SMR؛ #2011/21440-3 و #2012/21921-4 إلى PCPB). وقدم المجلس الوطني للتنمية العلمية والتكنولوجية بالتعاون مع الاتحاد دعما إضافيا (المركز الوطني للتكهبت #465637/2014-0، وFAPESP #2014/50926-0 إلى اللجنة الاستشارية لنقابات المحامين).
Materials
| Name | Company | Catalog Number | Comments |
| 96-well microplates | Kasvi | Flat bottom | |
| Activated carbon | LABSYNTH | Clean up and/or fractionation step | |
| Analytical mill | Ika LabortechniK | Model A11 Basic | |
| Blood agar plates | Laborclin | ||
| Chromatographic column C18 | Phenomenex Kinetex | 150 × 2.1 mm, 2.6 µm, 100Â | |
| Dimethyl sulfoxide | Sigma-Aldrich | Vehicle solution | |
| ELISA plate reader | Biochrom Ez | ||
| Ethanol | J. T. Baker | For extraction and fractionation steps, and mobile phase composition | |
| Ethanol | Sigma-Aldrich | Vehicle solution | |
| Ethyl acetate | J. T. Baker | Fractionation step | |
| GraphPad Software | La Jolla | GraphPad Prism7 | |
| Hexane | J. T. Baker | Fractionation step | |
| Incubator | Thermo Scientific | ||
| Isopropanol | J. T. Baker | For extraction step | |
| Lyophilizer (a freeze dryer) | Savant | Modulyo | |
| Nylon Millipore | LAC | 0.22 µm x 13 mm | |
| Orbital shaker | Quimis | Model G816 M20 | |
| Polyamide solid phase extraction cartridge | Macherey-Nagel | Clean up and/or fractionation step | |
| Silica gel | Merck | 40–63 μm, 60 Â | |
| Sodium Chloride (NaCl) | Synth | 0,89% in water | |
| Solid phase extraction cartridges (SPE) | Macherey-Nagel | Clean up and/or fractionation step | |
| Tryptone | Difco | ||
| UHPLC-DAD | Dionex | Ultimate 3000 RS | |
| Ultrasonic bath | UNIQUE | Model USC 2800 | |
| Yeast extract | Difco |
References
- Newman, D. J., Cragg, G. M. Natural Products as Sources of New Drugs over the Nearly Four Decades from 01/1981 to 09/2019. Journal of Natural Products. 83 (3), 770-803 (2020).
- Wolfender, J. L., Litaudon, M., Touboul, D., Queiroz, E. F. Innovative omics-based approaches for prioritisation and targeted isolation of natural products – new strategies for drug discovery. Natural Product Report. 36 (6), 855-868 (2019).
- Michel, T., Halabalaki, M., Skaltsounis, A. New Concepts, Experimental Approaches, and Dereplication Strategies for the Discovery of Novel Phytoestrogens from Natural Sources. Planta Medica. 79 (7), 514-532 (2013).
- Jeon, J. G., Rosalen, P. L., Falsetta, M. L., Koo, H. Natural products in caries research: current (limited) knowledge, challenges and future perspective. Caries Research. 45 (3), 243-263 (2011).
- Tonetti, M. S., Jepsen, S., Jin, L., Otomo-Corgel, J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. Journal of Clinical Periodontology. 44 (5), 456-462 (2017).
- Peres, M. A., et al. Oral diseases: a global public health challenge. Lancet. 394 (10194), 249-260 (2019).
- Bowen, W. H., Burne, R. A., Wu, H., Koo, H. Oral biofilms: pathogens, matrix, and polymicrobial interactions in microenvironments. Trends Microbiology. 26 (3), 229-242 (2018).
- Paes Leme, A. F., Koo, H., Bellato, C. M., Bedi, G., Cury, J. A. The role of sucrose in cariogenic dental biofilm formation--new insight. Journal of Dental Research. 85 (10), 878-887 (2006).
- Koo, H., Falsetta, M. L., Klein, M. I. The exopolysaccharide matrix: a virulence determinant of cariogenic biofilm. Journal of Dental Research. 92 (12), 1065-1073 (2013).
- Cury, J. A., de Oliveira, B. H., dos Santos, A. P., Tenuta, L. M. Are dental fluoride releasing materials clinically effective on caries control. Dental Materials. 32 (3), 323-333 (2016).
- Mattos-Graner, R. O., Klein, M. I., Smith, D. J. Lessons Learned from Clinical Studies: Roles of Mutans Streptococci in the Pathogenesis of Dental Caries. Current Oral Health Reports. 1, 70-78 (2014).
- Rocha, G. R., Florez Salamanca, E. J., de Barros, A. L., Lobo, C. I. V., Klein, M. I. Effect of tt-farnesol and myricetin on in vitro biofilm formed by Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 18 (1), 61 (2018).
- Ribeiro, S. M., et al. Antimicrobial and antibiofilm activities of Casearia sylvestris extracts from distinct Brazilian Biomes against Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 19 (1), 308 (2019).
- Pilon, A. C., et al. Metabolômica de plantas: métodos e desafios. Quimica Nova. 43 (3), 329-354 (2020).
- Wolfender, J. L., Nuzillard, J. M., Hooft, J. J. J., Renault, J. H., Bertrand, S. Accelerating Metabolite Identification in Natural Product Research: Toward an Ideal Combination of Liquid Chromatography-High-Resolution Tandem Mass Spectrometry and NMR Profiling, in Silico Databases, and Chemometrics. Analytical Chemistry. 91 (1), 704-742 (2019).
- Allard, P. M., et al. Pharmacognosy in the digital era: shifting to contextualized metabolomics. Current opinion in biotechnology. 54, 57-64 (2018).
- Hubert, J., Nuzillard, J., Renault, J. Dereplication strategies in natural product research: How many tools and methodologies behind the same concept. Phytochemistry Reviews. 16, 55-95 (2017).
- Bueno, P. C. P., Pereira, F. M. V., Torres, R. B., Cavalheiro, A. J. Development of a comprehensive method for analysing clerodane-type diterpenes and phenolic compounds from Casearia sylvestris Swartz (Salicaceae) based on ultra-high performance liquid chromatography combined with chemometric tools. Journal of separation science. 38 (10), 1649-1656 (2015).
- Bueno, P. C. P., Lopes, N. P. Metabolomics to Characterize Adaptive and Signaling Responses in Legume Crops under Abiotic Stresses. American Chemical Society omega. 5 (4), 1752-1763 (2020).
- Blaženović, I., Kind, T., Ji, J., Fiehn, O. Software tools and approaches for compound identification of LC-MS/MS data in metabolomics. Metabolites. 8 (2), 31 (2018).
- Eloff, J. N. Quantifying the bioactivity of plant extracts during screening and bioassay-guided fractionation. Phytomedicine: International Journal Of Phytotherapy And Phytopharmacology. 11 (4), 370-371 (2004).
- Rios, J. L., Recio, M. C. Medicinal plants and antimicrobial activity. Journal of Ethnopharmacology. 100 (1-2), 80-84 (2005).
- Eloff, J. N. A sensitive and quick microplate method to determine the minimal inhibitory concentration of plant extracts for bacteria. Planta Medica. 64, 711-714 (1998).
- Eloff, J. N. Avoiding pitfalls in determining antimicrobial activity of plant extracts and publishing the results. BMC Complementary and Alternative Medicine. 19 (1), 106 (2019).
- Klein, M. I., Xiao, J., Heydorn, A., Koo, H. An analytical tool-box for comprehensive biochemical, structural and transcriptome evaluation of oral biofilms mediated by mutans streptococci. Journal of Visualized Experiments. (47), e2512 (2011).
- Lemos, J. A., Abranches, J., Koo, H., Marquis, R. E., Burne, R. A. Protocols to study the physiology of oral biofilms. Methods in molecular biology. 666, 87-102 (2010).
- Venkitaraman, A. R., Vacca-Smith, A. M., Kopec, L. K., Bowen, W. H. Characterization of glucosyltransferase B, GtfC, and GtfD in solution and on the surface of hydroxyapatite. Journal of Dental Research. 74, 1695-1701 (1995).
- Vacca-Smith, A. M., Venkitaraman, A. R., Quivey, R. G., Bowen, W. H. Interactions of streptococcal glucosyltransferases with alpha-amylase and starch on the surface of saliva-coated hydroxyapatite. Archives of Oral Biology. 41, 291-298 (1996).
- Van Dijck, P., et al. Methodologies for in vitro and in vivo evaluation of efficacy of antifungal and antibiofilm agents and surface coatings against fungal biofilms. Microbial Cell. 5 (7), 300-326 (2018).
- Marsh, P. D. Are dental diseases examples of ecological catastrophes. Microbiology. 149 (2), 279-294 (2003).
- Bowen, W. H., Koo, H. Biology of Streptococcus mutans-derived glucosyltransferases: role in extracellular matrix formation of cariogenic biofilms. Caries Research. 45 (1), 69-86 (2011).
- Lobo, C. I. V., et al. Dual-species biofilms of Streptococcus mutans and Candida albicans exhibit more biomass and are mutually beneficial compared with single-species biofilms. Journal of Oral Microbioly. 11 (1), 1581520 (2019).
- Kim, D., et al. Candida albicans stimulates Streptococcus mutans microcolony development via crosskingdom biofilm-derived metabolites. Scientific reports. 7, 41332 (2017).
- Ferreira, P. M. Folk uses and pharmacological properties of Casearia sylvestris: a medicinal review. Anais da Academia Brasileira de Ciencias. 83 (4), 1373-1384 (2011).
- Xia, L., Guo, Q., Tu, P., Chai, X. The genus Casearia: a phytochemical and pharmacological overview. Phytochemistry Reviews. 14, 99-135 (2015).
- Ferreira, P. M. P., et al. Toxicological findings about an anticancer fraction with casearins described by traditional and alternative techniques as support to the Brazilian Unified Health System (SUS). Journal of Ethnopharmacol. 15, 241 (2019).
- Koo, H., Xiao, J., Klein, M. I., Jeon, J. G. Exopolysaccharides produced by Streptococcus mutans glucosyltransferases modulate the establishment of microcolonies within multispecies biofilms. Journal of Bacteriology. 192 (12), 3024-3032 (2010).
- Maske, T. T., van de Sande, F. H., Arthur, R. A., Huysmans, M. -. C. D. N. J. M., Cenci, M. S. In vitro biofilm models to study dental caries: a systematic review. Biofouling. 33 (8), 661-675 (2017).
- Fu, Y., Luo, J., Qin, J., Yang, M. Screening techniques for the identification of bioactive compounds in natural products. Journal of Pharmaceutical and Biomedical Analysis. 168, 189-200 (2019).
- Sarker, S. D., Nahar, L. An introduction to natural products isolation. Methods in molecular biology. 864, 1-25 (2012).
- Clinical Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing; twenty-fifth informational supplement. Clinical Laboratory Standards Institute (CLSI). , (2015).
- Saputo, S., Faustoferri, R. C., Quivey, R. G. A drug repositioning approach reveals that Streptococcus mutans is susceptible to a diverse range of established antimicrobials and nonantibiotics. Antimicrobial Agents and Chemotherapy. 62 (1), 01674 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved