このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
植物の抽出物と分率から新しい抗菌分子と抗バイオフィルム分子を同定し、齲蝕を予防する体系的アプローチ
* これらの著者は同等に貢献しました
要約
天然物は、新薬および治療薬の開発の有望な出発点を表しています。しかし、化学的多様性が高いため、植物から新しい治療化合物を見つけることは困難で時間のかかる作業です。植物抽出物および分画から抗菌分子および抗バイオフィルム分子を同定するための簡便なアプローチを説明する。
要約
天然物は、構造的に異なる物質を提供し、無数の生物学的活動を提供します。しかし、植物からの活性化合物の同定と分離は、複雑な植物マトリックスと時間のかかる分離および同定手順のために困難です。そこで、潜在的に活性な分子の単離および同定を含む植物由来の天然化合物をスクリーニングするための段階的アプローチが提示される。それは植物材料のコレクションを含みます。粗抽出物の調製と分画;クロマトグラフィーおよび分光法(UHPLC-DAD-HRMSおよびNMR)の分析および化合物同定のためのアプローチ;バイオアッセイ(抗菌および抗バイオフィルム活性;選択された治療で治療された唾液ペリクルおよび初期グルカンマトリックスへの細菌の「接着強度」);データ分析を行います。モデルは簡単で、再生可能で、複数の化合物、濃度および処置ステップのハイスループットスクリーニングを一貫して制御することができる。得られたデータは、最も活性な抽出物および/または画分を含む製剤、分子の単離、微生物細胞およびバイオフィルム内の特定の標的への分子のモデリングを含む、将来の研究のための基礎を提供する。例えば、齲蝕原性バイオフィルムを制御する1つの標的は、細胞外マトリックスのグルカンを合成する レンサ球菌変異体 グルコシルトランスファーーゼの活性を阻害するものである。これらの酵素の阻害は、バイオフィルムの蓄積を防ぎ、その毒性を低下させる。
概要
社会で使用される医学の最も初期のモデルは、天然物(NP)に基づいていました。それ以来、人間は、薬物1に変換することができる自然界の新しい化学物質を探しています。この探索は、民族植物スクリーニング1、2、3の技術と方法の継続的な改善を引き起こした。NPは構造的に多様な物質の豊富な供給源を提供し、代替療法やアジュバント療法の開発に役立つ幅広い生物学的活動を提供しています。しかし、固有の複雑な植物マトリックスは、活性化合物の分離と同定を困難で時間のかかる作業4にします。
NPsベースの薬物または製剤は、口腔に影響を与えるいくつかの状態を予防および/または治療するために使用することができます, 歯科用虫歯を含む4.世界的に最も流行している慢性疾患の一つである齲蝕は、糖が豊富な食生活と微生物のバイオフィルム(歯垢)の相互作用に由来し、歯面に形成され、微生物代謝に由来する有機酸によって生じる脱灰化につながり、治療しなければ、歯の損失5,6を引き起こす。他の微生物は7を関連付けてもよいが、ストレプトコッカス変異体は、酸性、酸尿、および細胞外マトリックスビルダーであるため、重要な発膜性細菌である。本種は、ショ糖を基質8として使用する複数のエキソ酵素(例えば、グリコシルトランスファーゼまたはGtfs)をコードし、細胞外多糖を豊富に含む細胞外マトリックスを構築し、これは毒性決定基9である。また、カンディダ・アルビカンス菌は、その細胞外マトリックス7の産生を促進することができる。フッ化物は、様々なモダリティで投与されるが、齲蝕10を予防するための基礎であり続け、その有効性を高めるために補助剤として新しいアプローチが必要である。また、利用可能な抗プラークモダクティビティは、広域スペクトル微小bicidal剤(例えば、クロルヘキシジン)11の使用に基づいている。代替として、NPはバイオフィルムを制御し、歯の齲蝕12、13を防ぐための潜在的な治療法です。
植物からの新しい生理活性化合物の発見のさらなる進歩には、(i)植物がしばしば特異性の内在性を示すことを考慮して、サンプリングのための信頼性の高い再現可能なプロトコルの使用のような必要なステップまたはアプローチが含まれます。(ii) 小規模での包括的抽出物およびそれぞれの分画の調製。(iii) それらの化学プロファイルの特性評価および/または非複製は、GC-MS、LC-DAD-MS、またはNMRなどの多次元データの取得を考えた。(iv) 生物活性を評価するための実行可能で高収率モデルの使用。(v) 多変量データ分析またはその他の統計ツールに基づく潜在的な新しいヒットの選択。(vi)標的化合物または有望な候補の単離および精製を行う。(vii)単離化合物2,14を用いた対応した生物学的活性の検証。
デレプリケーションは、粗抽出物中の既知の化合物を迅速に同定するプロセスであり、既に研究されているものとは新しい化合物を区別することを可能にする。また、このプロセスは、生物活性が特定の化合物について既に記述されている場合の単離を防ぎ、「頻繁な打者」を検出するのに特に有用である。これは、主要な化合物同定または活動誘導分画の加速から抽出物のコレクションの化学プロファイリングまで、さまざまなターゲットを絞られていないワークフローで使用されています。CEの非標的化学プロファイリングまたは代謝産物の標的同定のためのメタボロミック研究と完全に統合することができる。このすべては、最終的に分離手順1、15、16、17の前に抽出物の優先順位付けにつながります。
そこで本稿では、植物抽出物および画分から抗菌分子および抗菌膜分子を同定するための体系的なアプローチを述べる。それは4つの学際的なステップを含んでいる:(1)植物材料のコレクション;(2)粗抽出物(CE)および分数(CEF)の調製、その後の化学プロファイル分析;(3) バイオアッセイ(4)生物・化学データ分析(図1)。そこで、ストレプトコッカス・ミュータンスおよびカンジダ・アルビカンス13に対するカゼリアシルヴェストリス抽出物および画分の抗菌・抗バイオフィルム活動を分析するために開発されたプロトコルと、植物化学的特性解析とデータ分析の手順を提示する。簡単にするために、ここでの焦点は、細菌を使用して天然化合物をスクリーニングするためのアプローチを実証することです。
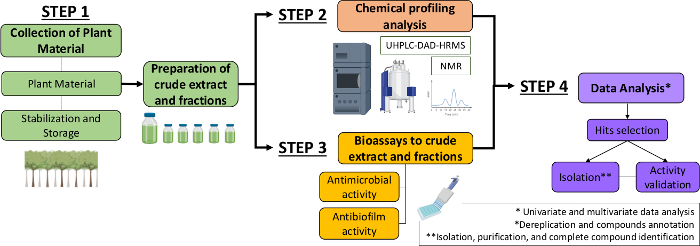
図1:植物抽出物と分画から活性分子を同定する系統的アプローチのフローチャート。この図の大きなバージョンを表示するには、ここをクリックしてください。
プロトコル
1. 植物材料の回収
- 植物材料
- コレクションが行われる国の遺伝的遺産へのアクセスを規制する電子プラットフォーム上の植物材料へのアクセスを記録します。例えば、ブラジルでは、遺伝的遺産と関連する伝統的知識の管理のための国家システムに登録する - SisGen (ウェブサイト https://sisgen.gov.br/paginas/login.aspx)。
- 目的の植物材料(例えば、葉、茎、根、花、果実)のサンプルを収集します。物質が生殖または栄養段階で収集された場合に登録します。
- 収集パラメータ(日付、ジオリファレンス、年間平均気温、平均湿度率)を記録します。
- サンプルを正確に特定し、分類学者は真正性を確認する必要があります。
- 植物サンプル安定化および貯蔵
- コレクションの直後に、個々のビニール袋またはフラスコに植物器官を分ける。
- (i)液体窒素中で直ちに凍結し、(ii)循環式エアーオーブン(40°C)で脱水するか、または(iii)凍結乾燥により試料を凍結乾燥させることにより、潜在的な酵素反応を不活性化する。
- 安定した材料は、室温または冷凍庫で密閉された袋に保管し、使用するまで(-20または-80°C、保管期間または使用目的に応じて) 保管してください。
- 分析用ミル(組織の種類や入手可能性に応じてナイフまたはボール)でサンプルを研削し、標準化されたふるいを使用して粒子サイズを標準化します。
- 以降の抽出手順に応じて、サンプルの重量を個別に測定します。
2. 化学プロファイル分析およびバイオアッセイへの粗抽出物(CE)および分数(CEF)の調製
- 粗抽出物の調製(CE)
注: 手順は図 2Aのフローチャートに示されています。- 水性アルコール混合液(例えば、エタノール(EtOH)70%または水、EtOH、および他の修飾剤の三元混合物を含む抽出溶媒を調製し、これまでの報告に従っての実験計画によって定義される。
- 溶媒の各mLに対して50〜100mgの範囲の比率サンプル重量(乾燥重量、mg)/抽出溶媒(mL)を使用してください。
- 迅速かつ再現性のある抽出には、マイクロチューブを使用してバッチ抽出を使用します。
注: 統計分析を行うためには、この時点で少なくとも 3 つの反復を使用する必要があります。 - 超音波支援抽出(UAE)を実行して、迅速かつ簡単に、安価にします。
- 最適な効率を得る場合は、この手順を 3 回(それぞれ 15 分)繰り返します。
- 各抽出工程の後、遠心分離により固形残渣をデカントし、上清を除去する。
- 上清を個別に組み合わせ、フィルター処理し、同時に化学分析とバイオアッセイのためのアリコートを保存します。必要に応じて、真空、窒素流、または凍結乾燥の下で抽出溶媒を除去し、計量と収率を登録します。
- 光から保護された-20°Cで保管してください。
注: ここでプロトコルを一時停止して CE をスクリーニングし、目的のアクティビティを提示するものを選択できます。
- 粗抽出物の分画(CEF)
注: これらの手順は図 2Bのフローチャートに示されています。- 吸着剤の少なくとも1 gとカートリッジを使用してください。アルカロイドがCEに存在する可能性がある場合は、0.1%のギ酸(FA)を含む溶媒を使用してください。
- 最も適した溶媒(または溶媒混合物)でサンプルを希釈し、100mg/mLのサンプル溶液を得る。次いで、サンプル溶液の1mLを固相抽出カートリッジ-SPE(1gの吸着剤、6 mLの容量)をあらかじめ調整した固相抽出カートリッジに移す。
- 各抽出溶出液の約3つのデッドボリュームを用いて分別を行う(1gのカートリッジに、各溶媒の2mLに相当する)。アルカロイドがCEに存在する可能性がある場合は、FAの0.1%を含む溶媒を使用してください。
- 溶出組成物によって1つの分数を収集し、同時に化学分析とバイオアッセイのためのアリコートを保存します。
- 真空、窒素流、または凍結乾燥の下で溶媒を除去し、計量と収率を登録します。
注: CE が初期溶出混合物に溶解しにくい場合は、カートリッジの上部に材料をロードする前に、固体相(例えば、C 18 またはc18 または celite)の比率で CE を分散させます。
注意: マイクロチューブを事前に計量して、抽出物と分数の質量収率を計算します。
- 化学プロファイリング分析
注:各植物種は、その化学分析のために最適化された特定の方法を必要とすることを考慮して、次のセクションでは、植物材料を分析するために使用される最も一般的な分析アプローチを説明します。実際の例として、逆相液体クロマトグラフィーを開発し、2種類の カゼリアシルヴェストリス ・スワルツ(サリカーセ)によって異なる生合成したフェノール化合物とクレロダン型ジテルペン類の同時分析のために検証されました。UPLC-DAD装置には、デガッサー、第4次ポンプ、自動サンプラー、UV-Visフォトダイオードアレイ検出器、およびオーブン(ブエノら201518.00を参照)を装備していました。以下の例に記載されている同様のアプローチは、他の植物種および/または植物材料に応じて最適化することができる。- クロマトグラフィー分析とハイフネーションの可能性
- 超高性能液体クロマトグラフィー(UPLC)を使用した分離には、互換性のある事前カラムで保護されたC18 クロマトグラフィーカラム(例えば、150×2.1mm、2.6 μm、100 Å)を使用してください。
注:他のカラムフェーズやクロマトグラフィーモードは、植物種/材料に応じて使用することができます。従来のHPLCも使用できます。その場合、適切なクロマトグラフィーカラムを選択する必要があります。優れた分離を実現するには、流量(μL/min)、カラム温度(°C)、射出量(μL)を考慮してクロマトグラフィー条件を調整します。移動相は通常、水(A)とアセトニトリルまたはメタノール(B)から成り、線形または多段階溶出勾配またはイソクラティック溶出を使用する。バッファー、酸、塩基、その他の修飾剤も使用できます。 - 植物材料分析(CEおよび/またはCEF)を実行し、利用可能なハイフネーションに応じて、スペクトルデータ(UV-Visおよび/またはMS検出器を使用)、保持時間(分)などの関連データをすべて登録します。
注: 液体クロマトグラフィー (LC) は、通常、LC-HRMS として高解像度質量分析 (HRMS) とハイフン (結合) され、CE OU CEF15で代謝産物の迅速な注釈に使用されます。 - 定性的なデータが必要で、定量的なデータが必要な場合は、同じプロトコルに従って、慎重にキャリブレーションカーブを準備し、注入します。
注:最良のクロマトグラフィー条件の開発は、Buenoら 201518、または同様の文献で記述されているように、実験の設計の助けを借りて行うことができます。メソッド開発の際には、内部標準を含めることを考慮することが重要です。サンプル調製と注入の間に正しい技術的な偏差を可能にし、データ分析のためのさらに正規化を可能にするので、彼らは非常に高く評価されています。
- 超高性能液体クロマトグラフィー(UPLC)を使用した分離には、互換性のある事前カラムで保護されたC18 クロマトグラフィーカラム(例えば、150×2.1mm、2.6 μm、100 Å)を使用してください。
- クロマトグラフィー分析とハイフネーションの可能性
- 1変量および多変量データ分析
- 登録されたクロマトグラムを適切な形式(例えば、ASCII、.txt、または.csv形式)でエクスポートします。複数のサンプルを分析する場合、クロマトグラムを結合して整列することで、1 つのデータマトリックスを設定でき、比較が必要です。得られたマトリックスは、使用される内部標準に従ってクロマトグラムを正規化する必要があります。
- 多変量および1変量法を用いて、植物のメタボロミクスデータを分析します。教師なし主成分分析 (PCA) や階層クラスター分析 (HCA) や教師付き部分最小二乗解析 (PLS、OPLS、PLS-DA など) を含む多変量統計手法を使用した複数の変数の同時分析を通じて、メタボロミクスデータセットを探索し、視覚化します。ANOVA、学生、チューキー、ウェルチのt検定などの一変量法は、サンプル19の定量的な違いを正確に分析する上で特に興味深いものです。
- レプリケーションのデレプリケーションとコンパウンドアノテーション
注: このステップの目的は、ユニまたは多変量データ分析に同時に実行できる退屈な分離を避けるために、既知のNPsの迅速なオンライン識別に専念することです。- 検出された化合物またはターゲット化合物の識別レベルを実行します。
- 完全な3D構造と立体化学(レベル0)を含む同定された化合物、
- 保持時間と MS/MS スペクトル (レベル 1) などの 2 つの直交パラメーターによって実現される識別;
- 推定アクロウンド化合物と化合物クラス(レベル2および3);
- 分析データに基づいて区別できる未確認または未分類の代謝物 (レベル 4)19,20.
- 商用データベースまたはパブリックデータベースを使用して既知のコンパウンドを特徴付けます。最も重要なデータベースの中で、それは強調することができます:NIST(https://www.nist.gov)、ワイリー(https://www.sisweb.com/software/ms/wiley.htm)、マスバンク(https://massbank.eu/MassBank/)、GMD(http://gmd.mpimp-golm.mpg.de/)、METLIN(https://metlin.scripps.edu)、および世界天然物社会分子ネットワーキング - GNPSデータベース(https://gnps.ucsd.edu)19.
注: 注釈にはさまざまなレベルがあり、研究中に採用されたハイフネーション化された手法に依存し、MS-(またはNMR)ベースのスペクトルデータベースの支援と、インリコスペクトル予測アルゴリズムが含まれる場合があります。 - 単離、精製、完全な化合物同定
注: 特定の化合物(統計的手法によって身元が疑われる)が完全な構造識別を必要とする場合、このタスクを実行する最初のステップは、より大きなスケールで目的の化合物を分離して精製することです。既に開発されたプロトコルをスケールアップすることで実現できます。- 適切に確立され、最適化された分量クロマトグラフィー技術によって、標的化合物(複数可)の迅速かつ直接的な分離を行う。乾式負荷注入による半調製HPLCは、高負荷とサンプル可溶化1の間で一般的に行う必要がある妥協を避けるために使用することができる。
- 分離された化合物の完全な構造特性と同定を行います。これは、異なる手法の組み合わせを介して行うことができます。
- 核磁気共鳴(NMR);
- 質量分析 (MS);
- 紫外線(UV)および赤外線(IR)領域における分光技術は、機能群の特性評価にも非常に有用である。
- 電子・振動循環二色(ECDおよびVCD)、ラマン光学活性(ROA)、X線結晶学などのカイ光学分光法の使用は、絶対構成特性評価のための重要な技術である。
- 検出された化合物またはターゲット化合物の識別レベルを実行します。
3. バイオアッセイ
注:生物学的スクリーニング:CEおよびCEFの潜在的な生物活性を迅速に評価するために、天然物質の初期スクリーニングを整理し、簡単にする必要があります。
- バイオアッセイのためのCEおよびCEFの調製
- 可能な限り最良の溶媒(実験的に決定することができる)で乾燥物質を再構成する。実験計画21,22は、ストック溶液および溶媒の濃度を定義する。
- ストック溶液の溶媒濃度を計算します。これを行うには、C 1 x V1 = C 2 x V2の式を使用します。 V1は溶媒の体積を表します。C2は CE および/または CEF の重みです。V2は、ストックソリューションの最終容積 (mL) です。
注:例えば、ストック溶液の溶媒濃度として84.15%のEtOHと15%のジメチルスルホキシド(DMSO)を選択しました。CEのストック濃度を6mg/mL、CEFを1mg/mL13に準備しました。CEおよびCEFを希釈する溶媒は、生物学的活性の評価方法に依存する。車両として使用される溶媒は、生物学的および毒物学的活性を妨げてはならない。典型的には、水、DMSO、EtOH、またはEtOHに基づく水性溶媒が、植物抽出物または植物誘導体4、13を可溶化するために使用される。
- 試験生物の調製
- 微生物株を再活性化する、例えばS.ミュータンスUA159血液寒天(48時間、 37°C、5%CO2)、および液体培養培地(例えば、トリプトン酵母エキスブロス[TYE:2.5%(w/v)トリプドン1.5%(w/v)酵母エキス)1%のグルコース(w/v)(TYEg)を16時間、37°C、5%CO2で培養する。
- 同じ培養培地で微生物の初期培養液の1:20希釈を行う(初期培養の希釈比は、実験計画に応じて変化してもよい)。
- 中ログ成長段階に達するまでインキュベートします。
- 抗菌アッセイ用のTYEgの定義された集団(例えば、ミリリットル当たり2x106 コロニー形成単位- CFU/mL)を有するバイオアッセイの接種を準備し、バイオフィルムアッセイの場合は1%スクロース(TYE)を用いたTYEを準備する。
注:成長条件は、試験した微生物によって異なります。
- 抗菌活性
注 : 手順は図 3に示します。- 96ウェルプレートに、CEおよび/またはCEFストック溶液(治療)のアリコート(μL)を加えます。アリコートの体積は、試験濃度によって定義され、以前の研究に基づいて選択する必要があります。例えば、0.5 mg/mL試験濃度でCEを試験するには、6mg/mLで16.67 μLのストック溶液のアリコートを使用します。この計算では、C1 x V1 = C2 x V2の式を使用し、C1 はストック濃度、V1 はストック溶液アリコートの体積、C2 はテスト濃度、V2 は 96 ウェル プレートの体積(200 μL に相当)を使用します。この実験条件では、溶媒(車両)の試験濃度は7%EtOHおよび1.25%DMSOになります。
- 各プレートのコントロールのセットを含める:治療を伴うカラム、接種なし(治療当たりのブランクコントロール、微生物の成長からそれ自体を使用する治療によって濁りを区別するのに役立ちます)。車両と接種物(CEまたはCEFまたは0 mg/mLコントロールの希釈剤)を有するカラム。培養培地のみを有するカラム(培養培地制御)と、接種物(微生物増殖制御)のみを有するカラム。
- TYEgを使用して、音量を100 μLに調整します。次に、インキュベートは、例えば、24時間、37°C、5%CO2(試験した微生物に依存する)である。
- 微生物の100 μL(1x 106 CFU/mL)を96ウェルプレートに接種します。
- ウェルの目視検査(透明または曇り)によって濁りに応じて細菌の成長を分析します。クリア:微生物の目視的な成長がないことを意味する。曇り:微生物の視覚的な成長があることを意味する。
- 各ウェル(540nmを用いたELISAリーダー)における細菌培養物の吸光度(光学密度またはO.D.)を測定する。次に、900 μL の生理液(0.89% NaCl)を含むマイクロチューブに培養物を 100 μL 転送し、ボルテックスでよく混合します。次に、目的の値になるまで10倍のシリアル希釈を続けます。
- 特定の寒天プレート(重複)で所望の希釈のアリコートを接種する。例えば、血液寒天プレート上の特定希釈液の10 μL。
- インキュベート。微生物の間で条件が変化する可能性があります, 例えば, S. ミュータンス: 48 h, 37 °C, 5%CO2.
- 後でCFU/mLに変質するためにプレート上のコロニーカウントを行う(コロニー数x10 n)/q。この式において、nは希釈の絶対値(0、1、2、または3)に等しく、qは、寒天板にメッキされた希釈液ごとにmLで、ピペット化された量に等しい。また、CFU/mL をログ値に変換することもできます。
注:植物抽出物を培養液に添加すると、抽出物からの粒子の沈殿が起こることがあります。この事実は結果を解釈するのを困難にする可能性があります。マイクロプレートリーダーが、場合によってはマイクロプレートの底に細胞が集まるように濁度を測定する場合にも同じことが起こります。また、使用する抽出物によっては、植物葉エキスの色が濁度23,24を定量することが困難になる場合がある。別の方法は、微生物細胞が代謝活性であるかどうかを明らかにする染料を使用します24.
- 抗バイオフィルム活性
注: バイオフィルム形成に対する治療の効果を評価する手順を図 4に示します。- バイオフィルムの形成と加工
- 抗菌活性プロトコルのステップに記載されているように、96ウェルプレート中の培養培地(TYE)における希薄化処理。
- プレートをインキュベートします。S.ミュータンを使用した例では、インキュベーションは24時間、37°C、および5%CO2で行われる。
- インキュベーション後、プレートを軌道シェーカー(5分、37°C、75rpm)に置き、バイオフィルムに付着していない細胞を緩めます。次いで、接着していない細胞を含む培養培地を廃棄し、残りのバイオフィルムを0.89%NaClで3回洗浄して非接着細胞を除去する。
- 処理されたバイオフィルムからのバイオマスの定量
注: 手順は図 4Aのフローチャートに示されています。- バイオフィルムをプレートに洗浄し、1%の水溶液を50μLずつ加えます。
- プレートを室温で35分間インキュベートします。
- 汚れた井戸をMilliQ水(3回)で洗い、60〜90分間空気乾燥します。
- プレートを軌道シェーカー(5分、37°C、75rpm)にインキュベートすることにより、99%EtOHの200 μLで染色されたウェルから結晶を溶出させます。
- 溶出した色素を用いて各ウェルから150μLのアリコートを別のプレートに移し、サンプルバイオマス(ELISAリーダー570nm)を定量化します。
- 処理したバイオフィルムの生菌性微生物集団(CFU/mL)の定量化
注 : この手順は、 図 4Bのフローチャートに示されています。- 洗浄したバイオフィルムをピペットと200 μLのNaCl 0.89%でプレートから取り出し、得られた懸濁液を個別に無菌マイクロチューブに移します。
- NaCl 0.89%の追加200 μLをウェルあたりに使用し、すでに初期バイオフィルムサスペンションの200 μLを含む対応するチューブに移します。このプロセスは、元のウェルあたり1 mLバイオフィルムの総懸濁液に達するまで行います。
- 各チューブからアリコートを使用して、10倍の連続希釈を行います。
- 特定の寒天プレート(重複)で所望の希釈のアリコートを接種する。例えば、血液寒天プレート上の特定希釈液の10 μL。
- 寒天プレート(例えば、48時間、37°C、5%CO2)をインキュベートし、コロニーを数えて上記のようにCFU/mLを決定する。
- バイオフィルムの形成と加工
- 生物活性検証段階
- 唾液ペリクル形成
- ヒドロキシアパタイト(HA)ビーズ(マクロ準備セラミックハイドロキシアパタイトI型I型80μm)を表面として用い、唾液膜25を形成する。これらのビーズ表面は歯科エナメル質を模倣する。
- マイクロチューブでHAビーズ(例えば、10mg)を秤量し、殺菌します。次いで、吸着バッファー(ABバッファー:50mM KCl、1 mM KPO4、1mM CaCl2、1mM MgCl2、dd-H2O、pH6.5]0.1 mMフェニルメチルスルホニルフッ化物(PMSF)および0.02%アミドナトリウム(NaN3)を使用して洗浄する。
- 収集し、人間の唾液26を準備します。制度倫理委員会の承認が必要です。
- マイクロチューブに500μLの唾液を加え、インキュベート(40分、37°C、24rpm)します。
- 次に、唾液上清を取り出し、ビーズを洗浄する(PMSF及びNaN3を含むAB緩衝液で3回)。 sHA ビーズ(唾液ペリクル付きHAビーズ)は、下流アッセイの準備が整いました。
注:唾液は健康なボランティアから収集されます。採取後、唾液(1:1 v/v)をAB緩衝液と遠心分離機(1699 x g、20分、4°C)で希釈します。濾過による滅菌(ポリエーテルサルホン膜フィルター、0.22 μmタンパク質への低結合)26.制度倫理委員会は調査を承認しなければならない。我々の場合、機関の倫理委員会は調査を承認しました(CAAE:68161417.0.0000.5416)。
- 選択した抽出物で処理されたフィルム唾液およびグルカンへの接着後の S.ミュータン の剥離
- 上記のように、中対成長期まで微生物を培養する。
- 培養物が所望のO.D.に達すると、遠心分離機(4000×g20分間)、0.89%NaCl溶液で洗浄し、同じ初期量の培養液を使用してペレットを0.89%NaClで再懸濁する。
- S.ミュータンスなどのレンサ球菌を使用する場合は、デチェインするプローブで培養物を超音波処理します(30、7 W、3回)。単一の細胞生物を使用する場合、このステップはスキップできます。
- 2 x 106 CFU/mL に濃度を調整するには、O.D. (540 nm) を確認します。
- S. ミュータン の唾液ペリクル (sHA) への付着および接着された細胞の剥離
注 : この手順は、 図 5のフローチャートに示されています。- 上記のとおり にsHA サンプルを入手する。
- 選択した処理(試験濃度で0.5 mg/mLなど)のアリコート(例では500 μLを追加)、または sHAのサンプルを含むマイクロチューブ内のコントロールを追加します。
- sHAサンプルを処理またはコントロール(30分、37°C、24 rpm)でインキュベートします。次に、ビーズをABバッファ(PMSFおよびNaN3を含む)で3回洗浄します。
- 微生物培養物を加える。この例では、各マイクロチューブに500 μLの S.ミュータンス 培養物(2 x 106 CFU/mL)を加えます。
- インキュベート(1時間、37°C、24rpm)を、ABバッファーで3回洗浄して非結合細胞を除去する。
- 各サンプルをアリコート(例では1000 μL)のABバッファと超音波処理をプローブ(30 s,7 W)で再中断します。
- 各懸濁液のアリコートを使用して、10倍の連続希釈液を使用して、特定の寒天プレート上でめっきすることによって生存可能なコロニーの数を決定する(48時間、37°C、5%CO2)。次に、上記のようにCFU/mLを決定するためにコロニーを数えます。
注:超音波処理のステップは 、sHAに付着した細胞を取り外すために行われます。
- 初期グルカンマトリックス(gsHA)へのS.ミュータンの接着と接着細胞の剥離
注 : この手順は、図 6のフローチャートに示されています。GtfB酵素を、GtfBを製造するように設計されたレンサプトコッカス・ミラーリKSB8の培養上清から精製した。精製は、2つのプロテアーゼ阻害剤(0.1 mM PMSFおよび0.02%NaN3)27,28を含有する緩衝剤を用いてヒドロキシアパタイトビーズを含むクロマトグラフィーカラムで行った。次いで、酵素をアクリルアミドゲル(SDS-PAGE)でチェックし、硝酸銀で染色した。酵素のアリコートは使用するまで−80°Cで保存した。- 上記のとおり にsHA サンプルを入手する。次に、各チューブにGtfB酵素のアリコート(例では500 μLを加える)を加え、ホモジナイザー(40分、37°C、24rpm)でインキュベートします。次いで、ABバッファ(PMSFおよびNaN3を含む)で3回洗浄する。
- 各マイクロチューブに、治療(または試験濃度でコントロール-コントロール)を含むスクロース基質(例えば、500 μL)のアリコート(例えば、500 μL)を加えます。
- ホモジナイザー(4時間、37°C、24rpm)でサンプルをインキュベートします。次いで、ABバッファ(PMSFおよびNaN3)で3回のスリングを行い、合成されたグルカンに組み込まれていないスクロースの治療および過剰量 (gsHAのサンプル)を除去する。
- 各マイクロチューブに 、S.ミュータン ズ接種(2 x 106 CFU/mL)のアリコート(例では500 μLを追加)を加えます。
- ホモジナイザー(1時間、37°C、24rpm)でインキュベートし、ABバッファー(PMSFおよびNaN3)で3回洗浄し、非結合細胞を除去する。
- 各サンプルをABバッファ(PMSFおよびNaN3)のアリコート(例えば1000 μL)で再懸濁し、プローブで超音波処理し 、gsHA(30 s,7 W)に付着した細胞を取り外します。
- 各懸濁液のアリコートを使用して、10倍の連続希釈液を使用して、特定の寒天プレート上でめっきすることによって生存可能なコロニーの数を決定する(48時間、37°C、5%CO2)。次に、上記のようにCFU/mLを決定するためにコロニーを数えます。
- 唾液ペリクル形成
4. 生物データ解析
- バイオアッセイデータ
- スプレッドシートにバイオアッセイの生データを入力します。各処理による微生物増殖阻害のログを計算する(A CFU/mLの治療 + 1)x log10。次いで、微生物増殖阻害の対数割合を算出し、(Alog10 CFU/mLの処置/平均Alog10 CFU/mLの車両制御)x 100%を用いた車両制御と比較した。
- 治療(CEおよびCEF処理群)および車両制御(陰性対照)によって処理されたプランクトニック培養およびバイオマスの正しいO.D.。補正のために、培養培地(Ablank)のみを含むウェル(A処置群培地 /A陰性対照培地)x 100%から得られたものから処理されたウェルの吸光度を差し引く。
- この補正後、バイオマス阻害の割合を算出し、車両制御と比較して(A処理したバイオマス/平均A車種制御)x100%とする。
- 特定のソフトウェアを使用してデータの統計分析のために生成された生データを送信します。
メモ: 特定の処理の有効性の解釈は、IC50/IC90などのブレークポイントを使用して決定されます。これらの値は、細菌の増殖またはバイオフィルム形成24の50%および90%をそれぞれ阻害し得る治療の最小濃度として定義される。これらのパラメータは、データを解釈するのに役立ち、より良い活性を持つ化合物を選択するための基礎を提供します13,29.
結果
我々は、植物抽出物および分画の生物学的活性をスクリーニングする体系的なアプローチを用いて、新しい抗齲虫療法の可能性のある活性分子を同定する例を提供する:ストレプトコッカス・ミュータンスおよびカンジダ・アルビカンス13に対するブラジルの異なるバイオームからのカゼリアシルベストリス抽出物の抗菌および抗バイオフィルム活性。
...ディスカッション
天然の粗抽出物の研究に関連する主な課題は、その複雑な組成と古典的な生体誘導分離研究の不十分さから成り立っています。このプロセスは遅いですが,効果的であり,NP研究における主要な知見につながっています。合理化には、優先順位付け主導型の研究が必要です。したがって、分離前のCEおよび非複製の分析のための現代の化学プロファイリングアプローチの使用は、研究された材料?...
開示事項
利益相反は宣言されていません。
謝辞
植物材料の製造研究所を提供してくれたアララクアラ/SPのUNESP化学研究所のヌクレオ・デ・バイオレジオジオス、バイオスシンテーゼ・エ・エコフィシオロジア・デ・プロドゥトス・ナチュラワ(NuBBE)に感謝の意を表します。また、アララクアラ/SPの歯学・補生学科応用微生物学研究室に感謝します。この研究は、サンパウロ研究財団(FAPESP #2013/07600-3からAJC)の研究助成金と、奨学金に加えてオーバーヘッド資金(FAPESP #2017/07408-6およびFAPESP #2019/23175-7からSMR #2012 #2011への研究助成金によって支えられました。FAPESPに関連する国家科学技術開発評議会は追加の支援を提供しました(INCT CNPq #465637/2014-0およびFAPESP #2014/50926-0をAJCに)。
資料
| Name | Company | Catalog Number | Comments |
| 96-well microplates | Kasvi | Flat bottom | |
| Activated carbon | LABSYNTH | Clean up and/or fractionation step | |
| Analytical mill | Ika LabortechniK | Model A11 Basic | |
| Blood agar plates | Laborclin | ||
| Chromatographic column C18 | Phenomenex Kinetex | 150 × 2.1 mm, 2.6 µm, 100Â | |
| Dimethyl sulfoxide | Sigma-Aldrich | Vehicle solution | |
| ELISA plate reader | Biochrom Ez | ||
| Ethanol | J. T. Baker | For extraction and fractionation steps, and mobile phase composition | |
| Ethanol | Sigma-Aldrich | Vehicle solution | |
| Ethyl acetate | J. T. Baker | Fractionation step | |
| GraphPad Software | La Jolla | GraphPad Prism7 | |
| Hexane | J. T. Baker | Fractionation step | |
| Incubator | Thermo Scientific | ||
| Isopropanol | J. T. Baker | For extraction step | |
| Lyophilizer (a freeze dryer) | Savant | Modulyo | |
| Nylon Millipore | LAC | 0.22 µm x 13 mm | |
| Orbital shaker | Quimis | Model G816 M20 | |
| Polyamide solid phase extraction cartridge | Macherey-Nagel | Clean up and/or fractionation step | |
| Silica gel | Merck | 40–63 μm, 60 Â | |
| Sodium Chloride (NaCl) | Synth | 0,89% in water | |
| Solid phase extraction cartridges (SPE) | Macherey-Nagel | Clean up and/or fractionation step | |
| Tryptone | Difco | ||
| UHPLC-DAD | Dionex | Ultimate 3000 RS | |
| Ultrasonic bath | UNIQUE | Model USC 2800 | |
| Yeast extract | Difco |
参考文献
- Newman, D. J., Cragg, G. M. Natural Products as Sources of New Drugs over the Nearly Four Decades from 01/1981 to 09/2019. Journal of Natural Products. 83 (3), 770-803 (2020).
- Wolfender, J. L., Litaudon, M., Touboul, D., Queiroz, E. F. Innovative omics-based approaches for prioritisation and targeted isolation of natural products – new strategies for drug discovery. Natural Product Report. 36 (6), 855-868 (2019).
- Michel, T., Halabalaki, M., Skaltsounis, A. New Concepts, Experimental Approaches, and Dereplication Strategies for the Discovery of Novel Phytoestrogens from Natural Sources. Planta Medica. 79 (7), 514-532 (2013).
- Jeon, J. G., Rosalen, P. L., Falsetta, M. L., Koo, H. Natural products in caries research: current (limited) knowledge, challenges and future perspective. Caries Research. 45 (3), 243-263 (2011).
- Tonetti, M. S., Jepsen, S., Jin, L., Otomo-Corgel, J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. Journal of Clinical Periodontology. 44 (5), 456-462 (2017).
- Peres, M. A., et al. Oral diseases: a global public health challenge. Lancet. 394 (10194), 249-260 (2019).
- Bowen, W. H., Burne, R. A., Wu, H., Koo, H. Oral biofilms: pathogens, matrix, and polymicrobial interactions in microenvironments. Trends Microbiology. 26 (3), 229-242 (2018).
- Paes Leme, A. F., Koo, H., Bellato, C. M., Bedi, G., Cury, J. A. The role of sucrose in cariogenic dental biofilm formation--new insight. Journal of Dental Research. 85 (10), 878-887 (2006).
- Koo, H., Falsetta, M. L., Klein, M. I. The exopolysaccharide matrix: a virulence determinant of cariogenic biofilm. Journal of Dental Research. 92 (12), 1065-1073 (2013).
- Cury, J. A., de Oliveira, B. H., dos Santos, A. P., Tenuta, L. M. Are dental fluoride releasing materials clinically effective on caries control. Dental Materials. 32 (3), 323-333 (2016).
- Mattos-Graner, R. O., Klein, M. I., Smith, D. J. Lessons Learned from Clinical Studies: Roles of Mutans Streptococci in the Pathogenesis of Dental Caries. Current Oral Health Reports. 1, 70-78 (2014).
- Rocha, G. R., Florez Salamanca, E. J., de Barros, A. L., Lobo, C. I. V., Klein, M. I. Effect of tt-farnesol and myricetin on in vitro biofilm formed by Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 18 (1), 61 (2018).
- Ribeiro, S. M., et al. Antimicrobial and antibiofilm activities of Casearia sylvestris extracts from distinct Brazilian Biomes against Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 19 (1), 308 (2019).
- Pilon, A. C., et al. Metabolômica de plantas: métodos e desafios. Quimica Nova. 43 (3), 329-354 (2020).
- Wolfender, J. L., Nuzillard, J. M., Hooft, J. J. J., Renault, J. H., Bertrand, S. Accelerating Metabolite Identification in Natural Product Research: Toward an Ideal Combination of Liquid Chromatography-High-Resolution Tandem Mass Spectrometry and NMR Profiling, in Silico Databases, and Chemometrics. Analytical Chemistry. 91 (1), 704-742 (2019).
- Allard, P. M., et al. Pharmacognosy in the digital era: shifting to contextualized metabolomics. Current opinion in biotechnology. 54, 57-64 (2018).
- Hubert, J., Nuzillard, J., Renault, J. Dereplication strategies in natural product research: How many tools and methodologies behind the same concept. Phytochemistry Reviews. 16, 55-95 (2017).
- Bueno, P. C. P., Pereira, F. M. V., Torres, R. B., Cavalheiro, A. J. Development of a comprehensive method for analysing clerodane-type diterpenes and phenolic compounds from Casearia sylvestris Swartz (Salicaceae) based on ultra-high performance liquid chromatography combined with chemometric tools. Journal of separation science. 38 (10), 1649-1656 (2015).
- Bueno, P. C. P., Lopes, N. P. Metabolomics to Characterize Adaptive and Signaling Responses in Legume Crops under Abiotic Stresses. American Chemical Society omega. 5 (4), 1752-1763 (2020).
- Blaženović, I., Kind, T., Ji, J., Fiehn, O. Software tools and approaches for compound identification of LC-MS/MS data in metabolomics. Metabolites. 8 (2), 31 (2018).
- Eloff, J. N. Quantifying the bioactivity of plant extracts during screening and bioassay-guided fractionation. Phytomedicine: International Journal Of Phytotherapy And Phytopharmacology. 11 (4), 370-371 (2004).
- Rios, J. L., Recio, M. C. Medicinal plants and antimicrobial activity. Journal of Ethnopharmacology. 100 (1-2), 80-84 (2005).
- Eloff, J. N. A sensitive and quick microplate method to determine the minimal inhibitory concentration of plant extracts for bacteria. Planta Medica. 64, 711-714 (1998).
- Eloff, J. N. Avoiding pitfalls in determining antimicrobial activity of plant extracts and publishing the results. BMC Complementary and Alternative Medicine. 19 (1), 106 (2019).
- Klein, M. I., Xiao, J., Heydorn, A., Koo, H. An analytical tool-box for comprehensive biochemical, structural and transcriptome evaluation of oral biofilms mediated by mutans streptococci. Journal of Visualized Experiments. (47), e2512 (2011).
- Lemos, J. A., Abranches, J., Koo, H., Marquis, R. E., Burne, R. A. Protocols to study the physiology of oral biofilms. Methods in molecular biology. 666, 87-102 (2010).
- Venkitaraman, A. R., Vacca-Smith, A. M., Kopec, L. K., Bowen, W. H. Characterization of glucosyltransferase B, GtfC, and GtfD in solution and on the surface of hydroxyapatite. Journal of Dental Research. 74, 1695-1701 (1995).
- Vacca-Smith, A. M., Venkitaraman, A. R., Quivey, R. G., Bowen, W. H. Interactions of streptococcal glucosyltransferases with alpha-amylase and starch on the surface of saliva-coated hydroxyapatite. Archives of Oral Biology. 41, 291-298 (1996).
- Van Dijck, P., et al. Methodologies for in vitro and in vivo evaluation of efficacy of antifungal and antibiofilm agents and surface coatings against fungal biofilms. Microbial Cell. 5 (7), 300-326 (2018).
- Marsh, P. D. Are dental diseases examples of ecological catastrophes. Microbiology. 149 (2), 279-294 (2003).
- Bowen, W. H., Koo, H. Biology of Streptococcus mutans-derived glucosyltransferases: role in extracellular matrix formation of cariogenic biofilms. Caries Research. 45 (1), 69-86 (2011).
- Lobo, C. I. V., et al. Dual-species biofilms of Streptococcus mutans and Candida albicans exhibit more biomass and are mutually beneficial compared with single-species biofilms. Journal of Oral Microbioly. 11 (1), 1581520 (2019).
- Kim, D., et al. Candida albicans stimulates Streptococcus mutans microcolony development via crosskingdom biofilm-derived metabolites. Scientific reports. 7, 41332 (2017).
- Ferreira, P. M. Folk uses and pharmacological properties of Casearia sylvestris: a medicinal review. Anais da Academia Brasileira de Ciencias. 83 (4), 1373-1384 (2011).
- Xia, L., Guo, Q., Tu, P., Chai, X. The genus Casearia: a phytochemical and pharmacological overview. Phytochemistry Reviews. 14, 99-135 (2015).
- Ferreira, P. M. P., et al. Toxicological findings about an anticancer fraction with casearins described by traditional and alternative techniques as support to the Brazilian Unified Health System (SUS). Journal of Ethnopharmacol. 15, 241 (2019).
- Koo, H., Xiao, J., Klein, M. I., Jeon, J. G. Exopolysaccharides produced by Streptococcus mutans glucosyltransferases modulate the establishment of microcolonies within multispecies biofilms. Journal of Bacteriology. 192 (12), 3024-3032 (2010).
- Maske, T. T., van de Sande, F. H., Arthur, R. A., Huysmans, M. -. C. D. N. J. M., Cenci, M. S. In vitro biofilm models to study dental caries: a systematic review. Biofouling. 33 (8), 661-675 (2017).
- Fu, Y., Luo, J., Qin, J., Yang, M. Screening techniques for the identification of bioactive compounds in natural products. Journal of Pharmaceutical and Biomedical Analysis. 168, 189-200 (2019).
- Sarker, S. D., Nahar, L. An introduction to natural products isolation. Methods in molecular biology. 864, 1-25 (2012).
- Clinical Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing; twenty-fifth informational supplement. Clinical Laboratory Standards Institute (CLSI). , (2015).
- Saputo, S., Faustoferri, R. C., Quivey, R. G. A drug repositioning approach reveals that Streptococcus mutans is susceptible to a diverse range of established antimicrobials and nonantibiotics. Antimicrobial Agents and Chemotherapy. 62 (1), 01674 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved