JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
식물의 추출물과 분획에서 새로운 항균 및 항바이오필름 분자를 식별하여 치과 용 충치를 방지하기 위한 체계적인 접근법
* 이 저자들은 동등하게 기여했습니다
요약
천연 제품은 신약 및 치료제 개발을 위한 유망한 출발점을 나타냅니다. 그러나, 높은 화학 다양성으로 인해, 식물에서 새로운 치료 화합물을 찾는 것은 도전적이고 시간이 많이 소요되는 작업입니다. 우리는 식물 추출물과 분획에서 항균 및 항바이오필름 분자를 식별하는 단순화된 접근법을 설명합니다.
초록
천연 제품은 구조적으로 다른 물질을 제공하며 무수한 생물학적 활동을 제공합니다. 그러나, 식물에서 활성 화합물의 식별 및 격리는 복잡한 식물 매트릭스와 시간이 많이 소요되는 격리 및 식별 절차 때문에 도전적입니다. 따라서, 잠재적으로 활성 분자의 격리 및 식별을 포함하여 식물에서 천연 화합물을 선별하기 위한 단계적 접근법이 제시된다. 식물 재료의 수집을 포함한다; 원유 추출물의 준비 및 분별; 크로마토그래피 및 분광법(UHPLC-DAD-HRMS 및 NMR) 분석 및 화합물 식별을 위한 접근법; 생체 분석 (항균 및 항바이오필름 활동; 타액 펠리클 및 초기 글루칸 매트릭스에 대한 세균 "접착 강도"가 선택된 치료법으로 치료됨); 데이터 분석. 이 모델은 간단하고 재현 가능하며 여러 화합물, 농도 및 치료 단계의 고처리량 스크리닝을 일관되게 제어할 수 있습니다. 얻어진 데이터는 미생물 세포 및 생물막에 있는 특정 표적으로 분자를 모델링하는 가장 능동적인 추출물 및/또는 분수, 분자의 격리를 가진 제형을 포함하여 미래 연구 결과를 위한 기초를 제공합니다. 예를 들어, 카리오겐 생물막을 제어하는 한 가지 표적은 세포외 매트릭스의 글루칸을 합성하는 연쇄상 구균 뮤탄의 활성을 억제하는 것이다. 그 효소의 억제는 생물막 축적을 방지, 그것의 독성을 감소.
서문
사회에서 사용되는 의학의 초기 모델은 천연 제품 (NP)을 기반으로했다. 그 이후로, 인간은 약물1로변환 될 수있는 자연에서 새로운 화학 물질을 찾고있다. 이 검색은 윤리학적 스크리닝1,2,3에대한 기술과 방법의 지속적인 개선을 일으켰다. NPs는 대체 또는 보조 요법을 개발하는 데 유용한 광범위한 생물학적 활동과 함께 구조적으로 다양한 물질의 풍부한 공급원을 제공합니다. 그러나, 내재된 복잡한 식물 매트릭스는 활성 화합물의 격리 및 식별을 도전적이고 시간이 많이 소요되는 작업4로만든다.
NPs 기반 약물 또는 제형은 치과 충치4를포함하여 경구에 영향을 미치는 여러 조건을 예방 및/또는 치료하는 데 사용될 수 있다. 전 세계적으로 가장 널리 퍼진 만성 질환 중 하나인 치과용 충치는 미생물 대사로부터 유래된 유기산에 의한 탈염을 유발하는 치아 표면에 형성된 설탕이 풍부한 식단과 미생물 생물막(치피플라)의 상호작용으로부터 유래하며, 치료하지 않으면 치아 손실5,6로이어집니다. 다른 미생물은7, 연쇄상 구균 뮤탄은 산성, 산성 및 세포외 매트릭스 빌더이기 때문에 중요한 카리오겐 성 박테리아입니다. 이 종은기판으로 자당을 사용하는 다발성 효소 (예를 들어, 글리코실 전달효소 또는 Gtfs)를 인코딩하여 발성 결정제9인외폴리당산에 풍부한 세포외 매트릭스를 구축합니다. 또한, 곰팡이 칸디다 알비칸스는 세포 외 매트릭스7의생산을 구동 할 수 있습니다. 다양한 양식으로 투여되는 불소이기는 하지만 치과 충치방지의기초가 남아 있으며, 그 효과를 높이기 위해 보조제로 새로운 접근법이 필요합니다. 또한, 사용 가능한 플라크 방지 양식은 광범위한 스펙트럼 미생물제(예를 들어, 클로레헨시딘)11의사용을 기반으로 한다. 대안으로, NPs는 생물막을 통제하고 치과 충치를 방지하기위한 잠재적 인 치료법이다12,13.
식물에서 새로운 생리 활성 화합물의 발견에 추가 사전은 필요한 단계 또는 접근 방식을 포함: (i) 샘플링에 대 한 신뢰할 수 있는 재현 프로토콜의 사용, 식물 종종 특이 적 가변성을 표시 고려; (ii) 포괄적인 추출물및 그 각각의 분획을 작은 규모로 제조; (iii) 그들의 화학 프로파일의 특성화 및/또는 복제는 GC-MS, LC-DAD-MS 또는 NMR과 같은 다차원 데이터의 획득을 예를 들어, (iv) 생체 활성을 평가하기 위해 실행 가능한 고수익 모델의 사용; (v) 다변량 데이터 분석 또는 기타 통계 도구를 기반으로 잠재적인 새로운 조회수 선택; (vi) 표적 화합물 또는 유망한 후보자의 격리 및 정화를 수행하기 위해; 및 (vii) 격리된화합물을이용한 대응하는 생물학적 활동의 유효성검사2,14.
복제는 원유 추출물에서 알려진 화합물을 신속하게 식별하는 과정이며 이미 연구된 화합물과 새로운 화합물을 분화할 수 있습니다. 게다가, 이 프로세스는 생체 활성이 이미 특정 화합물에 대해 설명된 때 격리를 방지하고, 특히 "빈번한 타자"를 검출하는 것이 도움이됩니다. 주요 화합물 식별 또는 활동 유도 분수의 가속도에서 추출 컬렉션의 화학 프로파일링에 이르기까지 다양한 미표적 워크플로우에 사용되었습니다. 그것은 완전히 CE의 표적 화학 프로파일링 또는 대사 산물의 표적 식별에 대 한 metabolomic 연구와 통합 될 수 있습니다. 이 모든 것은 궁극적으로 격리절차1,15, 16,17전에 추출의 우선 순위를 지정하는 것으로 이어집니다.
따라서, 본 원고에서는 식물 추출물 및 분획으로부터 항균 및 항바이오막 분자를 식별하는 체계적인 접근법을 설명한다. 그것은 네 개의 종합 단계를 포함: (1) 식물 재료의 수집; (2) 원유 추출물(CE) 및 분획(CEF)의 제제, 그 다음으로 화학물질 프로파일 분석; (3) 바이오아세이스; (4) 생물학적 및 화학적 데이터분석(그림 1). 따라서, 우리는 연쇄상 구균 뮤탄및 칸디다 알비칸스(13)에대한 카카타리아 실베스트리스 추출물 및 분획의 항균 및 항바이오필름 활동을 분석하기 위해 개발된 프로토콜뿐만 아니라 식물화학적 특성화 및 데이터 분석을 위한 절차를 제시한다. 단순성을 위해, 여기에서 초점은 박테리아를 사용하여 천연 화합물을 선별하기위한 접근 방식을 입증하는 것입니다.
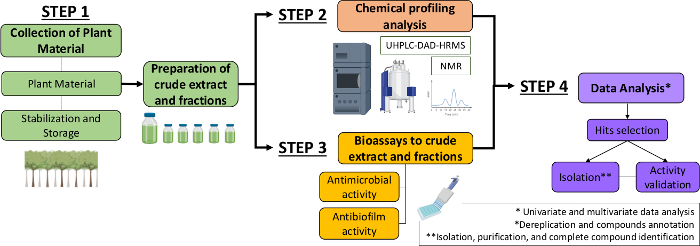
그림 1: 식물 추출물 및 분수에서 활성 분자를 식별하는 체계적인 접근법의 흐름 차트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
1. 식물 재료의 수집
- 식물 재료
- 수집이 이루어지는 국가의 유전 유산에 대한 액세스를 규제하는 전자 플랫폼에서 식물 재료에 대한 액세스를 기록합니다. 예를 들어, 브라질에서는 유전 유산 및 관련 전통 지식 관리를 위한 국가 시스템에 등록 - SisGen (웹 사이트 https://sisgen.gov.br/paginas/login.aspx).
- 관심있는 식물 재료의 샘플을 수집합니다 (예 : 잎, 줄기, 뿌리, 꽃, 과일). 생식 또는 식물 단계 중에 재료가 수집되었는지 등록하십시오.
- 수집 매개 변수(날짜, 지리 참조, 연평균 온도 및 평균 습도 백분율)를 기록합니다.
- 샘플을 정확하게 식별하고 분류학자는 진위를 확인해야 합니다.
- 플랜트 샘플 안정화 및 저장
- 개별 비닐 봉지에 식물 장기를 분리하거나 수집 직후 플라스크.
- (i) 액체 질소에서 즉시 동결, (ii) 순환 공기 오븐에서 탈수(40°C), 또는 (iii) 동결 건조시 류생술반응에 의해 잠재적 인 효소 반응을 비활성화하여 리소필화에 의한 시료를 동결한다.
- 안정화된 재료를 실온 또는 냉동고에 보관하여 사용할 때까지 보관하십시오(-20 또는 -80°C, 저장 기간 또는 의도된 사용에 따라).
- 분석 밀 (조직 유형 또는 가용성에 따라 칼 이나 공)에서 샘플을 분쇄 하 고 표준화 된 체를 사용 하 여 입자 크기를 표준화.
- 후속 추출 단계에 대해 샘플을 개별적으로 계량합니다.
2. 화학 물질 프로파일 분석 및 바이오아세이스에 대한 원유 추출물(CE) 및 분수(CEF) 제제
- 원유 추출물 준비 (CE)
참고: 단계는 그림 2A의흐름 차트에 설명되어 있습니다.- 수중 알코올 혼합물 (예를 들어, 에탄올 (EtOH) 70 % 또는 이전 보고서에 따른 실험 설계에 의해 정의 된 다른 수정기의 대동맥 혼합물을 사용하여 추출 용매를 준비합니다.
- 용매의 각 mL에 대해 50 에서 100 mg까지 다양한 비율 샘플 중량 (건조 중량, mg)/ 추출 용매 (mL)를 사용합니다.
- 빠르고 재현 가능한 추출을 위해 마이크로튜브를 사용하여 배치 추출을 사용하십시오.
참고: 통계 분석을 허용하려면 이 시점에서 적어도 세 개의 복제본을 사용해야 합니다. - 빠르고 쉽고 저렴하게 초음파 보조 추출 (UAE)을 수행하십시오.
- 최상의 효율성을 위해 세 번(각 15분)을 반복합니다.
- 각 추출 단계 후, 원심분리에 의해 고체 잔류물을 데칭하고 상체를 제거합니다.
- 수퍼네이너티를 개별적으로 결합하고, 필터를 적용하고, 알리쿼트에 저장하여 동시 화학 분석 및 생체 분석에 대해 다. 필요한 경우 진공, 질소 흐름 또는 lyophilization 하에서 추출 용매를 제거하고 계량 및 수율을 등록하십시오.
- -20°C에 저장하여 빛으로부터 보호합니다.
참고: 프로토콜을 일시 중지하여 CE를 검사하고 원하는 활동을 표시하는 프로토콜을 선택할 수 있습니다.
- 원유 추출물의 분획(CEF)
참고: 단계는 그림 2B의흐름 차트에 설명되어 있습니다.- 흡착제가 1g 이상인 카트리지를 사용하십시오. 알칼로이드가 CE에 잠재적으로 존재하는 경우, 포믹산 (FA)의 0.1 %를 포함하는 용매를 사용합니다.
- 100 mg/mL 샘플 용액을 얻기 위해 가장 적합한 용매(또는 용매 혼합물)에서 샘플을 희석시 희석시. 그런 다음, 샘플 용액의 1mL을 사전 조절된 고체 단계 추출 카트리지-SPE(흡착1g, 용량 6mL)으로 전송한다.
- 각 추출 용출물의 약 3개의 데드 볼륨을 사용하여 분획을 수행합니다(1g의 카트리지에 각 용매의 2mL에 해당합니다). 알칼로이드가 CE에 잠재적으로 존재하는 경우, FA의 0.1 %를 포함하는 용매를 사용합니다.
- 용액 조성에 의해 하나의 분수를 수집하고 동시 화학 분석 및 생체 분석을 위해 알리쿼트를 저장합니다.
- 진공, 질소 흐름 또는 lyophilization하에서 용매를 제거하고 계량 및 수율을 등록합니다.
참고: CE가 초기 용출 혼합물에서 용해하기 어려운 경우, 카트리지 상단에 재료를 적재하기 전에 1:1(w/w) 비율로 고체 상(예를 들어, C18 또는 celite)으로 CE를 분산시한다.
주의: 마이크로튜브를 미리 계량하여 추출물과 분수의 질량 수율을 계산합니다.
- 화학 프로파일링 분석
참고: 각 식물 종은 화학 분석을 위해 최적화되고 구체적인 방법이 필요하다는 점을 고려하여 다음 섹션에서 는 식물 물질을 분석하는 데 사용되는 가장 일반적인 분석 방법을 설명합니다. 실용적인 예로, 카카리아실바리스 스와츠(Salicaceae)의 2종에 의해 분화된 페놀 화합물과 클레로단형 디테르펜의 동시 분석을 위해 역상 액체 크로마토그래피를 개발 및 검증하였다. UPLC-DAD 장치에는 드가저, 쿼터니얼 펌프, 자동 샘플러, UV-Vis 포토다이오드 어레이 검출기 및 오븐이 장착되어 있습니다(Bueno et al. 201518의세부 정보 참조). 다음 예에 기재된 유사한 접근법은 다른 식물 종 및/또는 식물 재료에 따라 최적화될 수 있다.- 크로마토그래피 분석 및 최면 가능성
- 초고성능 액체 크로마토그래피(UPLC)를 사용하여 분리하려면 호환되는 프리 컬럼으로 보호되는 C18 크로마토그래피 컬럼(예: 150 × 2.1mm, 2.6 μm, 100 Å)을 사용하십시오.
참고: 다른 컬럼 상 또는 크로마토그래피 모드는 식물 종/재료에 따라 사용할 수 있습니다. 종래의 HPLC도 사용할 수 있습니다. 이 경우 적절한 크로마토그래피 컬럼을 선택해야 합니다. 우수한 분리를 달성하기 위해 유량(μL/min), 컬럼 온도(°C), 사출 부피(μL)를 고려하여 크로마토그래피 조건을 조정합니다. 이동 상은 일반적으로 선형 또는 다단계 용출 그라데이션 또는 이소크레틱 용출을 사용하여 물 (A) 및 아세토닐 또는 메탄올 (B)으로 구성됩니다. 완충제, 산, 염기 등과 같은 수정자도 사용할 수 있습니다. - 플랜트 재료 분석(CE 및/또는 CEF)을 수행하고 사용 가능한 최면에 따라 스펙트럼 데이터(UV-Vis 및/또는 우선적으로, MS 검출기 사용), 보존 시간(분) 등과 같은 모든 관련 데이터를 등록합니다.
참고: 액체 크로마토그래피(LC)는 일반적으로 LC−HRMS로서 고해상도 질량 분석법(HRMS)과 하이픈(결합)이며, CE OU CEF15에서대사산물의 신속한 주석에 일반적으로 사용된다. - 정성적 데이터가 필요하고 정량적 데이터가 필요한 경우 동일한 프로토콜에 따라 교정 곡선을 신중하게 준비하고 주입합니다.
참고: 최고의 크로마토그래피 조건의 개발은 Bueno 외. 2015년 18또는 유사한 문헌에 의해 설명된 바와 같이 실험의 디자인의 도움으로 수행 될 수있다. 방법 개발 중에 내부 표준을 포함하는 것을 고려하는 것이 중요합니다. 그들은 샘플 준비 및 주사 동안 올바른 기술적 편차를 허용하고 데이터 분석을위한 추가 정규화를 허용하기 때문에 매우 감사합니다.
- 초고성능 액체 크로마토그래피(UPLC)를 사용하여 분리하려면 호환되는 프리 컬럼으로 보호되는 C18 크로마토그래피 컬럼(예: 150 × 2.1mm, 2.6 μm, 100 Å)을 사용하십시오.
- 크로마토그래피 분석 및 최면 가능성
- 데이터 분석 간변량 및 다변량
- 등록된 크로마토그램을 적절한 형식으로 내보냅니다(예: ASCII, .txt 또는 .csv 형식). 여러 샘플을 분석하고 비교가 필요한 경우 크로마토그램에 결합하고 정렬하여 단일 데이터 매트릭스를 설정할 수 있습니다. 생성된 행렬은 사용되는 내부 표준에 따라 크로마토그램을 정규화해야 합니다.
- 다변량 및 단변형 방법을 사용하여 식물 메타볼로믹스 데이터를 분석합니다. 감독되지 않은 주 성분 분석(PCA) 및 계층 적 클러스터링 분석(HCA) 또는 감독된 부분 최소 제곱 분석(예: PLS, OPLS, PLS-DA)을 포함하여 다변변량 통계 방법을 사용하여 다변량 통계 방법을 사용하여 메타볼로믹스 데이터 집합을 탐색하고 시각화합니다. ANOVA, 학생, 투키 및 웰치의 t-테스트와 같은 Univariate 메서드는 특히 샘플19간의 정량적 차이의 정확한 분석에 특히 흥미롭습니다.
- 복제 및 화합물 성모
참고: 이 단계의 목적은 알려진 NP의 신속한 온라인 식별에 전념하여 단일 또는 다변량 데이터 분석에 동시에 수행할 수 있는 지루한 격리를 방지합니다.- 검출된 화합물 또는 표적 화합물의 식별 수준을 수행합니다.
- 전체 3D 구조 및 스테레오케미케(레벨 0)를 포함한 확인된 화합물;
- 보존 시간 및 MS/MS 스펙트럼(레벨 1)과 같은 두 개의 직교 매개 변수에 의해 달성된 식별;
- 푸티에 의해 부가 된 화합물 및 화합물 클래스 (레벨 2 및 3);
- 분석 데이터(레벨 4)19,20을기반으로 분화될 수 있는 미확인 또는 분류되지 않은 대사산물.
- 상용 또는 공용 데이터베이스를 사용하여 알려진 화합물을 특성화합니다. 가장 중요한 데이터베이스 중에서도 NIST(https://www.nist.gov), 와일리(https://www.sisweb.com/software/ms/wiley.htm), 매스뱅크(https://massbank.eu/MassBank/), GMD(http://gmd.mpimp-golm.mpg.de/), 메틀린(https://metlin.scripps.edu), 글로벌 천연제품 소셜 분자 네트워킹 – GNPS 데이터베이스(https://gnps.ucsd.edu)19.
참고: 주석의 다른 수준이 있고 연구 도중 에 채택된 하이픈 기술에 의존하고 있습니다: MS-(또는 NMR) 기반 스펙트럼 데이터베이스의 지원, 실리코 스펙트럼 예측 알고리즘. - 격리, 정제 및 완전한 화합물 식별
참고: 주어진 화합물(통계적 방법에 의해 신원이 의심됨)이 완전한 구조적 식별이 필요한 경우, 이 작업을 수행하는 첫 번째 단계는 원하는 화합물을 더 큰 규모로 분리하고 정화하는 것입니다. 이미 개발된 프로토콜을 확장하여 수행할 수 있습니다.- 미리 확립되고 최적화된 전소 크로마토그래피 기술에 의해 표적 화합물(들)의 신속하고 직접적인 절연을 수행한다. 건조 부하 주입을 사용한 반전성 HPLC를 사용하여 일반적으로 높은 하중과 시료 용해화1사이에 수행해야 하는 절충안을 피할 수 있다.
- 격리된 화합물의 완전한 구조적 특성화 및 식별을 달성합니다. 이것은 다른 기술의 조합을 통해 이루어질 수 있습니다:
- 핵 자기 공명 (NMR);
- 질량 분석법 (MS);
- 자외선(UV) 및 적외선(IR) 영역에서분광 기술은 기능성 기의 특성화에도 매우 유용하다;
- 전자 및 진동 원형 이색성(ECD 및 VCD), 라만 광학 활동(ROA), X선 결정과 같은 치광학 분광학의 사용은 절대 구성 특성화를 위한 중요한 기술입니다.
- 검출된 화합물 또는 표적 화합물의 식별 수준을 수행합니다.
3. 바이오아세이스
참고: 생물학적 선별: CE 및 CEF의 잠재적 인 생체 활성을 신속하게 평가하기 위해 천연 물질의 초기 선별을 조직하고 간단해야합니다.
- 바이오아세이스용 CE및CEF 준비
- 최상의 용매(실험적으로 결정될 수 있음)로 건조 물질을 재구성합니다. 실험설계(21),22는 용매의 스톡 용액 및 농도를 정의한다.
- 스톡 솔루션의 용매 농도를 계산합니다. 이렇게 하려면 C1 x V1 = C 2 x V2, C1이 CE 및/또는 CEF의 주식 용액(mg)을 나타내는 수식을 사용합니다. V1은 용매의 부피를 나타낸다. C2는 CE 및/또는 CEF의 중량; V2는 주식 솔루션의 최종 볼륨(mL)입니다.
참고: 예를 들어, 우리는 재고 용액의 용매 농도로 84.15 % EtOH 및 15 % 디메틸 설프리산화물 (DMSO)을 선택했습니다. CE의 재고 농도를 6 mg/mL로, CEF는 1 mg/mL13까지준비하였다. CE 및 CEF를 희석하는 용매는 생물학적 활성의 평가 방법에 의존한다. 차량으로 사용되는 용매는 생물학적 및 독성 활동을 방해해서는 안됩니다. 전형적으로, 물, DMSO, EtOH, 또는 EtOH에 기초한 수성 용매는 식물 추출물 또는 식물 유도체4,13을용해시키는 데 사용된다.
- 시험 유기체의 준비
- 혈액 한천에 예를 들어 미생물 균주를 다시 활성화 (48 h, 37°C, 5%CO2),액체 배양 배지(예를 들어, 트립톤 효모 추출물 국물 [TYE: 2.5% (w/v) 1.5%(w/v) 효모 추출물]을 함유한 1%의 포도당(w/v) (TYEg)를 함유한 16시간, 37°C, 5%CO2로배양한다.
- 동일한 배양 배지에서 미생물의 초기 배양의 1:20 희석을 수행한다(초기 배양의 희석 비율은 실험 설계에 따라 변경될 수 있음).
- 중간 로그 성장 단계에 도달할 때까지 배양합니다.
- 생물학적 필름 에세이를 위한 1% 자당(w/v)(TYE)을 위한 항균 저술 및 TYE를 위해 티에그의 정의된 인구(예를 들어, 밀리리터당 2x106 콜로니 형성 단위- CFU/mL)를 가진 생체분해를 위한 접종을 준비한다.
참고: 성장 조건은 테스트된 미생물에 따라 달라집니다.
- 항균 활성
참고: 단계는 그림 3에설명되어 있습니다.- 96웰 플레이트에서 CE 및/또는 CEF 스톡 용액(치료)의 알리쿼트(μL)를 추가합니다. aliquot의 부피는 이전 연구에 따라 선택해야 하는 시험 농도에 의해 정의됩니다. 예를 들어, 0.5 mg/mL 시험 농도에서 CE를 테스트하려면 6 mg/mL에서 스톡 용액의 16.67 μL 알리쿼트를 사용하십시오. 이 계산을 위해, C1 x V1 = C 2 x V2,C1이 주식 농도인 경우, V1은 스톡 용액 알리쿼트의 부피, C 2는 시험 농도이고 V 2는 96웰 플레이트의 부피(200 μL에 해당)를 사용한다. 이러한 실험 조건에서, 용매(vehicle)의 시험 농도는 7%EtOH 및 1.25% DMSO가 될 것이다.
- 각 플레이트에 대한 컨트롤 세트를 포함하십시오: 치료용 컬럼이 없는 컬럼(치료당 빈 대조군, 미생물 성장에서 자체적으로 사용되는 치료에 의한 탁도분화하는 데 도움이 됨); 차량 및 무분비(CE 또는 CEF 또는 0 mg/mL 제어의 희석제); 배양 배지(배양 배지 제어) 및 무접종(미생물 성장 제어)만 있는 컬럼이 있는 컬럼.
- TYEg를 사용하여 부피를 100 μL로 조정합니다. 다음으로, 인큐베이션, 예를 들어, 24h, 37°C, 5%CO2(시험된 미생물에 따라다).
- 미생물 접종(1x 106 CFU/mL)의 100 μL을 96웰 플레이트에 접종합니다.
- 우물 (명확하거나 흐린)의 육각 검사에 의해 탁도에 따라 세균 성장을 분석합니다. 명확한: 미생물의 시각적 성장이 없다는 것을 의미합니다. 흐린: 미생물의 시각적 성장이 있음을 의미합니다.
- 각 우물에서 세균 배양의 흡광도(광학 밀도 또는 O.D.)를 측정한다(540nm를 사용하는 ELISA 판독기). 다음으로, 배양물의 100 μL을 900μL의 식염수 용액(0.89% NaCl)을 포함하는 마이크로튜브로 전송하여 소용돌이에 잘 섞는다. 다음으로 원하는 값까지 10배의 직렬 희석을 계속 수행합니다.
- 특정 한천 판에서 원하는 희석의 알리쿼트(중복)를 접종한다. 예를 들어, 혈액 천판에 대한 특정 희석의 10 μL.
- 인큐베이션. 조건은 미생물, 예를 들어, S. 뮤탄: 48h, 37 °C, 5 % CO 2 사이에 변경할 수있습니다.
- CFU/mL로 나중에 변환하기 위해 플레이트에콜로니 카운트를 수행합니다(식민지 수 x 10 n)/q. 이 수식에서,n은 희석(0, 1, 2 또는 3)의 절대값과 같고, q는 agar 플레이트상에 도금된 각 희석에 대해 배관된 mL의 양과 같습니다. 또한 CFU/mL을 로그 값으로 변환할 수 있습니다.
참고: 식물 추출물이 배양 배지에 첨가되면 추출물로부터 입자의 침전이 발생할 수 있습니다. 이 사실은 결과를 해석하기 어렵게 만들 수 있습니다. 마이크로 플레이트 판독기가 탁도를 측정할 때, 어떤 경우에는 세포가 마이크로 플레이트의 바닥에 뭉쳐있을 때 동일한 일이 발생합니다. 또한, 사용되는 추출물에 따라 식물 잎 추출물의 색은탁도(23,24)를정량화하기 어렵게 만들 수 있다. 다른 방법은 미생물 세포가 대사적으로 활성화되어 있는지 여부를 밝히는 염료를 사용하며24.
- 항바이오필름 활성
참고: 생물막 형성에 대한 치료법의 효과를 평가하는 단계는 도 4에나와 있다.- 생물막의 형성 및 처리
- 항균 활성 프로토콜의 단계에 설명된 바와 같이 배양 배지(TYEs)에서 처리를 희석시키는 96-웰 플레이트에서.
- 접시를 배양합니다. S. 뮤탄을 가진 예에서, 인큐베이션은 24시간 동안, 37°C에서, 및 5% CO2에서수행된다.
- 인큐베이션 후, 플레이트를 궤도 셰이커(5분, 37°C, 75rpm)에 배치하여 생물막에 부착되지 않은 세포를 풀어줍니다. 이어서, 부착되지 않은 세포를 함유한 배양 배지를 버리고, 나머지 생물막을 0.89%로 3회 세척하여 비부착세포를제거한다.
- 처리된 생물막에서 바이오매스의 정량화
참고: 단계는 그림 4A의흐름 차트에 설명되어 있습니다.- 접시에 세척 된 생물막을 유지하고 각 우물에 1 % 크리스탈 바이올렛 수성 용액의 50 μL을 추가합니다.
- 35 분 동안 실온에서 접시를 배양.
- 염색된 우물을 밀리크 워터(3회)로 씻은 다음 공기가 60-90분 동안 건조합니다.
- 피진 된 우물에서 크리스탈 바이올렛을 99 % EtOH의 200 μL로 궤도 셰이커 (5 분, 37 °C, 75 rpm)로 배양합니다.
- 용출염염을 각각 잘 하여 150μL 알리쿼트를 다른 플레이트로 옮기고 시료 바이오매스(ELISA 리더 570 nm)를 정량화한다.
- 처리된 생물막의 실행 가능한 미생물 집단(CFU/mL)의 정량화
참고: 단계는 그림 4B의흐름 차트에 설명되어 있습니다.- 플레이트에서 세척된 생물막과 NaCl00 μL0.89%를 제거하고 그 결과 서스펜션을 개별적으로 이송하여 미생물튜브를 멸균합니다.
- 우물당 0.89%의 200 μL을 추가로 사용하여 초기 생물막 현탁액의 200 μL을 이미 포함하는 해당 튜브로 이송하십시오. 원래 우물당 1mL 의 총 정지에 도달 할 때까지이 과정을 수행합니다.
- 각 튜브의 알리쿼트(aliquot)를 사용하여 10배 의 연속 희석을 수행합니다.
- 특정 한천 판에서 원하는 희석의 알리쿼트(중복)를 접종한다. 예를 들어, 혈액 천판에 대한 특정 희석의 10 μL.
- 식기 플레이트(예: 48h, 37°C, 5%CO2)를배양한 다음, 상기와 같이 CFU/mL을 결정하기 위해 식민지를 계산한다.
- 생물막의 형성 및 처리
- 생물학적 활성 검증 단계
- 타액 펠리클 형성
- 하이드록시아파티테(HA) 구슬(매크로-프렙 세라믹 하이드록시아파티트 타입 I 80 μm)을 표면으로 사용하여 타액필름(25)을형성한다. 이 구슬 표면은 치과 에나멜을 모방합니다.
- 마이크로튜브에서 HA 구슬(예: 10 mg)의 무게를 측정하고 살균합니다. 이어서, 흡착 버퍼(AB 버퍼: 50mM KCl, 1mM KPO4,1mM CaCl2,1mM MgCl2,dd-H2O, pH 6.5]250.1 mM 페닐메틸술폰실 플루오라이드(PMSF) 및 0.02%의 나트륨(Naads)을 사용한다.
- 수집 및 인간의 타액을 준비26. 제도윤리위원회의 승인을 받아야 합니다.
- 마이크로튜브에 500 μL의 타액을 넣고 배양(40분, 37°C, 24rpm)을 배양합니다.
- 다음으로, 타액 상체를 제거하고 구슬을 씻는다(PMSF 및 NaN3을포함하는 AB 버퍼로 세 번). sHA 구슬 (타액 펠리클HA 구슬)은 이제 다운스트림 분석에 대한 준비가되어 있습니다.
참고: 타액은 건강한 자원봉사자들로부터 수집됩니다. 수집 후 AB 버퍼 및 원심분리기(1699 x g, 20분, 4°C)로 타액(1: 1 v/v)을 희석합니다. 여과(0.22 μm 단백질에 대한 낮은 결합을 가진 폴리예테술폰 멤브레인 필터)에 의해 살균한다26. 제도윤리위원회는 반드시 연구를 승인해야 한다. 우리의 경우, 기관의 윤리위원회는 연구를 승인 (CAAE: 68161417.0000.5416).
- 선택한 추출물로 처리된 필름 타액 및 글루칸에 부착한 후 S. 뮤탄분리
- 위에서 설명한 바와 같이 중간 로그 성장 단계까지 미생물을 육성한다.
- 문화가 원하는 O.D., 원심분리기(4000× g20분)에 도달하면 0.89%의 NaCl 용액으로 세척하고 배양 배지의 동일한 초기 부피를 사용하여 0.89%의 NaCl로 펠릿을 재보종한다.
- S. 뮤탄과같은 연쇄상 구균을 사용하는 경우, 사슬을 쇠사슬하는 프로브로 배양을 초음파처리한다(30s, 7 W, 3회). 단일 세포 유기체를 사용하는 경우 이 단계를 건너뛸 수 있습니다.
- 농도를 2 x 106 CFU/mL로 조정하려면 O.D.(540 nm)를 확인하십시오.
- 침질 충리클(sHA)에 대한 S. 뮤탄의 접착 및 부착된 세포의 분리
참고: 단계는 그림 5의흐름 차트에 설명되어 있습니다.- 위에서 설명한 바와 같이 sHA 샘플을 가져옵니다.
- 선택한 치료법(예: 시험 농도, 예: 0.5 mg/mL)의 알리쿼트(예: 500 μL)를 추가하거나 sHA샘플을 포함하는 마이크로튜브의 컨트롤을 추가합니다.
- sHA 샘플을 치료 또는 대조군(30분, 37°C, 24rpm)으로 배양합니다. 그런 다음 AB 버퍼(PMSF 및 NaN3포함)로 구슬을 세 번 세척합니다.
- 미생물 배양을 추가합니다. 이 예에서는 각 마이크로튜브에 500 μL의 S. 뮤탄 배양(2 x 106 CFU/mL)을 추가합니다.
- 인큐베이션 (1 h, 37 °C, 24 rpm) 다음 AB 버퍼로 세 번 세척하여 언바운드 셀을 제거합니다.
- 각 샘플을 aliquot(예에서 AB 버퍼 1000 μL)로 다시 중단하고 프로브(30s, 7W)로 초음파 처리합니다.
- 10배 의 일련 희석을 위해 각 서스펜션의 알리쿼트(aliquot)를 사용하여 특정 한천 판(48h, 37°C, 5%CO2)에도금하여 실행 가능한 콜로니의 수를 결정한다. 다음으로, 위에서 설명한 바와 같이 CFU/mL을 결정하기 위해 식민지를 계산합니다.
참고: 초음파 처리 단계는 sHA에부착 된 세포를 분리하기 위해 수행됩니다.
- 초기 글루칸매트릭스(gsHA)에 대한 S. 뮤탄의 접착 및 부착된 세포의 분리
참고: 단계는 그림 6의흐름 차트에 설명되어 있습니다. GtfB 효소는 GtfB를 생산하도록 설계된 배양 상류층 의 스테레토코커스 밀러리 KSB8에서 정제되었다. 정제는 2개의 프로테아제 억제제(0.1 mM PMSF 및 0.02% NaN3)27,28을포함하는 완충제를 사용하여 하이드록샤파티테 구슬을 포함하는 크로마토그래피 컬럼으로 수행되었다. 이어서, 효소는 아크릴아미드 젤(SDS-PAGE)에서 검사되었고 은 질산염으로 염색하였다. 효소의 알리쿼트들은 사용전까지 -80°C에 저장하였다.- 위에서 설명한 바와 같이 sHA 샘플을 가져옵니다. 다음으로, 각 튜브에 GtfB 효소의 알리쿼트(예시, 500 μL)를 추가하고 균질화(40분, 37°C, 24rpm)로 배양한다. 그런 다음 AB 버퍼(PMSF 및 NaN3포함)로 세 번 세척합니다.
- 각 마이크로튜브에 치료(또는 시험 농도, 예를 들어 0.5 mg/mL)를 포함하는 자당 기판(sucrose의 100mmol)의 알리쿼트(예를 들어, 500 μL)를 추가한다.
- 균질화제(4h, 37°C, 24rpm)에서 샘플을 배양한다. 이어서, 합성글루칸(gsHA의샘플)에 통합되지 않은 치료 및 자당의 과잉을 제거하기 위해 AB 버퍼(PMSF 및 NaN3)로3개의 세척을 수행한다.
- 각 마이크로튜브에 S. 뮤탄 접종(2 x 106 CFU/mL)의 알리쿼트(예: 500 μL)를 추가합니다.
- 균질화제(1h, 37°C, 24rpm)에서 배양하고 AB 버퍼(PMSF 및 NaN3)로세 번 세척하여 언바운드 셀을 제거합니다.
- AB 버퍼(PMSF 및 NaN3포함)의 알리쿼트(예를 들어, 1000 μL)로 각 샘플을 재연하고 gsHA(30s, 7W)에 부착된 세포를 분리하는 프로브로 초음파 처리합니다.
- 10배 의 일련 희석을 위해 각 서스펜션의 알리쿼트(aliquot)를 사용하여 특정 한천 판(48h, 37°C, 5%CO2)에도금하여 실행 가능한 콜로니의 수를 결정한다. 다음으로, 위에서 설명한 바와 같이 CFU/mL을 결정하기 위해 식민지를 계산합니다.
- 타액 펠리클 형성
4. 생물학적 데이터 분석
- 바이오아세이데이터
- 스프레드시트에 생체 분석에 대한 원시 데이터를 입력합니다. 각 치료법에 의한 미생물 성장 억제의 로그를계산(A CFU/mL 의 치료 + 1) x 로그(10). 이어서, 차량제어(Alog10 CFU/mL 의 처리/평균Alog10 CFU/mL 의 차량 제어)를사용하여 미생물 성장 억제의 로그 백분율을 계산합니다.
- 치료(CE 및 CEF 처리군)와 차량 제어(음성 제어)에 의해 처리된 판자 배양 및 바이오매스의 올바른 O.D. 보정을 위해, 배양 배지(Ablank)만 포함하는 우물에서 얻은 우물로부터 처리된 우물의 흡광도를 빼는 것으로(처리된 그룹 배지/A 음성 제어 배지)x 100%.
- 이 보정 후, 차량 제어에 비해 바이오매스 억제의 비율을계산(처리된 바이오매스/평균A차량 제어)x 100%.
- 특정 소프트웨어를 사용하여 데이터의 통계 분석을 위해 생성된 원시 데이터를 제출합니다.
참고: 주어진 치료의 효과에 대한 해석은 IC50/IC 90과같은중단점을 사용하여 결정됩니다. 이들 값은 세균 성장 또는 생물막형성(24)의각각 50% 및 90%를 억제할 수 있는 치료의 최소 농도로 정의된다. 이러한 매개 변수는 데이터를 해석하고 더 나은활동(13,29)을가진 화합물을 선택하는 기초를 제공하는 데 도움이 될 수 있다.
결과
우리는 가능한 새로운 항 충치 요법에 대한 잠재적으로 활성 분자를 식별하기 위해 식물 추출물과 분획의 생물학적 활성을 선별하는 체계적인 접근 방식을 사용하는 예를 제공합니다 : 연쇄상 구균 뮤탄과 칸디다 알비칸스13에대한 뚜렷한 브라질 생물군계에서 카카리아 실베스트리스 추출물의 항균 및 항바이오필름 활동.
배경
토론
천연 원유 추출물과 관련된 주요 과제는 복잡한 구성과 고전적인 바이오 유도 격리 연구의 부적절성으로 구성됩니다. 이 과정은 느리지만 효과적이며 NP 연구에서 주요 연구 결과를 초래했습니다. 합리화하려면 우선 순위 지정 중심의 연구가 합리화될 필요가 있습니다. 따라서, 격리 전에 CE 및 복제의 분석을 위한 현대 화학 프로파일링 접근법의 사용은 연구된 물질을 특성화하는 것이 중요하며, ...
공개
이해 상충이 선언되지 않았습니다.
감사의 말
우리는 Núcleo de Bioensaios, Biossíntese e Ecofisiologia de Produtos Naturais (NuBBE) UNESP의 화학 연구소의, 아라라쿠라 / SP에 식물 재료 제조를위한 실험실을 제공하는 것에 감사드립니다. 우리는 또한 치과 재료 및 보조동학과의 응용 미생물학 실험실, UNESP, 아라라 쿼라 / SP에 감사드립니다. 이 연구는 상파울루 연구 재단 (FAPESP #2013/07600-3 AJC)과 장학금 플러스 오버 헤드 펀드 (FAPESP #2017/07408-6 및 FAPESP #2019/23175-7 SMR; #2011/21440-3 및 #2012/21921-4PB)의 연구 보조금에 의해 지원되었습니다. FAPESP와 관련하여 국립 과학 기술 개발 위원회는 추가 지원을 제공 (INCT CNPq #465637/2014-0 및 FAPESP #2014/50926-0 AJC에).
자료
| Name | Company | Catalog Number | Comments |
| 96-well microplates | Kasvi | Flat bottom | |
| Activated carbon | LABSYNTH | Clean up and/or fractionation step | |
| Analytical mill | Ika LabortechniK | Model A11 Basic | |
| Blood agar plates | Laborclin | ||
| Chromatographic column C18 | Phenomenex Kinetex | 150 × 2.1 mm, 2.6 µm, 100Â | |
| Dimethyl sulfoxide | Sigma-Aldrich | Vehicle solution | |
| ELISA plate reader | Biochrom Ez | ||
| Ethanol | J. T. Baker | For extraction and fractionation steps, and mobile phase composition | |
| Ethanol | Sigma-Aldrich | Vehicle solution | |
| Ethyl acetate | J. T. Baker | Fractionation step | |
| GraphPad Software | La Jolla | GraphPad Prism7 | |
| Hexane | J. T. Baker | Fractionation step | |
| Incubator | Thermo Scientific | ||
| Isopropanol | J. T. Baker | For extraction step | |
| Lyophilizer (a freeze dryer) | Savant | Modulyo | |
| Nylon Millipore | LAC | 0.22 µm x 13 mm | |
| Orbital shaker | Quimis | Model G816 M20 | |
| Polyamide solid phase extraction cartridge | Macherey-Nagel | Clean up and/or fractionation step | |
| Silica gel | Merck | 40–63 μm, 60 Â | |
| Sodium Chloride (NaCl) | Synth | 0,89% in water | |
| Solid phase extraction cartridges (SPE) | Macherey-Nagel | Clean up and/or fractionation step | |
| Tryptone | Difco | ||
| UHPLC-DAD | Dionex | Ultimate 3000 RS | |
| Ultrasonic bath | UNIQUE | Model USC 2800 | |
| Yeast extract | Difco |
참고문헌
- Newman, D. J., Cragg, G. M. Natural Products as Sources of New Drugs over the Nearly Four Decades from 01/1981 to 09/2019. Journal of Natural Products. 83 (3), 770-803 (2020).
- Wolfender, J. L., Litaudon, M., Touboul, D., Queiroz, E. F. Innovative omics-based approaches for prioritisation and targeted isolation of natural products – new strategies for drug discovery. Natural Product Report. 36 (6), 855-868 (2019).
- Michel, T., Halabalaki, M., Skaltsounis, A. New Concepts, Experimental Approaches, and Dereplication Strategies for the Discovery of Novel Phytoestrogens from Natural Sources. Planta Medica. 79 (7), 514-532 (2013).
- Jeon, J. G., Rosalen, P. L., Falsetta, M. L., Koo, H. Natural products in caries research: current (limited) knowledge, challenges and future perspective. Caries Research. 45 (3), 243-263 (2011).
- Tonetti, M. S., Jepsen, S., Jin, L., Otomo-Corgel, J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. Journal of Clinical Periodontology. 44 (5), 456-462 (2017).
- Peres, M. A., et al. Oral diseases: a global public health challenge. Lancet. 394 (10194), 249-260 (2019).
- Bowen, W. H., Burne, R. A., Wu, H., Koo, H. Oral biofilms: pathogens, matrix, and polymicrobial interactions in microenvironments. Trends Microbiology. 26 (3), 229-242 (2018).
- Paes Leme, A. F., Koo, H., Bellato, C. M., Bedi, G., Cury, J. A. The role of sucrose in cariogenic dental biofilm formation--new insight. Journal of Dental Research. 85 (10), 878-887 (2006).
- Koo, H., Falsetta, M. L., Klein, M. I. The exopolysaccharide matrix: a virulence determinant of cariogenic biofilm. Journal of Dental Research. 92 (12), 1065-1073 (2013).
- Cury, J. A., de Oliveira, B. H., dos Santos, A. P., Tenuta, L. M. Are dental fluoride releasing materials clinically effective on caries control. Dental Materials. 32 (3), 323-333 (2016).
- Mattos-Graner, R. O., Klein, M. I., Smith, D. J. Lessons Learned from Clinical Studies: Roles of Mutans Streptococci in the Pathogenesis of Dental Caries. Current Oral Health Reports. 1, 70-78 (2014).
- Rocha, G. R., Florez Salamanca, E. J., de Barros, A. L., Lobo, C. I. V., Klein, M. I. Effect of tt-farnesol and myricetin on in vitro biofilm formed by Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 18 (1), 61 (2018).
- Ribeiro, S. M., et al. Antimicrobial and antibiofilm activities of Casearia sylvestris extracts from distinct Brazilian Biomes against Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 19 (1), 308 (2019).
- Pilon, A. C., et al. Metabolômica de plantas: métodos e desafios. Quimica Nova. 43 (3), 329-354 (2020).
- Wolfender, J. L., Nuzillard, J. M., Hooft, J. J. J., Renault, J. H., Bertrand, S. Accelerating Metabolite Identification in Natural Product Research: Toward an Ideal Combination of Liquid Chromatography-High-Resolution Tandem Mass Spectrometry and NMR Profiling, in Silico Databases, and Chemometrics. Analytical Chemistry. 91 (1), 704-742 (2019).
- Allard, P. M., et al. Pharmacognosy in the digital era: shifting to contextualized metabolomics. Current opinion in biotechnology. 54, 57-64 (2018).
- Hubert, J., Nuzillard, J., Renault, J. Dereplication strategies in natural product research: How many tools and methodologies behind the same concept. Phytochemistry Reviews. 16, 55-95 (2017).
- Bueno, P. C. P., Pereira, F. M. V., Torres, R. B., Cavalheiro, A. J. Development of a comprehensive method for analysing clerodane-type diterpenes and phenolic compounds from Casearia sylvestris Swartz (Salicaceae) based on ultra-high performance liquid chromatography combined with chemometric tools. Journal of separation science. 38 (10), 1649-1656 (2015).
- Bueno, P. C. P., Lopes, N. P. Metabolomics to Characterize Adaptive and Signaling Responses in Legume Crops under Abiotic Stresses. American Chemical Society omega. 5 (4), 1752-1763 (2020).
- Blaženović, I., Kind, T., Ji, J., Fiehn, O. Software tools and approaches for compound identification of LC-MS/MS data in metabolomics. Metabolites. 8 (2), 31 (2018).
- Eloff, J. N. Quantifying the bioactivity of plant extracts during screening and bioassay-guided fractionation. Phytomedicine: International Journal Of Phytotherapy And Phytopharmacology. 11 (4), 370-371 (2004).
- Rios, J. L., Recio, M. C. Medicinal plants and antimicrobial activity. Journal of Ethnopharmacology. 100 (1-2), 80-84 (2005).
- Eloff, J. N. A sensitive and quick microplate method to determine the minimal inhibitory concentration of plant extracts for bacteria. Planta Medica. 64, 711-714 (1998).
- Eloff, J. N. Avoiding pitfalls in determining antimicrobial activity of plant extracts and publishing the results. BMC Complementary and Alternative Medicine. 19 (1), 106 (2019).
- Klein, M. I., Xiao, J., Heydorn, A., Koo, H. An analytical tool-box for comprehensive biochemical, structural and transcriptome evaluation of oral biofilms mediated by mutans streptococci. Journal of Visualized Experiments. (47), e2512 (2011).
- Lemos, J. A., Abranches, J., Koo, H., Marquis, R. E., Burne, R. A. Protocols to study the physiology of oral biofilms. Methods in molecular biology. 666, 87-102 (2010).
- Venkitaraman, A. R., Vacca-Smith, A. M., Kopec, L. K., Bowen, W. H. Characterization of glucosyltransferase B, GtfC, and GtfD in solution and on the surface of hydroxyapatite. Journal of Dental Research. 74, 1695-1701 (1995).
- Vacca-Smith, A. M., Venkitaraman, A. R., Quivey, R. G., Bowen, W. H. Interactions of streptococcal glucosyltransferases with alpha-amylase and starch on the surface of saliva-coated hydroxyapatite. Archives of Oral Biology. 41, 291-298 (1996).
- Van Dijck, P., et al. Methodologies for in vitro and in vivo evaluation of efficacy of antifungal and antibiofilm agents and surface coatings against fungal biofilms. Microbial Cell. 5 (7), 300-326 (2018).
- Marsh, P. D. Are dental diseases examples of ecological catastrophes. Microbiology. 149 (2), 279-294 (2003).
- Bowen, W. H., Koo, H. Biology of Streptococcus mutans-derived glucosyltransferases: role in extracellular matrix formation of cariogenic biofilms. Caries Research. 45 (1), 69-86 (2011).
- Lobo, C. I. V., et al. Dual-species biofilms of Streptococcus mutans and Candida albicans exhibit more biomass and are mutually beneficial compared with single-species biofilms. Journal of Oral Microbioly. 11 (1), 1581520 (2019).
- Kim, D., et al. Candida albicans stimulates Streptococcus mutans microcolony development via crosskingdom biofilm-derived metabolites. Scientific reports. 7, 41332 (2017).
- Ferreira, P. M. Folk uses and pharmacological properties of Casearia sylvestris: a medicinal review. Anais da Academia Brasileira de Ciencias. 83 (4), 1373-1384 (2011).
- Xia, L., Guo, Q., Tu, P., Chai, X. The genus Casearia: a phytochemical and pharmacological overview. Phytochemistry Reviews. 14, 99-135 (2015).
- Ferreira, P. M. P., et al. Toxicological findings about an anticancer fraction with casearins described by traditional and alternative techniques as support to the Brazilian Unified Health System (SUS). Journal of Ethnopharmacol. 15, 241 (2019).
- Koo, H., Xiao, J., Klein, M. I., Jeon, J. G. Exopolysaccharides produced by Streptococcus mutans glucosyltransferases modulate the establishment of microcolonies within multispecies biofilms. Journal of Bacteriology. 192 (12), 3024-3032 (2010).
- Maske, T. T., van de Sande, F. H., Arthur, R. A., Huysmans, M. -. C. D. N. J. M., Cenci, M. S. In vitro biofilm models to study dental caries: a systematic review. Biofouling. 33 (8), 661-675 (2017).
- Fu, Y., Luo, J., Qin, J., Yang, M. Screening techniques for the identification of bioactive compounds in natural products. Journal of Pharmaceutical and Biomedical Analysis. 168, 189-200 (2019).
- Sarker, S. D., Nahar, L. An introduction to natural products isolation. Methods in molecular biology. 864, 1-25 (2012).
- Clinical Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing; twenty-fifth informational supplement. Clinical Laboratory Standards Institute (CLSI). , (2015).
- Saputo, S., Faustoferri, R. C., Quivey, R. G. A drug repositioning approach reveals that Streptococcus mutans is susceptible to a diverse range of established antimicrobials and nonantibiotics. Antimicrobial Agents and Chemotherapy. 62 (1), 01674 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유