A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
العزل والتقييم الوظيفي للخلايا الجذعية لسرطان الثدي البشري من عينات الخلايا والأنسجة
In This Article
Summary
يصف هذا البروتوكول التجريبي عزل BCSCs من عينات خلايا وأنسجة سرطان الثدي بالإضافة إلى المقايسات في المختبر وفي الجسم الحي التي يمكن استخدامها لتقييم النمط الظاهري ووظيفة BCSC.
Abstract
الخلايا الجذعية لسرطان الثدي (BCSCs) هي خلايا سرطانية ذات خصائص شبيهة بالخلايا الجذعية الموروثة أو المكتسبة. على الرغم من تواترها المنخفض ، إلا أنها تساهم بشكل رئيسي في بدء سرطان الثدي والانتكاس وورم خبيث ومقاومة العلاج. من الضروري فهم بيولوجيا الخلايا الجذعية لسرطان الثدي من أجل تحديد أهداف علاجية جديدة لعلاج سرطان الثدي. يتم عزل الخلايا الجذعية لسرطان الثدي وتمييزها بناء على التعبير عن علامات سطح الخلية الفريدة مثل CD44 و CD24 والنشاط الأنزيمي لنازعة هيدروجين الألدهيد (ALDH). تشكل خلايا ALDHعاليةCD44 + CD24- مجموعة BCSC ويمكن عزلها عن طريق فرز الخلايا المنشط بالفلور (FACS) للدراسات الوظيفية النهائية. اعتمادا على السؤال العلمي ، يمكن استخدام طرق مختلفة في المختبر وفي الجسم الحي لتقييم الخصائص الوظيفية ل BCSCs. هنا ، نقدم بروتوكولا تجريبيا مفصلا لعزل BCSCs البشرية من كل من المجموعات غير المتجانسة من خلايا سرطان الثدي وكذلك أنسجة الورم الأولية التي تم الحصول عليها من مرضى سرطان الثدي. بالإضافة إلى ذلك ، نسلط الضوء على المصب في المقايسات الوظيفية في المختبر وفي الجسم الحي بما في ذلك فحوصات تشكيل المستعمرة ، ومقايسات الغلاف الجوي ، ونماذج ثقافة 3D ومقايسات الكسب غير المشروع للورم التي يمكن استخدامها لتقييم وظيفة BCSC.
Introduction
يعد فهم الآليات الخلوية والجزيئية للخلايا الجذعية البشرية لسرطان الثدي (BCSCs) أمرا بالغ الأهمية لمواجهة التحديات التي تواجه علاج سرطان الثدي. يعود ظهور مفهوم BCSC إلىأوائل القرن الحادي والعشرين ، حيث تم العثور على عدد صغير من خلايا سرطان الثدي CD44 + CD24 / منخفضة قادرة على توليد أورام غير متجانسة في الفئران 1,2. بعد ذلك ، لوحظ أن خلايا سرطان الثدي البشرية ذات النشاط الأنزيمي العالي لنازعة هيدروجين الألدهيد (ALDHhigh) أظهرت أيضا خصائص مماثلة تشبه الخلايا الجذعية3. تمثل هذه BCSCs مجموعة صغيرة من الخلايا القادرة على التجديد الذاتي والتمايز ، مما يساهم في الطبيعة غير المتجانسة للأورام السائبة1،2،3. تشير الأدلة المتراكمة إلى أن التغييرات في مسارات الإشارات المحفوظة تطوريا تدفع بقاء BCSC وصيانته4،5،6،7،8،9،10،11،12،13،14 . بالإضافة إلى ذلك ، فقد ثبت أن البيئة المكروية الخارجية للخلية تلعب دورا محوريا في إملاء وظائف BCSC المختلفة15،16،17. تساهم هذه المسارات الجزيئية والعوامل الخارجية التي تنظم وظيفة BCSC في انتكاس سرطان الثدي ، ورم خبيث18 وتطوير مقاومة للعلاجات19،20،21 ، مع الوجود المتبقي ل BCSCs بعد العلاج الذي يشكل تحديا كبيرا للبقاء على قيد الحياة بشكل عام لمرضى سرطان الثدي22،23 . لذلك فإن التقييم قبل السريري لهذه العوامل مهم جدا لتحديد العلاجات التي تستهدف BCSC والتي يمكن أن تكون مفيدة لتحقيق نتائج علاجية أفضل وتحسين البقاء على قيد الحياة بشكل عام لدى مرضى سرطان الثدي.
تم استخدام العديد من نماذج خط خلايا سرطان الثدي البشرية في المختبر ونماذج xenograft البشرية في الجسم الحي لتوصيف BCSCs24،25،26،27،28،29. إن قدرة خطوط الخلايا على إعادة الملء باستمرار بعد كل مقطع متتالي تجعلها نظاما نموذجيا مثاليا لإجراء دراسات قائمة على الأوميكس والصيدلة الجينية. ومع ذلك ، غالبا ما تفشل خطوط الخلايا في تلخيص عدم التجانس الذي لوحظ في عينات المرضى. وبالتالي ، من المهم استكمال بيانات خط الخلية بعينات مشتقة من المريض. يعد عزل BCSCs في أنقى صورها أمرا مهما لتمكين التوصيف التفصيلي ل BCSCs. يعتمد تحقيق هذا النقاء على اختيار علامات النمط الظاهري الخاصة ب BCSCs. حاليا ، يستخدم النمط الظاهريللخليةALDH CD44 + CD24 المرتفع بشكل شائع لتمييز وعزل BCSCs البشرية عن مجموعات خلايا سرطان الثدي السائبة باستخدام فرز الخلايا المنشط مضان (FACS) لتحقيق أقصى قدر من النقاء1 ، 3,26. علاوة على ذلك ، يمكن تقييم خصائص BCSCs المعزولة مثل التجديد الذاتي والانتشار والتمايز باستخدام تقنيات في المختبر وفي الجسم الحي.
على سبيل المثال ، يمكن استخدام فحوصات تشكيل مستعمرة في المختبر لتقييم قدرة خلية واحدة على التجديد الذاتي لتشكيل مستعمرة من 50 خلية أو أكثر في وجود ظروف علاج مختلفة30. يمكن أيضا استخدام فحوصات الماموسفير لتقييم إمكانات التجديد الذاتي لخلايا سرطان الثدي في ظل ظروف مستقلة عن المرساة. يقيس هذا الفحص قدرة الخلايا المفردة على التوليد والنمو ككرات (خليط من BCSCs وغير BCSCs) في كل ممر متتالي في ظروف الاستزراع غير الملتصقة الخالية من المصل31. بالإضافة إلى ذلك ، يمكن استخدام نماذج الثقافة ثلاثية الأبعاد (3D) لتقييم وظيفة BCSC ، بما في ذلك تفاعلات الخلية الخلوية ومصفوفة الخلية التي تلخص عن كثب البيئة المكروية في الجسم الحي وتسمح بالتحقيق في نشاط العلاجات المحتملة التي تستهدف BCSC32. على الرغم من التطبيقات المتنوعة للنماذج في المختبر ، من الصعب نمذجة تعقيد الظروف في الجسم الحي باستخدام المقايسات في المختبر فقط. يمكن التغلب على هذا التحدي باستخدام نماذج xenograft للفأر لتقييم سلوك BCSC في الجسم الحي. على وجه الخصوص ، تعمل هذه النماذج كنظام مثالي لتقييم ورم خبيث لسرطان الثدي 33 ، والتحقيق في التفاعلات مع البيئة المكروية أثناء تطور المرض 34 ، والتصوير في الجسم الحي 35 ، وللتنبؤ بالسمية الخاصة بالمريض وفعالية العوامل المضادة للأورام34.
يوفر هذا البروتوكول وصفا مفصلا لعزل ALDHالبشري عاليCD44 + CD24- BCSCs بأقصى درجات النقاء عن المجموعات السائبة من خلايا سرطان الثدي غير المتجانسة. كما نقدم وصفا مفصلا لثلاث تقنيات في المختبر (مقايسة تشكيل المستعمرة ، ومقايسة الغلاف الجوي ، ونموذج ثقافة 3D) ومقايسة الكسب غير المشروع للورم في الجسم الحي التي يمكن استخدامها لتقييم الوظائف المختلفة ل BCSCs. ستكون هذه الطرق مناسبة للاستخدام من قبل الباحثين المهتمين بعزل وتوصيف BCSCs من خطوط خلايا سرطان الثدي البشرية أو خلايا سرطان الثدي المشتقة من المريض الأولي وأنسجة الورم لأغراض فهم بيولوجيا BCSC و / أو التحقيق في علاجات جديدة تستهدف BCSC.
Protocol
تم جمع العينات الجراحية أو الخزعة المشتقة من المريض مباشرة من مرضى سرطان الثدي الموافقين بموجب بروتوكول أخلاقيات الإنسان المعتمد من قبل مجلس الأخلاقيات المؤسسية. تم الحفاظ على جميع الفئران المستخدمة لتوليد نماذج xenograft المشتقة من المريض وإيوائها في منشأة حيوانية معتمدة من المؤسسة. تم إنشاء أنسجة الورم من نماذج xenograft المشتقة من المريض باستخدام الفئران وفقا لبروتوكول الأخلاقيات المعتمد من قبل لجنة رعاية الحيوان المؤسسية.
1. إعداد خطوط الخلايا
- قم بإجراء جميع إجراءات زراعة الخلايا وتلطيخها في ظل ظروف معقمة في خزانة السلامة البيولوجية. استخدم أطباق زراعة الخلايا المعقمة / القوارير والكواشف.
- الحفاظ على خلايا سرطان الثدي البشرية عند 37 درجة مئوية مع 5٪ CO2 في وسائط محددة مكملة بمصل بقري الجنين (FBS) وعوامل النمو الضرورية الخاصة بكل خط خلوي.
- الحفاظ على مزارع الخلايا الليفية NIH3T3 للفأر (للاستخدام في مقايسات تشكيل المستعمرة) عند 37 درجة مئوية مع 5٪ CO2 في وسط النسر المعدل من Dulbecco (DMEM) مع 10٪ FBS.
- لجميع الثقافات ، قم بتجديد الوسائط القديمة كل 2-3 أيام بوسائط جديدة. بمجرد أن تصل الثقافات إلى 75-80٪ من التقاء، تتحول الثقافة الفرعية إلى قوارير متعددة لثقافة الخلايا العقيمة.
2. تحضير أنسجة ورم سرطان الثدي
- جمع العينات الجراحية أو الخزعة المستمدة من المريض مباشرة من مرضى سرطان الثدي الموافقين بموجب بروتوكول أخلاقيات الإنسان المعتمد من قبل مجلس الأخلاقيات المؤسسية.
- بعد ذلك ، جمع وتوليد أنسجة الورم من نماذج xenograft المشتقة من المريض باستخدام الفئران بموجب بروتوكول أخلاقيات الحيوان المعتمد من قبل لجنة رعاية الحيوان المؤسسية.
- اجمع كل أنسجة الورم في ظل ظروف معقمة في أنبوب مخروطي معقم سعة 50 مل يحتوي على وسائط DMEM: F12 سعة 30 مل ، واحتفظ بها على الثلج ، وقم بمعالجة العينات كما هو موضح أدناه في غضون 2 ساعة من التجميع.
3. توليد معلقات أحادية الخلية لخلايا سرطان الثدي
- نضح الوسائط من القارورة التي تحتوي على طبقة أحادية من خلايا سرطان الثدي التي تكون 60-80٪ متقاربة (خطوط الخلايا المفضلة). اغسل الخلايا بمحلول ملحي 1x فوسفات مخزن (PBS). نضح PBS وإضافة محلول تفكك الخلية المناسب (على سبيل المثال ، Trypsin: EDTA ؛ يكفي فقط لتغطية الطبقة الأحادية من الخلايا) واحتضانها لمدة 5 دقائق في درجة حرارة الغرفة (موصى به) أو عند 37 درجة مئوية.
- أضف 5 مل من وسائط المزرعة لتحييد نشاط محلول تفكك الخلية.
- انقل محلول الخلية المنفصلة الناتج إلى أنبوب مخروطي سعة 50 مل وأجهزة طرد مركزي بسرعة 1000 × جم لمدة 5 دقائق.
- تخلص من المادة الطافية وأعد تعليق حبيبات الخلية في 5 مل من 1x PBS. عد الخلايا باستخدام مقياس الدم والمجهر.
ملاحظة: يجب الانتباه إلى تكتل الخلايا في مقياس الدم. كرر خطوة تفكك الخلية إذا لم يتشكل تعليق خلية واحدة. - بعد عد الخلايا ، أعد جهاز الطرد المركزي لتعليق الخلية عند 1000 × جم لمدة 5 دقائق ، وتخلص من المادة الطافية ، وأعد تعليق حبيبات الخلية في المخزن المؤقت لركيزة ALDH بتركيز 1 × 106 خلايا / مل.
4. توليد تعليق خلية واحدة من عينات الأنسجة
- فرم أنسجة الورم بشفرات جراحية باستخدام تقنية متقاطعة للحصول على قطع أصغر بحجم 1 مم تقريبا. انقل قطع الأنسجة إلى أنبوب مخروطي جديد سعة 50 مل يحتوي على مخزن مؤقت تفكك 10 مل (1X كولاجيناز في DMEM: F12). أغلق الأنبوب المخروطي باستخدام البارافيلم واحتضانه عند 37 درجة مئوية في حاضنة شاكر لمدة 40 دقيقة.
ملاحظة: إذا لم يكن هناك حاضنة شاكر ، ضع الأنبوب في حمام مائي 37 درجة مئوية واخلط الأنبوب عن طريق الدوامة كل 5-10 دقائق. - بيليه الأنسجة المهضومة عن طريق عينة الطرد المركزي في 530 × غرام لمدة 5 دقائق. تخلص من المادة الطافية وأضف 5 مل من التربسين. ماصة لأعلى ولأسفل باستخدام ماصة 1 مل (مضبوطة على علامة 750 ميكرولتر) لتعطيل الحبيبات واحتضانها في حمام مائي 37 درجة مئوية لمدة 5 دقائق. بعد الحضانة ، ماصة صعودا وهبوطا بقوة لتحرير خلايا واحدة.
- قم بتعبئة الحجم الإجمالي في الأنبوب إلى 25 مل باستخدام وسائط DMEM: F12 وأجهزة الطرد المركزي عند 1000 × جم لمدة 5 دقائق. تخلص من المادة الطافية وأعد تعليق الحبيبات في 1 مل من محلول dispase-DNase. احتضان في حمام مائي 37 درجة مئوية لمدة 5 دقائق.
- قم بتعبئة الحجم الإجمالي في الأنبوب إلى 10 مل باستخدام PBS. امزج عن طريق السحب لأعلى ولأسفل ، مرر تعليق الخلية الناتج من خلال مصفاة خلية 40 ميكرومتر متصلة بأنبوب مخروطي جديد سعة 50 مل. جهاز طرد مركزي عند 1000 × جم لمدة 5 دقائق.
- تخلص من المادة الطافية وأعد تعليق حبيبات الخلية في 5 مل من 1x PBS. عد الخلايا واستكمل تحضير معلق الخلية كما هو موضح في الخطوتين 3.4 و 3.5.
5. عزل الخلايا الجذعية لسرطان الثدي (BCSCs)
- أنابيب تدفق الملصق للتحكم غير الملوث ، وأدوات التحكم في تلطيخ الخلية الواحدة (تحكم DEAB ، ALDH ، CD44-PE ، CD24-PE-Cy7 ، 7AAD) ، أنبوب التحكم السلبي (ملطخ ب DEAB ، CD44-PE ، CD24-PE-Cy7 و 7AAD) ، عنصر تحكم الفلورسنت ناقص واحد (FMO) وأنبوب "الفرز" (ملطخ ب ALDH و CD44 و CD24 و 7AAD).
- نقل 500 ميكرولتر (0.5 × 106 خلايا) من معلقات الخلية من الخطوة 3.5 أو الخطوة 4.5 إلى كل أنبوب يسمى الخلايا فقط ، CD44 و CD24 و 7AAD. ضع الأنابيب على الثلج حتى الاستخدام.
- نقل 2 مل من العينة (2 × 106 خلايا) إلى أنبوب "ALDH" المعني. أضف 5 ميكرولتر من DEAB إلى أنابيب "التحكم DEAB" و "التحكم السلبي" وقم بتغطيتها بإحكام. أضف 10 ميكرولتر من ركيزة ALDH إلى أنبوب "ALDH" ، واخلطها جيدا عن طريق الدوامة ، وانقل على الفور 500 ميكرولتر إلى أنبوب "التحكم DEAB" و "التحكم السلبي" المقابل. قم بتلخيص "التحكم DEAB" و "التحكم السلبي" و "أنابيب ALDH" واحتضانها عند 37 درجة مئوية لمدة 30-60 دقيقة (لا تتجاوز 60 دقيقة).
ملاحظة: قد يتطلب وقت الحضانة الأمثل التحسين اعتمادا على خط الخلية. احرص دائما على حماية ركيزة ALDH والأنابيب التي تحتوي على خلايا ملطخة من الضوء. - بعد الحضانة ، أجهزة الطرد المركزي جميع العينات لمدة 5 دقائق في 250 × غرام. أعد تعليق الخلايا في 500 ميكرولتر من المخزن المؤقت للركيزة ALDH. أضف تركيزا موصى به من قبل الشركة المصنعة أو محسن للمستخدم من كوكتيل الأجسام المضادة anti-CD44-PE و anti-CD24-PE-Cy7 واحتضانه عند 4 درجات مئوية لمدة 30 دقيقة. أضف الأجسام المضادة ل CD44-PE و CD24-PE-Cy7 إلى الأنابيب التي تحمل علامة "CD44" و "CD24".
- بعد الحضانة ، أجهزة الطرد المركزي جميع العينات في 250 × غرام لمدة 5 دقائق. أعد تعليق الخلايا في 500 ميكرولتر من المخزن المؤقت للركيزة ALDH. احتضان أنبوب "التحكم السلبي" وأنبوب "الفرز" وأنبوب "7ADD" مع 7AAD (التركيز المقترح: 0.25 ميكروغرام / 1 × 106 خلايا) لمدة 10 دقائق على الجليد.
ملاحظة: تم الكشف عن نشاط ALDH في القناة الفلورية الخضراء ، لذلك يجب استخدام فلوروكروم مع طيف انبعاث متوافق مختلف. وحيثما يلاحظ تداخل طيفي أثناء قياس التدفق الخلوي متعدد المعلمات، ينبغي استخدام عناصر التحكم أحادية اللون والتحكم في FMO كدليل للسماح بالتعويض بين الفلوروكرومات لتقليل انسكاب إشارة الفلورسنت إلى قنوات أخرى. - وضع بروتوكول التحليل على أداة نظام مراقبة الأصول الميدانية استعدادا لتحليل العينات. إنشاء مخططات مبعثرة (مبعثر أمامي مقابل جانبي ، مبعثر أمامي مقابل قنوات فلورسنت).
- باستخدام عنصر التحكم غير الملوث ، اضبط المضاعف الضوئي لفصل الحطام عن عدد الخلايا بالكامل واضبط جهد الفلورسنت لتحريك عدد الخلايا بالكامل حول مقياس اللوغاريتم الأول (101). باستخدام عنصر تحكم DEAB ، انقل عدد الخلايا بالكامل داخل مقياس اللوغاريتم الثاني (102) عن طريق ضبط قناة الجهد الفلوري الخضراء.
- قم بتحليل جميع عناصر التحكم في التلوين الفردي أولا (ALDH و CD44-PE و CD24-PE-Cy7) والتحكم في 7AAD و FMO ، وضبط الجهد لفصل الخلايا الملطخة عن الخلايا غير الملوثة وتقليل انسكاب إشارات الفلورسنت إلى قنوات أخرى.
- بوابة على المجتمع الإحصائي الإيجابي لكل عينة خلية ملطخة. باستخدام أنبوب التحكم السلبي ، بوابة الجدوى (7AAD سلبية) ، ALDHمنخفضة و ALDH مجموعات الخلاياالعالية (استراتيجية البوابة التمثيلية الموضحة في الشكل 1B).
- تحليل العينات الملطخة متعددة العوامل ذات الأهمية لعزل BCSCs. باستخدام بوابات ALDHالمنخفضة و ALDHالعالية القابلة للتطبيق ، حدد عدد خلايا CD44 + CD24- (BCSC) و CD44-CD24 + (غير BCSC) على التوالي (الشكل 1 ب).
- اجمع BCSCs القابلة للحياة وغير BCSCs في وسائط التجميع في أنابيب تجميع معقمة (مجموعات من خطين خلويين تمثيليين موضحين في الشكل 2A و B). استخدم الخلايا المصنفة في الفحوصات في المختبر وفي الجسم الحي كما هو موضح أدناه.
ملاحظة: بالإضافة إلى المقايسات في المختبر وفي الجسم الحي الموضحة أدناه ، يمكن التحقق من صحة BCSCs عن طريق قياس التعبير عن العلامات متعددة القدرات مثل SOX2 و OCT4 و NANOG عبر تقنيات النشاف المناعي القياسية.
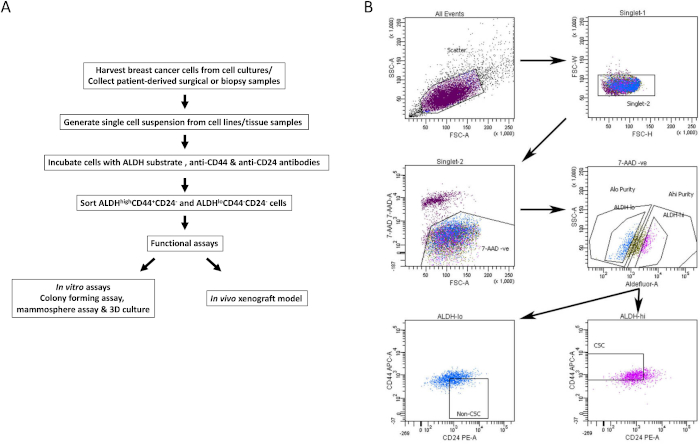
الشكل 1: استراتيجية بوابات FACS لعزل BCSCs من خطوط خلايا سرطان الثدي وعينات الأنسجة. (أ) مخطط انسيابي يصف إجراء عزل BCSC. (ب) مخططات تمثيلية لنظام مراقبة الأصول الميدانية (FACS) تبين استراتيجية الفرز المستخدمة لعزل BCSCs القابلة للحياة وغير BCSCs من مجموعة غير متجانسة من الخلايا. يتم تصنيف خلايا سرطان الثدي البشرية MDA-MB-231 بشكل متزامن مع 7-AAD و CD44-APC و CD24-PE وركيزة ALDH. تم عزل المجموعات الفرعية للخلايا باستخدام بروتوكول رباعي الألوان على جهاز FACS. يتم اختيار الخلايا بناء على تشتت الضوء المتوقع ، ثم للمفردات ، والجدوى بناء على استبعاد 7-AAD. ثم يتم تحليل الخلايا لنشاط ALDH ويتم اختيار أعلى 20٪ الأكثر إيجابية على أنهاعدد سكان ALDH مرتفع ، في حين تم اعتبار أدنى 20٪ من الخلايا ذات أقل نشاط ALDHمنخفضة ALDH. أخيرا ، يتم اختيار 50٪ من خلايا ALDHالمنخفضة بناء على النمط الظاهري منخفض CD44/ -CD24 + ، ويتم اختيار 50٪ من خلايا ALDHالعالية بناء على النمط الظاهري CD44 + CD24. تم اقتباس هذا الرقم من Chu et al.17. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
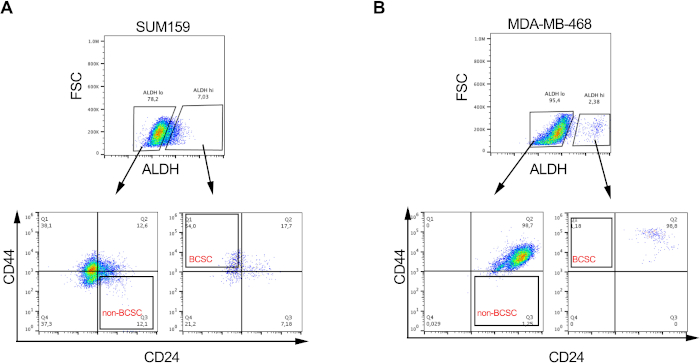
الشكل 2: نسب BCSCs متغيرة في خطوط خلايا سرطان الثدي المختلفة. صورة تمثيلية توضح النسبة التفاضلية ل BCSCs وغير BCSCs في (A) SUM159 و (B) MDA-MD-468 خطوط خلايا سرطان الثدي السلبية الثلاثية بعد وضع العلامات والفرز كما هو موضح في الشكل 1. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
6. مقايسة تشكيل مستعمرة
- أعد تعليق الخلايا المهمة (الخلايا التي تم فرزها من الخطوة 5.11 أو الخلايا غير المصنفة من الخطوتين 3.5 أو 4.5) في وسائط كاملة.
- قم بتسمية ثلاثة أنابيب تدفق لخلايا 1 × 10 2 و 2 × 10 2 و 5 × 102. أضف 2 مل من الوسائط الكاملة وانقل رقم الخلية المناسب (تم فرزها من الخطوة 5.11 أو الخلايا غير المصنفة من الخطوتين 3.5 أو 4.5) في الأنابيب المعنية. امزج محاليل الخلايا جيدا عن طريق سحبها لأعلى ولأسفل 5 مرات.
- قم بتجميع الخلايا في لوحة مكونة من 6 آبار وقم بتوزيع معلق الخلية عن طريق تحريك الألواح برفق للحصول على توزيع موحد للخلايا.
- احتضان الألواح في حاضنة 37 درجة مئوية ، 5٪ CO2 حتى تظهر المستعمرات (حيث المستعمرات = ≥50 خلية لكل مستعمرة). قم بتجديد الوسائط بعناية مرتين في الأسبوع دون إزعاج تكوين مستعمرة.
- نضح الوسائط واغسلها مرة واحدة باستخدام 1 مل PBS. أضف 0.5 مل من محلول الكريستال البنفسجي 0.05٪ في كل بئر واحتضان اللوحة لمدة 30 دقيقة. قم بإزالة البقع البنفسجية الكريستالية الزائدة عن طريق الغسيل ب 2 مل من الماء. كرر خطوة الغسيل حتى تتم إزالة تلطيخ الخلفية.
- باستخدام المجهر عند تكبير 4x و 10x ، قم بحساب وتسجيل العدد الإجمالي للمستعمرات التي تم إنشاؤها (الصور التمثيلية الموضحة في الشكل 3 أ).
- احسب تكرار تكوين المستعمرة على النحو التالي: التردد (٪) = (# من المستعمرات المشكلة / عدد الخلايا المصنفة ) × 100. على سبيل المثال ، إذا تم إنشاء 25 مستعمرة من خلايا 1 × 102 ، فإن تكرار تكوين المستعمرة هو ، التردد = (25/100) × 100 = 25٪.
- بدلا من ذلك ، يستعاض عن الخطوات من 6.1 إلى 6.4 بطريقة بديلة تنطوي على الاستزراع المشترك مع الخلايا الليفية ، والتي توفر دعما بيئيا دقيقا ل BCSCs من خلال إنتاج عوامل النمو والبقاء الضرورية.
- قم بطلاء أطباق الاستزراع 60 مم من خلايا ما قبل الطلاء مع الكولاجين البقري من النوع الأول (1 في 30 مخفف من 3 مجم / مل كولاجين). اسمح للكولاجين بالبلمرة لمدة 30 دقيقة في حاضنة 37 درجة مئوية. نضح الكولاجين غير المبلمر وغسل اللوحة مرتين مع 1x PBS. قم بتغطية اللوحة المطلية بالكولاجين ب 1 مل من PBS وضعها جانبا في درجة حرارة الغرفة حتى الاستخدام.
- قم بتسمية ثلاثة أنابيب تدفق لخلايا 1 × 10 3 و 5 × 103 و 1 × 104. أضف 4 مل من وسائط فحص تشكيل المستعمرة وانقل العدد المناسب من الخلايا (مرتبة من الخطوة 5.11 أو الخلايا غير المصنفة من الخطوتين 3.5 أو 4.5) إلى الأنابيب المعنية. أضف الخلايا الليفية للماوس المشعع NIH3T3 (4 × 104 خلايا / مل من الوسائط). امزج محاليل الخلايا جيدا عن طريق سحبها لأعلى ولأسفل 5 مرات.
- قم بشفط PBS من طبق الاستزراع المطلي بالكولاجين من الخطوة 6.1 وقم بطبقة خليط الخلية على كل لوحة من لوحات زراعة الخلايا كما هو موضح في الخطوة 6.3.
- احتضان الألواح في حاضنة 37 درجة مئوية ، 5٪ CO2 واتركها دون إزعاج لمدة 7-10 أيام أو حتى تتشكل المستعمرات ، دون تجديد الوسائط. عد وسجل العدد الإجمالي للمستعمرات التي تم إنشاؤها كما هو موضح في الخطوتين 6.6 و 6.7.
7. فحص الماموسفير
- أعد تعليق الخلايا ذات الأهمية (الخلايا المصنفة من الخطوة 5.11 أو الخلايا غير المصنفة من الخطوتين 3.5 أو 4.5) في وسائط الغلاف الشعاعي الكاملة وخلايا الصفائح بكثافة بذر تبلغ 5 × 102 خلية / سم2 في 96 صفيحة استزراع خلية ارتباط منخفضة للغاية.
ملاحظة: يجب تحسين كثافة بذر الخلية لخطوط الخلايا المختلفة. - احتضان ألواح الاستزراع لمدة 5-10 أيام في حاضنة 37 درجة مئوية مع 5٪ CO2. قم بتجديد الوسائط بعناية مرتين في الأسبوع دون إزعاج تكوين الماموسفير.
- بعد الحضانة ، احسب عدد الماموسفير المتولد في كل بئر باستخدام المجهر ؛ حيث يتم تعريف الغلاف الشعاعي للثدي على أنه مجموعات خلايا سرطان الثدي التي يزيد قطرها عن 100 ميكرومتر (الصور التمثيلية الموضحة في الشكل 3 ب).
- احسب كفاءة تكوين الماموسفير (MFE) على النحو التالي: MFE (٪) = (عدد الماموسفير لكل بئر) / (عدد الخلايا المزروعة لكل بئر) × 100 (أي إذا تم إنشاء 5 ثدي بواسطة 1 × 102 خلية في بئر ، فإن MFE = (5/100) × 100 = 5٪).
- لتربية الغلاف الجوي الفرعي ، انقل بعناية الوسائط التي تحتوي على محتوى الغلاف الجوي إلى أنبوب مخروطي جديد سعة 50 مل ووسائط طرد مركزي بسرعة 1000 × جم لمدة 5 دقائق. قم بإزالة المادة الطافية بعناية ، وأعد تعليق حبيبات الخلية في 500 ميكرولتر من التربسين ، واحتضانها لمدة 5 دقائق في درجة حرارة الغرفة.
- تخلص من المادة الطافية وأعد تعليق الحبيبات في 1 مل من وسائط الماموسفير الكاملة. عد الخلايا باستخدام مقياس الدم وأعد ترتيب الخلايا في صفيحة زراعة خلايا ملحقة منخفضة للغاية كما هو موضح في الخطوة 7.1.
ملاحظة: بالإضافة إلى الزراعة الفرعية ، يمكن أيضا تحليل الخلايا المشتقة من الغلاف الجوي بواسطة FACS لتقييم النمط الظاهري ل BCSC و / أو الحصول على مجموعات نقية من BCSCs للمقايسات الأخرى في اتجاه مجرى النهر. - لتحديد عدد الخلايا البادئة للثدي الموجودة داخل مجموعات الخلايا الخاصة بك ، استخدم طريقة بديلة تتضمن تحليل تخفيف الحد من المجال (SLDA). خلايا الصفيحة في التخفيفات التسلسلية لأرقام الخلايا العالية إلى المنخفضة في 96 صفيحة زراعة خلية ارتباط منخفضة للغاية ، مع أعلى تخفيف ينتج عنه أقل من خلية واحدة لكل بئر.
- احتضان صفيحة الاستزراع لمدة 10-14 يوما في حاضنة 37 درجة مئوية مع 5٪ CO2 واتركها دون عائق لتجنب تراكم الخلايا.
- بعد الحضانة ، احسب عدد الماموسفير المتولد في كل بئر باستخدام المجهر ؛ حيث يتم تعريف الماموسفير على أنه مجموعات خلايا سرطان الثدي التي يزيد قطرها عن 100 ميكرومتر. احسب تردد بدء المجال وأهميته باستخدام برنامج تحليل التخفيف المحدد للغاية (ELDA) عبر الإنترنت (http://bioinf.wehi.edu.au/software/elda/).
8.3D نموذج الثقافة
- اعتمادا على السؤال التجريبي ، استخدم مستخلص الغشاء القاعدي (BME) مع أو بدون عوامل نمو (مخفضة). من أجل تقييم تأثير عامل النمو الفردي على الخلايا السرطانية ، استخدم عامل النمو المخفض BME. كما أنه يساعد في تقليل الآثار غير المحددة لعوامل النمو الداخلية الموجودة في BME.
ملاحظة: يتجمد BME فوق 10 درجات مئوية. احتفظ دائما ب BME على الجليد حتى أثناء خطوة الذوبان. - أضف بعناية 50 ميكرولتر من BME لكل بئر في لوحة 96 بئرا دون إنشاء فقاعات هواء واتركها تتبلمر عند 37 درجة مئوية لمدة 1 ساعة. بعد 10 دقائق من الحضانة ، أضف 100 ميكرولتر PBS لتجنب تجفيف طبقة الهلام.
- أعد تعليق الخلايا التي تم فرزها من الخطوة 5.11 أو الخلايا غير المصنفة من الخطوتين 3.5 أو 4.5 بتركيز 5 × 103 إلى 5 × 104/200 ميكرولتر في وسائط الثقافة ثلاثية الأبعاد.
- بمجرد بلمرة BME ، قم بإزالة PBS ، أضف 200 ميكرولتر من تعليق الخلية إلى كل بئر واحتضانها في حاضنة 37 درجة مئوية مع 5٪ CO2. أضف PBS إلى الآبار المحيطة لتجنب تبخر الوسائط.
ملاحظة: يجب تحديد العدد الأمثل لخلايا الطلاء قبل إعداد التجربة. اعتمادا على السؤال التجريبي ، يمكن زراعة BCSCs بمفردها أو مع أنواع أخرى من الخلايا (الخلايا الليفية / البطانية / الخلايا المناعية وما إلى ذلك). - أضف وسائط جديدة إلى لوحات الثقافة مرتين أسبوعيا. الحفاظ على الثقافات لمدة 10-14 يوما قبل تحليل تكوين المواد العضوية (الصور التمثيلية الموضحة في الشكل 3C).
- للزراعة الفرعية ، استنشق الوسائط بعناية وأضف 200 ميكرولتر من dispase إلى كل خلية تحتوي على بئر. احتضان اللوحة في حاضنة 37 درجة مئوية لمدة 1 ساعة. في منتصف فترة الحضانة (30 دقيقة) ، أخرج الطبق ، واسحب المحلول برفق لأعلى ولأسفل 5 مرات ، وضعه مرة أخرى في الحاضنة لمدة 30 دقيقة أخرى.
- بعد 1 ساعة ، انقل محلول الخلية المنفصلة إلى أنبوب تدفق. اغسل البئر باستخدام 1x PBS يحتوي على 2٪ FBS (fPBS) وانقله إلى أنبوب التدفق. جهاز طرد مركزي للأنبوب بسرعة 1000 × جم لمدة 5 دقائق. استنشاق المادة الطافية بعناية وإضافة 500 ميكرولتر من التربسين ، واحتضانها عند 37 درجة مئوية لمدة 5 دقائق. قم بتعطيل التربسين عن طريق إضافة كمية متساوية من fPBS وأجهزة الطرد المركزي عند 1000 × جم لمدة 5 دقائق.
- تخلص من المادة الطافية وأعد تعليق الحبيبات في 1 مل من وسائط الثقافة ثلاثية الأبعاد. عد الخلايا وأعد ترتيب العدد المطلوب من الخلايا في BME كما في الخطوات من 8.2 إلى 8.4.
ملاحظة: يمكن تجميع آبار متعددة لمزيد من التحليل أو فرز عدد الخلايا محل الاهتمام.
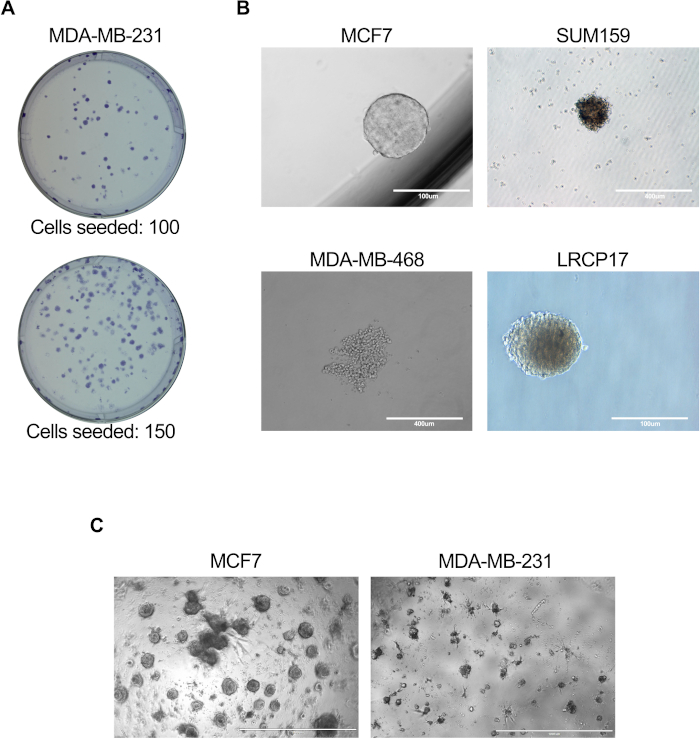
الشكل 3: المقايسات في المختبر لتقييم وظيفة خلية BCSC. تم إجراء الفحوصات في المختبر كما هو موضح في أقسام البروتوكول 6.1 إلى 6.5 (أ) أو 7.1 إلى 7.4 (ب) أو 81. إلى 8.4 + 8.6 (ج). (أ) صورة تمثيلية توضح المستعمرات التي تولدها خلايا سرطان الثدي البشرية MDA-MB-231 ؛ (ب) صور تمثيلية تظهر تكوين الماموسفير بواسطة خطوط الخلايا البشرية MCF7 أو SUM159 أو MDA-MB-468 بالإضافة إلى خلايا سرطان الثدي LRCP17 المشتقة من المريض. (ج) صور تمثيلية تظهر الهياكل ثلاثية الأبعاد التي شكلتها خلايا سرطان الثدي MCF7 و MDA-MB-231 في نماذج الثقافات ثلاثية الأبعاد. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
ملاحظة: إجراء تجارب على الحيوانات بموجب بروتوكول أخلاقيات الحيوان المعتمد من قبل لجنة رعاية الحيوان المؤسسية.
9. نموذج xenograft في الجسم الحي
- من أجل تحديد قدرة بدء الورم للخلايا الجذعية لسرطان الثدي ، قم بإعداد الخلايا (السكان المصنفة من الخطوة 5.7 أو المجموعات غير المصنفة من الخطوات 3.5 أو 4.5) باستخدام نهج التخفيف المحدد. الخلايا المخففة بشكل متسلسل في PBS باستخدام ما بين 1 و 5 مجموعات تخفيف مختلفة ، بجرعات منخفضة تصل إلى 0.01-0.2 × 102 خلية / 100 ميكرولتر وتصل إلى 1 × 106 خلايا / 100 ميكرولتر.
ملاحظة: يمكن استخدام خلايا السكان غير المصنفة/الكاملة كعنصر تحكم. يعتمد عدد مجموعات التخفيف المستخدمة على النتيجة العلمية المرجوة (على سبيل المثال ، إذا كان اختبار الورم فقط ، فيمكن استخدام مجموعة 1 بعدد خلايا أعلى ، بينما عند حساب قدرة بدء الورم ، من الأفضل اختبار 5 جرعات تخفيف محددة). - لتوليد نماذج xenograft من خلايا سرطان الثدي البشرية ، استخدم إناث الفئران التي تعاني من نقص المناعة (athymic nude [nu / nu] ، السكري غير البدين / نقص المناعة المشترك الشديد [NOD / SCID] أو سلالات NOD / SCID IL2γ [NGS]).
ملاحظة: على الرغم من أنه يمكن استخدام ما لا يقل عن 4 لكل مجموعة ، يوصى باستخدام 8-12 حيوانا لكل مجموعة للحصول على نتائج قوية خاصة للحد من تحليل التخفيف. - إجراء حقن ضمادة الدهون الثديية القياسية (MFP) باستخدام 100 ميكرولتر / فأر من كل مستحضر خلية ، في ظل ظروف معقمة في خزانة السلامة البيولوجية.
ملاحظة: للحصول على النمو الأمثل لورم الثدي وورم خبيث عفوي إلى الأعضاء البعيدة ، يوصى باستخدام MFP الصدري. بدلا من ذلك ، يمكن أيضا استخدام MFP الأربي. - بعد الحقن ، راقب الفئران على أساس يومي للصحة العامة ونمو الورم في موقع الحقن. عند اكتشاف ورم ملموس ، ابدأ في قياس حجم الورم بواسطة الفرجار في بعدين متعامدين وسجل أسبوعيا حتى نقطة النهاية.
ملاحظة: يتم تحديد نقطة النهاية التجريبية بناء على اللوائح الموضوعة للبروتوكول المؤسسي لأخلاقيات الحيوان. عادة ، عادة ما تكون نقطة النهاية عن طريق القتل الرحيم مطلوبة بمجرد وصول أحجام الورم إلى 1500 مم3. بالنسبة لمجموعات BCSC و / أو جرعات الخلايا الأعلى (على سبيل المثال >1 × 104 خلايا) ، من المحتمل أن يتم الوصول إلى نقطة النهاية هذه في غضون 4-8 أسابيع من حقن MFP. بالنسبة لجرعات الخلايا المنخفضة جدا و / أو مجموعات الخلايا غير BCSC ، يجب السماح لنمو الورم بالتقدم لمدة تصل إلى 8 أشهر بعد الحقن. - من هذه القياسات ، احسب حجم الورم باستخدام الصيغة التالية: الحجم بالملليمتر3 = 0.52 × (العرض)2 × الطول. في حالة استخدام نهج التخفيف المحدود ، احسب قدرة بدء الورم وأهميته باستخدام برنامج ELDA عبر الإنترنت (http://bioinf.wehi.edu.au/software/elda/).
- بدلا من ذلك ، لتوسيع نقطة النهاية بشكل إنساني ، وإزالة الأورام الأولية جراحيا والاستمرار في مراقبة الفئران من أجل الصحة و / أو تطور ورم خبيث عفوي في الأعضاء البعيدة. استخدام أنسجة الورم المقطوعة لتوليد xenotransplants المتسلسلة.
- عند نقطة النهاية ، حصاد الأنسجة من الأورام الأولية والأعضاء البعيدة (الغدد الليمفاوية والرئة والكبد والدماغ والعظام) وإجراء التحليل النسيجي المرضي و / أو المناعي الكيميائي أو فصل أنسجة الورم واستخدامها في المقايسات المختبرية الموضحة في الأقسام 6-8.
النتائج
يسمح البروتوكول الموصوف بعزل BCSCs البشرية عن مجموعة غير متجانسة من خلايا سرطان الثدي ، إما من خطوط الخلايا أو من أنسجة الورم المنفصلة. بالنسبة لأي خط خلية أو عينة نسيج معينة ، من الأهمية بمكان إنشاء معلق أحادي الخلية موحد لعزل BCSCs بأقصى درجات النقاء لأن تلويث السكان غير BCSC يمكن أن يؤدي إلى اس...
Discussion
أصبح ورم خبيث لسرطان الثدي ومقاومة العلاج سببا رئيسيا لوفيات النساء في جميع أنحاء العالم. يساهم وجود مجموعة فرعية من الخلايا الجذعية لسرطان الثدي (BCSCs) في تعزيز ورم خبيث26،43،44،45،46 ومقاومة العلاج21،47
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
نشكر أعضاء مختبرنا على مناقشاتهم المفيدة ودعمهم. يتم تمويل أبحاثنا حول الخلايا الجذعية لسرطان الثدي والبيئة المكروية للورم من خلال منح من معهد أبحاث جمعية أبحاث السرطان الكندية وبرنامج سرطان الثدي التابع لوزارة الدفاع الأمريكية (Grant # BC160912). يتم دعم V.B. من قبل زمالة ما بعد الدكتوراه الغربية (الجامعة الغربية) ، ويتم دعم كل من A.L.A. و V.B. من قبل جمعية سرطان الثدي في كندا. يتم دعم CL من خلال منحة Vanier Canada للدراسات العليا من حكومة كندا.
Materials
| Name | Company | Catalog Number | Comments |
| 7-Aminoactinomycin D (7AAD) | BD | 51-68981E | suggested: 0.25 µg/1x106 cells |
| Acetone | Fisher | A18-1 | |
| Aldehyde dehydrogenase (ALDH) substrate | Stemcell Technologies | 1700 | Sold commerically as part of the ALDEFLOUR Assay kit; follow manufacturer's instructions for ALDH substrate preparation |
| Basement membrane extract (BME) | Corning | 354234 | Sold under the commercial name Matrigel |
| Cell culture plates: 6 well | Corning | 877218 | |
| Cell culture plates: 60mm | Corning | 353002 | |
| Cell culture plates: 96-well ultra low attachment | Corning | 3474 | |
| Cell strainer: 40 micron | BD | 352340 | |
| Collagen | Stemcell Technologies | 7001 | Prepare 1:30 dilution of 3 mg/mL collagen in PBS |
| Collagenase | Sigma | 11088807001 | 1x |
| Conical tubes: 50 mL | Fisher scientific | 05-539-7 | |
| Crystal violet | Sigma | C6158 | Use 0.05% crystal violet solution in water for staining |
| Dispase | Stemcell Technologies | 7913 | 5U/mL |
| DMEM:F12 | Gibco | 11330-032 | 1x, With L-glutamine and 15 mM HEPES |
| DNAse | Sigma | D5052 | 0.1 mg/mL final concentration |
| FBS | Avantor Seradigm Lifescience | 97068-085 | |
| Flow tubes: 5ml | BD | 352063 | Polypropylene round-bottom tubes |
| Methanol | Fisher | 84124 | |
| mouse anti-Human CD24 antibody | BD | 561646 | R-phycoerythrin and Cyanine dye conjugated Clone: ML5 |
| mouse anti-Human CD44 antibody | BD | 555479 | R-phycoerythrin conjugated, Clone: G44-26 |
| N,N-diethylaminobenzaldehyde (DEAB) | Stemcell Technologies | 1700 | Sold commerically as part of the ALDEFLOUR Assay kit; follow manufacturer's instructions DEAB preparation |
| PBS | Wisent Inc | 311-425-CL | 1x, Without calcium and magnesium |
| Trypsin-EDTA | Gibco | 25200-056 | |
| Mammosphere Media Composition | |||
| B27 | Gibco | 17504-44 | 1x |
| bFGF | Sigma | F2006 | 10 ng/mL |
| BSA | Bioshop | ALB003 | 04% |
| DMEM:F12 | Gibco | 11330-032 | 1x, With L-glutamine and 15 mM HEPES |
| EGF | Sigma | E9644 | 20 ng/mL |
| Insulin | Sigma | 16634 | 5 µg/mL |
| 3D Organoid Media Composition | |||
| A8301 | Tocris | 2939 | 500 nM |
| B27 | Gibco | 17504-44 | 1x |
| DMEM:F12 | Gibco | 11330-032 | 1x, With L-glutamine and 15 mM HEPES |
| EGF | Sigma | E9644 | 5 ng/mL |
| FGF10 | Peprotech | 100-26 | 20 ng/mL |
| FGF7 | Peprotech | 100-19 | 5 ng/mL |
| GlutaMax | Invitrogen | 35050-061 | 1x |
| HEPES | Gibco | 15630-080 | 10 mM |
| N-acetylcysteine | Sigma | A9165 | 1.25 mM |
| Neuregulin β1 | Peprotech | 100-03 | 5 nM |
| Nicotinamide | Sigma | N0636 | 5 mM |
| Noggin | Peprotech | 120-10C | 100 ng/mL |
| R-spondin3 | R&D | 3500 | 250 ng/mL |
| SB202190 | Sigma | S7067 | 500 nM |
| Y-27632 | Tocris | 1254 | 5 µM |
References
- Al-Hajj, M., Wicha, M. S., Benito-Hernandez, A., Morrison, S. J., Clarke, M. F. Prospective identification of tumorigenic breast cancer cells. Proceedings of the National Academy of Sciences of the United States of America. 100 (7), 3983-3988 (2003).
- Shipitsin, M., et al. Molecular definition of breast tumor heterogeneity. Cancer Cell. 11 (3), 259-273 (2007).
- Ginestier, C., et al. ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome. Cell Stem Cell. 1 (5), 555-567 (2007).
- Sulaiman, A., et al. Dual inhibition of Wnt and Yes-associated protein signaling retards the growth of triple-negative breast cancer in both mesenchymal and epithelial states. Molecular Oncology. 12 (4), 423-440 (2018).
- Debeb, B. G., et al. Histone deacetylase inhibitors stimulate dedifferentiation of human breast cancer cells through WNT/β-catenin signaling. Stem Cells. 30 (11), 2366-2377 (2012).
- Klutzny, S., et al. PDE5 inhibition eliminates cancer stem cells via induction of PKA signaling. Cell Death & Disease. 9 (2), 192 (2018).
- DiMeo, T. A., et al. A novel lung metastasis signature links Wnt signaling with cancer cell self-renewal and epithelial-mesenchymal transition in basal-like breast cancer. Cancer Research. 69 (13), 5364-5373 (2009).
- Liu, C. C., Prior, J., Piwnica-Worms, D., Bu, G. LRP6 overexpression defines a class of breast cancer subtype and is a target for therapy. Proceedings of the National Academy of Sciences of the United States of America. 107 (11), 5136-5141 (2010).
- Miller-Kleinhenz, J., et al. Dual-targeting Wnt and uPA receptors using peptide conjugated ultra-small nanoparticle drug carriers inhibited cancer stem-cell phenotype in chemo-resistant breast cancer. Biomaterials. 152, 47-62 (2018).
- Mamaeva, V., et al. Inhibiting Notch Activity in Breast Cancer Stem Cells by Glucose Functionalized Nanoparticles Carrying γ-secretase Inhibitors. Molecular Therapy. 24 (5), 926-936 (2016).
- Ithimakin, S., et al. HER2 drives luminal breast cancer stem cells in the absence of HER2 amplification: implications for efficacy of adjuvant trastuzumab. Cancer Research. 73 (5), 1635-1646 (2013).
- Koike, Y., et al. Anti-cell growth and anti-cancer stem cell activities of the non-canonical hedgehog inhibitor GANT61 in triple-negative breast cancer cells. Breast Cancer. 24 (5), 683-693 (2017).
- Sun, Y., et al. Estrogen promotes stemness and invasiveness of ER-positive breast cancer cells through Gli1 activation. Molecular Cancer. 13, 137 (2014).
- Colavito, S. A., Zou, M. R., Yan, Q., Nguyen, D. X., Stern, D. F. Significance of glioma-associated oncogene homolog 1 (GLI1) expression in claudin-low breast cancer and crosstalk with the nuclear factor kappa-light-chain-enhancer of activated B cells (NFκB) pathway. Breast Cancer Research. 16 (5), 444 (2014).
- Bhat, V., Allan, A. L., Raouf, A. Role of the Microenvironment in Regulating Normal and Cancer Stem Cell Activity: Implications for Breast Cancer Progression and Therapy Response. Cancers. 11 (9), (2019).
- Pio, G. M., Xia, Y., Piaseczny, M. M., Chu, J. E., Allan, A. L. Soluble bone-derived osteopontin promotes migration and stem-like behavior of breast cancer cells. PloS One. 12 (5), 0177640 (2017).
- Chu, J. E., et al. Lung-derived factors mediate breast cancer cell migration through CD44 receptor-ligand interactions in a novel ex vivo system for analysis of organ-specific soluble proteins. Neoplasia. 16 (2), 180-191 (2014).
- McGowan, P. M., et al. Notch1 inhibition alters the CD44hi/CD24lo population and reduces the formation of brain metastases from breast cancer. Molecular Cancer Research. 9 (7), 834-844 (2011).
- Mao, J., et al. ShRNA targeting Notch1 sensitizes breast cancer stem cell to paclitaxel. International Journal of Biochemistry and Cell Biology. 45 (6), 1064-1073 (2013).
- Duru, N., et al. HER2-associated radioresistance of breast cancer stem cells isolated from HER2-negative breast cancer cells. Clinical Cancer Research. 18 (24), 6634-6647 (2012).
- Croker, A. K., Allan, A. L. Inhibition of aldehyde dehydrogenase (ALDH) activity reduces chemotherapy and radiation resistance of stem-like ALDHhiCD44+ human breast cancer cells. Breast Cancer Research and Treatment. 133 (1), 75-87 (2012).
- Creighton, C. J., et al. Residual breast cancers after conventional therapy display mesenchymal as well as tumor-initiating features. Proceedings of the National Academy of Sciences of the United States of America. 106 (33), 13820-13825 (2009).
- Calcagno, A. M., et al. Prolonged drug selection of breast cancer cells and enrichment of cancer stem cell characteristics. Journal of the National Cancer Institute. 102 (21), 1637-1652 (2010).
- Feng, Y., et al. Breast cancer development and progression: Risk factors, cancer stem cells, signaling pathways, genomics, and molecular pathogenesis. Genes Dis. 5 (2), 77-106 (2018).
- Samanta, D., Gilkes, D. M., Chaturvedi, P., Xiang, L., Semenza, G. L. Hypoxia-inducible factors are required for chemotherapy resistance of breast cancer stem cells. Proceedings of the National Academy of Sciences of the United States of America. 111 (50), 5429-5438 (2014).
- Croker, A. K., et al. High aldehyde dehydrogenase and expression of cancer stem cell markers selects for breast cancer cells with enhanced malignant and metastatic ability. Journal of Cellular and Molecular Medicine. 13 (8), 2236-2252 (2009).
- Morel, A. P., et al. Generation of breast cancer stem cells through epithelial-mesenchymal transition. PloS One. 3 (8), 2888 (2008).
- Muntimadugu, E., Kumar, R., Saladi, S., Rafeeqi, T. A., Khan, W. CD44 targeted chemotherapy for co-eradication of breast cancer stem cells and cancer cells using polymeric nanoparticles of salinomycin and paclitaxel. Colloids Surf B Biointerfaces. 143, 532-546 (2016).
- Liu, S., et al. Breast cancer stem cells transition between epithelial and mesenchymal states reflective of their normal counterparts. Stem Cell Reports. 2 (1), 78-91 (2014).
- Munshi, A., Hobbs, M., Meyn, R. E. Clonogenic cell survival assay. Methods in Molecular Medicine. 110, 21-28 (2005).
- Shaw, F. L., et al. A detailed mammosphere assay protocol for the quantification of breast stem cell activity. Journal of Mammary Gland Biology and Neoplasia. 17 (2), 111-117 (2012).
- Shin, C. S., Kwak, B., Han, B., Park, K. Development of an in vitro 3D tumor model to study therapeutic efficiency of an anticancer drug. Molecular Pharmaceutics. 10 (6), 2167-2175 (2013).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Cheon, D. J., Orsulic, S. Mouse models of cancer. Annual Review of Pathology. 6, 95-119 (2011).
- Lyons, S. K. Advances in imaging mouse tumour models in vivo. Journal of Pathology. 205 (2), 194-205 (2005).
- Margaryan, N. V., et al. The Stem Cell Phenotype of Aggressive Breast Cancer Cells. Cancers. 11 (3), (2019).
- Ma, F., et al. Enriched CD44(+)/CD24(-) population drives the aggressive phenotypes presented in triple-negative breast cancer (TNBC). Cancer Letters. 353 (2), 153-159 (2014).
- Chatterjee, S., et al. Paracrine Crosstalk between Fibroblasts and ER(+) Breast Cancer Cells Creates an IL1β-Enriched Niche that Promotes Tumor Growth. iScience. 19, 388-401 (2019).
- Phan-Lai, V., et al. Three-dimensional scaffolds to evaluate tumor associated fibroblast-mediated suppression of breast tumor specific T cells. Biomacromolecules. 14 (5), 1330-1337 (2013).
- O'Brien, C. A., Kreso, A., Jamieson, C. H. Cancer stem cells and self-renewal. Clinical Cancer Research. 16 (12), 3113-3120 (2010).
- Hu, Y., Smyth, G. K. ELDA: extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. Journal of Immunological Methods. 347 (1-2), 70-78 (2009).
- Stewart, J. M., et al. Phenotypic heterogeneity and instability of human ovarian tumor-initiating cells. Proceedings of the National Academy of Sciences of the United States of America. 108 (16), 6468-6473 (2011).
- Abraham, B. K., et al. Prevalence of CD44+/CD24-/low cells in breast cancer may not be associated with clinical outcome but may favor distant metastasis. Clinical Cancer Research. 11 (3), 1154-1159 (2005).
- Balic, M., et al. Most early disseminated cancer cells detected in bone marrow of breast cancer patients have a putative breast cancer stem cell phenotype. Clinical Cancer Research. 12 (19), 5615-5621 (2006).
- Charafe-Jauffret, E., et al. Aldehyde dehydrogenase 1-positive cancer stem cells mediate metastasis and poor clinical outcome in inflammatory breast cancer. Clinical Cancer Research. 16 (1), 45-55 (2010).
- Marcato, P., et al. Aldehyde dehydrogenase activity of breast cancer stem cells is primarily due to isoform ALDH1A3 and its expression is predictive of metastasis. Stem Cells. 29 (1), 32-45 (2011).
- Lacerda, L., Pusztai, L., Woodward, W. A. The role of tumor initiating cells in drug resistance of breast cancer: Implications for future therapeutic approaches. Drug Resist Updat. 13 (4-5), 99-108 (2010).
- Liu, S., Wicha, M. S. Targeting breast cancer stem cells. Journal of Clinical Oncology. 28 (25), 4006-4012 (2010).
- D'Angelo, R. C., et al. Notch reporter activity in breast cancer cell lines identifies a subset of cells with stem cell activity. Molecular Cancer Therapeutics. 14 (3), 779-787 (2015).
- Neve, R. M., et al. A collection of breast cancer cell lines for the study of functionally distinct cancer subtypes. Cancer Cell. 10 (6), 515-527 (2006).
- Forozan, F., et al. Comparative genomic hybridization analysis of 38 breast cancer cell lines: a basis for interpreting complementary DNA microarray data. Cancer Research. 60 (16), 4519-4525 (2000).
- Lanier, L. L. Just the FACS. Journal of Immunology. 193 (5), 2043-2044 (2014).
- Ibrahim, S. F., van den Engh, G. Flow cytometry and cell sorting. Advances in Biochemical Engineering/Biotechnology. 106, 19-39 (2007).
- Shapiro, H. M. Flow Cytometry: The Glass Is Half Full. Methods in Molecular Biology. 1678, 1-10 (2018).
- Tsuji, K., et al. Effects of Different Cell-Detaching Methods on the Viability and Cell Surface Antigen Expression of Synovial Mesenchymal Stem Cells. Cell Transplantation. 26 (6), 1089-1102 (2017).
- Sun, C., et al. Immunomagnetic separation of tumor initiating cells by screening two surface markers. Scientific Reports. 7, 40632 (2017).
- Rodríguez, C. E., et al. Breast cancer stem cells are involved in Trastuzumab resistance through the HER2 modulation in 3D culture. Journal of Cellular Biochemistry. 119 (2), 1381-1391 (2018).
- Kim, D. W., Cho, J. Y. NQO1 is Required for β-Lapachone-Mediated Downregulation of Breast-Cancer Stem-Cell Activity. International Journal of Molecular Sciences. 19 (12), (2018).
- Xu, L. Z., et al. p62/SQSTM1 enhances breast cancer stem-like properties by stabilizing MYC mRNA. Oncogene. 36 (3), 304-317 (2017).
- Huang, X., et al. Breast cancer stem cell selectivity of synthetic nanomolar-active salinomycin analogs. BMC Cancer. 16, 145 (2016).
- Liu, T. J., et al. CD133+ cells with cancer stem cell characteristics associates with vasculogenic mimicry in triple-negative breast cancer. Oncogene. 32 (5), 544-553 (2013).
- Ponti, D., et al. Isolation and in vitro propagation of tumorigenic breast cancer cells with stem/progenitor cell properties. Cancer Research. 65 (13), 5506-5511 (2005).
- Velasco-Velázquez, M. A., Popov, V. M., Lisanti, M. P., Pestell, R. G. The role of breast cancer stem cells in metastasis and therapeutic implications. American Journal of Pathology. 179 (1), 2-11 (2011).
- Palomeras, S., Ruiz-Martínez, S., Puig, T. Targeting Breast Cancer Stem Cells to Overcome Treatment Resistance. Molecules. 23 (9), (2018).
- McClements, L., et al. Targeting treatment-resistant breast cancer stem cells with FKBPL and its peptide derivative, AD-01, via the CD44 pathway. Clinical Cancer Research. 19 (14), 3881-3893 (2013).
- Berger, D. P., Henss, H., Winterhalter, B. R., Fiebig, H. H. The clonogenic assay with human tumor xenografts: evaluation, predictive value and application for drug screening. Annals of Oncology. 1 (5), 333-341 (1990).
- Tian, J., et al. Dasatinib sensitises triple negative breast cancer cells to chemotherapy by targeting breast cancer stem cells. British Journal of Cancer. 119 (12), 1495-1507 (2018).
- Samoszuk, M., Tan, J., Chorn, G. Clonogenic growth of human breast cancer cells co-cultured in direct contact with serum-activated fibroblasts. Breast Cancer Research. 7 (3), 274-283 (2005).
- Linnemann, J. R., et al. Quantification of regenerative potential in primary human mammary epithelial cells. Development. 142 (18), 3239-3251 (2015).
- Xu, Y., Hu, Y. D., Zhou, J., Zhang, M. H. Establishing a lung cancer stem cell culture using autologous intratumoral fibroblasts as feeder cells. Cell Biology International. 35 (5), 509-517 (2011).
- Palmieri, C., et al. Fibroblast growth factor 7, secreted by breast fibroblasts, is an interleukin-1beta-induced paracrine growth factor for human breast cells. Journal of Endocrinology. 177 (1), 65-81 (2003).
- Bourguignon, L. Y., Peyrollier, K., Xia, W., Gilad, E. Hyaluronan-CD44 interaction activates stem cell marker Nanog, Stat-3-mediated MDR1 gene expression, and ankyrin-regulated multidrug efflux in breast and ovarian tumor cells. Journal of Biological Chemistry. 283 (25), 17635-17651 (2008).
- Yin, X., et al. Engineering Stem Cell Organoids. Cell Stem Cell. 18 (1), 25-38 (2016).
- Sachs, N., et al. A Living Biobank of Breast Cancer Organoids Captures Disease Heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Kim, M., et al. Patient-derived lung cancer organoids as in vitro cancer models for therapeutic screening. Nature Communications. 10 (1), 3991 (2019).
- Okano, M., et al. Orthotopic Implantation Achieves Better Engraftment and Faster Growth Than Subcutaneous Implantation in Breast Cancer Patient-Derived Xenografts. Journal of Mammary Gland Biology and Neoplasia. 25 (1), 27-36 (2020).
- Zhang, Y., et al. Establishment of a murine breast tumor model by subcutaneous or orthotopic implantation. Oncology Letters. 15 (5), 6233-6240 (2018).
- Zhang, W., et al. Comparative Study of Subcutaneous and Orthotopic Mouse Models of Prostate Cancer: Vascular Perfusion, Vasculature Density, Hypoxic Burden and BB2r-Targeting Efficacy. Scientific Reports. 9 (1), 11117 (2019).
- Kim, R., Emi, M., Tanabe, K. Cancer immunoediting from immune surveillance to immune escape. Immunology. 121 (1), 1-14 (2007).
- Rosato, R. R., et al. Evaluation of anti-PD-1-based therapy against triple-negative breast cancer patient-derived xenograft tumors engrafted in humanized mouse models. Breast Cancer Research. 20 (1), 108 (2018).
- Choi, Y., et al. Studying cancer immunotherapy using patient-derived xenografts (PDXs) in humanized mice. Experimental and Molecular Medicine. 50 (8), 99 (2018).
- Meraz, I. M., et al. An Improved Patient-Derived Xenograft Humanized Mouse Model for Evaluation of Lung Cancer Immune Responses. Cancer Immunol Res. 7 (8), 1267-1279 (2019).
- Wege, A. K. Humanized Mouse Models for the Preclinical Assessment of Cancer Immunotherapy. Biodrugs. 32 (3), 245-266 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved