Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İnsan Meme Kanseri Kök Hücrelerinin Hücre ve Doku Örneklerinden İzolasyonu ve Fonksiyonel Değerlendirmesi
Bu Makalede
Özet
Bu deneysel protokol, BCSC'lerin meme kanseri hücre ve doku örneklerinden izolasyonunun yanı sıra BCSC fenotipini ve fonksiyonunu değerlendirmek için kullanılabilecek in vitro ve in vivo testleri tanımlamaktadır.
Özet
Meme kanseri kök hücreleri (BCSC'ler), kalıtsal veya edinilmiş kök hücre benzeri özelliklere sahip kanser hücreleridir. Düşük sıklıklarına rağmen meme kanserinin başlamasına, nüksetmesine, metastaza ve tedavi direncine önemli katkılarda bulunurlar. Meme kanseri tedavisinde yeni terapötik hedefler belirlemek için meme kanseri kök hücrelerinin biyolojisini anlamak zorunludur. Meme kanseri kök hücreleri, CD44, CD24 gibi benzersiz hücre yüzey belirteçlerinin ekspresyonuna ve aldehit dehidrojenazın (ALDH) enzimatik aktivitesine dayanarak izole edilir ve karakterize edilir. Bu ALDHyüksekCD44 + CD24- hücreleri BCSC popülasyonunu oluşturur ve aşağı akış fonksiyonel çalışmaları için floresan ile aktive edilmiş hücre sıralama (FACS) ile izole edilebilir. Bilimsel soruya bağlı olarak, BCSC'lerin fonksiyonel özelliklerini değerlendirmek için farklı in vitro ve in vivo yöntemler kullanılabilir. Burada, insan BCSC'lerinin hem meme kanseri hücrelerinin heterojen popülasyonlarından hem de meme kanseri hastalarından elde edilen primer tümör dokusundan izole edilmesi için ayrıntılı bir deneysel protokol sunuyoruz. Ek olarak, BCSC fonksiyonunu değerlendirmek için kullanılabilecek koloni oluşturma testleri, mamosfer testleri, 3D kültür modelleri ve tümör ksenogreft testleri dahil olmak üzere aşağı akış in vitro ve in vivo fonksiyonel tahlillerini vurguluyoruz.
Giriş
İnsan meme kanseri kök hücrelerinin (BCSC'ler) hücresel ve moleküler mekanizmalarını anlamak, meme kanseri tedavisinde karşılaşılan zorlukları ele almak için çok önemlidir. BCSC kavramının ortaya çıkışı, CD44 + CD24 / düşük meme kanseri hücrelerinin küçük bir popülasyonunun farelerde heterojen tümörler üretebildiği 1,2 bulunduğu21. yüzyılın başlarına kadar uzanmaktadır. Daha sonra, aldehit dehidrogenazın (ALDH yüksek) enzimatik aktivitesiyüksek olan insan meme kanseri hücrelerinin de benzer kök hücre benzeri özellikler gösterdiği gözlenmiştir3. Bu BCSC'ler, kendini yenileme ve farklılaşma yeteneğine sahip küçük bir hücre popülasyonunu temsil eder ve toplu tümörlerin heterojen doğasına katkıda bulunur 1,2,3. Biriken kanıtlar, evrimsel olarak korunmuş sinyal yollarındaki değişikliklerin BCSC'nin hayatta kalmasını ve bakımını sağladığını göstermektedir 4,5,6,7,8,9,10,11,12,13,14 . Ek olarak, hücre dışsal mikro ortamının farklı BCSC fonksiyonlarının dikte edilmesinde çok önemli bir rol oynadığı gösterilmiştir15,16,17. Bu moleküler yollar ve BCSC fonksiyonunu düzenleyen dış faktörler meme kanseri nüksetmesine, metastaza18 ve tedavilere direnç gelişimine katkıda bulunur 19,20,21, tedavi sonrası BCSC'lerin kalıntı varlığı meme kanseri hastalarının genel sağkalımında büyük bir zorluk oluşturmaktadır22,23 . Bu nedenle, bu faktörlerin klinik öncesi değerlendirilmesi, meme kanseri hastalarında daha iyi tedavi sonuçları elde etmek ve genel sağkalımı iyileştirmek için yararlı olabilecek BCSC hedefleme tedavilerinin belirlenmesinde çok önemlidir.
BCSC'leri 24,25,26,27,28,29 karakterize etmek için çeşitli in vitro insan meme kanseri hücre hattı modelleri ve in vivo insan ksenograft modelleri kullanılmıştır. Hücre hatlarının her ardışık geçişten sonra sürekli olarak yeniden doldurulma yeteneği, bunları omik tabanlı ve farmakogenomik çalışmalar yapmak için ideal bir model sistemi haline getirir. Bununla birlikte, hücre hatları genellikle hasta örneklerinde gözlenen heterojenliği özetlemekte başarısız olur. Bu nedenle, hücre hattı verilerini hasta kaynaklı örneklerle tamamlamak önemlidir. BCSC'lerin en saf haliyle izolasyonu, BCSC'lerin ayrıntılı karakterizasyonunu sağlamak için önemlidir. Bu saflığın elde edilmesi, BCSC'lere özgü fenotipik belirteçlerin seçimine bağlıdır. Şu anda, ALDHyüksekCD44 + CD24- hücre fenotipi, maksimum saflık için floresan aktive hücre sıralama (FACS) kullanarak insan BCSC'lerini toplu meme kanseri hücre popülasyonlarından ayırt etmek ve izole etmek için en yaygın olarak kullanılmaktadır1, 3,26. Ayrıca, izole BCSC'lerin kendini yenileme, proliferasyon ve farklılaşma gibi özellikleri in vitro ve in vivo teknikler kullanılarak değerlendirilebilir.
Örneğin, in vitro koloni oluşturma testleri, farklı tedavi koşullarının varlığında tek bir hücrenin 50 veya daha fazla hücreden oluşan bir koloni oluşturmak için kendini yenileme yeteneğini değerlendirmek için kullanılabilir30. Mamosfer testleri, ankrajdan bağımsız koşullar altında meme kanseri hücrelerinin kendini yenileme potansiyelini değerlendirmek için de kullanılabilir. Bu tahlil, tek hücrelerin serumsuz yapışkan olmayan kültür koşullarındaki her ardışık geçişte küreler (BCSC'lerin ve BCSC'lerin karışımı) olarak üretme ve büyüme yeteneğini ölçer31. Ek olarak, in vivo mikro çevreyi yakından özetleyen ve potansiyel BCSC hedefli tedavilerin aktivitesinin araştırılmasına izin veren hücre-hücre ve hücre-matris etkileşimleri de dahil olmak üzere BCSC fonksiyonunu değerlendirmek için 3 Boyutlu (3D) kültür modelleri kullanılabilir32. İn vitro modellerin çeşitli uygulamalarına rağmen, in vivo koşulların karmaşıklığını sadece in vitro tahlilleri kullanarak modellemek zordur. Bu zorluk, BCSC davranışını in vivo olarak değerlendirmek için fare ksenograft modellerinin kullanılmasıyla aşılabilir. Özellikle, bu tür modeller meme kanseri metastazı33'ü değerlendirmek, hastalık progresyonu sırasında mikroçevre ile etkileşimleri araştırmak 34, in vivo görüntüleme35 ve antitümör ajanların hastaya özgü toksisitesini ve etkinliğini tahmin etmek için ideal bir sistem olarak hizmet eder34.
Bu protokol, insan ALDHyüksekCD44 + CD24- BCSC'lerinin heterojen meme kanseri hücrelerinin toplu popülasyonlarından maksimum saflıkta izolasyonu için ayrıntılı bir açıklama sağlar. Ayrıca, üç in vitro tekniğin (koloni oluşturma testi, mamosfer testi ve 3D kültür modeli) ve BCSC'lerin farklı fonksiyonlarını değerlendirmek için kullanılabilecek bir in vivo tümör ksenograft testinin ayrıntılı bir tanımını sunuyoruz. Bu yöntemler, BCSC biyolojisini anlamak ve / veya yeni BCSC hedefleme tedavilerini araştırmak amacıyla BCSC'leri insan meme kanseri hücre hatlarından veya birincil hasta kaynaklı meme kanseri hücrelerinden ve tümör dokusundan izole etmek ve karakterize etmek isteyen araştırmacılar tarafından kullanılmak üzere uygun olacaktır.
Protokol
Hasta kaynaklı cerrahi veya biyopsi örneklerinin doğrudan rıza gösteren meme kanseri hastalarından toplanması, kurumsal etik kurul tarafından onaylanan onaylanmış insan etiği protokolü kapsamında gerçekleştirilmiştir. Hasta kaynaklı ksenogreft modelleri üretmek için kullanılan tüm fareler, kurum onaylı bir hayvan tesisinde muhafaza edildi ve barındırıldı. Fareler kullanılarak hasta kaynaklı ksenogreft modellerinden elde edilen tümör dokusu, kurumsal hayvan bakım komitesi tarafından onaylanan onaylanmış etik protokole göre oluşturulmuştur.
1. Hücre hatlarının hazırlanması
- Tüm hücre kültürü ve boyama prosedürlerini steril koşullar altında bir biyogüvenlik kabininde gerçekleştirin. Steril hücre kültürü tabakları/şişeleri ve reaktifleri kullanın.
- İnsan meme kanseri hücrelerini, fetal sığır serumu (FBS) ve her hücre hattına özgü gerekli büyüme faktörleri ile desteklenmiş tanımlanmış ortamda% 5 CO2 ile 37 ° C'de tutun.
- Fare NIH3T3 fibroblast hücre kültürlerini (koloni oluşturma tahlillerinde kullanım için) 37 ° C'de, Dulbecco'nun Modifiye Kartal Ortamı'nda (DMEM)% 10 FBS ile desteklenen% 5 CO2 ile koruyun.
- Tüm kültürler için, eski medyayı her 2-3 günde bir taze medya ile doldurun. Kültürler% 75-80 akıcılığa ulaştığında, çoklu steril hücre kültürü şişelerine alt kültür şişeleri.
2. Meme kanseri tümör dokusunun hazırlanması
- Hasta kaynaklı cerrahi veya biyopsi örneklerini kurumsal etik kurulu tarafından onaylanan bir insan etiği protokolü kapsamında doğrudan rıza gösteren meme kanseri hastalarından toplar.
- Daha sonra, kurumsal hayvan bakım komitesi tarafından onaylanan bir hayvan etiği protokolü kapsamında fareleri kullanarak hasta kaynaklı ksenogreft modellerinden tümör dokusu toplayın ve üretin.
- Steril koşullar altında tüm tümör dokularını 30 mL DMEM: F12 ortamı içeren 50 mL steril konik bir tüpte toplayın, buz üzerinde tutun ve örnekleri aşağıda açıklandığı gibi toplama işleminden sonraki 2 saat içinde işleyin.
3. Meme kanseri hücrelerinin tek hücreli süspansiyonlarının oluşturulması
- % 60-80 oranında kaynaşan tek katmanlı meme kanseri hücresi içeren şişeden aspirat ortamı (tercih edilen hücre hatları). Hücreleri 1x fosfat tamponlu salin (PBS) ile yıkayın. PBS'yi aspire edin ve uygun hücre ayrışma çözeltisi ekleyin (örneğin, Tripsin: EDTA; hücrelerin tek katmanını örtmek için yeterli) ve oda sıcaklığında (önerilen) veya 37 ° C'de 5 dakika boyunca inkübe edin.
- Hücre ayrışma çözeltisinin aktivitesini nötralize etmek için 5 mL kültür ortamı ekleyin.
- Elde edilen ayrışmış hücre çözeltisini 50 mL'lik bir konik tüpe aktarın ve 5 dakika boyunca 1000 x g'de santrifüj yapın.
- Süpernatantı atın ve hücre peletini 5 mL'lik 1x PBS'de yeniden askıya alın. Bir hemositometre ve mikroskop kullanarak hücreleri sayın.
NOT: Hemositometrede hücre kümelenmesine dikkat edin. Tek hücre süspansiyonu oluşmadıysa hücre ayrışma adımını tekrarlayın. - Hücre sayımından sonra, hücre süspansiyonunu 5 dakika boyunca 1000 x g'de yeniden santrifüj edin, süpernatanı atın ve hücre peletini ALDH substrat tamponunda 1 x 106 hücre / mL konsantrasyonunda yeniden askıya alın.
4. Doku örneklerinden tek hücreli süspansiyon üretimi
- Yaklaşık 1 mm boyutunda daha küçük parçalar elde etmek için çapraz tekniği kullanarak tümör dokusunu cerrahi bıçaklarla kesin. Doku parçalarını 10 mL ayrışma tamponu (DMEM: F12'de 1X Kollajenaz) içeren taze bir 50 mL konik tüpe aktarın. Konik tüpü parafilm ile kapatın ve 37 ° C'de bir çalkalayıcı inkübatörde 40 dakika boyunca inkübe edin.
NOT: Bir çalkalayıcı inkübatör yoksa, tüpü 37 ° C'lik bir su banyosuna yerleştirin ve tüpü her 5-10 dakikada bir vorteks yaparak karıştırın. - Sindirilen dokuyu 5 dakika boyunca 530 x g'de santrifüj yaparak toplayın. Süpernatantı atın ve 5 mL tripsin ekleyin. Pelet bozmak ve 37 °C'lik bir su banyosunda 5 dakika boyunca inkübe etmek için 1 mL pipet (750 μL işaretine ayarlanmış) kullanarak pipeti yukarı ve aşağı doğru çekin. Kuluçkadan sonra, tek hücreleri serbest bırakmak için kuvvetli bir şekilde yukarı ve aşağı pipetleyin.
- DMEM:F12 medya ile tüpteki toplam hacmi 25 mL'ye yükseltin ve 5 dakika boyunca 1000 x g'de santrifüj yapın. Süpernatantı atın ve peleti 1 mL dispase-DNaz çözeltisinde yeniden askıya alın. 37 °C su banyosunda 5 dakika boyunca inkübe edin.
- PBS ile tüpteki toplam hacmi 10 mL'ye yükseltin. Yukarı ve aşağı pipetle indirerek karıştırın, elde edilen hücre süspansiyonunu taze bir 50 mL konik tüpe bağlı 40 μm hücre süzgecinden geçirin. 5 dakika boyunca 1000 x g'de santrifüj.
- Süpernatantı atın ve hücre peletini 5 mL 1x PBS'de yeniden askıya alın. Hücreleri sayın ve 3.4 ve 3.5 numaralı adımlarda açıklandığı gibi hücre süspansiyonunun tam olarak hazırlanması.
5. Meme kanseri kök hücrelerinin (BCSC) izolasyonu
- Lekesiz kontrol için etiket akış tüpleri, tek hücreli boyama kontrolleri (DEAB kontrolü, ALDH, CD44-PE, CD24-PE-Cy7, 7AAD), negatif kontrol tüpü (DEAB, CD44-PE, CD24-PE-Cy7 ve 7AAD ile boyanmış), floresan eksi bir (FMO) kontrolü ve 'sıralama' tüpü (ALDH, CD44, CD24 ve 7AAD ile boyanmış).
- Adım 3.5 veya adım 4.5'teki hücre süspansiyonlarının 500 μL'sini (0.5 x 106 hücre) yalnızca hücreler, CD44, CD24 ve 7AAD olarak etiketlenmiş her tüpe aktarın. Tüpleri kullanana kadar buz üzerine yerleştirin.
- 2 mL numuneyi (2 x 106 hücre) ilgili 'ALDH' tüpüne aktarın. 'DEAB kontrolü' ve 'negatif kontrol' tüplerine 5 μL DEAB ekleyin ve sıkıca kapatın. 'ALDH' tüpüne 10 μL ALDH substratı ekleyin, vorteks yaparak iyice karıştırın ve hemen 500 μL'yi karşılık gelen 'DEAB kontrolü' ve 'negatif kontrol' tüpüne aktarın. 'DEAB kontrolü', 'negatif kontrol' ve 'ALDH tüplerini' özetleyin ve 37 ° C'de 30-60 dakika (60 dakikayı geçmeyin) inkübe edin.
NOT: Optimum inkübasyon süresi, hücre hattına bağlı olarak optimizasyon gerektirebilir. ALDH substratını ve lekeli hücreleri içeren tüpleri daima ışıktan koruyun. - Kuluçkayı takiben, tüm numuneleri 250 x g'da 5 dakika boyunca santrifüj edin. Hücreleri 500 μL ALDH substrat tamponunda yeniden askıya alın. Üretici tarafından önerilen veya kullanıcı tarafından optimize edilen anti-CD44-PE ve anti-CD24-PE-Cy7 antikor kokteyli konsantrasyonunu ekleyin ve 30 dakika boyunca 4 °C'de inkübe edin. İlgili 'CD44' ve 'CD24' etiketli tüplere anti-CD44-PE ve anti-CD24-PE-Cy7 antikorları ekleyin.
- Kuluçkayı takiben, tüm numuneleri 5 dakika boyunca 250 x g'de santrifüj edin. Hücreleri 500 μL ALDH substrat tamponunda yeniden askıya alın. 'Negatif kontrol' tüpünü, 'Sıralama tüpünü' ve '7ADD' tüpünü 7AAD (önerilen konsantrasyon: 0.25 μg / 1 x 106 hücre) ile buz üzerinde 10 dakika boyunca inkübe edin.
NOT: ALDH aktivitesi yeşil floresan kanalda tespit edilir, bu nedenle farklı bir uyumlu emisyon spektrumuna sahip bir florokrom kullanılmalıdır. Çok parametreli akış sitometrisi sırasında spektral örtüşmenin gözlendiği durumlarda, tek renk kontrolleri ve FMO kontrolü, floresan sinyalin diğer kanallara dökülmesini en aza indirmek için florokromlar arasında kompanzasyona izin vermek için bir kılavuz olarak kullanılmalıdır. - Numune analizine hazırlık için FACS cihazında analiz protokolünü ayarlayın. Dağılım grafikleri oluşturun (ileriye karşı yan saçılım, ileri dağılım ve floresan kanallar).
- Lekesiz kontrolü kullanarak, enkazı tüm hücre popülasyonundan ayırmak için fotoçarpanı ayarlayın ve tüm hücre popülasyonunu ilk kütük ölçeği etrafında hareket ettirmek için floresan voltajını ayarlayın (101). DEAB denetimini kullanarak, yeşil floresan voltaj kanalını ayarlayarak tüm hücre popülasyonunu ikinci günlük ölçeği (102) içinde hareket ettirin.
- Önce tüm tek boyama kontrollerini (ALDH, CD44-PE, CD24-PE-Cy7) ve 7AAD ve FMO kontrolünü analiz edin, boyanmış hücreleri lekesiz hücrelerden ayırmak ve floresan sinyallerin diğer kanallara dökülmesini en aza indirmek için voltajı ayarlayın.
- Her bir lekeli hücre örneği için pozitif popülasyon kapısı. Negatif kontrol tüpünü, canlılık kapısını (7AAD negatif), ALDHdüşük ve ALDHyüksek hücre popülasyonlarını ( Şekil 1B'de gösterilen temsili geçit stratejisi) kullanarak.
- Uygulanabilir ALDHdüşük ve ALDHyüksek kapılarını kullanarak, sırasıyla CD44 + CD24- (BCSC) ve CD44-CD24 + (BCSC olmayan) hücre popülasyonunu seçin (Şekil 1B).
- Steril toplama tüplerinde toplama ortamlarında uygulanabilir BCSC'leri ve BCSC olmayanları toplayın ( Şekil 2 A& B'de gösterilen iki temsili hücre hattından popülasyonlar). Aşağıda açıklandığı gibi aşağı akış in vitro ve in vivo tahlilleri için sıralanmış hücreler kullanın.
NOT: Aşağıda açıklanan in vitro ve in vivo testlere ek olarak, BCSC'ler standart immünoblotlama teknikleri ile SOX2, OCT4 ve NANOG gibi pluripotent belirteçlerin ekspresyonunu ölçerek doğrulanabilir.
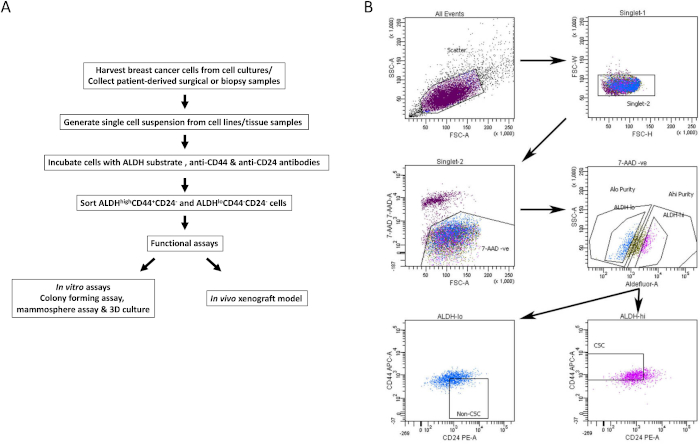
Şekil 1: BCSC'lerin meme kanseri hücre hatlarından ve doku örneklerinden izolasyonu için FACS geçit stratejisi. (A) BCSC izolasyon prosedürünü açıklayan akış şeması. (B) Canlı BCSC'leri ve BCSC olmayanları heterojen bir hücre havuzundan izole etmek için kullanılan sıralama stratejisini gösteren temsili FACS grafikleri. MDA-MB-231 insan meme kanseri hücreleri aynı anda 7-AAD, CD44-APC, CD24-PE ve ALDH substratı ile etiketlenir. Hücre alt kümeleri, bir FACS makinesinde dört renkli bir protokol kullanılarak izole edildi. Hücreler beklenen ışık saçılımına göre, daha sonra singlet'lar için ve 7-AAD dışlamasına dayalı olarak yaşayabilirliğe göre seçilir. Hücreler daha sonra ALDH aktivitesi için analiz edilir ve en üst% 20 en pozitif ALDHyüksek popülasyonu olarak seçilirken, en düşük ALDH aktivitesine sahip hücrelerin alt% 20'si ALDHdüşük olarak kabul edilir. Son olarak, ALDH düşük hücrelerinin% 50'si CD44düşük / -CD24 + fenotipine göre seçilir ve ALDHyüksek hücrelerinin% 50'si CD44 + CD24 fenotipine göre seçilir. Bu rakam Chu ve ark.17'den uyarlanmıştır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
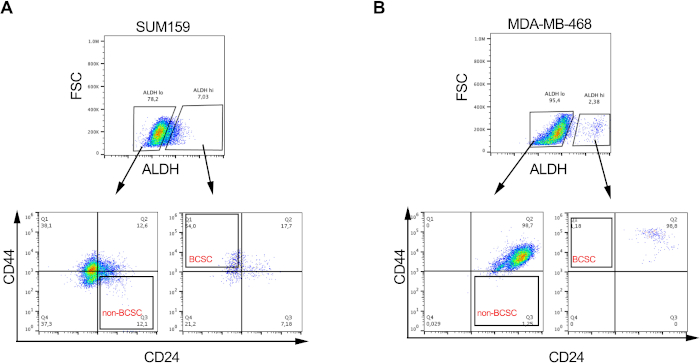
Şekil 2: BCSC'lerin oranları farklı meme kanseri hücre hatlarında değişkendir. (A) SUM159 ve (B) MDA-MD-468 üçlü negatif meme kanseri hücre hatlarındaki BCSC'lerin ve BCSC olmayanların diferansiyel oranını, Şekil 1'de açıklandığı gibi etiketleme ve sıralamayı takiben gösteren temsili görüntü. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
6. Koloni oluşturma tahlili
- İlgilenilen hücreleri (adım 5.11'den sıralanmış hücreler veya adım 3.5 veya 4.5'ten sıralanmamış hücreler) tam ortamda yeniden askıya alın.
- 1 x 10 2, 2 x 10 2 ve 5 x 102 hücre için üç akış tüpünü etiketleyin. 2 mL tam ortam ekleyin ve uygun hücre numarasını (adım 5.11'den sıralanmış veya adım 3.5 veya 4.5'ten sıralanmamış hücreler) ilgili tüplere aktarın. Hücre çözeltilerini 5 kez yukarı ve aşağı pipetleyerek, iyice karıştırın.
- Hücreleri 6 delikli bir plakaya yerleştirin ve hücrelerin düzgün dağılımını elde etmek için plakaları hafifçe döndürerek hücre süspansiyonunu dağıtın.
- Koloniler ortaya çıkana kadar plakaları 37 ° C,% 5 CO2 inkübatöründe inkübe edin (burada koloniler = koloni başına ≥50 hücre). Koloni oluşumunu bozmadan haftada iki kez medyayı dikkatlice doldurun.
- Ortamları aspire edin ve 1 mL PBS ile bir kez yıkayın. Her bir oyuğa 0,5 mL% 0,05 kristal menekşe çözeltisi ekleyin ve plakayı 30 dakika inkübe edin. Fazla kristal menekşe lekesini 2 mL su ile yıkayarak çıkarın. Arka plan lekesi giderilene kadar yıkama adımını tekrarlayın.
- 4x ve 10x büyütmede bir mikroskop kullanarak, üretilen toplam koloni sayısını sayın ve kaydedin ( Şekil 3A'da gösterilen temsili görüntüler).
- Koloni oluşum sıklığını aşağıdaki gibi hesaplayın: Frekans (%) = (oluşan koloni sayısı/tohumlanan hücre sayısı) x 100. Örneğin, 1 x 10 2 hücreden 25 koloni üretilirse, koloni oluşumunun sıklığı, Frekans = (25/100) x100 =% 25'tir.
- Alternatif olarak, 6.1 ila 6.4 arasındaki adımları, gerekli büyüme ve hayatta kalma faktörlerinin üretimi yoluyla BCSC'ler için mikroçevresel bir destek sağlayan fibroblastlarla ko-kültürü içeren alternatif bir yöntemle değiştirin.
- Tip I sığır kollajeni içeren ön kat hücreli 60 mm kültür yemekleri (3 mg/mL kollajenin 30 seyreltilmesinde 1). Kollajenin 37 °C'lik bir inkübatörde 30 dakika boyunca polimerize olmasına izin verin. Polimerize edilmemiş kollajeni aspire edin ve plakayı 1x PBS ile iki kez yıkayın. Kollajen kaplı plakayı 1 mL PBS ile örtün ve kullanana kadar oda sıcaklığında bir kenara koyun.
- 1 x 10 3, 5 x 103 ve 1 x 104 hücre için üç akış tüpünü etiketleyin. 4 mL koloni oluşturan tahlil ortamı ekleyin ve uygun sayıda hücreyi (adım 5.11'den sıralanmış veya adım 3.5 veya 4.5'ten sıralanmamış hücreler) ilgili tüplere aktarın. Işınlanmış fare NIH3T3 fibroblastları ekleyin (4 x 104 hücre/mL ortam). Hücre çözeltilerini 5 kez yukarı ve aşağı pipetleyerek, iyice karıştırın.
- PBS'yi kollajen kaplı kültür kabından adım 6.1'den aspire edin ve hücre karışımını adım 6.3'te açıklandığı gibi hücre kültürü plakalarının her birine tabaklayın.
- Plakaları 37 ° C,% 5 CO2 inkübatöründe inkübe edin ve medyayı doldurmadan 7-10 gün boyunca veya koloniler oluşana kadar bozulmadan bırakın. Adım 6.6 ve 6.7'de açıklandığı gibi oluşturulan toplam koloni sayısını sayın ve kaydedin.
7. Mamosfer testi
- İlgilenilen hücreleri (adım 5.11'den sıralanmış hücreler veya adım 3.5 veya 4.5'ten sıralanmamış hücreler) tam mamosfer ortamında ve plaka hücrelerinde, 96 kuyu ultra düşük bağlanma hücre kültürü plakasında 5 x 102 hücre /cm2 alanın tohumlama yoğunluğunda yeniden askıya alın.
NOT: Hücre tohumlama yoğunluğu, farklı hücre hatları için optimize edilmelidir. - Kültür plakalarını% 5 CO 2 ile 37 ° C'lik bir inkübatörde 5-10 gün boyuncainkübe edin. Mamosfer oluşumunu bozmadan haftada iki kez medyayı dikkatlice doldurun.
- Kuluçkadan sonra, mikroskop kullanarak her kuyuda üretilen mamosfer sayısını sayın; mamosferlerin çapı 100 μm'den büyük meme kanseri hücre kümeleri olarak tanımlandığı durumlarda ( temsili görüntüler Şekil 3B'de gösterilmiştir).
- Mamosfer oluşum verimliliğini (MFE) aşağıdaki gibi hesaplayın: MFE (%) = (kuyu başına mamosfer sayısı)/ (kuyu başına tohumlanan hücre sayısı) x 100 (yani, bir kuyuda 1 x 102 hücre tarafından 5 mamosfer üretiliyorsa, MFE = (5/100) x 100 =% 5).
- Alt kültür mamosferleri için, mamosfer içeriği içeren ortamları 5 dakika boyunca 1000 x g'de taze bir 50 mL konik tüp ve santrifüj ortamına dikkatlice aktarın. Süper natantı dikkatlice çıkarın, hücre peletini 500 μL tripsin içinde yeniden askıya alın ve oda sıcaklığında 5 dakika inkübe edin.
- Süpernatantı atın ve peleti 1 mL tam mamosfer ortamında yeniden askıya alın. Bir hemositometre kullanarak hücreleri sayın ve adım 7.1'de açıklandığı gibi ultra düşük bir bağlanma hücre kültürü plakasındaki hücreleri yeniden plakalayın.
NOT: Alt kültürlemeye ek olarak, mamosfer kaynaklı hücreler, BCSC fenotipini değerlendirmek ve / veya diğer aşağı akış testleri için saf BCSC popülasyonları elde etmek için FACS tarafından daha fazla analiz edilebilir. - Hücre popülasyonlarınızda bulunan mamosfer başlatıcı hücrelerin sayısını belirlemek için, küre sınırlayıcı seyreltme analizini (SLDA) içeren alternatif bir yöntem kullanın. 96 kuyu ultra düşük bağlantı hücre kültürü plakasında yüksek ila düşük hücre numaralarının seri seyreltmelerinde plaka hücreleri, kuyu başına bir hücreden daha azıyla sonuçlanan en yüksek seyreltme ile.
- Kültür plakasını% 5 CO2 ile 37 ° C'lik bir inkübatörde 10-14 gün boyunca inkübe edin ve hücre kümelenmesini önlemek için rahatsız edilmeden bırakın.
- Kuluçkadan sonra, mikroskop kullanarak her kuyuda üretilen mamosfer sayısını sayın; mamosferlerin çapı 100 μm'den büyük meme kanseri hücre kümeleri olarak tanımlandığı yerlerde. Aşırı Sınırlayıcı Seyreltme Analizi (ELDA) çevrimiçi yazılımını (http://bioinf.wehi.edu.au/software/elda/) kullanarak küre başlatan frekansı ve önemi hesaplayın.
8.3D kültür modeli
- Deneysel soruya bağlı olarak, büyüme faktörleri olan veya olmayan (azaltılmış) bazal membran ekstraktı (BME) kullanın. Bireysel büyüme faktörünün kanser hücreleri üzerindeki etkisini değerlendirmek için, büyüme faktörü azaltılmış BME'yi kullanın. Ayrıca, BME'de bulunan endojen büyüme faktörlerinin spesifik olmayan etkilerini en aza indirmeye yardımcı olur.
NOT: BME 10 °C'nin üzerinde katılaşır. Çözülme adımında bile BME'yi daima buz üzerinde tutun. - Hava kabarcıkları oluşturmadan 96 delikli bir plakaya kuyucuk başına 50 μL BME'yi dikkatlice ekleyin ve 1 saat boyunca 37 ° C'de polimerize olmasına izin verin. 10 dakikalık inkübasyondan sonra, jel tabakasının kurumasını önlemek için 100 μL PBS ekleyin.
- Sıralanmış hücreleri adım 5.11'den veya sıralanmamış hücreleri adım 3.5 veya 4.5'ten 3B kültür ortamında 5 x 103 ila 5 x 104/200 μL konsantrasyonda yeniden askıya alın.
- BME polimerize olduktan sonra, PBS'yi çıkarın, her bir kuyucuğa 200 μL hücre süspansiyonu ekleyin ve% 5 CO2 ile 37 ° C inkübatörde inkübe edin. Ortamın buharlaşmasını önlemek için çevredeki kuyucuklara PBS ekleyin.
NOT: Kaplama için en uygun hücre sayısı, deneyin ayarlanmasından önce belirlenmelidir. Deneysel soruya bağlı olarak, BCSC'ler tek başlarına veya diğer hücre tipleriyle (fibroblastlar / endotel / immün hücreler vb.) birlikte kültürlenebilir. - Kültür plakalarına haftada iki kez taze medya ekleyin. Organoidlerin oluşumunu analiz etmeden önce kültürleri 10-14 gün boyunca koruyun ( Şekil 3C'de gösterilen temsili görüntüler).
- Alt kültürleme için, ortamı dikkatlice aspire edin ve hücreleri içeren her bir kuyucuğa 200 μL dispase ekleyin. Plakayı 37 °C'lik bir inkübatörde 1 saat boyunca inkübe edin. Kuluçka süresinin yarısında (30 dakika), plakayı çıkarın, dispase çözeltisini 5 kez yukarı ve aşağı yavaşça pipetleyin ve inkübatöre 30 dakika daha geri yerleştirin.
- 1 saat sonra, ayrışmış hücre çözeltisini bir akış tüpüne aktarın. Kuyuyu% 2 FBS (fPBS) içeren 1x PBS ile yıkayın ve akış tüpüne aktarın. Tüpü 5 dakika boyunca 1000 x g'de santrifüj yapın. Süpernatantı dikkatlice aspire edin ve 500 μL tripsin ekleyin, 5 dakika boyunca 37 ° C'de inkübe edin. 5 dakika boyunca 1000 x g'de eşit miktarda fPBS ve santrifüj ekleyerek tripsisini devre dışı bırakın.
- Süpernatantı atın ve peleti 1 mL 3D kültür ortamında yeniden askıya alın. Hücreleri sayın ve BME'deki gerekli hücre sayısını 8.2 ila 8.4 arasındaki adımlarda olduğu gibi yeniden plakalayın.
NOT: İlgilenilen hücre popülasyonunu daha fazla analiz etmek veya sıralamak için birden fazla kuyu toplanabilir.
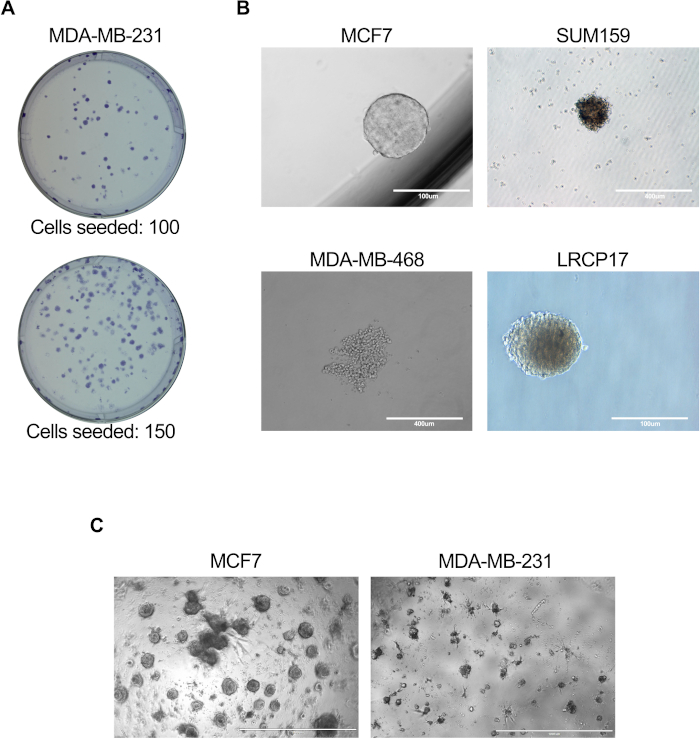
Şekil 3: BCSC hücre fonksiyonunu değerlendirmek için in vitro testler. İn vitro testler, protokol bölümleri 6.1 ila 6.5 (A), 7.1 ila 7.4 (B) veya 81'de açıklandığı gibi yapıldı. 8,4 + 8,6 (C) 'ye kadar. (A) MDA-MB-231 insan meme kanseri hücreleri tarafından üretilen kolonileri gösteren temsili görüntü; (B) MCF7, SUM159 veya MDA-MB-468 insan hücre hatları ve hasta kaynaklı LRCP17 meme kanseri hücreleri tarafından mamosfer oluşumunu gösteren temsili görüntüler. (C) 3D kültür modellerinde MCF7 ve MDA-MB-231 meme kanseri hücrelerinin oluşturduğu 3D yapıları gösteren temsili görüntüler. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
NOT: Kurumsal hayvan bakım komitesi tarafından onaylanan bir hayvan etiği protokolü kapsamında hayvan deneyleri yapın.
9. In vivo ksenograft modeli
- Meme kanseri kök hücrelerinin tümör başlatma kapasitesini belirlemek için, sınırlayıcı bir seyreltme yaklaşımı kullanarak hücreleri (adım 5.7'den sıralanmış popülasyon veya adım 3.5 veya 4.5'ten sıralanmamış popülasyonlar) hazırlayın. PBS'deki hücreleri, 0.01-0.2 x 10 2 hücre / 100 μL kadar düşük ve 1 x 106 hücre / 100 μL kadar yüksek dozlarda 1 ila 5 farklı seyreltme grubu kullanarak seri olarak seyreltin.
NOT: Sıralanmamış/tüm popülasyon hücreleri kontrol olarak kullanılabilir. Kullanılan seyreltme gruplarının sayısı, istenen bilimsel sonuca bağlı olacaktır (örneğin, sadece tümörjeniteyi test ederse, daha yüksek bir hücre sayısında 1 grup kullanılabilirken, tümör başlatma kapasitesini hesaplarken, 5 sınırlayıcı seyreltme dozunu test etmek en uygunudur). - İnsan meme kanseri hücrelerinden ksenogreft modelleri oluşturmak için, bağışıklık sistemi baskılanmış dişi fareler kullanın (atimik çıplak [nu / nu], obez olmayan diyabetik / şiddetli kombine immün yetmezlikli [NOD / SCID] veya NOD / SCID IL2γ [NGS] suşları).
NOT: Grup başına en az 4 hayvan kullanılabilse de, özellikle seyreltme analizini sınırlamak için sağlam sonuçlar elde etmek için grup başına 8-12 hayvan önerilir. - Bir biyogüvenlik kabininde steril koşullar altında, her hücre preparatının 100 μL/faresini kullanarak standart meme yağ yastığı (MFP) enjeksiyonları gerçekleştirin.
NOT: Optimal meme tümörü büyümesi ve uzak organlara spontan metastaz için torasik MFP önerilir. Alternatif olarak, kasık MFP de kullanılabilir. - Enjeksiyon sonrası, enjeksiyon bölgesinde genel sağlık ve tümör büyümesi için fareleri günlük olarak izleyin. Palpe edilebilir bir tümörün tespiti üzerine, tümör boyutunu iki dik boyutta kumpaslarla ölçmeye başlayın ve son noktaya kadar haftalık olarak kaydedin.
NOT: Deneysel bitiş noktası, kurumsal hayvan etiği protokolünde ortaya konan düzenlemelere dayanarak belirlenir; Tipik olarak, ötanazi ile sonlanım noktası genellikle tümör hacimleri 1500mm3'e ulaştığında gereklidir. BCSC popülasyonları ve / veya daha yüksek hücre dozları için (örneğin >1 x 104 hücre), bu son noktaya MFP enjeksiyonundan sonraki 4-8 hafta içinde ulaşılacaktır. Çok düşük hücre dozları ve / veya BCSC olmayan hücre popülasyonları için, tümör büyümesinin enjeksiyondan sonra 8 aya kadar ilerlemesine izin verilmelidir. - Bu ölçümlerden, aşağıdaki formülü kullanarak tümör hacmini hesaplayın: mm3 cinsinden hacim = 0.52 x (genişlik)2 x uzunluk. Sınırlayıcı bir seyreltme yaklaşımı kullanıyorsanız, ELDA çevrimiçi yazılımını (http://bioinf.wehi.edu.au/software/elda/) kullanarak tümör başlatıcı kapasiteyi ve önemi hesaplayın.
- Alternatif olarak, sonlanım noktasını insani olarak genişletmek, primer tümörleri cerrahi olarak çıkarmak ve fareleri uzak organlarda spontan metastaz gelişimi ve / veya sağlığı için izlemeye devam etmek. Seri ksenotransplantların üretimi için rezeke edilmiş tümör dokusunu kullanın.
- Son noktada, primer tümörlerden ve uzak organlardan (lenf nodları, akciğer, karaciğer, beyin, kemik) doku toplamak ve histopatolojik ve/veya immünohistokimyasal analizler yapmak veya tümör dokusunu ayrıştırmak ve bölüm 6-8'de tanımlanan in vitro tahlillerde kullanmak.
Sonuçlar
Tanımlanan protokol, insan BCSC'lerinin heterojen bir meme kanseri hücresi popülasyonundan, hücre hatlarından veya ayrışmış tümör dokusundan izole edilmesine izin verir. Herhangi bir hücre hattı veya doku örneği için, BCSC'leri maksimum saflıkta izole etmek için tek tip bir tek hücreli süspansiyon oluşturmak çok önemlidir, çünkü BCSC olmayan popülasyonları kirletmek, özellikle de çalışmanın amacı BCSC'leri hedef alan terapötik ajanların etkinliğini değerlendirmekse, değişken hücre...
Tartışmalar
Meme kanseri metastazı ve tedaviye direnç tüm dünyada kadınlarda mortalitenin önemli nedeni haline gelmiştir. Meme kanseri kök hücrelerinin (BCSC) bir alt popülasyonunun varlığı, metastaz 26,43,44,45,46 ve tedavi direncinin21,47,48 artmasına katkıda bulunur....
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Laboratuvar üyelerimize yararlı tartışmaları ve destekleri için teşekkür ederiz. Meme kanseri kök hücreleri ve tümör mikro ortamı üzerine yaptığımız araştırmalar, Kanada Kanser Araştırma Derneği Araştırma Enstitüsü ve ABD Ordusu Savunma Bakanlığı Meme Kanseri Programı'ndan (Hibe # BC160912) gelen hibelerle finanse edilmektedir. V.B., Batı Doktora Sonrası Bursu (Western University) tarafından desteklenmektedir ve hem A.L.A. hem de V.B. Kanada Meme Kanseri Derneği tarafından desteklenmektedir. C.L., Kanada Hükümeti'nden Vanier Canada Yüksek Lisans Bursu ile desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 7-Aminoactinomycin D (7AAD) | BD | 51-68981E | suggested: 0.25 µg/1x106 cells |
| Acetone | Fisher | A18-1 | |
| Aldehyde dehydrogenase (ALDH) substrate | Stemcell Technologies | 1700 | Sold commerically as part of the ALDEFLOUR Assay kit; follow manufacturer's instructions for ALDH substrate preparation |
| Basement membrane extract (BME) | Corning | 354234 | Sold under the commercial name Matrigel |
| Cell culture plates: 6 well | Corning | 877218 | |
| Cell culture plates: 60mm | Corning | 353002 | |
| Cell culture plates: 96-well ultra low attachment | Corning | 3474 | |
| Cell strainer: 40 micron | BD | 352340 | |
| Collagen | Stemcell Technologies | 7001 | Prepare 1:30 dilution of 3 mg/mL collagen in PBS |
| Collagenase | Sigma | 11088807001 | 1x |
| Conical tubes: 50 mL | Fisher scientific | 05-539-7 | |
| Crystal violet | Sigma | C6158 | Use 0.05% crystal violet solution in water for staining |
| Dispase | Stemcell Technologies | 7913 | 5U/mL |
| DMEM:F12 | Gibco | 11330-032 | 1x, With L-glutamine and 15 mM HEPES |
| DNAse | Sigma | D5052 | 0.1 mg/mL final concentration |
| FBS | Avantor Seradigm Lifescience | 97068-085 | |
| Flow tubes: 5ml | BD | 352063 | Polypropylene round-bottom tubes |
| Methanol | Fisher | 84124 | |
| mouse anti-Human CD24 antibody | BD | 561646 | R-phycoerythrin and Cyanine dye conjugated Clone: ML5 |
| mouse anti-Human CD44 antibody | BD | 555479 | R-phycoerythrin conjugated, Clone: G44-26 |
| N,N-diethylaminobenzaldehyde (DEAB) | Stemcell Technologies | 1700 | Sold commerically as part of the ALDEFLOUR Assay kit; follow manufacturer's instructions DEAB preparation |
| PBS | Wisent Inc | 311-425-CL | 1x, Without calcium and magnesium |
| Trypsin-EDTA | Gibco | 25200-056 | |
| Mammosphere Media Composition | |||
| B27 | Gibco | 17504-44 | 1x |
| bFGF | Sigma | F2006 | 10 ng/mL |
| BSA | Bioshop | ALB003 | 04% |
| DMEM:F12 | Gibco | 11330-032 | 1x, With L-glutamine and 15 mM HEPES |
| EGF | Sigma | E9644 | 20 ng/mL |
| Insulin | Sigma | 16634 | 5 µg/mL |
| 3D Organoid Media Composition | |||
| A8301 | Tocris | 2939 | 500 nM |
| B27 | Gibco | 17504-44 | 1x |
| DMEM:F12 | Gibco | 11330-032 | 1x, With L-glutamine and 15 mM HEPES |
| EGF | Sigma | E9644 | 5 ng/mL |
| FGF10 | Peprotech | 100-26 | 20 ng/mL |
| FGF7 | Peprotech | 100-19 | 5 ng/mL |
| GlutaMax | Invitrogen | 35050-061 | 1x |
| HEPES | Gibco | 15630-080 | 10 mM |
| N-acetylcysteine | Sigma | A9165 | 1.25 mM |
| Neuregulin β1 | Peprotech | 100-03 | 5 nM |
| Nicotinamide | Sigma | N0636 | 5 mM |
| Noggin | Peprotech | 120-10C | 100 ng/mL |
| R-spondin3 | R&D | 3500 | 250 ng/mL |
| SB202190 | Sigma | S7067 | 500 nM |
| Y-27632 | Tocris | 1254 | 5 µM |
Referanslar
- Al-Hajj, M., Wicha, M. S., Benito-Hernandez, A., Morrison, S. J., Clarke, M. F. Prospective identification of tumorigenic breast cancer cells. Proceedings of the National Academy of Sciences of the United States of America. 100 (7), 3983-3988 (2003).
- Shipitsin, M., et al. Molecular definition of breast tumor heterogeneity. Cancer Cell. 11 (3), 259-273 (2007).
- Ginestier, C., et al. ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome. Cell Stem Cell. 1 (5), 555-567 (2007).
- Sulaiman, A., et al. Dual inhibition of Wnt and Yes-associated protein signaling retards the growth of triple-negative breast cancer in both mesenchymal and epithelial states. Molecular Oncology. 12 (4), 423-440 (2018).
- Debeb, B. G., et al. Histone deacetylase inhibitors stimulate dedifferentiation of human breast cancer cells through WNT/β-catenin signaling. Stem Cells. 30 (11), 2366-2377 (2012).
- Klutzny, S., et al. PDE5 inhibition eliminates cancer stem cells via induction of PKA signaling. Cell Death & Disease. 9 (2), 192 (2018).
- DiMeo, T. A., et al. A novel lung metastasis signature links Wnt signaling with cancer cell self-renewal and epithelial-mesenchymal transition in basal-like breast cancer. Cancer Research. 69 (13), 5364-5373 (2009).
- Liu, C. C., Prior, J., Piwnica-Worms, D., Bu, G. LRP6 overexpression defines a class of breast cancer subtype and is a target for therapy. Proceedings of the National Academy of Sciences of the United States of America. 107 (11), 5136-5141 (2010).
- Miller-Kleinhenz, J., et al. Dual-targeting Wnt and uPA receptors using peptide conjugated ultra-small nanoparticle drug carriers inhibited cancer stem-cell phenotype in chemo-resistant breast cancer. Biomaterials. 152, 47-62 (2018).
- Mamaeva, V., et al. Inhibiting Notch Activity in Breast Cancer Stem Cells by Glucose Functionalized Nanoparticles Carrying γ-secretase Inhibitors. Molecular Therapy. 24 (5), 926-936 (2016).
- Ithimakin, S., et al. HER2 drives luminal breast cancer stem cells in the absence of HER2 amplification: implications for efficacy of adjuvant trastuzumab. Cancer Research. 73 (5), 1635-1646 (2013).
- Koike, Y., et al. Anti-cell growth and anti-cancer stem cell activities of the non-canonical hedgehog inhibitor GANT61 in triple-negative breast cancer cells. Breast Cancer. 24 (5), 683-693 (2017).
- Sun, Y., et al. Estrogen promotes stemness and invasiveness of ER-positive breast cancer cells through Gli1 activation. Molecular Cancer. 13, 137 (2014).
- Colavito, S. A., Zou, M. R., Yan, Q., Nguyen, D. X., Stern, D. F. Significance of glioma-associated oncogene homolog 1 (GLI1) expression in claudin-low breast cancer and crosstalk with the nuclear factor kappa-light-chain-enhancer of activated B cells (NFκB) pathway. Breast Cancer Research. 16 (5), 444 (2014).
- Bhat, V., Allan, A. L., Raouf, A. Role of the Microenvironment in Regulating Normal and Cancer Stem Cell Activity: Implications for Breast Cancer Progression and Therapy Response. Cancers. 11 (9), (2019).
- Pio, G. M., Xia, Y., Piaseczny, M. M., Chu, J. E., Allan, A. L. Soluble bone-derived osteopontin promotes migration and stem-like behavior of breast cancer cells. PloS One. 12 (5), 0177640 (2017).
- Chu, J. E., et al. Lung-derived factors mediate breast cancer cell migration through CD44 receptor-ligand interactions in a novel ex vivo system for analysis of organ-specific soluble proteins. Neoplasia. 16 (2), 180-191 (2014).
- McGowan, P. M., et al. Notch1 inhibition alters the CD44hi/CD24lo population and reduces the formation of brain metastases from breast cancer. Molecular Cancer Research. 9 (7), 834-844 (2011).
- Mao, J., et al. ShRNA targeting Notch1 sensitizes breast cancer stem cell to paclitaxel. International Journal of Biochemistry and Cell Biology. 45 (6), 1064-1073 (2013).
- Duru, N., et al. HER2-associated radioresistance of breast cancer stem cells isolated from HER2-negative breast cancer cells. Clinical Cancer Research. 18 (24), 6634-6647 (2012).
- Croker, A. K., Allan, A. L. Inhibition of aldehyde dehydrogenase (ALDH) activity reduces chemotherapy and radiation resistance of stem-like ALDHhiCD44+ human breast cancer cells. Breast Cancer Research and Treatment. 133 (1), 75-87 (2012).
- Creighton, C. J., et al. Residual breast cancers after conventional therapy display mesenchymal as well as tumor-initiating features. Proceedings of the National Academy of Sciences of the United States of America. 106 (33), 13820-13825 (2009).
- Calcagno, A. M., et al. Prolonged drug selection of breast cancer cells and enrichment of cancer stem cell characteristics. Journal of the National Cancer Institute. 102 (21), 1637-1652 (2010).
- Feng, Y., et al. Breast cancer development and progression: Risk factors, cancer stem cells, signaling pathways, genomics, and molecular pathogenesis. Genes Dis. 5 (2), 77-106 (2018).
- Samanta, D., Gilkes, D. M., Chaturvedi, P., Xiang, L., Semenza, G. L. Hypoxia-inducible factors are required for chemotherapy resistance of breast cancer stem cells. Proceedings of the National Academy of Sciences of the United States of America. 111 (50), 5429-5438 (2014).
- Croker, A. K., et al. High aldehyde dehydrogenase and expression of cancer stem cell markers selects for breast cancer cells with enhanced malignant and metastatic ability. Journal of Cellular and Molecular Medicine. 13 (8), 2236-2252 (2009).
- Morel, A. P., et al. Generation of breast cancer stem cells through epithelial-mesenchymal transition. PloS One. 3 (8), 2888 (2008).
- Muntimadugu, E., Kumar, R., Saladi, S., Rafeeqi, T. A., Khan, W. CD44 targeted chemotherapy for co-eradication of breast cancer stem cells and cancer cells using polymeric nanoparticles of salinomycin and paclitaxel. Colloids Surf B Biointerfaces. 143, 532-546 (2016).
- Liu, S., et al. Breast cancer stem cells transition between epithelial and mesenchymal states reflective of their normal counterparts. Stem Cell Reports. 2 (1), 78-91 (2014).
- Munshi, A., Hobbs, M., Meyn, R. E. Clonogenic cell survival assay. Methods in Molecular Medicine. 110, 21-28 (2005).
- Shaw, F. L., et al. A detailed mammosphere assay protocol for the quantification of breast stem cell activity. Journal of Mammary Gland Biology and Neoplasia. 17 (2), 111-117 (2012).
- Shin, C. S., Kwak, B., Han, B., Park, K. Development of an in vitro 3D tumor model to study therapeutic efficiency of an anticancer drug. Molecular Pharmaceutics. 10 (6), 2167-2175 (2013).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Cheon, D. J., Orsulic, S. Mouse models of cancer. Annual Review of Pathology. 6, 95-119 (2011).
- Lyons, S. K. Advances in imaging mouse tumour models in vivo. Journal of Pathology. 205 (2), 194-205 (2005).
- Margaryan, N. V., et al. The Stem Cell Phenotype of Aggressive Breast Cancer Cells. Cancers. 11 (3), (2019).
- Ma, F., et al. Enriched CD44(+)/CD24(-) population drives the aggressive phenotypes presented in triple-negative breast cancer (TNBC). Cancer Letters. 353 (2), 153-159 (2014).
- Chatterjee, S., et al. Paracrine Crosstalk between Fibroblasts and ER(+) Breast Cancer Cells Creates an IL1β-Enriched Niche that Promotes Tumor Growth. iScience. 19, 388-401 (2019).
- Phan-Lai, V., et al. Three-dimensional scaffolds to evaluate tumor associated fibroblast-mediated suppression of breast tumor specific T cells. Biomacromolecules. 14 (5), 1330-1337 (2013).
- O'Brien, C. A., Kreso, A., Jamieson, C. H. Cancer stem cells and self-renewal. Clinical Cancer Research. 16 (12), 3113-3120 (2010).
- Hu, Y., Smyth, G. K. ELDA: extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. Journal of Immunological Methods. 347 (1-2), 70-78 (2009).
- Stewart, J. M., et al. Phenotypic heterogeneity and instability of human ovarian tumor-initiating cells. Proceedings of the National Academy of Sciences of the United States of America. 108 (16), 6468-6473 (2011).
- Abraham, B. K., et al. Prevalence of CD44+/CD24-/low cells in breast cancer may not be associated with clinical outcome but may favor distant metastasis. Clinical Cancer Research. 11 (3), 1154-1159 (2005).
- Balic, M., et al. Most early disseminated cancer cells detected in bone marrow of breast cancer patients have a putative breast cancer stem cell phenotype. Clinical Cancer Research. 12 (19), 5615-5621 (2006).
- Charafe-Jauffret, E., et al. Aldehyde dehydrogenase 1-positive cancer stem cells mediate metastasis and poor clinical outcome in inflammatory breast cancer. Clinical Cancer Research. 16 (1), 45-55 (2010).
- Marcato, P., et al. Aldehyde dehydrogenase activity of breast cancer stem cells is primarily due to isoform ALDH1A3 and its expression is predictive of metastasis. Stem Cells. 29 (1), 32-45 (2011).
- Lacerda, L., Pusztai, L., Woodward, W. A. The role of tumor initiating cells in drug resistance of breast cancer: Implications for future therapeutic approaches. Drug Resist Updat. 13 (4-5), 99-108 (2010).
- Liu, S., Wicha, M. S. Targeting breast cancer stem cells. Journal of Clinical Oncology. 28 (25), 4006-4012 (2010).
- D'Angelo, R. C., et al. Notch reporter activity in breast cancer cell lines identifies a subset of cells with stem cell activity. Molecular Cancer Therapeutics. 14 (3), 779-787 (2015).
- Neve, R. M., et al. A collection of breast cancer cell lines for the study of functionally distinct cancer subtypes. Cancer Cell. 10 (6), 515-527 (2006).
- Forozan, F., et al. Comparative genomic hybridization analysis of 38 breast cancer cell lines: a basis for interpreting complementary DNA microarray data. Cancer Research. 60 (16), 4519-4525 (2000).
- Lanier, L. L. Just the FACS. Journal of Immunology. 193 (5), 2043-2044 (2014).
- Ibrahim, S. F., van den Engh, G. Flow cytometry and cell sorting. Advances in Biochemical Engineering/Biotechnology. 106, 19-39 (2007).
- Shapiro, H. M. Flow Cytometry: The Glass Is Half Full. Methods in Molecular Biology. 1678, 1-10 (2018).
- Tsuji, K., et al. Effects of Different Cell-Detaching Methods on the Viability and Cell Surface Antigen Expression of Synovial Mesenchymal Stem Cells. Cell Transplantation. 26 (6), 1089-1102 (2017).
- Sun, C., et al. Immunomagnetic separation of tumor initiating cells by screening two surface markers. Scientific Reports. 7, 40632 (2017).
- Rodríguez, C. E., et al. Breast cancer stem cells are involved in Trastuzumab resistance through the HER2 modulation in 3D culture. Journal of Cellular Biochemistry. 119 (2), 1381-1391 (2018).
- Kim, D. W., Cho, J. Y. NQO1 is Required for β-Lapachone-Mediated Downregulation of Breast-Cancer Stem-Cell Activity. International Journal of Molecular Sciences. 19 (12), (2018).
- Xu, L. Z., et al. p62/SQSTM1 enhances breast cancer stem-like properties by stabilizing MYC mRNA. Oncogene. 36 (3), 304-317 (2017).
- Huang, X., et al. Breast cancer stem cell selectivity of synthetic nanomolar-active salinomycin analogs. BMC Cancer. 16, 145 (2016).
- Liu, T. J., et al. CD133+ cells with cancer stem cell characteristics associates with vasculogenic mimicry in triple-negative breast cancer. Oncogene. 32 (5), 544-553 (2013).
- Ponti, D., et al. Isolation and in vitro propagation of tumorigenic breast cancer cells with stem/progenitor cell properties. Cancer Research. 65 (13), 5506-5511 (2005).
- Velasco-Velázquez, M. A., Popov, V. M., Lisanti, M. P., Pestell, R. G. The role of breast cancer stem cells in metastasis and therapeutic implications. American Journal of Pathology. 179 (1), 2-11 (2011).
- Palomeras, S., Ruiz-Martínez, S., Puig, T. Targeting Breast Cancer Stem Cells to Overcome Treatment Resistance. Molecules. 23 (9), (2018).
- McClements, L., et al. Targeting treatment-resistant breast cancer stem cells with FKBPL and its peptide derivative, AD-01, via the CD44 pathway. Clinical Cancer Research. 19 (14), 3881-3893 (2013).
- Berger, D. P., Henss, H., Winterhalter, B. R., Fiebig, H. H. The clonogenic assay with human tumor xenografts: evaluation, predictive value and application for drug screening. Annals of Oncology. 1 (5), 333-341 (1990).
- Tian, J., et al. Dasatinib sensitises triple negative breast cancer cells to chemotherapy by targeting breast cancer stem cells. British Journal of Cancer. 119 (12), 1495-1507 (2018).
- Samoszuk, M., Tan, J., Chorn, G. Clonogenic growth of human breast cancer cells co-cultured in direct contact with serum-activated fibroblasts. Breast Cancer Research. 7 (3), 274-283 (2005).
- Linnemann, J. R., et al. Quantification of regenerative potential in primary human mammary epithelial cells. Development. 142 (18), 3239-3251 (2015).
- Xu, Y., Hu, Y. D., Zhou, J., Zhang, M. H. Establishing a lung cancer stem cell culture using autologous intratumoral fibroblasts as feeder cells. Cell Biology International. 35 (5), 509-517 (2011).
- Palmieri, C., et al. Fibroblast growth factor 7, secreted by breast fibroblasts, is an interleukin-1beta-induced paracrine growth factor for human breast cells. Journal of Endocrinology. 177 (1), 65-81 (2003).
- Bourguignon, L. Y., Peyrollier, K., Xia, W., Gilad, E. Hyaluronan-CD44 interaction activates stem cell marker Nanog, Stat-3-mediated MDR1 gene expression, and ankyrin-regulated multidrug efflux in breast and ovarian tumor cells. Journal of Biological Chemistry. 283 (25), 17635-17651 (2008).
- Yin, X., et al. Engineering Stem Cell Organoids. Cell Stem Cell. 18 (1), 25-38 (2016).
- Sachs, N., et al. A Living Biobank of Breast Cancer Organoids Captures Disease Heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Kim, M., et al. Patient-derived lung cancer organoids as in vitro cancer models for therapeutic screening. Nature Communications. 10 (1), 3991 (2019).
- Okano, M., et al. Orthotopic Implantation Achieves Better Engraftment and Faster Growth Than Subcutaneous Implantation in Breast Cancer Patient-Derived Xenografts. Journal of Mammary Gland Biology and Neoplasia. 25 (1), 27-36 (2020).
- Zhang, Y., et al. Establishment of a murine breast tumor model by subcutaneous or orthotopic implantation. Oncology Letters. 15 (5), 6233-6240 (2018).
- Zhang, W., et al. Comparative Study of Subcutaneous and Orthotopic Mouse Models of Prostate Cancer: Vascular Perfusion, Vasculature Density, Hypoxic Burden and BB2r-Targeting Efficacy. Scientific Reports. 9 (1), 11117 (2019).
- Kim, R., Emi, M., Tanabe, K. Cancer immunoediting from immune surveillance to immune escape. Immunology. 121 (1), 1-14 (2007).
- Rosato, R. R., et al. Evaluation of anti-PD-1-based therapy against triple-negative breast cancer patient-derived xenograft tumors engrafted in humanized mouse models. Breast Cancer Research. 20 (1), 108 (2018).
- Choi, Y., et al. Studying cancer immunotherapy using patient-derived xenografts (PDXs) in humanized mice. Experimental and Molecular Medicine. 50 (8), 99 (2018).
- Meraz, I. M., et al. An Improved Patient-Derived Xenograft Humanized Mouse Model for Evaluation of Lung Cancer Immune Responses. Cancer Immunol Res. 7 (8), 1267-1279 (2019).
- Wege, A. K. Humanized Mouse Models for the Preclinical Assessment of Cancer Immunotherapy. Biodrugs. 32 (3), 245-266 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır