Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Aislamiento y evaluación funcional de células madre de cáncer de mama humano a partir de muestras de células y tejidos
En este artículo
Resumen
Este protocolo experimental describe el aislamiento de BCSC a partir de muestras de células y tejidos de cáncer de mama, así como los ensayos in vitro e in vivo que se pueden utilizar para evaluar el fenotipo y la función de BCSC.
Resumen
Las células madre del cáncer de mama (BCSC) son células cancerosas con características similares a las células madre heredadas o adquiridas. A pesar de su baja frecuencia, son los principales contribuyentes al inicio del cáncer de mama, la recaída, la metástasis y la resistencia a la terapia. Es imperativo comprender la biología de las células madre del cáncer de mama para identificar nuevos objetivos terapéuticos para tratar el cáncer de mama. Las células madre del cáncer de mama se aíslan y caracterizan en función de la expresión de marcadores de superficie celular únicos como CD44, CD24 y la actividad enzimática de la aldehído deshidrogenasa (ALDH). Estas células ALDHaltasCD44 + CD24- constituyen la población BCSC y pueden aislarse mediante clasificación celular activada por fluorescencia (FACS) para estudios funcionales posteriores. Dependiendo de la cuestión científica, se pueden utilizar diferentes métodos in vitro e in vivo para evaluar las características funcionales de las BCSC. Aquí, proporcionamos un protocolo experimental detallado para el aislamiento de BCSC humanas tanto de poblaciones heterogéneas de células de cáncer de mama como de tejido tumoral primario obtenido de pacientes con cáncer de mama. Además, destacamos los ensayos funcionales in vitro e in vivo posteriores, incluidos los ensayos de formación de colonias, los ensayos de mamosfera, los modelos de cultivo 3D y los ensayos de xenoinjerto tumoral que se pueden usar para evaluar la función de BCSC.
Introducción
Comprender los mecanismos celulares y moleculares de las células madre del cáncer de mama humano (BCSC) es crucial para abordar los desafíos encontrados en el tratamiento del cáncer de mama. La aparición del concepto BCSC se remonta a principiosdel siglo 21, donde se encontró que una pequeña población de CD44 + CD24 / células de cáncer de mama bajo era capaz de generar tumores heterogéneos en ratones 1,2. Posteriormente, se observó que las células de cáncer de mama humano con alta actividad enzimática de aldehído deshidrogenasa (ALDH alta) también mostraron propiedades similares a las células madre3. Estas BCSC representan una pequeña población de células capaces de autorrenovarse y diferenciarse, contribuyendo a la naturaleza heterogénea de los tumores a granel 1,2,3. La evidencia acumulada sugiere que las alteraciones en las vías de señalización conservadas evolutivamente impulsan la supervivencia y el mantenimiento de BCSC 4,5,6,7,8,9,10,11,12,13,14 . Además, se ha demostrado que el microambiente extrínseco celular desempeña un papel fundamental en el dictado de diferentes funciones BCSC15,16,17. Estas vías moleculares y los factores externos que regulan la función de BCSC contribuyen a la recaída del cáncer de mama, metástasis18 y desarrollo de resistencia a las terapias 19,20,21, siendo la existencia residual de BCSC después del tratamiento un gran desafío para la supervivencia global de pacientes con cáncer de mama22,23 . Por lo tanto, la evaluación preclínica de estos factores es muy importante para identificar terapias dirigidas a BCSC que podrían ser beneficiosas para lograr mejores resultados de tratamiento y mejorar la supervivencia general en pacientes con cáncer de mama.
Se han utilizado varios modelos de líneas celulares de cáncer de mama humano in vitro y modelos de xenoinjertos humanos in vivo para caracterizar BCSC 24,25,26,27,28,29. La capacidad de las líneas celulares para repoblar continuamente después de cada paso sucesivo hace de estos un sistema modelo ideal para realizar estudios basados en ómicas y farmacogenómica. Sin embargo, las líneas celulares a menudo no logran recapitular la heterogeneidad observada en las muestras de pacientes. Por lo tanto, es importante complementar los datos de la línea celular con muestras derivadas de pacientes. El aislamiento de las BCSC en su forma más pura es importante para permitir la caracterización detallada de las BCSC. El logro de esta pureza depende de la selección de marcadores fenotípicos que son específicos de las BCSC. Actualmente, el fenotipo de células CD44+CD24- altas de ALDH se usa más comúnmente para distinguir y aislar BCSC humanas de poblaciones de células de cáncerdemama a granel utilizando clasificación de células activadas por fluorescencia (FACS) para una pureza máxima1, 3,26. Además, las propiedades de las BCSC aisladas, como la autorrenovación, la proliferación y la diferenciación, se pueden evaluar utilizando técnicas in vitro e in vivo.
Por ejemplo, los ensayos in vitro de formación de colonias se pueden utilizar para evaluar la capacidad de una sola célula para autorrenovarse para formar una colonia de 50 células o más en presencia de diferentes condiciones de tratamiento30. Los ensayos de mamosfera también se pueden utilizar para evaluar el potencial de autorrenovación de las células de cáncer de mama en condiciones independientes del anclaje. Este ensayo mide la capacidad de las células individuales para generar y crecer como esferas (mezcla de BCSC y no BCSC) en cada paso sucesivo en condiciones de cultivo no adherentes libres de suero31. Además, se pueden utilizar modelos de cultivo tridimensionales (3D) para evaluar la función de BCSC, incluidas las interacciones célula-célula y célula-matriz que recapitulan estrechamente el microambiente in vivo y permiten la investigación de la actividad de posibles terapias dirigidas a BCSC32. A pesar de las diversas aplicaciones de los modelos in vitro, es difícil modelar la complejidad de las condiciones in vivo utilizando solo ensayos in vitro. Este desafío puede superarse mediante el uso de modelos de xenoinjerto de ratón para evaluar el comportamiento de BCSC in vivo. En particular, tales modelos sirven como un sistema ideal para evaluar la metástasis del cáncer de mama 33, investigar las interacciones con el microambiente durante la progresión de la enfermedad 34, la imagen in vivo 35, y para predecir la toxicidad específica del paciente y la eficacia de los agentes antitumorales 34.
Este protocolo proporciona una descripción detallada para el aislamiento de ALDHhumana altaCD44 + CD24- BCSC con la máxima pureza de poblaciones a granel de células heterogéneas de cáncer de mama. También proporcionamos una descripción detallada de tres técnicas in vitro (ensayo de formación de colonias, ensayo de mamosfera y modelo de cultivo 3D) y un ensayo de xenoinjerto tumoral in vivo que se puede utilizar para evaluar diferentes funciones de BCSC. Estos métodos serían apropiados para su uso por investigadores interesados en aislar y caracterizar BCSC de líneas celulares de cáncer de mama humano o células de cáncer de mama derivadas de pacientes primarios y tejido tumoral con el fin de comprender la biología de BCSC y / o investigar nuevas terapias dirigidas a BCSC.
Protocolo
La recolección de muestras quirúrgicas o de biopsia derivadas de pacientes directamente de pacientes con cáncer de mama que consintieron se llevó a cabo bajo un protocolo de ética humana aprobado y aprobado por la junta de ética institucional. Todos los ratones utilizados para generar modelos de xenoinjertos derivados de pacientes se mantuvieron y alojaron en una instalación animal aprobada por la institución. El tejido tumoral de modelos de xenoinjertos derivados de pacientes utilizando ratones se generó según el protocolo ético aprobado por el comité institucional de cuidado animal.
1. Preparación de líneas celulares
- Realizar todos los procedimientos de cultivo celular y tinción en condiciones estériles en un gabinete de bioseguridad. Use platos/frascos y reactivos de cultivo celular estéril.
- Mantener las células de cáncer de mama humano a 37 °C con 5% deCO2 en medios definidos suplementados con suero fetal bovino (FBS) y factores de crecimiento necesarios específicos para cada línea celular.
- Mantener cultivos de células de fibroblastos NIH3T3 de ratón (para uso en ensayos de formación de colonias) a 37 °C con 5% deCO2 en el Medio de Águila Modificada (DMEM) de Dulbecco suplementado con 10% de FBS.
- Para todas las culturas, reponga los medios antiguos cada 2-3 días con medios nuevos. Una vez que los cultivos alcanzan el 75-80% de confluencia, subcultivo en múltiples frascos de cultivo celular estéril.
2. Preparación del tejido tumoral del cáncer de mama
- Recolectar las muestras quirúrgicas o de biopsia derivadas del paciente directamente de pacientes con cáncer de mama que consintieron bajo un protocolo de ética humana aprobado por la junta de ética institucional.
- Posteriormente, recolectar y generar tejido tumoral a partir de modelos de xenoinjertos derivados de pacientes utilizando ratones bajo un protocolo de ética animal aprobado por el comité institucional de cuidado animal.
- Recoja todos los tejidos tumorales en condiciones estériles en un tubo cónico estéril de 50 ml que contenga 30 ml de DMEM:F12, manténgalo en hielo y procese las muestras como se describe a continuación dentro de las 2 h posteriores a la recolección.
3. Generación de suspensiones unicelulares de células de cáncer de mama
- Medios de aspiración del matraz que contienen una monocapa de células de cáncer de mama que es 60-80% confluente (líneas celulares de elección). Lave las células con 1x solución salina tamponada con fosfato (PBS). Aspirar PBS y añadir una solución de disociación celular adecuada (por ejemplo, tripsina:EDTA; lo suficiente para cubrir la monocapa de células) e incubar durante 5 min a temperatura ambiente (recomendado) o a 37 °C.
- Añadir 5 ml de medios de cultivo para neutralizar la actividad de la solución de disociación celular.
- Transfiera la solución celular disociada resultante a un tubo cónico de 50 ml y centrifugar a 1000 x g durante 5 min.
- Desechar sobrenadante y resuspender el pellet celular en 5 mL de 1x PBS. Cuente las células con un hemocitómetro y un microscopio.
NOTA: Observe la aglutinación celular en el hemocitómetro. Repita el paso de disociación celular si no se ha formado una suspensión de una sola célula. - Después del recuento celular, vuelva a centrifugar la suspensión celular a 1000 x g durante 5 minutos, deseche el sobrenadante y vuelva a suspender el pellet celular en el tampón de sustrato ALDH a una concentración de 1 x 106 células/ml.
4. Generación de suspensión unicelular a partir de muestras de tejido
- Picar el tejido tumoral con cuchillas quirúrgicas utilizando una técnica entrecruzada para obtener piezas más pequeñas de aproximadamente 1 mm de tamaño. Transfiera las piezas de tejido a un tubo cónico fresco de 50 ml que contenga 10 ml de tampón de disociación (1X colagenasa en DMEM: F12). Sellar el tubo cónico con parafilm e incubar a 37 °C en una incubadora agitadora durante 40 min.
NOTA: Si no hay una incubadora agitadora, coloque el tubo en un baño de agua a 37 ° C y mezcle el tubo con vórtice cada 5-10 minutos. - Granular el tejido digerido centrifugando la muestra a 530 x g durante 5 min. Deseche el sobrenadante y agregue 5 ml de tripsina. Pipetear hacia arriba y hacia abajo con una pipeta de 1 ml (ajustada a la marca de 750 μL) para interrumpir el pellet e incubar en un baño maría a 37 °C durante 5 min. Después de la incubación, pipetear hacia arriba y hacia abajo vigorosamente para liberar células individuales.
- Recargue el volumen total en el tubo a 25 ml con medios DMEM: F12 y centrífuga a 1000 x g durante 5 min. Deseche el sobrenadante y vuelva a suspender el pellet en 1 ml de solución de dispasa-DNasa. Incubar en un baño maría a 37 °C durante 5 min.
- Aumente el volumen total en el tubo a 10 ml con PBS. Mezclar pipeteando hacia arriba y hacia abajo, pasar la suspensión celular resultante a través de un filtro celular de 40 μm conectado a un tubo cónico fresco de 50 ml. Centrifugar a 1000 x g durante 5 min.
- Desechar sobrenadante y resuspender la célula en 5 mL de 1x PBS. Contar las células y completar la preparación de la suspensión celular como se describe en los pasos 3.4 y 3.5.
5. Aislamiento de células madre de cáncer de mama (BCSC)
- Tubos de flujo de etiqueta para el control no teñido, controles de tinción unicelular (control DEAB, ALDH, CD44-PE, CD24-PE-Cy7, 7AAD), el tubo de control negativo (teñido con DEAB, CD44-PE, CD24-PE-Cy7 y 7AAD), control fluorescente menos uno (FMO) y el tubo "sort" (teñido con ALDH, CD44, CD24 y 7AAD).
- Transfiera 500 μL (0,5 x 106 células) de las suspensiones celulares desde el paso 3.5 o el paso 4.5 a cada tubo que esté marcado solo con células, CD44, CD24 y 7AAD. Coloque los tubos sobre hielo hasta que los use.
- Transfiera 2 ml de muestra (2 x 106 células) al tubo 'ALDH' respectivo. Añadir 5 μL de DEAB a los tubos de «control DEAB» y «control negativo» y taparlo herméticamente. Añadir 10 μL de sustrato de ALDH al tubo «ALDH», mezclar bien mediante vórtice y transferir inmediatamente 500 μL al tubo correspondiente de «control DEAB» y «control negativo». Recapitular los «tubos de control DEAB», «control negativo» y «tubos ALDH» e incubar a 37 °C durante 30-60 min (no superar los 60 min).
NOTA: El tiempo óptimo de incubación puede requerir optimización dependiendo de la línea celular. Proteja siempre del sustrato ALDH y de la luz los tubos que contienen células teñidas. - Después de la incubación, centrifugar todas las muestras durante 5 min a 250 x g. Resuspender las células en 500 μL de tampón de sustrato ALDH. Añadir una concentración recomendada por el fabricante u optimizada para el usuario de cóctel de anticuerpos anti-CD44-PE y anti-CD24-PE-Cy7 e incubar a 4 °C durante 30 min. Añadir anticuerpos anti-CD44-PE y anti-CD24-PE-Cy7 a los respectivos tubos marcados con «CD44» y «CD24».
- Después de la incubación, centrifugar todas las muestras a 250 x g durante 5 min. Resuspender las células en 500 μL de tampón de sustrato ALDH. Incubar el tubo de "control negativo", el tubo "Sort" y el tubo "7ADD" con 7AAD (concentración sugerida: 0,25 μg/1 x 106 células) durante 10 min en hielo.
NOTA: La actividad de ALDH se detecta en el canal fluorescente verde, por lo tanto, se debe utilizar un fluorocromo con un espectro de emisión compatible diferente. Cuando se observa superposición espectral durante la citometría de flujo multiparamétrica, se deben usar controles de un solo color y control FMO como guía para permitir la compensación entre fluorocromos para minimizar el derrame de la señal fluorescente en otros canales. - Establecer el protocolo de análisis en el instrumento FACS en preparación para el análisis de muestras. Cree gráficos de dispersión (dispersión hacia adelante vs lateral, dispersión hacia adelante vs canales fluorescentes).
- Usando el control no teñido, ajuste el fotomultiplicador para separar los desechos de la población celular total y ajuste el voltaje fluorescente para mover toda la población celular alrededor de la primera escala logarítmica (101). Usando el control DEAB, mueva toda la población celular dentro de la segunda escala logarítmica (102) ajustando el canal de voltaje fluorescente verde.
- Analice primero todos los controles de tinción individuales (ALDH, CD44-PE, CD24-PE-Cy7) y el control de 7AAD y FMO, ajustando el voltaje para separar las células teñidas de las no teñidas y minimizar el derrame de señales fluorescentes en otros canales.
- Puerta en la población positiva para cada muestra de células teñidas. Usando el tubo de control negativo, puerta para viabilidad (7AAD negativo), ALDHbaja y ALDHalta poblaciones celulares (estrategia de compuerta representativa que se muestra en la Figura 1B).
- Analizar muestras teñidas multiparamétricas de interés para aislar BCSC. Utilizando las puertas ALDHbaja y ALDHalta viables, seleccione la población celular CD44+CD24- (BCSC) y CD44-CD24+ (no BCSC) respectivamente (Figura 1B).
- Recolectar BCSC viables y no BCSC en medios de recolección en tubos de recolección estériles (poblaciones de dos líneas celulares representativas que se muestran en la Figura 2A y B). Utilice células clasificadas para ensayos in vitro e in vivo posteriores, como se describe a continuación.
NOTA: Además de los ensayos in vitro e in vivo que se describen a continuación, las BCSC pueden validarse midiendo la expresión de marcadores pluripotentes como SOX2, OCT4 y NANOG mediante técnicas estándar de inmunotransferencia.
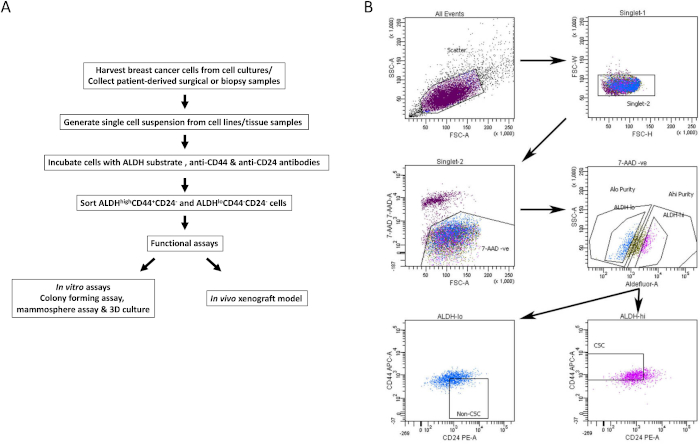
Figura 1: Estrategia de activación del sistema de control de los bienes sobre el terreno para el aislamiento de BCSC de líneas celulares de cáncer de mama y muestras de tejido. (A) Diagrama de flujo que describe el procedimiento de aislamiento de BCSC. B) Gráficos representativos del sistema de control del terreno que muestren la estrategia de clasificación utilizada para aislar las BCSC y las no BCSC viables de un conjunto heterogéneo de células. Las células de cáncer de mama humano MDA-MB-231 se marcan simultáneamente con 7-AAD, CD44-APC, CD24-PE y el sustrato ALDH. Los subconjuntos de células se aislaron utilizando un protocolo de cuatro colores en una máquina FACS. Las celdas se seleccionan en función de la dispersión de luz esperada, luego para los singletes y la viabilidad basada en la exclusión de 7-AAD. Luego se analizan las células para determinar la actividad de ALDH y el 20% superior más positivo se selecciona como la poblaciónalta de ALDH, mientras que el 20% inferior de las células con la actividad de ALDH más baja se consideróque era ALDH baja. Finalmente, el 50% de las célulasbajas de ALDH se seleccionan en función de un fenotipo CD44bajo / -CD24 +, y el 50% de las célulasaltas de ALDH se seleccionan en función del fenotipo CD44 + CD24-. Esta figura ha sido adaptada de Chu et al.17. Haga clic aquí para ver una versión más grande de esta figura.
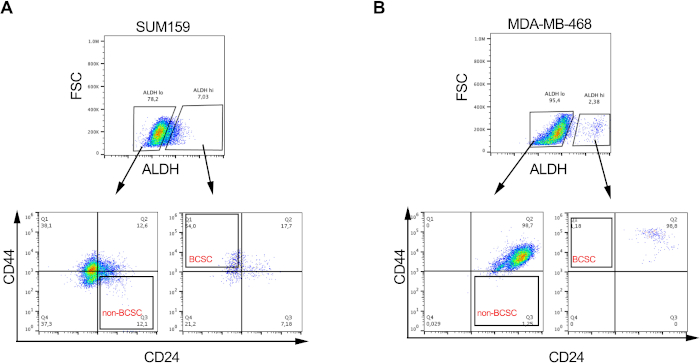
Figura 2: Las proporciones de BCSC son variables en diferentes líneas celulares de cáncer de mama. Imagen representativa que muestra la proporción diferencial de BCSC y no BCSC en (A) SUM159 y (B) MDA-MD-468 líneas celulares de cáncer de mama triple negativo después del etiquetado y la clasificación como se describe en la Figura 1. Haga clic aquí para ver una versión más grande de esta figura.
6. Ensayo de formación de colonias
- Resuspenda las celdas de interés (celdas ordenadas del paso 5.11 o celdas sin ordenar de los pasos 3.5 o 4.5) en medios completos.
- Etiquete tres tubos de flujo para 1 x 10 2, 2 x 10 2 y 5 x 102 celdas. Agregue 2 ml de medio completo y transfiera el número de celda apropiado (ordenado del paso 5.11 o celdas sin clasificar de los pasos 3.5 o 4.5) en los tubos respectivos. Mezcle bien las soluciones celulares pipeteándolas hacia arriba y hacia abajo 5 veces.
- Coloque las células en una placa de 6 pocillos y distribuya la suspensión celular girando suavemente las placas para obtener una distribución uniforme de las células.
- Incubar las placas en una incubadora de 37 °C, 5% deCO2 hasta que aparezcan colonias (donde colonias = ≥50 células por colonia). Reponga cuidadosamente los medios dos veces por semana sin perturbar la formación de colonias.
- Aspirar los medios y lavar una vez con 1 ml de PBS. Agregue 0.5 ml de solución de violeta cristalina al 0.05% en cada pocillo e incube la placa durante 30 minutos. Eliminar el exceso de manchas violetas cristalinas lavando con 2 mL de agua. Repita el paso de lavado hasta que se haya eliminado la tinción de fondo.
- Usando un microscopio con un aumento de 4x y 10x, cuente y registre el número total de colonias generadas (imágenes representativas que se muestran en la Figura 3A).
- Calcule la frecuencia de formación de colonias de la siguiente manera: Frecuencia (%) = (# de colonias formadas/número de células sembradas) x 100. Por ejemplo, si se generan 25 colonias a partir de 1 x 102 células, entonces la frecuencia de formación de colonias es, frecuencia = (25/100) x100 = 25%.
- Alternativamente, reemplace los pasos 6.1 a 6.4 con un método alternativo que involucre el cocultivo con fibroblastos, que proporcionan un apoyo microambiental para las BCSC a través de la producción de los factores de crecimiento y supervivencia necesarios.
- Placas de cultivo de células de precapa de 60 mm con colágeno bovino tipo I (dilución de 1 en 30 de 3 mg/ml de colágeno). Dejar que el colágeno polimerice durante 30 min en una incubadora a 37 °C. Aspirar el colágeno no polimerizado y lavar la placa dos veces con 1x PBS. Cubra la placa recubierta de colágeno con 1 ml de PBS y déjela a un lado a temperatura ambiente hasta que la use.
- Etiquete tres tubos de flujo para 1 x 10 3, 5 x 103 y 1 x 104 celdas. Añadir 4 ml de medios de ensayo formadores de colonias y transferir el número adecuado de células (ordenadas del paso 5.11 o células no clasificadas de los pasos 3.5 o 4.5) a los tubos respectivos. Añadir fibroblastos NIH3T3 de ratón irradiados (4 x 104 células/ml de medios). Mezcle bien las soluciones celulares pipeteándolas hacia arriba y hacia abajo 5 veces.
- Aspirar el PBS de la placa de cultivo recubierta de colágeno del paso 6.1 y colocar la mezcla celular en cada una de las placas de cultivo celular como se describe en el paso 6.3.
- Incubar las placas en una incubadora de 37 °C, 5% deCO2 y dejarlas inalteradas durante 7-10 días o hasta que se formen colonias, sin reponer los medios. Cuente y registre el número total de colonias generadas como se describe en los pasos 6.6 y 6.7.
7. Ensayo de mamosfera
- Resuspender las células de interés (células ordenadas del paso 5.11 o células no clasificadas de los pasos 3.5 o 4.5) en medios de mamosfera completos y células en placa a una densidad de siembra de 5 x 102 células/ cm2 área en una placa de cultivo celular de unión ultra baja de 96 pocillos.
NOTA: La densidad de siembra celular debe optimizarse para diferentes líneas celulares. - Incubar las placas de cultivo durante 5-10 días en una incubadora a 37 °C con un 5% deCO2. Reponga cuidadosamente los medios dos veces por semana sin perturbar la formación de la mamosfera.
- Después de la incubación, contar el número de mamosferas generadas en cada pocillo usando un microscopio; donde las mamosferas se definen como grupos de células de cáncer de mama de más de 100 μm de diámetro (imágenes representativas que se muestran en la Figura 3B).
- Calcule la eficiencia de formación de la mamosfera (MFE) de la siguiente manera: MFE (%) = (número de mamosferas por pozo)/ (número de células sembradas por pozo) x 100 (es decir, si 5 mamosferas son generadas por 1 x 102 células en un pozo, entonces MFE = (5/100) x 100 = 5%).
- Para subcultivar mamosferas, transfiera cuidadosamente los medios que contienen contenido de mamosferas a un tubo cónico fresco de 50 ml y a un medio centrífugo a 1000 x g durante 5 min. Retire con cuidado el sobrenadante, resuspenda el pellet celular en 500 μL de tripsina e incube durante 5 minutos a temperatura ambiente.
- Deseche el sobrenadante y vuelva a suspender el pellet en 1 ml de medio mamosphere completo. Contar las células con un hemocitómetro y volver a placar las células en una placa de cultivo celular de unión ultrabaja, como se describe en el paso 7.1.
NOTA: Además del subcultivo, las células derivadas de la mamosfera también pueden ser analizadas más a fondo por FACS para evaluar el fenotipo BCSC y / u obtener poblaciones puras de BCSC para otros ensayos posteriores. - Para determinar el número de células iniciadoras de la mamosfera contenidas en sus poblaciones celulares, use un método alternativo que involucre el análisis de dilución limitante de esfera (SLDA). Células en placa en diluciones seriadas de números celulares altos a bajos en una placa de cultivo celular de unión ultra baja de 96 pocillos, con la dilución más alta que resulta en menos de una celda por pocillo.
- Incubar la placa de cultivo durante 10-14 días en una incubadora a 37 °C con un 5% deCO2 y dejarlos inalterados para evitar la agregación celular.
- Después de la incubación, contar el número de mamosferas generadas en cada pocillo usando un microscopio; donde las mamosferas se definen como grupos de células de cáncer de mama de más de 100 μm de diámetro. Calcule la frecuencia y la importancia de iniciación de la esfera utilizando el software en línea Extreme Limiting Dilution Analysis (ELDA) (http://bioinf.wehi.edu.au/software/elda/).
8.3D Modelo de cultura
- Dependiendo de la pregunta experimental, use extracto de membrana basal (BME) con o sin factores de crecimiento (reducido). Para evaluar el efecto del factor de crecimiento individual en las células cancerosas, utilice el factor de crecimiento reducido BME. También ayuda a minimizar los efectos no específicos de los factores de crecimiento endógenos presentes en BME.
NOTA: BME se solidifica por encima de 10 °C. Mantenga siempre BME en hielo incluso durante el paso de descongelación. - Añadir con cuidado 50 μL de BME por pocillo en una placa de 96 pocillos sin crear burbujas de aire y dejar que polimerice a 37 °C durante 1 h. Después de 10 minutos de incubación, añadir 100 μL de PBS para evitar el secado de la capa de gel.
- Resuspender las células ordenadas del paso 5.11 o las células no clasificadas de los pasos 3.5 o 4.5 a una concentración de 5 x 103 a 5 x 104/200 μL en medios de cultivo 3D.
- Una vez que el BME se haya polimerizado, eliminar el PBS, añadir 200 μL de suspensión celular a cada pocillo e incubar en una incubadora a 37 °C con 5% deCO2. Agregue PBS a los pozos circundantes para evitar la evaporación de los medios.
NOTA: El número óptimo de celdas para el recubrimiento debe determinarse antes de configurar el experimento. Dependiendo de la pregunta experimental, las BCSC se pueden cultivar solas o con otros tipos de células (fibroblastos / células endoteliales / inmunes, etc.). - Agregue medios frescos a las placas de cultivo dos veces por semana. Mantener los cultivos durante 10-14 días antes de analizar la formación de organoides (imágenes representativas que se muestran en la Figura 3C).
- Para el subcultivo, aspire cuidadosamente el medio y agregue 200 μL de dispasa a cada célula que contenga pocillos. Incubar la placa en una incubadora a 37 °C durante 1 h. A mitad del período de incubación (30 min), saque el plato, pipete suavemente la solución de dispase hacia arriba y hacia abajo 5 veces y vuelva a colocarla en la incubadora durante otros 30 minutos.
- Después de 1 h, transfiera la solución celular disociada a un tubo de flujo. Lave el pozo con 1x PBS que contenga 2% de FBS (fPBS) y transfiéralo al tubo de flujo. Centrifugar el tubo a 1000 x g durante 5 min. Aspirar cuidadosamente el sobrenadante y añadir 500 μL de tripsina, incubar a 37 °C durante 5 min. Inactivar la tripsina añadiendo la misma cantidad de fPBS y centrifugar a 1000 x g durante 5 min.
- Deseche el sobrenadante y vuelva a suspender el pellet en 1 ml de medios de cultivo 3D. Cuente las celdas y vuelva a colocar el número necesario de celdas en el BME como en los pasos 8.2 a 8.4.
NOTA: Se pueden agrupar varios pozos para analizar o clasificar más a fondo la población celular de interés.
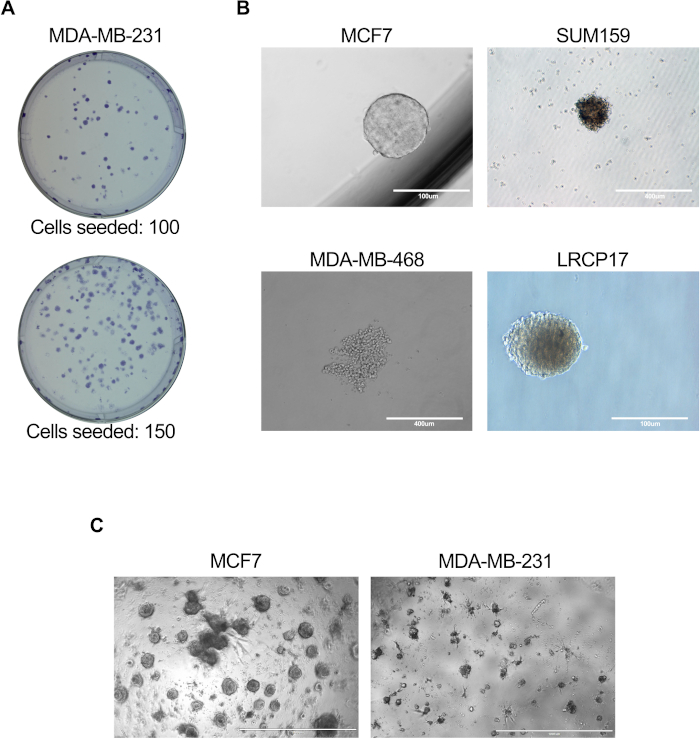
Figura 3: Ensayos in vitro para evaluar la función de las células BCSC. Los ensayos in vitro se realizaron como se describe en las secciones del protocolo 6.1 a 6.5 (A), 7.1 a 7.4 (B) u 81. a 8.4 + 8.6 (C). (A) Imagen representativa que muestra las colonias generadas por células de cáncer de mama humano MDA-MB-231; (B) Imágenes representativas que muestran la formación de mamosfera por líneas celulares humanas MCF7, SUM159 o MDA-MB-468, así como células de cáncer de mama LRCP17 derivadas de pacientes. (C) Imágenes representativas que muestran las estructuras 3D formadas por células de cáncer de mama MCF7 y MDA-MB-231 en modelos de cultivos 3D. Haga clic aquí para ver una versión más grande de esta figura.
NOTA: Realizar experimentos con animales bajo un protocolo de ética animal aprobado por el comité institucional de cuidado animal.
9. Modelo de xenoinjerto in vivo
- Para determinar la capacidad de iniciación tumoral de las células madre del cáncer de mama, prepare las células (población clasificada del paso 5.7 o poblaciones no clasificadas de los pasos 3.5 o 4.5) utilizando un enfoque de dilución limitante. Células diluidas en serie en PBS utilizando entre 1 y 5 grupos de dilución diferentes, con dosis tan bajas como 0.01-0.2 x 102 células/100 μL y tan altas como 1 x 106 células/100 μL.
NOTA: Las celdas de población sin ordenar/de toda la población se pueden utilizar como control. El número de grupos de dilución utilizados dependerá del resultado científico deseado (por ejemplo, si solo se prueba la tumorgenicidad, se puede usar 1 grupo con un número de células más alto, mientras que al calcular la capacidad de iniciación del tumor, es óptimo probar 5 dosis de dilución limitantes). - Para generar modelos de xenoinjerto a partir de células de cáncer de mama humano, utilice ratones hembra inmunocomprometidos (cepas athymic nude [nu/nu], diabetes no obesa/inmunodeficiencia combinada grave [NOD/SCID] o NOD/SCID IL2γ [NGS]).
NOTA: Aunque se puede utilizar un mínimo de 4 animales por grupo, se recomienda 8-12 animales por grupo para obtener resultados sólidos, especialmente para limitar el análisis de dilución. - Realizar inyecciones estándar de almohadillas de grasa mamaria (MFP) utilizando 100 μL/ratón de cada preparación celular, en condiciones estériles en un gabinete de bioseguridad.
NOTA: Para un crecimiento óptimo del tumor de mama y metástasis espontáneas a órganos distantes, se recomienda la MFP torácica. Alternativamente, también se puede utilizar la impresora multifunción inguinal. - Después de la inyección, controle a los ratones diariamente para determinar la salud general y el crecimiento tumoral en el sitio de la inyección. Tras la detección de un tumor palpable, comience a medir el tamaño del tumor con calibradores en dos dimensiones perpendiculares y registre semanalmente hasta el punto final.
NOTA: El punto final experimental se determina con base en las regulaciones establecidas en el protocolo institucional de ética animal; Por lo general, el criterio de valoración por eutanasia generalmente se requiere una vez que los volúmenes tumorales alcanzan los 1500 mm3. Para poblaciones de BCSC y / o dosis celulares más altas (por ejemplo, >1 x 104 células), este punto final probablemente se alcanzará dentro de las 4-8 semanas posteriores a la inyección de MFP. Para dosis celulares muy bajas y/o poblaciones de células no BCSC, se debe permitir que el crecimiento tumoral progrese hasta 8 meses después de la inyección. - A partir de estas mediciones, calcule el volumen del tumor utilizando la siguiente fórmula: Volumen en mm3 = 0.52 x (ancho)2 x largo. Si utiliza un enfoque de dilución limitante, calcule la capacidad y la importancia de iniciación del tumor utilizando el software en línea ELDA (http://bioinf.wehi.edu.au/software/elda/).
- Alternativamente, para extender humanamente el punto final, extirpar quirúrgicamente los tumores primarios y continuar monitoreando la salud de los ratones y / o el desarrollo de metástasis espontáneas en órganos distantes. Utilizar tejido tumoral resecado para la generación de xenotrasplantes seriados.
- Al finalización, extraer tejido de tumores primarios y órganos distantes (ganglios linfáticos, pulmón, hígado, cerebro, hueso) y realizar análisis histopatológicos y/o inmunohistoquímicos o disociar el tejido tumoral y utilizarlo en los ensayos in vitro descritos en las secciones 6-8.
Resultados
El protocolo descrito permite el aislamiento de BCSC humanas de una población heterogénea de células de cáncer de mama, ya sea de líneas celulares o de tejido tumoral disociado. Para cualquier línea celular o muestra de tejido dado, es crucial generar una suspensión uniforme de una sola célula para aislar BCSC con la máxima pureza, ya que contaminar poblaciones no BCSC podría dar lugar a respuestas celulares variables, especialmente si el objetivo del estudio es evaluar la eficacia de los agentes terapéuticos ...
Discusión
La metástasis del cáncer de mama y la resistencia a la terapia se han convertido en la principal causa de mortalidad en las mujeres en todo el mundo. La existencia de una subpoblación de células madre de cáncer de mama (BCSC) contribuye a la metástasis mejorada 26,43,44,45,46 y la resistencia a la terapia21,47,48.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a los miembros de nuestro laboratorio por sus útiles discusiones y apoyo. Nuestra investigación sobre las células madre del cáncer de mama y el microambiente tumoral está financiada por subvenciones del Instituto de Investigación de la Sociedad Canadiense de Investigación del Cáncer y el Programa de Cáncer de Mama del Departamento de Defensa del Ejército de los Estados Unidos (Subvención # BC160912). V.B. cuenta con el apoyo de una beca postdoctoral occidental (Western University), y tanto A.L.A. como V.B. cuentan con el apoyo de la Sociedad de Cáncer de Mama de Canadá. C.L. cuenta con el apoyo de una beca de posgrado Vanier Canada del Gobierno de Canadá.
Materiales
| Name | Company | Catalog Number | Comments |
| 7-Aminoactinomycin D (7AAD) | BD | 51-68981E | suggested: 0.25 µg/1x106 cells |
| Acetone | Fisher | A18-1 | |
| Aldehyde dehydrogenase (ALDH) substrate | Stemcell Technologies | 1700 | Sold commerically as part of the ALDEFLOUR Assay kit; follow manufacturer's instructions for ALDH substrate preparation |
| Basement membrane extract (BME) | Corning | 354234 | Sold under the commercial name Matrigel |
| Cell culture plates: 6 well | Corning | 877218 | |
| Cell culture plates: 60mm | Corning | 353002 | |
| Cell culture plates: 96-well ultra low attachment | Corning | 3474 | |
| Cell strainer: 40 micron | BD | 352340 | |
| Collagen | Stemcell Technologies | 7001 | Prepare 1:30 dilution of 3 mg/mL collagen in PBS |
| Collagenase | Sigma | 11088807001 | 1x |
| Conical tubes: 50 mL | Fisher scientific | 05-539-7 | |
| Crystal violet | Sigma | C6158 | Use 0.05% crystal violet solution in water for staining |
| Dispase | Stemcell Technologies | 7913 | 5U/mL |
| DMEM:F12 | Gibco | 11330-032 | 1x, With L-glutamine and 15 mM HEPES |
| DNAse | Sigma | D5052 | 0.1 mg/mL final concentration |
| FBS | Avantor Seradigm Lifescience | 97068-085 | |
| Flow tubes: 5ml | BD | 352063 | Polypropylene round-bottom tubes |
| Methanol | Fisher | 84124 | |
| mouse anti-Human CD24 antibody | BD | 561646 | R-phycoerythrin and Cyanine dye conjugated Clone: ML5 |
| mouse anti-Human CD44 antibody | BD | 555479 | R-phycoerythrin conjugated, Clone: G44-26 |
| N,N-diethylaminobenzaldehyde (DEAB) | Stemcell Technologies | 1700 | Sold commerically as part of the ALDEFLOUR Assay kit; follow manufacturer's instructions DEAB preparation |
| PBS | Wisent Inc | 311-425-CL | 1x, Without calcium and magnesium |
| Trypsin-EDTA | Gibco | 25200-056 | |
| Mammosphere Media Composition | |||
| B27 | Gibco | 17504-44 | 1x |
| bFGF | Sigma | F2006 | 10 ng/mL |
| BSA | Bioshop | ALB003 | 04% |
| DMEM:F12 | Gibco | 11330-032 | 1x, With L-glutamine and 15 mM HEPES |
| EGF | Sigma | E9644 | 20 ng/mL |
| Insulin | Sigma | 16634 | 5 µg/mL |
| 3D Organoid Media Composition | |||
| A8301 | Tocris | 2939 | 500 nM |
| B27 | Gibco | 17504-44 | 1x |
| DMEM:F12 | Gibco | 11330-032 | 1x, With L-glutamine and 15 mM HEPES |
| EGF | Sigma | E9644 | 5 ng/mL |
| FGF10 | Peprotech | 100-26 | 20 ng/mL |
| FGF7 | Peprotech | 100-19 | 5 ng/mL |
| GlutaMax | Invitrogen | 35050-061 | 1x |
| HEPES | Gibco | 15630-080 | 10 mM |
| N-acetylcysteine | Sigma | A9165 | 1.25 mM |
| Neuregulin β1 | Peprotech | 100-03 | 5 nM |
| Nicotinamide | Sigma | N0636 | 5 mM |
| Noggin | Peprotech | 120-10C | 100 ng/mL |
| R-spondin3 | R&D | 3500 | 250 ng/mL |
| SB202190 | Sigma | S7067 | 500 nM |
| Y-27632 | Tocris | 1254 | 5 µM |
Referencias
- Al-Hajj, M., Wicha, M. S., Benito-Hernandez, A., Morrison, S. J., Clarke, M. F. Prospective identification of tumorigenic breast cancer cells. Proceedings of the National Academy of Sciences of the United States of America. 100 (7), 3983-3988 (2003).
- Shipitsin, M., et al. Molecular definition of breast tumor heterogeneity. Cancer Cell. 11 (3), 259-273 (2007).
- Ginestier, C., et al. ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome. Cell Stem Cell. 1 (5), 555-567 (2007).
- Sulaiman, A., et al. Dual inhibition of Wnt and Yes-associated protein signaling retards the growth of triple-negative breast cancer in both mesenchymal and epithelial states. Molecular Oncology. 12 (4), 423-440 (2018).
- Debeb, B. G., et al. Histone deacetylase inhibitors stimulate dedifferentiation of human breast cancer cells through WNT/β-catenin signaling. Stem Cells. 30 (11), 2366-2377 (2012).
- Klutzny, S., et al. PDE5 inhibition eliminates cancer stem cells via induction of PKA signaling. Cell Death & Disease. 9 (2), 192 (2018).
- DiMeo, T. A., et al. A novel lung metastasis signature links Wnt signaling with cancer cell self-renewal and epithelial-mesenchymal transition in basal-like breast cancer. Cancer Research. 69 (13), 5364-5373 (2009).
- Liu, C. C., Prior, J., Piwnica-Worms, D., Bu, G. LRP6 overexpression defines a class of breast cancer subtype and is a target for therapy. Proceedings of the National Academy of Sciences of the United States of America. 107 (11), 5136-5141 (2010).
- Miller-Kleinhenz, J., et al. Dual-targeting Wnt and uPA receptors using peptide conjugated ultra-small nanoparticle drug carriers inhibited cancer stem-cell phenotype in chemo-resistant breast cancer. Biomaterials. 152, 47-62 (2018).
- Mamaeva, V., et al. Inhibiting Notch Activity in Breast Cancer Stem Cells by Glucose Functionalized Nanoparticles Carrying γ-secretase Inhibitors. Molecular Therapy. 24 (5), 926-936 (2016).
- Ithimakin, S., et al. HER2 drives luminal breast cancer stem cells in the absence of HER2 amplification: implications for efficacy of adjuvant trastuzumab. Cancer Research. 73 (5), 1635-1646 (2013).
- Koike, Y., et al. Anti-cell growth and anti-cancer stem cell activities of the non-canonical hedgehog inhibitor GANT61 in triple-negative breast cancer cells. Breast Cancer. 24 (5), 683-693 (2017).
- Sun, Y., et al. Estrogen promotes stemness and invasiveness of ER-positive breast cancer cells through Gli1 activation. Molecular Cancer. 13, 137 (2014).
- Colavito, S. A., Zou, M. R., Yan, Q., Nguyen, D. X., Stern, D. F. Significance of glioma-associated oncogene homolog 1 (GLI1) expression in claudin-low breast cancer and crosstalk with the nuclear factor kappa-light-chain-enhancer of activated B cells (NFκB) pathway. Breast Cancer Research. 16 (5), 444 (2014).
- Bhat, V., Allan, A. L., Raouf, A. Role of the Microenvironment in Regulating Normal and Cancer Stem Cell Activity: Implications for Breast Cancer Progression and Therapy Response. Cancers. 11 (9), (2019).
- Pio, G. M., Xia, Y., Piaseczny, M. M., Chu, J. E., Allan, A. L. Soluble bone-derived osteopontin promotes migration and stem-like behavior of breast cancer cells. PloS One. 12 (5), 0177640 (2017).
- Chu, J. E., et al. Lung-derived factors mediate breast cancer cell migration through CD44 receptor-ligand interactions in a novel ex vivo system for analysis of organ-specific soluble proteins. Neoplasia. 16 (2), 180-191 (2014).
- McGowan, P. M., et al. Notch1 inhibition alters the CD44hi/CD24lo population and reduces the formation of brain metastases from breast cancer. Molecular Cancer Research. 9 (7), 834-844 (2011).
- Mao, J., et al. ShRNA targeting Notch1 sensitizes breast cancer stem cell to paclitaxel. International Journal of Biochemistry and Cell Biology. 45 (6), 1064-1073 (2013).
- Duru, N., et al. HER2-associated radioresistance of breast cancer stem cells isolated from HER2-negative breast cancer cells. Clinical Cancer Research. 18 (24), 6634-6647 (2012).
- Croker, A. K., Allan, A. L. Inhibition of aldehyde dehydrogenase (ALDH) activity reduces chemotherapy and radiation resistance of stem-like ALDHhiCD44+ human breast cancer cells. Breast Cancer Research and Treatment. 133 (1), 75-87 (2012).
- Creighton, C. J., et al. Residual breast cancers after conventional therapy display mesenchymal as well as tumor-initiating features. Proceedings of the National Academy of Sciences of the United States of America. 106 (33), 13820-13825 (2009).
- Calcagno, A. M., et al. Prolonged drug selection of breast cancer cells and enrichment of cancer stem cell characteristics. Journal of the National Cancer Institute. 102 (21), 1637-1652 (2010).
- Feng, Y., et al. Breast cancer development and progression: Risk factors, cancer stem cells, signaling pathways, genomics, and molecular pathogenesis. Genes Dis. 5 (2), 77-106 (2018).
- Samanta, D., Gilkes, D. M., Chaturvedi, P., Xiang, L., Semenza, G. L. Hypoxia-inducible factors are required for chemotherapy resistance of breast cancer stem cells. Proceedings of the National Academy of Sciences of the United States of America. 111 (50), 5429-5438 (2014).
- Croker, A. K., et al. High aldehyde dehydrogenase and expression of cancer stem cell markers selects for breast cancer cells with enhanced malignant and metastatic ability. Journal of Cellular and Molecular Medicine. 13 (8), 2236-2252 (2009).
- Morel, A. P., et al. Generation of breast cancer stem cells through epithelial-mesenchymal transition. PloS One. 3 (8), 2888 (2008).
- Muntimadugu, E., Kumar, R., Saladi, S., Rafeeqi, T. A., Khan, W. CD44 targeted chemotherapy for co-eradication of breast cancer stem cells and cancer cells using polymeric nanoparticles of salinomycin and paclitaxel. Colloids Surf B Biointerfaces. 143, 532-546 (2016).
- Liu, S., et al. Breast cancer stem cells transition between epithelial and mesenchymal states reflective of their normal counterparts. Stem Cell Reports. 2 (1), 78-91 (2014).
- Munshi, A., Hobbs, M., Meyn, R. E. Clonogenic cell survival assay. Methods in Molecular Medicine. 110, 21-28 (2005).
- Shaw, F. L., et al. A detailed mammosphere assay protocol for the quantification of breast stem cell activity. Journal of Mammary Gland Biology and Neoplasia. 17 (2), 111-117 (2012).
- Shin, C. S., Kwak, B., Han, B., Park, K. Development of an in vitro 3D tumor model to study therapeutic efficiency of an anticancer drug. Molecular Pharmaceutics. 10 (6), 2167-2175 (2013).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Cheon, D. J., Orsulic, S. Mouse models of cancer. Annual Review of Pathology. 6, 95-119 (2011).
- Lyons, S. K. Advances in imaging mouse tumour models in vivo. Journal of Pathology. 205 (2), 194-205 (2005).
- Margaryan, N. V., et al. The Stem Cell Phenotype of Aggressive Breast Cancer Cells. Cancers. 11 (3), (2019).
- Ma, F., et al. Enriched CD44(+)/CD24(-) population drives the aggressive phenotypes presented in triple-negative breast cancer (TNBC). Cancer Letters. 353 (2), 153-159 (2014).
- Chatterjee, S., et al. Paracrine Crosstalk between Fibroblasts and ER(+) Breast Cancer Cells Creates an IL1β-Enriched Niche that Promotes Tumor Growth. iScience. 19, 388-401 (2019).
- Phan-Lai, V., et al. Three-dimensional scaffolds to evaluate tumor associated fibroblast-mediated suppression of breast tumor specific T cells. Biomacromolecules. 14 (5), 1330-1337 (2013).
- O'Brien, C. A., Kreso, A., Jamieson, C. H. Cancer stem cells and self-renewal. Clinical Cancer Research. 16 (12), 3113-3120 (2010).
- Hu, Y., Smyth, G. K. ELDA: extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. Journal of Immunological Methods. 347 (1-2), 70-78 (2009).
- Stewart, J. M., et al. Phenotypic heterogeneity and instability of human ovarian tumor-initiating cells. Proceedings of the National Academy of Sciences of the United States of America. 108 (16), 6468-6473 (2011).
- Abraham, B. K., et al. Prevalence of CD44+/CD24-/low cells in breast cancer may not be associated with clinical outcome but may favor distant metastasis. Clinical Cancer Research. 11 (3), 1154-1159 (2005).
- Balic, M., et al. Most early disseminated cancer cells detected in bone marrow of breast cancer patients have a putative breast cancer stem cell phenotype. Clinical Cancer Research. 12 (19), 5615-5621 (2006).
- Charafe-Jauffret, E., et al. Aldehyde dehydrogenase 1-positive cancer stem cells mediate metastasis and poor clinical outcome in inflammatory breast cancer. Clinical Cancer Research. 16 (1), 45-55 (2010).
- Marcato, P., et al. Aldehyde dehydrogenase activity of breast cancer stem cells is primarily due to isoform ALDH1A3 and its expression is predictive of metastasis. Stem Cells. 29 (1), 32-45 (2011).
- Lacerda, L., Pusztai, L., Woodward, W. A. The role of tumor initiating cells in drug resistance of breast cancer: Implications for future therapeutic approaches. Drug Resist Updat. 13 (4-5), 99-108 (2010).
- Liu, S., Wicha, M. S. Targeting breast cancer stem cells. Journal of Clinical Oncology. 28 (25), 4006-4012 (2010).
- D'Angelo, R. C., et al. Notch reporter activity in breast cancer cell lines identifies a subset of cells with stem cell activity. Molecular Cancer Therapeutics. 14 (3), 779-787 (2015).
- Neve, R. M., et al. A collection of breast cancer cell lines for the study of functionally distinct cancer subtypes. Cancer Cell. 10 (6), 515-527 (2006).
- Forozan, F., et al. Comparative genomic hybridization analysis of 38 breast cancer cell lines: a basis for interpreting complementary DNA microarray data. Cancer Research. 60 (16), 4519-4525 (2000).
- Lanier, L. L. Just the FACS. Journal of Immunology. 193 (5), 2043-2044 (2014).
- Ibrahim, S. F., van den Engh, G. Flow cytometry and cell sorting. Advances in Biochemical Engineering/Biotechnology. 106, 19-39 (2007).
- Shapiro, H. M. Flow Cytometry: The Glass Is Half Full. Methods in Molecular Biology. 1678, 1-10 (2018).
- Tsuji, K., et al. Effects of Different Cell-Detaching Methods on the Viability and Cell Surface Antigen Expression of Synovial Mesenchymal Stem Cells. Cell Transplantation. 26 (6), 1089-1102 (2017).
- Sun, C., et al. Immunomagnetic separation of tumor initiating cells by screening two surface markers. Scientific Reports. 7, 40632 (2017).
- Rodríguez, C. E., et al. Breast cancer stem cells are involved in Trastuzumab resistance through the HER2 modulation in 3D culture. Journal of Cellular Biochemistry. 119 (2), 1381-1391 (2018).
- Kim, D. W., Cho, J. Y. NQO1 is Required for β-Lapachone-Mediated Downregulation of Breast-Cancer Stem-Cell Activity. International Journal of Molecular Sciences. 19 (12), (2018).
- Xu, L. Z., et al. p62/SQSTM1 enhances breast cancer stem-like properties by stabilizing MYC mRNA. Oncogene. 36 (3), 304-317 (2017).
- Huang, X., et al. Breast cancer stem cell selectivity of synthetic nanomolar-active salinomycin analogs. BMC Cancer. 16, 145 (2016).
- Liu, T. J., et al. CD133+ cells with cancer stem cell characteristics associates with vasculogenic mimicry in triple-negative breast cancer. Oncogene. 32 (5), 544-553 (2013).
- Ponti, D., et al. Isolation and in vitro propagation of tumorigenic breast cancer cells with stem/progenitor cell properties. Cancer Research. 65 (13), 5506-5511 (2005).
- Velasco-Velázquez, M. A., Popov, V. M., Lisanti, M. P., Pestell, R. G. The role of breast cancer stem cells in metastasis and therapeutic implications. American Journal of Pathology. 179 (1), 2-11 (2011).
- Palomeras, S., Ruiz-Martínez, S., Puig, T. Targeting Breast Cancer Stem Cells to Overcome Treatment Resistance. Molecules. 23 (9), (2018).
- McClements, L., et al. Targeting treatment-resistant breast cancer stem cells with FKBPL and its peptide derivative, AD-01, via the CD44 pathway. Clinical Cancer Research. 19 (14), 3881-3893 (2013).
- Berger, D. P., Henss, H., Winterhalter, B. R., Fiebig, H. H. The clonogenic assay with human tumor xenografts: evaluation, predictive value and application for drug screening. Annals of Oncology. 1 (5), 333-341 (1990).
- Tian, J., et al. Dasatinib sensitises triple negative breast cancer cells to chemotherapy by targeting breast cancer stem cells. British Journal of Cancer. 119 (12), 1495-1507 (2018).
- Samoszuk, M., Tan, J., Chorn, G. Clonogenic growth of human breast cancer cells co-cultured in direct contact with serum-activated fibroblasts. Breast Cancer Research. 7 (3), 274-283 (2005).
- Linnemann, J. R., et al. Quantification of regenerative potential in primary human mammary epithelial cells. Development. 142 (18), 3239-3251 (2015).
- Xu, Y., Hu, Y. D., Zhou, J., Zhang, M. H. Establishing a lung cancer stem cell culture using autologous intratumoral fibroblasts as feeder cells. Cell Biology International. 35 (5), 509-517 (2011).
- Palmieri, C., et al. Fibroblast growth factor 7, secreted by breast fibroblasts, is an interleukin-1beta-induced paracrine growth factor for human breast cells. Journal of Endocrinology. 177 (1), 65-81 (2003).
- Bourguignon, L. Y., Peyrollier, K., Xia, W., Gilad, E. Hyaluronan-CD44 interaction activates stem cell marker Nanog, Stat-3-mediated MDR1 gene expression, and ankyrin-regulated multidrug efflux in breast and ovarian tumor cells. Journal of Biological Chemistry. 283 (25), 17635-17651 (2008).
- Yin, X., et al. Engineering Stem Cell Organoids. Cell Stem Cell. 18 (1), 25-38 (2016).
- Sachs, N., et al. A Living Biobank of Breast Cancer Organoids Captures Disease Heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Kim, M., et al. Patient-derived lung cancer organoids as in vitro cancer models for therapeutic screening. Nature Communications. 10 (1), 3991 (2019).
- Okano, M., et al. Orthotopic Implantation Achieves Better Engraftment and Faster Growth Than Subcutaneous Implantation in Breast Cancer Patient-Derived Xenografts. Journal of Mammary Gland Biology and Neoplasia. 25 (1), 27-36 (2020).
- Zhang, Y., et al. Establishment of a murine breast tumor model by subcutaneous or orthotopic implantation. Oncology Letters. 15 (5), 6233-6240 (2018).
- Zhang, W., et al. Comparative Study of Subcutaneous and Orthotopic Mouse Models of Prostate Cancer: Vascular Perfusion, Vasculature Density, Hypoxic Burden and BB2r-Targeting Efficacy. Scientific Reports. 9 (1), 11117 (2019).
- Kim, R., Emi, M., Tanabe, K. Cancer immunoediting from immune surveillance to immune escape. Immunology. 121 (1), 1-14 (2007).
- Rosato, R. R., et al. Evaluation of anti-PD-1-based therapy against triple-negative breast cancer patient-derived xenograft tumors engrafted in humanized mouse models. Breast Cancer Research. 20 (1), 108 (2018).
- Choi, Y., et al. Studying cancer immunotherapy using patient-derived xenografts (PDXs) in humanized mice. Experimental and Molecular Medicine. 50 (8), 99 (2018).
- Meraz, I. M., et al. An Improved Patient-Derived Xenograft Humanized Mouse Model for Evaluation of Lung Cancer Immune Responses. Cancer Immunol Res. 7 (8), 1267-1279 (2019).
- Wege, A. K. Humanized Mouse Models for the Preclinical Assessment of Cancer Immunotherapy. Biodrugs. 32 (3), 245-266 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados