Method Article
طريقة ال perfusion أنتيغراد لعزل القلب من الفئران
In This Article
Summary
طورنا طريقة simple لعزل خلايا قلب الفأر الفردية عالية الجودة عن طريق تقنية التشويش المسبق. هذه الطريقة خالية من Langendorff ومفيدة لعزل الخلايا العضلية البطينية والأبطية أو الخلايا الخلالية ، مثل الخلايا الليفية القلبية أو السلف.
Abstract
في البحوث الأساسية باستخدام قلب الماوس، عزل خلايا القلب الفردية قابلة للحياة هو خطوة تقنية حاسمة للتغلب عليها. تقليديا، تم إجراء عزل خلايا القلب من الأرانب والخنازير غينيا أو الفئران عن طريق التغلغل إلى الوراء من القلب مع الإنزيمات باستخدام جهاز Langendorff. ومع ذلك، مطلوب درجة عالية من المهارة عند استخدام هذه الطريقة مع قلب الماوس صغيرة. تم الإبلاغ مؤخرا عن طريقة التغلغل التي لا تستخدم جهاز Langendorff لعزل خلايا القلب الماوس. نحن هنا تقرير بروتوكول كامل لتحسين التغلغل قبل التحلل من القلب المقتطع لعزل خلايا القلب الفردية من الفئران البالغة (8-108 أسابيع من العمر). يتم إجراء التشوه الأمامي عن طريق حقن اليرفوسات بالقرب من قمة البطين الأيسر للقلب المقتطع ، الذي تم تثبيت الشريان الأورطي منه ، باستخدام مضخة ضخ. يتم تنفيذ جميع الإجراءات على حصيرة سخان مسبقة الدفء تحت المجهر ، مما يسمح بمراقبة عمليات الحقن والتشويش. تشير النتائج إلى أن الخلايا العضلية البطينية والأبطية ، والخلايا الليفية يمكن عزلها بشكل جيد عن فأر بالغ واحد في وقت واحد.
Introduction
عموما، الخطوة الأولى من عزلة خلية واحدة من الأنسجة تشريح ينطوي على قطع الأنسجة إلى قطع صغيرة، تليها هضم النسيج الضام ومصفوفة خارج الخلية مع الإنزيمات. ومع ذلك ، لا يمكن عزل خلايا القلب مع مثل هذه الطريقة التقطيع ، حيث أن الإثراء بمكونات المصفوفة خارج الخلية ، بما في ذلك ألياف الكولاجين والإيلاستين ، يجعل عضلة القلب صعبة للغاية على المفروم ، وخلايا القلب حساسة للغاية لنقص الأكبسجة والتغيرات الأخرى في البيئة الدقيقة. وهكذا، باستخدام نظام الارتخاء الرجعي القائم على Langendorff1،تم تطوير طريقة لهضم المصفوفة خارج الخلية مع الإنزيمات لعزل خلايا القلب الفردية من القلب2،3،4.
في نماذج الماوس، Langendorff المستندة إلى الرجعية perfusion القلب مع الانزيمات يستخدم أيضا لعزل خلايا القلب الفردية5،6،7،8. ومع ذلك ، فإن علبة الشريان الأورطي الماوس الصغيرة والرقيقة وتصاعدها على جهاز Langendorff لأداء التخثر الرجعي يتطلب درجة عالية من المهارة ، لأن قطر الشريان الأورطي في قلب البالغين يبلغ حوالي 1.2 مم. وعلاوة على ذلك، فإنه يأخذ وقتا لإجراء تجارب متعددة كما ينبغي تنظيف جهاز Langendorff قبل التغلغل في القلب التالي.
كبديل للتشويش الرجعي ، تم تطوير طريقة جديدة لعزل خلايا القلب من قلب فأر بالغ دون جهاز Langendorff. واستند هذا الأسلوب صنع عصر على التغلغل قبلغراد من الشرايين التاجية9. قمنا مؤخرا بتحسين كل خطوة من هذا البروتوكول السابق للتحلل ، مثل لقط الشريان الأورطي ، وإدخال الإبر ، والتحكم في درجة الحرارة ، ورصد جميع إجراءات التشوه بالمجهر10. نحن هنا تقرير بالتفصيل صقل هذه الطريقة التغلغل قبلغراد لتقصير الوقت للعزلة وتوفير شريط فيديو تكميلي. في هذه الطريقة ، يستغرق تغلغل القلب حوالي 7 دقائق مع 10 مل من الإنزيمات ، وتزيد فترة الهضم القصيرة هذه من صلاحية الخلايا. هذه طريقة بسيطة لعزل خلايا القلب المفردة بجودة عالية دون الحاجة إلى إضافة مواد كيميائية ، مثل 2،3 بوتانديون monoxime (BDM)6،11 أو تورين5،8. ونحن نعتقد أن هذه الطريقة سوف تخفض عتبة المهارة من هذه التقنية وتعزيز فائدة خلايا القلب الماوس في البحوث الأساسية.
Protocol
تتوافق جميع التجارب على الحيوانات مع دليل رعاية واستخدام المختبرات الذي نشرته المعاهد الوطنية للصحة في الولايات المتحدة (منشور المعاهد القومية للصحة رقم 85-23، المنقح لعام 1996) وتمت الموافقة عليه من قبل مجلس المراجعة المؤسسية التابع للجنة رعاية الحيوانات واستخدامها في جامعة شيغا للعلوم الطبية (تمت الموافقة على رقم 2019-3-7). وقد نفذت هذه الأساليب وفقا للمبادئ التوجيهية المعتمدة.
1. الصكوك والحل
ملاحظة: يوضح مخطط الإجراء التجريبي في رسم تخطيطي للتدفق(الشكل التكميلي 1). يجب استخدام مضخة التسريب (أو مضخة الحقن) لتشويش القلب في اتجاه واحد. لا ينصح مضخة التجذم الذي يخلق تدفق النابض.
- قبل التجربة
- وضع علامة على إبرة الحقن في موقع ما يقرب من 3 ملم من طرف مع طلاء الأظافر. بعد السماح لها الهواء الجاف، يبقيه في الحاوية في درجة حرارة الغرفة. من المستحسن وجود لون أحمر أو مشرق لتأكيد عمق الإدخال في عضلة القلب أثناء التغلغل.
- جعل القلب الوقوف عن طريق قطع الأغطية قبالة من أنابيب عينة 1.5-، 0.5- و 0.2 مل وإرفاق الأغطية إلى الجزء السفلي من طبق ثقافة 60 ملم مع شريط على الوجهين أو لاصقة. تثبيت ثلاثة أغطية مختلفة الحجم في طبق واحد يجعل من الممكن اختيار واحد مناسب وفقا لحجم قلب الماوس. يمكن إعادة استخدام حامل القلب هذا بعد الغسيل.
- جعل الأسهم الحل كما هو مبين في الجدول 1. تخزين حلول المخزون عند 4 °C.
- في يوم التجربة
ملاحظة: الخلية العزل العازلة (CIB) يحتوي على (في mM) 130 NaCl, 5.4 KCl, 0.5 MgCl2, 0.33 NaH2PO4, 22 الجلوكوز, 40 وحدة / مل الأنسولين و 25 HEPES (درجة الحموضة المعدلة إلى 7.4 مع NaOH); والحل التيرود يحتوي على (في mM) 140 NaCl، 5.4 KCl، 1.8 CaCl2،0.5 MgCl2،0.33 NaH2PO4، 5.5 الجلوكوز و 5.0 HEPES (درجة الحموضة المعدلة إلى 7.4 مع NaOH).- إعداد البنك التجاري الدولي. دافئ 160 مل من الماء المقطر (DW) باستخدام الميكروويف إلى حوالي 32 درجة مئوية ثم إضافة 20 مل من 10X CIB. بعد إضافة 0.79 غرام من الجلوكوز و 10 ميكرولتر من محلول الأنسولين، قم بضبط درجة الحموضة باستخدام 1 M NaOH وجلب إلى 200 مل مع DW.
- إعداد محلول مزيج الانزيم (مزيج الانزيم). إضافة 30 ملغ من الكولاجيناز, 1.8 ملغ من تريبسين, 1.8 ملغ من بروتياز و 90 ميكرولتر من 100 م م كاكل2 حل الأسهم إلى 30 مل من CIB (النهائي كا2 + تركيز 0.3 mM), مزيج, ويبقيه على الجليد. في الفئران <4 أسابيع من العمر, تقليل التريبسين والبروتيز إلى 0.9 ملغ10. دافئ عند 37 درجة مئوية في حمام مائي قبل الاستخدام.
- إعداد حل CIB-Ca2+-BSA. إضافة 30 ملغ BSA و 90 ميكرولتر من 100 mM CaCl2 حل الأسهم إلى 15 مل من CIB (النهائي Ca2 + تركيز 1.2 mM), مزيج, تصفية من خلال مرشح 20-μm, ويبقيه على الجليد.
- إعداد حل CIB-EGTA. بعد إجراء الحلول الموضحة في الخطوتين 1.2.2 و 1.2.3، أضف 400 متر EGTA إلى حل سهم البنك التجاري الدولي المتبقي عند تخفيف 1:1000 (تركيز EGTA النهائي هو 0.4 mM)، ومزيج. املأ طبق الثقافة مقاس 35 ملم وطبق حامل القلب مع CIB-EGTA وابقهما على الجليد.
- صب ما يقرب من 20 مل من CIB-EGTA في كوب زجاجي 30 مل والوقوف ماصة نقل البلاستيك في الكأس، وإبقائه على الجليد.
- إعداد حل تايرود. أضف 100 مل من 10X Tyrode إلى 800 مل من DW ودفئه باستخدام ميكروويف إلى حوالي 32 درجة مئوية. بعد إضافة 0.99 غرام من الجلوكوز و 1.8 مل من 1 M CaCl2، ضبط درجة الحموضة باستخدام 1 M NaOH وجلب إلى 1000 مل مع DW.
- إعداد حل إعادة الإنفاق الخلية. إضافة 30 ملغ من BSA و 300 ميكرولتر من المضادات الحيوية 50X إلى 15 مل من محلول التيرود.
- إعداد المحاقن. املأ المحاقن التي يبلغ سعة 20 مل والمتصلة بأنبوب التمديد المرن وإبرة الحقن المميزة مع CIB-EGTA. املأ المحاقن التي يبلغ سعة 30 مل بمزيج الإنزيم الدافئ. عقد لهم على حد سواء في 37 درجة مئوية حتى قبل الاستخدام مباشرة.
- إعداد لوحة التخبط. قبل الحرب حصيرة سخان تحت المجهر مجسمة. ضع لوحة التشوه (غطاء لوحة ثقافة متعددة الآبار) على حصيرة سخان ما قبل الحرب. ما قبل الحرب المشبك الأوعية الدموية عن طريق وضعه في لوحة التخبط حتى الاستخدام. ضع طبق الثقافة 60 ملم لpipetting ومجهد الخلية على حصيرة سخان ما قبل الحرب كذلك.
2. تغلغل أنتيغراد من قلب الماوس
ملاحظة: يجب أن يكون ماصة نقل البلاستيك المستخدمة لامتصاص القلب لينة ولا تكون مدببة بشكل حاد نحو الطرف. اختيار المشبك الأوعية الدموية الصغيرة مع serration. وترد الصكوك الموصى بها في جدول المواد.
- استئصال قلب الفأر و لقط الشريان الأورطي
ملاحظة: الفئران البالغة (>8 أسابيع من العمر) يجب أن يقتل رميا بالرصاص بجرعة زائدة من البنتوباربيتال الصوديوم (>300 ملغم/كغ، الحقن داخل الصفاق [i.p.] مع الهيبارين (8000 وحدة/كجم).- استئصال قلب الماوس بسرعة عن طريق مص.
- افتح تجويف الصدر بسرعة لكشف القلب. قطع ماصة نقل البلاستيك، غيض منها هو تقريبا نفس حجم، أو أصغر قليلا من، والقلب المكشوفة (عادة في موقع ما يقرب من 1 سم من علامة 0.5 مل نحو الطرف، ولكن ذلك يعتمد على حجم القلب).
- تمتص القلب في ماصة، ورفع ماصة لخلق مساحة كافية لإدراج مقص، والمكوس القلب مع مقص المنحني من الجانب الظهري، وتجنب إتلاف الأذين.
- نقل القلب المقتطع على الفور إلى كوب زجاجي سعة 30 مل يحتوي على CIB-EGTA المبرد بالجليد لوقف الانكماش. يستغرق هذا الإجراء عادة <1 دقيقة.
- التنظيف حول الشريان الأورطي
- نقل القلب إلى طبق ثقافة 35 ملم مليئة الجليد المبردة CIB-EGTA وإزالة الرئة والأنسجة المرئية الأخرى، ومن ثم نقل القلب تنظيفها تقريبا إلى موقف القلب مليئة المبردة CIB-EGTA ووضعه مع قمة أسفل.
- تحت المجهر المجسم، قم بإزالة الأنسجة الدهنية والضاغطة لتنظيفها حول الشريان الأورطي. إذا كان طول الشريان الأورطي المقطوع طويلا جدا بما في ذلك الشريان العضدي ، أو الشريان السباتي الأيسر الشائع أو الشريان تحت الترقوة الأيسر ، فقطع الشريان الأورطي أسفل الشريان العضدي لتقصيره من أجل المضي قدما في الخطوة التالية. هذا الإجراء عادة ما يستغرق حوالي 4 دقائق.
- لقط الشريان الأورطي ووضع القلب فرضت على لوحة التغلغل
- تحت المجهر، ضع القلب في موقف القلب. يجب أن يواجه المشغل السطح الأمامي للقلب ، ويلتقط نهاية الشريان الأورطي بالملاقط ، ويشبك الشريان الأورطي بالقرب من الأذين بمشبك الأوعية الدموية الصغير أثناء الضغط برفق على الشريان الأورطي قليلا.
- ضع القلب المشدون على لوحة التشوه مع الجانب الأمامي لأعلى ، ثم قم بتغطيته ببضع قطرات من CIB-EGTA لمنعه من الجفاف. هذا الإجراء عادة ما يستغرق 20 < s.
- استئصال قلب الماوس بسرعة عن طريق مص.
- التشوه الأمامي للقلب
ملاحظة: أولا، يتغلغل القلب مع CIB-EGTA لتفريغ الدم ومنع التخثر.- أدخل إبرة الحقن وابدأ التشوه لتفريغ الدم
- تعيين حقنة 20 مل مليئة CIB-EGTA prewarmed متصلة أنبوب تمديد مرنة وإبرة حقن ملحوظ على مضخة التسريب. بدء المضخة بمعدل بطيء 0.5 مل / دقيقة لملء بعناية الإبرة وأنبوب مع CIB-EGTA وتأكد من منع أي هواء من دخول الأنبوب.
- ضع إبرة الحقن على لوحة التشوه مع الجانب الأقصر من الشكل القطري في الأمام. حرك الإبرة نحو قمة القلب حتى تلمسها، ثم أدخل الإبرة بعناية بالقرب من قمة البطين الأيسر في غرفة البطين دون التواء. لا تفصل الإبرة عن اللوحة أثناء إجراء الإدخال.
- مشاهدة العلامة الحمراء لتقدير عمق إدخال الإبرة. عند اكتمال إدخال الإبرة، يجب أن يبدأ تفريغ الدم المتدفق من الشريان التاجي.
- إصلاح إبرة الحقن على لوحة مع الشريط، وزيادة سرعة المضخة إلى 1 مل / دقيقة. هذا الإجراء عادة ما يستغرق حوالي 30 s. إذا تم تغلغل القلب بنجاح ، يمكن رؤية تدفق CIB-EGTA في الشعرية تحت الإبيكارديوم تحت المجهر.
- تغلغل القلب مع مزيج الانزيم
ملاحظة: أثناء الانزيمية التشوه، يمكن رصد عمق الإبرة إدراجها عن طريق التحقق من علامة حمراء على الإبرة.- بعد التغلغل 2-3 مل من CIB-EGTA لتصريف الدم تماما من الشريان التاجي، وتغيير perfusate إلى مزيج الانزيم. تجنب السماح لفقاعات الهواء بدخول الأنبوب. تحقق من تدفق مزيج الانزيم، وتأكد من أن إبرة الحقن لم يخرج عن طريق التحقق من موقف العلامة الحمراء.
- بعد أن تم perfused 1-2 مل، وزيادة سرعة المضخة إلى 1.5 مل / دقيقة. إزالة perfusate المتراكمة التي تحتوي على الدم الذي تدفق من القلب مع ماصة من وقت لآخر.
ملاحظة: مع مرور الوقت، سوف يصبح جدار عضلة القلب شفافا في بعض الأماكن ويظهر مرقش، وهو علامة على هضم المصفوفة خارج الخلية بعد التغلغل الناجح. علامة أخرى هي إعادة تشغيل الضرب الأذيني الناجم عن وجود Ca2 + في مزيج الإنزيم. - توقف عن التشوه عندما يكون الحجم الإجمالي لمزيج الإنزيم المشبع 10 مل.
- أدخل إبرة الحقن وابدأ التشوه لتفريغ الدم
3. عزل خلايا القلب الفردية
- فصل خلايا القلب
- بعد التغلغل مع مزيج الانزيم، نقل 10 مل من مزيج الانزيم المتبقية في الحقنة إلى طبق ثقافة 60 ملم وضعت على حصيرة سخان وإضافة 20 ملغ من BSA (0.2٪ BSA في مزيج الانزيم). يجب أن يذوب مسحوق BSA الذي تم إسقاطه على الفور عن طريق الدوران برفق بيد. إزالة إبرة الحقن والمشبك الوعائي من القلب.
- فصل البطينين والأتريا ونقل كل في مزيج انزيم تستكمل مع 0.2٪ BSA على حصيرة سخان.
- عزل الخلايا العضلية البطينية
- الاستيلاء على epicardium مع اثنين من ملاقط، وتمزيق بلطف وسحب البطينين من جانب إلى آخر في مزيج انزيم تكملها مع 0.2٪ BSA إلى قطع صغيرة. تفريق الخلايا مع pipetting لطيف (حوالي 30 مرة).
- فلتر الحطام غير المهضوم من خلال مصفاة خلايا شبكية سعة 100 ميكرومتر، ونقل الخيوط إلى أنبوب طرد مركزي سعة 15 مل للطرد المركزي عند 50 × غرام لمدة 3 دقائق. Resuspend خلايا القلب بيليه في PREWARMED CIB-Ca2 +-BSA الحل، واحتضان لمدة 5 دقائق في 37 درجة مئوية، ومن ثم الطرد المركزي في 14 × غرام لمدة 3 دقائق.
- إعادة إنفاق خلايا القلب المعجل النهائي في محلول إعادة تعليق الخلية (يتم سرد التكوين في الجدول 2)والاحتفاظ به عند 37 درجة مئوية.
- عزل الخلايا العضلية الأذينية
- أثناء الطرد المركزي النهائي لجزء الخلايا النيبية البطيني في الخطوة 3.2 ، ابدأ في عزل الخلايا العضلية الأذينية. نقل الأذين، وتخزينها كما هو الحال في الخطوة 3.1، إلى حل CIB-Ca2+-BSA قبل الحرب، المسيل للدموع إلى قطع وتفكيك الخلايا عن طريق الأنابيب مع تلميح ماصة في 10 ميكرولتر على حصيرة سخان.
- الطرد المركزي خليط الخلية في 14 × ز لمدة 3 دقائق وإعادة إنفاق الخلايا الأذينية بيليه مع محلول إعادة الإنفاق الخلية.
- عزل وثقافة الخلايا الليفية القلبية
- نقل supernatant من الطرد المركزي الأول في الخطوة 3.2 إلى أنبوب آخر 15 مل الطرد المركزي، والطرد المركزي في 190 × غرام لمدة 5 دقائق. غسل الخلايا عجلت مرتين مع الطرد المركزي في دولبيكو النسر المعدل المتوسط (DMEM)، ومن ثم تعليق الخلايا مع DMEM تكملها 10٪ ألبوم الأبقار الجنينية (FBS) والمضادات الحيوية.
- لوحة كسر الخلية النهائي في قارورة الثقافة (25 سم2)والسماح للخلايا على الانضمام إلى الجزء السفلي من القارورة في جو رطب من الهواء 95٪ و 5٪ CO2. بعد 90 دقيقة حضانة، تجاهل الخلايا غير مرتبطة، وإضافة وسيطة ثقافة جديدة. يجب أن تقترب الخلايا من الالتقاء بعد حوالي 4 أيام ، وعند هذه النقطة يجب تضخيمها عن طريق المحاولة وزرعها في أطباق ثقافية جديدة.
4. حصاد البروتينات من الأذينين والبطينين
- بعد التخثر، فصل الأذينين والبطينين، وتجانسها في عازلة تحلل بنسبة 10 ملغ من وزن الأنسجة إلى 100 ميكرولتر من العازلة باستخدام طاحونة صغيرة في أنبوب عينة 1.5 مل.
- الحفاظ على التجانس في الجليد لمدة 40 دقيقة مع دوامة خلط كل 10 دقيقة لاستخراج البروتينات، ومن ثم الطرد المركزي الأنبوب في 15000 × غرام لمدة 20 دقيقة في 4 درجة مئوية. تخزين كسر فائقة في -80 درجة مئوية كعينة البروتين.
5. الاحتواء المناعي لخلايا القلب المعزولة
ملاحظة: من الضروري تعطيل خلايا القلب غير الملتصقة إلى أسفل طبق تصوير الخلايا باستخدام الغراء البيولوجي.
- الالتصاق بخلايا القلب المعزولة إلى طبق ثقافة الزجاج القاع
- قبل البدء في عزل الخلية، قم بتغليف طبق الثقافة الزجاجي السفلي بالغراء البيولوجي (على سبيل المثال، Cell-Tak) وفقا لتعليمات الشركة المصنعة، وشطفه ب DW، وتجفيف الهواء في درجة حرارة الغرفة.
- بعد إعادة تعليق خلايا القلب المعزولة في حل CIB-Ca2+- BSA ، أسقط تعليق الخلية في الجزء السفلي من الأطباق المغلفة بالغراء ، واحتضن لمدة 20 دقيقة في درجة حرارة الغرفة دون هياج.
- التثبيط المناعي
- لوحة cardiomyocytes معزولة على طبق الزجاج القاع precoated مع الغراء البيولوجية ويبقيه في درجة حرارة الغرفة لمدة 40 دقيقة للسماح للخلايا على الالتزام الطبق. ثقافة الخلايا الليفية القلبية في أطباق ثقافة الزجاج السفلي.
- شطف الخلايا مع المالحة العازلة بالفوسفات (PBS)، وإصلاحها مع 4٪ paraformaldehyde (PFA) لمدة 5 دقائق مع اهتزاز. غسل الخلايا الثابتة مع برنامج تلفزيوني لمدة 10 دقيقة ثلاث مرات، واحتضان لهم في حل حجب permeabilization لمدة 60 دقيقة في درجة حرارة الغرفة مع اهتزاز.
- خلايا التحقيق مع الأجسام المضادة الأولية المخففة في حل منع permeabilization لمدة 60 دقيقة في درجة حرارة الغرفة أو بين عشية وضحاها في 4 درجة مئوية. غسل الخلايا مع برنامج تلفزيوني لمدة 10 دقيقة ثلاث مرات، واحتضان ثم مع الأجسام المضادة الثانوية المضان المسمى لمدة 60 دقيقة في درجة حرارة الغرفة.
- بعد غسلها ثلاث مرات مع برنامج تلفزيوني لمدة 10 دقائق ، وصمة عار النوى مع DAPI (1:10000 التخفيف في برنامج تلفزيوني). تحليل إشارات الفلورسنت باستخدام المجهر المسح بالليزر confocal.
6. كامل الخلية التصحيح تسجيلات المشبك
- تصنيع أقطاب التصحيح من الشعيرات الدموية الزجاجية باستخدام سحب microelectrode الأفقي. وتراوحت مقاومة القطب الكهربائي من 2 إلى 4 MΩ عند ملؤها بمحلول ماصة K+-rich (الجدول 2). نقل aliquot من خلايا القلب المعزولة إلى غرفة تسجيل محمولة على خشبة المسرح من المجهر المقلوب superfused مع تايرود بمعدل 1 مل / دقيقة في 36-37 درجة مئوية.
- تسجيل إمكانات العمل باستخدام طريقة مثقبة التصحيح المشبك مع K+الغنية محلول ماصة تحتوي على 30 ملغ / مل amphotericin B عن طريق تطبيق النبضات الحالية من 5-10 مللي ثانية في المدة بمعدل 1 هرتز عبر القطب التصحيح.
7. تحليلات البقع الغربية
- في هذه الدراسة، قم بإجراء تحليل لطخة غربية للبروتينات الصغيرة الجزيئية الوزن، مثل الببتيد الناتري يوري يوري الأذيني (ANP).
- حل عينة البروتين في التركيز النهائي من 1X عينة العازلة، 2٪ 2 'ميركابتوثانول، وإزالة البروتينات لمدة 60 دقيقة في 37 درجة مئوية. تحميل 20 ميكروغرام من البروتين في كل بئر، وأداء الكهربائي في تشغيل العازلة مع 20 mA لكل هلام لمدة 120 دقيقة.
- نقل البروتين إلى غشاء PVDF في نقل العازلة في 10 V لمدة 40 دقيقة. غسل الغشاء المنقول مرتين مع TBST لمدة 5 دقائق، ثم كتلة مع الحليب الخالي من الدسم 5 ٪ في TBST لمدة 60 دقيقة في درجة حرارة الغرفة، والتحقيق مع الأجسام المضادة الأولية المذابة في TBST بين عشية وضحاها في 4 درجة مئوية.
- غسل الغشاء 5 مرات مع TBST لمدة 7 دقائق، واحتضانه مع الأجسام المضادة الثانوية المخفف في TBST لمدة 120 دقيقة في درجة حرارة الغرفة.
- بعد غسل الغشاء 5 مرات مع TBST لمدة 7 دقائق ، تصور الإشارات مع فحص chemi-luminescence وتحليلها مع محلل صورة لومينو.
النتائج
مبدأ هذه الطريقة بسيط: يتدفق التغلغل من الغرفة اليسرى ، ويتم فتح الصمام الأبهري ، ويمتد التغلغل إلى الشريان التاجي في نفس اتجاه تشغيل الدم ، حيث يتم إغلاق الشريان الأبهري عن طريق اللقط ، مما يتيح التغلغل العميق في عضلة القلب من أجل هضم المصفوفة خارج الخلية.
تظهر الخلايا الن البطينية المعزولة حديثا مع الطريقة الحالية في الشكل 1A. يظهر الشكل 1B صورا مكبرة للخلايا العضلية البطينية والبطينية. وقد أسفر هذا الإجراء عن ارتفاع الغلة (70٪-80٪) من الخلايا البطينية على شكل قضيب من الفئران البالغة (8-10 أسابيع) ، والتي كانت متاحة في غضون 5 ساعات تقريبا بعد العزلة (الشكل 1C) ، وهو فاصل زمني مماثل لذلك عند استخدام الإجراء التقليدي القائم على Langendorff7. ومع ذلك ، كانت نسبة الخلايا القابلة للحياة المعزولة حديثا أقل في الفئران القديمة من >2 سنة(الشكل 1C). كان العدد الإجمالي للخلايا الن البطينية التي تم الحصول عليها لكل قلب بالغ باستخدام هذا البروتوكول حوالي 3 × 106 خلايا ، والتي كانت مماثلة للقيمة المبلغ عنها سابقا7،12. وكانت إمكانات العمل المسجلة في الخلايا العضلية البطينية والبطينية(الشكل 1D)مماثلة لتلك الموجودة في الخلايا التي تم الحصول عليها من خلال الطريقة10المستندة إلى Langendorff . أكد تحليل المناعة أن الهيكل الساركوميري للخلايا العضلية البطينية كان منظما بشكل جيد مع غشاء خلية مرئي بوضوح(الشكل 2A). يمكن استخدام خلايا القلب الفردية المعزولة مع هذه الطريقة مباشرة في التجارب ، مثل التحليل الكهربي10 أو تجربة التخبز المناعي.
توجد الخلايا الليفية القلبية في المساحات الخلالية. الهضم الكافي للمصفوفة خارج الخلية يؤدي إلى عزل تلك الخلايا. تتكاثر الخلايا الليفية القلبية المعزولة في ظل ظروف الثقافة ويمكن تمريرها عدة مرات أو تخزينها في النيتروجين السائل في محلول خزان الخلايا المناسب. الشكل 2B يظهر أن معظم الخلايا الليفية القلبية المستزرعة قد تحولت إلى الخلايا العضلية الليفية خلال الثقافة الفرعية، كما أكد التعبير المتزايد عن α العضلات الملساء actin13،14. أيضا ، يمكن عزل السلف القلبية مع الطريقة الحالية ومثقفة في وسط الثقافة المناسبة ، والتي تبدأ الضرب تلقائيا10،15.
تجانس عضلة القلب القوية ليس سهلا ، خاصة بالنسبة للأنسجة القلبية من الفئران القديمة ، التي تمتلك كمية كبيرة من الألياف خارج الخلية. بعد التخثر المسبق ، يمكن تجانس البروتين من الأذينين والبطينين بسهولة في حاجز التحلل مع قوة الضوء لاستخراج البروتينات. أظهر تحليل لطخة غربية التعبير المحدد عن ANP في الأذينين ولكن ليس في البطينين من البالغين (20 أسبوعا) والذين تتراوح أعمارهم بين (108 أسابيع من العمر) الفئران(الشكل 3).
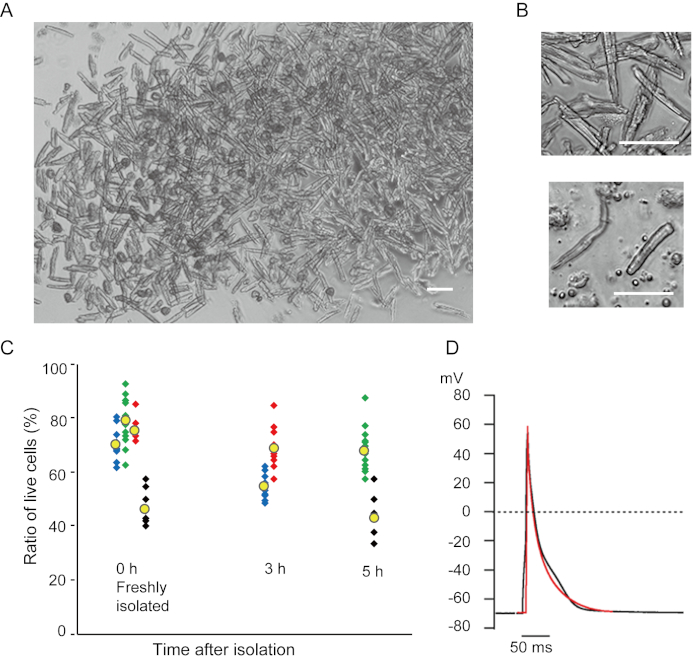
الشكل 1 - الأرقام 1- الأرقام 1 خلايا القلب المعزولة من الفئران. A. الخلايا العضلية البطينية معزولة حديثا مع التخبط قبل التحلل، مع الصور المكتسبة مع التكبير منخفضة. بعد الغسيل النهائي ، تم إعادة إنفاق خلايا القلب مع 2 مل من محلول إعادة الإنفاق الخلوي ، تم إسقاط 100 ميكرولتر منها على طبق ثقافة الزجاج السفلي وتسوية الخلية المنتظرة. شريط، 100 ميكرومتر.B. صور مكبرة من الخلايا العضلية البطينية المعزولة (العلوي) والخلايا العضلية الأذينية (أقل). بار، 100 ميكرومتر.C. تم تعليق الخلايا المعزولة في محلول إعادة تعليق الخلية وتخزينها عند 37 درجة مئوية للفترة المطلوبة، وتم حساب عدد الخلايا العضلية البطينية الحية في 10-15 حقلا تحت المجهر. واعتبرت الزنزانات المستديرة مصابة أو ميتة بصورة لا رجعة فيها16. تم الحصول على رموز خضراء وزرقاء وحمراء من 3 فئران في عمر 8-10 أسابيع ، وكانت الرموز السوداء من الماوس القديم 106 أسابيع. يشير الرمز الأصفر إلى متوسط كل مجموعة. دال - إمكانات العمل التمثيلية المسجلة من الخلايا العضلية البطينية (السوداء) والأذيان (الحمراء) من الفئران 8-10. تم الحصول على البيانات من الخلايا حوالي 3 ساعة بعد العزل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
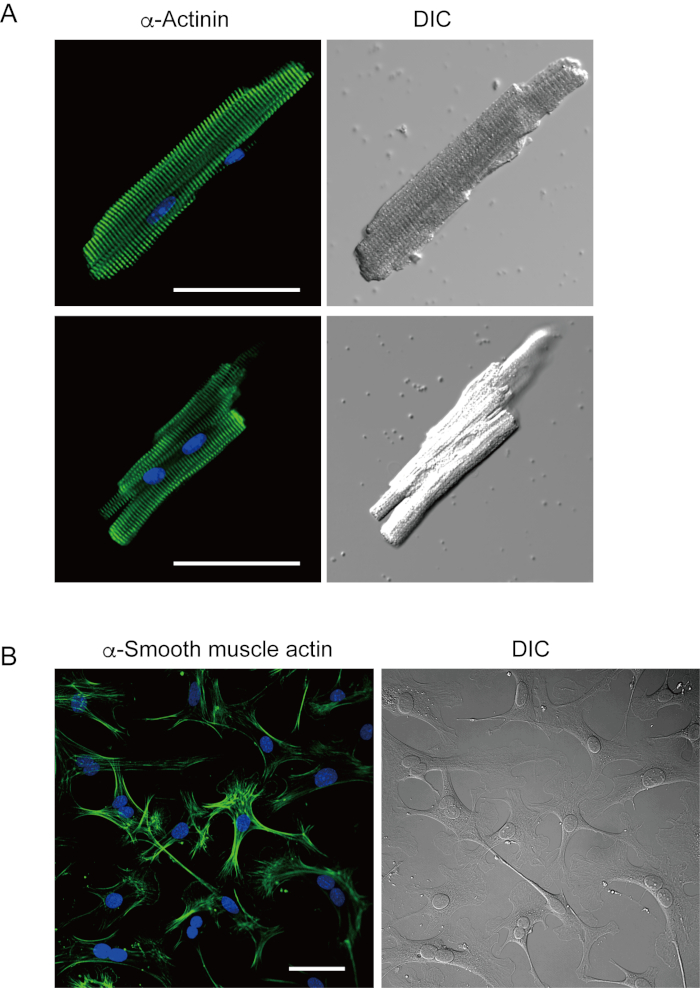
الشكل 2 - الأرقام 2- الأرقام التي تم المناعة α-actinin في الخلايا العضلية البطين الماوس معزولة والعضلات α الملساء actin في الخلايا الليفية القلبية الماوس المستزرعة. أ. فحص الليزر Confocal المجهر من المناعة لsin α (الأخضر)، DAPI تلطيخ لنوى (الأزرق) وصورة DIC من الخلايا العضلية البطيني معزولة عن قلب الماوس مع التشوه قبل التحلل. شريط، 50 ميكرومتر.B. المناعة لactin العضلات α على نحو سلس (الأخضر)، DAPI تلطيخ لنوى (الأزرق) وصورة DIC من الخلايا الليفية القلبية معزولة عن قلب الماوس مع التشوه قبل التحلل. تم استزراع الخلايا الليفية القلبية لمدة أربعة أيام. شريط، 100 ميكرومتر. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
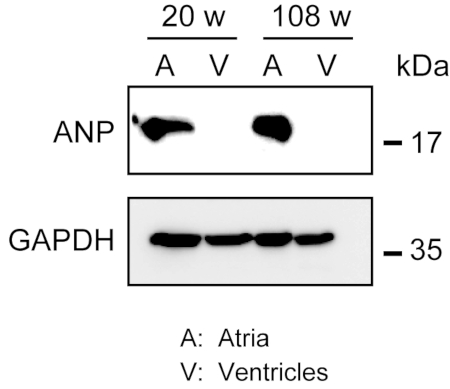
الشكل 3 - الأرقام 3- الأرقام التي يمكن أن تحليلات بقعة الغربية من ANP في الأذينين والبطينين. تحليلات لطخة الغربية للببتيد ناتريوريتيك الأذينية علامة (ANP) في الأذينين (A) والبطينين (V) أعدت من الكبار (20 أسبوعا) والذين تتراوح أعمارهم بين (108 أسابيع) قلوب. ANP موجود في الأذينين ولكن غائبة في البطينين. استخدام غليسيرالدهيد 3 فوسفات ديهيدروجيناز (GAPDH) كبروتين مراقبة حفظ المنزل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| حلول المخزون لعزل خلايا القلب | |
| 10X CIB (500 مل) | |
| ناكل | 37.99 غرام |
| KCI | 2.01 غرام |
| 1 م م م2 | 2.5 مل |
| NaH2PO4 | 0.23 غرام |
| هيبس | 29.79 غرام |
| جاف | تعبئة حتى 500 مل |
| 100 mM CaCl2 الأسهم soution | |
| كاكل2 | 100 مليون متر |
| 400 mM EGTA الأسهم الحل | |
| EGTA | 400 مليون متر |
| محلول الأنسولين | |
| إنسولين | وحدة واحدة/مل في 0.1 م هكل |
| 50X المضادات الحيوية الأسهم حل (20 مل) | |
| بنسلين | 100 ملغ |
| ستريبتومايسين | 100 ملغ |
| فينول الأحمر | 1.5 غرام |
| جاف | 20 مل وتعقيم مع تصفية |
| حل 10X التيرود (1000 مل) | |
| ناكل | 81.82 غرام |
| KCl | 4.03 غرام |
| 1 م م م2 | 5 مل |
| NaH2PO4 | 0.47 غرام |
| هيبس | 11.92 غرام |
| ناوه | 0.8 غرام |
| جاف | تعبئة حتى 1000 مل |
| الأسهم الذوبان لتثبيط المناعة | |
| أسهم DAPI | |
| DAPI | 2 ملغم/مل في الميثانول |
| حلول الأسهم لللطخات الغربية | |
| HEPES العازلة (100 مل) | |
| ناكل | 0.88 غرام |
| 400 متر EGTA | 0.25 مل |
| هيبس | 0.24 غرام |
| 1M ناوه | ضبط درجة الحموضة إلى 7.4 |
| جاف | تعبئة حتى 500 مل |
| كوكتيل مثبطات البروتيز | |
| مصغرة كاملة | 1 قرص |
| جاف | 0.4 مل |
الجدول 1 - الجداول وصف حلول المخزون. حافظ على حلول المخزون عند 4 درجة مئوية. Aliquot مثبطات البروتيز كوكتيل للتخزين في -20 درجة مئوية.
| حلول لخلايا القلب متساوية الالتهاز | |
| CIB (200 مل) | |
| 10X CIB | 20 مل |
| محلول الأنسولين | 0.01 مل |
| الجلوكوز | 0.79 غرام |
| 1M ناوه | درجة الحموضة ضبط إلى 7.4 |
| جاف | تعبئة حتى 200 مل |
| محلول مزيج الإنزيم (30 مل) | |
| كولاجيناز type2 | 30 ملغ |
| تريبسين | 1.8 ملغ |
| بروتياز | 1.8 ملغ |
| 100 mM CaCl2 حل الأسهم | 0.09 مل |
| CIB | 30 مل |
| CIB-Ca2+- BSA (15 مل) | |
| جيش صرب البوسنه | 30 ملغ |
| 100 mM CaCl2 حل الأسهم | 0.18 مل |
| CIB | 15 مل |
| CIB-EGTA (150 مل) | |
| 400 mM EGTA الأسهم الحل | 0.150 مل |
| CIB | 150 مل |
| حل التيرود (1000 مل) | |
| 10X تايرود الأسهم الحل | 100 مل |
| الجلوكوز | 0.99 غرام |
| 1M كاتال2 | 1.8 مل |
| 1M ناوه | درجة الحموضة ضبط إلى 7.4 |
| جاف | تعبئة حتى 1000 مل |
| محلول إعادة إعادة الإنفاق الخلوي (15 مل) | |
| جيش صرب البوسنه | 30 ملغ |
| 50X المضادات الحيوية الأسهم الحل | 0.3 مل |
| حل تايرود | 15 مل |
| حلول لتثبيط المناعة | |
| حل معتنق للخلية (0.3 مل) | |
| خلية تاك | 0.01 مل |
| 0.1 م ناهكو3 (pH8.0) | 0.285 مل |
| 0.1 م ناوه | 0.005 مل |
| حظر-permeabilizatin الحل (10 مل) | |
| مصل الأبقار الجنينية | 1 مل |
| تريتون X-100 | 1 مل |
| 10X برنامج تلفزيوني | 1 مل |
| جاف | 7 مل |
| K+ حل ماصة الغنية | |
| أسبارتات البوتاسيوم | 70 مليون متر |
| KCl | 50 مليون متر |
| KH2PO4 | 10 مليون متر |
| مغسو4 | 1 مليون متر |
| ملح دي الصوديوم ATP | 3 مليون متر |
| GTP ملح الليثيوم | 0.1 مليون متر |
| EGTA | 5 مليون متر |
| هيبس | 5 مليون متر |
| كوه | درجة الحموضة ضبط إلى 7.2 |
| حلول لللطخات الغربية | |
| تحلل العازلة (1 مل) | |
| عازل HEPES | 0.86 مل |
| نونيدت-P40 | 0.1 مل |
| كوكتيل مثبطات البروتيز | 0.04 مل |
| المخزن المؤقت Runnning (1000 مل) | |
| 10X TG (0.25 متر تريس و 1.92 M غليسين) | 100 مل |
| الحزب الديمقراطي الصربي | 1 غرام |
| جاف | 900 مل |
| نقل المخزن المؤقت (1000 مل) | |
| 10X TG | 100 مل |
| ميثانول | 200 مل |
| جاف | 700 مل |
| المخزن المؤقت النشاف (TBST) (1000 مل) | |
| 5M ناكل | 20 مل |
| 2M تريس-HCl (رقم الحموضة 7.5) | 5 مل |
| 10٪ توين 20 | 10 مل |
| جاف | 965 مل |
الجدول 2 - الأرباح وصف حلول العمل لعزل خلايا القلب، و المناعة و النشاف الغربي. إعداد جميع حلول العمل قبل التجارب مباشرة.
الشكل التكميلي 1 - الأرقام التكميلية 1- الأرقام التكميلية 1 مخطط تفصيلي لعزل الخلية. رسم بياني تدفق لعزل الخلايا العضلية البطينية والأبطية والخلايا الليفية القلبية من قلب واحد. يرجى الضغط هنا لتحميل هذا الرقم.
Discussion
نظرا لأن القلب عرضة بشدة للإصابة بالكيمياء ، فيجب الحفاظ على الوقت المستغرق لاستئصال القلب وغمره في CIB-EGTA البارد لوقف الانكماش قصيرا قدر الإمكان (<1 دقيقة). هذه هي الخطوة الهامة الأولى من هذا الأسلوب. وتتعلق الخطوة الحرجة الثانية باتجاه القلب. التوجه الخاص للقلب المقتطع في الخطوة 2.1.2 يجعل من السهل رؤية وإزالة الدهون والأنسجة الضامة حول الشريان الأورطي. بعد التنظيف حول الشريان الأورطي، ضع القلب المشدون مع الجانب السطحي الأمامي على لوحة التشوه. الخطوة الحاسمة الأخيرة تنطوي على إدخال إبرة الحقن. عند التقدم الإبرة نحو القلب، لا ينبغي فصل إبرة الحقن من لوحة التشوه من أجل الحفاظ على مسافة ثابتة من لوحة. يقع موضع الإدخال بالقرب من قمة البطين الأيسر. أدخل الإبرة بعناية دون التواء ، لأن مثل هذا التواء قد تكبير الحفرة. يمكن تقدير عمق إدخال الإبرة من خلال مشاهدة العلامة الحمراء. إذا تم إدخال الإبرة عميقة جدا، قد يخترق الطرف الحاجز البطيني ويدخل البطين الأيمن أو على الرغم من الصمام التاجي ويدخل الأذين الأيسر. بعد التأكد من اختفاء الدم من الشريان التاجي ، يجب إصلاح الإبرة بشريط على لوحة التشوه.
طول الأبهر أطول يجعل من الصعب المشبك الشريان الأورطي في الموقف الصحيح. إذا كان المشبك بعيدا جدا عن الأذين ، فقد يدور القلب بعد التسريب. لمنع هذا، قطع الشريان الأورطي فقط تحت الشريان العضدي لتقصير الشريان الأورطي قبل لقط.
إذا لم يبدأ الدم في التصريف بعد التشوه بسرعة أولية تبلغ 0.5 مل/دقيقة، فرفع السرعة إلى 1 مل/دقيقة. إذا لم يساعد ذلك، فقد يتم وضع إبرة الحقن بشكل غير صحيح، كما هو الحال في البطين الأيمن أو الحاجز البطيني أو جدار عضلة القلب الأيسر. في مثل هذه الحالة، قم بإزالة الإبرة على الفور وحاول إعادة إدخالها بالقرب من قمة البطين الأيسر. عند إدخال الإبرة عدة مرات، قد تتدفق الخلايا المهضومة من الثقوب المفتوحة. لاحظ أن هذا لا يؤثر عادة بشكل خطير على عزل الخلية.
يمكن للمشغلين مراقبة العملية الكاملة للتشويش المسبق للقلب باستخدام مجهر مجسم لمراقبة التغيرات في اللون والشفافية وإعادة تشغيل ضرب الأذينين جنبا إلى جنب مع الهضم. وينبغي أن يكون ما مجموعه 10 مل من مزيج الانزيم الحد الأقصى المطلوب، حتى بالنسبة للقلب القديم. في قلوب الشباب (5-7 أسابيع من العمر)، ونحن خفض حجم إلى 9 مل، وهو ما يشبه النهج عن طريق التغلغل الرجعية مع نفس مزيج الانزيم.
يحتوي الناطور في الطرد المركزي النهائي على حطام وخلايا دم وخلايا غير عضلية في حين أن الكريات تحتوي بشكل رئيسي على خلايا القلب وتلوث الخلايا غير العضلية ، مثل الخلايا الليفية والخلايا البطانية. لتنقية خلايا القلب، هناك حاجة إلى مزيد من الخطوات. بشكل عام، يجب إعادة إنفاق بيليه في الوسط المناسب لثقافة الخلية وpreplateed لمدة 2 ساعة في 37 درجة مئوية على طبق زراعة الخلايا النسيجية، ومن ثم إزالة بلطف cardiomyocytes عن طريق الأنابيب وprelating للثقافة.
يحتوي مزيج الإنزيم على تركيز منخفض من Ca2+ (0.3 mM). لذلك نحن احتضان الخلايا المهضومة في CIB-Ca2+-BSA (1.2 mM Ca2+) قبل إعادة الإنفاق النهائي مع محلول إعادة إنفاق الخلية (1.8 mM Ca2+) ، والزيادة التدريجية في Ca2 + تتجنب التسبب في تلف الخلايا7. طالما أن خلايا القلب المعزولة سليمة (خلايا هادئة بدون انكماش) فإن إجراء التكيف Ca2+هذا لا يؤثر على صلاحية الخلية في الفئران. وبما أن الخلايا التالفة تموت أثناء هذا الحضانة، فإننا نحصل بالتالي على مجموعة خلايا سليمة. وبالمثل، يمكن تخزين الخلايا العضلية الأذينية المعزولة السليمة (الخلايا الكوزة دون انكماش غير منتظم) في نفس محلول إعادة الإنفاق على الخلايا. ومع ذلك ، فإن الخلايا العضلية الأذينية تميل إلى أن تكون أكثر حساسية ليتم تخزينها مقارنة بالخلايا العضلية البطينية.
في المختبر، تكون طريقة العزل هذه ناجحة دائما تقريبا ما لم يفشل إدخال الإبرة في البطين الأيسر. كما نجحنا في عزل الخلايا عن القلب المتضخم الذي أعده الانقباض الأبهري العرضي الجراحي. ومع ذلك ، في الفئران القديمة ، والتي غالبا ما يكون احتشاءات عضلة القلب الصغيرة ، يتوقف التغلغل في بعض الأماكن ، مما يؤدي إلى هضم غير مكتمل وبالتالي انخفاض العائد(الشكل 1C)، على غرار طريقة الرجعية المستندة إلى Langendorff. في مثل هذه الحالات ، يمكن ملاحظة الشكل المشوه للقلب حتى في بداية التشوه.
هذه الطريقة التغلغلية السابقة للتحلل مفيدة لعزل خلايا القلب عن الفئران من مختلف الأعمار ولكن ليس الحيوانات الكبيرة ، مثل الأرانب والخنازير الغينية. قد يكون من الممكن تطبيق هذه الطريقة على الفئران الوليدية أو الصغيرة قبل فطمها.
واحدة من مزايا هذه الطريقة التغلغل قبل التحلل هو أنه يقلل من العقبات التقنية المرتبطة باستخدام أسلوب التغلغل الرجعي القائم على Langendorff لقلوب الفئران الصغيرة. الوقت اللازم للتشويش هو حوالي 7 دقائق مع 10 مل من الإنزيمات ، تزيد فترة الهضم القصيرة هذه من صلاحية الخلايا. بالإضافة إلى ذلك ، فإنه يمكن من إجراء التشوه من خلال الدورة الدموية التاجية للقلب ، حتى بعد هضم الصمامات الأبهري. عزل الخلايا العضلية الأذينية عادة ما يتطلب Langendorff القائم على التحلل الرجعي والحضانة مزيد من الانزيمات17. هذا النهج التغلغل قبل التحلل، ومع ذلك، يمكن أن يتغلغل بعمق الأنسجة مع الانزيم لعزل الخلايا العضلية الأذينية.
في التجارب التي تستخدم الفئران متعددة، وينبغي تنظيف جهاز Langendorff قبل التغلغل في القلب التالي. ومع ذلك ، في الطريقة الحالية السابقة للتحلل ، طالما يتم إعداد العدد المطلوب من مجموعات الأدوات (مثل إبر المحاقن ولوحات التشويش) مسبقا ، يمكن إجراء التشوه بشكل مستمر.
نحن هنا تقرير المنهجية الأساسية للتشويش السابق للقلب الماوس باستخدام نفس الحلول مثل طريقة التغلغل الرجعية Langendorff القائم مع عدم وجود مواد كيميائية إضافية. يمكن تغيير تكوين البيرفوسات ليناسب الغرض من التجربة ، مثل استخدام المنظفات التي تحتوي على EGTA بدلا من الإنزيمات لصنع قلب منزوعالخلايا 18.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
يشكر المؤلفان ت. ياماموتو وY. موري على مساعدتهما في التجارب المورفولوجية. وقد دعم هذا العمل منحة في المعونة للبحوث العلمية (C) من الجمعية اليابانية لتعزيز العلوم (18K06871 إلى M.O.K. و 17K08536 إلى H.M).
Materials
| Name | Company | Catalog Number | Comments |
| Amphotericin B | Wako Pure Chemical Industries, Japan | ||
| Alexa Fluor 488 anti-mouse IgG antibody | Molecular Probes, USA | A11001 | Fluorescent-labeled secondary antibody. (1:400 dilution for immunostaining) |
| Anti-α-actinin (ACTN) | Sigma-Aldrich, USA | A7811 | Mouse monoclonal antibody (clone EA-53). (1:400 dilution for immunostaining) |
| Anti-atrial natriuretic peptide (ANP) | Merck-Millipore, USA | AB5490-I | Rabbit polyclonal antibody (1:2000 dilution for Western blots) |
| Anti-Glyceraldehyde 3-phosphate dehydrogenase (GAPDH) | Cell Signaling Technology, USA | 2118 | Mouse monoclonal antibody (1:10000 dilution for Western blots) |
| Anti-smooth muscle actin (SMA) | Dako, Denmark | M0851 | Mouse monoclonal antibody (clone 1A4) (1:400 for immunostaining) |
| Anti-rabbit IgG antibody | Amersham, GE Healthcare, USA | NA934 | Secondary antibody (1:10000 dilution for Western blots) |
| ATP disodium salt | Sigma-Aldrich, USA | A26209 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich, USA | A9418 | |
| Cell-Tak | Corning | 354240 | Biological material for adhesion of the cell or tissues |
| Chemi-Lumi One Super | Nacalai Tesque, Japan | 02230-14 | Chemiluminescent reagent used for western blotting. |
| Collagenase Type 2 | Worthington Biochemicals, USA | LS004176 | Choose the activity guaranteed to be greater than 300 unit/mg. |
| Complete Mini | Roche, Germany | 11836153001 | A mixture of several protease inhibitors. |
| 4'6'diamidino-2-phenylindole (DAPI) | Nacalai Tesque, Japan | 11034-56 | Used for cell-impermeant nuclear stainig |
| Dulbecco's Modified Eagle's Medium (DMEM) | Nacalai Tesque, Japan | 08458-45 | including 4.5 g/L gluose |
| Extension tube | Top, Japan | X1-50 | Connect with syringe and injection needle for antegrade perfusion. |
| EPC-8 patch-clamp amplifier | HEKA, Germany | ||
| Fetal bovine serum (FBS) | Sigma-Aldrich, USA | F7524-500ML | |
| Glass capillaries | Narishige Scientific Instrument Lab., Japan | outside diameter 1.5 mm, inside diameter 0.9 mm | |
| GTP lithium salt | Sigma-Aldrich, USA | G5884 | |
| Horizontal microelectrode puller | Germany) | P-97 | |
| Heater mat | Natsume Seisakusho, Japan | KN-475-3-40 | Equipment to warm the perfusion plate. |
| Infusion pump | TERUMO, Japan | TE-311 | Infusion syringe pump for antegrade perfusion. |
| Injeciton needle (27 gauge) | TERUMO, Japan | NN-2719S | Needle for insertion into the left ventricle. |
| Insulin (from bovine pancrease) | Sigma-Aldrich, USA | I5500 | Dissolve in 0.1 M HCl. |
| Mini cordless grinder | Funakoshi, Japan | cG-4A | Small grinder for homogenizing tissue in 1.5 mL sample tube. |
| 4%-Paraformaldehyde Phosphate Buffer solution (4% PFA) | Nacalai Tesque, Japan | 09154-85 | |
| Penicillin G potassium | Nacalai Tesque, Japan | 26239-84 | |
| Phenol Red | Nacalai Tesque, Japan | 26807-21 | |
| 10X Phosphate Buffered Saline (pH7.4) (10X PBS) | Nacalai Tesque, Japan | 27575-31 | |
| Plastic multi-well culture plate | Falcon, USA | 353226 | Use the lid of the multi-well culture plate as the perfusion plate. |
| Plastic syringe (20 mL) | TERUMO, Japan | SS-20ES | Use for infusion of CIB-EGTA. |
| Plastic syringe (30 mL) | TERUMO, Japan | SS-30ES | Use for infusion of Enzyme-mix |
| Plastic transfer pipette | Sarstedt, Germany | 86.1171 | Cut the tip just before sucking mouse heart into the pipette. |
| Polyvinylidene difluoride (PVDF) membrane | Merck-Millipore, USA | IPVH00010 | Immobilin-P membrane (Transfer membrane for protein blotting) |
| Protease | Sigma-Aldrich, USA | P5147 | A mixture of three or more proteases including extracellular serine protease. |
| 4X Sample buffer solution | Fuji Film, Japan | 198-13282 | Contains 0.25 M Tris-HCl (pH 6.8), 8 w/v% SDS,40 w/v% Glyceroland 0.02 w/v% BPB |
| SDS polyacrylamide gel (15%) | Fuji Film, Japan | 193-14991 | |
| Streptomycin sulfate | Nacalai Tesque, Japan | 32237-14 | |
| 10X Tris-Glycine buffer solution (10X TG) | Nacalai Tesque, Japan | 09422-81 | Contains 0.25 M-Tris and 1.92 M-Glycine, (pH 8.3) |
| Trypsin | Sigma-Aldrich, USA | T8003 | Trypsin from bovine Type 1. |
| Vascular clamp | Karl Hammacher GmbH, Germany | HSE 004-35 | Small straight vascular clamp used for clamping aorta. |
| All other reagents | Nacalai Tesque, Japan |
References
- Langendorff, O. Untersuchungen am überlebenden Säugethierherzen. Pflügers Archiv: European Journal of Physiology. 61, 291-332 (1898).
- Berry, M. N., Friend, D. S., Scheuer, J. Morphology and metabolism of intact muscle cells isolated from adult rat heart. Circulation Research. 26 (6), 679-687 (1970).
- Powell, T., Terrar, D. A., Twist, V. W. Electrical properties of individual cells isolated from adult rat ventricular myocardium. Journal of Physiology. 302, 131-153 (1980).
- Joshi-Mukherjee, R., et al. Structural and functional plasticity in long-term cultures of adult ventricular myocytes. Journal of Molecular and Cellular Cardiology. 65, 76-87 (2013).
- Benndorf, K., Boldt, W., Nilius, B. Sodium current in single myocardial mouse cells. Pflügers Archiv: European Journal of Physiology. 404 (2), 190-196 (1985).
- Zhou, Y. Y., et al. Culture and adenoviral infection of adult mouse cardiac myocytes: methods for cellular genetic physiology. American Journal of Physiology-Heart and Circulatory Physiology. 279 (1), 429-436 (2000).
- Shioya, T. A simple technique for isolating healthy heart cells from mouse models. Journal of Physiological Sciences. 57 (6), 327-335 (2007).
- Fiset, C., Clark, R. B., Larsen, T. S., Giles, W. R. A rapidly activating sustained K+ current modulates repolarization and excitation-contraction coupling in adult mouse ventricle. Journal of Physiology. 504, Pt 3 557-563 (1997).
- Ackers-Johnson, M., et al. A Simplified, Langendorff-Free Method for Concomitant Isolation of Viable Cardiac Myocytes and Nonmyocytes From the Adult Mouse Heart. Circulation Research. 119 (8), 909-920 (2016).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal to aged mice. Physiological Reports. 6 (9), 13688(2018).
- Sambrano, G. R., et al. Navigating the signalling network in mouse cardiac myocytes. Nature. 420 (6916), 712-714 (2002).
- Limana, F., et al. bcl-2 overexpression promotes myocyte proliferation. Proceedings of the National Academy of Sciences of the United States of America. 99 (9), 6257-6262 (2002).
- Santiago, J. J., et al. Cardiac fibroblast to myofibroblast differentiation in vivo and in vitro: expression of focal adhesion components in neonatal and adult rat ventricular myofibroblasts. Developmental Dynamics. 239 (6), 1573-1584 (2010).
- Chistiakov, D. A., Orekhov, A. N., Bobryshev, Y. V. The role of cardiac fibroblasts in post-myocardial heart tissue repair. Experimental and Molecular Pathology. 101 (2), 231-240 (2016).
- Omatsu-Kanbe, M., Matsuura, H. A novel type of self-beating cardiomyocytes in adult mouse ventricles. Biochemical and Biophysical Research Communications. 381 (3), 361-366 (2009).
- Shan, D., Marchase, R. B., Chatham, J. C. Overexpression of TRPC3 increases apoptosis but not necrosis in response to ischemia-reperfusion in adult mouse cardiomyocytes. American Journal of Physiology. 294 (3), 833-841 (2008).
- Nakamura, H., et al. Presence and functional role of the rapidly activating delayed rectifier K(+) current in left and right atria of adult mice. European Journal of Pharmacology. 649 (1-3), 14-22 (2010).
- Milgroom, A., Ralston, E. Clearing skeletal muscle with CLARITY for light microscopy imaging. Cell Biology International. 40 (4), 478-483 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved