Method Article
Un metodo di perfusione antegrada per l'isolamento dei cardiomiociti dai topi
In questo articolo
Riepilogo
Abbiamo sviluppato un metodo semplicie per isolare le singole cellule cardiache del topo di alta qualità con la tecnica della perfusione antegrada. Questo metodo è privo di Langendorff e utile per isolare miociti ventricolari e atriali o cellule interstiziali, come fibroblasti cardiaci o progenitori.
Abstract
Nella ricerca di base che utilizza il cuore del topo, isolare i cardiomiociti individuali vitali è un passo tecnico cruciale da superare. Tradizionalmente, l'isolamento dei cardiomiociti da conigli, porcellini d'India o ratti è stato eseguito tramite perfusione retrograda del cuore con enzimi utilizzando un apparato di Langendorff. Tuttavia, è necessario un alto grado di abilità quando questo metodo viene utilizzato con un piccolo cuore di topo. Un metodo di perfusione pregrada che non utilizza un apparato di Langendorff è stato recentemente segnalato per l'isolamento dei cardiomiociti del topo. Nel presente documento viene indato un protocollo completo per una migliore perfusione antegrada del cuore asportato per isolare le singole cellule cardiache dai topi adulti (8 - 108 settimane). La perfusione antegrada viene eseguita iniettando perfusato vicino all'apice del ventricolo sinistro del cuore asportato, la cui aorta è stata bloccata, utilizzando una pompa per infusione. Tutte le procedure vengono eseguite su un tappetino riscaldante preri riscaldato al microscopio, che consente di monitorare i processi di iniezione e perfusione. I risultati suggeriscono che i miociti ventricolari e atriali e i fibroblasti possono essere ben isolati contemporaneamente da un singolo topo adulto.
Introduzione
Generalmente, il primo passo dell'isolamento a singola cellula del tessuto sezionato comporta la macinata del tessuto in piccoli pezzi, seguita dalla digestione del tessuto connettivo e dalla matrice extracellulare con enzimi. Tuttavia, i cardiomiociti non possono essere isolati con un tale metodo di taglio, poiché l'arricchimento con componenti della matrice extracellulare, comprese le fibre di collagene ed elastina, rende il miocardio troppo resistente alla tritacanza e i cardiomiociti sono altamente sensibili all'ipossia e ad altri cambiamenti nel microambiente. Pertanto, utilizzando il sistema di perfusione retrograda a base di Langendorff1, è stato sviluppato un metodo per digerire la matrice extracellulare con enzimi per isolare i singoli cardiomiociti dal cuore2,3,4.
Nei modelli di topo, la perfusione retrograda del cuore a base di Langendorff con enzimi viene utilizzata anche per l'isolamento dei singoli cardiomiociti5,6,7,8. Tuttavia, la cannulazione dell'aorta del topo piccola e sottile e il suo montaggio sull'apparato di Langendorff per eseguire la perfusione retrograda richiedono un alto grado di abilità, poiché il diametro dell'aorta nel cuore adulto è di circa 1,2 mm. Inoltre, ci vuole tempo per eseguire più esperimenti poiché l'apparato di Langendorff deve essere pulito prima di perfondere il cuore successivo.
In alternativa alla perfusione retrograda, è stato sviluppato un nuovo metodo per isolare i cardiomiociti da un cuore adulto di topo senza un apparato di Langendorff. Questo metodo epocale si basava sulla perfusione antegrada delle arterie coronarie9. Recentemente abbiamo migliorato ogni fase di questo protocollo antegrado, come il bloccaggio dell'aorta, l'inserimento dell'ago e il controllo della temperatura, e monitorato tutte le procedure di perfusione con unmicroscopio 10. Nel presente documento viene fornito un dettaglio del perfezionamento di questo metodo di perfusione antegrada per ridurre i tempi di isolamento e fornire un video supplementare. In questo metodo, la perfusione del cuore richiede circa 7 minuti con 10 mL degli enzimi e questo breve periodo di digestione aumenta la vitalità delle cellule. Questo è un metodo semplice per isolare le cellule monocuore ad alta qualità senza richiedere l'aggiunta di sostanze chimiche, come 2,3-butanedione monoxime (BDM)6,11 o taurina5,8. Crediamo che questo metodo alimenterà la soglia di abilità della tecnica e migliorerà l'utilità dei cardiomiociti del topo nella ricerca di base.
Protocollo
Tutti gli esperimenti sugli animali sono conformi alla Guida per la cura e l'uso degli animali da laboratorio pubblicata dal National Institutes of Health degli Stati Uniti (pubblicazione n. 85-23 del NIH, rivista nel 1996) e sono stati approvati dall'institutional Review Board della Shiga University of Medical Science Animal Care and Use Committee (approvato n. 2019-3-7). I metodi sono stati eseguiti secondo linee guida approvate.
1. Strumenti e soluzione
NOTA: Una descrizione della procedura sperimentale è illustrata in un diagramma di flusso(figura complementare 1). Una pompa per infusione (o pompa per siringhe) deve essere utilizzata per la perfusione antegrada del cuore con un flusso uni-way. Non è consigliabile una pompa peristaltica che crei un flusso pulsante.
- Prima della fase sperimentale
- Contrassegnare l'ago di iniezione in un sito a circa 3 mm dalla punta con smalto per unghie. Dopo avergli permesso l'aria asciutta, conservarla nel contenitore a temperatura ambiente. Un colore rosso o brillante è desiderabile per confermare la profondità di inserimento nel miocardio durante la perfusione.
- Fai stare il cuore tagliando i coperchi da tubi campione da 1,5, 0,5 e 0,2 ml e attaccando i coperchi sul fondo di un piatto di coltura da 60 mm con nastro o adesivo a doppia parte. La fissazione di tre coperchi di dimensioni diverse in un piatto consente di scegliere quello appropriato in base alle dimensioni del cuore del topo. Questo supporto cardiaco può essere riutilizzato dopo il lavaggio.
- Creare una soluzione stock come illustrato nella tabella 1. Conservare le soluzioni stock a 4 °C.
- Il giorno dell'esperimento
NOTA: Il tampone di isolamento cellulare (CIB) contiene (in mM) 130 NaCl, 5,4 KCl, 0,5 MgCl2, 0,33 NaH2PO4,22 glucosio, 40 unità/mL di insulina e 25 HEPES (pH regolato a 7,4 con NaOH); e la soluzione di tirodo contiene (in mM) 140 NaCl, 5,4 KCl, 1,8 CaCl2, 0,5 MgCl2, 0,33 NaH2PO4, 5,5 glucosio e 5,0 HEPES (pH regolato a 7,4 con NaOH).- Preparare il CIB. Riscaldare 160 mL di acqua distillata (DW) utilizzando un forno a microonde a circa 32 °C e quindi aggiungere 20 mL di CIB 10X. Dopo l'aggiunta di 0,79 g di glucosio e 10 μL di soluzione di insulina, regolare il pH utilizzando 1 M NaOH e portare a 200 mL con DW.
- Preparare la soluzione di mix enzimatico (mix enzimatico). Aggiungere 30 mg di collagenasi, 1,8 mg di tripside, 1,8 mg di proteasi e 90 μL di soluzione stock cacl2 da 100 mM a 30 mL di CIB (la concentrazione finale di Ca2 + è di 0,3 mM), mescolare e tenerlo sul ghiaccio. Nei topi <4 settimane, ridurre la tripside e la proteasi a 0,9 mg10. Riscaldare a 37 °C in un bagno d'acqua prima dell'uso.
- Preparare la soluzione CIB-Ca2+-BSA. Aggiungere 30 mg di BSA e 90 μL di soluzione di 100 mM CaCl2 a 15 mL di CIB (la concentrazione finale di Ca2+ è di 1,2 mM), mescolare, filtrare attraverso un filtro da 20 μm e tenerlo sul ghiaccio.
- Preparare la soluzione CIB-EGTA. Dopo aver fatto le soluzioni descritte nei passaggi 1.2.2 e 1.2.3, aggiungere 400 mM EGTA stock solution al CIB rimanente a una diluizione 1:1000 (la concentrazione finale di EGTA è di 0,4 mM) e mescolare. Riempi il piatto da coltura da 35 mm e il piatto del supporto per il cuore con CIB-EGTA e tienili sul ghiaccio.
- Versare circa 20 mL di CIB-EGTA in un bicchiere da 30 mL e tenere una pipetta di trasferimento in plastica nel becher, mantenendola sul ghiaccio.
- Preparare la soluzione Tyrode. Aggiungere 100 mL di tirolo 10X a 800 mL di DW e scaldarlo utilizzando un forno a microonde a circa 32 °C. Dopo aver aggiunto 0,99 g di glucosio e 1,8 mL di 1 M CaCl 2 ,regolareil pH utilizzando 1 M NaOH e portare a 1000 mL con DW.
- Preparare la soluzione di resospensione cellulare. Aggiungere 30 mg di BSA e 300 μL di antibiotici 50X a 15 mL di soluzione di tiroide.
- Preparare le siringhe. Riempire la siringa da 20 ml collegata al tubo di estensione flessibile e all'ago di iniezione marcato con CIB-EGTA. Riempire la siringa da 30 ml con la miscela enzimatica riscaldata. Tienili entrambi a 37 °C fino a poco prima dell'uso.
- Preparare la piastra perfusione. Prewarm il tappetino riscaldatore al microscopio stereoscopico. Posizionare la piastra di perfusione (coperchio di una piastra di coltura multi-pozzo) sul tappetino riscaldante prebellico. Prewarm il morsetto vascolare posizionandolo nella piastra di perfusione fino all'uso. Posizionare il piatto di coltura da 60 mm per la pipettazione e il filtro celle anche sul tappetino riscaldatore prebellico.
2. Perfusione antegrada del cuore del topo
NOTA: La pipetta di trasferimento in plastica utilizzata per succhiare il cuore deve essere morbida e non essere saldamente affusolata verso la punta. Scegli un piccolo morsetto vascolare con seghettamento. Gli strumenti consigliati sono elencati nella tabella dei materiali.
- Escissione del cuore del topo e bloccaggio dell'aorta
NOTA: I topi adulti (>8 settimane) devono essere eutanasiati da un sovradosaggio di pentobarbitale di sodio (>300 mg/kg, iniezione intraperitoneale [i.p.] con eparina (8000 unità/kg).- Asportare rapidamente il cuore del topo succhiando.
- Aprire rapidamente la cavità toracica per esporre il cuore. Tagliare la pipetta di trasferimento in plastica, la cui punta ha approssimativamente le stesse dimensioni o leggermente più piccola del cuore esposto (di solito in un sito a circa 1 cm dal segno di 0,5 mL verso la punta, ma dipende dalle dimensioni del cuore).
- Succhiare il cuore nella pipetta, sollevare la pipetta per creare spazio sufficiente per inserire le forbici e asportare il cuore con forbici curve dal lato dorsale, evitando di danneggiare gli atri.
- Trasferire immediatamente il cuore asportato al bicchiere da 30 mL contenente CIB-EGTA refrigerato con ghiaccio per fermare la contrazione. Questa procedura di solito richiede <1 min.
- Pulizia intorno all'aorta
- Trasferire il cuore in un piatto di coltura da 35 mm riempito con CIB-EGTA raffreddato dal ghiaccio e rimuovere il polmone e altri tessuti visibili, quindi trasferire il cuore approssimativamente pulito al supporto cardiaco pieno di CIB-EGTA refrigerato e posizionarlo con l'apice verso il basso.
- Al microscopio stereoscopico, rimuovere il grasso e i tessuti connettivi per pulire intorno all'aorta. Se la lunghezza dell'aorta tagliata è troppo lunga compresa l'arteria brachiocefallica, l'arteria carotide comune sinistra o l'arteria succlavia sinistra, tagliare l'aorta appena sotto l'arteria brachiocefalica per accorciarla per procedere al passo successivo. Questa procedura di solito richiede circa 4 minuti.
- Bloccaggio dell'aorta e posizionamento del cuore bloccato sulla piastra di perfusione
- Al microscopio, metti il cuore nel supporto del cuore. L'operatore deve affrontare la superficie anteriore del cuore, raccogliere l'estremità dell'aorta con una pinzetta e fissare l'aorta vicino all'atri con un piccolo morsetto vascolare mentre spinge delicatamente verso il basso sull'aorta un po '.
- Posizionare il cuore bloccato sulla piastra di perfusione con il lato anteriore verso l'alto, quindi coprirlo con alcune gocce di CIB-EGTA per evitare che si asciughi. Questa procedura di solito richiede <20 s.
- Asportare rapidamente il cuore del topo succhiando.
- Perfusione antegrada del cuore
NOTA: In primo luogo, perfondere il cuore con CIB-EGTA per scaricare il sangue e prevenire la coagulazione.- Inserire l'ago di iniezione e iniziare la perfusione per scaricare il sangue
- Impostare la siringa da 20 ml riempita con CIB-EGTA prebellico collegato al tubo di estensione flessibile e un ago di iniezione marcato sulla pompa per infusione. Avviare la pompa a una velocità lenta di 0,5 mL/min per riempire accuratamente l'ago e il tubo con CIB-EGTA e assicurarsi di impedire a qualsiasi aria di entrare nel tubo.
- Posizionare l'ago di iniezione sulla piastra di perfusione con il lato più corto della forma diagonale davanti. Far scorrere l'ago verso l'apice del cuore fino a toccarlo, quindi inserire con cura l'ago vicino all'apice del ventricolo sinistro nella camera ventricolare senza torcere. Non staccare l'ago dalla piastra durante l'esecuzione dell'inserimento.
- Guarda il segno rosso per stimare la profondità dell'inserimento dell'ago. Al termine dell'inserimento dell'ago, il sangue che scorre dall'arteria coronarica dovrebbe iniziare a essere scaricato.
- Fissare l'ago di iniezione sulla piastra con nastro adesivo e aumentare la velocità della pompa a 1 mL /min. Questa procedura di solito richiede circa 30 s. Se il cuore viene perfuso con successo, il flusso del CIB-EGTA nel capillare appena sotto l'epicardio può essere visto al microscopio.
- Perfusione del cuore con mix enzimatico
NOTA: Durante la perfusione enzimatica, la profondità dell'ago inserito può essere monitorata controllando il segno rosso sull'ago.- Dopo aver perfuso 2-3 mL di CIB-EGTA per scaricare completamente il sangue dall'arteria coronarica, cambiare il perfusato in miscela enzimatica. Evitare di consentire l'ingresso di bolle d'aria nel tubo. Controllare il flusso della miscela enzimatica e assicurarsi che l'ago di iniezione non sia uscito controllando la posizione del segno rosso.
- Dopo aver perfuso 1-2 mL, aumentare la velocità della pompa a 1,5 mL/min. Rimuovere il perfusato accumulato contenente sangue che di tanto in tanto è svanito dal cuore con una pipetta.
NOTA: Nel tempo, la parete miocardica diventerà traslucida in alcuni punti e apparirà screziata, che è un segno di digestione della matrice extracellulare dopo una perfusione riuscita. Un altro segno è il riavvio del battito atriale causato dalla presenza di Ca2+ nel mix enzimatico. - Interrompere la perfusione quando il volume totale della miscela enzimatica perfusa è di 10 mL.
- Inserire l'ago di iniezione e iniziare la perfusione per scaricare il sangue
3. Isolamento delle singole cellule cardiache
- Dissociazione delle cellule cardiache
- Dopo la perfusione con la miscela enzimatica, trasferire 10 ml della miscela enzimatica rimanente nella siringa in un piatto di coltura da 60 mm posto sul tappetino riscaldante e aggiungere 20 mg di BSA (0,2% BSA in miscela enzimatica). La polvere di BSA caduta deve dissolversi immediatamente ruotando delicatamente con una mano. Rimuovere l'ago di iniezione e il morsetto vascolare dal cuore.
- Separare i ventricoli e gli atri e trasferirli nella miscela enzimatica integrata con 0,2% di BSA sul tappetino riscaldante.
- Isolamento dei miociti ventricolari
- Afferrare l'epicardio con due pinzette e strappare delicatamente e tirare i ventricoli da un lato all'altro nella miscela enzimatica integrata con 0,2% di BSA in piccoli pezzi. Disperdere le cellule con pipettazione delicata (circa 30 volte).
- Filtrare i detriti non digeriti attraverso un filtro a celle a rete da 100 μm e trasferire il filtrato in un tubo di centrifuga da 15 ml per la centrifugazione a 50 × g per 3 min. Resopendare i cardiomiociti pellettati nella soluzione CIB-Ca2+-BSA prebellica, incubarla per 5 minuti a 37 °C, quindi centrifugarla a 14 × g per 3 min.
- Resopend l'ultimo cardiomiociti precipitato in soluzione di resuspensione cellulare (la composizione è elencata nella tabella 2) e tenerlo a 37 °C.
- Isolamento dei miociti atriali
- Durante la centrifugazione finale per la frazione ventricolare del miocita nel passaggio 3.2, iniziare a isolare i miociti atriali. Trasferire gli atri, conservati come nel passaggio 3.1, nella soluzione CIB-Ca2+-BSA prebellita, strapparli a pezzi e dissociare le cellule tubazioni con punta di pipetta a 10 μL sul tappetino riscaldante.
- Centrifugare la miscela cellulare a 14 × g per 3 minuti e rimorsi le cellule atriali pelletate con soluzione di resuspensione cellulare.
- Isolamento e coltura dei fibroblasti cardiaci
- Trasferire il supernatante dalla prima centrifugazione nella fase 3.2 ad un altro tubo di centrifuga da 15 mL e centrifugare a 190 × g per 5 min. Lavare le cellule precipitate due volte con centrifugazione nel Modified Eagle Medium (DMEM) di Dulbecco, quindi sospendere le cellule con DMEM integrato con albumina bovina fetale al 10% (FBS) e antibiotici.
- Placcare la frazione cellulare finale in un pallone da coltura (25 cm2) e consentire alle cellule di aderire al fondo del pallone in un'atmosfera umidificata del 95% di aria e del 5% di CO2. Dopo 90 minuti di incubazione, scartare le cellule non attaccate e aggiungere un mezzo di coltura fresco. Le cellule dovrebbero quasi confluenza dopo circa 4 giorni, a quel punto dovrebbero essere amplificate dalla trippsinizzazione e sementi in nuovi piatti di coltura.
4. Raccolta di proteine da atri e ventricoli
- Dopo la perfusione, separare gli atri e i ventricoli e omogeneizzarli in tampone di lisi ad un rapporto di 10 mg di peso tissutale a 100 μL di tampone utilizzando un piccolo macinino in un tubo campione da 1,5 ml.
- Mantenere l'omogeneato nel ghiaccio per 40 minuti con la miscelazione del vortice ogni 10 minuti per estrarre le proteine, quindi centrifugare il tubo a 15000 × g per 20 minuti a 4 °C. Conservare la frazione supernatante a -80 °C come campione proteico.
5. Immunostaining di cellule cardiache isolate
NOTA: È necessaria l'immobilizzazione dei cardiomiociti non aderenti sul fondo del piatto di imaging cellulare utilizzando colla biologica.
- Adesione di cardiomiociti isolati a un piatto di coltura con fondo di vetro
- Prima di iniziare l'isolamento cellulare, rivestire il piatto di coltura con fondo di vetro con colla biologica (ad esempio Cell-Tak) secondo le istruzioni del produttore, risciacquare con DW e asciugare all'aria a temperatura ambiente.
- Dopo la risospensione dei cardiomiociti isolati nella soluzione CIB-Ca2+-BSA, lasciare cadere la sospensione cellulare sul fondo dei piatti rivestiti di colla e incubare per 20 minuti a temperatura ambiente senza agitazione.
- Immunostaining
- Placcare i cardiomiociti isolati su un piatto con fondo di vetro prerivestito con colla biologica e tenerlo a temperatura ambiente per 40 minuti per consentire alle cellule di aderire al piatto. Coltura fibroblasti cardiaci in piatti di coltura bottom-glass.
- Risciacquare le cellule con saline tamponate da fosfati (PBS) e fissarle con paraformaldeide al 4% (PFA) per 5 minuti con scuotimento. Lavare le celle fisse con PBS per 10 min tre volte e incubarle in soluzione di blocco-permeabilizzazione per 60 minuti a temperatura ambiente con scuotimento.
- Cellule sonda con anticorpo primario diluito in soluzione bloccante-permeabilizzazione per 60 min a temperatura ambiente o durante la notte a 4 °C. Lavare le cellule con PBS per 10 minuti tre volte e incubare quindi con anticorpi secondari etichettati a fluorescenza per 60 minuti a temperatura ambiente.
- Dopo averli laviati tre volte con PBS per 10 minuti, macchiare i nuclei con DAPI (diluizione 1:10000 in PBS). Analizzare i segnali fluorescenti utilizzando un microscopio a scansione laser confocale.
6. Registrazioni di morsetti patch interi
- Fabbricare gli elettrodi patch da un capillare di vetro utilizzando un estrattore di microelettrodi orizzontali. La resistenza dell'elettrodo variava da 2 a 4 MΩ se riempita con unasoluzione dipipetta ricca di K +(Tabella 2). Trasferire un'aliquota di cardiomiociti isolati in una camera di registrazione montata sul palco di un microscopio invertito sovrafuso con tiroide ad una velocità di 1 mL/min a 36-37 °C.
- Registrare i potenziali di azione utilizzando il metodo patch-clamp perforato consoluzionedi pipetta ricca di K + contenente 30 mg/mL di ampotericina B applicando impulsi di corrente di durata di 5-10 ms ad una velocità di 1 Hz tramite l'elettrodo patch.
7. Analisi western blot
- In questo studio, eseguire un'analisi western blot di proteine di piccolo peso molecolare, come il peptide natriuretico atriale marcatore atriale (ANP).
- Sciogliere il campione proteico nella concentrazione finale di 1X Tampone campione, 2% 2' di mercaptoetanolo e denaturare le proteine per 60 min a 37 °C. Caricare 20 μg di proteine in ogni pozzo ed eseguire l'elettroforesi nel tampone di corsa con 20 mA per gel per 120 min.
- Trasferire la proteina in una membrana PVDF in tampone di trasferimento a 10 V per 40 min. Lavare la membrana trasferita due volte con TBST per 5 minuti, quindi bloccare con il 5 % di latte scremato in TBST per 60 minuti a temperatura ambiente e sondare con l'anticorpo primario sciolto in TBST durante la notte a 4 °C.
- Lavare la membrana 5 volte con TBST per 7 minuti e incubarla con l'anticorpo secondario diluito in TBST per 120 minuti a temperatura ambiente.
- Dopo aver lavato la membrana 5 volte con TBST per 7 minuti, visualizzare i segnali con un saggio di chemi-luminescenza e analizzarli con un analizzatore di lumino-immagine.
Risultati
Il principio di questo metodo è semplice: il perfusato scorre dalla camera sinistra, la valvola aortica viene aperta e il perfusato corre nell'arteria coronarica nella stessa direzione della corsa sanguigna, poiché l'aorta viene chiusa bloccando, il che consente la perfusione profonda del miocardio al fine di digerire la matrice extracellulare.
I miociti ventricolari appena isolati con il metodo attuale sono riportati nella figura 1A. La figura 1B mostra immagini ingrandite dei miociti ventricolari e atriali. Questa procedura di isolamento ha portato a un high yield (70%-80%) di miociti ventricolari quiescenti a forma di bastone provenienti da topi adulti (8-10 settimane), disponibili entro circa 5 ore dall'isolamento(Figura 1C),un intervallo simile a quello utilizzato quando si utilizza la tradizionale procedura basata su Langendorff7. Tuttavia, il rapporto tra cellule vitali appena isolate era inferiore nei topi invecchiati di >2 anni (Figura 1C). Il numero totale di miociti ventricolari ottenuti per cuore adulto utilizzando questo protocollo era di circa 3 x 106 cellule, che era simile al valore precedentementeriportato 7,12. I potenziali d'azione registrati nei miociti ventricolari e atriali(figura 1D)erano simili a quelli delle cellule ottenute con il metodo10basato su Langendorff. Un'analisi immunostaining ha confermato che la struttura sarcomerica dei miociti ventricolari era ben organizzata con una membrana cellulare chiaramente visibile (Figura 2A). I singoli cardiomiociti isolati con questo metodo possono essere utilizzati direttamente in esperimenti, come un'analisi elettrofisiologia10 o un esperimento di immunosociezione.
I fibroblasti cardiaci esistono negli spazi interstiziali. Una digestione sufficiente della matrice extracellulare comporta l'isolamento di tali cellule. I fibroblasti cardiaci isolati proliferano in condizioni di coltura e possono essere passaggi più volte o conservati in azoto liquido in un'appropriata soluzione di serbatoio cellulare. La figura 2B mostra che la maggior parte dei fibroblasti cardiaci coltivati si è trasformata in miofibroblasti durante la sottocultura, come confermato dall'aumento dell'espressione di un atto muscolare α liscio13,14. Inoltre, i progenitori cardiaci possono essere isolati con il metodo attuale e coltivati in un mezzo di coltura appropriato, che iniziano a battereautomaticamente 10,15.
L'omogeneizzazione del robusto miocardio non è facile, specialmente per il tessuto cardiaco proveniente da topi invecchiati, che possiede una grande quantità di fibre extracellulari. Dopo la perfusione pregrada, le proteine degli atri e dei ventricoli possono essere facilmente omogeneizzate nel tampone di lysis con forza leggera per estrarre le proteine. Un'analisi western blot ha dimostrato l'espressione specifica dell'ANP negli atri ma non nei ventricoli di topi adulti (20 settimane) e anziani (108 settimane)(figura 3).
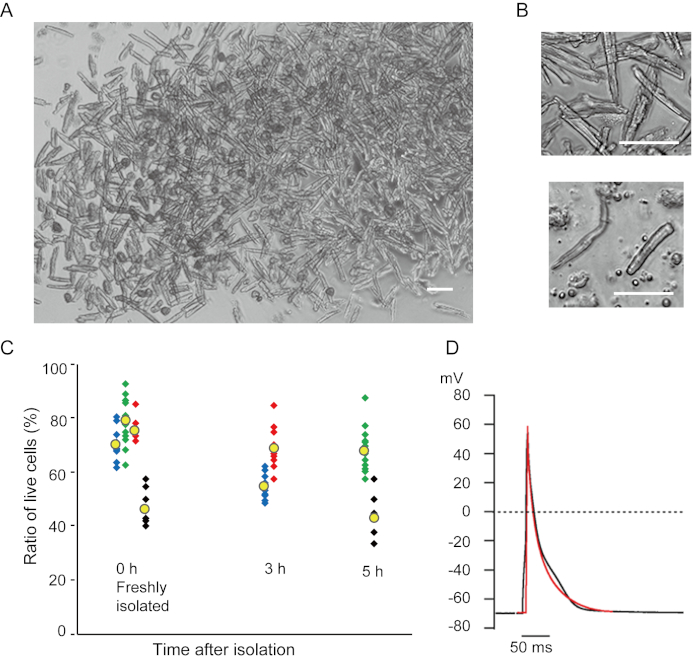
Figura 1. Cardiomiociti isolati dai topi. A. Miociti ventricolari appena isolati con la perfusione pregrada, con immagini acquisite a basso ingrandimento. Dopo il lavaggio finale, i cardiomiociti sono stati risosopensi con 2 mL di soluzione di risospensione cellulare, 100 μL dei quali sono stati lasciati cadere sul piatto di coltura con fondo di vetro e l'insediamento cellulare atteso. Bar, 100 μm.B. Immagini ingrandite di miociti ventricolari isolati (superiore) e miociti atriali (inferiore). Le cellule isolate.C sono state sospese nella soluzione di resospensione cellulare e conservate a 37°C per il periodo desiderato, e il numero di miociti ventricolari vivi è stato conteggiato in 10-15 campi al microscopio. Si ritiene che le cellule arrotondate siano state ferite o morte in modoirreversibile 16. Simboli verdi, blu e rossi sono stati ottenuti da 3 topi a 8-10 settimane e i simboli neri erano di 106 settimane di topo. Il simbolo giallo indica la media di ogni gruppo. D. Potenziali d'azione rappresentativi registrati da miociti ventricolari (neri) e atriali (rossi) di 8-10 topi. I dati sono stati ottenuti dalle cellule circa 3 ore dopo l'isolamento. Clicca qui per visualizzare una versione più grande di questa figura.
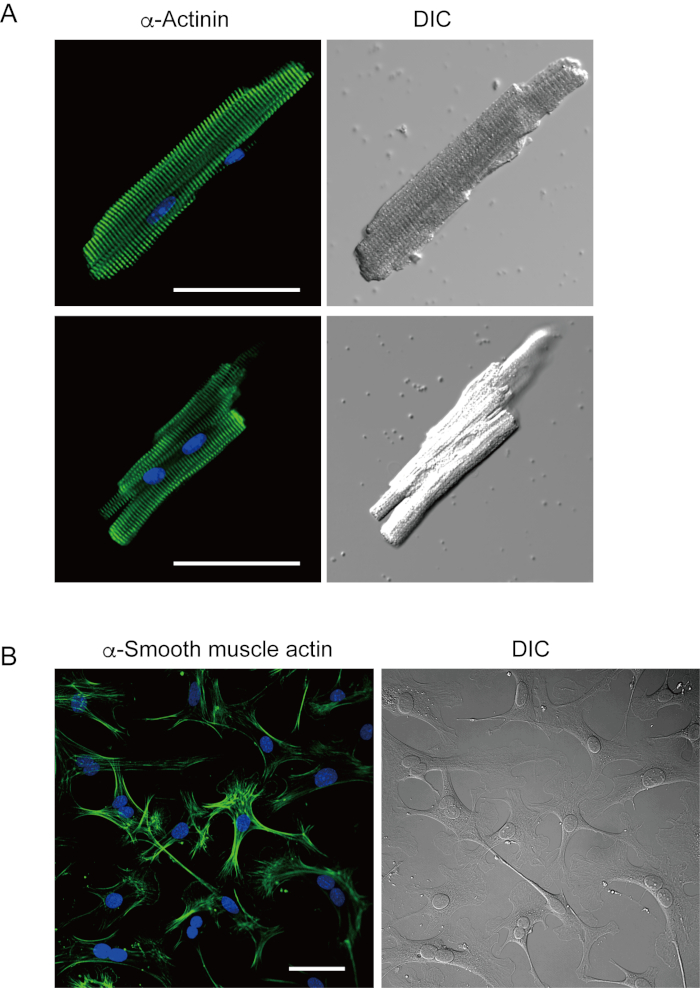
Figura 2. Immunostaining per α-actina in miociti ventricolari del topo isolati e actina muscolare α liscia nei fibroblasti cardiaci del topo coltivati. A. Microscopia a scansione laser confocale di immunostaining per α-actina (verde), colorazione DAPI per nuclei (blu) e un'immagine DIC di miociti ventricolari isolati dal cuore del topo con perfusione pregrada. Bar, 50 μm.B. Immunostaining per actina muscolare α liscia (verde), colorazione DAPI per nuclei (blu) e un'immagine DIC di fibroblasti cardiaci isolati dal cuore del topo con perfusione antegrada. I fibroblasti cardiaci sono stati coltivati per quattro giorni. Bar, 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
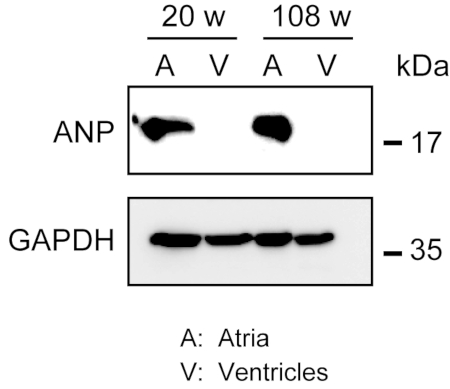
Figura 3. Analisi western dell'ANP negli atri e nei ventricoli. Analisi western blot per il peptide natriuretico atriale marcatore atriale (ANP) in atri (A) e ventricoli (V) preparati da cuori adulti (20 settimane) e invecchiati (108 settimane). L'ANP è presente negli atri ma assente nei ventricoli. Utilizzare la gliceraldeide 3-fosfato deidrogenasi (GAPDH) come proteina di controllo. Clicca qui per visualizzare una versione più grande di questa figura.
| Soluzioni stock per l'isolamento delle cellule cardiache | |
| 10X CIB (500 mL) | |
| NaCl | 37,99 g |
| Kci | 2,01 g |
| 1 M MgCl2 | 2,5 mL |
| NaH2PO4 | 0,23 g |
| HEPES | 29,79 g |
| Dw | Riempire fino a 500 mL |
| 100 mM CaCl2 stock soution | |
| CaCl2 | 100 mM |
| Soluzione stock EGTA da 400 mM | |
| EGTA | 400 mM |
| Soluzione di insulina | |
| insulina | 1 unità/mL in 0,1 M HCl |
| 50X Soluzione stock di antibiotici (20 mL) | |
| penicillina | 100 mg |
| streptomicina | 100 mg |
| Rosso fenolo | 1,5 g |
| Dw | 20 mL e sterilizzare con filtraggio |
| Soluzione di tirolo 10X (1000 mL) | |
| NaCl | 81,82 g |
| Kcl | 4,03 g |
| 1 M MgCl2 | 5 mL |
| NaH2PO4 | 0,47 g |
| HEPES | 11,92 g |
| Naoh | 0,8 g |
| Dw | Riempire fino a 1000 mL |
| Solutina stock per immunostaining | |
| Azioni DAPI | |
| DAPI | 2 mg/mL in metanolo |
| Soluzioni stock per western blots | |
| Tampone HEPES (100 mL) | |
| NaCl | 0,88 g |
| 400 mM EGTA | 0,25 mL |
| HEPES | 0,24 g |
| 1M NaoH | regolare il pH a 7,4 |
| Dw | Riempire fino a 500 mL |
| Cocktail di inibitori della proteasi | |
| Mini completa | 1 compressa |
| Dw | 0,4 mL |
La tabella 1. Descrizione delle soluzioni stock. Mantenere le soluzioni stock a 4 °C. Cocktail di inibitori della proteasi aliquota per la conservazione a -20 °C.
| Soluzioni per l'isoltatura delle cellule cardiache | |
| CIB (200 mL) | |
| 10X CIB | 20 mL |
| Soluzione di insulina | 0,01 mL |
| glucosio | 0,79 g |
| 1M NaoH | pH regolato a 7,4 |
| Dw | Riempire fino a 200 mL |
| Soluzione enzimatica-miscela (30 mL) | |
| Collagenasi tipo2 | 30 mg |
| tripsina | 1,8 mg |
| proteasi | 1,8 mg |
| Soluzione stock CaCl2 da 100 mM | 0,09 mL |
| Cib | 30 mL |
| CIB-Ca2+-BSA (15 mL) | |
| Bsa | 30 mg |
| Soluzione stock CaCl2 da 100 mM | 0,18 mL |
| Cib | 15 mL |
| CIB-EGTA (150 mL) | |
| Soluzione stock EGTA da 400 mM | 0,150 mL |
| Cib | 150 mL |
| Soluzione di tiroide (1000 mL) | |
| Soluzione stock 10X Tyrode | 100 mL |
| glucosio | 0,99 g |
| 1M CaCl2 | 1,8 mL |
| 1M NaoH | pH regolato a 7,4 |
| Dw | Riempire fino a 1000 mL |
| Soluzione di resospensione cellulare (15 mL) | |
| Bsa | 30 mg |
| 50X Soluzione stock di antibiotici | 0,3 mL |
| Soluzione tiroide | 15 mL |
| Soluzioni per l'immunosocienza | |
| Soluzione aderente alle cellule (0,3 mL) | |
| Lago Cell | 0,01 mL |
| 0,1 M NaHCO3 (pH8.0) | 0,285 mL |
| 0,1 M NaoH | 0,005 mL |
| Soluzione di blocco-permeabilizatina (10 mL) | |
| Siero bovino fetale | 1 mL |
| Tritone X-100 | 1 mL |
| 10X PBS | 1 mL |
| Dw | 7 mL |
| K+ ricca soluzione di pipetta | |
| Aspartato di potassio | 70 mM |
| Kcl | 50 mM |
| KH2PO4 | 10 mM |
| MgSO4 | 1 mM |
| Sale disodico ATP | 3 mM |
| Sale di litio GTP | 0,1 mM |
| EGTA | 5 mM |
| HEPES | 5 mM |
| Koh | pH regolato a 7,2 |
| Soluzioni per macchie occidentali | |
| Tampone di lysis (1 mL) | |
| Tampone HEPES | 0,86 mL |
| Nonidet-P40 | 0,1 mL |
| Cocktail di inibitori della proteasi | 0,04 mL |
| Buffer di runnning (1000 mL) | |
| 10X TG (0,25 M Tris e 1,92 M glicina) | 100 mL |
| Sds | 1 g |
| Dw | 900 mL |
| Buffer di trasferimento (1000 mL) | |
| 10X TG | 100 mL |
| metanolo | 200 mL |
| Dw | 700 mL |
| Buffer di blotting (TBST) (1000 mL) | |
| 5M NaCl | 20 mL |
| 2M Tris-HCl (pH 7.5) | 5 mL |
| 10% Interpolazione 20 | 10 mL |
| Dw | 965 mL |
La tabella 2. Descrizione delle soluzioni di lavoro per l'isolamento delle cellule cardiache, l'immunosottenimento e l'accoppiamento occidentale. Preparare tutte le soluzioni di lavoro poco prima degli esperimenti.
Figura complementare 1. Struttura dell'isolamento della cella. Diagramma di flusso dell'isolamento dei miociti ventricolari e atriali e dei fibroblasti cardiaci da un unico cuore. Clicca qui per scaricare questa cifra.
Discussione
Poiché il cuore è altamente suscettibile all'ischemia, il tempo necessario per asportare il cuore e immergerlo nel CIB-EGTA ghiacciato per fermare la contrazione deve essere tenuto corto il più possibile (<1 min). Questo è il primo passaggio critico di questo metodo. Il secondo passo critico riguarda la direzione del cuore. Il particolare orientamento del cuore asportato nella fase 2.1.2 rende più facile vedere e rimuovere il grasso e i tessuti connettivi intorno all'aorta. Dopo aver pulito intorno all'aorta, posizionare il cuore bloccato con il lato anteriore della superficie sulla piastra di perfusione. Il passaggio critico finale prevede l'inserimento dell'ago di iniezione. Quando si avanza l'ago verso il cuore, l'ago di iniezione non deve essere staccato dalla piastra di perfusione per mantenere una distanza costante dalla piastra. La posizione dell'inserimento è vicina all'apice del ventricolo sinistro. Inserire l'ago con attenzione senza torcere, poiché tale torsione può ingrandire il foro. La profondità dell'inserimento dell'ago può essere stimata guardando il segno rosso. Se l'ago viene inserito troppo in profondità, la punta può perforare attraverso il setto ventricolare ed entrare nel ventricolo destro o attraverso la valvola mitrale ed entrare nell'atrio sinistro. Dopo aver confermato la scomparsa del sangue dall'arteria coronarica, l'ago deve essere fissato con nastro adesivo alla piastra perfusionale.
Una lunghezza dell'aorta più lunga rende difficile bloccare l'aorta nella posizione giusta. Se il morsetto è troppo distante dagli atri, il cuore può ruotare dopo infusione perfusata. Per evitare ciò, tagliare l'aorta appena sotto l'arteria brachiocefalica per accorciare l'aorta prima del bloccaggio.
Se il sangue non inizia a scaricarsi dopo la perfusione ad una velocità iniziale di 0,5 mL/min, aumentare la velocità a 1 mL/min. Se ciò non aiuta, l'ago di iniezione può essere posizionato in modo errato, ad esempio nel ventricolo destro, nel setto ventricolare o nella parete miocardica sinistra. In tal caso, rimuovere immediatamente l'ago e provare a inserirlo di nuovo vicino all'apice del ventricolo sinistro. Quando si inserisce l'ago più volte, le cellule digerite possono fuoriescono dai fori aperti. Si noti che questo di solito non influisce seriamente sull'isolamento della cella.
Gli operatori possono monitorare l'intero processo di perfusione antegrada del cuore utilizzando un microscopio stereoscopico per osservare i cambiamenti di colore e trasparenza e riavviare il battito degli atri insieme alla digestione. Un totale di 10 mL di miscela enzimatica dovrebbe essere il massimo richiesto, anche per un vecchio cuore. Nei cuori più giovani (5-7 settimane), riduciamo il volume a 9 mL, che è simile all'approccio tramite perfusione retrograda con lo stesso mix enzimatico.
Il supernatante alla centrifugazione finale contiene detriti, cellule del sangue e non miociti mentre, il pellet contiene principalmente cardiomiociti e non miociti contaminanti, come fibroblasti e cellule endoteliali. Per purificare i cardiomiociti, sono necessari più passaggi. In generale, il pellet deve essere risosopendato nel mezzo di coltura cellulare appropriato e prepiato per 2 ore a 37 °C su un piatto di coltura di cellule tissutali, quindi rimuovere delicatamente i cardiomiociti pipettando e preplating per la coltura.
La miscela enzimatica contiene una bassa concentrazione di Ca2+ (0,3 mM). Incubamo quindi cellule digerite in CIB-Ca2+-BSA (1,2 mM Ca2+)prima della resuspensione finale con la soluzione di resopensione cellulare (1,8 mM Ca2+),e il graduale aumento di Ca2+ evita di causare danni allecellule 7. Finché i cardiomiociti isolati sono intatti (cellule quiescenti senza contrazione) questa procedura di adattamento Ca2+non influisce sulla vitalità cellulare nei topi. Poiché le cellule danneggiate stanno morendo durante questa incubazione, di conseguenza otteniamo un gruppo cellulare sano. Allo stesso modo, i miociti atriali intatti isolati (cellule quiescenti senza contrazione irregolare) possono essere conservati nella stessa soluzione di risospensione cellulare. Tuttavia, i miociti atriali tendono ad essere più delicati da archiviare rispetto ai miociti ventricolari.
In laboratorio, questo metodo di isolamento ha quasi sempre successo a meno che l'inserimento dell'ago nel ventricolo sinistro non fallisca. Siamo anche riusciti a isolare le cellule dal cuore ipertrofico preparato dalla costrizione aortica trasversale chirurgica. Tuttavia, nei topi invecchiati, che spesso hanno piccoli infarti miocardi, la perfusione cessa in alcuni punti, con conseguente digestione incompleta e quindi una bassa resa (Figura 1C), simile al metodo retrogrado a base di Langendorff. In questi casi, la forma distorta del cuore può essere osservata anche all'inizio della perfusione.
Questo metodo di perfusione pregrada è utile per isolare le cellule cardiache da topi di varie età ma non animali più grandi, come conigli e porcellini d'India. Potrebbe essere possibile applicare questo metodo ai ratti neonatale o giovanile prima dello svezzamento.
Uno dei vantaggi di questo metodo di perfusione pregrada è che riduce gli ostacoli tecnici associati all'utilizzo del metodo di perfusione retrograda a base di Langendorff per i cuori di topo piccolo. Il tempo necessario per la perfusione è di circa 7 minuti con 10 mL degli enzimi, questo breve periodo di digestione aumenta la vitalità delle cellule. Inoltre, consente di eseguire la perfusione attraverso la circolazione coronarica del cuore, anche dopo che le valvole aortiche sono state digerite. L'isolamento dei miociti atriali di solito richiede una perfusione retrograda a base di Langendorff e un'ulteriore incubazione con enzimi17. Questo approccio perfusione antegrado, tuttavia, può perfondere profondamente il tessuto con l'enzima per isolare i miociti atriali.
Negli esperimenti che utilizzano più topi, l'apparato di Langendorff deve essere pulito prima di perfondere il cuore successivo. Tuttavia, nell'attuale metodo antegrado, purché il numero desiderato di set di strumenti (ad esempio, aghi per siringhe e piastre perfusionali) sia preparato in anticipo, la perfusione può essere eseguita continuamente.
Nel presente documento viene presentata la metodologia di base della perfusione antegrada del cuore del topo utilizzando le stesse soluzioni del metodo di perfusione retrograda a base di Langendorff senza sostanze chimiche aggiuntive. La composizione del perfusato può essere modificata in base allo scopo dell'esperimento, come l'uso di un detergente contenente EGTA al posto degli enzimi per fare un cuore decellularizzato18.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori ringraziano T. Yamamoto e Y. Mori per la loro assistenza negli esperimenti morfologici. Questo lavoro è stato supportato da un Grant-in-Aid for Scientific Research (C) della Japan Society for the Promotion of Science (da 18K06871 a M.O.K. e 17K08536 a H.M.).
Materiali
| Name | Company | Catalog Number | Comments |
| Amphotericin B | Wako Pure Chemical Industries, Japan | ||
| Alexa Fluor 488 anti-mouse IgG antibody | Molecular Probes, USA | A11001 | Fluorescent-labeled secondary antibody. (1:400 dilution for immunostaining) |
| Anti-α-actinin (ACTN) | Sigma-Aldrich, USA | A7811 | Mouse monoclonal antibody (clone EA-53). (1:400 dilution for immunostaining) |
| Anti-atrial natriuretic peptide (ANP) | Merck-Millipore, USA | AB5490-I | Rabbit polyclonal antibody (1:2000 dilution for Western blots) |
| Anti-Glyceraldehyde 3-phosphate dehydrogenase (GAPDH) | Cell Signaling Technology, USA | 2118 | Mouse monoclonal antibody (1:10000 dilution for Western blots) |
| Anti-smooth muscle actin (SMA) | Dako, Denmark | M0851 | Mouse monoclonal antibody (clone 1A4) (1:400 for immunostaining) |
| Anti-rabbit IgG antibody | Amersham, GE Healthcare, USA | NA934 | Secondary antibody (1:10000 dilution for Western blots) |
| ATP disodium salt | Sigma-Aldrich, USA | A26209 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich, USA | A9418 | |
| Cell-Tak | Corning | 354240 | Biological material for adhesion of the cell or tissues |
| Chemi-Lumi One Super | Nacalai Tesque, Japan | 02230-14 | Chemiluminescent reagent used for western blotting. |
| Collagenase Type 2 | Worthington Biochemicals, USA | LS004176 | Choose the activity guaranteed to be greater than 300 unit/mg. |
| Complete Mini | Roche, Germany | 11836153001 | A mixture of several protease inhibitors. |
| 4'6'diamidino-2-phenylindole (DAPI) | Nacalai Tesque, Japan | 11034-56 | Used for cell-impermeant nuclear stainig |
| Dulbecco's Modified Eagle's Medium (DMEM) | Nacalai Tesque, Japan | 08458-45 | including 4.5 g/L gluose |
| Extension tube | Top, Japan | X1-50 | Connect with syringe and injection needle for antegrade perfusion. |
| EPC-8 patch-clamp amplifier | HEKA, Germany | ||
| Fetal bovine serum (FBS) | Sigma-Aldrich, USA | F7524-500ML | |
| Glass capillaries | Narishige Scientific Instrument Lab., Japan | outside diameter 1.5 mm, inside diameter 0.9 mm | |
| GTP lithium salt | Sigma-Aldrich, USA | G5884 | |
| Horizontal microelectrode puller | Germany) | P-97 | |
| Heater mat | Natsume Seisakusho, Japan | KN-475-3-40 | Equipment to warm the perfusion plate. |
| Infusion pump | TERUMO, Japan | TE-311 | Infusion syringe pump for antegrade perfusion. |
| Injeciton needle (27 gauge) | TERUMO, Japan | NN-2719S | Needle for insertion into the left ventricle. |
| Insulin (from bovine pancrease) | Sigma-Aldrich, USA | I5500 | Dissolve in 0.1 M HCl. |
| Mini cordless grinder | Funakoshi, Japan | cG-4A | Small grinder for homogenizing tissue in 1.5 mL sample tube. |
| 4%-Paraformaldehyde Phosphate Buffer solution (4% PFA) | Nacalai Tesque, Japan | 09154-85 | |
| Penicillin G potassium | Nacalai Tesque, Japan | 26239-84 | |
| Phenol Red | Nacalai Tesque, Japan | 26807-21 | |
| 10X Phosphate Buffered Saline (pH7.4) (10X PBS) | Nacalai Tesque, Japan | 27575-31 | |
| Plastic multi-well culture plate | Falcon, USA | 353226 | Use the lid of the multi-well culture plate as the perfusion plate. |
| Plastic syringe (20 mL) | TERUMO, Japan | SS-20ES | Use for infusion of CIB-EGTA. |
| Plastic syringe (30 mL) | TERUMO, Japan | SS-30ES | Use for infusion of Enzyme-mix |
| Plastic transfer pipette | Sarstedt, Germany | 86.1171 | Cut the tip just before sucking mouse heart into the pipette. |
| Polyvinylidene difluoride (PVDF) membrane | Merck-Millipore, USA | IPVH00010 | Immobilin-P membrane (Transfer membrane for protein blotting) |
| Protease | Sigma-Aldrich, USA | P5147 | A mixture of three or more proteases including extracellular serine protease. |
| 4X Sample buffer solution | Fuji Film, Japan | 198-13282 | Contains 0.25 M Tris-HCl (pH 6.8), 8 w/v% SDS,40 w/v% Glyceroland 0.02 w/v% BPB |
| SDS polyacrylamide gel (15%) | Fuji Film, Japan | 193-14991 | |
| Streptomycin sulfate | Nacalai Tesque, Japan | 32237-14 | |
| 10X Tris-Glycine buffer solution (10X TG) | Nacalai Tesque, Japan | 09422-81 | Contains 0.25 M-Tris and 1.92 M-Glycine, (pH 8.3) |
| Trypsin | Sigma-Aldrich, USA | T8003 | Trypsin from bovine Type 1. |
| Vascular clamp | Karl Hammacher GmbH, Germany | HSE 004-35 | Small straight vascular clamp used for clamping aorta. |
| All other reagents | Nacalai Tesque, Japan |
Riferimenti
- Langendorff, O. Untersuchungen am überlebenden Säugethierherzen. Pflügers Archiv: European Journal of Physiology. 61, 291-332 (1898).
- Berry, M. N., Friend, D. S., Scheuer, J. Morphology and metabolism of intact muscle cells isolated from adult rat heart. Circulation Research. 26 (6), 679-687 (1970).
- Powell, T., Terrar, D. A., Twist, V. W. Electrical properties of individual cells isolated from adult rat ventricular myocardium. Journal of Physiology. 302, 131-153 (1980).
- Joshi-Mukherjee, R., et al. Structural and functional plasticity in long-term cultures of adult ventricular myocytes. Journal of Molecular and Cellular Cardiology. 65, 76-87 (2013).
- Benndorf, K., Boldt, W., Nilius, B. Sodium current in single myocardial mouse cells. Pflügers Archiv: European Journal of Physiology. 404 (2), 190-196 (1985).
- Zhou, Y. Y., et al. Culture and adenoviral infection of adult mouse cardiac myocytes: methods for cellular genetic physiology. American Journal of Physiology-Heart and Circulatory Physiology. 279 (1), 429-436 (2000).
- Shioya, T. A simple technique for isolating healthy heart cells from mouse models. Journal of Physiological Sciences. 57 (6), 327-335 (2007).
- Fiset, C., Clark, R. B., Larsen, T. S., Giles, W. R. A rapidly activating sustained K+ current modulates repolarization and excitation-contraction coupling in adult mouse ventricle. Journal of Physiology. 504, Pt 3 557-563 (1997).
- Ackers-Johnson, M., et al. A Simplified, Langendorff-Free Method for Concomitant Isolation of Viable Cardiac Myocytes and Nonmyocytes From the Adult Mouse Heart. Circulation Research. 119 (8), 909-920 (2016).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal to aged mice. Physiological Reports. 6 (9), 13688(2018).
- Sambrano, G. R., et al. Navigating the signalling network in mouse cardiac myocytes. Nature. 420 (6916), 712-714 (2002).
- Limana, F., et al. bcl-2 overexpression promotes myocyte proliferation. Proceedings of the National Academy of Sciences of the United States of America. 99 (9), 6257-6262 (2002).
- Santiago, J. J., et al. Cardiac fibroblast to myofibroblast differentiation in vivo and in vitro: expression of focal adhesion components in neonatal and adult rat ventricular myofibroblasts. Developmental Dynamics. 239 (6), 1573-1584 (2010).
- Chistiakov, D. A., Orekhov, A. N., Bobryshev, Y. V. The role of cardiac fibroblasts in post-myocardial heart tissue repair. Experimental and Molecular Pathology. 101 (2), 231-240 (2016).
- Omatsu-Kanbe, M., Matsuura, H. A novel type of self-beating cardiomyocytes in adult mouse ventricles. Biochemical and Biophysical Research Communications. 381 (3), 361-366 (2009).
- Shan, D., Marchase, R. B., Chatham, J. C. Overexpression of TRPC3 increases apoptosis but not necrosis in response to ischemia-reperfusion in adult mouse cardiomyocytes. American Journal of Physiology. 294 (3), 833-841 (2008).
- Nakamura, H., et al. Presence and functional role of the rapidly activating delayed rectifier K(+) current in left and right atria of adult mice. European Journal of Pharmacology. 649 (1-3), 14-22 (2010).
- Milgroom, A., Ralston, E. Clearing skeletal muscle with CLARITY for light microscopy imaging. Cell Biology International. 40 (4), 478-483 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon