Method Article
マウスからの心筋細胞分離のための前向きの灌流法
要約
前向き灌流法により、高品質のマウスの心臓細胞を単離するためのシンプルe 法を開発しました。この方法はランゲンドルフフリーで、心室や心房筋細胞または心筋線維や前駆細胞などの間質細胞を単離するのに有用である。
要約
マウス心臓を用いた基礎研究では、実行可能な個々の心筋細胞を単離することは、克服するための重要な技術的ステップです。伝統的に、ウサギ、モルモットまたはラットから心筋細胞を単離することは、ランゲンドルフ装置を用いて酵素を用いた心臓の逆行灌流を介して行われてきた。しかし、この方法を小さなマウスの心臓で使用する場合は、高度なスキルが必要です。最近、マウス心筋細胞の単離のためにランゲンドルフ装置を使用しない前向きの灌流法が報告された。我々は、本明細書において、切除された心臓の改善された前向き灌流が成体マウスから個々の心臓細胞を単離するための完全なプロトコルを報告する(8〜108週齢)。前向きの灌流は、切除された心臓の左心室の頂点付近にパーフューズを注入することによって行われ、その大大ターをクランプし、注入ポンプを用いる。すべてのプロシージャは顕微鏡の下で事前に温めたヒーターのマットで行われるので、注入および潅流プロセスを監視することを可能にする。この結果は、心室と心房筋細胞、および線維芽細胞が単一の成体マウスから同時に十分に分離できることを示唆している。
概要
一般的に、解剖された組織の単一細胞単離の第一段階は、組織を小片に細かく刻み、続いて結合組織および酵素による細胞外マトリックスの消化を伴う。しかし、このような切り刻み方法では心筋細胞を単離できず、コラーゲンやエラスチン繊維を含む細胞外マトリックス成分を含む濃縮物として、心筋はミンチに対して強くなりすぎて、心筋細胞は低酸素症やその他の微小環境の変化に対して非常に敏感である。このように、ランゲンドルフ系逆行灌流系1を用いて、心臓2、3、4から個々の心筋細胞を単離する酵素を用いて細胞外マトリックスを消化する方法が開発されている。
マウスモデルでは、酵素を用いた心臓のランゲンドルフ系逆行灌流は、個々の心筋細胞5、6、7、8の単離にも使用される。しかしながら、ランゲンドルフ装置上での小さくて細いマウス大通りの缶詰及びその取り付けは、成体心臓の大腸の直径が約1.2mmであるため、高度な技術を必要とする。さらに、ランゲンドルフ装置は次の心臓を穿ファフューズする前に洗浄する必要がありますので、複数の実験を行うために時間がかかります。
逆行灌流の代替として、ランゲンドルフ装置を使わずに成体マウス心臓から心筋細胞を単離する新しい方法が開発された。この画期的な方法は、冠状動脈9の順次灌流に基づいていました。我々は最近、大通りのクランプ、針の挿入、および温度制御など、この順級プロトコルの各工程を改善し、顕微鏡10で全ての灌流手順を監視した。我々は、この前向き灌流法の改良を詳細に報告し、分離のための時間を短縮し、補足的なビデオを提供する。この方法では、心臓の灌流は10 mLの酵素で約7分かかり、この短い消化期間は細胞の生存率を増加させます。これは、2,3-ブタンジオンモノキシム(BDM)6、11またはタウリン5、8などの化学物質を添加することなく、高品質で単一の心臓細胞を単離するための簡単な方法である。この方法は、技術のスキル閾値を下げ、基礎研究におけるマウス心筋細胞の有用性を高めると考えています。
プロトコル
すべての動物実験は、米国国立衛生研究所(NIH出版第85-23号)が発行した実験動物のケアと使用に関するガイドに準拠し、滋賀医科学医科大学動物のケア・使用委員会の機関審査委員会(2019-3-7号)によって承認されました。方法は、承認されたガイドラインに従って行われた。
1. 計測器とソリューション
注: 実験手順の概要をフロー図(補足図1)に示します。輸液ポンプ(または注射器ポンプ)は、一方向の流れで心臓の前向きの灌流に使用する必要があります。脈動する流れを作り出す蠕動ポンプは推奨されない。
- 実験の前に
- マニキュアで先端から約3mmの部位に注射針をマークします。空気を乾燥させた後、室温で容器に入れておきます。赤または明るい色は、灌流中に心筋への挿入の深さを確認するために望ましい。
- 1.5 m-、0.5 mL、0.2mLのサンプルチューブの蓋を切り落とし、両面テープまたは接着剤で60mm培養皿の底に蓋を取り付けることで、心臓を立たせる。1つの皿の3つの異なったサイズのふたの固定はマウスの心臓の大きさに応じて適切なものを選び出すことを可能にする。この心臓スタンドは、洗濯後に再利用できます。
- 表 1に示すように、ストック ソリューションを作成します。ストックソリューションは4°Cで保管してください。
- 実験日に
注:細胞分離バッファー(CIB)には(mM)130 NaCl、5.4 KCl、0.5 MgCl 2、0.33 NaH2PO4、22グルコース、40単位/mLインスリン、25 HEPES(NaOHで7.4に調整されたpH)が含まれています。そしてタイロード溶液は(mM)140 NaCl、5.4 KCl、1.8 CaCl 2、0.5 MgCl2、0.33NaH2PO4、5.5グルコースおよび5.0 HEPES(NaOHで7.4に調整されたpH)を含む。- CIB を準備します。マイクロ波を用いて160mLの蒸留水(DW)を32°C程度に温め、20mLの10倍CIBを加えます。0.79 g のグルコースと 10 μL のインスリン溶液を添加した後、1 M NaOH を使用して pH を調整し、DW で 200 mL に持ち込みます。
- 酵素ミックス液(酵素ミックス)を準備する。コラゲナーゼ30mg、トリプシン1.8mg、プロテアーゼ1.8mg、100mMCaCl2 ストック溶液の90μLを30mLのCIB(最終的なCa2+ 濃度は0.3mM)に加え、混合し、氷の上に保ちます。生後<4週齢のマウスでは、トリプシンとプロテアーゼを0.9mg10に減らす。使用前に水浴で37°Cで温めます。
- CIB-Ca2+-BSA ソリューションを準備します。30 mg BSA と 90 μL の 100 mM CaCl2 ストック溶液を 15 mL の CIB (最終的な Ca2+ 濃度は 1.2 mM) に加え、混合し、20 μm フィルターを通してフィルターし、氷の上に保管します。
- CIB-EGTA ソリューションを準備します。ステップ1.2.2および1.2.3で説明した溶液を作った後、残りのCIBに400 mM EGTAストック溶液を1:1000希釈(最終的なEGTA濃度は0.4mM)で加え、混合します。35mmのカルチャーディッシュとハートスタンドディッシュにCIB-EGTAを入れ、氷の上に置いておきます。
- 約20mLのCIB-EGTAを30mLのガラスビーカーに注ぎ、ビーカーにプラスチックトランスファーピペットを置き、氷の上に置きます。
- タイロード溶液を準備します。DWの800 mLに10Xタイローデの100 mLを加え、マイクロ波で32°C程度に温める。 1 MCaCl2のグルコース0.99gと1.8mLを加えた後、1 M NaOHを使用してpHを調整し、DWで1000 mLに持ち込む。
- 細胞再懸濁液を準備します。15 mLのタイロード溶液に30mgのBSAと300μLの50X抗生物質を加えます。
- 注射器を準備します。フレキシブルエクステンションチューブに接続された20 mLシリンジと、CIB-EGTAでマークされた注射針を充填します。30 mL のシリンジに温めた酵素ミックスを入れる。使用直前まで37°Cで両方を保持します。
- 灌流板を準備します。立体顕微鏡下でヒーターマットを前温くします。灌流板(マルチウェル培養プレートの蓋)を、温め込んだヒーターマットの上に置きます。使用するまで、血管クランプを灌流板に入れることで、血管クランプを温め込む。ピペット用の60mm培養皿と、事前に温めたヒーターマットの上にセルストレーナーを置きます。
マウス心臓の前向きの灌流
注:心臓を吸うプラスチック製のトランスファーピペットは柔らかく、先端に向かって鋭く先細りしないでください。セレーションを持つ小さな血管クランプを選択してください。推奨される機器は、一覧の 一覧を示します。
- マウス心臓の切除と大根のクランプ
注:成虫マウス(生後8週>)は、ヘパリン(8000単位/kg)を用いたペントバルビタールナトリウム(>300mg/kg、腹腔内[i.p.]注射)の過剰摂取によって安楽死させるべきです。- 吸ってマウスの心臓を素早く物品食いする。
- 胸腔を素早く開いて心臓を露出する。プラスチック転写ピペットを切り、その先端は露出した心臓とほぼ同じ大きさ、またはわずかに小さい(通常、0.5mLマークから先端に向かって約1cmの部位で、それは心臓の大きさに依存する)。
- 心臓をピペットに吸い込み、ピペットを上げてはさみを挿入するのに十分なスペースを作り、心房を損傷しないように、後側から湾曲したはさみで心臓を切除します。
- すぐに切除された心臓を氷冷したCIB-EGTAを含む30mLガラスビーカーに移し、収縮を止める。この手順は通常<1分かかります。
- 大オルタの周りのクリーニング
- 氷冷したCIB-EGTAで満たされた35mmの培養皿に心臓を移し、肺やその他の目に見える組織を取り除き、おおよそ洗浄した心臓を冷やしたCIB-EGTAで満たされた心臓スタンドに移し、頂点を下に置きます。
- 立体顕微鏡の下で、脂肪と結合組織を取り除き、大器官の周りをきれいにします。切り傷大動脈の長さが腕頭筋動脈、左共通頸動脈または左鎖骨下動脈を含む長すぎる場合は、次のステップに進むためにそれを短くするために、腕頭動脈のすぐ下の大動脈を切断する。この手順は通常約4分かかります。
- 大オルタをクランプし、灌流板にクランプされた心臓を置く
- 顕微鏡の下で、心臓を心臓のスタンドに置きます。オペレータは心臓の前表面に向き、ピンセットで大動脈の端を拾い上げ、大動脈を少し軽く押し下げながら、心房付近の大動脈を小さな血管クランプでクランプする必要があります。
- 前部側面を上にして灌流板にクランプした心臓を置き、それを乾燥しないようにCIB-EGTAの数滴でそれをカバーする。この手順は通常、20 <を取ります。
- 吸ってマウスの心臓を素早く物品食いする。
- 心臓の前向きの灌流
注:まず、血液を排出し、凝固を防ぐためにCIB-EGTAで心臓を浸透させます。- 注射針を挿入し、血液を排出するために灌流を開始
- フレキシブルエクステンションチューブに接続されたプレウォーム付きCIB-EGTAと、注入ポンプに印の注射針を充填した20 mLシリンジをセットします。0.5 mL/minの遅い速度でポンプを開始し、針とチューブをCIB-EGTAで慎重に充填し、空気がチューブに入るのを防ぎます。
- 注入針を、斜めの形状の短い側を前にして、灌流板の上に置きます。針が心臓の頂点に向かって触れるまでスライドさせ、左心室の頂点付近の針をねじれずに心室室に慎重に挿入します。挿入を行う間は、針をプレートから取り外さない。
- 赤いマークを見て、針の挿入の深さを推定します。針の挿入が完了すると、冠状動脈から流れる血液が排出され始める。
- プレートの注入針をテープで固定し、ポンプ速度を1 mL/分に上げます。この手順は通常約 30 s です。心臓が正常に浸透すると、心気管の下のCIB-EGTAの流れが顕微鏡下で見ることができます。
- 酵素ミックスで心臓を灌流する
注:酵素灌流中、挿入された針の深さは針の赤いマークをチェックすることによって監視することができます。- 2-3 mLのCIB-EGTAを穿ファションした後、冠状動脈から血液を完全に排出し、パーフューズを酵素ミックスに変える。気泡がチューブに入らないようにしてください。酵素ミックスの流れを確認し、赤いマークの位置を確認して注射針が出ていないことを確認します。
- 1~2 mLを浸透させた後、ポンプ速度を1.5 mL/minに上げます。時々ピペットで心臓から流れ出た血液を含む蓄積された透過物を取り除きます。
注:時間が経つにつれて、心筋壁はいくつかの場所で半透明になり、まだ見えますが、これは灌流に成功した後の細胞外マトリックスの消化の兆候です。もう一つの兆候は、酵素ミックス中のCa2+ の存在によって引き起こされる心房殴打の再開である。 - 浸透した酵素ミックスの総体積が10mLである場合は、灌流を停止する。
- 注射針を挿入し、血液を排出するために灌流を開始
3. 個々の心臓細胞の分離
- 心臓細胞の解離
- 酵素ミックスを注入した後、シリンジに残った酵素ミックスの10mLをヒーターマットに置いた60mm培養皿に移し、20mgのBSA(酵素ミックス中のBSA)を加える。落とされたBSA粉末は、手でそっと旋回することによってすぐに溶解する必要があります。注射針と血管クランプを心臓から取り外します。
- 心室と心房を分離し、ヒーターマット上の0.2%BSAを補った酵素ミックスにそれぞれを移します。
- 心室筋細胞の分離
- 2つのピンセットで外心をつかみ、0.2%BSAを補った酵素ミックスで心室を左右に優しく引き裂き、小片に引っ張ります。穏やかなピペットで細胞を分散させます(約30回)。
- 100μmメッシュセルストレーナーを通して未消化の破片をろ過し、濾液を15mL遠心チューブに移し、50×gで遠心分離を3分間行います。ペレット化された心筋細胞を温め込んだCIB-Ca2+-BSA溶液で再懸濁し、37°Cで5分間インキュベートし、14×gで遠心分離して3分間培養します。
- 細胞再懸濁液中の最終的な沈殿した心筋細胞を再懸濁し(組成物を 表2に記載)、37°Cに保持する。
- 心房筋細胞の分離
- ステップ3.2における心室筋細胞画分の最終遠心分離の間に、心房筋細胞の単離を開始する。ステップ3.1のように保存されたアトリアを、温め込まれたCIB-Ca2+-BSA溶液に移し、それを粉々に裂き、ヒーターマットの10μLのピペットチップでピペットでピペット化して細胞を解離する。
- 細胞混合物を14×gで3分間遠心し、細胞再懸濁液でペレット化した心房細胞を再懸濁させた。
- 心臓線維芽細胞の分離と培養
- ステップ3.2の最初の遠心分離から別の15mL遠心管に上清を移し、遠心分離機を190×gで5分間移動します。沈殿細胞をダルベッコの変性イーグル培地(DMEM)で遠心分離で2回洗浄し、10%の胎児ウシアルブミン(FBS)と抗生物質を添加したDMEMで細胞を中断する。
- 培養フラスコ(25cm2)に最終細胞分数を入れ、細胞が95%空気と5%CO2の加湿雰囲気でフラスコの底部に付着するようにします。90分培養後、未結合の細胞を捨て、新鮮な培養培地を加える。細胞は約4日後に合流に近いはずですが、その時点でトリプシン化によって増幅され、新しい培養皿に播種されるべきです。
4. 心房と心室からのタンパク質の収穫
- 灌流後、心房と心室を分離し、1.5mLサンプルチューブ内の小さなグラインダーを使用して、10mgの組織重量と100μLの緩衝液の比でリシスバッファーで均質化します。
- ホモゲネートを40分間氷の中に入れ、10分ごとに渦を混ぜてタンパク質を抽出し、4°Cで20分間15000×gでチューブを遠心します。 上清分率を-80°Cでタンパク質サンプルとして保存します。
5. 単離した心臓細胞の免疫染色
注:生物学的接着剤を使用して細胞イメージング皿の底部に非接着心筋細胞を固定化することが必要です。
- ガラス底培養皿への分離型心筋細胞の接着
- 細胞分離を開始する前に、ガラス底培養皿に生物学的接着剤(例えば、Cell-Tak)を、メーカーの指示に従ってコーティングし、DWで洗い、室温で空気乾燥します。
- CIB-Ca2+-BSA溶液中の分離された心筋細胞の再懸濁後、接着剤コーティングされた皿の底に細胞懸濁液を落とし、攪拌することなく室温で20分間インキュベートする。
- 免疫染色
- 生物学的接着剤でコーティングされたガラス底皿に分離された心筋細胞をプレートし、細胞が皿に付着できるように40分間室温に保ちます。底ガラス培養皿における心筋線維芽細胞の培養。
- リン酸緩衝生理食塩液(PBS)で細胞をリンスし、4%パラホルムアルデヒド(PFA)で5分間揺れで固定します。固い細胞をPBSで10分間3回洗浄し、振盪で室温で60分間ブロッキングパーメアビライゼーション溶液にインキュベートします。
- 一次抗体を含むプローブ細胞は、ブロッキング透過性溶液中で、室温で60分間、または4°Cで一晩希釈した。 PBSで細胞を10分間3回洗浄し、蛍光標識二次抗体を室温で60分間インキュベートします。
- PBSで3回10分間洗浄した後、DAPIで核を染色(PBSで1:10000希釈)する。共焦点レーザー走査顕微鏡を用いて蛍光信号を解析します。
6. 全セルパッチクランプ記録
- 水平マイクロ電極プーラーを使用して、ガラスの毛細血管からパッチ電極を製造します。電極の抵抗は、K+リッチピペット溶液で充填すると2〜4MΩの範囲となった(表2)。36-37°Cで1mL/minの速度でタイロードを重ね合わされた反転顕微鏡のステージに取り付けられた記録室に単離された心筋細胞のアリコートを移す。
- パッチ電極を介して1Hzの速度で5〜10ミリ秒の電流パルスを適用することにより、30 mg/mLアンホテリシンBを含むK+-リッチピペット溶液で穿フォーリングパッチクランプ法を使用してアクション電位を記録します。
7. ウェスタンブロット分析
- 本研究では、心房マーカー心房性ニュートリウレチンペプチド(ANP)などの小分子量タンパク質のウェスタンブロット分析を行う。
- タンパク質サンプルを1Xサンプルバッファーの最終濃度、2%2'メルカプトエタノールに溶解し、37°Cで60分間タンパク質を変性させます。 各ウェルに20μgのタンパク質を積み込み、1ゲルあたり20 mAのランニングバッファで120分間電気泳動を行います。
- 10 Vで40分間、転写バッファー内のPVDF膜にタンパク質を移します。移した膜をTBSTで5分間洗浄し、室温で60分間TBSTで5%スキムミルクでブロックし、一次抗体を4°Cで一晩TBSTに溶解させたプローブを行います。
- 膜をTBSTで5回洗浄し、TBSTで120分間室温で希釈した二次抗体でインキュベートします。
- 膜をTBSTで5回洗浄した後、7分間、化学発光アッセイで信号を可視化し、ルミノ画像分析装置で分析します。
結果
この方法の原理は簡単です:左室からのパーフューザートが流れ、大動脈弁が開かれ、パーフューズ物は血液の流れと同じ方向に冠動脈に流れ込みます。
本方法で新たに単離された心室筋細胞は、図1Aに示されている。図1Bは、心室および心房筋細胞の拡大画像を示す。この分離手順は高収率(70%-80%)をもたらした成体マウス由来の棒状静止心室筋細胞(8~10週)のうち、分離後およそ5時間以内に利用可能であった(図1C)、従来のランゲンドルフ系手順7を用いた場合と同様の間隔を有する。しかしながら、新たに単離された生存細胞の割合は、>2歳の老化したマウスにおいて低かった(図1C)。このプロトコルを用いて成人心臓あたりに得られた心室筋細胞の総数は約3 x106細胞であり、これは以前に報告された値7,12と同様であった。心室および心房筋細胞に記録された作用電位(図1D)は、ランゲンドルフ系方法10によって得られた細胞内のものと類似していた。免疫染色分析により、心室筋細胞の肉体構造が、はっきりと見える細胞膜で十分に組織化されていることを確認した(図2A)。この方法で単離された個々の心筋細胞は、電気生理学的解析10や免疫染色実験などの実験で直接使用することができる。
心線維芽細胞は間質空間に存在する。細胞外マトリックスの十分な消化は、それらの細胞の単離をもたらす。分離された心臓線維芽細胞は培養条件下で増殖し、数回通過するか、適切な細胞貯留液中の液体窒素に貯蔵することができる。図2Bは、培養した心臓線維芽細胞の大部分がサブ培養中に筋線維芽細胞に変形したことを示し、α平滑筋アクチン13,14の発現増加によって確認された。また、心臓前駆物質は、本方法で単離し、適当な培養培地で培養することができ、これは自動的に10,15を拍動し始める。
特に、細胞外繊維を大量に保有する老化したマウスの心臓組織では、堅牢な心筋の均質化は容易ではない。前向きの灌流の後、心房および心室からのタンパク質は、タンパク質を抽出する軽い力で、容易にリシスバッファーで均質化することができる。ウェスタンブロット分析は、アテリアにおけるANPの特異的発現を示したが、成人(生後20週齢)および老化(108週齢)マウスからの心室では示されていない(図3)。
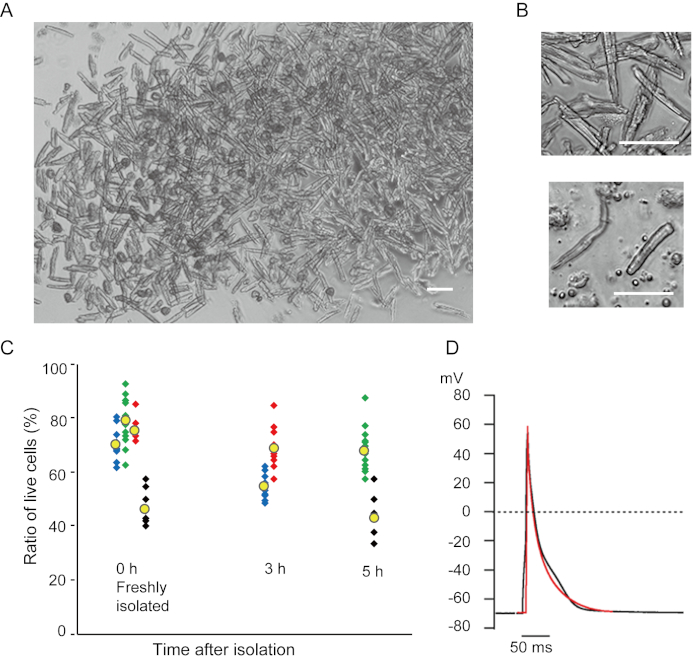
図 1.マウスから分離された心筋細胞。A. 心室筋細胞は、前向きの灌流で新たに単離され、画像は低倍率で取得した。最終洗浄後、心筋細胞を2mLの細胞再懸濁液で再懸濁し、そのうち100μLをガラス底培養皿に落とし、細胞の集落が待ち望んでいた。バー、100 μm.B.孤立した心室筋細胞(上)および心房筋細胞(下)の拡大画像。バー、100μm.C.分離細胞を細胞リサスペンション溶液に懸濁し、所望の期間37°Cで保存し、生きた心室筋細胞の数を顕微鏡下の10〜15の分野で数えた。丸みを帯びた細胞は、不可逆的に負傷したか、または死んだ16であったと考えられた。緑、青、赤のシンボルは、生後8〜10週齢の3匹のマウスから得られ、黒いシンボルは106週齢のマウスから得られた。黄色の記号は各グループの平均を示します。D. 8-10マウスの心室(黒)および心房(赤)筋細胞から記録された代表的な作用電位。データは、分離後約3時間の細胞から得た。この図の大きなバージョンを表示するには、ここをクリックしてください。
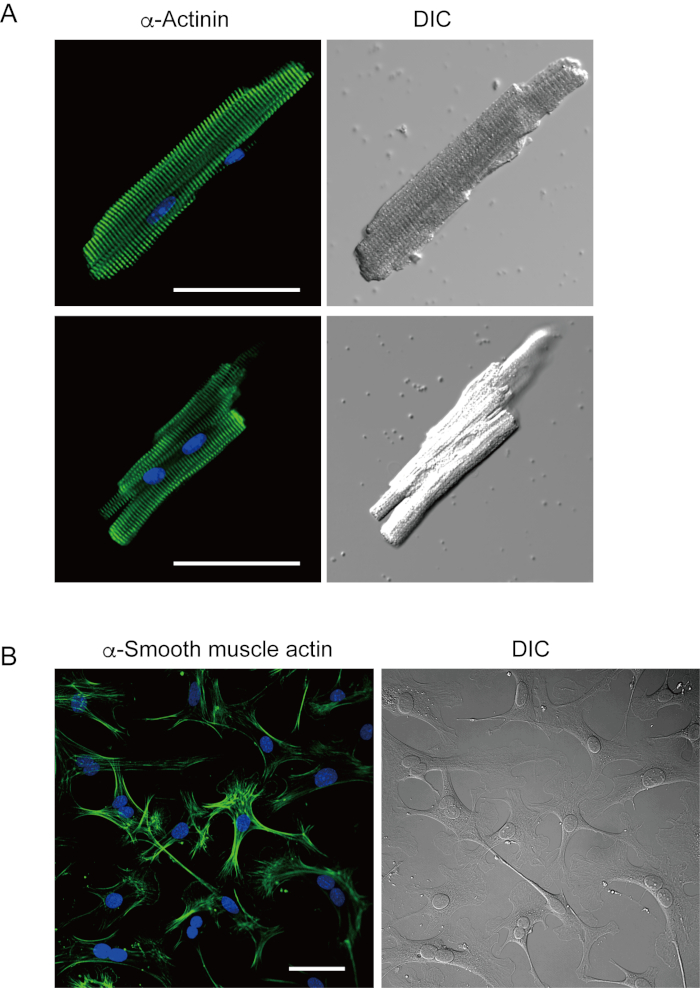
図 2.培養したマウス心筋線維芽細胞における単離マウス心室筋細胞およびα平滑筋アクチンにおけるαアクチニンの免疫染色。A. αアクチニン(緑色)の免疫染色の共焦点レーザー走査顕微鏡、核用DAPI染色(青)、前向きの灌流でマウス心臓から分離された心室筋細胞のDIC画像。Bar, 50 μm.B. α平滑筋アクチン(緑色)の免疫染色、核用DAPI染色(青)、および前向き灌流でマウス心臓から分離した心臓線維芽細胞のDIC画像。心臓線維芽細胞を4日間培養した。バー、100 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
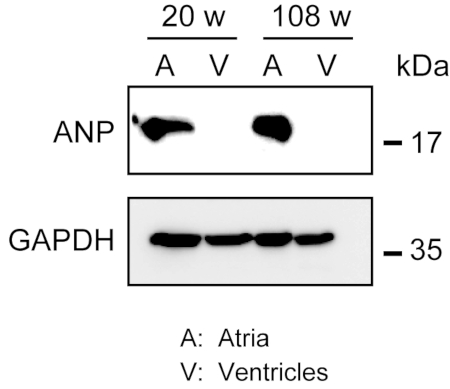
図 3.心房および心室におけるANPのウェスタンブロット分析。心房マーカー心房性性尿毒ペプチド(ANP)の心房性腺(A)および心室(V)に対するウェスタンブロット分析(20週齢)および高齢者(108週)の心臓。ANPは心房に存在するが、心室には存在しない。コントロールハウスキーピングタンパク質としてグリセアルデヒド3-リン酸デヒドロゲナーゼ(GAPDH)を使用してください。この図の大きなバージョンを表示するには、ここをクリックしてください。
| 心臓細胞を隔離するためのストックソリューション | |
| 10X CIB (500 mL) | |
| ナクル | 37.99 g |
| KCI | 2.01 g |
| 1 M MgCl2 | 2.5 mL |
| NaH2PO4 | 0.23 g |
| ヘペス | 29.79 g |
| DW | 500 mLまで満たす |
| 100 mM CaCl2 ストックサチオン | |
| CaCl2 | 100mM |
| 400 mM EGTA ストックソリューション | |
| EGTA | 400 mM |
| インスリン溶液 | |
| インスリン | 1 ユニット/mL 0.1 M HCl |
| 50X抗生物質ストック液(20 mL) | |
| ペニシリン | 100 mg |
| ストレプトマイシン | 100 mg |
| フェノールレッド | 1.5グラム |
| DW | 20 mLとフィルターで殺菌 |
| 10Xタイロード溶液(1000 mL) | |
| ナクル | 81.82 g |
| KCl | 4.03 g |
| 1 M MgCl2 | 5 mL |
| NaH2PO4 | 0.47 g |
| ヘペス | 11.92 g |
| ナオ | 0.8 g |
| DW | 1000 mLまで満たす |
| 免疫染色用のストックソルチン | |
| DAPI在庫 | |
| ダピス | メタノール中 2 mg/mL |
| ウェスタンブロット用ストックソリューション | |
| ヘペスバッファー (100 mL) | |
| ナクル | 0.88 g |
| 400 mM EGTA | 0.25 mL |
| ヘペス | 0.24 g |
| 1M NaOH | pHを7.4に調整する |
| DW | 500 mLまで満たす |
| プロテアーゼ阻害剤カクテル | |
| 完全なミニ | 1タブレット |
| DW | 0.4 mL |
表 1.ストック ソリューションの説明。ストックソリューションを4°Cに保ちます。 アリコートプロテアーゼ阻害剤は-20°Cで保存するためのカクテル。
| 心臓細胞の分離のためのソリューション | |
| CIB (200 mL) | |
| 10X CIB | 20 mL |
| インスリン溶液 | 0.01 mL |
| グルコース | 0.79 g |
| 1M NaOH | pH は 7.4 に調整 |
| DW | 200 mLまで充填 |
| 酵素混合液(30mL) | |
| コラゲナーゼタイプ2 | 30 mg |
| トリプシン | 1.8 mg |
| プロテアーゼ | 1.8 mg |
| 100 mM CaCl2 ストックソリューション | 0.09 mL |
| シビ | 30 mL |
| シブ-Ca2+-BSA (15 mL) | |
| BSA | 30 mg |
| 100 mM CaCl2 ストックソリューション | 0.18 mL |
| シビ | 15 mL |
| シブ-エグタ (150 mL) | |
| 400 mM EGTA ストックソリューション | 0.150 mL |
| シビ | 150 mL |
| タイロード溶液(1000 mL) | |
| 10Xタイローデストックソリューション | 100 mL |
| グルコース | 0.99 g |
| 1M カクル2 | 1.8 mL |
| 1M NaOH | pH は 7.4 に調整 |
| DW | 1000 mLまで満たす |
| 細胞リサスペンション溶液(15 mL) | |
| BSA | 30 mg |
| 50X抗生物質ストックソリューション | 0.3 mL |
| タイローデ溶液 | 15 mL |
| 免疫染色のためのソリューション | |
| 細胞接着溶液(0.3 mL) | |
| セルタク | 0.01 mL |
| 0.1 M NaHCO3 (pH8.0) | 0.285 mL |
| 0.1 M NaOH | 0.005 mL |
| ブロッキング-パーメアビジジン溶液(10 mL) | |
| ウシ胎児血清 | 1 mL |
| トリトンX-100 | 1 mL |
| 10X PBS | 1 mL |
| DW | 7 mL |
| K+ 豊富なピペット溶液 | |
| アスパラギン酸カリウム | 70mM |
| KCl | 50mM |
| KH2PO4 | 10mM |
| MgSO4 | 1 mM |
| ATP二ナトリウム塩 | 3 mM |
| GTPリチウム塩 | 0.1 mM |
| EGTA | 5 mM |
| ヘペス | 5 mM |
| 島 | pH は 7.2 に調整 |
| ウェスタンブロット向けソリューション | |
| リシスバッファー (1 mL) | |
| ヘペスバッファー | 0.86 mL |
| ノニデ-P40 | 0.1 mL |
| プロテアーゼ阻害剤カクテル | 0.04 mL |
| ランニングバッファ (1000 mL) | |
| 10X TG (0.25 M トリスおよび 1.92 M グリシン) | 100 mL |
| SDS | 1 g |
| DW | 900 mL |
| 転送バッファ(1000 mL) | |
| 10X TG | 100 mL |
| メタノール | 200 mL |
| DW | 700 mL |
| ブロッティングバッファ(TBST)(1000 mL) | |
| 5M ナクル | 20 mL |
| 2M トリス-HCl (pH 7.5) | 5 mL |
| 10% トゥイーン 20 | 10 mL |
| DW | 965 mL |
表 2.心臓細胞の単離、免疫染色およびウェスタンブロッティングのための働く解決法の説明。実験の直前にすべての作業ソリューションを準備します。
補助図 1.細胞分離の概要。心室および心房筋細胞および心臓線維芽細胞の単一の心臓からの分離の流れ図。こちらをダウンロードしてください。
ディスカッション
心臓は虚血の影響を受けやすいので、心臓を切除し、収縮を止めるために氷冷CIB-EGTAに浸すために要する時間はできるだけ短くしておくべきである(<1分)。これは、このメソッドの最初の重要なステップです。第二の重要なステップは、心臓の方向に関するものです。ステップ2.1.2で切除された心臓の特定の向きは、大器官の周りの脂肪および結合組織を見たり取り除いたりすることを容易にする。大間を掃除した後、前表面側でクランプされた心臓を灌流板の上に置きます。最後の重要なステップは注射針の挿入を含む。針を心臓に向かって進める場合、注入針はプレートからの一定の距離を維持するために、灌流板から切り離されるべきではありません。挿入位置は左心室の頂点付近にあります。このようなねじれが穴を大きくする可能性があるため、針をねじらずに慎重に挿入してください。針の挿入の深さは、赤いマークを見て推定することができます。針が深すぎると、先端が心室中隔を貫通して右心室に入るか、僧帽弁に入って左心房に入る。冠状動脈からの血液の消失を確認した後、針は、灌流板にテープで固定する必要があります。
大間の長さが長いほど、大間を適切な位置にクランプすることが困難になります。クランプが心房から離れ過ぎると、心が透過液注入後に回転する。これを防ぐために、腕頭筋のすぐ下で大動脈を切断し、クランプする前に大動脈を短くします。
血液が0.5mL/分の初期速度で灌流後に排出し始めなければ、速度を1 mL/minに上げます。それが役に立たない場合、注射針は右心室、心室中隔または左心筋壁など、正しく配置されない可能性があります。このような場合は、すぐに針を取り出し、左心室の頂点付近に再挿入してみてください。針を数回挿入すると、消化された細胞が開いた穴から流出する。これは通常、細胞分離に深刻な影響を与えないことに注意してください。
オペレータは、色と透明性の変化を観察し、消化と共に心房の鼓動の再開を観察するために立体顕微鏡を使用して心臓の前向き灌流のプロセス全体を監視することができます。10 mLの酵素ミックスは、古い心臓であっても、最大必要とされる。若い心臓(5〜7週齢)では、同じ酵素ミックスで逆行灌流を介したアプローチに似た9mLにボリュームを減らします。
最終遠心分離時の上清には、破片、血液細胞、非筋細胞が含まれるのに対し、ペレットには主に心筋細胞が含まれ、線維芽細胞や内皮細胞などの非筋細胞を汚染している。心筋細胞を浄化するには、より多くのステップが必要です。一般に、ペレットは適切な細胞培養培地に再懸濁し、組織細胞培養皿上で37°Cで2時間前置きし、培養のためにピペット化およびプレメッキによって心筋細胞を穏やかに除去する。
酵素ミックスは、低濃度のCa2+(0.3mM)を含む。したがって、細胞再懸濁液(1.8 mM Ca2+)で最終的な再懸濁液を行う前に、CIB-Ca2+-BSA(1.2 mM Ca2+)で消化細胞をインキュベートし、Ca2+の漸進的な増加は細胞損傷を引き起こすことを避ける。分離された心筋細胞が無傷である限り(収縮しない静止細胞)このCa2+適応手順は、マウスの細胞生存率に影響を与えない。このインキュベーション中に損傷を受けた細胞が死にかけているので、結果的に健康な細胞群を得る。同様に、単離された無傷の心筋細胞(不規則な収縮のない静止細胞)は、同じ細胞再懸濁液中に保存することができる。しかし、心房筋細胞は心室筋細胞と比較して保存されるより繊細である傾向がある。
実験室では、左心室への針の挿入が失敗しない限り、この分離方法はほとんど常に成功する。また、外科的横大動脈収縮によって調製された肥大性心臓から細胞を単離することにも成功しました。しかし、心筋梗塞が小さいことが多い老化したマウスでは、いくつかの場所で灌流が停止し、不完全な消化をもたらし、したがって低収率(図1C)をランゲンドルフベースの逆行法と同様にする。このような場合、心臓の変形形状は、灌流の開始時にも観察することができる。
この前向きの灌流法は、ウサギやモルモットなどの大きな動物ではなく、さまざまな年齢のマウスから心臓細胞を単離するのに有用である。この方法は、新生児または若年ラットに、引き分け前に適用することができる。
この順方向灌流法の利点の1つは、小さなマウス心臓に対するランゲンドルフベースの逆行灌流法の使用に伴う技術的障害を減少させることである。灌流に要する時間は、酵素の10mLで約7分であり、この短い消化期間は、細胞の生存率を増加させる。さらに、大動脈弁が消化された後でも、心臓の冠状循環を通して灌流を行うことができる。心房筋細胞の単離には通常、ランゲンドルフベースの逆行灌流および酵素17によるさらなるインキュベーションが必要である。しかし、この前向きの灌流アプローチは、心房筋細胞を単離するために酵素と組織を深く浸透させることができる。
複数のマウスを用いた実験では、ランゲンドルフ装置は次の心臓を穿ファフューズする前に洗浄する必要があります。しかし、本先行法では、所望の数の器具セット(例えば、注射針および灌流板)が事前に調製される限り、灌流を連続的に行うことができる。
我々は、追加の化学物質を含まずにランゲンドルフベースの逆行灌流法と同じ溶液を用いて、マウス心臓の前向性灌流の基本的方法論を報告する。パーフューザ剤の組成は、酵素の代わりにEGTAを含む洗浄剤を用いて脱細胞化された心臓18を作るなどの実験目的に合わせて変更することができる。
開示事項
著者らは開示するものは何もない。
謝辞
著者らは、形態実験における支援に対し、山本T・森氏に感謝する。この研究は、日本科学振興会(18K06871からM.O.K.、17K08536からH.M.)の科学研究助成(C)によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Amphotericin B | Wako Pure Chemical Industries, Japan | ||
| Alexa Fluor 488 anti-mouse IgG antibody | Molecular Probes, USA | A11001 | Fluorescent-labeled secondary antibody. (1:400 dilution for immunostaining) |
| Anti-α-actinin (ACTN) | Sigma-Aldrich, USA | A7811 | Mouse monoclonal antibody (clone EA-53). (1:400 dilution for immunostaining) |
| Anti-atrial natriuretic peptide (ANP) | Merck-Millipore, USA | AB5490-I | Rabbit polyclonal antibody (1:2000 dilution for Western blots) |
| Anti-Glyceraldehyde 3-phosphate dehydrogenase (GAPDH) | Cell Signaling Technology, USA | 2118 | Mouse monoclonal antibody (1:10000 dilution for Western blots) |
| Anti-smooth muscle actin (SMA) | Dako, Denmark | M0851 | Mouse monoclonal antibody (clone 1A4) (1:400 for immunostaining) |
| Anti-rabbit IgG antibody | Amersham, GE Healthcare, USA | NA934 | Secondary antibody (1:10000 dilution for Western blots) |
| ATP disodium salt | Sigma-Aldrich, USA | A26209 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich, USA | A9418 | |
| Cell-Tak | Corning | 354240 | Biological material for adhesion of the cell or tissues |
| Chemi-Lumi One Super | Nacalai Tesque, Japan | 02230-14 | Chemiluminescent reagent used for western blotting. |
| Collagenase Type 2 | Worthington Biochemicals, USA | LS004176 | Choose the activity guaranteed to be greater than 300 unit/mg. |
| Complete Mini | Roche, Germany | 11836153001 | A mixture of several protease inhibitors. |
| 4'6'diamidino-2-phenylindole (DAPI) | Nacalai Tesque, Japan | 11034-56 | Used for cell-impermeant nuclear stainig |
| Dulbecco's Modified Eagle's Medium (DMEM) | Nacalai Tesque, Japan | 08458-45 | including 4.5 g/L gluose |
| Extension tube | Top, Japan | X1-50 | Connect with syringe and injection needle for antegrade perfusion. |
| EPC-8 patch-clamp amplifier | HEKA, Germany | ||
| Fetal bovine serum (FBS) | Sigma-Aldrich, USA | F7524-500ML | |
| Glass capillaries | Narishige Scientific Instrument Lab., Japan | outside diameter 1.5 mm, inside diameter 0.9 mm | |
| GTP lithium salt | Sigma-Aldrich, USA | G5884 | |
| Horizontal microelectrode puller | Germany) | P-97 | |
| Heater mat | Natsume Seisakusho, Japan | KN-475-3-40 | Equipment to warm the perfusion plate. |
| Infusion pump | TERUMO, Japan | TE-311 | Infusion syringe pump for antegrade perfusion. |
| Injeciton needle (27 gauge) | TERUMO, Japan | NN-2719S | Needle for insertion into the left ventricle. |
| Insulin (from bovine pancrease) | Sigma-Aldrich, USA | I5500 | Dissolve in 0.1 M HCl. |
| Mini cordless grinder | Funakoshi, Japan | cG-4A | Small grinder for homogenizing tissue in 1.5 mL sample tube. |
| 4%-Paraformaldehyde Phosphate Buffer solution (4% PFA) | Nacalai Tesque, Japan | 09154-85 | |
| Penicillin G potassium | Nacalai Tesque, Japan | 26239-84 | |
| Phenol Red | Nacalai Tesque, Japan | 26807-21 | |
| 10X Phosphate Buffered Saline (pH7.4) (10X PBS) | Nacalai Tesque, Japan | 27575-31 | |
| Plastic multi-well culture plate | Falcon, USA | 353226 | Use the lid of the multi-well culture plate as the perfusion plate. |
| Plastic syringe (20 mL) | TERUMO, Japan | SS-20ES | Use for infusion of CIB-EGTA. |
| Plastic syringe (30 mL) | TERUMO, Japan | SS-30ES | Use for infusion of Enzyme-mix |
| Plastic transfer pipette | Sarstedt, Germany | 86.1171 | Cut the tip just before sucking mouse heart into the pipette. |
| Polyvinylidene difluoride (PVDF) membrane | Merck-Millipore, USA | IPVH00010 | Immobilin-P membrane (Transfer membrane for protein blotting) |
| Protease | Sigma-Aldrich, USA | P5147 | A mixture of three or more proteases including extracellular serine protease. |
| 4X Sample buffer solution | Fuji Film, Japan | 198-13282 | Contains 0.25 M Tris-HCl (pH 6.8), 8 w/v% SDS,40 w/v% Glyceroland 0.02 w/v% BPB |
| SDS polyacrylamide gel (15%) | Fuji Film, Japan | 193-14991 | |
| Streptomycin sulfate | Nacalai Tesque, Japan | 32237-14 | |
| 10X Tris-Glycine buffer solution (10X TG) | Nacalai Tesque, Japan | 09422-81 | Contains 0.25 M-Tris and 1.92 M-Glycine, (pH 8.3) |
| Trypsin | Sigma-Aldrich, USA | T8003 | Trypsin from bovine Type 1. |
| Vascular clamp | Karl Hammacher GmbH, Germany | HSE 004-35 | Small straight vascular clamp used for clamping aorta. |
| All other reagents | Nacalai Tesque, Japan |
参考文献
- Langendorff, O. Untersuchungen am überlebenden Säugethierherzen. Pflügers Archiv: European Journal of Physiology. 61, 291-332 (1898).
- Berry, M. N., Friend, D. S., Scheuer, J. Morphology and metabolism of intact muscle cells isolated from adult rat heart. Circulation Research. 26 (6), 679-687 (1970).
- Powell, T., Terrar, D. A., Twist, V. W. Electrical properties of individual cells isolated from adult rat ventricular myocardium. Journal of Physiology. 302, 131-153 (1980).
- Joshi-Mukherjee, R., et al. Structural and functional plasticity in long-term cultures of adult ventricular myocytes. Journal of Molecular and Cellular Cardiology. 65, 76-87 (2013).
- Benndorf, K., Boldt, W., Nilius, B. Sodium current in single myocardial mouse cells. Pflügers Archiv: European Journal of Physiology. 404 (2), 190-196 (1985).
- Zhou, Y. Y., et al. Culture and adenoviral infection of adult mouse cardiac myocytes: methods for cellular genetic physiology. American Journal of Physiology-Heart and Circulatory Physiology. 279 (1), 429-436 (2000).
- Shioya, T. A simple technique for isolating healthy heart cells from mouse models. Journal of Physiological Sciences. 57 (6), 327-335 (2007).
- Fiset, C., Clark, R. B., Larsen, T. S., Giles, W. R. A rapidly activating sustained K+ current modulates repolarization and excitation-contraction coupling in adult mouse ventricle. Journal of Physiology. 504, Pt 3 557-563 (1997).
- Ackers-Johnson, M., et al. A Simplified, Langendorff-Free Method for Concomitant Isolation of Viable Cardiac Myocytes and Nonmyocytes From the Adult Mouse Heart. Circulation Research. 119 (8), 909-920 (2016).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal to aged mice. Physiological Reports. 6 (9), 13688(2018).
- Sambrano, G. R., et al. Navigating the signalling network in mouse cardiac myocytes. Nature. 420 (6916), 712-714 (2002).
- Limana, F., et al. bcl-2 overexpression promotes myocyte proliferation. Proceedings of the National Academy of Sciences of the United States of America. 99 (9), 6257-6262 (2002).
- Santiago, J. J., et al. Cardiac fibroblast to myofibroblast differentiation in vivo and in vitro: expression of focal adhesion components in neonatal and adult rat ventricular myofibroblasts. Developmental Dynamics. 239 (6), 1573-1584 (2010).
- Chistiakov, D. A., Orekhov, A. N., Bobryshev, Y. V. The role of cardiac fibroblasts in post-myocardial heart tissue repair. Experimental and Molecular Pathology. 101 (2), 231-240 (2016).
- Omatsu-Kanbe, M., Matsuura, H. A novel type of self-beating cardiomyocytes in adult mouse ventricles. Biochemical and Biophysical Research Communications. 381 (3), 361-366 (2009).
- Shan, D., Marchase, R. B., Chatham, J. C. Overexpression of TRPC3 increases apoptosis but not necrosis in response to ischemia-reperfusion in adult mouse cardiomyocytes. American Journal of Physiology. 294 (3), 833-841 (2008).
- Nakamura, H., et al. Presence and functional role of the rapidly activating delayed rectifier K(+) current in left and right atria of adult mice. European Journal of Pharmacology. 649 (1-3), 14-22 (2010).
- Milgroom, A., Ralston, E. Clearing skeletal muscle with CLARITY for light microscopy imaging. Cell Biology International. 40 (4), 478-483 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved