Method Article
Eine antegrade Perfusionsmethode zur Kardiomyozytenisolation von Mäusen
In diesem Artikel
Zusammenfassung
Wir entwickelten eine einfacheMethode zur Isolierung hochwertiger einzelner Mausherzzellen durch die antegrade Perfusionstechnik. Diese Methode ist Langendorff-frei und nützlich zur Isolierung von ventrikulären und vorhofialen Myozyten oder interstitiellen Zellen, wie Herzfibroblasten oder Vorläuferzellen.
Zusammenfassung
In der Grundlagenforschung mit Mausherz ist die Isolierung lebensfähiger individueller Kardiomyozyten ein entscheidender technischer Schritt, den es zu überwinden gilt. Traditionell wurde die Isolierung von Kardiomyozyten von Kaninchen, Meerschweinchen oder Ratten durch retrograde Perfusion des Herzens mit Enzymen unter Verwendung eines Langendorff-Geräts durchgeführt. Ein hohes Maß an Geschick ist jedoch erforderlich, wenn diese Methode mit einem kleinen Mausherz angewendet wird. Für die Isolierung von Maus-Kardiomyozyten wurde kürzlich über eine antegrade Perfusionsmethode berichtet, bei der kein Langendorff-Gerät verwendet wird. Wir berichten hier über ein vollständiges Protokoll für die verbesserte antegrade Perfusion des herausgeschnittenen Herzens, um einzelne Herzzellen von erwachsenen Mäusen (8 - 108 Wochen alt) zu isolieren. Die antegrade Perfusion wird durch Injektion von Perfusat in der Nähe der Spitze des linken Ventrikels des herausgeschnittenen Herzens, dessen Aorta mit einer Infusionspumpe geklemmt wurde, durchgeführt. Alle Eingriffe werden auf einer vorgewärmten Heizmatte unter dem Mikroskop durchgeführt, wodurch die Injektions- und Perfusionsprozesse überwacht werden können. Die Ergebnisse deuten darauf hin, dass ventrikuläre und vorhofliche Myozyten und Fibroblasten gleichzeitig gut von einer einzigen erwachsenen Maus isoliert werden können.
Einleitung
Im Allgemeinen besteht der erste Schritt der Einzelzellisolierung von seziertem Gewebe darin, das Gewebe in kleine Stücke zu zerkleinern, gefolgt von der Verdauung des Bindegewebes und der extrazellulären Matrix mit Enzymen. Kardiomyozyten können jedoch nicht mit einer solchen Hackmethode isoliert werden, da die Anreicherung mit extrazellulären Matrixkomponenten, einschließlich Kollagen- und Elastinfasern, das Myokard zu zäh macht, um es zu hacken, und die Kardiomyozyten sind sehr empfindlich gegenüber Hypoxie und anderen Veränderungen in der Mikroumgebung. So wurde unter Verwendung des Langendorff-basierten retrograden Perfusionssystems1eine Methode zur Verdauung der extrazellulären Matrix mit Enzymen entwickelt, um einzelne Kardiomyozyten aus dem Herzen zu isolieren2,3,4.
In Mausmodellen wird die Langendorff-basierte retrograde Perfusion des Herzens mit Enzymen auch zur Isolierung einzelner Kardiomyozyten5,6,7,8verwendet. Die Kanulation der kleinen und dünnen Mausaorta und ihre Montage am Langendorff-Apparat zur Durchführung einer retrograden Perfusion erfordert jedoch ein hohes Maß an Geschicklichkeit, da der Durchmesser der Aorta im erwachsenen Herzen etwa 1,2 mm beträgt. Darüber hinaus braucht es Zeit, um mehrere Experimente durchzuführen, da das Langendorff-Gerät gereinigt werden sollte, bevor das nächste Herz durchsfundiert wird.
Als Alternative zur retrograden Perfusion wurde eine neuartige Methode zur Isolierung von Kardiomyozyten aus einem erwachsenen Mausherz ohne Langendorff-Apparat entwickelt. Diese epochale Methode basierte auf der antegraden Perfusion der Koronararterien9. Wir haben kürzlich jeden Schritt dieses antegraden Protokolls verbessert, wie das Klemmen der Aorta, das Einführen der Nadel und die Temperaturkontrolle, und alle Perfusionsverfahren miteinem Mikroskop überwacht 10. Wir berichten hier ausführlich über die Verfeinerung dieser antegraden Perfusionsmethode, um die Zeit für die Isolierung zu verkürzen und ein ergänzendes Video zur Verfügung zu stellen. Bei dieser Methode dauert die Perfusion des Herzens etwa 7 Minuten mit 10 ml der Enzyme, und diese kurze Verdauungszeit erhöht die Lebensfähigkeit der Zellen. Dies ist eine einfache Methode zur Isolierung einzelner Herzzellen in hoher Qualität, ohne dass die Zugabe von Chemikalien wie 2,3-Butanedionmonoxem (BDM)6,11 oder Taurin 5,8erforderlich ist. Wir glauben, dass diese Methode die Fähigkeitsschwelle der Technik senken und den Nutzen von Mauskardiomyozyten in der Grundlagenforschung verbessern wird.
Protokoll
Alle Tierversuche entsprachen dem von den US National Institutes of Health veröffentlichten Leitfaden für die Pflege und Verwendung von Versuchstieren (NIH-Publikation Nr. 85-23, überarbeitet 1996) und wurden vom institutionellen Review Board des Shiga University of Medical Science Animal Care and Use Committee genehmigt (genehmigt Nr. 2019-3-7). Die Methoden wurden nach genehmigten Richtlinien durchgeführt.
1. Instrumente und Lösung
HINWEIS: Ein Überblick über das experimentelle Verfahren ist in einem Flussdiagramm dargestellt (Ergänzende Abbildung 1). Eine Infusionspumpe (oder Spritzenpumpe) sollte für die antegrade Perfusion des Herzens mit einem Einwegfluss verwendet werden. Eine Peristaltikpumpe, die einen pulsierenden Durchfluss erzeugt, wird nicht empfohlen.
- Vor dem Experiment
- Markieren Sie die Injektionsnadel an einer Stelle etwa 3 mm von der Spitze mit Nagellack. Nachdem Sie es an der Luft trocknen lassen, bewahren Sie es bei Raumtemperatur im Behälter auf. Eine rote oder helle Farbe ist wünschenswert, um die Tiefe des Einsetzens in das Myokard während der Perfusion zu bestätigen.
- Lassen Sie das Herz stehen, indem Sie die Deckel von 1,5-, 0,5- und 0,2-ml-Probenröhrchen abschneiden und die Deckel mit doppelseitigem Klebeband oder Klebstoff am Boden einer 60-mm-Kulturschale befestigen. Die Fixierung von drei unterschiedlich großen Deckeln in einer Schüssel ermöglicht es, den geeigneten entsprechend der Größe des Mausherzes zu wählen. Dieser Herzständer kann nach dem Waschen wiederverwendet werden.
- Machen Sie eine Lagerlösung wie in Tabelle 1 dargestellt. Lagern Sie die Lagerlösungen bei 4 °C.
- Am Experimenttag
HINWEIS: Zellisolationspuffer (CIB) enthält (in mM) 130 NaCl, 5,4 KCl, 0,5MgCl2,0,33 NaH2PO4,22 Glukose, 40 Einheiten/ml Insulin und 25 HEPES (pH mit NaOH auf 7,4 eingestellt); und Tyrodenlösung enthält (in mM) 140 NaCl, 5,4 KCl, 1,8CaCl2,0,5MgCl2,0,33NaH2PO4,5,5 Glucose und 5,0 HEPES (pH mit NaOH auf 7,4 eingestellt).- Bereiten Sie die CIB vor. Erwärmen Sie 160 ml destilliertes Wasser (DW) mit einer Mikrowelle auf etwa 32 °C und fügen Sie dann 20 ml 10X CIB hinzu. Nach zugabe von 0,79 g Glukose und 10 μL Insulinlösung den pH-Wert mit 1 M NaOH einstellen und mit DW auf 200 ml bringen.
- Bereiten Sie die Enzymmischungslösung (Enzymmischung) vor. 30 mg Kollagenase, 1,8 mg Trypsin, 1,8 mg Protease und 90 μL 100 mMCaCl2-Stammlösung zu 30 ml CIB (endgültige Ca2+ Konzentration beträgt 0,3 mM) zuweisen, mischen und auf Eis halten. Bei Mäusen <4 Wochen alt, reduzieren Sie Trypsin und Protease auf 0,9 mg10. Vor Gebrauch bei 37 °C im Wasserbad erwärmen.
- Bereiten Sie die CIB-Ca2+-BSA-Lösung vor. 30 mg BSA und 90 μL 100 mM CaCl2-Stammlösung zu 15 ml CIB (endgültige Ca2+-Konzentration beträgt 1,2 mM) fündigen, mischen, durch einen 20-μm-Filter filtern und auf Eis aufbewahren.
- Bereiten Sie die CIB-EGTA-Lösung vor. Nach herstellung der in den Schritten 1.2.2 und 1.2.3 beschriebenen Lösungen wird der verbleibenden CIB 400 mM EGTA-Stammlösung in einer Verdünnung von 1:1000 (die endgültige EGTA-Konzentration beträgt 0,4 mM) hinzugefügt und gemischt. Füllen Sie die 35-mm-Kulturschale und die Herzständerschale mit CIB-EGTA und halten Sie sie auf Eis.
- Gießen Sie ca. 20 ml CIB-EGTA in ein 30-ml-Glasbecherglas und stellen Sie eine Kunststofftransferpipette in das Becherglas und halten Sie es auf Eis.
- Tyrode-Lösung vorbereiten. 100 ml 10X Tyrode zu 800 ml DW geben und mit einer Mikrowelle auf ca. 32 °C erwärmen. Nach Zugabe von 0,99 g Glukose und 1,8 ml 1 M CaCl2den pH-Wert mit 1 M NaOH einstellen und mit DW auf 1000 ml bringen.
- Bereiten Sie die Zell-Resuspensionslösung vor. 30 mg BSA und 300 μL 50X Antibiotika werden zu 15 ml Tyrode-Lösung hinzugefügt.
- Bereiten Sie Spritzen vor. Füllen Sie die 20-ml-Spritze, die mit dem flexiblen Verlängerungsrohr und der markierten Injektionsnadel verbunden ist, mit CIB-EGTA. Füllen Sie die 30-ml-Spritze mit der erwärmten Enzymmischung. Halten Sie beide bei 37 °C bis kurz vor Gebrauch.
- Bereiten Sie die Perfusionsplatte vor. Die Heizmatte unter einem stereoskopischen Mikroskop vorwärmen. Legen Sie die Perfusionsplatte (Deckel einer Multi-Well-Kulturplatte) auf die vorgewärmte Heizmatte. Die Gefäßklemme vorwärmen, indem Sie sie bis zum Gebrauch in die Perfusionsplatte legen. Stellen Sie die 60-mm-Kulturschale zum Pipettieren und das Zellsieb ebenso auf die vorgewärmte Heizmatte.
2. Antegrade Perfusion des Mausherzes
HINWEIS: Die Kunststoff-Transferpipette, die zum Saugen des Herzens verwendet wird, sollte weich sein und sich nicht stark zur Spitze hin verjüngen. Wählen Sie eine kleine Gefäßklemme mit Serration. Die empfohlenen Instrumente sind in der Materialtabelleaufgeführt.
- Exzision des Mausherzens und Klemmen der Aorta
HINWEIS: Die erwachsenen Mäuse (>8 Wochen alt) sollten durch eine Überdosierung von Natriumpentobarbital (>300 mg/kg, intraperitoneale [i.p.] Injektion) mit Heparin (8000 Einheit/kg) eingeschläfert werden.- Schneiden Sie das Mausherz schnell durch Saugen aus.
- Öffnen Sie die Brusthöhle schnell, um das Herz freizulegen. Schneiden Sie die Kunststofftransferpipette ab, deren Spitze ungefähr die gleiche Größe oder etwas kleiner als das freiliegende Herz hat (normalerweise an einer Stelle etwa 1 cm von der 0,5-ml-Marke zur Spitze entfernt, aber es hängt von der Herzgröße ab).
- Saugen Sie das Herz in die Pipette, heben Sie die Pipette an, um genügend Platz zum Einsetzen einer Schere zu schaffen, und schneiden Sie das Herz mit einer gekrümmten Schere von der Rückenseite ab, um eine Beschädigung der Vorhöfe zu vermeiden.
- Geben Sie das herausgeschnittene Herz sofort in das 30-ml-Glasbecherglas mit eisgekühltem CIB-EGTA, um die Kontraktion zu stoppen. Dieser Vorgang dauert in der Regel <1 min.
- Reinigung rund um die Aorta
- Übertragen Sie das Herz in eine 35-mm-Kulturschale, die mit eisgekühltem CIB-EGTA gefüllt ist, entfernen Sie die Lunge und andere sichtbare Gewebe, und übertragen Sie dann das grob gereinigte Herz auf den mit gekühltem CIB-EGTA gefüllten Herzständer und legen Sie es mit der Spitze nach unten.
- Unter dem stereoskopischen Mikroskop entfernen Sie das Fett und das Bindegewebe, um die Aorta zu reinigen. Wenn die Länge der geschnittenen Aorta einschließlich der Arteria brachiocephalis, der linken Halsschlagader oder der arteria subclavia links zu lang ist, schneiden Sie die Aorta direkt unter der Arteria brachiocephalis ab, um sie zu verkürzen, um mit dem nächsten Schritt fortzufahren. Dieser Vorgang dauert in der Regel ca. 4 min.
- Klemmen der Aorta und Legen des eingeklemmten Herzens auf die Perfusionsplatte
- Legen Sie das Herz unter das Mikroskop in den Herzständer. Der Bediener sollte der vorderen Oberfläche des Herzens zugewandt sein, das Ende der Aorta mit einer Pinzette aufnehmen und die Aorta in der Nähe der Vorhöfe mit einer kleinen Gefäßklemme klemmen, während er sanft auf die Aorta drückt.
- Legen Sie das eingeklemmte Herz mit der vorderen Seite nach oben auf die Perfusionsplatte und bedecken Sie es dann mit ein paar Tropfen CIB-EGTA, damit es nicht austrocknet. Dieses Verfahren dauert in der Regel <20 s.
- Schneiden Sie das Mausherz schnell durch Saugen aus.
- Antegrade Durchblutung des Herzens
HINWEIS: Zuerst perfundieren Sie das Herz mit CIB-EGTA, um Blut zu entladen und die Gerinnung zu verhindern.- Setzen Sie die Injektionsnadel ein und beginnen Sie mit der Perfusion, um Blut abflussen
- Stellen Sie die mit vorgewärmter CIB-EGTA gefüllte 20-ml-Spritze mit dem flexiblen Verlängerungsrohr und einer markierten Injektionsnadel auf der Infusionspumpe ein. Starten Sie die Pumpe mit einer langsamen Geschwindigkeit von 0,5 ml / min, um die Nadel und das Rohr vorsichtig mit CIB-EGTA zu füllen und darauf zu achten, dass keine Luft in das Rohr gelangt.
- Legen Sie die Injektionsnadel auf die Perfusionsplatte mit der kürzeren Seite der diagonalen Form davor. Schieben Sie die Nadel in Richtung der Spitze des Herzens, bis sie sie berührt, und führen Sie dann vorsichtig die Nadel in der Nähe der Spitze des linken Ventrikels in die Kammer ein, ohne sich zu verdrehen. Lösen Sie die Nadel während des Einführens nicht von der Platte.
- Achten Sie auf die rote Markierung, um die Tiefe des Nadeleinführungs zu schätzen. Wenn die Nadeleinführung abgeschlossen ist, sollte das aus der Koronararterie fließende Blut entladen werden.
- Befestigen Sie die Injektionsnadel mit Klebeband auf der Platte und erhöhen Sie die Pumpendrehzahl auf 1 ml/min. Dieser Vorgang dauert in der Regel etwa 30 s. Wird das Herz erfolgreich durchblutet, kann der Fluss des CIB-EGTA in der Kapillare direkt unter dem Epikard unter dem Mikroskop gesehen werden.
- Durchdringen Sie das Herz mit Enzymmischung
HINWEIS: Während der enzymatischen Perfusion kann die Tiefe der eingeführten Nadel überwacht werden, indem die rote Markierung auf der Nadel überprüft wird.- Nach dem Aufweichen von 2-3 ml CIB-EGTA, um Blut vollständig aus der Koronararterie abzuführen, ändern Sie das Perfusat in eine Enzymmischung. Vermeiden Sie es, dass Luftblasen in das Rohr eindringen. Überprüfen Sie den Fluss der Enzymmischung und stellen Sie sicher, dass die Injektionsnadel nicht herausgekommen ist, indem Sie die Position der roten Markierung überprüfen.
- Nachdem 1-2 ml durchblutet wurden, erhöhen Sie die Pumpendrehzahl auf 1,5 ml/ min. Entfernen Sie das angesammelte Perfusat, das Blut enthält, das von Zeit zu Zeit aus dem Herzen geflossen ist, mit einer Pipette.
HINWEIS: Im Laufe der Zeit wird die Myokardwand an einigen Stellen durchscheinend und erscheint fleckig, was ein Zeichen für die Verdauung der extrazellulären Matrix nach erfolgreicher Perfusion ist. Ein weiteres Zeichen ist der Neustart des Vorhoffnenschlags, der durch das Vorhandensein von Ca2+ in der Enzymmischung verursacht wird. - Stoppen Sie die Perfusion, wenn das Gesamtvolumen der perfundierten Enzymmischung 10 ml beträgt.
- Setzen Sie die Injektionsnadel ein und beginnen Sie mit der Perfusion, um Blut abflussen
3. Isolierung einzelner Herzzellen
- Dissoziierende Herzzellen
- Nach der Perfusion mit der Enzymmischung 10 ml der in der Spritze verbleibenden Enzymmischung in eine 60-mm-Kulturschale auf der Heizmatte übertragen und 20 mg BSA (0,2% BSA in Enzymmischung) hinzufügen. Das fallengelassene BSA-Pulver sollte sich sofort durch sanftes Schwenken mit der Hand auflösen. Entfernen Sie die Injektionsnadel und die Gefäßklemme vom Herzen.
- Trennen Sie die Ventrikel und Vorhöfe und übertragen Sie sie jeweils in die Enzymmischung, die mit 0,2% BSA auf der Heizmatte ergänzt wird.
- Isolierung ventrikulärer Myozyten
- Schnappen Sie sich das Epikardium mit zwei Pinzetten und reißen Und ziehen Sie die Ventrikel von Seite zu Seite in der Enzymmischung, die mit 0,2% BSA ergänzt wird, in kleine Stücke. Verteilen Sie die Zellen mit sanftem Pipettieren (ca. 30 mal).
- Filtern Sie die unverdauten Ablagerungen durch ein 100-μm-Netzzellensieb und übertragen Sie das Filtrat in ein 15-ml-Zentrifugenrohr zur Zentrifugation bei 50 × g für 3 min. Die pelletierten Kardiomyozyten in vorgewarmter CIB-Ca2+-BSA-Lösung resuspendieren, 5 min bei 37 °C inkubieren und dann bei 14 × g für 3 min zentrifugieren.
- Die endgültigen gefällten Kardiomyozyten in zellresuspensionslösung (Zusammensetzung ist in Tabelle 2aufgeführt) erneut abbrechen und bei 37 °C halten.
- Isolierung von Vorhoffyozyten
- Während der abschließenden Zentrifugation für die ventrikuläre Myozytenfraktion in Schritt 3.2 beginnen Sie mit der Isolierung der Vorhofmyozyten. Die wie in Schritt 3.1 gelagerten Vorhöfe in die vorgewärmte CIB-Ca2+-BSA-Lösung überführen, in Stücke reißen und die Zellen durch Pipettieren mit Pipettenspitze bei 10 μL auf der Heizmatte dissoziieren.
- Zentrifugieren Sie die Zellmischung bei 14 × g für 3 min und resuspendieren Sie die pelletierten Vorhoffnen mit Zellresuspensionslösung.
- Isolierung und Kultur von Herzfibroblasten
- Übertragen Sie den Überstand von der ersten Zentrifugation in Schritt 3.2 in ein anderes 15-ml-Zentrifugenrohr und zentrifugieren Sie bei 190 × g für 5 min. Waschen Sie die ausgefällten Zellen zweimal mit Zentrifugation in Dulbeccos Modified Eagle Medium (DMEM) und suspendieren Sie die Zellen dann mit DMEM, das mit 10% fetalem Rinderalbumin (FBS) und Antibiotika ergänzt wird.
- Die endgültige Zellfraktion wird in einem Kulturkolben (25cm2)plattiert und die Zellen in einer befeuchteten Atmosphäre von 95% Luft und 5% CO2am Boden des Kolbens haften lassen. Nach 90 Minuten Inkubation die nicht befestigten Zellen verwerfen und frisches Kulturmedium hinzufügen. Die Zellen sollten nach etwa 4 Tagen in die Nähe der Konfluenz geraten, an diesem Punkt sollten sie durch Trypsinisierung verstärkt und in neue Kulturschalen eingesät werden.
4. Proteine aus Vorhöfen und Ventrikeln ernten
- Trennen Sie nach der Perfusion die Vorhöfe und Ventrikel und homogenisieren Sie sie in einem Lysepuffer in einem Verhältnis von 10 mg Gewebegewicht zu 100 μL Puffer mit einer kleinen Mühle in einem 1,5-ml-Probenröhrchen.
- Halten Sie das Homogenat 40 Minuten lang im Eis, wobei der Wirbel alle 10 Minuten gemischt wird, um Proteine zu extrahieren, und zentrifugieren Sie dann das Röhrchen bei 15000 × g für 20 minuten bei 4 ° C. Lagern Sie die Überstandsfraktion bei -80 °C als Proteinprobe.
5. Immunfärbung isolierter Herzzellen
HINWEIS: Die Immobilisierung von nicht adhärenten Kardiomyozyten am Boden der Zellbildgebungsschale mit biologischem Klebstoff ist notwendig.
- Adhäsion isolierter Kardiomyozyten an einer Glasbodenkulturschale
- Bevor Sie mit der Zellisolierung beginnen, beschichten Sie die Glasbodenkulturschale mit biologischem Klebstoff (z. B. Cell-Tak) gemäß den Anweisungen des Herstellers, spülen Sie sie mit DW und trocknen Sie sie bei Raumtemperatur an der Luft.
- Nach der Resuspension der isolierten Kardiomyozyten in CIB-Ca2+-BSA-Lösung die Zellsuspension auf den Boden des mit Klebstoff beschichteten Geschirrs fallen lassen und 20 minuten lang bei Raumtemperatur ohne Rühren inkubieren.
- Immunfärbung
- Die isolierten Kardiomyozyten auf einer mit biologischem Klebstoff vorbeschichteten Glasbodenschale plattieren und 40 Minuten bei Raumtemperatur aufbewahren, damit die Zellen an der Schüssel haften können. Kultur kardiale Fibroblasten in Bodenglaskulturschalen.
- Spülen Sie die Zellen mit phosphatgepufferter Kochsalzlösung (PBS) und fixieren Sie sie mit 4% Paraformaldehyd (PFA) für 5 min unter Schütteln. Waschen Sie die festen Zellen dreimal 10 min mit PBS und inkubieren Sie sie in Blockier-Permeabilisationslösung für 60 min bei Raumtemperatur unter Schütteln.
- Sondenzellen mit primärem Antikörper, verdünnt in Blockierungspermeabilisationslösung für 60 min bei Raumtemperatur oder über Nacht bei 4 °C. Waschen Sie die Zellen dreimal 10 min lang mit PBS und inkubieren Sie sie dann mit fluoreszenzmarkierten sekundären Antikörpern für 60 min bei Raumtemperatur.
- Nachdem Sie sie dreimal mit PBS für 10 min gewaschen haben, färben Sie die Kerne mit DAPI (1:10000 Verdünnung in PBS). Analysieren Sie die fluoreszierenden Signale mit einem konfokalen Laserscanning-Mikroskop.
6. Ganzzellen-Patch-Clamp-Aufnahmen
- Fertigen Sie die Patch-Elektroden aus glaslichen Kapillaren mit einem horizontalen Mikroelektrodenzieher. Der Widerstand der Elektrode reichte von 2 bis 4 MΩ, wenn sie mit einer K+-reichen Pipettenlösung gefüllt wurde (Tabelle 2). Übertragen Sie ein Aliquot isolierter Kardiomyozyten in eine Aufnahmekammer, die auf der Stufe eines invertierten Mikroskops montiert ist, das mit Tyrode mit einer Geschwindigkeit von 1 ml / min bei 36-37 ° C überlagert ist.
- Erfassen Sie Aktionspotentiale mit dem perforierten Patch-Clamp-Verfahren mit K+-reicher Pipettenlösung mit 30 mg/ml Amphotericin B, indem Sie Stromimpulse von 5-10 ms Dauer mit einer Rate von 1 Hz über die Patch-Elektrode auftragen.
7. Western Blot Analysen
- Führen Sie in dieser Studie eine Western-Blot-Analyse von Proteinen mit kleinem Molekulargewicht durch, z. B. Vorhoffrialmarker natriuretisches Peptid (ANP).
- Die Proteinprobe in der Endkonzentration von 1X Probenpuffer, 2% 2' Mercaptoethanol auflösen und die Proteine für 60 min bei 37 °C denaturieren. Laden Sie 20 μg Protein in jede Vertiefung und führen Sie eine Elektrophorese im Laufpuffer mit 20 mA pro Gel für 120 minuten durch.
- Übertragen Sie das Protein auf eine PVDF-Membran im Transferpuffer bei 10 V für 40 min. Waschen Sie die übertragene Membran zweimal mit TBST für 5 min, dann blockieren Sie mit 5 % Magermilch in TBST für 60 min bei Raumtemperatur und sonden Sie mit dem primären Antikörper, der über Nacht bei 4 °C in TBST gelöst ist.
- Waschen Sie die Membran 5 mal mit TBST für 7 min und inkubieren Sie sie mit dem sekundären Antikörper, der in TBST verdünnt ist, für 120 min bei Raumtemperatur.
- Nachdem Sie die Membran 5 Mal mit TBST für 7 min gewaschen haben, visualisieren Sie die Signale mit einem Chemi-Lumineszenz-Assay und analysieren Sie sie mit einem Lumino-Bild-Analysator.
Ergebnisse
Das Prinzip dieser Methode ist einfach: Das Perfusat fließt aus der linken Kammer, die Aortenklappe wird geöffnet und das Perfusat läuft in die Koronararterie in die gleiche Richtung wie der Blutlauf, da die Aorta durch Klemmung geschlossen wird, was die tiefe Perfusion des Myokards ermöglicht, um die extrazelluläre Matrix zu verdauen.
Ventrikuläre Myozyten, die mit der vorliegenden Methode frisch isoliert wurden, sind in Abbildung 1A dargestellt. Abbildung 1B zeigt vergrößerte Bilder der ventrikulären und vorhofialen Myozyten. Dieses Isolationsverfahren führte zu einer hohen Ausbeute (70%-80%) von stäbchenförmigen ruhenden ventrikulären Myozyten von erwachsenen Mäusen (8-10 Wochen), die innerhalb von ca. 5 h nach der Isolierung zur Verfügung standen (Abbildung 1C), ein ähnliches Intervall wie bei Verwendung des traditionellen Langendorff-basierten Verfahrens7. Das Verhältnis der frisch isolierten lebensfähigen Zellen war jedoch bei gealterten Mäusen im Alter von >2 Jahren niedriger (Abbildung 1C). Die Gesamtzahl der ventrikulären Myozyten, die pro erwachsenem Herzen mit diesem Protokoll erhalten wurden, betrug etwa 3 x 106 Zellen, was dem zuvor berichteten Wert7,12ähnelte. Die in den ventrikulären und vorhoflichen Myozyten aufgezeichneten Aktionspotentiale (Abbildung 1D) ähnelten denen in Zellen, die mit der Langendorff-basierten Methode10erhalten wurden. Eine immunanhaltende Analyse bestätigte, dass die sarkomerische Struktur der ventrikulären Myozyten mit einer deutlich sichtbaren Zellmembran gut organisiert war (Abbildung 2A). Die einzelnen Kardiomyozyten, die mit dieser Methode isoliert wurden, können direkt in Experimenten wie einer elektrophysiologischen Analyse10 oder einem immunanhaltenden Experiment verwendet werden.
Herzfibroblasten existieren in interstitiellen Räumen. Eine ausreichende Verdauung der extrazellulären Matrix führt zur Isolierung dieser Zellen. Die isolierten Herzfibroblasten vermehren sich unter Kulturbedingungen und können mehrfach durchgespeichert oder in flüssigem Stickstoff in einer geeigneten Zellreservoirlösung gespeichert werden. Abbildung 2B zeigt, dass sich die meisten der kultivierten Herzfibroblasten während der Subkultur in Myofibroblasten umgewandelt hatten, was durch die erhöhte Expression von α-glatten Muskelaktin13,14bestätigt wurde. Auch die kardialen Vorläufer können mit der vorliegenden Methode isoliert und in geeignetes Kulturmedium kultiviert werden, die automatisch10,15schlagen.
Die Homogenisierung des robusten Myokards ist nicht einfach, insbesondere für Herzgewebe von gealterten Mäusen, das eine große Menge an extrazellulären Fasern besitzt. Nach der antegraden Perfusion kann Protein aus den Vorhöfen und Ventrikeln im Lysepuffer mit leichter Kraft leicht homogenisiert werden, um Proteine zu extrahieren. Eine Western-Blot-Analyse zeigte die spezifische Expression von ANP in Vorhöfen, aber nicht in Ventrikeln von erwachsenen (20 Wochen alten) und gealterten (108 Wochen alten) Mäusen(Abbildung 3).
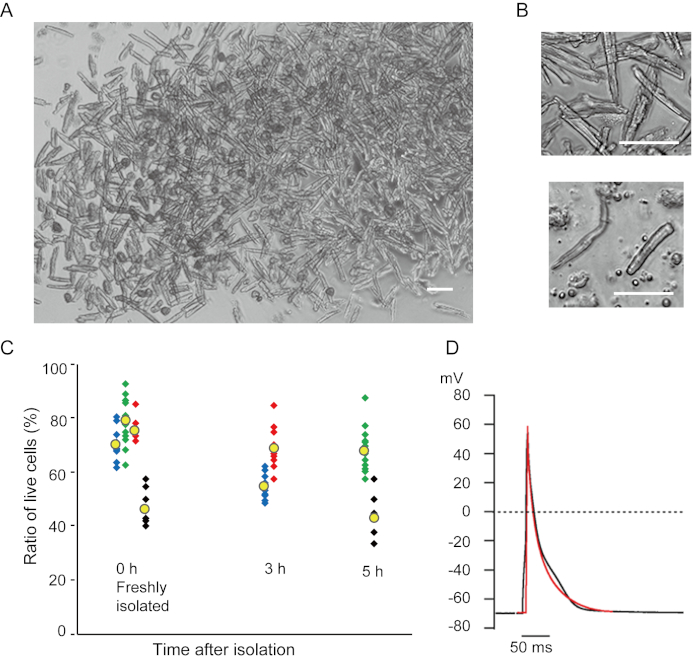
Abbildung 1. Isolierte Kardiomyozyten von Mäusen. A. Ventrikuläre Myozyten, die mit der antegraden Perfusion frisch isoliert wurden, wobei Bilder mit geringer Vergrößerung aufgenommen wurden. Nach dem abschließenden Waschen wurden die Kardiomyozyten mit 2 ml Zellresuspensionslösung resuspensiert, von denen 100 μL auf die Glasbodenkulturschale fallen gelassen wurden und die Zellansiedlung erwartet wurde. Bar, 100 μm.B. Vergrößerte Bilder von isolierten ventrikulären Myozyten (oben) und Vorhofmyozyten (unten). Bar, 100 μm.C. Isolierte Zellen wurden in der Zellresuspensionslösung suspendiert und bei 37°C für den gewünschten Zeitraum gelagert, und die Anzahl der lebenden ventrikulären Myozyten wurde in 10-15 Feldern unter einem Mikroskop gezählt. Abgerundete Zellen galten als irreversibel verletzt oder tot16. Grüne, blaue und rote Symbole wurden von 3 Mäusen im Alter von 8-10 Wochen erhalten, und schwarze Symbole waren von 106 Wochen alten Mäuse. Das gelbe Symbol zeigt den Mittelwert jeder Gruppe an. D. Repräsentative Aktionspotentiale, die von ventrikulären (schwarzen) und vorhofen (roten) Myozyten von 8-10 Mäusen aufgezeichnet wurden. Die Daten wurden ca. 3 h nach der Isolierung aus den Zellen gewonnen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
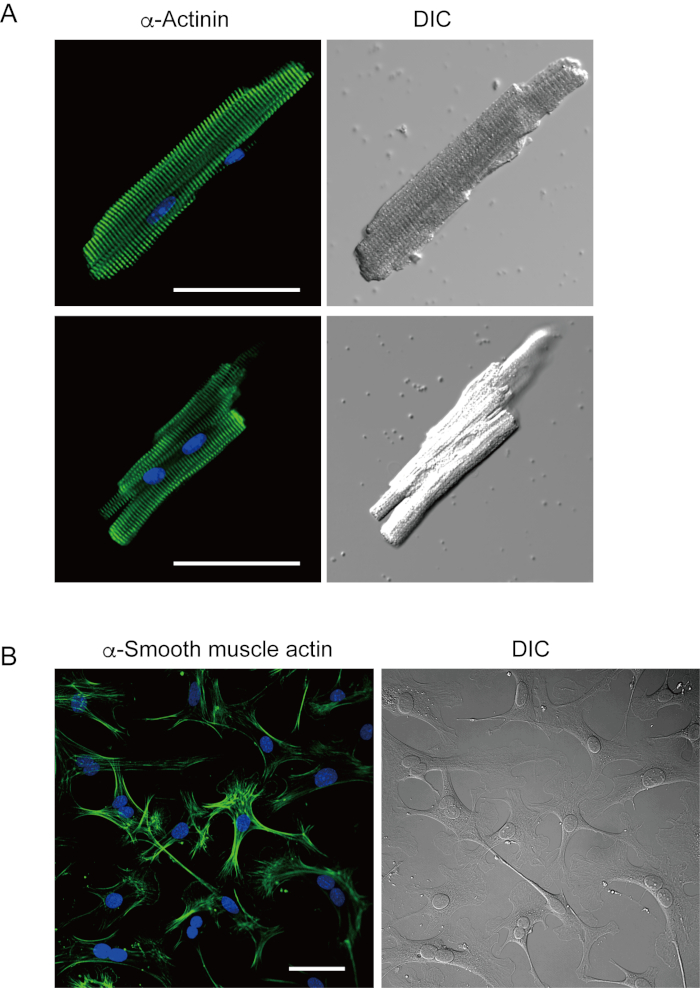
Abbildung 2. Immunfärbung für α-Actinin in isolierten ventrikulären Myozyten der Maus und α-glatten Muskelaktin in kultivierten Herzfibroblasten der Maus. A. Konfokale Laser-Scanning-Mikroskopie der Immunfärbung für α-Actinin (grün), DAPI-Färbung für Kerne (blau) und ein DIC-Bild von ventrikulären Myozyten, die aus dem Mausherz mit antegrader Perfusion isoliert wurden. Bar, 50 μm.B. Immunfärbung für α-glatte Muskelaktin (grün), DAPI-Färbung für Kerne (blau) und ein DIC-Bild von Herzfibroblasten, die aus dem Mausherz mit antegrader Perfusion isoliert wurden. Herzfibroblasten wurden vier Tage lang kultiviert. Bar, 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
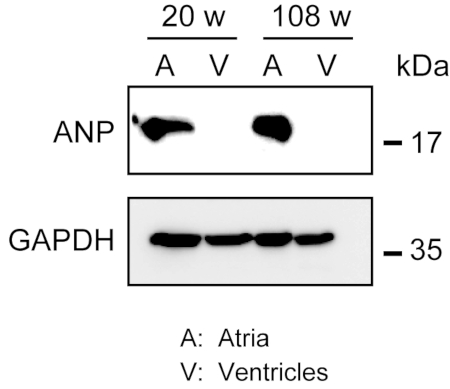
Abbildung 3. Western Blot Analysen von ANP in Vorhöfen und Ventrikeln. Western-Blot-Analysen für das vorhofmarkerale natriuretische Peptid (ANP) in Vorhöfen (A) und Ventrikeln (V), die von erwachsenen (20 Wochen) und gealterten (108 Wochen) Herzen hergestellt werden. ANP ist in den Vorhöfen vorhanden, aber in den Ventrikeln nicht vorhanden. Verwenden Sie Glyceraldehyd-3-phosphat-Dehydrogenase (GAPDH) als Kontrollprotein für die Haltung des Hauses. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Lagerlösungen zur Isolierung von Herzzellen | |
| 10X CIB (500 ml) | |
| NaCl | 37,99 g |
| Kci | 2,01 g |
| 1 mMgCl2 | 2,5 ml |
| NaH2PO4 | 0,23 g |
| HEPES | 29,79 g |
| Dw | Füllen Sie bis zu 500 ml |
| 100 mM CaCl2 Lagersoution | |
| CaCl2 | 100 mM |
| 400 mM EGTA-Lagerlösung | |
| EGTA | 400 mM |
| Insulinlösung | |
| Insulin | 1 Einheit/ml in 0,1 M HCl |
| 50X Antibiotika Stammlösung (20 ml) | |
| Penizillin | 100 mg |
| Streptomycin | 100 mg |
| Phenol rot | 1,5 g |
| Dw | 20 ml und mit Filterung sterilisieren |
| 10X Tyrode Lösung (1000 ml) | |
| NaCl | 81,82 g |
| Kcl | 4,03 g |
| 1 mMgCl2 | 5 ml |
| NaH2PO4 | 0,47 g |
| HEPES | 11,92 g |
| NaOH | 0,8 g |
| Dw | Füllen Sie bis zu 1000 ml |
| Lagerlösin zur Immunfärbung | |
| DAPI-Bestand | |
| DAPI | 2 mg/ml in Methanol |
| Lagerlösungen für Western Blots | |
| HEPES Puffer (100 ml) | |
| NaCl | 0,88 g |
| 400 mM EGTA | 0,25 ml |
| HEPES | 0,24 g |
| 1M NaOH | pH-Wert auf 7,4 einstellen |
| Dw | Füllen Sie bis zu 500 ml |
| Proteasehemmer Cocktail | |
| Kompletter Mini | 1 Tablette |
| Dw | 0,4 ml |
Tabelle 1. Beschreibung der Lagerlösungen. Lagerlösungen bei 4 °C aufbewahren. Aliquot Protease Inhibitoren Cocktail zur Lagerung bei -20 °C.
| Lösungen zur Isoltaing von Herzzellen | |
| CIB (200 ml) | |
| 10X CIB | 20 ml |
| Insulinlösung | 0,01 ml |
| Traubenzucker | 0,79 g |
| 1M NaOH | pH-Wert auf 7,4 einstellen |
| Dw | Füllen Sie bis zu 200 ml |
| Enzym-Mix-Lösung (30 ml) | |
| Kollagenase Typ2 | 30 mg |
| Trypsin | 1,8 mg |
| Protease | 1,8 mg |
| 100 mM CaCl2 Lagerlösung | 0,09 ml |
| Cib | 30 ml |
| CIB-Ca2+-BSA (15 ml) | |
| Bsa | 30 mg |
| 100 mM CaCl2 Lagerlösung | 0,18 ml |
| Cib | 15 ml |
| CIB-EGTA (150 ml) | |
| 400 mM EGTA-Lagerlösung | 0,150 ml |
| Cib | 150 ml |
| Tyrode-Lösung (1000 ml) | |
| 10X Tyrode Lagerlösung | 100 ml |
| Traubenzucker | 0,99 g |
| 1M CaCl2 | 1,8 ml |
| 1M NaOH | pH-Wert auf 7,4 einstellen |
| Dw | Füllen Sie bis zu 1000 ml |
| Zell-Resuspensionslösung (15 ml) | |
| Bsa | 30 mg |
| 50X Antibiotika Stammlösung | 0,3 ml |
| Tyrode Lösung | 15 ml |
| Lösungen für die Immunfärbung | |
| Zelladhärente Lösung (0,3 ml) | |
| Cell-Tak | 0,01 ml |
| 0,1 M NaHCO3 (pH8,0) | 0,285 ml |
| 0,1 M NaOH | 0,005 ml |
| Blockier-Permeabilizatin-Lösung (10 ml) | |
| Fetales Rinderserum | 1 ml |
| Triton X-100 | 1 ml |
| 10X PBS | 1 ml |
| Dw | 7 ml |
| K+ reichhaltige Pipettenlösung | |
| Kaliumaspartat | 70 mM |
| Kcl | 50 mM |
| KH2PO4 | 10 mM |
| MgSO4 | 1 mM |
| ATP-Dunatriumsalz | 3 mM |
| GTP Lithiumsalz | 0,1 mM |
| EGTA | 5 mM |
| HEPES | 5 mM |
| Koh | pH-Wert auf 7,2 einstellen |
| Lösungen für Western Blots | |
| Lysepuffer (1 ml) | |
| HEPES Puffer | 0,86 ml |
| Nonidet-P40 | 0,1 ml |
| Proteasehemmer Cocktail | 0,04 ml |
| Laufpuffer (1000 mL) | |
| 10x TG (0,25 M Tris und 1,92 M Glycin) | 100 ml |
| Sds | 1 g |
| Dw | 900 ml |
| Transferpuffer (1000 ml) | |
| 10X TG | 100 ml |
| Methanol | 200 ml |
| Dw | 700 ml |
| Blotting-Puffer (TBST) (1000 ml) | |
| 5M NaCl | 20 ml |
| 2M Tris-HCl (pH 7,5) | 5 ml |
| 10% Tween 20 | 10 ml |
| Dw | 965 ml |
Tabelle 2. Beschreibung der Arbeitslösungen zur Isolierung von Herzzellen, Immunfärbung und Western Blotting. Bereiten Sie alle funktionierenden Lösungen kurz vor den Experimenten vor.
Ergänzende Abbildung 1. Umriss der Zellisolierung. Flussdiagramm der Isolierung von ventrikulären und vorhofialen Myozyten und kardialen Fibroblasten aus einem einzigen Herzen. Bitte klicken Sie hier, um diese Figur herunterzuladen.
Diskussion
Da das Herz sehr anfällig für Ischämie ist, sollte die Zeit, die erforderlich ist, um das Herz zu entfernen und es in eiskaltes CIB-EGTA zu tauchen, um die Kontraktion zu stoppen, so kurz wie möglich gehalten werden (<1 min). Dies ist der erste kritische Schritt dieser Methode. Der zweite kritische Schritt betrifft die Richtung des Herzens. Die besondere Ausrichtung des herausgeschnittenen Herzens in Schritt 2.1.2 erleichtert das Sehen und Entfernen des Fettes und des Bindegewebes um die Aorta. Nach der Reinigung um die Aorta herum das eingeklemmte Herz mit der vorderen Oberfläche seitlich nach oben auf die Perfusionsplatte legen. Der letzte kritische Schritt ist das Einführen der Injektionsnadel. Beim Vorrücken der Nadel in Richtung Herz sollte die Injektionsnadel nicht von der Perfusionsplatte gelöst werden, um einen konstanten Abstand zur Platte zu halten. Die Position des Einsetzens befindet sich in der Nähe der Spitze des linken Ventrikels. Führen Sie die Nadel vorsichtig ein, ohne sich zu verdrehen, da eine solche Verdrehung das Loch vergrößern kann. Die Tiefe des Einführens der Nadel kann durch Beobachten der roten Markierung abgeschätzet werden. Wenn die Nadel zu tief eingeführt wird, kann die Spitze durch das ventrikuläre Septum stechen und in den rechten Ventrikel oder durch die Mitralklappe gelangen und in den linken Vorhof gelangen. Nach der Bestätigung des Verschwindens des Blutes aus der Koronararterie sollte die Nadel mit Klebeband auf der Perfusionsplatte befestigt werden.
Eine längere Aortenlänge erschwert es, die Aorta an der richtigen Position zu klemmen. Wenn die Klemme zu weit von den Vorhöfen entfernt ist, kann sich das Herz nach der Perfusatinfusion drehen. Um dies zu verhindern, schneiden Sie die Aorta direkt unter der Brachiocephalusarterie ab, um die Aorta vor dem Klemmen zu verkürzen.
Wenn das Blut nach der Perfusion mit einer Anfangsgeschwindigkeit von 0,5 ml / min nicht zu entladen beginnt, erhöhen Sie die Geschwindigkeit auf 1 ml / min. Hilft das nicht, kann die Injektionsnadel falsch positioniert sein, etwa im rechten Ventrikel, im ventrikulären Septum oder in der linken Myokardwand. Entfernen Sie in einem solchen Fall die Nadel sofort und versuchen Sie, sie in der Nähe der Spitze des linken Ventrikels wieder einzuführen. Beim mehrmaligen Einführen der Nadel können verdaute Zellen aus den geöffneten Löchern herausfließen. Beachten Sie, dass dies die Zellisolierung normalerweise nicht ernsthaft beeinträchtigt.
Die Bediener können den gesamten Prozess der antegraden Perfusion des Herzens mit einem stereoskopischen Mikroskop überwachen, um die Veränderungen in Farbe und Transparenz und den Neustart des Schlagens der Vorhöfe zusammen mit der Verdauung zu beobachten. Insgesamt 10 ml Enzymmischung sollten das Maximum sein, das auch für ein altes Herz erforderlich ist. Bei jüngeren Herzen (5-7 Wochen alt) reduzieren wir das Volumen auf 9 ml, was dem Ansatz über retrograde Perfusion mit der gleichen Enzymmischung ähnelt.
Der Überstand bei der endgültigen Zentrifugation enthält Trümmer, Blutzellen und Nicht-Myozyten, während das Pellet hauptsächlich Kardiomyozyten und kontaminierende Nicht-Myozyten wie Fibroblasten und Endothelzellen enthält. Um die Kardiomyozyten zu reinigen, sind weitere Schritte erforderlich. Im Allgemeinen sollte das Pellet im entsprechenden Zellkulturmedium resuspendiert und für 2 h bei 37 ° C auf einer Gewebezellkulturschale vorplattiert werden, und dann die Kardiomyozyten vorsichtig durch Pipettieren und Vorplattieren für die Kultur entfernen.
Die Enzymmischung enthält eine geringe Konzentration von Ca2+ (0,3 mM). Wir inkubieren daher verdaute Zellen in CIB-Ca2+ -BSA (1,2 mMCa2+) vor der endgültigen Resuspension mit der Zellresuspensionslösung (1,8 mMCa2+), und der allmähliche Anstieg von Ca2+ vermeidet Zellschäden7. Solange die isolierten Kardiomyozyten intakt sind (Ruhezellen ohne Kontraktion), beeinträchtigt dieses Ca2+-Anpassungsverfahren die Zelllebensfähigkeit bei Mäusen nicht. Da die geschädigten Zellen während dieser Inkubation absterben, erhalten wir folglich eine gesunde Zellgruppe. In ähnlicher Weise können isolierte intakte Vorhoffyrozyten (Ruhezellen ohne unregelmäßige Kontraktion) in derselben Zellresuspensionslösung gespeichert werden. Die Vorhofmyozyten neigen jedoch dazu, im Vergleich zu den ventrikulären Myozyten empfindlicher zu speichern.
Im Labor ist diese Isolationsmethode fast immer erfolgreich, es sei denn, das Einführen der Nadel in den linken Ventrikel schlägt fehl. Es ist uns auch gelungen, Zellen aus dem hypertrophierten Herzen zu isolieren, das durch chirurgische transversale Aortenverengung hergestellt wurde. Bei gealterten Mäusen, die oft kleine Myokardinfarkte aufweisen, hört die Perfusion jedoch an einigen Stellen auf, was zu einer unvollständigen Verdauung und damit zu einer geringen Ausbeute führt (Abbildung 1C), ähnlich der Langendorff-basierten retrograden Methode. In solchen Fällen kann die verzerrte Form des Herzens bereits zu Beginn der Perfusion beobachtet werden.
Diese antegrade Perfusionsmethode ist nützlich, um Herzzellen von Mäusen unterschiedlichen Alters, aber nicht von größeren Tieren wie Kaninchen und Meerschweinchen zu isolieren. Es kann möglich sein, diese Methode vor dem Absetzen auf neonatale oder juvenile Ratten anzuwenden.
Einer der Vorteile dieser antegraden Perfusionsmethode besteht darin, dass sie die technischen Hindernisse verringert, die mit der Verwendung der Langendorff-basierten retrograden Perfusionsmethode für kleine Mausherzen verbunden sind. Die für die Perfusion erforderliche Zeit beträgt ca. 7 min mit 10 ml der Enzyme, diese kurze Verdauungszeit erhöht die Lebensfähigkeit der Zellen. Darüber hinaus ermöglicht es die Perfusion durch die Koronarzirkulation des Herzens, auch nachdem die Aortenklappen verdaut wurden. Die Isolierung von Vorhoffyozyten erfordert in der Regel eine retrograde Perfusion auf Langendorff-Basis und eine weitere Inkubation mit Enzymen17. Dieser antegrade Perfusionsansatz kann jedoch das Gewebe tief mit dem Enzym durchdringen, um Vorhoffyozyten zu isolieren.
In Experimenten mit mehreren Mäusen sollte das Langendorff-Gerät gereinigt werden, bevor das nächste Herz durchschnundt wird. Bei der vorliegenden antegraden Methode kann jedoch, solange die gewünschte Anzahl von Instrumentensätzen (z. B. Spritzennadeln und Perfusionsplatten) im Voraus vorbereitet wird, die Perfusion kontinuierlich durchgeführt werden.
Wir berichten hier über die grundlegende Methodik der antegraden Perfusion des Mausherzes mit den gleichen Lösungen wie die Langendorff-basierte retrograde Perfusionsmethode ohne zusätzliche Chemikalien. Die Zusammensetzung des Perfusat kann an den Zweck des Experiments angepasst werden, z. B. die Verwendung eines REINIGUNGSMITTELS, das EGTA anstelle der Enzyme enthält, um ein dezellularisiertes Herzherzustellen 18.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Die Autoren danken T. Yamamoto und Y. Mori für ihre Unterstützung bei den morphologischen Experimenten. Diese Arbeit wurde durch einen Grant-in-Aid for Scientific Research (C) der Japan Society for the Promotion of Science (18K06871 bis M.O.K. und 17K08536 bis H.M.) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Amphotericin B | Wako Pure Chemical Industries, Japan | ||
| Alexa Fluor 488 anti-mouse IgG antibody | Molecular Probes, USA | A11001 | Fluorescent-labeled secondary antibody. (1:400 dilution for immunostaining) |
| Anti-α-actinin (ACTN) | Sigma-Aldrich, USA | A7811 | Mouse monoclonal antibody (clone EA-53). (1:400 dilution for immunostaining) |
| Anti-atrial natriuretic peptide (ANP) | Merck-Millipore, USA | AB5490-I | Rabbit polyclonal antibody (1:2000 dilution for Western blots) |
| Anti-Glyceraldehyde 3-phosphate dehydrogenase (GAPDH) | Cell Signaling Technology, USA | 2118 | Mouse monoclonal antibody (1:10000 dilution for Western blots) |
| Anti-smooth muscle actin (SMA) | Dako, Denmark | M0851 | Mouse monoclonal antibody (clone 1A4) (1:400 for immunostaining) |
| Anti-rabbit IgG antibody | Amersham, GE Healthcare, USA | NA934 | Secondary antibody (1:10000 dilution for Western blots) |
| ATP disodium salt | Sigma-Aldrich, USA | A26209 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich, USA | A9418 | |
| Cell-Tak | Corning | 354240 | Biological material for adhesion of the cell or tissues |
| Chemi-Lumi One Super | Nacalai Tesque, Japan | 02230-14 | Chemiluminescent reagent used for western blotting. |
| Collagenase Type 2 | Worthington Biochemicals, USA | LS004176 | Choose the activity guaranteed to be greater than 300 unit/mg. |
| Complete Mini | Roche, Germany | 11836153001 | A mixture of several protease inhibitors. |
| 4'6'diamidino-2-phenylindole (DAPI) | Nacalai Tesque, Japan | 11034-56 | Used for cell-impermeant nuclear stainig |
| Dulbecco's Modified Eagle's Medium (DMEM) | Nacalai Tesque, Japan | 08458-45 | including 4.5 g/L gluose |
| Extension tube | Top, Japan | X1-50 | Connect with syringe and injection needle for antegrade perfusion. |
| EPC-8 patch-clamp amplifier | HEKA, Germany | ||
| Fetal bovine serum (FBS) | Sigma-Aldrich, USA | F7524-500ML | |
| Glass capillaries | Narishige Scientific Instrument Lab., Japan | outside diameter 1.5 mm, inside diameter 0.9 mm | |
| GTP lithium salt | Sigma-Aldrich, USA | G5884 | |
| Horizontal microelectrode puller | Germany) | P-97 | |
| Heater mat | Natsume Seisakusho, Japan | KN-475-3-40 | Equipment to warm the perfusion plate. |
| Infusion pump | TERUMO, Japan | TE-311 | Infusion syringe pump for antegrade perfusion. |
| Injeciton needle (27 gauge) | TERUMO, Japan | NN-2719S | Needle for insertion into the left ventricle. |
| Insulin (from bovine pancrease) | Sigma-Aldrich, USA | I5500 | Dissolve in 0.1 M HCl. |
| Mini cordless grinder | Funakoshi, Japan | cG-4A | Small grinder for homogenizing tissue in 1.5 mL sample tube. |
| 4%-Paraformaldehyde Phosphate Buffer solution (4% PFA) | Nacalai Tesque, Japan | 09154-85 | |
| Penicillin G potassium | Nacalai Tesque, Japan | 26239-84 | |
| Phenol Red | Nacalai Tesque, Japan | 26807-21 | |
| 10X Phosphate Buffered Saline (pH7.4) (10X PBS) | Nacalai Tesque, Japan | 27575-31 | |
| Plastic multi-well culture plate | Falcon, USA | 353226 | Use the lid of the multi-well culture plate as the perfusion plate. |
| Plastic syringe (20 mL) | TERUMO, Japan | SS-20ES | Use for infusion of CIB-EGTA. |
| Plastic syringe (30 mL) | TERUMO, Japan | SS-30ES | Use for infusion of Enzyme-mix |
| Plastic transfer pipette | Sarstedt, Germany | 86.1171 | Cut the tip just before sucking mouse heart into the pipette. |
| Polyvinylidene difluoride (PVDF) membrane | Merck-Millipore, USA | IPVH00010 | Immobilin-P membrane (Transfer membrane for protein blotting) |
| Protease | Sigma-Aldrich, USA | P5147 | A mixture of three or more proteases including extracellular serine protease. |
| 4X Sample buffer solution | Fuji Film, Japan | 198-13282 | Contains 0.25 M Tris-HCl (pH 6.8), 8 w/v% SDS,40 w/v% Glyceroland 0.02 w/v% BPB |
| SDS polyacrylamide gel (15%) | Fuji Film, Japan | 193-14991 | |
| Streptomycin sulfate | Nacalai Tesque, Japan | 32237-14 | |
| 10X Tris-Glycine buffer solution (10X TG) | Nacalai Tesque, Japan | 09422-81 | Contains 0.25 M-Tris and 1.92 M-Glycine, (pH 8.3) |
| Trypsin | Sigma-Aldrich, USA | T8003 | Trypsin from bovine Type 1. |
| Vascular clamp | Karl Hammacher GmbH, Germany | HSE 004-35 | Small straight vascular clamp used for clamping aorta. |
| All other reagents | Nacalai Tesque, Japan |
Referenzen
- Langendorff, O. Untersuchungen am überlebenden Säugethierherzen. Pflügers Archiv: European Journal of Physiology. 61, 291-332 (1898).
- Berry, M. N., Friend, D. S., Scheuer, J. Morphology and metabolism of intact muscle cells isolated from adult rat heart. Circulation Research. 26 (6), 679-687 (1970).
- Powell, T., Terrar, D. A., Twist, V. W. Electrical properties of individual cells isolated from adult rat ventricular myocardium. Journal of Physiology. 302, 131-153 (1980).
- Joshi-Mukherjee, R., et al. Structural and functional plasticity in long-term cultures of adult ventricular myocytes. Journal of Molecular and Cellular Cardiology. 65, 76-87 (2013).
- Benndorf, K., Boldt, W., Nilius, B. Sodium current in single myocardial mouse cells. Pflügers Archiv: European Journal of Physiology. 404 (2), 190-196 (1985).
- Zhou, Y. Y., et al. Culture and adenoviral infection of adult mouse cardiac myocytes: methods for cellular genetic physiology. American Journal of Physiology-Heart and Circulatory Physiology. 279 (1), 429-436 (2000).
- Shioya, T. A simple technique for isolating healthy heart cells from mouse models. Journal of Physiological Sciences. 57 (6), 327-335 (2007).
- Fiset, C., Clark, R. B., Larsen, T. S., Giles, W. R. A rapidly activating sustained K+ current modulates repolarization and excitation-contraction coupling in adult mouse ventricle. Journal of Physiology. 504, 557-563 (1997).
- Ackers-Johnson, M., et al. A Simplified, Langendorff-Free Method for Concomitant Isolation of Viable Cardiac Myocytes and Nonmyocytes From the Adult Mouse Heart. Circulation Research. 119 (8), 909-920 (2016).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal to aged mice. Physiological Reports. 6 (9), 13688 (2018).
- Sambrano, G. R., et al. Navigating the signalling network in mouse cardiac myocytes. Nature. 420 (6916), 712-714 (2002).
- Limana, F., et al. bcl-2 overexpression promotes myocyte proliferation. Proceedings of the National Academy of Sciences of the United States of America. 99 (9), 6257-6262 (2002).
- Santiago, J. J., et al. Cardiac fibroblast to myofibroblast differentiation in vivo and in vitro: expression of focal adhesion components in neonatal and adult rat ventricular myofibroblasts. Developmental Dynamics. 239 (6), 1573-1584 (2010).
- Chistiakov, D. A., Orekhov, A. N., Bobryshev, Y. V. The role of cardiac fibroblasts in post-myocardial heart tissue repair. Experimental and Molecular Pathology. 101 (2), 231-240 (2016).
- Omatsu-Kanbe, M., Matsuura, H. A novel type of self-beating cardiomyocytes in adult mouse ventricles. Biochemical and Biophysical Research Communications. 381 (3), 361-366 (2009).
- Shan, D., Marchase, R. B., Chatham, J. C. Overexpression of TRPC3 increases apoptosis but not necrosis in response to ischemia-reperfusion in adult mouse cardiomyocytes. American Journal of Physiology. 294 (3), 833-841 (2008).
- Nakamura, H., et al. Presence and functional role of the rapidly activating delayed rectifier K(+) current in left and right atria of adult mice. European Journal of Pharmacology. 649 (1-3), 14-22 (2010).
- Milgroom, A., Ralston, E. Clearing skeletal muscle with CLARITY for light microscopy imaging. Cell Biology International. 40 (4), 478-483 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten