Method Article
שיטת זלוף Antegrade לבידוד קרדיומיוציטים מעכברים
In This Article
Summary
פיתחנו שיטה פישוטe לבידוד תאי לב בודדים באיכות גבוהה על ידי טכניקת זלוף antegrade. שיטה זו היא נטולת לנגנדורף ושימושית לבידוד מיוציטים חדריים ופרונליים או תאים ביניים, כגון פיברובלסטים לבביים או אבות.
Abstract
במחקר בסיסי באמצעות לב העכבר, בידוד קרדיומיוציטים בודדים קיימא הוא צעד טכני חיוני להתגבר. באופן מסורתי, בידוד קרדיומיוציטים מארנבים, שרקנים או חולדות בוצע באמצעות זלוף מדרדר של הלב עם אנזימים באמצעות מנגנון Langendorff. עם זאת, רמה גבוהה של מיומנות נדרשת כאשר שיטה זו משמשת עם לב עכבר קטן. שיטת זלוף antegrade שאינו משתמש במנגנדורף מנגנון דווח לאחרונה לבידוד של קרדיומיוציטים העכבר. אנו מדווחים בזאת פרוטוקול מלא עבור זלוף antegrade משופר של הלב שנכרת כדי לבודד תאי לב בודדים מעכברים בוגרים (8 - 108 שבועות). זלוף Antegrade מבוצע על ידי הזרקת perfusate ליד השיא של החדר השמאלי של הלב שנכרת, שאב העורקים של אשר היה מהודק, באמצעות משאבת עירוי. כל ההליכים מתבצעים על מחצלת תנור מחוממת מראש תחת מיקרוסקופ, המאפשרת ניטור של תהליכי ההזרקה והזלוף. התוצאות מראות כי מיוציטים חדריים ואקבריים, ופיברובלסטים יכולים להיות מבודדים היטב מעכבר בוגר יחיד בו זמנית.
Introduction
בדרך כלל, הצעד הראשון של בידוד תא יחיד של רקמה מנותחת כרוך טחון הרקמה לחתיכות קטנות, ואחריו העיכול של רקמת החיבור מטריצה חוץ תאית עם אנזימים. עם זאת, לא ניתן לבודד קרדיומיוציטים בשיטת חיתוך כזו, שכן העשרה ברכיבי מטריצה חוץ-תאית, כולל סיבי קולגן ואלסטין, הופכת את שריר הלב לקשה מדי לטחון, והקרדיומיוציטים רגישים מאוד להיפוקסיה ולשינויים אחרים במיקרו-וירוס. לכן, באמצעות מערכת זלוף מדרדר מבוסס Langendorff1, שיטה לעיכול המטריצה חוץ תאית עם אנזימים פותחה כדי לבודד קרדיומיוציטים בודדים מהלב2,3,4.
בדגמי עכבר, זלוף מדרדר מבוסס Langendorff של הלב עם אנזימים משמש גם לבידוד של קרדיומיוציטים בודדים5,6,7,8. עם זאת, הכנרת של סיומת העכבר הקטנה והדקה וההרכבה שלה על מנגנון לנגנדורף לביצוע זלוף מדרדר דורשת רמה גבוהה של מיומנות, שכן קוטר העורקים בלב הבוגר הוא כ -1.2 מ"מ. יתר על כן, זה לוקח זמן לבצע ניסויים מרובים כמו מנגנון Langendorff יש לנקות לפני זלוף הלב הבא.
כחלופה זלוף מדרדר, שיטה חדשנית לבידוד cardiomyocytes מלב עכבר בוגר ללא מנגנון Langendorff פותחה. שיטה זו לייצור עידן התבססה על זלוף אנגרד של העורקים הכליליים9. לאחרונה שיפרנו כל שלב בפרוטוקול antegrade זה, כגון הידוק של העורקים, החדרת מחט ובקרת טמפרטורה, וניטרנו את כל הליכי הזלוף במיקרוסקופ10. אנו מדווחים בפירוט על עידון שיטת זלוף זו כדי לקצר את זמן הבידוד ולספק סרטון משלים. בשיטה זו, זלוף הלב לוקח בערך 7 דקות עם 10 מ"ל של האנזימים, ותקופת עיכול קצרה זו מגבירה את הכדאיות של התאים. זוהי שיטה פשוטה לבודד תאי לב בודדים באיכות גבוהה ללא צורך בתוספת של כימיקלים, כגון 2,3-butanedione monoxime (BDM)6,11 או טאורין5,8. אנו מאמינים כי שיטה זו תוריד את סף המיומנות של הטכניקה ולשפר את התועלת של קרדיומיוציטים העכבר במחקר בסיסי.
Protocol
כל הניסויים בבעלי חיים התאימו למדריך לטיפול ולשימוש בחיות מעבדה שפורסם על ידי המכונים הלאומיים לבריאות בארה"ב (פרסום NIH מס ' 85-23, תוקן בשנת 1996) ואושרו על ידי ועדת הביקורת המוסדית של אוניברסיטת שיגה למדעי הרפואה טיפול בבעלי חיים ושימוש בוועדה (אושר מס '2019-3-7). השיטות בוצעו בהתאם להנחיות שאושרו.
1. מכשירים ופתרון
הערה: חלוקה לרמות של ההליך הניסיוני מודגמת בדיאגרמת זרימה (איור משלים 1). משאבת עירוי (או משאבת מזרק) יש להשתמש עבור זלוף antegrade של הלב עם זרימה חד כיוונית. משאבה פריסטלית שיוצרת זרימה פועמת אינה מומלצת.
- לפני הניסוי
- סמן את מחט ההזרקה באתר כ 3 מ"מ מהקצה עם לק. לאחר שתאפשר לו את האוויר יבש, לשמור אותו במיכל בטמפרטורת החדר. צבע אדום או בהיר רצוי לאשר את עומק הכניסה לתוך שריר הלב במהלך זלוף.
- הפוך את הלב לעמוד על ידי חיתוך העפעפיים של 1.5-, 0.5- ו 0.2 מ"ל צינורות מדגם וחיבורי העפעפיים לתחתית צלחת תרבות 60 מ"מ עם סרט דו צדדי או דבק. קיבוע של שלושה מכסים בגדלים שונים בצלחת אחת מאפשר לבחור את המכסה המתאים בהתאם לגודל לב העכבר. ניתן לעשות שימוש חוזר בדוכן לב זה לאחר הכביסה.
- בצע פתרון מלאי כפי שמוצג בטבלה 1. אחסן את פתרונות המלאי ב- 4 °C (69 °F).
- ביום הניסוי
הערה: מאגר בידוד תאים (CIB) מכיל (ב mM) 130 NaCl, 5.4 KCl, 0.5 MgCl2, 0.33 NaH2PO4, 22 גלוקוז, 40 יחידות / מ"ל אינסולין ו 25 HEPES (pH מותאם 7.4 עם NaOH); ותמיסת Tyrode מכילה (ב mM) 140 NaCl, 5.4 KCl, 1.8 CaCl2, 0.5 MgCl2, 0.33 NaH2PO4, 5.5 גלוקוז ו 5.0 HEPES (pH מותאם 7.4 עם NaOH).- הכינו את הסי.איי.אי. חם 160 מ"ל של מים מזוקקים (DW) באמצעות מיקרוגל סביב 32 מעלות צלזיוס ולאחר מכן להוסיף 20 מ"ל של 10X CIB. לאחר תוספת של 0.79 גרם גלוקוז ו 10 μL של פתרון אינסולין, להתאים את ה- pH באמצעות 1 M NaOH ולהביא 200 מ"ל עם DW.
- מכינים את תמיסת תערובת האנזימים (תערובת אנזימים). הוסף 30 מ"ג של קולגנאז, 1.8 מ"ג של טריפסין, 1.8 מ"ג פרוטאז ו 90 μL של 100 מ"מ CaCl2 פתרון מלאי ל 30 מ"ל של CIB (ריכוז Ca2 + הסופי הוא 0.3 מ"מ), לערבב, ולשמור אותו על קרח. בעכברים <4 שבועות, להפחית טריפסין ופרוטאז ל 0.9 מ"ג10. חם ב 37 מעלות צלזיוס באמבט מים לפני השימוש.
- הכן את פתרון CIB-Ca2+-BSA. הוסף 30 מ"ג BSA ו 90 μL של 100 מ"מ CaCl2 פתרון מלאי ל 15 מ"ל של CIB (ריכוז Ca2 + הסופי הוא 1.2 מ"מ), לערבב, לסנן דרך מסנן 20 מיקרומטר, ולשמור אותו על קרח.
- הכן את פתרון CIB-EGTA. לאחר ביצוע הפתרונות המתוארים בשלבים 1.2.2 ו 1.2.3, להוסיף 400 mM EGTA פתרון מניית CIB הנותרים בדילול 1:1000 (ריכוז EGTA הסופי הוא 0.4 מ"מ), ומערבבים. מלאו את מנת התרבות 35 מ"מ ואת צלחת הדוכן בלב עם CIB-EGTA ושמרו אותם על הקרח.
- יוצקים כ 20 מל של CIB-EGTA לתוך זכוכית 30 מל ולעמוד פיפטה העברת פלסטיק בכומתה, שמירה אותו על קרח.
- הכינו את פתרון טיירוד. הוסף 100 מ"ל של 10X Tyrode ל 800 מ"ל של DW ולחמם אותו באמצעות מיקרוגל סביב 32 °C (60 °F). לאחר הוספת 0.99 גרם של גלוקוז ו 1.8 מ"ל של 1 M CaCl2, להתאים את ה- pH באמצעות 1 M NaOH ולהביא 1000 מ"ל עם DW.
- הכן את פתרון ההשעיה מחדש של התא. הוסף 30 מ"ג של BSA ו 300 μL של אנטיביוטיקה 50X ל 15 מ"ל של פתרון Tyrode.
- הכינו מזרקים. מלאו את המזרק של 20 מ"ל המחובר לצינור ההרחבה הגמיש ומחט ההזרקה המסומנת עם CIB-EGTA. ממלאים את המזרק 30 מ"ל עם תערובת אנזימים מחוממת. החזק את שניהם ב 37 מעלות צלזיוס עד ממש לפני השימוש.
- הכינו את צלחת הזלוף. מחממים את מחצלת החימום תחת מיקרוסקופ סטריאוסקופי. מניחים את צלחת הזלוף (מכסה של צלחת תרבות רב-באר) על מחצלת החימום שלפני המלחמה. מחממים את מלחצי כלי הדם על ידי הצבתו בצלחת הזלוף עד לשימוש. מניחים את צלחת התרבות 60 מ"מ עבור pipetting ואת מסננת התא על מחצלת תנור מראש גם כן.
2. זלוף אנגרד של לב העכבר
הערה: פיפטה העברת פלסטיק המשמש למצוץ את הלב צריך להיות רך ולא להיות מחודד בחדות לכיוון הקצה. בחר מהדק כלי דם קטן עם serration. המכשירים המומלצים מפורטים בטבלת החומרים.
- כריתת לב העכבר והידוק העורקים
הערה: העכברים הבוגרים (>8 שבועות) צריך להיות מורדם על ידי מנת יתר של נתרן pentobarbital (>300 מ"ג / קילוגרם, תוך-אישית [i.p.] הזרקה) עם הפרין (8000 יחידה / קילוגרם).- בלו את לב העכבר במהירות על ידי מציצה.
- פתח את חלל בית החזה במהירות כדי לחשוף את הלב. חותכים את פיפטה העברת פלסטיק, קצה אשר בערך באותו גודל כמו, או מעט קטן יותר, הלב החשוף (בדרך כלל באתר כ 1 ס"מ מן סימן 0.5-mL לכיוון הקצה, אבל זה תלוי בגודל הלב).
- למצוץ את הלב לתוך פיפטה, להעלות את פיפטה כדי ליצור מספיק מקום כדי להכניס מספריים, ובלה את הלב עם מספריים מעוגלים מהצד הגבי, הימנעות מפגיעה atria.
- מעבירים מיד את הלב שנכרת אל הזכוכית 30 מל המכילה CIB-EGTA מקורר קרח כדי לעצור את ההתכווצות. הליך זה נמשך בדרך כלל <1 דקות.
- ניקוי סביב העורקים
- מעבירים את הלב לצלחת תרבות של 35 מ"מ מלאה ב- CIB-EGTA מקורר קרח ומסירים את הריאה ורקמות גלויות אחרות, ולאחר מכן מעבירים את הלב המנוקה בגסות לדוכן הלב המלא ב- CIB-EGTA מצונן ומניחים אותו עם השיא למטה.
- תחת המיקרוסקופ הסטריאוסקופי, להסיר את השומן ואת רקמות החיבור כדי לנקות סביב העורקים. אם אורך אבי העורקים החתוכים ארוך מדי כולל העורק הברכיוצפלי, עורק העורק הראשי המשותף השמאלי או העורק התת-קלבי השמאלי, חותכים את אבי העורקים ממש מתחת לעורק הברכיוסקפלי כדי לקצר אותו כדי להמשיך לשלב הבא. הליך זה נמשך בדרך כלל כ- 4 דקות.
- מהדקים את העורקים ומניחים את הלב המהדק על צלחת הזלוף
- מתחת למיקרוסקופ, הנח את הלב בדוכן הלב. המפעיל צריך להתמודד עם פני השטח של הלב, להרים את קצה העורקים עם פינצטה, ולהדק את העורקים ליד האטריה עם מהדק כלי דם קטן תוך דחיפה בעדינות על העורקים קצת.
- מניחים את הלב מהודק על צלחת זלוף עם הצד החיצוני למעלה, ולאחר מכן לכסות אותו עם כמה טיפות של CIB-EGTA כדי למנוע ממנו להתייבש. הליך זה נמשך בדרך כלל <20 שניות.
- בלו את לב העכבר במהירות על ידי מציצה.
- זלוף אנגרד של הלב
הערה: ראשית, להחדיר את הלב עם CIB-EGTA לפרוק דם ולמנוע קרישה.- הכנס את מחט ההזרקה ולהתחיל זלוף לפרוק דם
- הגדר את המזרק 20 מ"ל מלא CIB-EGTA מראש מחובר צינור הארכה גמיש מחט הזרקה מסומן על משאבת עירוי. התחל את המשאבה בקצב איטי של 0.5 מ"ל / דקה כדי למלא בזהירות את המחט ואת הצינור עם CIB-EGTA הקפד למנוע כל אוויר מלהיכנס לצינור.
- מניחים את מחט ההזרקה על צלחת הזלוף עם הצד הקצר יותר של הצורה האלכסונית מלפנים. החלק את המחט לכיוון פסגת הלב עד שהיא נוגעת בו, ולאחר מכן בזהירות להכניס את המחט ליד השיא של החדר השמאלי לתוך החדר מבלי לסובב. אין לנתק את המחט מהצלחת בעת ביצוע החדרה.
- צפה בסימן האדום כדי להעריך את עומק החדרת המחט. כאשר החדרת המחט הושלמה, דם זורם מן העורק הכלילי צריך להתחיל להשתחרר.
- לתקן את מחט ההזרקה על הצלחת עם קלטת, ולהגדיל את מהירות המשאבה ל 1 מ"ל / דקה. הליך זה בדרך כלל לוקח בערך 30 s. אם הלב הוא perfused בהצלחה, את זרימת CIB-EGTA נימי ממש מתחת epicardium ניתן לראות תחת המיקרוסקופ.
- זלוף הלב עם תערובת אנזימים
הערה: במהלך זלוף אנזימטי, ניתן לפקח על עומק המחט שהוכנסה על ידי בדיקת הסימן האדום על המחט.- לאחר perfusing 2-3 מ"ל של CIB-EGTA לפרוק דם לחלוטין מן העורק הכלילי, לשנות את perfusate לתערובת אנזימים. הימנעו מלאפשר לבועות אוויר להיכנס לצינור. בדוק את זרימת תערובת האנזימים, וודא כי מחט ההזרקה לא יצאה על ידי בדיקת המיקום של הסימן האדום.
- לאחר 1-2 מ"ל כבר perfused, להגדיל את מהירות המשאבה ל 1.5 מ"ל / דקה. הסר את perfusate שנצבר המכיל דם שזרם מהלב עם פיפטה מעת לעת.
הערה: עם הזמן, קיר שריר הלב יהפוך שקוף במקומות מסוימים ונראה מנומר, וזה סימן לעיכול של המטריצה החוץ תאית בעקבות זלוף מוצלח. סימן נוסף הוא הפעלה מחדש של מכות בין-מדינתיות הנגרמות על ידי נוכחות של Ca2+ בתמהיל האנזימים. - עצור זלוף כאשר הנפח הכולל של תערובת האנזימים perfused הוא 10 מ"ל.
- הכנס את מחט ההזרקה ולהתחיל זלוף לפרוק דם
3. בידוד של תאי לב בודדים
- ניתוק תאי לב
- לאחר זלוף עם תערובת האנזימים, מעבירים 10 מ"ל מתערובת האנזימים שנותרה במזרק לתבשיל תרבות של 60 מ"מ המונח על מחצלת החימום ומוסיפים 20 מ"ג BSA (0.2% BSA בתמהיל האנזימים). אבקת BSA ירד צריך להתמוסס מיד על ידי מערבולת בעדינות עם יד. הסר את מחט ההזרקה ואת מהדק כלי הדם מהלב.
- מפרידים את החדרים ואת atria ומעבירים כל אחד לתערובת האנזימים בתוספת 0.2% BSA על מחצלת התנור.
- בידוד מיוציטים חדריים
- תפוס את epicardium עם שני פינצטה, בעדינות לקרוע ולמשוך את החדרים מצד לצד בתמהיל האנזים בתוספת 0.2% BSA לחתיכות קטנות. לפזר את התאים עם pipetting עדין (כ 30 פעמים).
- לסנן את הפסולת מעוכל דרך מסננת תא רשת 100-μm, ולהעביר את הסינון לצינור צנטריפוגה 15-mL עבור צנטריפוגה ב 50 × g במשך 3 דקות. Resuspend את הקרדיומיוציטים גלולה ב CIB-Caמראש-Ca 2 +-BSA פתרון, לדגור אותו במשך 5 דקות ב 37 מעלות צלזיוס, ולאחר מכן צנטריפוגה זה ב 14 × גרם במשך 3 דקות.
- התחדשו עם הקרדיומיוציטים האחרונים בתמיסת ההשעיה מחדש של התא (הרכב מופיע בטבלה 2)והחזיקו אותו ב-37°C.
- בידוד מיוציטים בין-מדינתיים
- במהלך הצנטריפוגה הסופית לשבר מיוציטים חדריים בשלב 3.2, להתחיל לבודד את מיוציטים פרזדורי. להעביר את atria, מאוחסן כמו בשלב 3.1, לתמיסת CIB-Ca2 +-BSA מראש, לקרוע אותו לחתיכות לנתק את התאים על ידי pipetting עם קצה פיפטה ב 10 μL על מחצלת התנור.
- צנטריפוגה תערובת התא ב 14 × גרם במשך 3 דקות ו resuspend את התאים הפטרונית גלולות עם פתרון ההשעיה מחדש של התא.
- בידוד ותרבות של פיברובלסטים לבביים
- להעביר את supernatant מן הצנטריפוגה הראשונה בשלב 3.2 לצינור צנטריפוגה אחר 15 מ"ל, וצנטריפוגה ב 190 × g במשך 5 דקות. לשטוף את התאים מזרז פעמיים עם צנטריפוגה בינוני הנשר שונה של Dulbecco (DMEM), ולאחר מכן להשעות את התאים עם DMEM בתוספת 10% אלבומין שור עוברי (FBS) ואנטיביוטיקה.
- צלחת שבר התא הסופי בבקבוק תרבות (25 ס"מ2)ולאפשר לתאים לדבוק בחלק התחתון של הבקבוק באווירה לחה של 95% אוויר ו 5% CO2. לאחר 90 דקות דגירה, להשליך את התאים מחוברים, ולהוסיף מדיום תרבות טרי. תאים צריכים להיות קרובים למפגש לאחר כ -4 ימים, ובשלב זה הם צריכים להיות מוגברים על ידי טריפסיניזציה וזרע לתוך מנות תרבות חדשות.
4. קצירת חלבונים מאטריה ומחממים
- לאחר זלוף, להפריד את atria ואת החדרים, הומוגנית אותם מאגר תמוגזה ביחס של 10 מ"ג של משקל רקמות ל 100 μL של חיץ באמצעות מטחנה קטנה בצינור מדגם 1.5 מ"ל.
- שמור על הומוגניט בקרח במשך 40 דקות עם ערבוב מערבולת כל 10 דקות כדי לחלץ חלבונים, ולאחר מכן צנטריפוגה הצינור ב 15000 × גרם במשך 20 דקות ב 4 מעלות צלזיוס. אחסן את השבר העל-טבעי ב-80°C כמדגם חלבון.
5. חיסון של תאי לב מבודדים
הערה: יש צורך בשיתוק של קרדיומיוציטים שאינם חסידים לתחתית צלחת הדמיית התאים באמצעות דבק ביולוגי.
- הידבקות של קרדיומיוציטים מבודדים לצלחת תרבות תחתית זכוכית
- לפני תחילת בידוד התאים, מצפים את צלחת התרבות בתחתית הזכוכית בדבק ביולוגי (למשל, Cell-Tak) בהתאם להוראת היצרן, שוטפים עם DW ויבשים באוויר בטמפרטורת החדר.
- לאחר ההשעיה מחדש של הקרדיומיוציטים המבודדים בתמיסת CIB-Ca2+-BSA, שחררו את מתלה התא בתחתית הכלים מצופי הדבק, והדגירה למשך 20 דקות בטמפרטורת החדר ללא תסיסה.
- פגיעה חיסונית
- צלחת cardiomyocytes מבודד על צלחת תחתית זכוכית precoated עם דבק ביולוגי ולשמור אותו בטמפרטורת החדר במשך 40 דקות כדי לאפשר לתאים לדבוק בצלחת. תרבות פיברובלסטים לבביים במנות תרבות זכוכית תחתית.
- יש לשטוף תאים עם תמיסת מלח עם אגירת פוספט (PBS), ולתקן אותם עם 4% paraformaldehyde (PFA) במשך 5 דקות עם רועד. לשטוף את התאים הקבועים עם PBS במשך 10 דקות שלוש פעמים, ולהדגיר אותם בפתרון חסימה-חדירה במשך 60 דקות בטמפרטורת החדר עם רועד.
- יש לבדוק תאים עם נוגדן ראשוני מדולל בתמיסת חסימה-חדירה למשך 60 דקות בטמפרטורת החדר או לילה בטמפרטורה של 4 מעלות צלזיוס. לשטוף את התאים עם PBS במשך 10 דקות שלוש פעמים, ו הדגירה אז עם נוגדן משני שכותרתו פלואורסצנטי במשך 60 דקות בטמפרטורת החדר.
- לאחר שטיפת אותם שלוש פעמים עם PBS במשך 10 דקות, כתם את הגרעינים עם DAPI (1:10000 דילול PBS). נתח את אותות הפלואורסצנט באמצעות מיקרוסקופ סריקת לייזר קונפוקאלי.
6. הקלטות מהדק תיקון תא שלם
- פברק את האלקטרודות טלאי מ נימי זכוכית באמצעות משיכה מיקרואלקטרוניקה אופקית. ההתנגדות של האלקטרודה נעה בין 2 ל 4 MΩ כאשר מלא פתרון פיפט K+עשיר (טבלה 2). להעביר aliquot של קרדיומיוציטים מבודדים לתא הקלטה רכוב על הבמה של מיקרוסקופ הפוך superfused עם Tyrode בקצב של 1 מ"ל / דקה ב 36-37 מעלות צלזיוס.
- רשום פוטנציאל פעולה בשיטת המהדק המחורר עם K+- פתרון פיפטה עשיר המכיל 30 מ"ג / מ"ל amphotericin B על ידי החלת פולסים נוכחיים של 5-10 ms משך בקצב של 1 הרץ באמצעות אלקטרודה תיקון.
7. ניתוחי כתמים מערביים
- במחקר זה, לבצע ניתוח כתם מערבי של חלבונים במשקל מולקולרי קטן, כגון פפטיד פרוזדורי סמן נטריורטית (ANP).
- ממיסים את דגימת החלבון בריכוז הסופי של חיץ מדגם 1X, 2% מרקפתנול 2' ומפרקים את החלבונים למשך 60 דקות ב-37 מעלות צלזיוס. לטעון 20 מיקרוגרם של חלבון לתוך כל באר, ולבצע אלקטרופורזה במאגר ריצה עם 20 mA לכל ג'ל במשך 120 דקות.
- מעבירים את החלבון לקרום PVDF במאגר העברה ב-10 וולט למשך 40 דקות. לשטוף את הממברנה שהועברה פעמיים עם TBST במשך 5 דקות, ואז לחסום עם 5 % חלב רזה ב TBST במשך 60 דקות בטמפרטורת החדר, ולבדוק עם הנוגדן העיקרי מומס TBST לילה ב 4 מעלות צלזיוס.
- לשטוף את הממברנה 5 פעמים עם TBST במשך 7 דקות, ולהדגיר אותו עם הנוגדן המשני מדולל TBST במשך 120 דקות בטמפרטורת החדר.
- לאחר שטיפת הממברנה 5 פעמים עם TBST במשך 7 דקות, לדמיין את האותות עם בדיקת חמי-זוהר ולנתח אותם עם מנתח תמונה לומינו.
תוצאות
העיקרון של שיטה זו הוא פשוט: perfusate זורם מן התא השמאלי, שסתום אבי העורקים נפתח, ואת perfusate פועל לתוך העורק הכלילי באותו כיוון כמו ריצת הדם, שכן אבי העורקים סגור על ידי הידוק, המאפשר זלוף עמוק של שריר הלב על מנת לעכל את המטריצה החוץ תאית.
מיוציטים חדריים מבודדים זה עתה בשיטה הנוכחית מוצגים באיור 1A. איור 1B מציג תמונות מוגדלות של מיוציטים חדריים ופטריים. הליך בידוד זה הביא לתשואה גבוהה (70%-80%) של מיוציטים חדריים רגיעה בצורת מוט מעכברים בוגרים (8-10 שבועות), שהיו זמינים בתוך כ 5 שעות לאחר הבידוד (איור 1C), מרווח דומה לזה בעת שימוש בהליך המסורתי מבוסס Langendorff7. עם זאת, היחס בין תאים בני קיימא שבודדו זה עתה היה נמוך יותר בעכברים בגילאי >2 שנים (איור 1C). המספר הכולל של מיוציטים חדריים שהושגו לכל לב בוגר באמצעות פרוטוקול זה היה כ 3 x 106 תאים, אשר היה דומה לערך שדווח בעבר7,12. פוטנציאל הפעולה שנרשם במיציטים החדריים והפרוצדורניים(איור 1D)היה דומה לזה של תאים שהושגו על ידי השיטה המבוססת על לנגנדורף10. ניתוח חיסוני אישר כי המבנה הסרקוומרי של מיוציטים חדריים היה מאורגן היטב עם קרום תא גלוי בבירור (איור 2A). הקרדיומיוציטים הבודדים המבודדים בשיטה זו יכולים לשמש ישירות בניסויים, כגון ניתוח אלקטרופיזיולוגי10 או ניסוי immunostaining.
פיברובלסטים לבביים קיימים בחללים ביניים. עיכול מספיק של המטריצה החוץ תאית גורם לבידוד של תאים אלה. פיברובלסטים לב מבודדים להתרבות בתנאי תרבות ניתן לעבור מספר פעמים או מאוחסן חנקן נוזלי בתמיסת מאגר התא המתאים. איור 2B מראה כי רוב פיברובלסטים לב תרבותיים הפכו myofibroblasts במהלך תת תרבות, כפי שאושר על ידי ביטוי מוגבר של α חלקה שריר actin13,14. כמו כן, אבות הלב יכולים להיות מבודדים עם השיטה הנוכחית ותרבית במדיום התרבות המתאים, אשר מתחילים להכות באופן אוטומטי10,15.
הומוגניזציה של שריר הלב חזק לא קל, במיוחד עבור רקמת לב מעכברים בגילאי, אשר בעל כמות גדולה של סיבים חוץ תאיים. לאחר זלוף אנגרד, חלבון מן האטריה החדרים ניתן הומוגנית בקלות במאגר התמוגה עם כוח אור כדי לחלץ חלבונים. ניתוח כתמים מערבי הדגים את הביטוי הספציפי של ANP באטריה אך לא בחדרים מעכברים בוגרים (בני 20 שבועות) ומבוגרים (בני 108 שבועות)(איור 3).
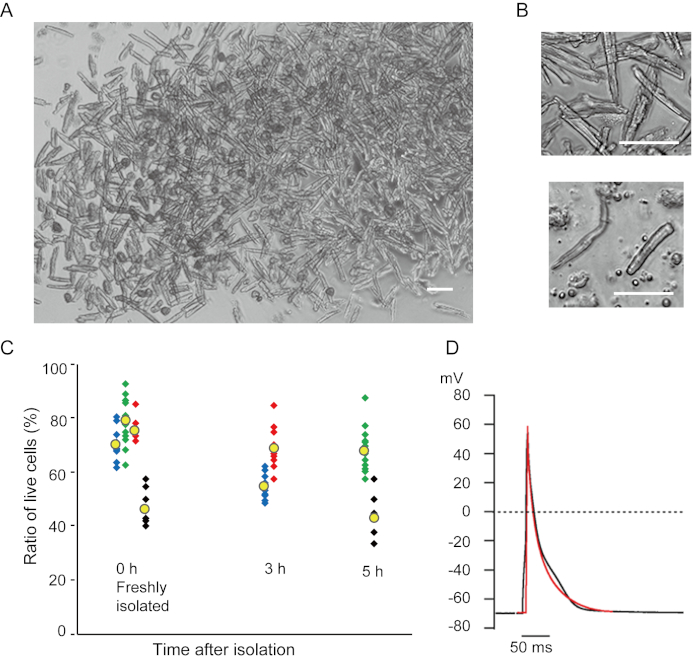
איור 1. קרדיומיוציטים מבודדים מעכברים. א. מיוציטים חדריים מבודדים זה עתה עם זלוף אנגרד, עם תמונות שנרכשו בהגדלה נמוכה. לאחר הכביסה הסופית, הקרדיומיוציטים נוצלו מחדש עם 2 מ"ל של פתרון ההשעיה מחדש של התא, 100 μL מתוכם הושלכו על צלחת התרבות בתחתית הזכוכית ויישוב התא חיכה. בר, 100 מיקרומטר.B. תמונות מוגדלות של מיוציטים חדריים מבודדים (עליון) ומיוציטים פרך (למטה). בר, 100 מיקרומטר.C. תאים מבודדים הושעו בתמיסת ההשעיה מחדש של התא ואחסנו ב 37 מעלות צלזיוס לתקופה הרצויה, ומספר מיוציטים חדריים חיים נספר ב 10-15 שדות תחת מיקרוסקופ. תאים מעוגלים נחשבו לפצועים או מתיםבאופן בלתיהפיך 16 . סמלים ירוקים, כחולים ואדומים התקבלו מ-3 עכברים בגיל 8-10 שבועות, וסמלים שחורים היו מעכבר בן 106 שבועות. סימן צהוב מציין את הממוצע של כל קבוצה. ד. פוטנציאל פעולה מייצג שנרשם ממיוציטים חדריים (שחורים) ופסוליים (אדומים) של 8-10 עכברים. הנתונים התקבלו מהתאים כ 3 שעות לאחר הבידוד. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
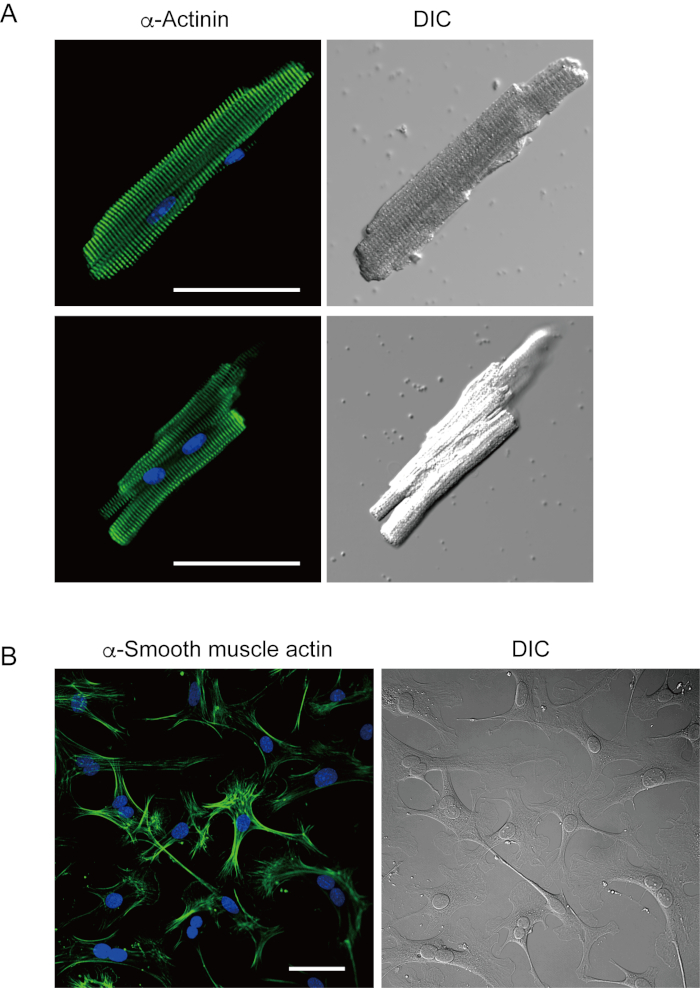
איור 2. חיסון עבור α-actinin ב myocytes חדרי עכבר מבודדים α חלקה שרירים actin פיברובלסטים לב עכבר בתרבית. א. מיקרוסקופיית סריקת לייזר קונפוקלית של אימונוסטיין עבור α-אקטין (ירוק), כתמי DAPI עבור גרעינים (כחול) ותמונת DIC של מיוציטים חדריים מבודדים מלב העכבר עם זלוף אנגרד. בר, 50 מיקרומטר.B. Immunostaining עבור α חלקה שריר actin (ירוק), כתמי DAPI עבור גרעינים (כחול) ותמונה DIC של פיברובלסטים לב מבודדים מלב העכבר עם זלוף antegrade. פיברובלסטים לבביים היו תרבותיים במשך ארבעה ימים. בר, 100 מיקרומטר.
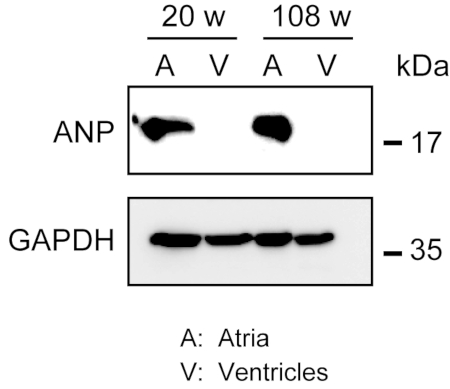
איור 3. ניתוחי כתמים מערביים של ANP באטריה ובחמלים. ניתוחי כתמים מערביים עבור פפטיד נטריורטיק סמן סמן פרך (ANP) ב atria (A) ו ventricles (V) מוכן ממבוגר (20 שבועות) ומעלה (108 שבועות) לבבות. ANP נוכח באטריה אך נעדר בחדרים. השתמש גליצרלדהיד 3-פוספט דהידרוגנאז (GAPDH) כמו חלבון שליטה בית שמירה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| פתרונות מלאי לבידוד תאי לב | |
| 10X CIB (500 מ"ל) | |
| נקלה (נקל) | 37.99 גרם |
| KCI | 2.01 גרם |
| 1 M MgCl2 | 2.5 מ"ל |
| NaH2PO4 | 0.23 גרם |
| היפס (היפס) | 29.79 גרם |
| DW | מילוי עד 500 מ"ל |
| 100 מ"מ CaCl2 תפוגת מניות | |
| CaCl2 | 100 מ"ר |
| פתרון מניית EGTA של 400 מ"מ | |
| EGTA (EGTA) | 400 מ"ר |
| פתרון אינסולין | |
| אינסולין | יחידה אחת/מ"ל ב- 0.1 M HCl |
| 50X פתרון מלאי אנטיביוטיקה (20 מ"ל) | |
| פניצילין | 100 מ"ג |
| סטרפטומיצין | 100 מ"ג |
| פנול אדום | 1.5 גרם |
| DW | 20 מ"ל וחיטוי באמצעות סינון |
| פתרון 10X Tyrode (1000 מ"ל) | |
| נקלה (נקל) | 81.82 גרם |
| KCl | 4.03 גרם |
| 1 M MgCl2 | 5 מ"ל |
| NaH2PO4 | 0.47 גרם |
| היפס (היפס) | 11.92 גרם |
| נאוה | 0.8 גר' |
| DW | מילוי עד 1000 מ"ל |
| סולוטין מלאי לחיסון | |
| מלאי DAPI | |
| DAPI | 2 מ"ג/מ"ל במתנול |
| פתרונות מלאי עבור כתמים מערביים | |
| מאגר HEPES (100 מ"ל) | |
| נקלה (נקל) | 0.88 גרם |
| 400 מ"מ אגטה | 0.25 מ"ל |
| היפס (היפס) | 0.24 גרם |
| 1M נאוה | התאמת pH ל- 7.4 |
| DW | מילוי עד 500 מ"ל |
| קוקטייל מעכבי פרוטאז | |
| מיני שלם | טאבלט אחד |
| DW | 0.4 מ"ל |
שולחן 1. תיאור פתרונות המלאי. שמור על פתרונות מלאי ב 4 °C (69 °F). מעכבי פרוטאז Aliquot קוקטייל לאחסון ב -20 מעלות צלזיוס.
| פתרונות לבודד תאי לב | |
| CIB (200 מ"ל) | |
| 10X CIB | 20 מ"ל |
| פתרון אינסולין | 0.01 מ"ל |
| גלוקוז | 0.79 גרם |
| 1M נאוה | התאמת pH ל- 7.4 |
| DW | מילוי עד 200 מ"ל |
| תמיסת תערובת אנזימים (30 מ"ל) | |
| סוג קולגנאז2 | 30 מ"ג |
| טריפסין (נסיון) | 1.8 מ"ג (1.8 מ"ג) |
| פרוטאז | 1.8 מ"ג (1.8 מ"ג) |
| פתרון מניות CaCl2 של 100 מ"מ | 0.09 מ"ל |
| CIB | 30 מ"ל |
| CIB-Ca2+-BSA (15 מ"ל) | |
| BSA | 30 מ"ג |
| פתרון מניות CaCl2 של 100 מ"מ | 0.18 מ"ל |
| CIB | 15 מ"ל |
| CIB-אגטה (150 מ"ל) | |
| פתרון מניית EGTA של 400 מ"מ | 0.150 מ"ל |
| CIB | 150 מ"ל |
| פתרון טיירוד (1000 מ"ל) | |
| פתרון מניית טיירוד 10X | 100 מ"ל |
| גלוקוז | 0.99 גרם |
| 1M CaCl2 | 1.8 מ"ל |
| 1M נאוה | התאמת pH ל- 7.4 |
| DW | מילוי עד 1000 מ"ל |
| פתרון שימוש חוזר בתאים (15 מ"ל) | |
| BSA | 30 מ"ג |
| פתרון מלאי אנטיביוטיקה 50X | 0.3 מ"ל |
| פתרון טיירוד | 15 מ"ל |
| פתרונות לחיסון | |
| פתרון דבק תא (0.3 מ"ל) | |
| תא-טאק | 0.01 מ"ל |
| 0.1 M נהקו3 (עמ' 8.0) | 0.285 מ"ל |
| 0.1 מ' נאוה | 0.005 מ"ל |
| פתרון חסימה-פרמביליזטין (10 מ"ל) | |
| סרום שור עוברי | 1 מ"ל |
| טריטון X-100 | 1 מ"ל |
| פי 10 PBS | 1 מ"ל |
| DW | 7 מ"ל |
| K+ פתרון פיפטה עשיר | |
| אשלגן אספרטט | 70 מ"מ |
| KCl | 50 מ"מ |
| KH2PO4 | 10 מ"מ |
| MgSO4 | 1 מ"מ |
| מלח דיסודיום ATP | 3 מ"מ |
| מלח ליתיום GTP | 0.1 מ"מ |
| EGTA (EGTA) | 5 מ"מ |
| היפס (היפס) | 5 מ"מ |
| קו ה- KOH | ה-pH מותאם ל-7.2 |
| פתרונות כתמים מערביים | |
| מאגר תמוגה (1 מ"ל) | |
| מאגר HEPES | 0.86 מ"ל |
| לא אידיט-P40 | 0.1 מ"ל |
| קוקטייל מעכבי פרוטאז | 0.04 מ"ל |
| מאגר הפעלה (1000 מ"ל) | |
| 10X TG (0.25 מטר טריס ו-1.92 מ' גליצין) | 100 מ"ל |
| SDS (SDS) | 1 גרם |
| DW | 900 מ"ל |
| מאגר העברה (1000 מ"ל) | |
| 10X TG | 100 מ"ל |
| מתנול (רתנול) | 200 מ"ל |
| DW | 700 מ"ל |
| מאגר סופג (TBST) (1000 מ"ל) | |
| 5M NaCl | 20 מ"ל |
| 2M טריס-HCl (עמ' 7.5) | 5 מ"ל |
| 10% טווין 20 | 10 מ"ל |
| DW | 965 מ"ל |
שולחן 2. תיאור פתרונות העבודה לבודד תאי לב, חיסונים וכתמים מערביים. הכינו את כל פתרונות העבודה ממש לפני הניסויים.
איור משלים 1. קו המתאר של בידוד התא. תרשים זרימה של בידוד מיוציטים חדריים ואסטריים ופיברובלסטים לב מלב אחד. אנא לחץ כאן כדי להוריד נתון זה.
Discussion
מאז הלב רגיש מאוד איסכמיה, הזמן לקח כדי excise את הלב לטבול אותו CIB-EGTA קר כקרח כדי לעצור התכווצות צריך להישמר קצר ככל האפשר (<1 דקות). זהו השלב הקריטי הראשון בשיטה זו. הצעד הקריטי השני נוגע לכיוון הלב. האוריינטציה המסוימת של הלב שנכרת בשלב 2.1.2 מקלה על הצפייה וההסרה של רקמות השומן והחיבור סביב העורקים. לאחר ניקוי סביב העורקים, מניחים את הלב מהודק עם צד משטח לפנים על צלחת זלוף. השלב הקריטי האחרון כרוך החדרת מחט ההזרקה. בעת קידום המחט לכיוון הלב, מחט ההזרקה לא צריכה להיות מנותקת מצלחת הזלוף על מנת לשמור על מרחק קבוע מהצלחת. מיקום ההכנסה קרוב לשיא החדר השמאלי. הכנס את המחט בזהירות מבלי לסובב, שכן פיתול כזה עשוי להגדיל את החור. ניתן להעריך את עומק החדרת המחט על ידי צפייה בסימן האדום. אם המחט מוכנסת עמוק מדי, הקצה עשוי לנקב דרך מחיצת החדר ולהיכנס לחדר הימני או אם כי השסתום המיטרלי ולהיכנס לאטריום השמאלי. לאחר אישור היעלמות הדם מהקורק הכלילי, יש לתקן את המחט עם סרט הדבקה ללוחית הזלוף.
אורך ארוך יותר של העורקים מקשה על הידק של העורקים בתנוחה הנכונה. אם המהדק רחוק מדי מן האטריה, הלב עשוי להסתובב לאחר עירוי זלוף. כדי למנוע זאת, לחתוך את העורקים רק מתחת לעורק brachiocephalic כדי לקצר את כאבי העורקים לפני ההידוק.
אם הדם לא מתחיל לפרוק לאחר זלוף במהירות ראשונית של 0.5 מ"ל / דקה, להגדיל את המהירות ל 1 מ"ל / דקה. אם זה לא עוזר, מחט ההזרקה עשויה להיות ממוקמת באופן שגוי, כגון בחדר הימני, מחיצה חדרית או קיר שריר הלב השמאלי. במקרה כזה, להסיר את המחט מיד ולנסות להכניס אותו מחדש ליד השיא של החדר השמאלי. בעת החדרת המחט מספר פעמים, תאים מתעכלים עשויים לזרום החוצה מן החורים שנפתחו. שים לב כי זה בדרך כלל לא משפיע ברצינות על בידוד התא.
המפעילים יכולים לפקח על כל התהליך של זלוף antegrade של הלב באמצעות מיקרוסקופ סטריאוסקופי כדי לבחון את השינויים בצבע ושקיפות והפעלה מחדש של מכות האטריה יחד עם העיכול. סך של 10 מ"ל של תערובת אנזימים צריך להיות המקסימום הנדרש, אפילו עבור לב ישן. בלבבות צעירים יותר (5-7 שבועות), אנו מפחיתים את הנפח ל 9 מ"ל, אשר דומה לגישה באמצעות זלוף מדרדר עם אותו תערובת אנזימים.
supernatant בצנטריפוגה הסופית מכיל פסולת, תאי דם, ולא מיוציטים ואילו, גלולה מכיל בעיקר cardiomyocytes וזיהום שאינם מיוציטים, כגון fibroblasts ותאי אנדותל. כדי לטהר את הקרדיומיוציטים, יש צורך בצעדים נוספים. באופן כללי, גלולה צריך להיות resuspended במדיום תרבות התא המתאים preplated במשך 2 שעות ב 37 מעלות צלזיוס על צלחת תרבית תא רקמה, ולאחר מכן בעדינות להסיר את cardiomyocytes על ידי pipetting ו preplating לתרבות.
תערובת האנזימים מכילה ריכוז נמוך של Ca2+ (0.3 מ"מ). לכן אנו דגירה תאים מתעכלים CIB-Ca2 +-BSA (1.2 mM Ca2+) לפני ההשעיה הסופית עם פתרון ההשעיה מחדש של התא (1.8 mM Ca2+), ואת הגידול ההדרגתי Ca2+ נמנע גרימת נזק לתא7. כל עוד הקרדיומיוציטים המבודדים שלמים (תאים רגיעה ללא התכווצות) הליך התאמה זה של Ca2+אינו משפיע על הכדאיות של התאים בעכברים. כמו התאים הפגועים מתים במהלך דגירה זו, אנו מקבלים כתוצאה מכך קבוצת תאים בריאה. באופן דומה, מיוציטים פרוזדוריים שלמים מבודדים (תאים רגיעה ללא התכווצות לא סדירה) ניתן לאחסן באותו פתרון ההשעיה מחדש של התא. עם זאת, myocytes הפרוזדורי נוטים להיות עדינים יותר כדי להיות מאוחסן להשוות את myocytes חדרית.
במעבדה, שיטת בידוד זו היא כמעט תמיד מוצלחת אלא אם כן החדרת המחט לחדר השמאלי נכשלת. הצלחנו גם לבודד תאים מהלב hypertrophied שהוכן על ידי התכווצות אבי העורקים רוחבית כירורגית. עם זאת, בעכברים מיושנים, שלעתים קרובות יש להם אוטם שריר לב קטן, הזלוף נפסק במקומות מסוימים, וכתוצאה מכך עיכול לא שלם ובכך תשואה נמוכה (איור 1C), בדומה לשיטת הנסיגה המבוססת על לנגנדורף. במקרים כאלה, ניתן לראות את הצורה המעוותת של הלב גם בתחילת הזחילה.
שיטת זלוף antegrade זו שימושית לבידוד תאי לב מעכברים בגילאים שונים אך לא מבעלי חיים גדולים יותר, כגון ארנבות ושפני ניסיונות. ייתכן שניתן יהיה ליישם שיטה זו על חולדות יילודים או נוער לפני התיישנות.
אחד היתרונות של שיטת זלוף antegrade זה הוא שזה מקטין את המכשולים הטכניים הקשורים באמצעות שיטת זלוף מדרדר מבוסס Langendorff עבור לבבות עכבר קטנים. הזמן הנדרש עבור זלוף הוא כ 7 דקות עם 10 מ"ל של האנזימים, תקופת עיכול קצרה זו מגבירה את הכדאיות של התאים. בנוסף, הוא מאפשר זלוף להתבצע באמצעות זרימת הדם הכלילית של הלב, גם לאחר שסתומי אבי העורקים כבר מתעכל. בידוד של מיוציטים פרוזדוריים בדרך כלל דורש זלוף מדרדר מבוסס Langendorff ודגרת נוספת עםאנזימים 17. גישה זו זלוף antegrade, עם זאת, יכול להחדיר עמוק את הרקמה עם האנזים כדי לבודד מיוציטים פרוזדוריים.
בניסויים באמצעות עכברים מרובים, יש לנקות את מנגנון לנגנדורף לפני שהוא מחלחל ללב הבא. עם זאת, בשיטת antegrade הנוכחית, כל עוד המספר הרצוי של ערכות מכשירים (למשל, מחטי מזרקים וצלחות זלוף) מוכנים מראש, זלוף יכול להתבצע ברציפות.
אנו מדווחים בזאת על המתודולוגיה הבסיסית של זלוף אנגרד של לב העכבר באמצעות אותם פתרונות כמו שיטת זלוף מדרדר מבוסס לנגנדורף ללא כימיקלים נוספים. ההרכב של perfusate ניתן לשנות כדי להתאים את מטרת הניסוי, כגון שימוש בחומר ניקוי המכיל EGTA במקום האנזימים כדי להפוך לב decellularized18.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים מודים לטי ימאמוטו וליורי על עזרתם בניסויים המורפוגליים. עבודה זו נתמכה על ידי מענק בסיוע למחקר מדעי (C) מהחברה היפנית לקידום המדע (18K06871 ל M.O.K. ו 17K08536 ל H.M.).
Materials
| Name | Company | Catalog Number | Comments |
| Amphotericin B | Wako Pure Chemical Industries, Japan | ||
| Alexa Fluor 488 anti-mouse IgG antibody | Molecular Probes, USA | A11001 | Fluorescent-labeled secondary antibody. (1:400 dilution for immunostaining) |
| Anti-α-actinin (ACTN) | Sigma-Aldrich, USA | A7811 | Mouse monoclonal antibody (clone EA-53). (1:400 dilution for immunostaining) |
| Anti-atrial natriuretic peptide (ANP) | Merck-Millipore, USA | AB5490-I | Rabbit polyclonal antibody (1:2000 dilution for Western blots) |
| Anti-Glyceraldehyde 3-phosphate dehydrogenase (GAPDH) | Cell Signaling Technology, USA | 2118 | Mouse monoclonal antibody (1:10000 dilution for Western blots) |
| Anti-smooth muscle actin (SMA) | Dako, Denmark | M0851 | Mouse monoclonal antibody (clone 1A4) (1:400 for immunostaining) |
| Anti-rabbit IgG antibody | Amersham, GE Healthcare, USA | NA934 | Secondary antibody (1:10000 dilution for Western blots) |
| ATP disodium salt | Sigma-Aldrich, USA | A26209 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich, USA | A9418 | |
| Cell-Tak | Corning | 354240 | Biological material for adhesion of the cell or tissues |
| Chemi-Lumi One Super | Nacalai Tesque, Japan | 02230-14 | Chemiluminescent reagent used for western blotting. |
| Collagenase Type 2 | Worthington Biochemicals, USA | LS004176 | Choose the activity guaranteed to be greater than 300 unit/mg. |
| Complete Mini | Roche, Germany | 11836153001 | A mixture of several protease inhibitors. |
| 4'6'diamidino-2-phenylindole (DAPI) | Nacalai Tesque, Japan | 11034-56 | Used for cell-impermeant nuclear stainig |
| Dulbecco's Modified Eagle's Medium (DMEM) | Nacalai Tesque, Japan | 08458-45 | including 4.5 g/L gluose |
| Extension tube | Top, Japan | X1-50 | Connect with syringe and injection needle for antegrade perfusion. |
| EPC-8 patch-clamp amplifier | HEKA, Germany | ||
| Fetal bovine serum (FBS) | Sigma-Aldrich, USA | F7524-500ML | |
| Glass capillaries | Narishige Scientific Instrument Lab., Japan | outside diameter 1.5 mm, inside diameter 0.9 mm | |
| GTP lithium salt | Sigma-Aldrich, USA | G5884 | |
| Horizontal microelectrode puller | Germany) | P-97 | |
| Heater mat | Natsume Seisakusho, Japan | KN-475-3-40 | Equipment to warm the perfusion plate. |
| Infusion pump | TERUMO, Japan | TE-311 | Infusion syringe pump for antegrade perfusion. |
| Injeciton needle (27 gauge) | TERUMO, Japan | NN-2719S | Needle for insertion into the left ventricle. |
| Insulin (from bovine pancrease) | Sigma-Aldrich, USA | I5500 | Dissolve in 0.1 M HCl. |
| Mini cordless grinder | Funakoshi, Japan | cG-4A | Small grinder for homogenizing tissue in 1.5 mL sample tube. |
| 4%-Paraformaldehyde Phosphate Buffer solution (4% PFA) | Nacalai Tesque, Japan | 09154-85 | |
| Penicillin G potassium | Nacalai Tesque, Japan | 26239-84 | |
| Phenol Red | Nacalai Tesque, Japan | 26807-21 | |
| 10X Phosphate Buffered Saline (pH7.4) (10X PBS) | Nacalai Tesque, Japan | 27575-31 | |
| Plastic multi-well culture plate | Falcon, USA | 353226 | Use the lid of the multi-well culture plate as the perfusion plate. |
| Plastic syringe (20 mL) | TERUMO, Japan | SS-20ES | Use for infusion of CIB-EGTA. |
| Plastic syringe (30 mL) | TERUMO, Japan | SS-30ES | Use for infusion of Enzyme-mix |
| Plastic transfer pipette | Sarstedt, Germany | 86.1171 | Cut the tip just before sucking mouse heart into the pipette. |
| Polyvinylidene difluoride (PVDF) membrane | Merck-Millipore, USA | IPVH00010 | Immobilin-P membrane (Transfer membrane for protein blotting) |
| Protease | Sigma-Aldrich, USA | P5147 | A mixture of three or more proteases including extracellular serine protease. |
| 4X Sample buffer solution | Fuji Film, Japan | 198-13282 | Contains 0.25 M Tris-HCl (pH 6.8), 8 w/v% SDS,40 w/v% Glyceroland 0.02 w/v% BPB |
| SDS polyacrylamide gel (15%) | Fuji Film, Japan | 193-14991 | |
| Streptomycin sulfate | Nacalai Tesque, Japan | 32237-14 | |
| 10X Tris-Glycine buffer solution (10X TG) | Nacalai Tesque, Japan | 09422-81 | Contains 0.25 M-Tris and 1.92 M-Glycine, (pH 8.3) |
| Trypsin | Sigma-Aldrich, USA | T8003 | Trypsin from bovine Type 1. |
| Vascular clamp | Karl Hammacher GmbH, Germany | HSE 004-35 | Small straight vascular clamp used for clamping aorta. |
| All other reagents | Nacalai Tesque, Japan |
References
- Langendorff, O. Untersuchungen am überlebenden Säugethierherzen. Pflügers Archiv: European Journal of Physiology. 61, 291-332 (1898).
- Berry, M. N., Friend, D. S., Scheuer, J. Morphology and metabolism of intact muscle cells isolated from adult rat heart. Circulation Research. 26 (6), 679-687 (1970).
- Powell, T., Terrar, D. A., Twist, V. W. Electrical properties of individual cells isolated from adult rat ventricular myocardium. Journal of Physiology. 302, 131-153 (1980).
- Joshi-Mukherjee, R., et al. Structural and functional plasticity in long-term cultures of adult ventricular myocytes. Journal of Molecular and Cellular Cardiology. 65, 76-87 (2013).
- Benndorf, K., Boldt, W., Nilius, B. Sodium current in single myocardial mouse cells. Pflügers Archiv: European Journal of Physiology. 404 (2), 190-196 (1985).
- Zhou, Y. Y., et al. Culture and adenoviral infection of adult mouse cardiac myocytes: methods for cellular genetic physiology. American Journal of Physiology-Heart and Circulatory Physiology. 279 (1), 429-436 (2000).
- Shioya, T. A simple technique for isolating healthy heart cells from mouse models. Journal of Physiological Sciences. 57 (6), 327-335 (2007).
- Fiset, C., Clark, R. B., Larsen, T. S., Giles, W. R. A rapidly activating sustained K+ current modulates repolarization and excitation-contraction coupling in adult mouse ventricle. Journal of Physiology. 504, Pt 3 557-563 (1997).
- Ackers-Johnson, M., et al. A Simplified, Langendorff-Free Method for Concomitant Isolation of Viable Cardiac Myocytes and Nonmyocytes From the Adult Mouse Heart. Circulation Research. 119 (8), 909-920 (2016).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal to aged mice. Physiological Reports. 6 (9), 13688(2018).
- Sambrano, G. R., et al. Navigating the signalling network in mouse cardiac myocytes. Nature. 420 (6916), 712-714 (2002).
- Limana, F., et al. bcl-2 overexpression promotes myocyte proliferation. Proceedings of the National Academy of Sciences of the United States of America. 99 (9), 6257-6262 (2002).
- Santiago, J. J., et al. Cardiac fibroblast to myofibroblast differentiation in vivo and in vitro: expression of focal adhesion components in neonatal and adult rat ventricular myofibroblasts. Developmental Dynamics. 239 (6), 1573-1584 (2010).
- Chistiakov, D. A., Orekhov, A. N., Bobryshev, Y. V. The role of cardiac fibroblasts in post-myocardial heart tissue repair. Experimental and Molecular Pathology. 101 (2), 231-240 (2016).
- Omatsu-Kanbe, M., Matsuura, H. A novel type of self-beating cardiomyocytes in adult mouse ventricles. Biochemical and Biophysical Research Communications. 381 (3), 361-366 (2009).
- Shan, D., Marchase, R. B., Chatham, J. C. Overexpression of TRPC3 increases apoptosis but not necrosis in response to ischemia-reperfusion in adult mouse cardiomyocytes. American Journal of Physiology. 294 (3), 833-841 (2008).
- Nakamura, H., et al. Presence and functional role of the rapidly activating delayed rectifier K(+) current in left and right atria of adult mice. European Journal of Pharmacology. 649 (1-3), 14-22 (2010).
- Milgroom, A., Ralston, E. Clearing skeletal muscle with CLARITY for light microscopy imaging. Cell Biology International. 40 (4), 478-483 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved