Method Article
Procédé de perfusion antegrade pour l’isolement de cardiomyocytes de souris
Dans cet article
Résumé
Nous avons développé une méthode simple pour isoler les cellules individuelles de coeur de souris de haute qualité par la technique antegrade de perfusion. Cette méthode est sans Langendorff et utile pour isoler les myocytes ventriculaires et auriculaires ou les cellules interstitielles, telles que les fibroblastes cardiaques ou les progéniteurs.
Résumé
Dans la recherche fondamentale utilisant le cœur de souris, l’isolement de cardiomyocytes individuels viables est une étape technique cruciale à surmonter. Traditionnellement, l’isolement des cardiomyocytes des lapins, des cobayes ou des rats a été effectué via une perfusion rétrograde du cœur avec des enzymes à l’aide d’un appareil de Langendorff. Cependant, un haut degré de compétence est requis lorsque cette méthode est utilisée avec un petit cœur de souris. Une méthode antegrade de perfusion qui n’utilise pas un appareil de Langendorff a été récemment rapportée pour l’isolement des cardiomyocytes de souris. Nous rapportons ci-dessus un protocole complet pour la perfusion antegrade améliorée du coeur excisé pour isoler les cellules individuelles de coeur des souris adultes (8 - 108 semaines). La perfusion antegrade est réalisée en injectant du perfusat près de l’apex du ventricule gauche du cœur excisé, dont l’aorte a été serrée, à l’aide d’une pompe à perfusion. Toutes les procédures sont effectuées sur un tapis chauffant préchauffé au microscope, ce qui permet de surveiller les processus d’injection et de perfusion. Les résultats suggèrent que les myocytes ventriculaires et atriculaires, et les fibroblastes puissent être bien isolés d’une souris adulte simple simultanément.
Introduction
Généralement, la première étape de l’isolement unicellulaire du tissu disséqué consiste à miisser le tissu en petits morceaux, suivie de la digestion du tissu conjonctif et de la matrice extracellulaire avec des enzymes. Cependant, les cardiomyocytes ne peuvent pas être isolés avec une telle méthode de hachage, car l’enrichissement avec des composants de la matrice extracellulaire, y compris les fibres de collagène et d’élastine, rend le myocarde trop difficile à hacher, et les cardiomyocytes sont très sensibles à l’hypoxie et à d’autres changements dans le microenvironnement. Ainsi, en utilisant le système de perfusion rétrograde à base de Langendorff1,une méthode de digestion de la matrice extracellulaire avec des enzymes a été développée pour isoler les cardiomyocytes individuels du cœur2,3,4.
Dans les modèles murins, la perfusion rétrograde du cœur à base de Langendorff avec des enzymes est également utilisée pour l’isolement de cardiomyocytes individuels5,6,7,8. Cependant, l’ondulation de l’aorte de souris petite et mince et son montage sur l’appareil de Langendorff pour effectuer une perfusion rétrograde nécessitent un degré élevé de compétence, car le diamètre de l’aorte dans le cœur adulte est d’environ 1,2 mm. De plus, il faut du temps pour effectuer plusieurs expériences car l’appareil de Langendorff doit être nettoyé avant de perfuser le cœur suivant.
Comme alternative à la perfusion rétrograde, une nouvelle méthode pour isoler des cardiomyocytes d’un coeur adulte de souris sans appareil de Langendorff a été développée. Cette méthode de fabrication d’époque a été basée sur la perfusion antegrade des artères coronaires9. Nous avons récemment amélioré chaque étape de ce protocole antegrade, tel que le serrage de l’aorte, l’insertion d’aiguille, et le contrôle de température, et surveillé toutes les procédures de perfusion avec un microscope10. Nous rapportons ci-dessus en détail le raffinement de cette méthode antegrade de perfusion pour raccourcir le temps pour l’isolement et fournir un vidéo supplémentaire. Dans cette méthode, la perfusion du cœur prend environ 7 min avec 10 mL d’enzymes, et cette courte période de digestion augmente la viabilité des cellules. Il s’agit d’une méthode simple pour isoler les cellules à cœur unique à une haute qualité sans nécessiter l’ajout de produits chimiques, tels que la 2,3-butanedione monoxime (BDM)6,11 ou la taurine5,8. Nous croyons que cette méthode abaissera le seuil de compétence de la technique et améliorera l’utilité des cardiomyocytes de souris dans la recherche fondamentale.
Protocole
Toutes les expériences sur les animaux étaient conformes au Guide for the Care and Use of Laboratory Animals publié par les National Institutes of Health des États-Unis (publication des NIH n° 85-23, révisée en 1996) et approuvées par le comité d’examen institutionnel du Comité de soins et d’utilisation des animaux de l’Université shiga des sciences médicales (approuvé n° 2019-3-7). Les méthodes ont été mises en œuvre conformément aux lignes directrices approuvées.
1. Instruments et solution
NOTA : Un aperçu de la procédure expérimentale est illustré dans un organigramme(figure supplémentaire 1). Une pompe à perfusion (ou pompe à seringue) doit être utilisée pour la perfusion antegrade du cœur avec un flux unidirectionn. Une pompe péristaltique qui crée un débit pulsant n’est pas recommandée.
- Avant l’expérimentation
- Marquez l’aiguille d’injection à un site situé à environ 3 mm de la pointe avec du vernis à ongles. Après l’avoir autorisé à sécher à l’air, conservez-le dans le récipient à température ambiante. Une couleur rouge ou vive est souhaitable pour confirmer la profondeur d’insertion dans le myocarde pendant la perfusion.
- Tenez le cœur debout en coupant les couvercles des tubes d’échantillonnage de 1,5, 0,5 et 0,2 mL et en fixant les couvercles au fond d’un plat de culture de 60 mm avec du ruban adhésif double face ou de l’adhésif. La fixation de trois couvercles de taille différente dans un plat permet de choisir celui qui convient en fonction de la taille du cœur de la souris. Ce support de cœur peut être réutilisé après lavage.
- Fabriquez une solution mère comme indiqué dans le tableau 1. Conservez les solutions de stock à 4 °C.
- Le jour de l’expérience
REMARQUE: Le tampon d’isolement cellulaire (CIB) contient (en mM) 130 NaCl, 5,4 KCl, 0,5MgCl2,0,33NaH2PO4,22 glucose, 40 unités/mL d’insuline et 25 HEPES (pH ajusté à 7,4 avec NaOH); et la solution de Tyrode contient (en mM) 140 NaCl, 5,4 KCl, 1,8CaCl2,0,5MgCl2,0,33NaH2PO4, 5,5 glucose et 5,0 HEPES (pH ajusté à 7,4 avec NaOH).- Préparez la BIC. Réchauffer 160 mL d’eau distillée (DW) à l’aide d’un micro-ondes à environ 32 °C, puis ajouter 20 mL de 10X CIB. Après l’ajout de 0,79 g de glucose et de 10 μL de solution d’insuline, ajuster le pH en utilisant 1 M NaOH et porter à 200 mL avec DW.
- Préparer la solution de mélange d’enzymes (mélange d’enzymes). Ajouter 30 mg de collagénase, 1,8 mg de trypsine, 1,8 mg de protéase et 90 μL de solution mère de CaCl2 à 100 mM à 30 mL de CIB (la concentration finale deCa2+ est de 0,3 mM), mélanger et le garder sur la glace. Chez les souris <4 semaines, réduire la trypsine et la protéase à 0,9 mg10. Réchauffer à 37 °C au bain-marie avant utilisation.
- Préparez la solution CIB-Ca2+-BSA. Ajouter 30 mg de BSA et 90 μL de solution mère de CaCl2 à 100 mM à 15 mL de CIB (la concentration finale de Ca2+ est de 1,2 mM), mélanger, filtrer à travers un filtre de 20 μm et le garder sur de la glace.
- Préparer la solution CIB-EGTA. Après avoir fait les solutions décrites aux étapes 1.2.2 et 1.2.3, ajouter une solution mère d’EGTA de 400 mM au CIB restant à une dilution de 1:1000 (la concentration finale d’EGTA est de 0,4 mM) et mélanger. Remplissez le plat de culture de 35 mm et le plat de support de cœur avec CIB-EGTA et gardez-les sur la glace.
- Versez environ 20 mL de CIB-EGTA dans un bécher en verre de 30 mL et tenez une pipette de transfert en plastique dans le bécher, en le gardant sur la glace.
- Préparer la solution tyrode. Ajouter 100 mL de Tyrode 10X à 800 mL de DW et le réchauffer à l’aide d’un micro-ondes à environ 32 °C. Après avoir ajouté 0,99 g de glucose et 1,8 mL de 1 MCaCl2,ajuster le pH en utilisant 1 M NaOH et porter à 1000 mL avec DW.
- Préparer la solution de remise en suspension des cellules. Ajouter 30 mg de BSA et 300 μL d’antibiotiques 50X à 15 mL de solution de Tyrode.
- Préparez des seringues. Remplissez la seringue de 20 mL reliée au tube d’extension flexible et l’aiguille d’injection marquée avec CIB-EGTA. Remplissez la seringue de 30 ml avec le mélange d’enzymes réchauffées. Maintenez-les tous les deux à 37 °C jusqu’à juste avant utilisation.
- Préparer la plaque de perfusion. Préchauffer le tapis chauffant sous un microscope stéréoscopique. Placez la plaque de perfusion (couvercle d’une plaque de culture multi-puits) sur le tapis chauffant pré-préchauffé. Pré-rasez la pince vasculaire en la plaçant dans la plaque de perfusion jusqu’à l’utilisation. Placez également la parabole de culture de 60 mm pour le pipetage et la passoire cellulaire sur le tapis chauffant préchauffé.
2. Perfusion antegrade du cœur de souris
REMARQUE: La pipette de transfert en plastique utilisée pour sucer le cœur doit être douce et ne pas être fortement effilée vers la pointe. Choisissez une petite pince vasculaire avec sérration. Les instruments recommandés sont répertoriés dans la table des matériaux.
- Excision du cœur de la souris et serrage de l’aorte
REMARQUE : Les souris adultes (>8 semaines) devraient être euthanasiées par surdose de pentobarbital de sodium (>300 mg/kg, injection intrapéritonéale [i.p.]) d’héparine (8000 unités/kg).- Exciser le cœur de la souris rapidement en suçant.
- Ouvrez rapidement la cavité thoracique pour exposer le cœur. Couper la pipette de transfert en plastique, dont la pointe est à peu près de la même taille que le cœur exposé ou légèrement plus petite que celle-ci (habituellement à un site situé à environ 1 cm de la marque de 0,5 mL vers la pointe, mais cela dépend de la taille du cœur).
- Aspirez le cœur dans la pipette, soulevez la pipette pour créer suffisamment d’espace pour insérer des ciseaux et excisez le cœur avec des ciseaux incurvés du côté dorsal, en évitant d’endommager les oreillettes.
- Transférer immédiatement le cœur excisé vers le bécher en verre de 30 mL contenant du CIB-EGTA réfrigéré à la glace pour arrêter la contraction. Cette procédure prend généralement <1 min.
- Nettoyage autour de l’aorte
- Transférer le cœur dans un plat de culture de 35 mm rempli de CIB-EGTA réfrigéré à la glace et retirer le poumon et d’autres tissus visibles, puis transférer le cœur grossièrement nettoyé sur le support cardiaque rempli de CIB-EGTA réfrigéré et le placer avec l’apex vers le bas.
- Sous le microscope stéréoscopique, retirez la graisse et les tissus conjonctifs pour nettoyer autour de l’aorte. Si la longueur de l’aorte coupée est trop longue, y compris l’artère brachiocéphalique, l’artère carotide commune gauche ou l’artère sous-clavière gauche, coupez l’aorte juste sous l’artère brachiocéphalique pour la raccourcir afin de passer à l’étape suivante. Cette procédure prend généralement environ 4 min.
- Serrage de l’aorte et placement du cœur serré sur la plaque de perfusion
- Sous le microscope, placez le cœur dans le support du cœur. L’opérateur doit faire face à la surface antérieure du cœur, ramasser l’extrémité de l’aorte avec une pince à épiler et serrer l’aorte près des oreillettes avec une petite pince vasculaire tout en poussant doucement un peu vers le bas sur l’aorte.
- Placez le cœur serré sur la plaque de perfusion avec le côté antérieur vers le haut, puis couvrez-le de quelques gouttes de CIB-EGTA pour l’empêcher de se dessécher. Cette procédure prend généralement <20 s.
- Exciser le cœur de la souris rapidement en suçant.
- Perfusion antegrade du cœur
REMARQUE: Tout d’abord, perfuse le cœur avec CIB-EGTA pour décharger le sang et empêcher la coagulation.- Insérez l’aiguille d’injection et commencez la perfusion pour décharger le sang
- Réglez la seringue de 20 mL remplie de CIB-EGTA pré-feu connecté au tube d’extension flexible et à une aiguille d’injection marquée sur la pompe à perfusion. Démarrez la pompe à un rythme lent de 0,5 mL/min pour remplir soigneusement l’aiguille et le tube avec CIB-EGTA et assurez-vous d’empêcher tout air de pénétrer dans le tube.
- Placez l’aiguille d’injection sur la plaque de perfusion avec le côté le plus court de la forme diagonale à l’avant. Faites glisser l’aiguille vers l’apex du cœur jusqu’à ce qu’elle la touche, puis insérez soigneusement l’aiguille près de l’apex du ventricule gauche dans la chambre ventriculaire sans la torsion. Ne détachez pas l’aiguille de la plaque pendant l’insertion.
- Regardez la marque rouge pour estimer la profondeur de l’insertion de l’aiguille. Lorsque l’insertion de l’aiguille est terminée, le sang qui coule de l’artère coronaire devrait commencer à être déchargé.
- Fixez l’aiguille d’injection sur la plaque avec du ruban adhésif et augmentez la vitesse de la pompe à 1 mL/min. Cette procédure prend généralement environ 30 s. Si le cœur est perfusé avec succès, l’écoulement du CIB-EGTA dans le capillaire juste sous l’épicaire peut être vu au microscope.
- Perfusion du cœur avec mélange d’enzymes
REMARQUE: Pendant la perfusion enzymatique, la profondeur de l’aiguille insérée peut être surveillée en vérifiant la marque rouge sur l’aiguille.- Après avoir perfusé 2-3 mL de CIB-EGTA pour décharger complètement le sang de l’artère coronaire, changez le perfusat en mélange d’enzymes. Évitez de laisser des bulles d’air pénétrer dans le tube. Vérifiez le débit du mélange d’enzymes et assurez-vous que l’aiguille d’injection n’est pas sortie en vérifiant la position de la marque rouge.
- Après avoir perfusé 1 à 2 mL, augmenter la vitesse de la pompe à 1,5 mL/min. Retirez le perfusat accumulé contenant du sang qui s’est écoulé hors du cœur avec une pipette de temps en temps.
REMARQUE: Au fil du temps, la paroi myocardique deviendra translucide à certains endroits et apparaîtra tachetée, ce qui est un signe de digestion de la matrice extracellulaire après une perfusion réussie. Un autre signe est le redémarrage des battements auriculaires causés par la présence de Ca2+ dans le mélange d’enzymes. - Arrêter la perfusion lorsque le volume total du mélange d’enzymes perfusé est de 10 ml.
- Insérez l’aiguille d’injection et commencez la perfusion pour décharger le sang
3. Isolement des cellules cardiaques individuelles
- Dissociation des cellules cardiaques
- Après perfusion avec le mélange d’enzymes, transférer 10 mL du mélange d’enzymes restant dans la seringue à une parabole de culture de 60 mm placée sur le tapis chauffant et ajouter 20 mg de BSA (0,2% BSA dans le mélange d’enzymes). La poudre BSA tombée doit se dissoudre immédiatement en tourbillonnant doucement avec une main. Retirez l’aiguille d’injection et la pince vasculaire du cœur.
- Séparez les ventricules et les oreillettes et transférez chacun dans le mélange d’enzymes complété par 0,2% de BSA sur le tapis chauffant.
- Isolement des myocytes ventriculaires
- Prenez l’épicurium avec deux pinces à épiler, et déchirez doucement et tirez les ventricules d’un côté à l’autre dans le mélange d’enzymes complété par 0,2% BSA en petits morceaux. Disperser les cellules avec un pipetage doux (environ 30 fois).
- Filtrer les débris non digérés à travers une passoire cellulaire à mailles de 100 μm et transférer le filtrat dans un tube centrifuge de 15 mL pour centrifugation à 50 × g pendant 3 min. Remettre en suspension les cardiomyocytes en granulés dans une solution CIB-Ca2+-BSA pré-indemne, incuber pendant 5 min à 37 °C, puis centrifuger à 14 × g pendant 3 min.
- Remettre en suspension les cardiomyocytes précipités finaux dans une solution de remise en suspension cellulaire (la composition est indiquée dans le tableau 2)et les maintenir à 37 °C.
- Isolement des myocytes auriculaires
- Lors de la centrifugation finale de la fraction myocytes ventriculaire à l’étape 3.2, commencez à isoler les myocytes auriculaires. Transférer les oreillettes, stockées comme à l’étape 3.1, dans la solution CIB-Ca2+-BSA préchauffée, les déchirer en morceaux et dissocier les cellules en pipetant avec pointe de pipette à 10 μL sur le tapis chauffant.
- Centrifuger le mélange cellulaire à 14 × g pendant 3 min et ressusciter les cellules auriculaires granulées avec une solution de ressuspention cellulaire.
- Isolement et culture de fibroblastes cardiaques
- Transférer le surnageant de la première centrifugation de l’étape 3.2 dans un autre tube centrifuge de 15 mL, puis centrifuger à 190 × g pendant 5 min. Lavez les cellules précipitées deux fois par centrifugation dans le milieu Eagle modifié (DMEM) de Dulbecco, puis suspendez les cellules avec du DMEM complété par 10% d’albumine fœtale bovine (FBS) et d’antibiotiques.
- Mettre en plaques la fraction cellulaire finale dans une fiole de culture (25cm2)et laisser les cellules adhérer au fond de la fiole dans une atmosphère humidifiée de 95 % d’air et de 5 % deCO2. Après 90 min d’incubation, jeter les cellules non attachées et ajouter un milieu de culture frais. Les cellules doivent approcher de la confluence après environ 4 jours, après quoi elles doivent être amplifiées par trypsinisation et ensemencées dans de nouveaux plats de culture.
4. Récolte des protéines des oreillettes et des ventricules
- Après perfusion, séparer les oreillettes et les ventricules, et les homogénéiser dans un tampon de lyse à un rapport de 10 mg de poids tissulaire à 100 μL de tampon à l’aide d’un petit broyeur dans un tube d’échantillonnage de 1,5 mL.
- Conserver l’homogénat dans de la glace pendant 40 min avec un mélange de vortex toutes les 10 min pour extraire les protéines, puis centrifuger le tube à 15000 × g pendant 20 min à 4 °C. Conserver la fraction surnageante à -80 °C sous forme d’échantillon de protéines.
5. Immunomarquage de cellules cardiaques isolées
REMARQUE: L’immobilisation des cardiomyocytes non adhérents au fond de la boîte d’imagerie cellulaire à l’aide de colle biologique est nécessaire.
- Adhérence de cardiomyocytes isolés à une parabole de culture à fond de verre
- Avant de commencer l’isolement cellulaire, enduire le plat de culture à fond de verre avec de la colle biologique (p. ex. Cell-Tak) conformément aux instructions du fabricant, rincer avec du DW et sécher à l’air à température ambiante.
- Après remise en suspension des cardiomyocytes d’isolement dans la solution CIB-Ca2+-BSA, laisser tomber la suspension cellulaire sur le fond des plats enduits de colle, et incuber pendant 20 min à température ambiante sans agitation.
- Immunomarquage
- Plaquez les cardiomyocytes isolés sur une boîte à fond de verre pré-revêtue de colle biologique et maintenez-la à température ambiante pendant 40 min pour permettre aux cellules d’adhérer à la boîte. Culturez des fibroblastes cardiaques dans des plats de culture en verre de fond.
- Rincer les cellules avec une solution saline tamponnée au phosphate (PBS) et les fixer avec du paraformaldéhyde à 4% (PFA) pendant 5 min en secouant. Laver les cellules fixes avec du PBS pendant 10 min trois fois, et les incuber dans une solution de blocage-perméabilisation pendant 60 min à température ambiante avec secousse.
- Sondez les cellules avec des anticorps primaires dilués dans une solution de blocage-perméabilisation pendant 60 min à température ambiante ou pendant une nuit à 4 °C. Laver les cellules avec du PBS pendant 10 min trois fois, puis incuber ensuite avec de l’anticorps secondaire marqué par fluorescence pendant 60 min à température ambiante.
- Après les avoir lavés trois fois avec du PBS pendant 10 min, colorez les noyaux avec du DAPI (dilution de 1:10000 dans du PBS). Analyser les signaux fluorescents à l’aide d’un microscope à balayage laser confocal.
6. Enregistrements de pinces de raccordement à cellules entières
- Fabriquer les électrodes de patch à partir d’un capillaire en verre à l’aide d’un tireur de microélectrode horizontal. La résistance de l’électrode variait de 2 à 4 MΩ lorsqu’elle était remplie d’une solution de pipette riche en K+(tableau 2). Transférer une partie aliquote de cardiomyocytes isolés dans une chambre d’enregistrement montée sur le stade d’un microscope inversé superfusé avec Tyrode à raison de 1 mL/min à 36-37 °C.
- Enregistrer les potentiels d’action en utilisant la méthode patch-clamp perforée avec une solution de pipette riche en K+contenant 30 mg / mL d’amphotéricine B en appliquant des impulsions de courant de 5-10 ms à un taux de 1 Hz via l’électrode de patch.
7. Analyses par transfert western
- Dans cette étude, effectuez une analyse western blot de protéines de petit poids moléculaire, telles que le peptide natriurétique auriculaire (ANP) de marqueur auriculaire.
- Dissoudre l’échantillon de protéines dans la concentration finale du tampon de l’échantillon 1X, 2 % de mercaptoéthanol 2', et dénaturer les protéines pendant 60 min à 37 °C. Chargez 20 μg de protéines dans chaque puits et effectuez une électrophorèse dans un tampon de fonctionnement avec 20 mA par gel pendant 120 min.
- Transférer la protéine dans une membrane PVDF dans un tampon de transfert à 10 V pendant 40 min. Laver la membrane transférée deux fois avec TBST pendant 5 min, puis bloquer avec 5 % de lait écrémé dans TBST pendant 60 min à température ambiante, et sonder avec l’anticorps primaire dissous dans TBST pendant une nuit à 4 °C.
- Laver la membrane 5 fois avec TBST pendant 7 min, et l’incuber avec l’anticorps secondaire dilué dans TBST pendant 120 min à température ambiante.
- Après avoir lavé la membrane 5 fois avec TBST pendant 7 min, visualisez les signaux avec un test de luminescence chimio et analysez-les avec un analyseur de lumino-image.
Résultats
Le principe de cette méthode est simple: le perfusat s’écoule de la chambre gauche, la valve aortique est ouverte et le perfusat se jette dans l’artère coronaire dans la même direction que le sang, car l’aorte est fermée par serrage, ce qui permet la perfusion profonde du myocarde afin de digérer la matrice extracellulaire.
Les myocytes ventriculaires fraîchement isolés avec la présente méthode sont représentés à la figure 1A. La figure 1B montre des images agrandies des myocytes ventriculaires et auriculaires. Cette procédure d’isolement a eu comme conséquence un rendement élevé (70%-80%) de myocytes ventriculaires tranquilles en forme de bâtonnet de souris adultes (8-10 semaines), qui étaient disponibles dans environ 5 h après l’isolement(figure 1C),un intervalle similaire à celui lors de l’utilisation de la procédure traditionnelle à base de Langendorff7. Cependant, le ratio de cellules viables fraîchement isolées était plus faible chez les souris âgées de >2 ans (Figure 1C). Le nombre total de myocytes ventriculaires obtenus par coeur adulte utilisant ce protocole était approximativement 3 x 106 cellules, ce qui était similaire à la valeur précédemment rapportée7,12. Les potentiels d’action enregistrés dans les myocytes ventriculaires et auriculaires(figure 1D)étaient similaires à ceux des cellules obtenues par la méthode à base de Langendorff10. Une analyse immunomarquante a confirmé que la structure sarcomérique des myocytes ventriculaires était bien organisée avec une membrane cellulaire clairement visible(figure 2A). Les cardiomyocytes individuels isolés avec cette méthode peuvent être directement utilisés dans des expériences, telles qu’une analyse électrophysiologique10 ou une expérience d’immunomarquage.
Les fibroblastes cardiaques existent dans les espaces interstitiels. Une digestion suffisante de la matrice extracellulaire entraîne l’isolement de ces cellules. Les fibroblastes cardiaques isolés prolifèrent dans des conditions de culture et peuvent être passages plusieurs fois ou stockés dans de l’azote liquide dans une solution de réservoir cellulaire appropriée. La figure 2B montre que la plupart des fibroblastes cardiaques cultivés s’étaient transformés en myofibroblastes au cours de la sous-culture, comme le confirme l’expression accrue de l’actine13, 14du muscle α lisse. En outre, les progéniteurs cardiaques peuvent être isolés avec la méthode actuelle et cultivés dans un milieu de culture approprié, qui commencent à battre automatiquement10,15.
L’homogénéisation du myocarde robuste n’est pas facile, en particulier pour le tissu cardiaque de souris âgées, qui possède une grande quantité de fibres extracellulaires. Après perfusion antegrade, la protéine des oreillettes et des ventricules peut être facilement homogénéisée dans le tampon de lyse avec la force légère pour extraire des protéines. Une analyse par transfert western a démontré l’expression spécifique de la PEV dans les oreillettes, mais pas dans les ventricules de souris adultes (20 semaines) et âgées (108 semaines)(figure 3).
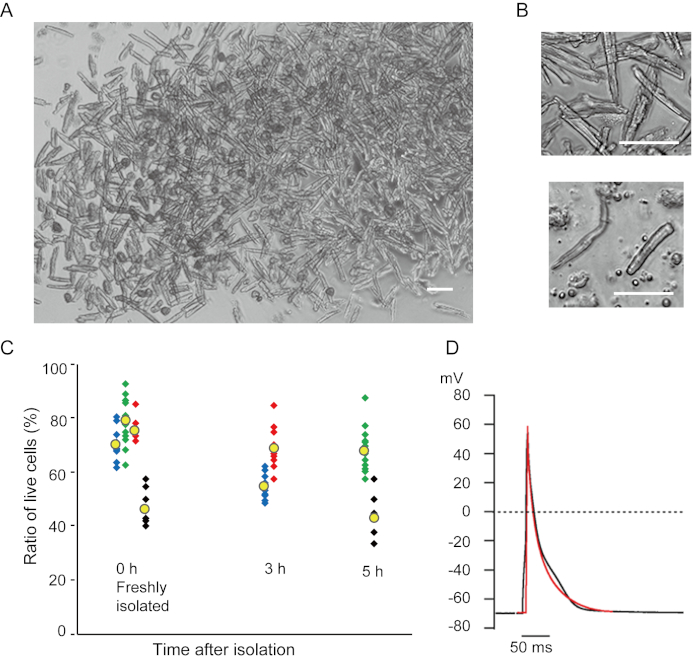
Figure 1. Cardiomyocytes isolés de souris. A. Myocytes ventriculaires fraîchement isolés avec la perfusion antegrade, avec des images acquises avec le bas grossissement. Après le lavage final, les cardiomyocytes ont été remises en suspension avec 2 mL de solution de remise en suspension cellulaire, dont 100 μL ont été déposés sur la parabole de culture à fond de verre et le tassement cellulaire attendu. Bar, 100 μm.B. Images agrandies de myocytes ventriculaires isolés (supérieur) et de myocytes auriculaires (inférieur). Bar, 100 μm.C. Les cellules isolées ont été suspendues dans la solution de remise en suspension cellulaire et stockées à 37 °C pendant la période souhaitée, et le nombre de myocytes ventriculaires vivants a été compté dans 10 à 15 champs au microscope. Les cellules arrondies ont été considérées comme ayant été irréversiblement blessées ou mortes16. Des symboles verts, bleus et rouges ont été obtenus à partir de 3 souris à l’âge de 8 à 10 semaines, et les symboles noirs à partir d’une souris âgée de 106 semaines. Le symbole jaune indique la moyenne de chaque groupe. D. Potentiels d’action représentatifs enregistrés à partir de myocytes ventriculaires (noirs) et auriculaires (rouges) de 8 à 10 souris. Les données ont été obtenues à partir des cellules approximativement 3 h après isolement. Veuillez cliquer ici pour voir une version plus grande de cette figure.
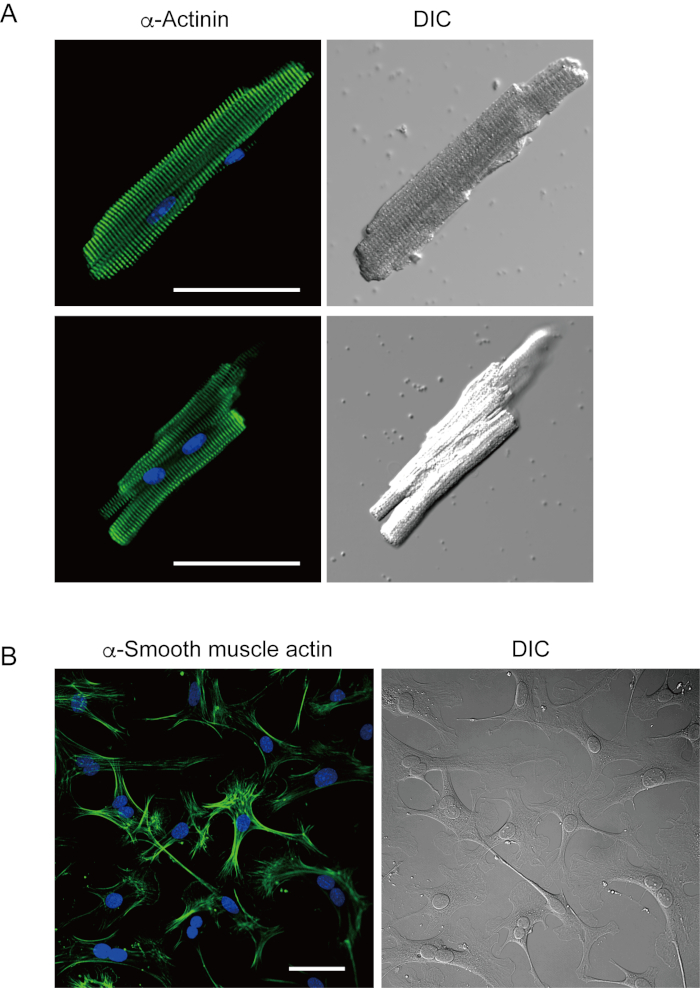
Figure 2. Immunostaining pour la α-actinine dans les myocytes ventriculaires d’isolement de souris et l’actine de muscle α-lisse dans les fibroblastes cardiaques cultivés de souris. A. Microscopie confocale de balayage de laser d’immunostaining pour α-actinine (vert), souillure de DAPI pour des noyaux (bleu) et une image DIC des myocytes ventriculaires isolés dans le coeur de souris avec la perfusion antegrade. Bar, 50 μm.B. Immunomarquage pour l’actine des muscles α lisses (vert), coloration DAPI pour les noyaux (bleu) et image DIC de fibroblastes cardiaques isolés du cœur de souris avec perfusion antegrade. Des fibroblastes cardiaques ont été cultivés pendant quatre jours. Bar, 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
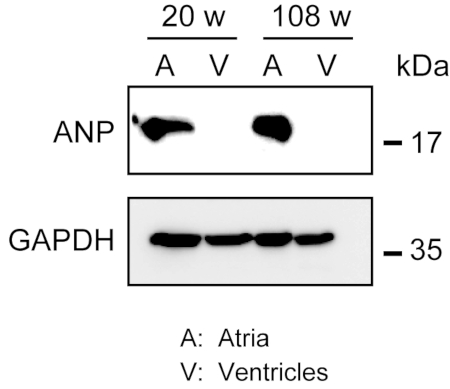
Figure 3. Analyses occidentales de tache d’ANP dans des oreillettes et des ventricules. Analyses occidentales de tache pour le peptide natriurétique auriculaire de marqueur auriculaire (ANP) dans les oreillettes (A) et les ventricules (V) préparées à partir des coeurs adultes (20 semaines) et âgés (108 semaines). La PZ est présente dans les oreillettes mais absente dans les ventricules. Utilisez la glycéraldéhyde 3-phosphate déshydrogénase (GAPDH) comme protéine de contrôle. Veuillez cliquer ici pour voir une version plus grande de cette figure.
| Solutions de stock pour isoler les cellules cardiaques | |
| 10X CIB (500 mL) | |
| NaCl | 37,99 g |
| Kci | 2,01 g |
| 1 M MgCl2 | 2,5 mL |
| NaH2PO4 | 0,23 g |
| HEPES | 29,79 g |
| Dw | Remplir jusqu’à 500 mL |
| 100 mM CaCl2 stock soution | |
| CaCl2 | 100 mM |
| Solution mère EGTA 400 mM | |
| EGTA | 400 mM |
| Solution d’insuline | |
| insuline | 1 unité/mL en HCl 0,1 M |
| Solution mère d’antibiotiques 50X (20 mL) | |
| pénicilline | 100 mg |
| streptomycine | 100 mg |
| Rouge de phénol | 1,5 g |
| Dw | 20 mL et stériliser avec filtrage |
| Solution de tyrode 10X (1000 mL) | |
| NaCl | 81,82 g |
| Kcl | 4,03 g |
| 1 M MgCl2 | 5 mL |
| NaH2PO4 | 0,47 g |
| HEPES | 11,92 g |
| NaOH | 0,8 g |
| Dw | Remplissez jusqu’à 1000 mL |
| Solutétine de stock pour l’immunomarquage | |
| Stock DAPI | |
| DAPI | 2 mg/mL dans le méthanol |
| Solutions de stock pour les western blots | |
| Tampon HEPES (100 mL) | |
| NaCl | 0,88 g |
| EGTA de 400 mM | 0,25 mL |
| HEPES | 0,24 g |
| NaOH 1M | ajuster le pH à 7,4 |
| Dw | Remplir jusqu’à 500 mL |
| Cocktail d’inhibiteurs de la protéase | |
| Mini complet | 1 comprimé |
| Dw | 0,4 mL |
Tableau 1. Description des solutions de stock. Conservez les solutions d’origine à 4 °C. Cocktail d’inhibiteurs de la protéase aliquote pour le stockage à -20 °C.
| Solutions pour isoltaing cellules cardiaques | |
| BIC (200 mL) | |
| 10X CIB | 20 mL |
| Solution d’insuline | 0,01 mL |
| glucose | 0,79 g |
| NaOH 1M | Le pH s’ajuste à 7,4 |
| Dw | Remplir jusqu’à 200 mL |
| Solution de mélange d’enzymes (30 mL) | |
| Collagénase de type2 | 30 mg |
| trypsine | 1,8 mg |
| protéase | 1,8 mg |
| Solution mère cacl2 100 mM | 0,09 mL |
| BIC | 30 mL |
| CIB-Ca2+-BSA (15 mL) | |
| Bsa | 30 mg |
| Solution mère cacl2 100 mM | 0,18 mL |
| BIC | 15 mL |
| CIB-EGTA (150 mL) | |
| Solution mère EGTA 400 mM | 0,150 mL |
| BIC | 150 mL |
| Solution de tyrode (1000 mL) | |
| Solution mère tyrode 10X | 100 mL |
| glucose | 0,99 g |
| 1M CaCl2 | 1,8 mL |
| NaOH 1M | Le pH s’ajuste à 7,4 |
| Dw | Remplissez jusqu’à 1000 mL |
| Solution de remise en suspension cellulaire (15 mL) | |
| Bsa | 30 mg |
| Solution mère d’antibiotiques 50X | 0,3 mL |
| Solution de tyrode | 15 mL |
| Solutions pour l’immunomarquage | |
| Solution adhérente cellulaire (0,3 mL) | |
| Cellule-Tak | 0,01 mL |
| 0,1 M NaHCO3 (pH8,0) | 0,285 mL |
| 0,1 M NaOH | 0,005 mL |
| Solution bloquante-perméabilizatine (10 mL) | |
| Sérum fœtal bovin | 1 mL |
| Triton X-100 | 1 mL |
| PBS 10X | 1 mL |
| Dw | 7 mL |
| K+ solution de pipette riche | |
| Aspartate de potassium | 70 mM |
| Kcl | 50 mM |
| KH2PO4 | 10 mM |
| MgSO4 | 1 mM |
| SEL DISODIQUE ATP | 3 mM |
| Sel de lithium GTP | 0,1 mM |
| EGTA | 5 mM |
| HEPES | 5 mM |
| Koh | Le pH s’ajuste à 7,2 |
| Solutions pour les taches western | |
| Tampon de lyse (1 mL) | |
| Tampon HEPES | 0,86 mL |
| Nonidet-P40 | 0,1 mL |
| Cocktail d’inhibiteurs de la protéase | 0,04 mL |
| Tampon d’exécution (1000 mL) | |
| 10X TG (0,25 M Tris et 1,92 M Glycine) | 100 mL |
| Sds | 1 g |
| Dw | 900 mL |
| Tampon de transfert (1000 mL) | |
| TG 10X | 100 mL |
| méthanol | 200 mL |
| Dw | 700 mL |
| Tampon buvard (TBST) (1000 mL) | |
| NaCl 5M | 20 mL |
| Tris-HCl 2M (pH 7,5) | 5 mL |
| 10% Tween 20 | 10 mL |
| Dw | 965 mL |
Tableau 2. Description des solutions de travail pour isoler les cellules cardiaques, immunomarquage et western blotting. Préparez toutes les solutions de travail juste avant les expériences.
Figure supplémentaire 1. Contour de l’isolation cellulaire. Organigramme de l’isolement des myocytes ventriculaires et auriculaires et des fibroblastes cardiaques d’un seul cœur. Veuillez cliquer ici pour télécharger cette figure.
Discussion
Puisque le coeur est fortement sensible à l’ischémie, le temps nécessaire pour exciser le coeur et l’immerger dans le CIB-EGTA glacé pour arrêter la contraction devrait être maintenu court autant que possible (<1 min). Il s’agit de la première étape critique de cette méthode. La deuxième étape critique concerne la direction du cœur. L’orientation particulière du cœur excisé à l’étape 2.1.2 facilite la vue et l’enlever de la graisse et des tissus conjonctifs autour de l’aorte. Après le nettoyage autour de l’aorte, placez le cœur serré avec le côté de la surface antérieure vers le haut sur la plaque de perfusion. La dernière étape critique implique l’insertion de l’aiguille d’injection. Lors de l’avancement de l’aiguille vers le cœur, l’aiguille d’injection ne doit pas être détachée de la plaque de perfusion afin de maintenir une distance constante de la plaque. La position de l’insertion est près de l’apex du ventricule gauche. Insérez soigneusement l’aiguille sans torsion, car une telle torsion peut agrandir le trou. La profondeur de l’insertion de l’aiguille peut être estimée en regardant la marque rouge. Si l’aiguille est insérée trop profondément, la pointe peut percer à travers le septum ventriculaire et entrer dans le ventricule droit ou si la valvule mitrale et entrer dans l’oreillette gauche. Après avoir confirmé la disparition du sang de l’artère coronaire, l’aiguille doit être fixée avec du ruban adhésif sur la plaque de perfusion.
Une longueur d’aorte plus longue rend difficile le serrage de l’aorte à la bonne position. Si la pince est trop éloignée des oreillettes, le cœur peut tourner après perfusion de perfusat. Pour éviter cela, coupez l’aorte juste sous l’artère brachiocéphalique pour raccourcir l’aorte avant de la serrer.
Si le sang ne commence pas à s’extraire après la perfusion à une vitesse initiale de 0,5 mL/min, augmentez la vitesse à 1 mL/min. Si cela n’aide pas, l’aiguille d’injection peut être mal positionnée, comme dans le ventricule droit, le septum ventriculaire ou la paroi myocardique gauche. Dans un tel cas, retirez immédiatement l’aiguille et essayez de la réinsérer près de l’apex du ventricule gauche. Lors de l’insertion de l’aiguille plusieurs fois, les cellules digérées peuvent s’écouler des trous ouverts. Notez que cela n’affecte généralement pas sérieusement l’isolement cellulaire.
Les opérateurs peuvent surveiller l’ensemble du processus de perfusion antegrade du cœur à l’aide d’un microscope stéréoscopique pour observer les changements de couleur et de transparence et le redémarrage du battement des oreillettes avec la digestion. Un total de 10 mL de mélange d’enzymes devrait être le maximum requis, même pour un vieux cœur. Dans les coeurs plus jeunes (5-7 semaines), nous réduisons le volume à 9 ml, qui est semblable à l’approche par l’intermédiaire de la perfusion rétrograde avec le même mélange d’enzymes.
Le surnageant à la centrifugation finale contient des débris, des cellules sanguines et des non-myocytes tandis que le granule contient principalement des cardiomyocytes et des non-myocytes contaminants, tels que les fibroblastes et les cellules endothéliales. Pour purifier les cardiomyocytes, d’autres étapes sont nécessaires. En général, le culot doit être ressuscité dans le milieu de culture cellulaire approprié et préplaqué pendant 2 h à 37 °C sur un plat de culture cellulaire tissulaire, puis retirer délicatement les cardiomyocytes par pipetage et prélation pour la culture.
Le mélange d’enzymes contient une faible concentration deCa2+ (0,3 mM). Nous incubons donc les cellules digérées dansCIB-Ca2+-BSA (1,2 mMCa2+)avant la remise en suspension finale avec la solution de réuspension cellulaire (1,8 mMCa2+),et l’augmentation progressive deCa2+ évite de causer des dommages cellulaires7. Tant que les cardiomyocytes isolés sont intacts (cellules quiescentes sans contraction), cette procédure d’adaptation au Ca2+n’affecte pas la viabilité cellulaire chez la souris. Comme les cellules endommagées meurent pendant cette incubation, nous obtenons par conséquent un groupe cellulaire sain. De même, des myocytes auriculaires intacts isolés (cellules de repos sans contraction irrégulière) peuvent être stockés dans la même solution de remise en suspension cellulaire. Cependant, les myocytes auriculaires ont tendance à être plus délicats à stocker par rapport aux myocytes ventriculaires.
En laboratoire, cette méthode d’isolement est presque toujours réussie à moins que l’insertion de l’aiguille dans le ventricule gauche échoue. Nous avons également réussi à isoler des cellules du coeur hypertrophié préparé par constriction aortique transversale chirurgicale. Cependant, chez les souris âgées, qui ont souvent de petits infarctus du myocarde, la perfusion cesse à certains endroits, ce qui entraîne une digestion incomplète et donc un faible rendement (Figure 1C), similaire à la méthode rétrograde basée sur Langendorff. Dans de tels cas, la forme déformée du cœur peut être observée même au début de la perfusion.
Cette méthode de perfusion antegrade est utile pour isoler les cellules cardiaques de souris de différents âges, mais pas d’animaux plus gros, tels que les lapins et les cobayes. Il peut être possible d’appliquer cette méthode à des rats néonatals ou juvéniles avant le sevrage.
L’un des avantages de cette méthode de perfusion antegrade est qu’elle diminue les obstacles techniques associés à l’utilisation de la méthode de perfusion rétrograde à base de Langendorff pour les petits cœurs de souris. Le temps nécessaire à la perfusion est d’environ 7 min avec 10 mL d’enzymes, cette courte période de digestion augmente la viabilité des cellules. De plus, il permet d’effectuer la perfusion par la circulation coronaire du cœur, même après que les valves aortiques ont été digérées. L’isolement des myocytes auriculaires nécessite généralement une perfusion rétrograde à base de Langendorff et une incubation supplémentaire avec des enzymes17. Cette approche antegrade de perfusion, cependant, peut profondément perfuser le tissu avec l’enzyme pour isoler les myocytes atriaux.
Dans les expériences utilisant plusieurs souris, l’appareil de Langendorff doit être nettoyé avant de perfuser le cœur suivant. Cependant, dans la méthode antegrade actuelle, tant que le nombre souhaité de jeux d’instruments (par exemple, aiguilles de seringues et plaques de perfusion) sont préparés à l’avance, la perfusion peut être effectuée en continu.
Nous rapportons ci-dessus la méthodologie de base de la perfusion antegrade du coeur de souris utilisant les mêmes solutions que la méthode rétrograde Langendorff-basée de perfusion sans les produits chimiques additionnels. La composition du perfusat peut être modifiée en fonction du but de l’expérience, comme l’utilisation d’un détergent contenant de l’EGTA au lieu des enzymes pour fabriquer un cœur décellulaire18.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient T. Yamamoto et Y. Mori pour leur aide dans les expériences morphologiques. Ce travail a été soutenu par une subvention pour la recherche scientifique (C) de la Société japonaise pour la promotion de la science (18K06871 à M.O.K. et 17K08536 à H.M.).
matériels
| Name | Company | Catalog Number | Comments |
| Amphotericin B | Wako Pure Chemical Industries, Japan | ||
| Alexa Fluor 488 anti-mouse IgG antibody | Molecular Probes, USA | A11001 | Fluorescent-labeled secondary antibody. (1:400 dilution for immunostaining) |
| Anti-α-actinin (ACTN) | Sigma-Aldrich, USA | A7811 | Mouse monoclonal antibody (clone EA-53). (1:400 dilution for immunostaining) |
| Anti-atrial natriuretic peptide (ANP) | Merck-Millipore, USA | AB5490-I | Rabbit polyclonal antibody (1:2000 dilution for Western blots) |
| Anti-Glyceraldehyde 3-phosphate dehydrogenase (GAPDH) | Cell Signaling Technology, USA | 2118 | Mouse monoclonal antibody (1:10000 dilution for Western blots) |
| Anti-smooth muscle actin (SMA) | Dako, Denmark | M0851 | Mouse monoclonal antibody (clone 1A4) (1:400 for immunostaining) |
| Anti-rabbit IgG antibody | Amersham, GE Healthcare, USA | NA934 | Secondary antibody (1:10000 dilution for Western blots) |
| ATP disodium salt | Sigma-Aldrich, USA | A26209 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich, USA | A9418 | |
| Cell-Tak | Corning | 354240 | Biological material for adhesion of the cell or tissues |
| Chemi-Lumi One Super | Nacalai Tesque, Japan | 02230-14 | Chemiluminescent reagent used for western blotting. |
| Collagenase Type 2 | Worthington Biochemicals, USA | LS004176 | Choose the activity guaranteed to be greater than 300 unit/mg. |
| Complete Mini | Roche, Germany | 11836153001 | A mixture of several protease inhibitors. |
| 4'6'diamidino-2-phenylindole (DAPI) | Nacalai Tesque, Japan | 11034-56 | Used for cell-impermeant nuclear stainig |
| Dulbecco's Modified Eagle's Medium (DMEM) | Nacalai Tesque, Japan | 08458-45 | including 4.5 g/L gluose |
| Extension tube | Top, Japan | X1-50 | Connect with syringe and injection needle for antegrade perfusion. |
| EPC-8 patch-clamp amplifier | HEKA, Germany | ||
| Fetal bovine serum (FBS) | Sigma-Aldrich, USA | F7524-500ML | |
| Glass capillaries | Narishige Scientific Instrument Lab., Japan | outside diameter 1.5 mm, inside diameter 0.9 mm | |
| GTP lithium salt | Sigma-Aldrich, USA | G5884 | |
| Horizontal microelectrode puller | Germany) | P-97 | |
| Heater mat | Natsume Seisakusho, Japan | KN-475-3-40 | Equipment to warm the perfusion plate. |
| Infusion pump | TERUMO, Japan | TE-311 | Infusion syringe pump for antegrade perfusion. |
| Injeciton needle (27 gauge) | TERUMO, Japan | NN-2719S | Needle for insertion into the left ventricle. |
| Insulin (from bovine pancrease) | Sigma-Aldrich, USA | I5500 | Dissolve in 0.1 M HCl. |
| Mini cordless grinder | Funakoshi, Japan | cG-4A | Small grinder for homogenizing tissue in 1.5 mL sample tube. |
| 4%-Paraformaldehyde Phosphate Buffer solution (4% PFA) | Nacalai Tesque, Japan | 09154-85 | |
| Penicillin G potassium | Nacalai Tesque, Japan | 26239-84 | |
| Phenol Red | Nacalai Tesque, Japan | 26807-21 | |
| 10X Phosphate Buffered Saline (pH7.4) (10X PBS) | Nacalai Tesque, Japan | 27575-31 | |
| Plastic multi-well culture plate | Falcon, USA | 353226 | Use the lid of the multi-well culture plate as the perfusion plate. |
| Plastic syringe (20 mL) | TERUMO, Japan | SS-20ES | Use for infusion of CIB-EGTA. |
| Plastic syringe (30 mL) | TERUMO, Japan | SS-30ES | Use for infusion of Enzyme-mix |
| Plastic transfer pipette | Sarstedt, Germany | 86.1171 | Cut the tip just before sucking mouse heart into the pipette. |
| Polyvinylidene difluoride (PVDF) membrane | Merck-Millipore, USA | IPVH00010 | Immobilin-P membrane (Transfer membrane for protein blotting) |
| Protease | Sigma-Aldrich, USA | P5147 | A mixture of three or more proteases including extracellular serine protease. |
| 4X Sample buffer solution | Fuji Film, Japan | 198-13282 | Contains 0.25 M Tris-HCl (pH 6.8), 8 w/v% SDS,40 w/v% Glyceroland 0.02 w/v% BPB |
| SDS polyacrylamide gel (15%) | Fuji Film, Japan | 193-14991 | |
| Streptomycin sulfate | Nacalai Tesque, Japan | 32237-14 | |
| 10X Tris-Glycine buffer solution (10X TG) | Nacalai Tesque, Japan | 09422-81 | Contains 0.25 M-Tris and 1.92 M-Glycine, (pH 8.3) |
| Trypsin | Sigma-Aldrich, USA | T8003 | Trypsin from bovine Type 1. |
| Vascular clamp | Karl Hammacher GmbH, Germany | HSE 004-35 | Small straight vascular clamp used for clamping aorta. |
| All other reagents | Nacalai Tesque, Japan |
Références
- Langendorff, O. Untersuchungen am überlebenden Säugethierherzen. Pflügers Archiv: European Journal of Physiology. 61, 291-332 (1898).
- Berry, M. N., Friend, D. S., Scheuer, J. Morphology and metabolism of intact muscle cells isolated from adult rat heart. Circulation Research. 26 (6), 679-687 (1970).
- Powell, T., Terrar, D. A., Twist, V. W. Electrical properties of individual cells isolated from adult rat ventricular myocardium. Journal of Physiology. 302, 131-153 (1980).
- Joshi-Mukherjee, R., et al. Structural and functional plasticity in long-term cultures of adult ventricular myocytes. Journal of Molecular and Cellular Cardiology. 65, 76-87 (2013).
- Benndorf, K., Boldt, W., Nilius, B. Sodium current in single myocardial mouse cells. Pflügers Archiv: European Journal of Physiology. 404 (2), 190-196 (1985).
- Zhou, Y. Y., et al. Culture and adenoviral infection of adult mouse cardiac myocytes: methods for cellular genetic physiology. American Journal of Physiology-Heart and Circulatory Physiology. 279 (1), 429-436 (2000).
- Shioya, T. A simple technique for isolating healthy heart cells from mouse models. Journal of Physiological Sciences. 57 (6), 327-335 (2007).
- Fiset, C., Clark, R. B., Larsen, T. S., Giles, W. R. A rapidly activating sustained K+ current modulates repolarization and excitation-contraction coupling in adult mouse ventricle. Journal of Physiology. 504, 557-563 (1997).
- Ackers-Johnson, M., et al. A Simplified, Langendorff-Free Method for Concomitant Isolation of Viable Cardiac Myocytes and Nonmyocytes From the Adult Mouse Heart. Circulation Research. 119 (8), 909-920 (2016).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal to aged mice. Physiological Reports. 6 (9), 13688 (2018).
- Sambrano, G. R., et al. Navigating the signalling network in mouse cardiac myocytes. Nature. 420 (6916), 712-714 (2002).
- Limana, F., et al. bcl-2 overexpression promotes myocyte proliferation. Proceedings of the National Academy of Sciences of the United States of America. 99 (9), 6257-6262 (2002).
- Santiago, J. J., et al. Cardiac fibroblast to myofibroblast differentiation in vivo and in vitro: expression of focal adhesion components in neonatal and adult rat ventricular myofibroblasts. Developmental Dynamics. 239 (6), 1573-1584 (2010).
- Chistiakov, D. A., Orekhov, A. N., Bobryshev, Y. V. The role of cardiac fibroblasts in post-myocardial heart tissue repair. Experimental and Molecular Pathology. 101 (2), 231-240 (2016).
- Omatsu-Kanbe, M., Matsuura, H. A novel type of self-beating cardiomyocytes in adult mouse ventricles. Biochemical and Biophysical Research Communications. 381 (3), 361-366 (2009).
- Shan, D., Marchase, R. B., Chatham, J. C. Overexpression of TRPC3 increases apoptosis but not necrosis in response to ischemia-reperfusion in adult mouse cardiomyocytes. American Journal of Physiology. 294 (3), 833-841 (2008).
- Nakamura, H., et al. Presence and functional role of the rapidly activating delayed rectifier K(+) current in left and right atria of adult mice. European Journal of Pharmacology. 649 (1-3), 14-22 (2010).
- Milgroom, A., Ralston, E. Clearing skeletal muscle with CLARITY for light microscopy imaging. Cell Biology International. 40 (4), 478-483 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon