A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
3D الخلية المطبوعة سرطان نقص الأكز على رقاقة لتلخيص التقدم المرضي للسرطان الصلب
* These authors contributed equally
In This Article
Summary
نقص الأكسيجة هو السمة المميزة للبيئة الدقيقة الورم ويلعب دورا حاسما في تطور السرطان. تصف هذه المقالة عملية تصنيع سرطان نقص الأكاكس على رقاقة استنادا إلى تقنية طباعة الخلايا ثلاثية الأبعاد لتلخيص أمراض السرطان المرتبطة بنقص الأكسيا.
Abstract
إن البيئة الدقيقة للسرطان لها تأثير كبير على تطور المرض. على وجه الخصوص، نقص الأكxia هو المحرك الرئيسي للبقاء على قيد الحياة السرطان، والغزو، وschemresistance. على الرغم من أنه تم تطوير العديد من النماذج في المختبر لدراسة أمراض السرطان المرتبطة بنقص الأكسيا ، إلا أن التفاعل المعقد للبيئة الدقيقة للسرطان التي لوحظت في الجسم الحي لم يتم استنساخه بعد بسبب عدم وجود رقابة مكانية دقيقة. وبدلا من ذلك، اقترحت نهج تصنيع بيولوجي ثلاثي الأبعاد لإنشاء نظم فيزيائية دقيقة من أجل محاكاة أفضل لإيكولوجيا السرطان وتقييم دقيق لعلاج السرطان المضاد للسرطان. هنا، نقترح نهج الطباعة الخلوية ثلاثية الأبعاد لتصنيع سرطان نقص الأكز على رقاقة. تم تحديد المكونات المحفزة لنقص الأكسيجة في الشريحة على أساس محاكاة حاسوبية لتوزيع الأكسجين. طبعت حلقات متحدة المركز للسرطان ستروما باستخدام البيوينكات التي تحتوي على خلايا الورم الأرومي الدبقي والخلايا البطانية لتلخيص نوع من السرطان الصلب. أدركت الشريحة الناتجة نقص الأكسوجة المركزية والخبيثة المشددة في السرطان مع تشكيل علامات الفيزيولوجيا المرضية التمثيلية. وبشكل عام، من المتوقع أن يؤدي النهج المقترح لإنشاء نظام فيزيائي دقيق صلب الميكروبيولوجية المضاد للسرطان إلى سد الفجوة بين النماذج الحية وفي المختبر لأبحاث السرطان.
Introduction
البيئة الدقيقة للسرطان هو عامل حاسم يقود تطور السرطان. تحدد المكونات المتعددة، بما في ذلك الإشارات الكيميائية الحيوية والفيزيائية الحيوية والخلوية، السمات المرضية للسرطان. من بين هذه, نقص الأكسيا يرتبط ارتباطا قويا مع البقاء على قيد الحياة السرطان, انتشار, والغزو1. بسبب النمو غير المحدود وتقسيم الخلايا السرطانية ، يتم استنفاد المواد الغذائية والأوكسجين باستمرار ، ويتم توليد تدرج نقص الأوكسي. في ظل ظروف منخفضة الأكسجين، تقوم الخلايا بتنشيط عامل النسخ غير القابل للاختزال (HIF) المرتبط بالسلسلة الجزيئية. هذه العملية تحفز نواة نخرية ، وتتسبب في تغييرات التمثيل الغذائي ، وتبدأ تضخم الأوعية الدموية والانبثاث2،3. في وقت لاحق، نقص الأكسيا في الخلايا السرطانية يسبب تدمير الأنسجة الطبيعية المجاورة. وعلاوة على ذلك، يرتبط نقص الأكxia بقوة مع المقاومة العلاجية للأورام الصلبة في آداب متعددة العوامل. نقص الأكسيا قد يعوق بشدة العلاج الإشعاعي، كما الحساسية الإشعاعية محدودة بسبب أنواع الأكسجينالتفاعلية 1،4. بالإضافة إلى ذلك ، فإنه يقلل من مستويات الحموضة في البيئات الدقيقة للسرطان ، مما يقلل من تراكم الأدوية1. لذلك ، فإن إعادة إنتاج الميزات المرضية المتعلقة بنقص الأكxia في المختبر هي استراتيجية واعدة للنتائج العلمية وما قبل السريرية.
يعد وضع نماذج لبيئة دقيقة محددة للسرطان أمرا ضروريا لفهم تطور السرطان واستكشاف العلاجات المناسبة. على الرغم من أن النماذج الحيوانية قد استخدمت على نطاق واسع بسبب أهميتها الفسيولوجية القوية ، إلا أن القضايا المتعلقة باختلافات الأنواع والمشاكل الأخلاقية موجودة5. وعلاوة على ذلك، على الرغم من أن النماذج التقليدية 2D و 3D تسمح للتلاعب والتصوير في الوقت الحقيقي من الخلايا السرطانية لتحليل متعمق، لا يمكن إعادة رسملة تعقيدها المعماري والخلوي بالكامل. على سبيل المثال، تم استخدام نماذج كروية السرطان على نطاق واسع، حيث يمكن أن يولد تجميع الخلايا السرطانية في كروية نقص الأكباس بشكل طبيعي في القلب. وعلاوة على ذلك، تم إنتاج أعداد كبيرة من كرويدات الخلوية من حجم موحد باستخدام البلاستيك أو السيليكون القائم على أنظمة متعددةالآبار 6،7. ومع ذلك ، فإن انخفاض المرونة فيما يتعلق بالتقاط الهيكل الدقيق غير المتجانس للأنسجة السرطانية مع المنصات التقليدية يتطلب إنشاء تقنية تصنيع بيولوجي متقدمة لبناء منصة محاكاة حيوية عالية لتحسين أبحاث السرطان8.
أنظمة الفيزيولوجيا الدقيقة ثلاثية الأبعاد (MPSs) هي أدوات مفيدة لتلخيص الهندسة المعقدة والتقدم المرضي للخلايا السرطانية9. كما الخلايا السرطانية الشعور التدرج الكيميائي الحيوي لعوامل النمو وchemkines والتجانس الميكانيكية المستنسخة على النظام، يمكن التحقيق في السمات الهامة لتطوير السرطان في المختبر. على سبيل المثال، تمت دراسة قابلية البقاء للسرطان، الخبيث النقيلي، ومقاومة الأدوية اعتمادا على تركيزات الأكسجين متفاوتة باستخدام MPSs10،11. على الرغم من التطورات الأخيرة ، فإن توليد ظروف نقص الأكسيد في النماذج المختبرية يعتمد على إجراءات التصنيع المعقدة ، بما في ذلك الاتصال بمضخات الغاز المادية. لذلك، هناك حاجة إلى طرق بسيطة ومرنة لبناء بيئة دقيقة خاصة بالسرطان.
اكتسبت تكنولوجيا الطباعة الخلوية ثلاثية الأبعاد اهتماما كبيرا بسبب سيطرتها الدقيقة على الترتيب المكاني للمواد الحيوية لتلخيص العمارات البيولوجية الأصلية12. وعلى وجه الخصوص، تتغلب هذه التكنولوجيا على القيود القائمة لنماذج نقص الأكxia ثلاثية الأبعاد بسبب قدرتها العالية على التحكم وجدوى بناء السمات المكانية للبيئة الدقيقة للسرطان. كما تسهل الطباعة ثلاثية الأبعاد التصنيع بمساعدة الكمبيوتر من خلال عملية طبقة تلو الأخرى، وبالتالي توفير بناء سريع ودقيق وقابل للاستنساخ للهندسة المعقدة لمحاكاة معماريات الأنسجة الفعلية. بالإضافة إلى مزايا استراتيجيات التصنيع القائمة ل MPSs ثلاثية الأبعاد ، يمكن إعادة إنتاج السمات المرضية الفسيولوجية لتطور السرطان عن طريق نقش المكونات الكيميائية الحيوية والخلوية والفيزيائية الحيوية13،14.
هنا، نقدم استراتيجية طباعة الخلايا ثلاثية الأبعاد لسرطان نقص الأكز على رقاقة لتلخيص عدم التجانس لسرطان صلب (الشكل 1)15. تم تحديد معلمات التصنيع من خلال محاكاة حسابية لتشكيل نقص الأكxia المركزي في النظام. تمت طباعة حلقات متحدة المركز للسرطان ستروما باستخدام نباتات الكولاجين التي تحتوي على خلايا الورم الأرومي الدبقي والخلايا البطانية لمحاكاة الفيزيولوجيا المرضية للورم الأرومي الدبقي، وهو نوع من السرطان الصلب. تشكيل تدرج الأكسجين الشعاعي تفاقم خبيثة السرطان، مما يدل على العدوانية المعززة. وعلاوة على ذلك، فإننا تشير إلى وجهات النظر المستقبلية لتطبيقات رقاقة لنماذج ما قبل السريرية المريض محددة. ومن المتوقع أن يؤدي النهج المقترح لإنشاء نظام فيزيائي دقيق صلب الميكروبيولوجية السرطانية إلى سد الفجوة بين نماذج السرطان الحية والمضموية.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. محاكاة الكمبيوتر لتشكيل التدرج الأكسجين
-
جيل من نموذج الهندسة ثلاثية الأبعاد للطباعة تحت الأكز السرطان على رقاقة
- تشغيل برنامج CAD ثلاثي الأبعاد.
- رسم نموذج الهندسة من سرطان نقص الأكز على رقاقة. انقر على رسم وحدد المستوى المطلوب لرسم الهندسة. راجع الرسم(الشكل 2A)للاطلاع على مقياس التفاصيل لكل جزء.
- تعيين سمك الهندسة عن طريق النقر على ميزة-بروز بوس / قاعدة. أدخل سمك المطلوب (الرجوع إلى الشكل 2A)في المربع الفارغ وحدد رمز الاختيار الأخضر لتشكيل الهندسة 3D.
ملاحظة: يتم تعريف بعد السرطان على رقاقة استنادا إلى المجلدات المطلوبة من وسائل الإعلام وhyd hydrogel. وفي هذه التجربة، كانت الكميات المطلوبة من الوسائط والهيدروجيل حوالي 500 1 ميكرولتر و 500 ميكرولتر، على التوالي، استنادا إلى التجارب العملية السابقة لحل الطابعة البيولوجية القائمة على البثق. - حفظ ملف الهندسة بتنسيق ملف CAD ثلاثي الأبعاد (.prt أو .stl).
-
تحديد الكثافة الخلوية لتحريض النواة نقص الأكز
- تشغيل برنامج محاكاة الانتشار المادي.
- انقر على LiveLink وحدد برنامج CAD المستخدم. انقر على مزامنة لاستيراد هندسة سرطان hypoxic على رقاقة على برنامج المحاكاة. وبما أن المساحة الداخلية للغرفة سوف تمتلئ بوسط ثقافي في بيئة تجريبية فعلية، فإن الأكسجين سوف ينتشر عبر المساحة الداخلية للغرفة والبناء الخلوي، الذي سيتألف من الهيدروجيل المحملة بالخلايا.
ملاحظة: الرجوع إلى الدراسة السابقة للحصول على تفاصيل حول المعلمات المادية15. - تعريف الهندسة 3D المستوردة كحجم التحكم في الفضاء حيث ينتشر الأكسجين، والخلايا تستهلك الأكسجين(الشكل 2B).
- تشغيل تحليل الكمبيوتر لتحليل نشر الغاز بعد دليل المستخدم والأساليب التي أنشئت سابقا16،17.
- من نتائج تحليل الكمبيوتر، قم بتصدير بيانات تركيز الأكسجين المقدرة عبر المقطع العرضي A-A في كل نقطة زمنية تتبع دليل المستخدم. تستند المعادلة الحاكمة إلى القانون الأول لفيك، كما هو من التعبير عنه في Eq. (1)(الشكل 2C).
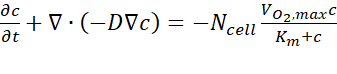
حيث ج هو التركيز، D هو معامل نشر الأكسجين، Nالخلية هي كثافة الخلايا،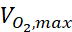 هو الحد الأقصى لمعدل المتابعة من الأوكسجين، وKm هو ثابت Michaelis-Menten. تم تطبيق الثوابت كما هو موضح في منشور سابق15.
هو الحد الأقصى لمعدل المتابعة من الأوكسجين، وKm هو ثابت Michaelis-Menten. تم تطبيق الثوابت كما هو موضح في منشور سابق15.
ملاحظة: كل نقطة زمنية تعني نقطة خطوة لمراقبة تغير انتشار الأكسجين بمرور الوقت. - تقييم ما إذا كان الحد الأدنى من مستوى الأكسجين يصل إلى عتبة نقص الأكسيجة وتكرار عملية تحليل الكمبيوتر مع زيادة أو تناقص الكثافة الخلوية.
ملاحظة: حدد أن تدرج نقص الأكسيا يتشكل في البناء إذا كان مستوى الأكسجين 80٪ في منطقة الهيدروجيل أقل من 0.02 mM بعد 24 ساعة. - تأكيد عدد الخلايا المطلوبة لتوليد التدرج الأكسجين مما يؤدي إلى نقص الأكسيجة في المنطقة الوسطى من القانون الأول فيك في الخطوة 1.2.5 ونتائج المحاكاة من الخطوة 1.2.6.
ملاحظة: في هذا البروتوكول، كان رقم الخلية 2 × 106 خلايا/كل بناء.
2. خلية ثقافة الخلايا السرطانية والخلايا السترومية
-
إعداد وسائل الإعلام ثقافة الخلية لتجنب الإجهاد الفسيولوجي
- لخلايا U-87 MG (خط الخلية الأرومية البشرية الخالدة)، ضع 12 مل من متوسط النسر المعدل Dulbecco عالي الجلوكوز الذي يحتوي على مصل بقري جنيني بنسبة 10٪، 100 U/mL البنسلين، و 100 ميكروغرام/مل ستربتومايسين في قارورة ثقافة الخلية T-75 في حاضنة 37 درجة مئوية، 5٪ CO2 رطب لمدة 30 دقيقة لتقليل الآثار الحرارية والقلوية للوسط على الخلايا.
ملاحظة: تم اختيار الورم الأرومي الدبقي كنوع من السرطان الصلب لأنه يحتوي على خصائص عدوانية في بيئة نقص الأكز. يمكن تطبيق أنواع أخرى مختلفة من السرطانات على هذا النموذج. - بالنسبة للخلايا البطانية الوريدية البشرية (HUVECs)، ضع 12 مل من متوسط نمو الخلايا البطانية في قارورة ثقافة الخلايا T-75 في حاضنة مرطبة5٪ CO 2 عند 37 درجة مئوية لمدة 30 دقيقة.
ملاحظة: تم اختيار HUVECs لأنه واحد من خطوط الخلايا البطانية الأكثر تمثيلا. ويمكن أيضا أن تطبق أنواع مختلفة من الخلايا السترومية لهذا النموذج.
- لخلايا U-87 MG (خط الخلية الأرومية البشرية الخالدة)، ضع 12 مل من متوسط النسر المعدل Dulbecco عالي الجلوكوز الذي يحتوي على مصل بقري جنيني بنسبة 10٪، 100 U/mL البنسلين، و 100 ميكروغرام/مل ستربتومايسين في قارورة ثقافة الخلية T-75 في حاضنة 37 درجة مئوية، 5٪ CO2 رطب لمدة 30 دقيقة لتقليل الآثار الحرارية والقلوية للوسط على الخلايا.
-
ذوبان سريع للخلايا السرطانية المبردة والخلايا السترومية وصيانتها
- نقل cryovials تحتوي على 5 × 105 U-87 خلايا MG وHUVECs من حاوية النيتروجين السائل إلى خزانة تدفق صفح. تخفيف فورا و retighten الغطاء للافراج عن الضغط الداخلي.
- ضع الخلايا المبردة برفق في حمام مائي عند 37 درجة مئوية لمدة دقيقتين، مع إبقاء الغطاء بعيدا عن الماء. شطف قارورة مع الإيثانول 70٪ تحت تدفق صفح لمنع التلوث.
- نقل الخلايا المذابة إلى قوارير تحتوي على وسائط ثقافة الخلية المعدة الموصوفة في الخطوة 2.1 ووضع قوارير تحتوي على الخلية في حاضنة 2 CO2 المرطبة بنسبة 37 درجة مئوية لاستعادة الخلية.
- تحديث وسائط الثقافة الخلية كل يومين والحفاظ على نمو الخلية.
- بعد 24 ساعة من ذوبان الجليد، استبدل وسائط ثقافة الخلية لتجنب السمية الخلوية لكبريتسيد ثنائي ميثيل (DMSO)، الذي كان يستخدم لتجميد الخلايا. استخدام HUVECs، التي مرت أقل من 6 مقاطع.
3. إعداد الكولاجين قبل هلام الحل
-
Solubilization من الكولاجين الإسفنج مع 0.1 N حمض الهيدروكلوريك (HCl)
- إعداد حل من 0.1 N HCl وتصفية مع مرشح حقنة 0.2 ميكرومتر.
- ل3 مل من 1٪ (ث / الخامس) تحييد الكولاجين قبل هلام الحل، وإعداد الإسفنج الكولاجين مقطعة إلى 5 × 5 ملم2 قطعة ووزنها 30 ملغ.
- نقل قطع الكولاجين قطع إلى قارورة زجاجية معقمة 10 مل.
ملاحظة: إعداد 1.5 مرات حجم هيدروجيل الكولاجين المطلوبة، بالنظر إلى فقدان الهيدروجيل بسبب السمة لزجة من محلول الكولاجين. - أضف 2.4 مل من 0.1 N HCl إلى القارورة الزجاجية المحتوية على الكولاجين واحتضنها على الروك عند 15 دورة في الدقيقة و4 درجات مئوية لمدة 3 أيام.
ملاحظة: كان حجم محلول 0.1 N HCl أربعة أخماس الحجم النهائي من هيدروجيل الكولاجين المطلوب. في هذه الحالة، تم إعداد 3 مل من الكولاجين. - بعد الهضم، غربال جزيئات الكولاجين غير المهضومة باستخدام مصفاة خلية 40 ميكرومتر. تخزين محلول الكولاجين الحمضية في 4 درجة مئوية واستخدامها في غضون 7 أيام.
-
تعديل الحموضة ل1٪ تحييد الكولاجين قبل هلام الحل
- طارد مركزي محلول الكولاجين الحمضي عند 1224 × ز لمدة 5 دقائق عند 4 درجات مئوية.
- أضف 30 ميكرولتر من محلول الفينول الأحمر كمؤشر درجة الحموضة إلى تركيز نهائي قدره 1٪ (v/v) و 300 ميكرولتر من العازلة الملحية العازلة بالفوسفات 10x (PBS) إلى تركيز نهائي قدره 10٪ (v/v) في محلول الكولاجين قبل الجل.
- تحييد الحموضة إلى 7 مع 1 N هيدروكسيد الصوديوم (NaOH)، والتحقق من تغيير اللون.
ملاحظة: استنادا إلى الصيغة، الشامات H+ = الضرس H+ x حجم H+ = الشامات OH-= الضرس OH- x حجم OH-، إضافة 240 ميكرولتر من NaOH. - إضافة الماء المقطر للحصول على حجم إجمالي قدره 3 مل.
- بعد تعديل درجة الحموضة، قم بتخزين محلول الكولاجين قبل الجل الذي تم تحييده بنسبة 1٪ (ث/v) عند درجة حرارة 4 درجات مئوية واستخدمه في غضون 3 أيام.
ملاحظة: للتحقق مسبقا من هلام الكولاجين المحايد قبل هلام الحل، وجعل قطرات الكولاجين 50 ميكرولتر على طبق صغير باستخدام ماصة النزوح إيجابية واحتضانها في حاضنة 37 درجة مئوية لمدة 1 ساعة. راجع الطرق الثلاث التالية للتحقق من الربط المتبادل بين قطرات الكولاجين. - تحقق مما إذا كان لون الكولاجين قد تغير إلى أبيض معتم من لون شفاف.
- إمالة الحاوية والتحقق ما إذا كان يتم الالتزام الكولاجين إلى الجزء السفلي من الحاوية.
- صب 1x برنامج تلفزيوني على قطرات والتحقق مما إذا لم يتم كسر بناء الكولاجين في الحل.
4.3D طباعة حاجز نفاذية الغاز
-
الطباعة ثلاثية الأبعاد لقالب بولي ذبيحة (خلات الإيثيلين والفينيل) (PEVA)
- توليد هندسة 3D من قالب PEVA التضحية المحددة في الخطوة 1 باستخدام برنامج CAD 3D (الشكل 3A).
ملاحظة: تم عرض الهندسة ثلاثية الأبعاد ومقياس النموذج التفصيلي بما في ذلك الأبعاد والوحدات وأنواع الأسطر في الشكل 2A. - تحويل ملف CAD ثلاثي الأبعاد إلى تنسيق ملف STL بالنقر فوق ملف | حفظ ملف نوع STL. أيضا، انقر على الخيار | نموذج الإخراج ASCII لإنشاء التعليمات البرمجية G.
- انقر على | الملف افتح ملف STL وحدد ملف STL المحفوظ لاستيراد ملف STL الذي تم إنشاؤه. انقر على نموذج شريحة من المبادلات STL-CAD لتوليد تلقائيا G-رمز من قالب PEVA التضحية (الشكل 3B، C).
ملاحظة: يتم إنشاء مسار الطباعة مع اتصال النقاط المتقاطعة بين الشكل الأساسي لملف STL و مستوى التقطيع (أي الطبقة). أساسا، الرقم الأساسي للجزأة في ملف STL هو مثلث يحتوي على إحداثيات ثلاثية الأبعاد. بعد الحصول على النقاط المتقاطعة بين المثلث والطبقة، يتم إنشاء رمز G للطباعة عن طريق توصيل كل نقطة دون مسار متراكب على طبقة18. يمكن استخدام أي خوارزمية توليد G-code على متن البرنامج لتوليد مسارات الطباعة لتصنيع رقاقة. - إعداد لاصقة معقمة والأنسجة المائية الشريحة.
ملاحظة: الزجاج الشريحة الهيدروفيلية أمر بالغ الأهمية للترابط الدائم من polydimethylsiloxane (PDMS) على الزجاج والالتصاق من يبني الكولاجين تغليف الخلايا السرطانية والخلايا النجمية. - اطبع قالب PEVA الأضاحي على الشريحة مع فوهة دقيقة 50 G بضغط هوائي قدره 500 كيلو باسكال عند 110 درجة مئوية.
ملاحظة: يتأثر عرض الخط بمعدل التغذية وقياس الفوهة ودرجة حرارة المادة. تم استخدام فوهة 50 G وتم تطبيق معدل تغذية 400 لتوليد عرض خط 500 ميكرومتر للجدار القرباني. يتم تعريف مقياس فوهة، الضغط الهوائي، ومعدل التغذية مع نتائج عملية19. الجدار التضحية يجب أن تكون سميكة بما فيه الكفاية لعقد حل PDMS، والتي هي الخطوة التالية تلفيق.
- توليد هندسة 3D من قالب PEVA التضحية المحددة في الخطوة 1 باستخدام برنامج CAD 3D (الشكل 3A).
-
صب حاجز البوليديميثيلسيلوكسيان (PDMS)
- مزيج 6 مل PDMS قاعدة الاستومر و 0.6 مل عامل علاج متجانسة أكثر من 5 دقائق في خزان من البلاستيك. هذا يمكن أن تلفيق 6 سرطان نقص الأكدمة على رقائق، والنظر في الخسارة بسبب السمة لزجة من PDMS.
- قم بتحميل محلول PDMS المخلوط في حقنة يمكن التخلص منها سعة 10 مل ولائم رأس الحقنة بطرف موزع بلاستيكي مدبب سعة 20 جراما.
- ملء قالب PEVA التضحية مع حل PDMS المخلوطة في الحقنة. سوف PDMS المخلوطة ملء قالب PEVA التضحية مع سطح محدب. ارتفاع حاجز PDMS سيكون أعلى من ذلك من قالب PEVA.
- علاج حاجز PDMS في فرن في 40 درجة مئوية لأكثر من 36 ساعة لتجنب ذوبان PEVA. لا تزيد درجة الحرارة إلى أكثر من 88 درجة مئوية، وهي درجة حرارة ذوبان PEVA.
- فصل قالب PEVA التضحية مع زوج من الملاقط الدقة وتعقيم الحاجز نفاذية الغاز في 120 درجة مئوية في الأوتوكلاف.
5. إعداد الخلايا المغلفة الكولاجين الأحبار الحيوية
-
انفصال الخلايا السرطانية المعدة والخلايا السترومية
ملاحظة: بالنظر إلى صلاحية الخلية، يجب إكمال عملية الطباعة بأكملها في أقرب وقت ممكن بعد فصل الخلايا.- غسل السرطان والخلايا السترومالية مع 10 مل من برنامج تلفزيوني 1x باستخدام ماصة المصلية; علاج مع 2 مل من 0.25٪ من حمض تريبسين-إيثيلينديامينتتراستيك (EDTA) باستخدام ماصة واحتضانها لمدة 3 دقائق في 37 درجة مئوية.
- تحييد الخلايا المريبة مع 3 مل من وسائط ثقافة الخلية؛ جمع تعليق الخلايا في أنابيب مخروطية 15 مل والطرد المركزي في 516 × ز لمدة 5 دقائق في 20 درجة مئوية.
- يستنشق العملاق ببطء؛ resuspend الكريات الخلية في وسائل الإعلام ثقافة الخلية 5 مل وعدد الخلايا باستخدام مقياس الدم.
- نقل 5 × 106 خلايا من كل نوع الخلية إلى أنابيب مخروطية جديدة 15 مل والطرد المركزي لهم في 516 × ز لمدة 5 دقائق في 20 درجة مئوية.
- يستنشق العملاقة قبالة ووضعه على الجليد الرطب.
-
خلط كل نوع من أنواع الخلايا مع محلول الكولاجين قبل الجل المحايد بنسبة 1٪
ملاحظة: لتجنب التجسيد الحراري لمحلول الكولاجين قبل الجل المحايد بنسبة 1٪، يجب إجراء هذه العملية على الجليد الرطب.- Resuspend كل نوع من بيليه الخلية التي تم جمعها في الخطوة 5.1.4 مع 20 ميكرولتر من وسائل الإعلام ثقافة الخلية لكل منهما.
- إضافة 1 مل من 1٪ تحييد الكولاجين قبل هلام الحل في كل من تعليق الخلية resuspended ومزجها بشكل متجانس باستخدام ماصة النزوح إيجابية. وسيكون التركيز النهائي لكل نوع من أنواع الخلايا 5 × 106 خلايا/مل.
- نقل الخلايا مغلفة التينك الكولاجين إلى 3 مل المحاقن المتاح باستخدام ماصة إيجابية المتاح وتخزين المحاقن في 4 درجة مئوية حتى 3D الخلية الطباعة.
6.3D طباعة الخلايا من حلقات سرطان ستروما متحدة المركز
-
طباعة الخلايا ثلاثية الأبعاد للجينجين الحيوية التي تغلف الخلايا السرطانية والخلايا السترومية
- توليد الهندسة ثلاثية الأبعاد للحلقات متحدة المركز السرطان ستروما المحددة في الخطوة 1.2 باستخدام برنامج CAD 3D.
ملاحظة: يتم تعريف أبعاد حلقات السرطان stroma متحدة المركز عن طريق معلمات محاكاة. يتم عرض أبعاد معلمة البعد النهائي في الشكل 3A. - تحويل ملف CAD 3D إلى تنسيق ملف STL وتوليد G-رمز من حلقات متحدة المركز السرطان ستروما باستخدام مبادل STL-CAD.
ملاحظة: الرجوع إلى الملاحظة في الخطوة 4.1.2 خوارزمية إنشاء التعليمات البرمجية G. - قم بتحميل صفائح الكولاجين المغلفة بالخلايا الموجودة في 3 مل من المحاقن القابلة للتصرف على رأس الطابعة ثلاثية الأبعاد وتعيين درجة حرارة الرأس والطبق إلى 15 درجة مئوية.
ملاحظة: إذا وصلت درجة حرارة رأس الطابعة ولوحتها إلى أكثر من 37 درجة مئوية، فإن bioink يحصل على ربط متقاطع ولا يطبع بعد الآن. - قم بتحميل مسار الطباعة الذي تم إنشاؤه على برنامج التحكم الخاص بالطابعة ثلاثية الأبعاد.
- بالنقر على زر البدء، قم بطباعة البيوينك الكولاجين تغليف الخلايا السرطانية والخلايا السترومالية على الحاجز نفاذية الغاز بعد G-رمز محملة مع إبرة بلاستيكية 18 G في ضغط هوائي من حوالي 20 كيلو باسكال في 15 درجة مئوية.
- في نهاية كل عملية طباعة، ضع يدويا غطاء زجاجي معقم مقاس 22 مم × 50 مم فوق الحاجز نفاذية الغاز لتوليد التدرج نقص الأكز.
ملاحظة: مقارنة مجموعتين اعتمادا على وجود غطاء زجاجي (GR+) وغياب (GR-) من ذلك للتحقق من توليد التدرج hypoxic. - بعد توليد ثلاثة سرطان نقص الأكز على رقائق، نقل رقائق إلى حاضنة في 37 درجة مئوية لمدة 1 ساعة لربط عبر bioinks الكولاجين.
- توليد الهندسة ثلاثية الأبعاد للحلقات متحدة المركز السرطان ستروما المحددة في الخطوة 1.2 باستخدام برنامج CAD 3D.
-
الانتهاء من عملية التصنيع وصيانة سرطان نقص الأكز على رقاقة
- بعد الانتهاء من جميع عمليات الطباعة الخلوية ثلاثية الأبعاد للسرطان نقص الأكاكس على رقاقة ، فرك بلطف نظارات الغطاء على رأس الحواجز نفاذية الغاز مع سكرادر الخلية للترابط ضيق(الشكل 4A، باء).
ملاحظة: يتم تجميع زجاج الغطاء وحاجز نفاذية الغاز عن طريق الترابط الكاره للماء دون الغراء الكيميائي، ببساطة كشط الجزء المستعبدين بين الزجاج الغطاء وحاجز PDMS. - إدخال 1.5 مل من متوسط نمو الخلايا البطانية لكل رقاقة. لتجنب انفصال بناء السرطان ، أدخل وسيط ثقافة الخلية من جانب واحد من الشريحة. إمالة رقاقة للسماح للخلية الثقافة وسائل الإعلام لتدفق باستخدام ماصة.
- تحديث وسائط ثقافة الخلية كل يوم لمدة أسبوع. استخدام ماصة لطابير متوسطة ثقافة الخلية; لا تستخدم مضخة ضغط.
- بعد الانتهاء من جميع عمليات الطباعة الخلوية ثلاثية الأبعاد للسرطان نقص الأكاكس على رقاقة ، فرك بلطف نظارات الغطاء على رأس الحواجز نفاذية الغاز مع سكرادر الخلية للترابط ضيق(الشكل 4A، باء).
7. تقييم قابلية خلية ما بعد الطباعة
-
إعداد العينات والعلاج مع محلول كالسين AM وEthD-1
- دافئ 1x برنامج تلفزيوني في حمام مائي في 37 درجة مئوية.
- إعداد حل المقايسة عن طريق إضافة 0.75 ميكرولتر من كالسين أسيتوكسي ميثيل (كالسين AM) و 3 ميكرولتر من ethidium homodimer (EthD-1) إلى 1.5 مل قبل برنامج تلفزيوني ساخن.
- يستنشق بعناية جميع وسائل الإعلام من رقاقة باستخدام ماصة.
- غسل بناء السرطان مع برنامج تلفزيوني قبل الحرب. ملء 1.5 مل برنامج تلفزيوني في رقاقة باستخدام ماصة والسماح لها الوقوف لمدة 10 دقيقة في درجة حرارة الغرفة. لتجنب تشوه بناء السرطان ، وإدخال برنامج تلفزيوني 1x من جانب واحد من رقائق وإمالة رقائق للسماح 1x برنامج تلفزيوني لتدفق.
- يستنشق برنامج تلفزيوني من رقاقة؛ علاج محلول الفحص 1.5 مل واحتضان رقاقة في 37 درجة مئوية لمدة 20 دقيقة باستخدام احباط للحماية من الضوء. استخدام ماصة ل أسبرات 1x برنامج تلفزيوني; لا تستخدم مضخة شفط.
-
تصوير صلاحية الخلية باستخدام مجهر مضان
- عرض والتقاط الخلايا المسماة باستخدام مجهر مضان(الشكل 4C).
ملاحظة: Calcein AM علامات الخلايا الحية مع مضان أخضر (الطول الموجي ~ 488 نانومتر). يمثل EthD-1 إشارة الخلايا الميتة ذات الفلورسينس الأحمر (الطول الموجي ~ 594 نانومتر). - عد عدد الخلايا الحية والميتة باستخدام برنامج التصوير، وهو برنامج مفتوح المصدر لمعالجة الصور، وحساب الجدوى مع الأرقام.
- عرض والتقاط الخلايا المسماة باستخدام مجهر مضان(الشكل 4C).
8. immunofluorescence للتحقق من صحة تشكيل نقص الأكxia المركزية وتأثيرها على السرطان الخبيث
-
تثبيت، permeabilization، ومنع بناء السرطان
- إعداد 1x PBS، 4٪ بارافورمالديهايد (PFA)، 0.1٪ (v/v) تريتون X-100، و 2٪ (ث / v) ألبوم مصل البقر (BSA) في درجة حرارة الغرفة.
- يستنشق بعناية جميع وسائل الإعلام من رقاقة باستخدام ماصة وشطف رقاقة ثلاث مرات مع برنامج تلفزيوني 1x. لتجنب تشوه بناء السرطان ، وإدخال برنامج تلفزيوني 1x من جانب واحد من رقائق وإمالة رقائق للسماح 1x برنامج تلفزيوني لتدفق. بين كل خطوة غسل، دع الشريحة تقف مع برنامج تلفزيوني 1x لمدة 5 دقائق لإزالة الحلول المتبقية.
ملاحظة: تم يستنشق 1x PBS باستخدام ماصة، وليس مضخة ضغط. - إضافة 500 ميكرولتر من 4٪ PFA لبناء السرطان على رقاقة باستخدام ماصة. اتركه لمدة 15 دقيقة واغسل ثلاث مرات مع برنامج تلفزيوني 1x لإصلاح الخلايا في بناء السرطان.
- علاج السرطان بناء مع 500 ميكرولتر من 0.1٪ تريتون X-100 باستخدام ماصة في درجة حرارة الغرفة لمدة 5 دقائق ويغسل ثلاث مرات مع برنامج تلفزيوني 1x لsolubilize و permeabilize غشاء الخلية.
- علاج السرطان بناء مع 500 μL من 2٪ BSA باستخدام ماصة في درجة حرارة الغرفة لمدة 1 ساعة لمنع epitopes رد الفعل.
ملاحظة: قم بتغطية الشريحة بفيلم البارافين لمنع التبخر. - بعد 1 ساعة، وغسل رقاقة ثلاث مرات مع برنامج تلفزيوني 1x.
-
العلاج بالأجسام المضادة الأولية ، والأجسام المضادة الثانوية ، وDAPI وتصوير الهيكل باستخدام المجهر confocal.
- إعداد الأجسام المضادة للتحكم في النمط المتساوي ومزيج من الأجسام المضادة الأولية عن طريق تمييع الأجسام المضادة في برنامج تلفزيوني 1x لكل تركيز العمل المطلوب.
ملاحظة: يتم سرد التفاصيل المحددة للأجسام المضادة في جدول المواد. وينبغي استخدام نفس تركيزات العمل من الأجسام المضادة للسيطرة isotype كما ينبغي استخدام الأجسام المضادة الأولية. - يستنشق بعناية كل برنامج تلفزيوني 1x من رقاقة باستخدام ماصة وعلاج رقاقة مع 200 ميكرولتر حل الأجسام المضادة الأولية في 4 درجة مئوية بين عشية وضحاها. تغطية رقائق مع فيلم البارافين لمنع التبخر.
- يستنشق حل الأجسام المضادة الأساسية وغسل رقاقة ثلاث مرات مع برنامج تلفزيوني 1x.
- تمييع الأجسام المضادة الثانوية وDAPI في برنامج تلفزيوني 1x إلى تركيز العمل المطلوب.
ملاحظة: يستخدم الأجسام المضادة الثانوية المترافقة مع الفلورسينس الأخضر في هذه الحالة بنسبة 1:200. تم استخدام DAPI بنسبة 1:1000. - يستنشق بعناية كل برنامج تلفزيوني 1x من رقاقة باستخدام ماصة وعلاج رقاقة مع 200 ميكرولتر الأجسام المضادة الثانوية DAPI الحل في 4 درجة مئوية لمدة 3 ساعة. تغطية رقاقة مع فيلم البارافين لمنع التبخر ومن ثم التفاف عليه مع رقائق الألومنيوم لمنع photobleaching.
- يستنشق حل الأجسام المضادة الثانوية DAPI وغسل رقاقة ثلاث مرات مع برنامج تلفزيوني 1x.
- بعد الانتهاء من خطوة تلطيخ، نقل بناء السرطان إلى طبق confocal عن طريق تجتاح بلطف مع ملقط.
- تصور والتقاط الخلايا المسماة باستخدام المجهر confocal (الشكل 5).
ملاحظة: تم تعديل الطول الموجي للمجهر الكونفوجال، اعتمادا على نوع علامات الفلورسنت. وترد تفاصيل محددة من الأجسام المضادة في جدول المواد. للكشف بكفاءة عن موضع الخلية ، سيكون من الأفضل مراقبة نواة DAPI الملطخة للبناء في البداية. وكانت أطوال الموجات الاستهلالية/الانبعاثية للكشف عن الإشارات الفلورية هي 358/461 نانومتر (DAPI، أزرق)، و494/517 نانومتر (أخضر)، و590/617 نانومتر (أحمر). وكانت التكبيرات 4x و 10x و 20x ، وتعديلها من أدنى إلى أعلى.
- إعداد الأجسام المضادة للتحكم في النمط المتساوي ومزيج من الأجسام المضادة الأولية عن طريق تمييع الأجسام المضادة في برنامج تلفزيوني 1x لكل تركيز العمل المطلوب.
9. التحليل الإحصائي
-
عد الخلايا مع برنامج معالجة الصور
- تشغيل برنامج معالجة الصور لحساب عدد الخلايا الحية والميتة.
- افتح ملفات الصور الفلورية. انقر على | الملف افتح صور TIFF واستوردها.
- قم بتحويل الصور إلى صور ذات تدرج رمادي 16 بت. انقر على | الصور اكتب | 16 بت تدرج الرمادي.
- ضبط العتبة بالنقر على | الصور ضبط | عتبة وحدد لون الخلايا لتكون سوداء.
- قطع الخلايا المدمجة عن بعضها البعض عن طريق النقر على عملية | | ثنائي مستجمعات المياه لحساب دقيق للخلايا.
- عد عدد الخلايا بالنقر على تحليل ثم على تحليل الجسيمات ثلاث مرات. حساب متوسط وعرض البيانات على أنها متوسط ± خطأ قياسي.
ملاحظة: تم تحليل علامات الفلورة المناعية من خلال مقارنة كثافة الفلورسينس.
Access restricted. Please log in or start a trial to view this content.
النتائج
تم تطوير سرطان نقص الأكز على رقاقة باستخدام تكنولوجيا الطباعة الخلوية ثلاثية الأبعاد بمساعدة الكمبيوتر لتلخيص نقص الأكxia والأمراض المرتبطة بالسرطان (الشكل 1). تم محاكاة نقل الأكسجين واستهلاكه باستخدام نموذج الهندسة ثلاثية الأبعاد. تم تصميم الرقاقة في شك...
Access restricted. Please log in or start a trial to view this content.
Discussion
في هذه الدراسة، ونحن نصف عملية تصنيع سرطان نقص الأكز على رقاقة على أساس تكنولوجيا الطباعة الخلوية 3D. تم التنبؤ بتكوين التدرج نقص الأكز في الشريحة المصممة من خلال المحاكاة الحاسوبية. واستنسخت البيئة التي يمكن أن تحفز تدرجا غير متجانس لنقص الأوكسي عن طريق استراتيجية بسيطة تجمع بين الحاجز ن?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ولا يوجد لدى صاحبي البلاغ أي إفصاحات.
Acknowledgements
تم دعم هذا البحث من قبل المؤسسة الوطنية للبحوث في كوريا (NRF) بتمويل من وزارة التعليم (رقم 2020R1A6A1A03047902 و NRF-2018H1A2A1062091) والحكومة الكورية (رقم. NRF-2019R1C1C1009606 و NRF-2019R1A3A3005437).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Cells | |||
| Human umbilical vein endothelial cells | Promocell | C-12200 | |
| U-87 MG cells | ATCC | ATCC HTB-14 | |
| Disposable | |||
| 0.2 μm syringe filter | Sartorius | 16534-K | |
| 10 mL disposable syringe | Jung Rim | 10ml 21G32 | |
| 10 mL glass vial | Hubena | A0039 | |
| 10 mL Serological pipette tip | SPL lifescience | 91010 | |
| 15 mL conical tube | SPL lifescience | 50015 | |
| 18G plastic needle | Musashi engineering | PN-18G-B | |
| 20G plastic tapered dispense tip | Musashi engineering | TPND-20G-U | |
| 22x50 glass cover | MARIENFIELD | 0101142 | |
| 25 mL Serological pipette tip | SPL lifescience | 90125 | |
| 3 mL disposable syringes | HENKE-JET | 4020-X00V0 | |
| 40 µm cell strainer | Falcon | 352360 | |
| 5 mL Serological pipette tip | SPL lifescience | 91005 | |
| 50 mL conical tube | SPL lifescience | 50050 | |
| 50 mL Serological pipette tip | SPL lifescience | 90150 | |
| 50N precision nozzle | Musashi engineering | HN-0.5ND | |
| Aluminum foil | SINKWANG | ||
| Capillary tips | Gilson | CP1000 | |
| Cell-scrapper | SPL lifescience | 90030 | |
| Confocal dish | SPL lifescience | 200350 | |
| Parafilm | Bemis | PM996 | |
| Pre-coated histology slide | MATSUNAMI | MAS-11 | |
| Reservoir | SPL lifescience | 23050 | |
| T-75 cell culture flask | SPL lifescience | 70075 | |
| Equipment | |||
| 3DX printer | T&R Biofab | ||
| Autoclave | JEIOTECH | AC-12 | |
| Centrifuger | Cyrozen | 1580MGR | |
| Confocal laser microscopy | Olympus Life Science | FV 1000 | |
| Fluorescence microscope | FISHER SCEINTIFIC | O221S366 | |
| Forcep | Korea Ace Scientific | HC.203-30 | |
| Hand tally counter | KTRIO | ||
| Hemocytometer | MARIENFIELD | 0650030 | |
| Incubator | Panasonic | MCO-170AIC | |
| Laminar flow cabinet | DAECHUNG SCIENCE | CB-BMMS C-001 | |
| Metal syringe | IWASHITA engineering | SUS BARREL 10CC | |
| Operating Scissors | Hirose | HC.13-122 | |
| Oven | JEIOTECH | OF-12, H070023 | |
| Positive displacement pipette | GILSON | NJ05652 | |
| Refrigerator | SAMSUNG | CRFD-1141 | |
| Voltex Mixer | DAIHAN scientific | VM-10 | |
| Water bath | DAIHAN SCIENTIFIC | WB-11 | |
| Water purifier | WASSER LAB | DI-GR | |
| Materials | |||
| 0.25 % Trypsin-EDTA | Gibco | 25200-072 | |
| 10x PBS | Intron | IBS-BP007a | |
| 4% Paraformaldehyde | Biosesang | ||
| 70% Ethanol | Daejung | 4018-4410 | |
| Anti-CD31 antibody | Abcam | ab28364 | |
| Anti-HIF-1 alpha antibody | Abcam | ab16066 | |
| Anti-SHMT2/SHMT antibody | Abcam | ab88664 | |
| Anti-SOX2 antibody | Abcam | ab75485 | |
| Bovine Serum Albumin | Thermo scientific | J10857-22 | |
| Collagen from porcine skin | Dalim tissen | PC-001-1g | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Thermofisher | D1306 | |
| Endothelial Cell Growth Medium-2 | Promocell | C22011 | |
| Fetal bovine serum | Gibco | 12483-020 | |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Theromofisher | A-11001 | |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | Theromofisher | A-11012 | |
| High-glucose Dulbecco’s Modified Eagle Medium(DMEM) | Hyclone | SH30243-0 | |
| Hydrochloric acid | Sigma-Aldrich | 311413-100ML | |
| Live/dead assay kit | Invitrogen | L3224 | |
| Mouse IgG1, kappa monoclonal [15-6E10A7] - Isotype Control | Abcam | ab170190 | |
| Penicillin/streptomycin | Gibco | 15140-122 | |
| Phenol red solution | Sigma-Aldrich | P0290-100ML | |
| Poly(ethylene-vinyl acetate) | Poly science | 06108-500 | |
| Polydimethylsiloxane | Dowhitech | sylgard 184 | |
| Rabbit IgG, polyclonal - Isotype Control | Abcam | ab37415 | |
| Sodium hydroxide solution | Samchun | S0610 | |
| Triton X-100 | Biosesang | TRI020-500-50 | |
| Trypan Blue | Sigma-Aldrich | T8154 | |
| Software | |||
| COMSOL Multiphysics 3.5a | COMSOL AB | ||
| IMS beamer | in-house software | ||
| SolidWorks Package | Dassault Systems SolidWorks Corporation |
References
- Jing, X., et al. Role of hypoxia in cancer therapy by regulating the tumor microenvironment. Molecular Cancer. 18 (1), 157(2019).
- Al Tameemi, W., Dale, T. P., Al-Jumaily, R. M. K., Forsyth, N. R. Hypoxia-modified cancer cell metabolism. Frontiers in Cell and Developmental Biology. 7, 4(2019).
- Petrova, V., Annicchiarico-Petruzzelli, M., Melino, G., Amelio, I. The hypoxic tumour microenvironment. Oncogenesis. 7 (1), 1-13 (2018).
- Hockel, M., Vaupel, P. Tumor hypoxia: definitions and current clinical, biologic, and molecular aspects. Journal of the National Cancer Institute. 93 (4), 266-276 (2001).
- Kim, H., Lin, Q., Glazer, P. M., Yun, Z. The hypoxic tumor microenvironment in vivo selects the cancer stem cell fate of breast cancer cells. Breast Cancer Research. 20 (1), 16(2018).
- Jeong, G. S., Lee, J., Yoon, J., Chung, S., Lee, S. -H. Viscoelastic lithography for fabricating self-organizing soft micro-honeycomb structures with ultra-high aspect ratios. Nature Communications. 7 (1), 1-9 (2016).
- Razian, G., Yu, Y., Ungrin, M. Production of large numbers of size-controlled tumor spheroids using microwell plates. Journal of Visualized Experiments:JoVE. (81), e50665(2013).
- Nunes, A. S., Barros, A. S., Costa, E. C., Moreira, A. F., Correia, I. J. 3D tumor spheroids as in vitro models to mimic in vivo human solid tumors resistance to therapeutic drugs. Biotechnology and Bioengineering. 116 (1), 206-226 (2019).
- Wan, L., Neumann, C., LeDuc, P. Tumor-on-a-chip for integrating a 3D tumor microenvironment: chemical and mechanical factors. Lab on a Chip. 20 (5), 873-888 (2020).
- Nam, H., Funamoto, K., Jeon, J. S. Cancer cell migration and cancer drug screening in oxygen tension gradient chip. Biomicrofluidics. 14 (4), 044107(2020).
- Palacio-Castañeda, V., Kooijman, L., Venzac, B., Verdurmen, W. P., Le Gac, S. Metabolic switching of tumor cells under hypoxic conditions in a tumor-on-a-chip model. Micromachines. 11 (4), 382(2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: a fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Mi, S., Du, Z., Xu, Y., Sun, W. The crossing and integration between microfluidic technology and 3D printing for organ-on-chips. Journal of Materials Chemistry B. 6 (39), 6191-6206 (2018).
- Yi, H. -G., Lee, H., Cho, D. -W. 3D printing of organs-on-chips. Bioengineering. 4 (1), 10(2017).
- Yi, H. -G., et al. A bioprinted human-glioblastoma-on-a-chip for the identification of patient-specific responses to chemoradiotherapy. Nature Biomedical Engineering. 3 (7), 509-519 (2019).
- Kang, T. -Y., Hong, J. M., Jung, J. W., Yoo, J. J., Cho, D. -W. Design and assessment of a microfluidic network system for oxygen transport in engineered tissue. Langmuir. 29 (2), 701-709 (2013).
- Woo Jung, J., et al. Evaluation of the effective diffusivity of a freeform fabricated scaffold using computational simulation. Journal of Biomechanical Engineering. 135 (8), (2013).
- Brown, A. C., De Beer, D. Development of a stereolithography (STL) slicing and G-code generation algorithm for an entry level 3-D printer. 2013 Africon (IEEE). , 1-5 (2013).
- Shim, J. -H., Lee, J. -S., Kim, J. Y., Cho, D. -W. Bioprinting of a mechanically enhanced three-dimensional dual cell-laden construct for osteochondral tissue engineering using a multi-head tissue/organ building system. Journal of Micromechanics and Microengineering. 22 (8), 085014(2012).
- Gillispie, G., et al. Assessment methodologies for extrusion-based bioink printability. Biofabrication. 12 (2), 022003(2020).
- Kim, B. S., Das, S., Jang, J., Cho, D. -W. Decellularized extracellular matrix-based bioinks for engineering tissue-and organ-specific microenvironments. Chemical Reviews. 120 (19), 10608-10661 (2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved