Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Cancer hypoxique sur puce imprimé par cellules 3D pour récapituler la progression pathologique du cancer solide
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
L’hypoxie est une caractéristique du microenvironnement tumoral et joue un rôle crucial dans la progression du cancer. Cet article décrit le processus de fabrication d’un cancer-sur-une-puce hypoxique basé sur la technologie 3D d’impression cellulaire pour récapituler une pathologie hypoxie-connexe du cancer.
Résumé
Le microenvironnement du cancer a un impact significatif sur la progression de la maladie. En particulier, l’hypoxie est le principal moteur de la survie au cancer, de l’invasion et de la chimiorésistance. Bien que plusieurs modèles in vitro aient été développés pour étudier la pathologie cancéreuse liée à l’hypoxie, l’interaction complexe du microenvironnement cancéreux observé in vivo n’a pas encore été reproduite en raison de l’absence de contrôle spatial précis. Au lieu de cela, des approches de biofabrication 3D ont été proposées pour créer des systèmes microphysiologiques pour une meilleure émulation de l’écologie du cancer et une évaluation précise du traitement anticancéreux. Ici, nous proposons une approche d’impression cellulaire 3D pour fabriquer un cancer hypoxique sur puce. Les composants induisant l’hypoxie dans la puce ont été déterminés sur la base d’une simulation informatique de la distribution de l’oxygène. Des anneaux concentriques de Cancer-stroma ont été imprimés utilisant des bioinks contenant des cellules de glioblastoma et des cellules endothéliales pour récapituler un type de cancer solide. La puce résultante a réalisé l’hypoxie centrale et la malignité aggravée dans le cancer avec la formation des marqueurs pathophysiologiques représentatifs. Dans l’ensemble, l’approche proposée pour créer un système microphysiologique solide-cancer-mimétique devrait combler l’écart entre les modèles in vivo et in vitro pour la recherche sur le cancer.
Introduction
Le microenvironnement du cancer est un facteur essentiel de la progression du cancer. Les composants multiples, y compris les indices biochimiques, biophysiques et cellulaires, déterminent les dispositifs pathologiques du cancer. Parmi ceux-ci, l’hypoxie est fortement associée à la survie, à la prolifération et à l’invasion du cancer1. En raison de la croissance et de la division illimitées des cellules cancéreuses, les nutriments et l’oxygène sont continuellement épuisés et un gradient hypoxique est généré. Dans des conditions de faible teneur en oxygène, les cellules activent la cascade moléculaire associée au facteur de transcription inductible par l’hypoxie (HIF). Ce processus induit un noyau nécrotique, déclenche des changements métaboliques et initie une hyperplasie des vaisseaux sanguins et des métastases2,3. Par la suite, l’hypoxie dans les cellules cancéreuses provoque la destruction des tissus normaux voisins. En outre, l’hypoxie est fortement associée à la résistance thérapeutique des tumeurs solides de manière multifactorielle. L’hypoxie peut gravement entraver la radiothérapie, car la radiosensibilité est limitée en raison des espèces réactives de l’oxygène1,4. En outre, il diminue les niveaux de pH des microenvironnements du cancer, ce qui diminue l’accumulation de médicaments1. Par conséquent, la reproduction des dispositifs pathologiques liés à l’hypoxie in vitro est une stratégie prometteuse pour des résultats scientifiques et précliniques.
La modélisation d’un microenvironnement spécifique du cancer est essentielle pour comprendre le développement du cancer et explorer les traitements appropriés. Bien que les modèles animaux aient été largement utilisés en raison de leur forte pertinence physiologique, des problèmes liés aux différences entre les espèces et aux problèmes éthiques existent5. De plus, bien que les modèles 2D et 3D conventionnels permettent la manipulation et l’imagerie en temps réel des cellules cancéreuses pour une analyse approfondie, leur complexité architecturale et cellulaire ne peut pas être entièrement récapitulée. Par exemple, les modèles de sphéroïdes du cancer ont été largement utilisés, car l’agrégation des cellules cancéreuses dans un sphéroïde peut générer naturellement une hypoxie dans le noyau. De plus, un grand nombre de sphéroïdes cellulaires de taille uniforme ont été produits à l’aide de systèmes multi-puits à base de plastique ou de silicone6,7. Cependant, la flexibilité moindre en ce qui concerne la capture de la structure hétérogène exacte des tissus cancéreux avec des plates-formes conventionnelles a nécessité la mise en place d’une technologie de biofabrication avancée pour construire une plate-forme hautement biomimétique afin d’améliorer la recherche sur le cancer8.
Les systèmes microphysiologiques 3D (MPS) sont des outils utiles pour récapituler la géométrie complexe et la progression pathologique des cellules cancéreuses9. Comme les cellules cancéreuses détectent le gradient biochimique des facteurs de croissance et des chimiokines et l’hétérogénéité mécanique reproduite sur le système, des caractéristiques importantes du développement du cancer peuvent être étudiées in vitro. Par exemple, la viabilité du cancer, la malignité métastatique et la résistance aux médicaments en fonction des concentrations variables d’oxygène ont été étudiées à l’aide des MPS10,11. Malgré les progrès récents, la génération de conditions hypoxiques de modèles in vitro repose sur des procédures de fabrication complexes, y compris la connexion avec des pompes à essence physiques. Par conséquent, des méthodes simples et flexibles pour construire des microenvironnements spécifiques au cancer sont nécessaires.
La technologie d’impression cellulaire 3D a fait l’effet d’une attention considérable en raison de son contrôle précis de la disposition spatiale des biomatériaux pour récapituler les architectures biologiques natives12. En particulier, cette technologie surmonte les limites existantes des modèles d’hypoxie 3D en raison de sa grande contrôlabilité et de sa faisabilité pour la construction des caractéristiques spatiales du microenvironnement du cancer. L’impression 3D facilite également la fabrication assistée par ordinateur grâce à un processus couche par couche, fournissant ainsi une construction rapide, précise et reproductible de géométries complexes pour imiter les architectures tissulaires réelles. En plus des avantages des stratégies de fabrication existantes pour les MPS 3D, les caractéristiques physiopathologiques de la progression du cancer peuvent être reproduites en modelant les composants biochimiques, cellulaires et biophysiques13,14.
Nous présentons ici une stratégie d’impression cellulaire 3D pour un cancer hypoxique sur puce permettant de récapituler l’hétérogénéité d’un cancer solide(Figure 1)15. Les paramètres de fabrication ont été déterminés par une simulation computationnelle de la formation centrale d’hypoxie dans le système. Des anneaux concentriques de Cancer-stroma ont été imprimés utilisant des bioinks de collagène contenant des cellules de glioblastoma et des cellules endothéliales pour imiter la pathophysiologie du glioblastoma, un type de cancer plein. La formation d’un gradient radial d’oxygène a aggravé la malignité de cancer, indiquant l’agressivité renforcée. En outre, nous indiquons des perspectives d’avenir pour les applications de la puce aux modèles précliniques spécifiques au patient. L’approche proposée pour créer un système microphysiologique solide-cancer-mimétique devrait combler l’écart entre les modèles in vivo et in vitro de cancer.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Simulation informatique de la formation du gradient d’oxygène
-
Génération d’un modèle de géométrie 3D pour l’impression hypoxique de cancer sur puce
- Exécutez un logiciel de CAO 3D.
- Esquissez le modèle de géométrie du cancer hypoxique sur puce. Cliquez sur Esquisse (Sketch) et sélectionnez le plan souhaité pour dessiner la géométrie. Reportez-vous au dessin(figure 2A)pour l’échelle de détail de chaque pièce.
- Définissez l’épaisseur de la géométrie en cliquant sur Boss/Base de la fonction-saillie. Entrez l’épaisseur souhaitée (reportez-vous à la figure 2A)dans la zone vide et sélectionnez l’icône de coche verte pour former la géométrie 3D.
REMARQUE: La dimension du cancer sur puce est définie en fonction des volumes souhaités de milieux et d’hydrogel. Dans la présente expérience, les volumes souhaités de milieux et d’hydrogel étaient d’environ 1 500 μL et 500 μL, respectivement, sur la base des expériences pratiques antérieures pour la résolution du bio-imprimeur à base d’extrusion. - Enregistrez le fichier de géométrie au format de fichier CAO 3D (.prt ou .stl).
-
Détermination de la densité cellulaire pour l’induction du noyau hypoxique
- Exécutez un programme de simulation de diffusion physique.
- Cliquez sur LiveLink et sélectionnez le programme de CAO utilisé. Cliquez sur Synchroniser pour importer la géométrie du cancer hypoxique sur puce dans le programme de simulation. Comme l’espace intérieur de la chambre sera rempli d’un milieu de culture dans un cadre expérimental réel, l’oxygène diffusera à travers l’espace intérieur de la chambre et la construction cellulaire, qui sera composée d’hydrogels chargés de cellules.
NOTA : Se reporter à l’étude précédente pour plus de détails sur les paramètres physiques15. - Définissez la géométrie 3D importée comme un volume de contrôle de l’espace dans lequel l’oxygène diffuse et les cellules consomment de l’oxygène(Figure 2B).
- Exécuter une analyse informatique pour l’analyse de la diffusion des gaz en suivant un guide de l’utilisateur et des méthodes précédemment établies16,17.
- À partir des résultats de l’analyse informatique, exporter les données de concentration d’oxygène estimées sur la section transversale A-A' à chaque point temporel en suivant le guide de l’utilisateur. L’équation gouvernante est basée sur la première loi de Fick, telle qu’exprimée dans Eq. (1) (Figure 2C).
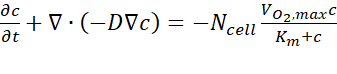
où c est la concentration, D est le coefficient de diffusion de l’oxygène, Ncell est la densité des cellules,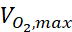 est le taux maximal de prise d’oxygène, et Km est la constante de Michaelis-Menten. Les constantes ont été appliquées comme décrit dans une publication précédente15.
est le taux maximal de prise d’oxygène, et Km est la constante de Michaelis-Menten. Les constantes ont été appliquées comme décrit dans une publication précédente15.
REMARQUE: Chaque point de temps signifie un point d’étape pour observer le changement de diffusion de l’oxygène au fil du temps. - Évaluer si le niveau minimal d’oxygène atteint un seuil d’hypoxie et répéter le processus d’analyse informatique avec une augmentation ou une décrémentation de la densité cellulaire.
REMARQUE: Définir que le gradient d’hypoxie est formé dans la construction si le niveau d’oxygène de 80% dans la zone d’hydrogel est inférieur à 0,02 mM après 24 h. - Confirmer le nombre de cellules nécessaires pour générer le gradient d’oxygène induisant l’hypoxie dans la région centrale à partir de la première loi de Fick à l’étape 1.2.5 et les résultats de la simulation de l’étape 1.2.6.
Remarque : dans ce protocole, le numéro de cellule était 2 × 106 cellules/chaque construction.
2. Culture cellulaire de cellules cancéreuses et de cellules stromales
-
Préparation de milieux de culture cellulaire pour éviter le stress physiologique
- Pour les cellules U-87 MG (lignée cellulaire immortalisée de glioblastome humain), placer 12 mL de milieu Eagle modifié de Dulbecco à haute teneur en glucose contenant 10 % de sérum fœtal bovin, 100 U/mL de pénicilline et 100 μg/mL de streptomycine dans une fiole de culture cellulaire T-75 dans un incubateur humidifié à 37 °C et 5 %co2 pendant 30 min afin de minimiser les effets thermiques et alcalins du milieu sur les cellules.
REMARQUE : Le glioblastome a été choisi comme type de cancer solide parce qu’il présente des caractéristiques agressives dans un environnement hypoxique. D’autres types de cancers peuvent être appliqués à ce modèle. - Pour les cellules endothéliales des veines ombilicales humaines (HUVECs), placer 12 mL de milieu de croissance des cellules endothéliales dans une fiole de culture cellulaire T-75 dans un incubateur humidifié à 5 % deCO2 à 37 °C pendant 30 min.
REMARQUE: HUVECs ont été choisis parce que c’est l’une des lignées cellulaires endothéliales les plus représentatives. Divers types de cellules stromales peuvent également être appliqués à ce modèle.
- Pour les cellules U-87 MG (lignée cellulaire immortalisée de glioblastome humain), placer 12 mL de milieu Eagle modifié de Dulbecco à haute teneur en glucose contenant 10 % de sérum fœtal bovin, 100 U/mL de pénicilline et 100 μg/mL de streptomycine dans une fiole de culture cellulaire T-75 dans un incubateur humidifié à 37 °C et 5 %co2 pendant 30 min afin de minimiser les effets thermiques et alcalins du milieu sur les cellules.
-
Décongélation rapide des cellules cancéreuses cryoconservées et des cellules stromales et leur maintien
- Déplacer les cryovials contenant 5 x 105 cellules U-87 MG et HUVECs du récipient d’azote liquide vers une armoire à flux laminaire. Desserrer et retenser immédiatement le capuchon pour libérer la pression interne.
- Placer délicatement les cellules cryoconservées dans un bain-marie à 37 °C pendant 2 min, en gardant le bouchon hors de l’eau. Rincez les flacons avec de l’éthanol à 70% sous flux laminaire pour éviter la contamination.
- Transdre les cellules décongelées dans les fioles contenant le milieu de culture cellulaire préparé décrit à l’étape 2.1 et placer les fioles contenant des cellules dans un incubateur humidifié à 5 % deCO2 à 37 °C pour la récupération cellulaire.
- Actualisez le milieu de culture cellulaire tous les 2 jours et maintenez la croissance cellulaire.
- Après 24 h de décongélation, remplacer le milieu de culture cellulaire pour éviter la cytotoxicité du diméthylsulfoxyde (DMSO), qui a été utilisé pour la congélation cellulaire. Utilisez HUVECs, qui a subi moins de 6 passages.
3. Préparation d’une solution de pré-gel de collagène
-
Solubilisation de l’éponge de collagène avec de l’acide chlorhydrique 0,1 N (HCl)
- Préparez une solution de 0,1 N HCl et filtrez-la avec un filtre à seringue de 0,2 μm.
- Pour 3 mL d’une solution de prégélation de collagène neutralisée à 1 % (p/v), préparer des éponges de collagène coupées en morceaux de 5 x 5 mm2 et pesant 30 mg.
- Transférer les morceaux de collagène coupés dans un flacon en verre stérile de 10 mL.
REMARQUE: Préparer 1,5 fois le volume de l’hydrogel de collagène requis, en tenant compte de la perte de l’hydrogel due à la caractéristique collante de la solution de collagène. - Ajouter 2,4 mL de 0,1 N HCl dans le flacon en verre contenant du collagène et l’incuber sur la bascule à 15 tr/min et à 4 °C pendant 3 jours.
REMARQUE: Le volume de la solution de HCl de 0,1 N était les quatre cinquièmes du volume final de l’hydrogel de collagène requis. Dans ce cas-ci, 3 ml de collagène ont été préparés. - Après la digestion, tamisez les particules de collagène non digérées à l’aide d’une passoire cellulaire de 40 μm. Conserver la solution de collagène acide à 4 °C et l’utiliser dans les 7 jours.
-
Ajustement du pH pour une solution de pré-gel de collagène neutralisée à 1%
- Centrifuger la solution de collagène acide à 1224 x g pendant 5 min à 4 °C.
- Ajouter 30 μL de solution rouge de phénol comme indicateur de pH à une concentration finale de 1 % (v/v) et 300 μL de tampon salin tamponné au phosphate (PBS) 10x à une concentration finale de 10 % (v/v) dans la solution prégélifiante de collagène.
- Neutraliser le pH à 7 avec 1 N d’hydroxyde de sodium (NaOH), en vérifiant le changement de couleur.
REMARQUE: Sur la base de la formule, les moles H+ = molarité H+ x volume H+ = moles OH-= molarité OH- x volume OH-, ajoutent 240 μL de NaOH. - Ajouter de l’eau distillée pour obtenir un volume total de 3 mL.
- Après ajustement du pH, conserver la solution de prégélation de collagène neutralisée à 1 % (p/v) à 4 °C et l’utiliser dans les 3 jours.
REMARQUE: Pour précontrôler la gélification de la solution de pré-gel de collagène neutralisée, faites des gouttelettes de collagène de 50 μL sur un petit plat à l’aide d’une pipette à déplacement positif et incuberez-les dans un incubateur à 37 °C pendant 1 h. Reportez-vous aux trois méthodes suivantes pour vérifier la réticulation des gouttelettes de collagène. - Vérifiez si la couleur du collagène est devenue blanche opaque à partir d’une couleur transparente.
- Inclinez le récipient et vérifiez si le collagène est collé au fond du récipient.
- Versez 1x PBS sur les gouttelettes et vérifiez si la construction de collagène n’est pas cassée dans la solution.
4.3D impression d’une barrière perméable aux gaz
-
Impression 3D d’un moule sacrificiel poly (éthylène-acétate de vinyle) (PEVA)
- Générez la géométrie 3D du moule PEVA sacrificiel défini à l’étape 1 à l’aide d’un logiciel de CAO 3D(Figure 3A).
REMARQUE : La géométrie 3D et l’échelle détaillée du modèle, y compris les dimensions, les unités et les types de lignes, ont été illustrées à la figure 2A. - Convertissez le fichier 3D CAD en un format de fichier STL en cliquant sur Fichier | Save-Type de fichier en tant que STL. Cliquez également sur Option | Formulaire de sortie au format ASCII pour la génération de code G.
- Cliquez sur Fichier | Ouvrez le fichier STL et sélectionnez le fichier STL enregistré pour importer le fichier STL généré. Cliquez sur Slice model of STL-CAD exchanger pour générer automatiquement le code G du moule sacrificiel PEVA(Figure 3B,C).
REMARQUE: Le chemin d’impression est généré avec la connexion de points intersectés entre la figure fondamentale du fichier STL et le plan de découpage (c’est-à-dire, couche). Fondamentalement, la figure fondamentale d’un fragment dans un fichier STL est un triangle qui contient les coordonnées 3D. Une fois les points intersectés entre le triangle et le calque obtenus, un code G pour l’impression est généré en connectant chaque point sans chemin superposé sur une couche18. Tout algorithme de génération de code G sur un logiciel embarqué peut être utilisé pour générer des chemins d’impression pour la fabrication de la puce. - Préparez un adhésif stérile et une lame d’histologie hydrophile.
REMARQUE: Le verre lame hydrophile est essentiel pour la liaison permanente du polydiméthylsiloxane (PDMS) sur le verre et l’adhérence du collagène construit encapsulant les cellules cancéreuses et les cellules stromales. - Imprimez le moule sacrificiel PEVA sur la lame avec une buse de précision de 50 G à une pression pneumatique de 500 kPa à 110 °C.
REMARQUE: La largeur de ligne est affectée par la vitesse d’avance, la jauge de buse et la température du matériau. La buse de 50 G a été utilisée et une vitesse d’alimentation de 400 a été appliquée pour générer une largeur de ligne de 500 μm pour la paroi sacrificielle. La jauge de buse, la pression pneumatique et la vitesse d’alimentation sont définies avec des résultats pratiques19. La paroi sacrificielle doit être suffisamment épaisse pour contenir la solution PDMS, qui est la prochaine étape de fabrication.
- Générez la géométrie 3D du moule PEVA sacrificiel défini à l’étape 1 à l’aide d’un logiciel de CAO 3D(Figure 3A).
-
Coulée de la barrière de polydiméthylsiloxane (PDMS)
- Mélanger 6 mL d’élastomère de base PDMS et 0,6 mL d’agent de durcissement de manière homogène sur 5 min dans un réservoir en plastique. Cela peut fabriquer 6 cancer-sur-puces hypoxiques, compte tenu de la perte due à la caractéristique collante du PDMS.
- Chargez la solution PDMS mélangée dans une seringue jetable de 10 mL et ajustez la tête de seringue avec une pointe de distribution conique en plastique de 20 G.
- Remplissez le moule PEVA sacrificiel avec la solution PDMS mélangée dans la seringue. Le PDMS mélangé remplira le moule PEVA sacrificiel avec une surface convexe. La hauteur de la barrière PDMS sera supérieure à celle du moule PEVA.
- Durcir la barrière PDMS dans un four à 40 °C pendant plus de 36 h pour éviter la fusion de la PEVA. N’augmentez pas la température à plus de 88 °C, qui est la température de fusion de la PEVA.
- Détachez le moule sacrificiel PEVA avec une paire de pinces de précision et stérilisez la barrière perméable aux gaz à 120 °C dans un autoclave.
5. Préparation de bio-encres de collagène encapsulées dans les cellules
-
Détachement des cellules cancéreuses préparées et des cellules stromales
REMARQUE: Compte tenu de la viabilité des cellules, l’ensemble du processus d’impression doit être terminé dès que possible après le détachement des cellules.- Laver le cancer et les cellules stromales avec 10 ml de PBS 1x à l’aide d’une pipette sérologique; traiter avec 2 mL d’acide trypsine-éthylènediaminetétraacétique (EDTA) à 0,25 % à l’aide d’une pipette et les incuber pendant 3 min à 37 °C.
- Neutraliser les cellules trypsinisées avec 3 mL de milieux de culture cellulaire; recueillir les suspensions de cellules dans des tubes coniques de 15 mL et centrifuger à 516 x g pendant 5 min à 20 °C.
- Aspirez le surnageant lentement; ressusciter les pastilles cellulaires dans des milieux de culture cellulaire de 5 mL et compter le nombre de cellules à l’aide d’un hémocytomètre.
- Transférer 5 x 106 cellules de chaque type de cellule dans de nouveaux tubes coniques de 15 mL et les centrifuger à 516 x g pendant 5 min à 20 °C.
- Aspirez le surnageant et placez-le sur de la glace humide.
-
Mélange de chaque type de cellule avec la solution de pré-gel de collagène neutralisé à 1%
REMARQUE: Pour éviter la solidification thermique de la solution de pré-gel de collagène neutralisé à 1%, ce processus doit être effectué sur de la glace humide.- Ressusciter chaque type de pastille cellulaire recueillie à l’étape 5.1.4 avec 20 μL de milieu de culture cellulaire chacun.
- Ajouter 1 mL de la solution de prégélation de collagène neutralisée à 1 % dans chacune des suspensions cellulaires remises en suspension et les mélanger de manière homogène à l’aide d’une pipette à déplacement positif. La concentration finale de chaque type de cellule sera de 5 x 106 cellules/mL.
- Transférer les bioinks de collagène encapsulés dans des seringues jetables de 3 mL à l’aide d’une pipette jetable positive et stocker les seringues à 4 °C jusqu’à l’impression cellulaire 3D.
6.3D impression cellulaire d’anneaux concentriques cancer-stroma
-
Impression cellulaire 3D de bioinks de collagène encapsulant des cellules cancéreuses et des cellules stromales
- Générez la géométrie 3D des anneaux concentriques cancer-stroma définis à l’étape 1.2 à l’aide d’un logiciel de CAO 3D.
REMARQUE: Les dimensions des anneaux concentriques stroma de cancer sont définies par des paramètres simulés. Les dimensions finales du paramètre de dimension sont illustrées à la figure 3A. - Convertissez le fichier DEAO 3D en un format de fichier STL et générez un code G des anneaux concentriques cancer-stroma à l’aide d’un échangeur STL-CAD.
Remarque : reportez-vous à la remarque de l’étape 4.1.2 pour l’algorithme de génération de code G. - Chargez les bioinks de collagène encapsulés dans les cellules contenues dans les seringues jetables de 3 mL sur la tête de l’imprimante 3D et réglez la température de la tête et de la plaque à 15 °C.
REMARQUE: Si la température de la tête et de la plaque de l’imprimante atteint plus de 37 ° C, le bioink est réticulé et n’imprime plus. - Chargez le chemin d’impression généré sur le logiciel de contrôle de l’imprimante 3D.
- En cliquant sur le bouton Démarrer, imprimez les bioinks de collagène encapsulant les cellules cancéreuses et les cellules stromales sur la barrière perméable aux gaz en suivant le code G chargé avec une aiguille en plastique de 18 G à une pression pneumatique d’environ 20 kPa à 15 °C.
- À la fin de chaque opération d’impression, placez manuellement un couvercle en verre stérilisé de 22 mm x 50 mm sur la barrière perméable aux gaz pour générer le gradient hypoxique.
REMARQUE: Comparez deux groupes en fonction de la présence de couvercle en verre (GR +) et de l’absence (GR-) de celle-ci pour vérifier la génération du gradient hypoxique. - Après avoir généré trois cancers hypoxiques sur puces, transférer les puces dans un incubateur à 37 °C pendant 1 h pour réticuler les bioinks de collagène.
- Générez la géométrie 3D des anneaux concentriques cancer-stroma définis à l’étape 1.2 à l’aide d’un logiciel de CAO 3D.
-
Achèvement du processus de fabrication et entretien du cancer hypoxique sur puce
- Après l’achèvement de tous les processus d’impression cellulaire 3D du cancer hypoxique sur puce, frottez doucement les verres de couverture sur le dessus des barrières perméables aux gaz avec le grattoir à cellules pour une liaison serrée (Figure 4A, B).
REMARQUE: Le verre de couverture et la barrière perméable aux gaz sont assemblés via une liaison hydrophobe sans colles chimiques, en grattant simplement la partie collée entre le verre de couverture et la barrière PDMS. - Introduire 1,5 mL de milieu de croissance cellulaire endothéliale à chaque puce. Pour éviter le détachement de la construction du cancer, introduisez un milieu de culture cellulaire d’un côté de la puce. Inclinez la puce pour permettre au milieu de culture cellulaire de circuler à l’aide d’une pipette.
- Actualisez le support de culture cellulaire tous les jours pendant une semaine. Utilisez une pipette pour aspirer le milieu de culture cellulaire; n’utilisez pas de pompe à pression.
- Après l’achèvement de tous les processus d’impression cellulaire 3D du cancer hypoxique sur puce, frottez doucement les verres de couverture sur le dessus des barrières perméables aux gaz avec le grattoir à cellules pour une liaison serrée (Figure 4A, B).
7. Évaluation de la viabilité des cellules post-impression
-
Préparation des échantillons et traitement avec de la calvine AM et une solution EthD-1
- Chaud 1x PBS dans un bain-marie à 37 °C.
- Préparer la solution d’essai en ajoutant 0,75 μL d’acétoxyméthyle de calcénine (calcéine AM) et 3 μL d’homodimère d’éthidium (EthD-1) à 1,5 mL de PBS préchauffé.
- Aspirez soigneusement tous les supports de la puce à l’aide d’une pipette.
- Lavez la construction de cancer avec pbs pré-warmed. Remplissez 1,5 mL de PBS dans la puce à l’aide d’une pipette et laissez-la reposer pendant 10 min à température ambiante. Pour éviter la déformation de la construction cancéreuse, introduisez 1x PBS d’un côté des puces et inclinez les puces pour permettre à 1x PBS de circuler.
- Aspirer le PBS de la puce; traiter la solution d’analyse de 1,5 mL et incuber la puce à 37 °C pendant 20 min à l’aide d’une feuille pour la protéger de la lumière. Utilisez une pipette pour aspirer 1x PBS; n’utilisez pas de pompe d’aspiration.
-
Imagerie de la viabilité cellulaire à l’aide d’un microscope à fluorescence
- Visualisez et capturez les cellules étiquetées à l’aide d’un microscope à fluorescence(Figure 4C).
REMARQUE: Calcein AM marque les cellules vivantes avec une fluorescence verte (longueur d’onde ~ 488 nm). EthD-1 représente le signal des cellules mortes avec fluorescence rouge (longueur d’onde ~ 594 nm). - Comptez le nombre de cellules vivantes et mortes à l’aide d’un logiciel d’imagerie, un programme de traitement d’images open source, et calculez la viabilité avec les nombres .
- Visualisez et capturez les cellules étiquetées à l’aide d’un microscope à fluorescence(Figure 4C).
8. Immunofluorescence pour valider la formation de l’hypoxie centrale et son effet sur la malignité du cancer
-
Fixation, perméabilisation et blocage de la construction du cancer
- Préparer 1x PBS, 4 % de paraformaldéhyde (PFA), 0,1 % (v/v) de Triton X-100 et 2 % (p/v) d’albumine sérique bovine (BSA) à température ambiante.
- Aspirez soigneusement tous les supports de la puce à l’aide d’une pipette et rincez la puce trois fois avec 1x PBS. Pour éviter la déformation de la construction cancéreuse, introduisez 1x PBS d’un côté des puces et inclinez les puces pour permettre à 1x PBS de circuler. Entre chaque étape de lavage, laissez la puce reposer avec 1x PBS pendant 5 min pour éliminer les solutions résiduelles.
REMARQUE: 1x PBS a été aspiré à l’aide d’une pipette, pas d’une pompe à pression. - Ajouter 500 μL de PFA à 4 % à la construction cancéreuse sur la puce à l’aide d’une pipette; laissez-le pendant 15 minutes et lavez-le trois fois avec 1x PBS pour fixer les cellules dans la construction du cancer.
- Traiter la construction cancéreuse avec 500 μL de Triton X-100 à 0,1 % à l’aide d’une pipette à température ambiante pendant 5 min et laver trois fois avec 1x PBS pour solubiliser et perméabiliser la membrane cellulaire.
- Traiter la construction cancéreuse avec 500 μL de BSA à 2% à l’aide d’une pipette à température ambiante pendant 1 h pour bloquer les épitopes réactifs.
REMARQUE: Couvrez la puce avec un film de paraffine pour éviter l’évaporation. - Après 1 h, lavez la puce trois fois avec 1x PBS.
-
Traitement avec de l’anticorps primaire, de l’anticorps secondaire, et du DAPI et de la formation image de la structure utilisant un microscope confocal.
- Préparer les anticorps de contrôle d’isotype et le cocktail d’anticorps primaires en diluant les anticorps dans 1x PBS à chaque concentration de travail désirée.
REMARQUE: Les détails spécifiques des anticorps sont énumérés dans la table des matériaux. Les mêmes concentrations de travail d’anticorps de contrôle d’isotype que les anticorps primaires devraient être utilisées. - Aspirer soigneusement tous les 1x PBS de la puce à l’aide d’une pipette et traiter la puce avec une solution d’anticorps primaires de 200 μL à 4 °C pendant la nuit. Couvrez les copeaux avec un film de paraffine pour éviter l’évaporation.
- Aspirer la solution d’anticorps primaires et laver la puce trois fois avec 1x PBS.
- Diluer les anticorps secondaires et le DAPI dans 1x PBS à la concentration de travail désirée.
REMARQUE: Un anticorps secondaire vert conjugué à la fluorescence est utilisé dans ce cas à un rapport de 1:200. DAPI a été utilisé à un rapport de 1:1000. - Aspirer soigneusement tout 1x PBS de la puce à l’aide d’une pipette et traiter la puce avec une solution d’anticorps secondaire-DAPI de 200 μL à 4 °C pendant 3 h. Couvrez la puce avec un film de paraffine pour éviter l’évaporation, puis enveloppez-la avec du papier d’aluminium pour éviter le photobleaching.
- Aspirer la solution d’anticorps secondaire-DAPI et laver la puce trois fois avec 1x PBS.
- Après avoir terminé l’étape de coloration, transférez la construction cancéreuse dans une parabole confocale en la saisissant doucement avec une pince.
- Visualisez et capturez les cellules étiquetées à l’aide d’un microscope confocal(Figure 5).
REMARQUE: La longueur d’onde du microscope confocal a été ajustée, en fonction du type de marqueurs fluorescents. Les détails spécifiques des anticorps sont énumérés dans la table des matériaux. Pour détecter efficacement la position de la cellule, il serait préférable d’observer d’abord les noyaux colorés DAPI de la construction. Les longueurs d’onde d’excitation/émission de détection des signaux fluorescents étaient de 358/461 nm (DAPI, Bleu), 494/517 nm (Vert) et 590/617 nm (Rouge). Les grossissements étaient 4x, 10x, et 20x, ajustés du plus bas au plus haut.
- Préparer les anticorps de contrôle d’isotype et le cocktail d’anticorps primaires en diluant les anticorps dans 1x PBS à chaque concentration de travail désirée.
9. Analyse statistique
-
Comptage de cellules avec programme de traitement d’image
- Exécutez un programme de traitement d’image pour compter le nombre de cellules vivantes et mortes.
- Ouvrez les fichiers image fluorescents. Cliquez sur Fichier | Ouvrez et importez les images TIFF.
- Convertissez les images en images en niveaux de gris 16 bits. Cliquez sur Image | Type | Niveaux de gris 16 bits.
- Ajustez le seuil en cliquant sur Image | Ajuster | Seuil, puis sélectionnez la couleur des cellules à noir.
- Coupez les cellules fusionnées en cliquant sur Traiter | | binaires Bassin versant pour un comptage précis des cellules.
- Comptez le nombre de cellules en cliquant trois fois sur Analyser, puis sur Analyser les particules; calculer la moyenne et présenter les données comme la moyenne ±'erreur type.
REMARQUE: Les marqueurs d’immunofluorescence ont été analysés en comparant l’intensité de fluorescence.
Access restricted. Please log in or start a trial to view this content.
Résultats
Le cancer hypoxique sur puce a été développé à l’aide de la technologie d’impression cellulaire 3D assistée par ordinateur pour récapituler l’hypoxie et la pathologie liée au cancer (Figure 1). Le transport et la consommation d’oxygène ont été simulés à l’aide du modèle de géométrie 3D. La puce a été conçue sous la forme d’anneaux concentriques pour imiter la diffusion et l’épuisement radiaux de l’oxygène, dans les tissus ...
Access restricted. Please log in or start a trial to view this content.
Discussion
Dans cette étude, nous décrivons le processus de fabrication d’un cancer-sur-une-puce hypoxique basé sur la technologie d’impression cellulaire 3D. La formation du gradient hypoxique dans la puce conçue a été prédite par des simulations informatiques. L’environnement qui peut induire un gradient hypoxique hétérogène a été reproduit via une stratégie simple combinant la barrière perméable au gaz imprimée en 3D et le couvercle en verre. Les dispositifs pathologiques hypoxie-connexes du glioblastoma, y...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont aucune information à fournir.
Remerciements
Cette recherche a été soutenue par la Fondation nationale de la recherche de Corée (NRF) financée par le ministère de l’Éducation (n ° 2020R1A6A1A03047902 et NRF-2018H1A2A1062091) et le gouvernement coréen (MSIT) (n ° NRF-2019R1C1C1009606 et NRF-2019R1A3A3005437).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Cells | |||
| Human umbilical vein endothelial cells | Promocell | C-12200 | |
| U-87 MG cells | ATCC | ATCC HTB-14 | |
| Disposable | |||
| 0.2 μm syringe filter | Sartorius | 16534-K | |
| 10 mL disposable syringe | Jung Rim | 10ml 21G32 | |
| 10 mL glass vial | Hubena | A0039 | |
| 10 mL Serological pipette tip | SPL lifescience | 91010 | |
| 15 mL conical tube | SPL lifescience | 50015 | |
| 18G plastic needle | Musashi engineering | PN-18G-B | |
| 20G plastic tapered dispense tip | Musashi engineering | TPND-20G-U | |
| 22x50 glass cover | MARIENFIELD | 0101142 | |
| 25 mL Serological pipette tip | SPL lifescience | 90125 | |
| 3 mL disposable syringes | HENKE-JET | 4020-X00V0 | |
| 40 µm cell strainer | Falcon | 352360 | |
| 5 mL Serological pipette tip | SPL lifescience | 91005 | |
| 50 mL conical tube | SPL lifescience | 50050 | |
| 50 mL Serological pipette tip | SPL lifescience | 90150 | |
| 50N precision nozzle | Musashi engineering | HN-0.5ND | |
| Aluminum foil | SINKWANG | ||
| Capillary tips | Gilson | CP1000 | |
| Cell-scrapper | SPL lifescience | 90030 | |
| Confocal dish | SPL lifescience | 200350 | |
| Parafilm | Bemis | PM996 | |
| Pre-coated histology slide | MATSUNAMI | MAS-11 | |
| Reservoir | SPL lifescience | 23050 | |
| T-75 cell culture flask | SPL lifescience | 70075 | |
| Equipment | |||
| 3DX printer | T&R Biofab | ||
| Autoclave | JEIOTECH | AC-12 | |
| Centrifuger | Cyrozen | 1580MGR | |
| Confocal laser microscopy | Olympus Life Science | FV 1000 | |
| Fluorescence microscope | FISHER SCEINTIFIC | O221S366 | |
| Forcep | Korea Ace Scientific | HC.203-30 | |
| Hand tally counter | KTRIO | ||
| Hemocytometer | MARIENFIELD | 0650030 | |
| Incubator | Panasonic | MCO-170AIC | |
| Laminar flow cabinet | DAECHUNG SCIENCE | CB-BMMS C-001 | |
| Metal syringe | IWASHITA engineering | SUS BARREL 10CC | |
| Operating Scissors | Hirose | HC.13-122 | |
| Oven | JEIOTECH | OF-12, H070023 | |
| Positive displacement pipette | GILSON | NJ05652 | |
| Refrigerator | SAMSUNG | CRFD-1141 | |
| Voltex Mixer | DAIHAN scientific | VM-10 | |
| Water bath | DAIHAN SCIENTIFIC | WB-11 | |
| Water purifier | WASSER LAB | DI-GR | |
| Materials | |||
| 0.25 % Trypsin-EDTA | Gibco | 25200-072 | |
| 10x PBS | Intron | IBS-BP007a | |
| 4% Paraformaldehyde | Biosesang | ||
| 70% Ethanol | Daejung | 4018-4410 | |
| Anti-CD31 antibody | Abcam | ab28364 | |
| Anti-HIF-1 alpha antibody | Abcam | ab16066 | |
| Anti-SHMT2/SHMT antibody | Abcam | ab88664 | |
| Anti-SOX2 antibody | Abcam | ab75485 | |
| Bovine Serum Albumin | Thermo scientific | J10857-22 | |
| Collagen from porcine skin | Dalim tissen | PC-001-1g | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Thermofisher | D1306 | |
| Endothelial Cell Growth Medium-2 | Promocell | C22011 | |
| Fetal bovine serum | Gibco | 12483-020 | |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Theromofisher | A-11001 | |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | Theromofisher | A-11012 | |
| High-glucose Dulbecco’s Modified Eagle Medium(DMEM) | Hyclone | SH30243-0 | |
| Hydrochloric acid | Sigma-Aldrich | 311413-100ML | |
| Live/dead assay kit | Invitrogen | L3224 | |
| Mouse IgG1, kappa monoclonal [15-6E10A7] - Isotype Control | Abcam | ab170190 | |
| Penicillin/streptomycin | Gibco | 15140-122 | |
| Phenol red solution | Sigma-Aldrich | P0290-100ML | |
| Poly(ethylene-vinyl acetate) | Poly science | 06108-500 | |
| Polydimethylsiloxane | Dowhitech | sylgard 184 | |
| Rabbit IgG, polyclonal - Isotype Control | Abcam | ab37415 | |
| Sodium hydroxide solution | Samchun | S0610 | |
| Triton X-100 | Biosesang | TRI020-500-50 | |
| Trypan Blue | Sigma-Aldrich | T8154 | |
| Software | |||
| COMSOL Multiphysics 3.5a | COMSOL AB | ||
| IMS beamer | in-house software | ||
| SolidWorks Package | Dassault Systems SolidWorks Corporation |
Références
- Jing, X., et al. Role of hypoxia in cancer therapy by regulating the tumor microenvironment. Molecular Cancer. 18 (1), 157(2019).
- Al Tameemi, W., Dale, T. P., Al-Jumaily, R. M. K., Forsyth, N. R. Hypoxia-modified cancer cell metabolism. Frontiers in Cell and Developmental Biology. 7, 4(2019).
- Petrova, V., Annicchiarico-Petruzzelli, M., Melino, G., Amelio, I. The hypoxic tumour microenvironment. Oncogenesis. 7 (1), 1-13 (2018).
- Hockel, M., Vaupel, P. Tumor hypoxia: definitions and current clinical, biologic, and molecular aspects. Journal of the National Cancer Institute. 93 (4), 266-276 (2001).
- Kim, H., Lin, Q., Glazer, P. M., Yun, Z. The hypoxic tumor microenvironment in vivo selects the cancer stem cell fate of breast cancer cells. Breast Cancer Research. 20 (1), 16(2018).
- Jeong, G. S., Lee, J., Yoon, J., Chung, S., Lee, S. -H. Viscoelastic lithography for fabricating self-organizing soft micro-honeycomb structures with ultra-high aspect ratios. Nature Communications. 7 (1), 1-9 (2016).
- Razian, G., Yu, Y., Ungrin, M. Production of large numbers of size-controlled tumor spheroids using microwell plates. Journal of Visualized Experiments:JoVE. (81), e50665(2013).
- Nunes, A. S., Barros, A. S., Costa, E. C., Moreira, A. F., Correia, I. J. 3D tumor spheroids as in vitro models to mimic in vivo human solid tumors resistance to therapeutic drugs. Biotechnology and Bioengineering. 116 (1), 206-226 (2019).
- Wan, L., Neumann, C., LeDuc, P. Tumor-on-a-chip for integrating a 3D tumor microenvironment: chemical and mechanical factors. Lab on a Chip. 20 (5), 873-888 (2020).
- Nam, H., Funamoto, K., Jeon, J. S. Cancer cell migration and cancer drug screening in oxygen tension gradient chip. Biomicrofluidics. 14 (4), 044107(2020).
- Palacio-Castañeda, V., Kooijman, L., Venzac, B., Verdurmen, W. P., Le Gac, S. Metabolic switching of tumor cells under hypoxic conditions in a tumor-on-a-chip model. Micromachines. 11 (4), 382(2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: a fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Mi, S., Du, Z., Xu, Y., Sun, W. The crossing and integration between microfluidic technology and 3D printing for organ-on-chips. Journal of Materials Chemistry B. 6 (39), 6191-6206 (2018).
- Yi, H. -G., Lee, H., Cho, D. -W. 3D printing of organs-on-chips. Bioengineering. 4 (1), 10(2017).
- Yi, H. -G., et al. A bioprinted human-glioblastoma-on-a-chip for the identification of patient-specific responses to chemoradiotherapy. Nature Biomedical Engineering. 3 (7), 509-519 (2019).
- Kang, T. -Y., Hong, J. M., Jung, J. W., Yoo, J. J., Cho, D. -W. Design and assessment of a microfluidic network system for oxygen transport in engineered tissue. Langmuir. 29 (2), 701-709 (2013).
- Woo Jung, J., et al. Evaluation of the effective diffusivity of a freeform fabricated scaffold using computational simulation. Journal of Biomechanical Engineering. 135 (8), (2013).
- Brown, A. C., De Beer, D. Development of a stereolithography (STL) slicing and G-code generation algorithm for an entry level 3-D printer. 2013 Africon (IEEE). , 1-5 (2013).
- Shim, J. -H., Lee, J. -S., Kim, J. Y., Cho, D. -W. Bioprinting of a mechanically enhanced three-dimensional dual cell-laden construct for osteochondral tissue engineering using a multi-head tissue/organ building system. Journal of Micromechanics and Microengineering. 22 (8), 085014(2012).
- Gillispie, G., et al. Assessment methodologies for extrusion-based bioink printability. Biofabrication. 12 (2), 022003(2020).
- Kim, B. S., Das, S., Jang, J., Cho, D. -W. Decellularized extracellular matrix-based bioinks for engineering tissue-and organ-specific microenvironments. Chemical Reviews. 120 (19), 10608-10661 (2020).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon