需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
3D 细胞打印的芯片上低氧癌症,用于回顾固体癌症的病理进展
* 这些作者具有相同的贡献
摘要
缺氧是肿瘤微环境的标志,在癌症进展中起着至关重要的作用。本文描述了基于3D细胞打印技术的芯片上低氧癌症的制造过程,以回顾癌症的缺氧相关病理学。
摘要
癌症微环境对疾病的进展有重大影响。特别是缺氧是癌症生存、入侵和耐受性的关键驱动因素。虽然已经开发了几个体外模型来研究缺氧相关的癌症病理学,但由于缺乏精确的空间控制,在体内观察到的癌症微环境的复杂相互作用尚未被复制。相反,提出了3D生物制剂方法,以创建微生理系统,以更好地模拟癌症生态学和准确的抗癌治疗评估。在此,我们提出了一种3D细胞打印方法,以制造一个芯片上的低氧癌症。芯片中的缺氧诱导组件是根据计算机对氧气分布的模拟确定的。使用含有胶质母细胞和内皮细胞的生物因子印刷癌症-斯特罗马同心环,以重新概括一种实体癌症。由此产生的芯片实现了癌症的中枢缺氧和加重恶性肿瘤,并形成具有代表性的病理生理标记。总体而言,为癌症研究创造实体癌-致密微生理系统的拟议方法有望弥合体内模型和体外模型之间的差距。
引言
癌症微环境是推动癌症进展的关键因素。多种成分,包括生化、生物物理和细胞线索,决定了癌症的病理特征。其中,缺氧与癌症的生存、增殖和入侵密切相关。由于癌细胞的无限生长和分裂,营养物质和氧气不断枯竭,产生缺氧梯度。在低氧条件下,细胞激活缺氧诱导转录因子(HIF)相关分子级联。这个过程诱导坏死核心,触发代谢变化,并启动血管增生和转移2,3。随后,癌细胞缺氧导致邻近正常组织的破坏。此外,缺氧与多因素的实体肿瘤的治疗耐药性密切相关。缺氧可能严重阻碍放射治疗,因为放射性敏感性有限,由于反应性氧物种1,4。此外,它降低了癌症微环境的pH水平,从而减少了药物积累1。因此,复制体外缺氧病理特征是科学和临床前发现有希望的策略。
模拟癌症的特定微环境对于了解癌症发展和探索适当的治疗方法至关重要。虽然动物模型由于其强烈的生理相关性而得到广泛应用,但与物种差异和伦理问题有关的问题依然存在。此外,虽然传统的2D和3D模型允许对癌细胞进行操作和实时成像,以便进行深入分析,但无法完全重新概括其结构和细胞的复杂性。例如,癌症球形模型已被广泛使用,因为球体中的癌细胞聚集自然会产生核心缺氧。此外,大量大小均匀的细胞球体已经使用塑料或硅基多井系统6,7生产。然而,在用传统平台捕捉癌组织的确切异质结构方面灵活性较低,这就要求建立先进的生物制剂技术,以建立一个高度仿生平台,以改善癌症研究。
3D微生理系统(MPSs)是回顾癌细胞9的复杂几何和病理进展的有用工具。当癌细胞感知生长因子和化疗因子的生化梯度以及系统中复制的机械异质性时,可以在体外研究癌症发展的重要特征。例如,使用MPS10、11研究了癌症的生存能力、转移恶性肿瘤和根据氧气浓度变化而形成的耐药性。尽管最近取得了进步,但产生体外模型的缺氧条件依赖于复杂的制造过程,包括与物理气体泵的连接。因此,需要简单和灵活的方法来建立癌症特有的微观环境。
3D细胞打印技术由于精确控制生物材料的空间排列,以回顾原生生物结构12而备受关注。特别是,该技术克服了3D缺氧模型的现有局限性,因为它具有很高的可控性和构建癌症微环境空间特征的可行性。3D 打印还通过一层一层的过程促进计算机辅助制造,从而提供快速、准确和可重复的复杂几何结构,以模拟实际的组织结构。除了现有的3D MPS制造策略的优势外,癌症进展的病理生理特征可以通过对生化、细胞和生物物理成分13、14的模式进行再现。
在此,我们提出了一个3D细胞打印策略,用于在芯片上复述一种缺氧癌(图1)15的异质性。制造参数是通过系统中中央缺氧形成的计算模拟确定的。使用含有胶质母细胞和内皮细胞的胶原蛋白生物因子印刷癌症-频闪同心环,以模拟胶质母细胞瘤的病理生理学,胶质母细胞瘤是一种实体癌症。径向氧梯度的形成加重了癌症恶性肿瘤,表明攻击性增强。此外,我们为芯片应用于患者特定的预科模型指明了未来的观点。提议的创建实体癌症-致密微生理系统的方法有望弥合体内和体外癌症模型之间的差距。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 氧气梯度形成的计算机模拟
-
用于芯片上低氧癌症打印的 3D 几何模型的生成
- 运行3D CAD软件。
- 勾勒出芯片上低氧癌症的几何模型。单击 草图 并选择所需的平面来绘制几何形状。请参阅图(图2A)了解每个部分的详细比例。
- 通过单击 功能突出型主/基座设置几何形状的厚度。在空框中输入所需的厚度(参照 图 2A),然后选择绿色复选图标以形成 3D 几何形状。
注:芯片上癌症的维度是根据所需的介质和水凝胶量定义的。在目前的实验中,根据以前解决挤压生物打印机的实际经验,所需的介质和水凝胶量分别为约1,500微升和500微升。 - 将几何文件保存为 3D CAD 文件格式 (.prt 或.stl)。
-
低氧核诱导细胞密度的确定
- 运行物理扩散模拟程序。
- 单击 实时链接 并选择使用的 CAD 程序。单击 同步输入 模拟程序上芯片上缺氧癌症的几何形状。由于在实际实验环境中,腔室的内部空间将充满培养介质,氧气将扩散到腔室的内部空间和细胞结构中,而细胞结构将由充满细胞的水凝胶组成。
注:请参阅先前的研究,了解有关物理参数15 的详细信息。 - 将导入的 3D 几何形状定义为氧气扩散空间的控制体积,细胞消耗氧气(图 2B)。
- 按照用户指南和先前确定的方法16、17运行气体扩散分析计算机分析。
- 从计算机分析结果来看,在用户指南之后的每个时间点将估计的氧浓度数据导出到横截面A-A'上。治理方程基于菲克的第一个定律,如Eq.(图2C)所述。
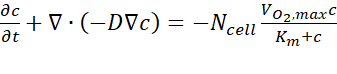
其中c是浓度,D是氧扩散系数,N细胞是细胞密度,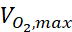 是氧气的最大上升速率,Km是迈克尔斯-门滕常数。常数应用如前一出版物15所述。
是氧气的最大上升速率,Km是迈克尔斯-门滕常数。常数应用如前一出版物15所述。
注:每个时间点都意味着观察氧气扩散随时间变化的步点。 - 评估最小氧水平是否达到缺氧阈值,并重复计算机分析过程,增加或减损细胞密度。
注:如果水凝胶区域80%的氧含量在24小时后低于0.02 mM,则定义结构中形成缺氧梯度。 - 确认从Fick的第一个定律第1.2.5步开始,在中部地区产生氧梯度诱导缺氧所需的细胞数量,以及从步骤1.2.6产生的模拟结果。
注:在此协议中,细胞编号为 2 × 106个单元格/每个构造。
2. 癌细胞和频闪细胞的细胞培养
-
准备细胞培养介质,避免生理压力
- 对于U-87 MG细胞(不朽的人类胶质母细胞瘤细胞系),放置12mL的高葡萄糖杜尔贝科的改良鹰介质含有10%胎儿牛血清, 100 U/mL 青霉素和 100μg/mL 链霉素在 T-75 细胞培养瓶中 37 °C, 5% CO2 加湿孵化器 30 分钟, 以尽量减少介质对细胞的热和碱性影响.
注:胶质母细胞瘤被选为一种固体癌症,因为它在缺氧环境中具有攻击性特征。其他类型的癌症可以应用于此模型。 - 对于人类脐带内皮细胞(HUVECs),将12mL的内皮细胞生长介质放置在T-75细胞培养瓶中,在37°C的5%CO2 加湿孵化器中放置30分钟。
注:之所以选择HUVEC,是因为它是最具代表性的内皮细胞系之一。各种类型的频闪细胞也可以应用于此模型。
- 对于U-87 MG细胞(不朽的人类胶质母细胞瘤细胞系),放置12mL的高葡萄糖杜尔贝科的改良鹰介质含有10%胎儿牛血清, 100 U/mL 青霉素和 100μg/mL 链霉素在 T-75 细胞培养瓶中 37 °C, 5% CO2 加湿孵化器 30 分钟, 以尽量减少介质对细胞的热和碱性影响.
-
冷冻保存的癌细胞和频闪细胞的快速解冻及其维持
- 将含有 5 x 105 U-87 MG 电池和 HUVEC 的低温层从液氮容器移动到层压流柜。立即松开并重新密封盖以释放内部压力。
- 将冷冻保存的细胞在37°C的水浴中轻轻放置2分钟,将盖子挡在水面外。在层压流下用 70% 乙醇冲洗小瓶,以防止污染。
- 将解冻的细胞转移到包含步骤 2.1 中描述的预制细胞培养介质的烧瓶中,并将含细胞的烧瓶放置在 5% 的 CO2 加湿孵化器中,以用于细胞恢复。
- 每 2 天刷新一次细胞培养介质,并保持细胞生长。
- 解冻24小时后,更换细胞培养介质,以避免用于细胞冻结的二甲基硫化物(DMSO)的细胞毒性。使用 HUVEC,该通道已经历不到 6 段。
3. 准备胶原蛋白凝胶前溶液
-
胶原蛋白海绵与0.1 N盐酸(HCl) 的溶解
- 准备0.1 N HCl的溶液,并使用0.2μm注射器过滤器进行过滤。
- 对于 1% (w/v) 中和胶原蛋白预凝胶溶液的 3 mL,准备胶原蛋白海绵切成 5 x 5 mm2 片,重量为 30 毫克。
- 将切开的胶原蛋白片转移到无菌的 10 毫升玻璃瓶中。
注意:考虑到胶原蛋白溶液的粘性特性,准备所需胶原蛋白水凝胶体积的 1.5 倍。 - 将 2.4 毫升的 0.1 N HCl 添加到含胶原蛋白的玻璃瓶中,并在 15 rpm 和 4 °C 的摇杆上孵育 3 天。
注:0.1 N HCl 溶液的体积是所需胶原蛋白水凝胶最终体积的五分之四。在这种情况下,准备了3毫升胶原蛋白。 - 消化后,使用40μm细胞过滤器筛下未消化的胶原蛋白颗粒。将酸性胶原蛋白溶液储存在 4 °C,并在 7 天内使用。
-
1% 中和胶原蛋白凝胶前溶液的 pH 调整
- 在 1224 x g 下将酸性胶原蛋白溶液离心 5 分钟,在 4 °C 下。
- 将 30 μL 的酚红色溶液作为 pH 指标添加到胶原蛋白预凝胶溶液中 10% (v/v) 和 300 μL 的 10 倍磷酸盐缓冲盐水 (PBS) 缓冲器的最终浓度为 10% (v/v)。
- 用1 N氢氧化钠(NaOH)中和pH到7,验证颜色变化。
注:根据公式,摩尔H+= 摩尔H+x 体积H+= 摩尔OH-=摩尔OH-x 体积OH-,添加240μL的NAOH。 - 加入蒸馏水,总积为 3 mL。
- pH 调整后,将 1% (w/v) 中和胶原蛋白预凝胶溶液存储在 4 °C,并在 3 天内使用。
注意:要预先检查中和胶原蛋白预凝胶溶液的凝胶,请使用正位移移液化器在小盘上制作 50μL 胶原蛋白液滴,并在 37 °C 孵化器中孵育 1 小时。参考以下三种方法,验证胶原蛋白液滴的交叉连接。 - 检查胶原蛋白的颜色是否从透明颜色变为不透明的白色。
- 倾斜容器并检查胶原蛋白是否粘附在容器底部。
- 将 1 倍 PBS 倒入液滴上,检查溶液中胶原蛋白构造是否未损坏。
4.3D气体透气屏障的印刷
-
牺牲聚(乙烯乙烯醋酸乙烯)(PEVA)模具的3D打印
- 使用 3D CAD 软件 (图 3A)生成第 1 步中定义的牺牲 PEVA 模具的 3D 几何形状。
注:3D几何形状和详细的模型比例,包括尺寸、单位和线型,显示在 图2A中。 - 通过单击 "文件|",将 3D CAD 文件转换为 STL 文件格式保存文件类型为 STL。此外,单击 选项|输出形式为 G 代码生成的 ASCII。
- 单击 文件|打开 STL 文件 并选择已保存的 STL 文件以导入生成的 STL 文件。单击 STL-CAD 交换器的 切片模型 ,自动生成牺牲的 PEVA 模具的 G 代码(图 3B,C)。
注:打印路径生成时,STL 文件的基本图与切片平面(即层)之间的交叉点连接。基本上,STL 文件中片段的基本图形是包含 3D 坐标的三角形。获得三角形和层之间的交叉点后,通过连接每个点生成打印的 G 代码,而不会在18层上出现重叠路径。船上任何 G 代码生成算法都可用于生成芯片制造的打印路径。 - 准备无菌胶粘剂和亲水性病理学幻灯片。
注意:亲水滑动玻璃对于玻璃上多晶硅氧烷 (PDMS) 的永久结合至关重要,胶原蛋白的粘附性将癌细胞和频闪细胞封装起来。 - 在 110 °C 的气动压力下,用 50 G 精密喷嘴在幻灯片上打印牺牲的 PEVA 模具。
注意:线宽受材料的进给率、喷嘴量表和温度的影响。使用了 50 G 喷嘴,并应用了 400 的进给率来为牺牲墙生成 500 μm 线宽度。喷嘴仪表、气动压力和进给率的定义与实际结果19。牺牲的墙需要足够厚,以保持PDMS解决方案,这是下一个捏造步骤。
- 使用 3D CAD 软件 (图 3A)生成第 1 步中定义的牺牲 PEVA 模具的 3D 几何形状。
-
多晶硅氧烷 (PDMS) 屏障的铸造
- 在塑料储液池中混合 6 mL PDMS 基层弹性体和 0.6 mL 固化剂均质超过 5 分钟。考虑到 PDMS 粘性特性的损失,这可以制造出 6 种芯片上的低氧癌症。
- 将混合的 PDMS 溶液加载到 10 mL 一次性注射器中,并配上 20 G 塑料锥形分配尖端的注射器头。
- 在注射器中用混合的 PDMS 解决方案填充牺牲的 PEVA 模具。混合的 PDMS 将用凸面填充牺牲的 PEVA 模具。PDMS 屏障的高度将高于 PEVA 模具的高度。
- 在 40 °C 以上的烤箱中固化 PDMS 屏障,超过 36 小时,以避免 PEVA 融化。不要将温度提高到超过 88 °C,这是 PEVA 的熔化温度。
- 用一对精密钳子分离牺牲的 PEVA 模具,并在高压灭菌器中以 120 °C 对气体渗透屏障进行消毒。
5. 细胞封装胶原蛋白生物墨水的制备
-
预制癌细胞和频闪细胞的分离
注意:考虑到细胞的生存能力,整个打印过程应在分离细胞后尽快完成。- 使用血清学移液器用 10 mL 的 1x PBS 清洗癌症和频闪细胞;使用移液器处理2 mL的0.25%三聚氰胺乙酰氨基酸(EDTA),并在37°C孵育3分钟。
- 用3mL的细胞培养介质中和试穿细胞:在20°C下,将细胞悬浮物收集到15mL圆锥管和离心机中,在516 x g 下5分钟。
- 慢慢吸气超自然人:在 5 mL 细胞培养介质中重新消耗细胞颗粒,并使用血细胞计计算细胞数量。
- 将每个细胞类型的 5 x 106 个细胞转移到新的 15 mL 圆锥管中,并在 20 °C 时以 516 x g 的离心机将其离心 5 分钟。
- 吸气超自然人,并将其放置在湿冰上。
-
将每个细胞类型与 1% 中和胶原蛋白凝胶前溶液混合
注意:为了避免1%中和胶原蛋白预凝胶溶液的热凝固,此过程应在湿冰上进行。- 以步骤 5.1.4 中收集的各类细胞颗粒进行补充,每个步骤 20 μL 的细胞培养介质。
- 将 1% 中和胶原蛋白预凝胶溶液中的 1 mL 添加到每个恢复的细胞悬架中,并使用正位移移液器均质混合。每个细胞类型的最终浓度为 5 x 106 细胞/mL。
- 使用正一次性移液器将细胞封装胶原蛋白生物因子转移到 3 mL 一次性注射器中,并将注射器储存在 4 °C,直到 3D 细胞打印。
6.3D癌-斯特罗马同心环的细胞打印
-
胶原蛋白生物因子的3D细胞打印封装癌细胞和频闪细胞
- 使用 3D CAD 软件生成步骤 1.2 中定义的癌症-频闪同心环的 3D 几何形状。
注:癌症频闪同心环的尺寸通过模拟参数进行定义。最终维度参数维度显示在 图 3A 中。 - 将 3D CAD 文件转换为 STL 文件格式,并使用 STL-CAD 交换器生成癌症频闪同心环的 G 代码。
注:请参阅 G 代码生成算法步骤 4.1.2 中的注释。 - 将 3 mL 一次性注射器中所含的细胞封装胶原蛋白生物因子加载到 3D 打印机的头部,并将头部和板材的温度设置为 15 °C。
注意:如果打印机的头部和板的温度达到 37 °C 以上,生物墨水将相互连接,不再打印。 - 在 3D 打印机的控制软件上加载生成的打印路径。
- 通过单击 "开始" 按钮,在加载的 G 码之后,在 15 °C 的气压下,用 18 G 塑料针在气压约为 20 kPa 时,将癌细胞和频闪细胞封装在气体渗透屏障上。
- 每次打印操作结束时,手动将消毒的 22 mm x 50 mm 玻璃盖放在透气屏障上,以产生低氧梯度。
注:根据玻璃盖 (GR+) 和缺 (GR-) 的存在对两组进行比较,以验证低氧梯度的生成。 - 在产生三个缺氧癌片后,将芯片转移到37°C的孵化器中1小时,将胶原蛋白生物因子交叉连接。
- 使用 3D CAD 软件生成步骤 1.2 中定义的癌症-频闪同心环的 3D 几何形状。
-
完成芯片上缺氧癌的制造过程和维护
- 完成芯片上缺氧癌的所有3D细胞打印过程后,用细胞刮刀轻轻擦盖玻璃杯,以紧密结合(图4A,B)。
注:盖玻璃和透气屏障通过疏水粘结组装而无化学胶水,只需刮擦盖玻璃和 PDMS 屏障之间的粘合部分即可。 - 将 1.5 mL 的内皮细胞生长介质引入每个芯片。为了避免癌症结构的分离,从芯片的一侧引入细胞培养介质。倾斜芯片,使细胞培养介质使用移液器流动。
- 一周内每天刷新细胞培养介质。使用移液器吸气细胞培养介质:不要使用压力泵。
- 完成芯片上缺氧癌的所有3D细胞打印过程后,用细胞刮刀轻轻擦盖玻璃杯,以紧密结合(图4A,B)。
7. 打印后细胞生存能力评估
-
用钙素 AM 和 EthD-1 溶液准备样品和治疗
- 在37°C的水浴中加热1倍PBS。
- 通过将 0.75 μL 的钙化乙酰甲基(钙素 AM)和 3 μL 的同源乙酰钠 (EthD-1) 添加到 1.5 mL 预热 PBS 中来准备检测解决方案。
- 使用移液器小心地从芯片中吸气所有介质。
- 用预热的 PBS 清洗癌症结构。使用移液器将 1.5 mL PBS 填充到芯片中,使其在室温下站立 10 分钟。为了避免癌症构造变形,从芯片的一侧引入 1 倍 PBS,并倾斜芯片以允许 1 倍 PBS 流动。
- 从芯片中吸气 PBS;处理1.5 mL的检测解决方案,并在37°C孵育芯片20分钟,使用铝箔,以防止光线。使用移液器吸气 1 倍 PBS;不要使用吸气泵。
-
使用荧光显微镜成像细胞生存能力
- 使用荧光显微镜(图 4C)查看和捕获标记的细胞。
注:钙素AM标记具有绿色荧光的活细胞(波长~488 nm)。EthD-1表示红荧光死细胞的信号(波长约594纳米)。 - 使用成像软件(开源图像处理程序)计算活细胞和死细胞的数量,并用数字计算生存能力。
- 使用荧光显微镜(图 4C)查看和捕获标记的细胞。
8. 免疫荧光,以验证中央缺氧的形成及其对癌症恶性肿瘤的影响
-
癌症构造的固定、渗透和阻塞
- 在室温下准备 1 倍 PBS、4% 副甲醛 (PFA)、0.1% (v/v) 特里顿 X-100 和 2% (w/v) 牛血清白蛋白 (BSA)。
- 使用移液器小心地吸气芯片上的所有介质,并用 1 倍 PBS 冲洗芯片三次。为了避免癌症构造变形,从芯片的一侧引入 1 倍 PBS,并倾斜芯片以允许 1 倍 PBS 流动。在每个洗涤步骤之间,让芯片与 1 倍 PBS 站在一起 5 分钟,以去除残留的解决方案。
注:1x PBS是使用移液器而不是压力泵吸气的。 - 使用移液器在芯片上的癌症构造中加入 500 μL 的 4% PFA;离开它15分钟,用1x PBS洗三次,以修复癌症结构中的细胞。
- 使用室温下的移液器治疗 500μL 的 0.1% Triton X-100 癌症结构,用 5 分钟,用 1 倍 PBS 洗三次,以溶解和渗透细胞膜。
- 使用室温下 1 小时的移液器治疗 500 μL 的 2% BSA 来阻止反应性表皮。
注意:用石蜡膜盖住芯片以防止蒸发。 - 1小时后,用1倍PBS洗三次芯片。
-
使用原发性抗体、二次抗体和DAPI进行治疗,并使用共聚焦显微镜对结构进行成像。
- 通过将抗体稀释为 1 倍 PBS 以达到每个所需的工作浓度,准备同型控制抗体和主要抗体的鸡尾酒。
注:抗体的具体细节列在 材料表中。应使用与主要抗体相同的同型控制抗体工作浓度。 - 使用移液器小心吸气芯片中的所有 1 倍 PBS,并在 4 °C 过夜时使用 200 μL 原抗体溶液处理芯片。用石蜡膜盖住芯片以防止蒸发。
- 吸气主抗体溶液,用 1 倍 PBS 清洗芯片三次。
- 将二次抗体和 DAPI 稀释为 1 倍 PBS,以达到所需的工作浓度。
注:在这种情况下,使用绿色荧光共生的二次抗体的比例为1:200。DAPI 的使用比例为 1:1000。 - 使用移液器小心吸气芯片中的所有 1 倍 PBS,并在 3 小时内在 4 °C 下使用 200 μL 二次抗体-DAPI 解决方案处理芯片。用石蜡膜盖住芯片以防止蒸发,然后用铝箔包裹,以防止光漂白。
- 吸气二次抗体-DAPI溶液,用1倍PBS清洗芯片三次。
- 完成染色步骤后,用钳子轻轻抓握,将癌症结构转移到圆盘中。
- 使用对焦显微镜(图 5)可视化并捕获标记的细胞。
注意:共焦显微镜的波长根据荧光标记的类型进行调整。抗体的具体细节列在 材料表中。为了有效地检测细胞位置,最好首先观察构造的DAPI染色核。荧光信号的检测激发/发射波长为358/461 nm(DAPI,蓝色)、494/517 nm(绿色)和590/617 nm(红色)。放大倍数为 4 倍、10 倍和 20 倍,从最低调整到最高。
- 通过将抗体稀释为 1 倍 PBS 以达到每个所需的工作浓度,准备同型控制抗体和主要抗体的鸡尾酒。
9. 统计分析
-
带图像处理程序的单元格计数
- 运行图像处理程序来计算活细胞和死细胞的数量。
- 打开荧光图像文件。单击 文件|打开 并导入 TIFF 图像。
- 将图像转换为 16 位灰度图像。点击 图像|类型|16 位灰度。
- 通过单击 "图像|调整阈值调整|阈值 ,然后选择细胞的颜色为黑色。
- 单击 "过程|",将合并后的单元拆开二进制| 用于精确细胞计数的分水岭。
- 通过单击 "分析" 然后点击分析 粒子 三次来计算细胞数量:计算平均值并将数据表示为平均±标准误差。
注:通过比较荧光强度来分析免疫荧光标记。
Access restricted. Please log in or start a trial to view this content.
结果
芯片上的缺氧癌是利用计算机辅助的3D细胞打印技术来重新概括缺氧和癌症相关病理学(图1)的。使用 3D 几何模型模拟氧气运输和消耗。该芯片设计为同心环,以模拟径向氧扩散和耗竭,在癌症组织(图2A)。在定义了氧气扩散并被细胞消耗的空间的控制体积后,通过计算有限元素分析(图2B,C)
Access restricted. Please log in or start a trial to view this content.
讨论
在这项研究中,我们描述了基于3D细胞打印技术的芯片上低氧癌症的制造过程。通过计算机模拟预测了设计芯片中低氧梯度的形成。通过结合 3D 打印气体透气屏障和玻璃盖的简单策略,再现了可诱导异质缺氧梯度的环境。胶质母细胞瘤的缺氧相关病理特征,包括伪帕利塞德和少量癌症干细胞,在芯片的低氧梯度条件下被重新概括。
为了提高生产率和可重复性,与之前公布的?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有披露。
致谢
这项研究得到了韩国国家研究基金会(NRF)的支持,该基金会由教育部(第2020R1A6A1A03047902号和NRF-2018H1A2A1062091)和韩国政府(MSIT)资助( NO.NRF-2019R1C1C1009606和NRF-2019R1A3A3005437)。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Cells | |||
| Human umbilical vein endothelial cells | Promocell | C-12200 | |
| U-87 MG cells | ATCC | ATCC HTB-14 | |
| Disposable | |||
| 0.2 μm syringe filter | Sartorius | 16534-K | |
| 10 mL disposable syringe | Jung Rim | 10ml 21G32 | |
| 10 mL glass vial | Hubena | A0039 | |
| 10 mL Serological pipette tip | SPL lifescience | 91010 | |
| 15 mL conical tube | SPL lifescience | 50015 | |
| 18G plastic needle | Musashi engineering | PN-18G-B | |
| 20G plastic tapered dispense tip | Musashi engineering | TPND-20G-U | |
| 22x50 glass cover | MARIENFIELD | 0101142 | |
| 25 mL Serological pipette tip | SPL lifescience | 90125 | |
| 3 mL disposable syringes | HENKE-JET | 4020-X00V0 | |
| 40 µm cell strainer | Falcon | 352360 | |
| 5 mL Serological pipette tip | SPL lifescience | 91005 | |
| 50 mL conical tube | SPL lifescience | 50050 | |
| 50 mL Serological pipette tip | SPL lifescience | 90150 | |
| 50N precision nozzle | Musashi engineering | HN-0.5ND | |
| Aluminum foil | SINKWANG | ||
| Capillary tips | Gilson | CP1000 | |
| Cell-scrapper | SPL lifescience | 90030 | |
| Confocal dish | SPL lifescience | 200350 | |
| Parafilm | Bemis | PM996 | |
| Pre-coated histology slide | MATSUNAMI | MAS-11 | |
| Reservoir | SPL lifescience | 23050 | |
| T-75 cell culture flask | SPL lifescience | 70075 | |
| Equipment | |||
| 3DX printer | T&R Biofab | ||
| Autoclave | JEIOTECH | AC-12 | |
| Centrifuger | Cyrozen | 1580MGR | |
| Confocal laser microscopy | Olympus Life Science | FV 1000 | |
| Fluorescence microscope | FISHER SCEINTIFIC | O221S366 | |
| Forcep | Korea Ace Scientific | HC.203-30 | |
| Hand tally counter | KTRIO | ||
| Hemocytometer | MARIENFIELD | 0650030 | |
| Incubator | Panasonic | MCO-170AIC | |
| Laminar flow cabinet | DAECHUNG SCIENCE | CB-BMMS C-001 | |
| Metal syringe | IWASHITA engineering | SUS BARREL 10CC | |
| Operating Scissors | Hirose | HC.13-122 | |
| Oven | JEIOTECH | OF-12, H070023 | |
| Positive displacement pipette | GILSON | NJ05652 | |
| Refrigerator | SAMSUNG | CRFD-1141 | |
| Voltex Mixer | DAIHAN scientific | VM-10 | |
| Water bath | DAIHAN SCIENTIFIC | WB-11 | |
| Water purifier | WASSER LAB | DI-GR | |
| Materials | |||
| 0.25 % Trypsin-EDTA | Gibco | 25200-072 | |
| 10x PBS | Intron | IBS-BP007a | |
| 4% Paraformaldehyde | Biosesang | ||
| 70% Ethanol | Daejung | 4018-4410 | |
| Anti-CD31 antibody | Abcam | ab28364 | |
| Anti-HIF-1 alpha antibody | Abcam | ab16066 | |
| Anti-SHMT2/SHMT antibody | Abcam | ab88664 | |
| Anti-SOX2 antibody | Abcam | ab75485 | |
| Bovine Serum Albumin | Thermo scientific | J10857-22 | |
| Collagen from porcine skin | Dalim tissen | PC-001-1g | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Thermofisher | D1306 | |
| Endothelial Cell Growth Medium-2 | Promocell | C22011 | |
| Fetal bovine serum | Gibco | 12483-020 | |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Theromofisher | A-11001 | |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | Theromofisher | A-11012 | |
| High-glucose Dulbecco’s Modified Eagle Medium(DMEM) | Hyclone | SH30243-0 | |
| Hydrochloric acid | Sigma-Aldrich | 311413-100ML | |
| Live/dead assay kit | Invitrogen | L3224 | |
| Mouse IgG1, kappa monoclonal [15-6E10A7] - Isotype Control | Abcam | ab170190 | |
| Penicillin/streptomycin | Gibco | 15140-122 | |
| Phenol red solution | Sigma-Aldrich | P0290-100ML | |
| Poly(ethylene-vinyl acetate) | Poly science | 06108-500 | |
| Polydimethylsiloxane | Dowhitech | sylgard 184 | |
| Rabbit IgG, polyclonal - Isotype Control | Abcam | ab37415 | |
| Sodium hydroxide solution | Samchun | S0610 | |
| Triton X-100 | Biosesang | TRI020-500-50 | |
| Trypan Blue | Sigma-Aldrich | T8154 | |
| Software | |||
| COMSOL Multiphysics 3.5a | COMSOL AB | ||
| IMS beamer | in-house software | ||
| SolidWorks Package | Dassault Systems SolidWorks Corporation |
参考文献
- Jing, X., et al. Role of hypoxia in cancer therapy by regulating the tumor microenvironment. Molecular Cancer. 18 (1), 157(2019).
- Al Tameemi, W., Dale, T. P., Al-Jumaily, R. M. K., Forsyth, N. R. Hypoxia-modified cancer cell metabolism. Frontiers in Cell and Developmental Biology. 7, 4(2019).
- Petrova, V., Annicchiarico-Petruzzelli, M., Melino, G., Amelio, I. The hypoxic tumour microenvironment. Oncogenesis. 7 (1), 1-13 (2018).
- Hockel, M., Vaupel, P. Tumor hypoxia: definitions and current clinical, biologic, and molecular aspects. Journal of the National Cancer Institute. 93 (4), 266-276 (2001).
- Kim, H., Lin, Q., Glazer, P. M., Yun, Z. The hypoxic tumor microenvironment in vivo selects the cancer stem cell fate of breast cancer cells. Breast Cancer Research. 20 (1), 16(2018).
- Jeong, G. S., Lee, J., Yoon, J., Chung, S., Lee, S. -H. Viscoelastic lithography for fabricating self-organizing soft micro-honeycomb structures with ultra-high aspect ratios. Nature Communications. 7 (1), 1-9 (2016).
- Razian, G., Yu, Y., Ungrin, M. Production of large numbers of size-controlled tumor spheroids using microwell plates. Journal of Visualized Experiments:JoVE. (81), e50665(2013).
- Nunes, A. S., Barros, A. S., Costa, E. C., Moreira, A. F., Correia, I. J. 3D tumor spheroids as in vitro models to mimic in vivo human solid tumors resistance to therapeutic drugs. Biotechnology and Bioengineering. 116 (1), 206-226 (2019).
- Wan, L., Neumann, C., LeDuc, P. Tumor-on-a-chip for integrating a 3D tumor microenvironment: chemical and mechanical factors. Lab on a Chip. 20 (5), 873-888 (2020).
- Nam, H., Funamoto, K., Jeon, J. S. Cancer cell migration and cancer drug screening in oxygen tension gradient chip. Biomicrofluidics. 14 (4), 044107(2020).
- Palacio-Castañeda, V., Kooijman, L., Venzac, B., Verdurmen, W. P., Le Gac, S. Metabolic switching of tumor cells under hypoxic conditions in a tumor-on-a-chip model. Micromachines. 11 (4), 382(2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: a fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Mi, S., Du, Z., Xu, Y., Sun, W. The crossing and integration between microfluidic technology and 3D printing for organ-on-chips. Journal of Materials Chemistry B. 6 (39), 6191-6206 (2018).
- Yi, H. -G., Lee, H., Cho, D. -W. 3D printing of organs-on-chips. Bioengineering. 4 (1), 10(2017).
- Yi, H. -G., et al. A bioprinted human-glioblastoma-on-a-chip for the identification of patient-specific responses to chemoradiotherapy. Nature Biomedical Engineering. 3 (7), 509-519 (2019).
- Kang, T. -Y., Hong, J. M., Jung, J. W., Yoo, J. J., Cho, D. -W. Design and assessment of a microfluidic network system for oxygen transport in engineered tissue. Langmuir. 29 (2), 701-709 (2013).
- Woo Jung, J., et al. Evaluation of the effective diffusivity of a freeform fabricated scaffold using computational simulation. Journal of Biomechanical Engineering. 135 (8), (2013).
- Brown, A. C., De Beer, D. Development of a stereolithography (STL) slicing and G-code generation algorithm for an entry level 3-D printer. 2013 Africon (IEEE). , 1-5 (2013).
- Shim, J. -H., Lee, J. -S., Kim, J. Y., Cho, D. -W. Bioprinting of a mechanically enhanced three-dimensional dual cell-laden construct for osteochondral tissue engineering using a multi-head tissue/organ building system. Journal of Micromechanics and Microengineering. 22 (8), 085014(2012).
- Gillispie, G., et al. Assessment methodologies for extrusion-based bioink printability. Biofabrication. 12 (2), 022003(2020).
- Kim, B. S., Das, S., Jang, J., Cho, D. -W. Decellularized extracellular matrix-based bioinks for engineering tissue-and organ-specific microenvironments. Chemical Reviews. 120 (19), 10608-10661 (2020).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。