Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Katı Kanserin Patolojik İlerlemesinin Yeniden Kapsüllenilmesi için Çip Üzerinde 3D Hücre Baskılı Hipoksik Kanser
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Hipoksi tümör mikroçevriminin ayırt edici özelliğidir ve kanserin ilerlemesinde çok önemli bir rol oynar. Bu makalede, hipoksiye bağlı bir kanser patolojisini yeniden canlandırmak için 3D hücre baskı teknolojisine dayanan çip üzerinde hipoksik bir kanserin fabrikasyon süreci açıklanmaktadır.
Özet
Kanser mikroçevrişiminin hastalığın ilerlemesi üzerinde önemli bir etkisi vardır. Özellikle, hipoksi kanser sağkalım, istila ve chemoresistance anahtar sürücüdür. Hipoksi ile ilgili kanser patolojisini incelemek için çeşitli in vitro modeller geliştirilmiş olmasına rağmen, in vivo olarak gözlenen kanser mikroçevriciliğinin karmaşık etkileşimi, hassas mekansal kontrol eksikliği nedeniyle henüz çoğaltılamamıştır. Bunun yerine, kanser ekolojisinin daha iyi öykünmesi ve doğru antikanser tedavi değerlendirmesi için mikrofizyolojik sistemler oluşturmak için 3D biyofabrikasyon yaklaşımları önerilmiştir. Burada, çip üzerinde hipoksik bir kanser imal etmek için 3D hücre baskı yaklaşımı öneriyoruz. Çipteki hipoksiyi indükleyen bileşenler, oksijen dağılımının bilgisayar simülasyonundan yola çıkarak belirlendi. Kanser-stroma eşmerkezli halkaları, bir tür katı kanseri nüksetlemek için glioblastom hücreleri ve endotel hücreleri içeren biyoinksler kullanılarak basılmıştır. Elde edilen çip, temsili patofizyolojik belirteçlerin oluşumu ile kanserde merkezi hipoksi ve ağırlaştırılmış maligniteyi fark etti. Genel olarak, katı-kanser-mimetik mikrofizyolojik sistem oluşturmak için önerilen yaklaşımın, kanser araştırmaları için in vivo ve in vitro modeller arasındaki boşluğu kapatması beklenmiştir.
Giriş
Kanser mikroçevrişi, kanserin ilerlemesini yönlendiren kritik bir faktördür. Biyokimyasal, biyofiziksel ve hücresel ipuçları da dahil olmak üzere birden fazla bileşen kanserin patolojik özelliklerini belirler. Bunlar arasında hipoksi kanser sağkalım, çoğalma ve istila1ile güçlü bir şekilde ilişkilidir. Kanser hücrelerinin sınırsız büyümesi ve bölünmesi nedeniyle, besinler ve oksijen sürekli tükenir ve hipoksik bir gradyan üretilir. Düşük oksijen koşullarında, hücreler hipoksi indüklendirilebilir transkripsiyon faktörünü (HIF) aktive eder moleküler basamak. Bu işlem nekrotik bir çekirdeğe neden olur, metabolik değişiklikleri tetikler ve kan damarı hiperplazisini ve metastazı2,3'ü başlatır. Daha sonra, kanser hücrelerindeki hipoksi komşu normal dokuların tahrip olmasına neden olur. Ayrıca, hipoksi, katı tümörlerin multifaktöriyel olarak terapötik direnci ile güçlü bir şekilde ilişkilidir. Hipoksi radyoterapiyi ciddi şekilde engelleyebilir, çünkü radyosensitivite reaktif oksijen türleri nedeniyle sınırlıdır1,4. Ek olarak, ilaç birikimini azaltan kanser mikroçevranlıklarının pH seviyelerini azaltır1. Bu nedenle hipoksi in vitro ile ilgili patolojik özelliklerin yeniden üretilmesi bilimsel ve klinik öncesi bulgular için umut verici bir stratejidir.
Kanserin belirli bir mikroçevriciliğini modellemek, kanser gelişimini anlamak ve uygun tedavileri keşfetmek için gereklidir. Hayvan modelleri güçlü fizyolojik alakaları nedeniyle yaygın olarak kullanılsa da, tür farklılıkları ve etik problemler ile ilgili konularmevcuttur 5. Ayrıca, geleneksel 2D ve 3D modeller derinlemesine bir analiz için kanser hücrelerinin manipülasyonu ve gerçek zamanlı görüntülenmesine izin verse de, mimari ve hücresel karmaşıklıkları tam olarak yeniden elde edilemez. Örneğin, bir küreseldeki kanser hücresi toplaması çekirdekte doğal olarak hipoksi üretebildiği için kanser sferoid modelleri yaygın olarak kullanılmıştır. Ayrıca, plastik veya silikon bazlı çok kuyulu sistemler kullanılarak çok sayıda tekdüze boyutta hücresel sferoid üretilmiştir6,7. Bununla birlikte, kanserli dokuların tam heterojen yapısını geleneksel platformlarla yakalama konusunda daha düşük esneklik, kanser araştırmalarını geliştirmek için son derece biyomimetik bir platform oluşturmak için gelişmiş bir biyofabrikasyon teknolojisinin kurulmasını gerektirmektedir8.
3D mikrofizyolojik sistemler (MPS'ler) kanser hücrelerinin karmaşık geometrisini ve patolojik ilerlemesini yeniden sağlamak için yararlı araçlardır9. Kanser hücreleri büyüme faktörlerinin ve kemokinlerin biyokimyasal gradyanını ve sistem üzerinde yeniden üretilen mekanik heterojenliği algıladıkça, kanser gelişiminin önemli özellikleri in vitro olarak araştırılabilir. Örneğin, değişen oksijen konsantrasyonlarına bağlı olarak kanser canlılığı, metastatik malignite ve ilaç direnci MPSs10,11kullanılarak çalışılmıştır. Son gelişmelere rağmen, in vitro modellerin hipoksik koşullarının oluşturulması, fiziksel gaz pompaları ile bağlantı da dahil olmak üzere karmaşık imalat prosedürlerine dayanmaktadır. Bu nedenle, kansere özgü mikroçevrimler oluşturmak için basit ve esnek yöntemlere ihtiyaç vardır.
3D hücre baskı teknolojisi, yerel biyolojik mimarileri yeniden canlandırmak için biyomalzemelerin mekansal düzenini hassas bir şekilde kontrol etmesi nedeniyle önemli ölçüde dikkat çekmektedir12. Özellikle, bu teknoloji, kanser mikroçevriciliğinin mekansal özelliklerini oluşturmak için yüksek kontrol edilebilirliği ve fizibilitesi nedeniyle 3D hipoksi modellerinin mevcut sınırlamalarının üstesinden gelmektedir. 3D baskı ayrıca katman katman bir süreçle bilgisayar destekli üretimi kolaylaştırır, böylece gerçek doku mimarilerini taklit etmek için karmaşık geometrilerin hızlı, doğru ve tekrarlanabilir bir şekilde inşasını sağlar. 3D MPS'ler için mevcut üretim stratejilerinin avantajlarına ek olarak, kanser ilerlemesinin patofizyolojik özellikleri biyokimyasal, hücresel ve biyofiziksel bileşenlerin desenlenerek çoğaltılabilir13,14.
Burada, katı bir kanserin heterojenliğini yeniden yakalamak için çip üzerinde hipoksik bir kanser için 3D hücre baskı stratejisi sunuyoruz (Şekil 1)15. İmalat parametreleri, sistemdeki merkezi hipoksi oluşumunun hesaplamalı simülasyoni ile belirlendi. Kanser-stroma eşmerkezli halkalar, bir tür katı kanser olan glioblastom patofizyolojisini taklit etmek için glioblastom hücreleri ve endotel hücreleri içeren kollajen biyoinksler kullanılarak basıldı. Radyal oksijen gradyanı oluşumu kanser malignitesini ağırlaştırarak saldırganlığın güçlendiğini gösterir. Ayrıca, çipin hastaya özgü preklinik modellere uygulamaları için gelecekteki perspektifleri belirtiyoruz. Katı-kanser-mimetik mikrofizyolojik sistem oluşturmak için önerilen yaklaşımın in vivo ve in vitro kanser modelleri arasındaki boşluğu kapatması beklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Oksijen gradyan oluşumunun bilgisayar simülasyonları
-
Çip üzerinde hipoksik kanser baskısı için 3D geometri modelinin üretimi
- Bir 3D CAD yazılımı çalıştırın.
- Çip üzerinde hipoksik kanserin geometri modelini çizin. Çizim'e tıklayın ve geometriyi çizmek için istediğiniz düzlemi seçin. Her parçanın ayrıntı ölçeği için çizime (Şekil 2A) bakın.
- Özellik Çıkıntı patronu/tabanı 'na tıklayarak geometrinin kalınlığını ayarlayın. Boş kutuya istediğiniz kalınlığı girin (Şekil 2A'yabakın) ve 3B geometriyi oluşturmak için yeşil onay simgesini seçin.
NOT: Çip üzerindeki kanser boyutu, istenen ortam ve hidrojel hacimlerine göre tanımlanır. Mevcut deneyde, ekstrüzyon bazlı biyobaskı çözümü için önceki pratik deneyimlere dayanarak, istenen medya ve hidrojel hacimleri sırasıyla yaklaşık 1.500 μL ve 500 μL'ydi. - Geometri dosyasını 3B CAD dosya biçimi (.prt veya .stl) olarak kaydedin.
-
Hipoksik çekirdeğin indüksiyonu için hücresel yoğunluğun belirlenmesi
- Fiziksel bir difüzyon simülasyon programı çalıştırın.
- LiveLink'e tıklayın ve kullanılan CAD programını seçin. Simülasyon programındaki hipoksik kanser-on-a-chip geometrisini içe aktarmak için Senkronize'ye tıklayın. Odanın iç alanı gerçek bir deneysel ortamda bir kültür ortamı ile doldurulacağından, oksijen odanın iç boşluğuna ve hücre yüklü hidrojellerden oluşacak hücresel yapıya yayılacaktır.
NOT: Fiziksel parametreler hakkında ayrıntılı bilgi için önceki çalışmaya bakın15. - İthal edilen 3B geometriyi oksijenin dağınık olduğu ve hücrelerin oksijen tükettiği alanın kontrol hacmi olarak tanımlayın (Şekil 2B).
- Bir kullanım kılavuzu ve önceden belirlenmiş yöntemler16,17'yi izleyerek gaz difüzyon analizi için bir bilgisayar analizi çalıştırın.
- Bilgisayar analiz sonuçlarından, tahmini oksijen konsantrasyonu verilerini, kullanım kılavuzunu izleyen her zaman noktasında kesit A-A' üzerinden dışa aktarabilirsiniz. Yönetim denklemi, Eq. (1) (Şekil 2C)olarak ifade edildiği gibi Fick'in ilk yasasına dayanmaktadır.
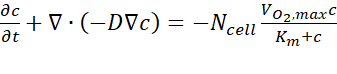
burada c konsantrasyondur, D oksijen difüzyon katsayısıdır, Nhücresi hücrelerin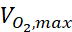 yoğunluğudur, maksimum oksijen alma oranıdır ve Km Michaelis-Menten sabitidir. Sabitler önceki bir yayında açıklandığı gibi uygulanmıştır15.
yoğunluğudur, maksimum oksijen alma oranıdır ve Km Michaelis-Menten sabitidir. Sabitler önceki bir yayında açıklandığı gibi uygulanmıştır15.
NOT: Her zaman noktası, zaman içinde oksijen difüzyon değişimini gözlemlemek için bir adım noktası anlamına gelir. - Minimum oksijen seviyesinin hipoksi eşiğine ulaşıp ulaşmadığını değerlendirin ve hücresel yoğunluğun artarak veya azalarak bilgisayar analiz sürecini tekrarlayın.
NOT: Hidrojel alanda %80'lik oksijen seviyesi 24 saat sonra 0,02 mM'den azsa, yapıda hipoksi gradyanı oluştuğunu tanımlayın. - Fick'in 1.2.5.
NOT: Bu protokolde hücre sayısı 2 × 106 hücre/her yapı idi.
2. Kanser hücrelerinin ve stromal hücrelerin hücre kültürü
-
Fizyolojik stresi önlemek için hücre kültürü medyasının hazırlanması
- U-87 MG hücreleri (ölümsüzleştirilmiş insan glioblastoma hücre hattı) için, %10 fetal sığır serumu içeren yüksek glikozlu Dulbecco'nun modifiye Kartal ortamının 12 mL'sini yerleştirin, Ortamın hücreler üzerindeki termal ve alkali etkilerini en aza indirmek için 37 °C'lik bir T-75 hücre kültürü şişesinde 100 U/mL penisilin ve 100 μg/mL streptomisinin% 5 CO2 nemlendirilmiş inkübatörü 30 dakika boyunca.
NOT: Glioblastoma hipoksik ortamda agresif özelliklere sahip olduğu için katı kanser türü olarak seçilmiştir. Bu modele diğer çeşitli kanser türleri de uygulanabilir. - İnsan göbek damarı endotel hücreleri (HUVEC' ler) için, 30 dakika boyunca 37 °C'de %5 CO 2 nemlendirilmiş inkübatöre bir T-75 hücre kültürü şişesine12 mL endotel hücre büyüme ortamı yerleştirin.
NOT: HUVEC'ler en temsili endotel hücre çizgilerinden biri olduğu için seçilmiştir. Bu modele çeşitli stromal hücre türleri de uygulanabilir.
- U-87 MG hücreleri (ölümsüzleştirilmiş insan glioblastoma hücre hattı) için, %10 fetal sığır serumu içeren yüksek glikozlu Dulbecco'nun modifiye Kartal ortamının 12 mL'sini yerleştirin, Ortamın hücreler üzerindeki termal ve alkali etkilerini en aza indirmek için 37 °C'lik bir T-75 hücre kültürü şişesinde 100 U/mL penisilin ve 100 μg/mL streptomisinin% 5 CO2 nemlendirilmiş inkübatörü 30 dakika boyunca.
-
Kriyoprezite edilmiş kanser hücrelerinin ve stromal hücrelerin hızlı çözülmesi ve bakımı
- 5 x10 5 U-87 MG hücre ve HUVEC içeren cryovials sıvı azot kabından laminer akış kabinine taşıyın. İç basıncı serbest bırakmak için kapağı hemen gevşetin ve yeniden sıkın.
- Kriyoprezite edilmiş hücreleri 2 dakika boyunca 37 °C'de bir su banyosuna yerleştirin ve kapağı sudan uzak tutun. Kirlenmeyi önlemek için şişeleri laminer akış altında% 70 etanol ile durulayın.
- Çözülmüş hücreleri, adım 2.1'de açıklanan hazırlanmış hücre kültürü ortamını içeren şişelere aktarın ve hücre içeren şişeleri hücre iyileşmesi için 37 °C'de% 5 CO2 nemlendirilmiş bir inkübatöre yerleştirin.
- Hücre kültürü medyasını her 2 günde bir yenileyin ve hücre büyümesini koruyun.
- 24 saat çözdükten sonra, hücre dondurma için kullanılan dimetil sülfitin (DMSO) sitotoksikliğini önlemek için hücre kültürü medyasını değiştirin. 6'dan az geçişten geçmiş HUVEC'leri kullanın.
3. Kollajen öncesi jel çözeltisinin hazırlanması
-
0.1 N hidroklorik asit (HCl) ile kollajen süngerinin çözünürlüğü
- 0,1 N HCl'lik bir çözelti hazırlayın ve 0,2 μm şırıng filtresi ile filtreleyin.
- %1 (w/v) nötralize kollajen pre-jel çözeltisinin 3 mL'si için, 5 x 5 mm2 parçaya kesilmiş ve 30 mg ağırlığında kollajen süngerleri hazırlayın.
- Kesilen kollajen parçalarını steril 10 mL cam şişeye aktarın.
NOT: Kollajen çözeltisinin yapışkan özelliği nedeniyle hidrojel kaybını göz önünde bulundurarak gerekli kollajen hidrojel hacminin 1,5 katını hazırlayın. - Kollajen içeren cam şişeye 2,4 mL 0,1 N HCl ekleyin ve 3 gün boyunca 15 rpm ve 4 °C'de rocker üzerinde kuluçkaya yatırın.
NOT: 0.1 N HCl çözeltisinin hacmi, gerekli kollajen hidrojelinin son hacminin beşte dördüydü. Bu durumda 3 mL kolajen hazırlandı. - Sindirimden sonra, sindirilmemiş kollajen parçacıklarını 40 μm hücre süzgeci kullanarak elek haline alın. Asidik kollajen çözeltisini 4 °C'de saklayın ve 7 gün içinde kullanın.
-
%1 nötralize kollajen pre-jel çözeltisi için pH ayarı
- Asidik kollajen çözeltisini 1224 x g'da 4 °C'de 5 dakika santrifüj edin.
- Kollajen ön jel çözeltisinde %1 (v/v) nihai konsantrasyona pH göstergesi olarak 30 μL fenol kırmızısı çözeltisi ve 10x fosfat tamponlu salin (PBS) tamponunun 300 μL'sini ekleyin.
- Renk değişimini doğrulayarak 1 N sodyum hidroksit (NaOH) ile pH'ı 7'ye nötralize edin.
NOT: Formüle dayanarak, H+ = molarity H+ x volume H+ = moles OH-= molarity OH- x volume OH-, 240 μL NaOH ekleyin. - Toplam 3 mL hacim elde etmek için damıtılmış su ekleyin.
- pH ayarından sonra% 1 (w/v) nötralize kollajen ön jel çözeltisini 4 °C'de saklayın ve 3 gün içinde kullanın.
NOT: Nötralize kollajen pre-jel çözeltisinin jelleşmesini önceden kontrol etmek için, pozitif bir deplasman pipet kullanarak küçük bir tabakta 50 μL kollajen damlacıkları yapın ve 1 saat boyunca 37 °C inkübatörde kuluçkaya yatırın. Kollajen damlacıklarının çapraz bağlanmasını doğrulamak için aşağıdaki üç yönteme bakın. - Kollajen renginin saydam renkten opak beyaza dönüşüp dönüşmediğini kontrol edin.
- Kabı eğin ve kolajenin kabın altına yapışıp yapışmadığını kontrol edin.
- Damlacıkların üzerine 1x PBS dökün ve kollajen yapının çözeltide kırılmadığını kontrol edin.
4.3D gaz geçirgen bariyer baskısı
-
Kurbanlık poli (etilen-vinil asetat) (PEVA) kalıbının 3D baskısı
- 1. adımda tanımlanan kurbanlık PEVA kalıbının 3B geometrisini bir 3D CAD yazılımı kullanarak oluşturun (Şekil 3A).
NOT: Boyut, birim ve çizgi tiplerini içeren 3B geometri ve ayrıntılı model ölçeği Şekil 2A'dagösterilmiştir. - Dosya | tıklayarak 3D CAD dosyasını STL dosya biçimine dönüştürme Dosyayı STL olarak kaydet türü. Ayrıca, Seçenek | G kodu oluşturma için ASCII olarak çıktı formu.
- Dosya | tıklayın STL dosyasını açın ve oluşturulan STL dosyasını almak için kaydedilen STL dosyasını seçin. Kurbanlık PEVA kalıbının G kodunu otomatik olarak oluşturmak için STL-CAD eşanjörün Dilim modeline tıklayın (Şekil 3B, C).
NOT: Yazdırma yolu, STL dosyasının temel figürü ile dilimleme düzlemi (yani katman) arasındaki kesişen noktaların bağlantısıyla oluşturulur. Temel olarak, bir STL dosyasındaki bir parçanın temel şekli, 3D koordinatları içeren bir üçgendir. Üçgen ve katman arasındaki kesişen noktalar elde edildikten sonra, her noktanın katman18üzerinde çakışmış bir yol olmadan bağlanmasıyla yazdırma için bir G kodu oluşturulur. Yerleşik yazılımdaki herhangi bir G kodu oluşturma algoritması, talaş imalatı için yazdırma yolları oluşturmak için kullanılabilir. - Steril bir yapıştırıcı ve hidrofilik histoloji slaytı hazırlayın.
NOT: Hidrofilik slayt camı, polidimetilsiloksan'ın (PDMS) cama kalıcı olarak bağlanması ve kollajen yapışması kanser hücrelerini ve stromal hücreleri kapsülleyen yapılar için kritik öneme sahiptir. - Kurbanlık PEVA kalıbını 110 °C'de 500 kPa pnömatik basınçta 50 G hassasiyetli nozülle slayta yazdırın.
NOT: Çizgi genişliği, malzemenin ilerleme hızından, nozül ölçerden ve sıcaklığından etkilenir. 50 G nozulu kullanıldı ve kurban duvarı için 500 μm hat genişliği oluşturmak için 400 besleme oranı uygulandı. Nozül göstergesi, pnömatik basınç ve ilerleme hızı pratik sonuçlarla tanımlanır19. Bir sonraki imalat adımı olan PDMS çözeltisini tutmak için kurban duvarının yeterince kalın olması gerekir.
- 1. adımda tanımlanan kurbanlık PEVA kalıbının 3B geometrisini bir 3D CAD yazılımı kullanarak oluşturun (Şekil 3A).
-
Polidimetilsiloksan (PDMS) bariyerinin dökümü
- Plastik bir rezervuarda 5 dakika boyunca 6 mL PDMS taban elastomer ve 0,6 mL kürleme maddesini homojen bir şekilde karıştırın. Bu, PDMS'nin yapışkan özelliği nedeniyle kaybı göz önünde bulundurarak 6 hipoksik kanser-on-chips üretebilir.
- Karıştırılmış PDMS solüsyonunu 10 mL tek kullanımlık şırınnaya yükleyin ve şırınna kafasını 20 G plastik konik dağıtım ucuna takın.
- Kurbanlık PEVA kalıbını şırınnadaki harmanlanmış PDMS çözeltisi ile doldurun. Harmanlanmış PDMS, kurbanlık PEVA kalıbını dışbükey bir yüzeyle dolduracaktır. PDMS bariyerinin yüksekliği PEVA kalıbından daha yüksek olacaktır.
- PEVA'nın erimesini önlemek için PDMS bariyerini 40 °C'deki bir fırında 36 saatten fazla tedavi edin. Sıcaklığı PEVA'nın erime sıcaklığı olan 88 °C'nin üzerine çıkarmayın.
- Kurbanlık PEVA kalıbını bir çift hassas cımbızla ayırın ve 120 °C'de gaz geçirgen bariyeri bir otoklavda sterilize edin.
5. Hücre kapsüllü kollajen biyo-mürekkeplerin hazırlanması
-
Hazırlanan kanser hücrelerinin ve stromal hücrelerin bireyi
NOT: Hücre canlılığı göz önüne alındığında, hücrelerin ayrılarak tüm yazdırma işlemi mümkün olan en kısa sürede tamamlanmalıdır.- Serolojik pipet kullanarak kanser ve stromal hücreleri 10 mL 1x PBS ile yıkayın; pipet kullanarak 2 mL%0,25 trypsin-etylenediaminetetraacetic asit (EDTA) ile tedavi edin ve 37 °C'de 3 dakika kuluçkaya yatırın.
- 3 mL hücre kültürü ortamı ile trypsinized hücreleri nötralize; hücrelerin süspansiyonlarını 15 mL konik tüpler ve santrifüj 516 x g'da 20 °C'de 5 dakika boyunca toplayın.
- Üstnatantı yavaşça aspire edin; hücre peletlerini 5 mL hücre kültürü ortamına yeniden aşılar ve hemositometre kullanarak hücre sayısını sayar.
- Her hücre türünden 5 x10 6 hücreyi yeni 15 mL konik tüplere aktarın ve 20 °C'de 5 dakika boyunca 516 x g'da santrifüj edin.
- Süpernatantı aspire edin ve ıslak buzun üzerine yerleştirin.
-
Her hücre tipinin% 1 nötralize kollajen pre-jel çözeltisi ile karıştırılması
NOT: %1 nötralize kollajen pre-jel çözeltisinin termal katılaşmasını önlemek için bu işlem ıslak buz üzerinde yapılmalıdır.- 5.1.4 adımında toplanan her hücre peletini her biri 20 μL hücre kültürü ortamıyla yeniden biriktirin.
- Yeniden canlanan hücre süspansiyonlarının her birine % 1 nötralize kollajen pre-jel çözeltisinin 1 mL'sini ekleyin ve pozitif bir deplasman pipeti kullanarak homojen bir şekilde karıştırın. Her hücre tipinin son konsantrasyonu 5 x 106 hücre/mL olacaktır.
- Hücre kapsüllü kollajen biyoinkslerini pozitif tek kullanımlık pipet kullanarak 3 mL tek kullanımlık şırınna aktarın ve şırınnaları 3D hücre baskısına kadar 4 °C'de saklayın.
6.3D kanser-stroma eşmerkezli halkaların hücre baskısı
-
Kanser hücrelerini ve stromal hücreleri kapsülleyen kollajen biyoinkslerinin 3D hücre baskısı
- 3D CAD yazılımı kullanarak adım 1.2'de tanımlanan kanser-stroma eşmerkezli halkaların 3B geometrisini oluşturun.
NOT: Kanser stroma eşmerkezli halkalarının boyutları simüle edilmiş parametrelerle tanımlanır. Son boyut parametre boyutları Şekil 3A'da gösterilmiştir. - 3D CAD dosyasını bir STL dosya formatına dönüştürün ve bir STL-CAD eşanjörü kullanarak kanser-stroma eşmerkezli halkaların G kodunu oluşturun.
NOT: G kodu oluşturma algoritması için 4.1.2 adımındaki nota bakın. - 3 mL tek kullanımlık şırınnalarda bulunan hücre kapsüllü kollajen biyoinkslerini 3D yazıcının başına yükleyin ve kafa ve plakanın sıcaklığını 15 °C'ye ayarlayın.
NOT: Yazıcının kafasının ve plakasının sıcaklığı 37 °C'nin üzerine ulaşırsa, biyoink çapraz bağlanır ve artık baskı yapılmaz. - Oluşturulan yazdırma yolunu 3D yazıcının kontrol yazılımına yükleyin.
- Başlat düğmesine tıklayarak, kanser hücrelerini ve stromal hücreleri kapsülleyen kollajen biyoinkslerini, yüklü G kodunu 15 °C'de yaklaşık 20 kPa pnömatik basınçta 18 G plastik iğne ile yüklü G kodunu takiben gaz geçirgen bariyerine yazdırın.
- Her baskı işleminin sonunda, hipoksik gradyanı oluşturmak için gaz geçirgen bariyerin üzerine manuel olarak sterilize edilmiş 22 mm x 50 mm cam kapak yerleştirin.
NOT: Hipoksik gradyanın neslini doğrulamak için cam kapağın (GR+) varlığına ve yokluğuna (GR-) bağlı olarak iki grubu karşılaştırın. - Üç hipoksik kanser-on-chips ürettikten sonra, kollajen biyoinks çapraz bağlamak için 1 saat boyunca 37 °C'de bir inkübatöre cips aktarın.
- 3D CAD yazılımı kullanarak adım 1.2'de tanımlanan kanser-stroma eşmerkezli halkaların 3B geometrisini oluşturun.
-
Üretim sürecinin tamamlanması ve çip üzerinde hipoksik kanserin sürdürülmesi
- Hipoksik kanser-on-a-chip tüm 3D hücre baskı işlemlerinin tamamlandıktan sonra, sıkı yapıştırma için hücre kazıyıcı ile gaz geçirgen bariyerlerin üzerine kapak camlarını hafifçe sürün (Şekil 4A,B).
NOT: Kapak camı ve gaz geçirgen bariyeri, kimyasal yapıştırıcılar olmadan hidrofobik yapıştırma yoluyla monte edilir, sadece kapak camı ile PDMS bariyeri arasındaki yapıştırılmış kısmı kazır. - Her çipe 1,5 mL endotel hücre büyüme ortamı tanıtın. Kanser yapısından kopmayı önlemek için, çipin bir tarafından hücre kültürü ortamını tanıtın. Hücre kültürü ortamlarının pipet kullanarak akmasını sağlamak için çipi eğin.
- Hücre kültürü medyasını bir hafta boyunca her gün yenileyin. Hücre kültürü ortamını aspire etmek için bir pipet kullanın; basınç pompası kullanmayın.
- Hipoksik kanser-on-a-chip tüm 3D hücre baskı işlemlerinin tamamlandıktan sonra, sıkı yapıştırma için hücre kazıyıcı ile gaz geçirgen bariyerlerin üzerine kapak camlarını hafifçe sürün (Şekil 4A,B).
7. Baskı sonrası hücre canlılığının değerlendirilmesi
-
Calcein ve EthD-1 çözeltisi ile numunelerin hazırlanması ve tedavisi
- 37 °C'de bir su banyosunda 1x PBS ısıtın.
- Önceden ısıtılmış 1,5 mL PBS'ye 0,75 μL kalsetin asetoksimetil (kalsein AM) ve 3 μL ethidyum homodimer (EthD-1) ekleyerek test çözeltisini hazırlayın.
- Bir pipet kullanarak çipten tüm ortamları dikkatlice emiş edin.
- Kanser yapısını önceden ısıtılan PBS ile yıkayın. 1,5 mL PBS'yi bir pipet kullanarak çipe doldurun ve oda sıcaklığında 10 dakika bekletin. Kanser yapısındaki deformasyonu önlemek için, talaşların bir tarafından 1x PBS tanıtın ve 1x PBS'nin akmasını sağlamak için yongaları eğin.
- PBS'i çipten epire edin; 1,5 mL test çözeltisini tedavi edin ve ışıktan korumak için bir folyo kullanarak çipi 37 °C'de 20 dakika kuluçkaya yatırın. 1x PBS'yi aspire etmek için bir pipet kullanın; emme pompası kullanmayın.
-
Floresan mikroskop kullanılarak hücre canlılığının görüntülenmesi
- Floresan mikroskobu kullanarak etiketli hücreleri görüntüleyin ve yakalayın (Şekil 4C).
NOT: Calcein canlı hücreleri yeşil floresan ile işaretler (dalga boyu ~488 nm). EthD-1, kırmızı floresanlı ölü hücrelerin sinyalini temsil eder (dalga boyu ~594 nm). - Açık kaynaklı bir görüntü işleme programı olan görüntüleme yazılımını kullanarak canlı ve ölü hücrelerin sayısını sayın ve sayılarla canlılığı hesaplayın.
- Floresan mikroskobu kullanarak etiketli hücreleri görüntüleyin ve yakalayın (Şekil 4C).
8. Merkezi hipoksi oluşumunu ve kanser malignitesi üzerindeki etkisini doğrulamak için immünoresans
-
Kanser yapısında fiksasyon, permeabilizasyon ve bloke etme
- Oda sıcaklığında 1x PBS, %4 paraformaldehit (PFA), %0,1 (v/v) Triton X-100 ve %2 (w/v) sığır serum albümini (BSA) hazırlayın.
- Bir pipet kullanarak çipten tüm medyayı dikkatlice emiş ve çipi 1x PBS ile üç kez durulayın. Kanser yapısındaki deformasyonu önlemek için, talaşların bir tarafından 1x PBS tanıtın ve 1x PBS'nin akmasını sağlamak için yongaları eğin. Her yıkama adımı arasında, artık çözeltileri çıkarmak için çipin 5 dakika boyunca 1x PBS ile durmasına izin verin.
NOT: 1x PBS basınç pompası değil pipet kullanılarak emişli. - Pipet kullanarak çip üzerindeki kanser yapısına 500 μL% 4 PFA ekleyin; 15 dakika bekletin ve kanser yapısındaki hücreleri düzeltmek için 1x PBS ile üç kez yıkayın.
- Kanser yapısını 5 dakika boyunca oda sıcaklığında bir pipet kullanarak% 0.1 Triton X-100'ün 500 μL'si ile tedavi edin ve hücre zarını yatıştırmak ve permeabilize etmek için 1x PBS ile üç kez yıkayın.
- Reaktif epitopları engellemek için oda sıcaklığında 1 saat boyunca bir pipet kullanarak% 2 BSA'nın 500 μL'si ile kanser yapısını tedavi edin.
NOT: Buharlaşmayı önlemek için çipi parafin filmi ile örtün. - 1 saat sonra, çipi 1x PBS ile üç kez yıkayın.
-
Primer antikor, sekonder antikor ve DAPI ile tedavi ve konfokal mikroskop kullanılarak yapının görüntülenmesi.
- Antikorları istenen her çalışma konsantrasyonuna 1x PBS olarak seyrelterek izotip kontrol antikorlarını ve birincil antikorların kokteylini hazırlayın.
NOT: Antikorların özel ayrıntıları Malzeme Tablosu'nda listelenmiştir. Birincil antikorlarla aynı çalışma konsantrasyonları izotip kontrol antikorları kullanılmalıdır. - Bir pipet kullanarak çipten tüm 1x PBS'leri dikkatlice epire edin ve çipi bir gecede 4 °C'de 200 μL birincil antikor çözeltisi ile tedavi edin. Buharlaşmayı önlemek için talaşları parafin filmi ile örtün.
- Birincil antikor çözeltisini epire edin ve çipi 1x PBS ile üç kez yıkayın.
- sekonder antikorları ve DAPI'yı istenen çalışma konsantrasyonuna göre 1x PBS olarak seyreltin.
NOT: Bu durumda 1:200 oranında Yeşil floresan konjuge sekonder antikor kullanılır. DAPI 1:1000 oranında kullanılmıştır. - Bir pipet kullanarak çipten tüm 1x PBS'yi dikkatlice epire edin ve çipi 3 saat boyunca 4 °C'de 200 μL ikincil antikor-DAPI çözeltisi ile tedavi edin. Buharlaşmayı önlemek için çipi parafin filmi ile örtün ve ardından fotobleachingi önlemek için alüminyum folyo ile sarın.
- İkincil antikor-DAPI çözeltisini epire edin ve çipi 1x PBS ile üç kez yıkayın.
- Boyama adımını bitirdikten sonra, kanser yapısını kümes parmaklarıyla hafifçe kavrarak bir konfokal yemeğe aktarın.
- Etiketli hücreleri konfokal mikroskop kullanarak görselleştirin ve yakalayın (Şekil 5).
NOT: Konfokal mikroskobun dalga boyu, floresan belirteçlerin türüne bağlı olarak ayarlandı. Antikorların özel detayları Malzeme Tablosu'nda listelenmiştir. Hücre konumunu verimli bir şekilde tespit etmek için, ilk başta yapının DAPI lekeli çekirdeklerini gözlemlemek daha iyi olacaktır. Floresan sinyallerin algılama ekscitasyon/emisyon dalga boyları 358/461 nm (DAPI, Mavi), 494/517 nm (Yeşil) ve 590/617 nm (Kırmızı) olarak belirlendi. Büyütmeler 4x, 10x ve 20x'tir, en düşükten en yükseğe ayarlanmıştır.
- Antikorları istenen her çalışma konsantrasyonuna 1x PBS olarak seyrelterek izotip kontrol antikorlarını ve birincil antikorların kokteylini hazırlayın.
9. İstatistiksel analiz
-
Görüntü işleme programı ile hücre sayımı
- Canlı ve ölü hücrelerin sayısını saymak için bir görüntü işleme programı çalıştırın.
- Floresan görüntü dosyalarını açın. Dosya | tıklayın TIFF görüntülerini açın ve içe aktarın.
- Görüntüleri 16 bit gri tonlamalı görüntülere dönüştürün. Resim | tıklayın | yazın 16 bit Gri Tonlama.
- Görüntü |'na tıklayarak eşiği ayarlama | ayarlama Eşik ve sonra siyah olacak hücrelerin rengini seçin.
- İşlem | tıklayarak birleştirilmiş hücreleri birbirinden ayırın İkili | Kesin hücre sayımı için su havzası.
- Çözümle'ye ve ardından Parçacıkları Üç Kez Çözümle'ye tıklayarak hücre sayısını sayın; ortalamayı hesaplayın ve verileri standart hatanın ortalaması olarak ±.
NOT: İmmünofluoresans belirteçleri floresan yoğunluğu karşılaştırılarak analiz edildi.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Çip üzerindeki hipoksik kanser, hipoksi ve kanserle ilgili patolojiyi yeniden canlandırmak için bilgisayar destekli 3D hücre baskı teknolojisi kullanılarak geliştirilmiştir (Şekil 1). Oksijen taşıma ve tüketimi 3D geometri modeli kullanılarak simüle edildi. Çip, kanser dokularında radyal oksijen difüzyonunu ve tükenmesini taklit etmek için eşmerkezli halkalar şeklinde tasarlanmıştır (Şekil 2A). Oksijenin...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu çalışmada, 3D hücre baskı teknolojisine dayanan çip üzerinde hipoksik bir kanserin üretim sürecini açıklıyoruz. Tasarlanan çipte hipoksik gradyanın oluşumu bilgisayar simülasyonları ile tahmin edildi. Heterojen hipoksik gradyanı indükleyen ortam, 3D baskılı gaz geçirgen bariyeri ve cam kapağı birleştiren basit bir strateji ile yeniden üretildi. Glioblastomanın psödomopalisade ve küçük bir kanser kök hücre popülasyonu da dahil olmak üzere hipoksiye bağlı patolojik özellikleri, çip...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların hiçbir açıklaması yok.
Teşekkürler
Bu araştırma, Eğitim Bakanlığı (No. 2020R1A6A1A03047902 ve NRF-2018H1A2A1062091) ve Kore hükümeti (MSIT) (No. NRF-2019R1C1C1009606 ve NRF-2019R1A3A3005437).
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Cells | |||
| Human umbilical vein endothelial cells | Promocell | C-12200 | |
| U-87 MG cells | ATCC | ATCC HTB-14 | |
| Disposable | |||
| 0.2 μm syringe filter | Sartorius | 16534-K | |
| 10 mL disposable syringe | Jung Rim | 10ml 21G32 | |
| 10 mL glass vial | Hubena | A0039 | |
| 10 mL Serological pipette tip | SPL lifescience | 91010 | |
| 15 mL conical tube | SPL lifescience | 50015 | |
| 18G plastic needle | Musashi engineering | PN-18G-B | |
| 20G plastic tapered dispense tip | Musashi engineering | TPND-20G-U | |
| 22x50 glass cover | MARIENFIELD | 0101142 | |
| 25 mL Serological pipette tip | SPL lifescience | 90125 | |
| 3 mL disposable syringes | HENKE-JET | 4020-X00V0 | |
| 40 µm cell strainer | Falcon | 352360 | |
| 5 mL Serological pipette tip | SPL lifescience | 91005 | |
| 50 mL conical tube | SPL lifescience | 50050 | |
| 50 mL Serological pipette tip | SPL lifescience | 90150 | |
| 50N precision nozzle | Musashi engineering | HN-0.5ND | |
| Aluminum foil | SINKWANG | ||
| Capillary tips | Gilson | CP1000 | |
| Cell-scrapper | SPL lifescience | 90030 | |
| Confocal dish | SPL lifescience | 200350 | |
| Parafilm | Bemis | PM996 | |
| Pre-coated histology slide | MATSUNAMI | MAS-11 | |
| Reservoir | SPL lifescience | 23050 | |
| T-75 cell culture flask | SPL lifescience | 70075 | |
| Equipment | |||
| 3DX printer | T&R Biofab | ||
| Autoclave | JEIOTECH | AC-12 | |
| Centrifuger | Cyrozen | 1580MGR | |
| Confocal laser microscopy | Olympus Life Science | FV 1000 | |
| Fluorescence microscope | FISHER SCEINTIFIC | O221S366 | |
| Forcep | Korea Ace Scientific | HC.203-30 | |
| Hand tally counter | KTRIO | ||
| Hemocytometer | MARIENFIELD | 0650030 | |
| Incubator | Panasonic | MCO-170AIC | |
| Laminar flow cabinet | DAECHUNG SCIENCE | CB-BMMS C-001 | |
| Metal syringe | IWASHITA engineering | SUS BARREL 10CC | |
| Operating Scissors | Hirose | HC.13-122 | |
| Oven | JEIOTECH | OF-12, H070023 | |
| Positive displacement pipette | GILSON | NJ05652 | |
| Refrigerator | SAMSUNG | CRFD-1141 | |
| Voltex Mixer | DAIHAN scientific | VM-10 | |
| Water bath | DAIHAN SCIENTIFIC | WB-11 | |
| Water purifier | WASSER LAB | DI-GR | |
| Materials | |||
| 0.25 % Trypsin-EDTA | Gibco | 25200-072 | |
| 10x PBS | Intron | IBS-BP007a | |
| 4% Paraformaldehyde | Biosesang | ||
| 70% Ethanol | Daejung | 4018-4410 | |
| Anti-CD31 antibody | Abcam | ab28364 | |
| Anti-HIF-1 alpha antibody | Abcam | ab16066 | |
| Anti-SHMT2/SHMT antibody | Abcam | ab88664 | |
| Anti-SOX2 antibody | Abcam | ab75485 | |
| Bovine Serum Albumin | Thermo scientific | J10857-22 | |
| Collagen from porcine skin | Dalim tissen | PC-001-1g | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Thermofisher | D1306 | |
| Endothelial Cell Growth Medium-2 | Promocell | C22011 | |
| Fetal bovine serum | Gibco | 12483-020 | |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Theromofisher | A-11001 | |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | Theromofisher | A-11012 | |
| High-glucose Dulbecco’s Modified Eagle Medium(DMEM) | Hyclone | SH30243-0 | |
| Hydrochloric acid | Sigma-Aldrich | 311413-100ML | |
| Live/dead assay kit | Invitrogen | L3224 | |
| Mouse IgG1, kappa monoclonal [15-6E10A7] - Isotype Control | Abcam | ab170190 | |
| Penicillin/streptomycin | Gibco | 15140-122 | |
| Phenol red solution | Sigma-Aldrich | P0290-100ML | |
| Poly(ethylene-vinyl acetate) | Poly science | 06108-500 | |
| Polydimethylsiloxane | Dowhitech | sylgard 184 | |
| Rabbit IgG, polyclonal - Isotype Control | Abcam | ab37415 | |
| Sodium hydroxide solution | Samchun | S0610 | |
| Triton X-100 | Biosesang | TRI020-500-50 | |
| Trypan Blue | Sigma-Aldrich | T8154 | |
| Software | |||
| COMSOL Multiphysics 3.5a | COMSOL AB | ||
| IMS beamer | in-house software | ||
| SolidWorks Package | Dassault Systems SolidWorks Corporation |
Referanslar
- Jing, X., et al. Role of hypoxia in cancer therapy by regulating the tumor microenvironment. Molecular Cancer. 18 (1), 157(2019).
- Al Tameemi, W., Dale, T. P., Al-Jumaily, R. M. K., Forsyth, N. R. Hypoxia-modified cancer cell metabolism. Frontiers in Cell and Developmental Biology. 7, 4(2019).
- Petrova, V., Annicchiarico-Petruzzelli, M., Melino, G., Amelio, I. The hypoxic tumour microenvironment. Oncogenesis. 7 (1), 1-13 (2018).
- Hockel, M., Vaupel, P. Tumor hypoxia: definitions and current clinical, biologic, and molecular aspects. Journal of the National Cancer Institute. 93 (4), 266-276 (2001).
- Kim, H., Lin, Q., Glazer, P. M., Yun, Z. The hypoxic tumor microenvironment in vivo selects the cancer stem cell fate of breast cancer cells. Breast Cancer Research. 20 (1), 16(2018).
- Jeong, G. S., Lee, J., Yoon, J., Chung, S., Lee, S. -H. Viscoelastic lithography for fabricating self-organizing soft micro-honeycomb structures with ultra-high aspect ratios. Nature Communications. 7 (1), 1-9 (2016).
- Razian, G., Yu, Y., Ungrin, M. Production of large numbers of size-controlled tumor spheroids using microwell plates. Journal of Visualized Experiments:JoVE. (81), e50665(2013).
- Nunes, A. S., Barros, A. S., Costa, E. C., Moreira, A. F., Correia, I. J. 3D tumor spheroids as in vitro models to mimic in vivo human solid tumors resistance to therapeutic drugs. Biotechnology and Bioengineering. 116 (1), 206-226 (2019).
- Wan, L., Neumann, C., LeDuc, P. Tumor-on-a-chip for integrating a 3D tumor microenvironment: chemical and mechanical factors. Lab on a Chip. 20 (5), 873-888 (2020).
- Nam, H., Funamoto, K., Jeon, J. S. Cancer cell migration and cancer drug screening in oxygen tension gradient chip. Biomicrofluidics. 14 (4), 044107(2020).
- Palacio-Castañeda, V., Kooijman, L., Venzac, B., Verdurmen, W. P., Le Gac, S. Metabolic switching of tumor cells under hypoxic conditions in a tumor-on-a-chip model. Micromachines. 11 (4), 382(2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: a fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Mi, S., Du, Z., Xu, Y., Sun, W. The crossing and integration between microfluidic technology and 3D printing for organ-on-chips. Journal of Materials Chemistry B. 6 (39), 6191-6206 (2018).
- Yi, H. -G., Lee, H., Cho, D. -W. 3D printing of organs-on-chips. Bioengineering. 4 (1), 10(2017).
- Yi, H. -G., et al. A bioprinted human-glioblastoma-on-a-chip for the identification of patient-specific responses to chemoradiotherapy. Nature Biomedical Engineering. 3 (7), 509-519 (2019).
- Kang, T. -Y., Hong, J. M., Jung, J. W., Yoo, J. J., Cho, D. -W. Design and assessment of a microfluidic network system for oxygen transport in engineered tissue. Langmuir. 29 (2), 701-709 (2013).
- Woo Jung, J., et al. Evaluation of the effective diffusivity of a freeform fabricated scaffold using computational simulation. Journal of Biomechanical Engineering. 135 (8), (2013).
- Brown, A. C., De Beer, D. Development of a stereolithography (STL) slicing and G-code generation algorithm for an entry level 3-D printer. 2013 Africon (IEEE). , 1-5 (2013).
- Shim, J. -H., Lee, J. -S., Kim, J. Y., Cho, D. -W. Bioprinting of a mechanically enhanced three-dimensional dual cell-laden construct for osteochondral tissue engineering using a multi-head tissue/organ building system. Journal of Micromechanics and Microengineering. 22 (8), 085014(2012).
- Gillispie, G., et al. Assessment methodologies for extrusion-based bioink printability. Biofabrication. 12 (2), 022003(2020).
- Kim, B. S., Das, S., Jang, J., Cho, D. -W. Decellularized extracellular matrix-based bioinks for engineering tissue-and organ-specific microenvironments. Chemical Reviews. 120 (19), 10608-10661 (2020).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır