Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
3D-клеточная печать гипоксического рака на чипе для рекапитуляции патологической прогрессии солидного рака
* Эти авторы внесли равный вклад
В этой статье
Резюме
Гипоксия является отличительной чертой микроокружения опухоли и играет решающую роль в прогрессировании рака. В этой статье описывается процесс изготовления гипоксического рака на чипе на основе технологии 3D-печати клеток для повторения патологии рака, связанной с гипоксией.
Аннотация
Рак микроокружения оказывает значительное влияние на прогрессирование заболевания. В частности, гипоксия является ключевым фактором выживания при раке, инвазии и хеморазистанции. Хотя для изучения патологии рака, связанной с гипоксией, было разработано несколько моделей in vitro, сложное взаимодействие микроокружения рака, наблюдаемое in vivo, еще не было воспроизведено из-за отсутствия точного пространственного контроля. Вместо этого были предложены подходы к 3D-биофабрикации для создания микрофизиологических систем для лучшей эмуляции экологии рака и точной оценки противоопухолевого лечения. Здесь мы предлагаем подход к 3D-клеточной печати для изготовления гипоксического рака на чипе. Вызывающие гипоксию компоненты в чипе были определены на основе компьютерного моделирования распределения кислорода. Концентрические кольца Рак-строма были напечатаны с использованием биолинь, содержащих клетки глиобластомы и эндотелиальные клетки, для рекапитуляции типа солидного рака. Полученный чип реализовал центральную гипоксию и усугубил злокачественность при раке с образованием репрезентативных патофизиологических маркеров. В целом, ожидается, что предлагаемый подход к созданию микрофизиологической системы с твердым раком и миметикой преодолеет разрыв между моделями in vivo и in vitro для исследований рака.
Введение
Микроокружение рака является критическим фактором, стимулирующим прогрессирование рака. Множественные компоненты, включая биохимические, биофизические и клеточные сигналы, определяют патологические особенности рака. Среди них гипоксия тесно связана с выживаемостью при раке, пролифрацией и инвазией1. Из-за неограниченного роста и деления раковых клеток питательные вещества и кислород непрерывно истощаются, и генерируется гипоксический градиент. В условиях низкого содержания кислорода клетки активируют молекулярный каскад, связанный с гипоксией индуцируемым транскрипционным фактором (HIF). Этот процесс индуцирует некротическое ядро, запускает метаболические изменения и инициирует гиперплазию кровеносных сосудов и метастазирование2,3. Впоследствии гипоксия в раковых клетках вызывает разрушение соседних нормальных тканей. Кроме того, гипоксия тесно связана с терапевтической устойчивостью солидных опухолей многофакторными способами. Гипоксия может сильно препятствовать лучевой терапии, так как радиочувствительность ограничена из-за активных форм кислорода1,4. Кроме того, снижается уровень рН раковых микросред, что уменьшает накопление препарата1. Поэтому воспроизведение патологических особенностей, связанных с гипоксией in vitro, является перспективной стратегией для научных и доклинических результатов.
Моделирование конкретной микросреды рака имеет важное значение для понимания развития рака и изучения соответствующих методов лечения. Хотя животные модели широко используются из-за их сильной физиологической значимости, существуют вопросы, связанные с видовых различиями и этическими проблемами5. Кроме того, хотя обычные 2D- и 3D-модели позволяют манипулировать раковыми клетками в режиме реального времени для углубленного анализа, их архитектурная и клеточная сложность не может быть полностью повторена. Например, модели раковых сфероидов широко используются, так как агрегация раковых клеток в сфероиде может естественным образом генерировать гипоксию в ядре. Кроме того, большое количество клеточных сфероидов однородного размера было получено с использованием многоязычных систем6, 7наосновепластика или силикона. Однако более низкая гибкость в отношении захвата точной гетерогенной структуры раковых тканей с помощью обычных платформ потребовала создания передовой технологии биофабрикации для создания высокобиомиметической платформы для улучшения исследований рака8.
3D микрофизиологические системы (MPS) являются полезными инструментами для рекапитуляции сложной геометрии и патологического прогрессирования раковых клеток9. Поскольку раковые клетки ощущают биохимический градиент факторов роста и хемокиных веществ и механическую гетерогенность, воспроизводимую в системе, важные особенности развития рака могут быть исследованы in vitro. Например, жизнеспособность рака, метастатическая злокачественность и лекарственная устойчивость в зависимости от изменяющихся концентраций кислорода были изучены с использованием MPSs10,11. Несмотря на последние достижения, создание гипоксических состояний моделей in vitro зависит от сложных процедур изготовления, включая соединение с физическими газовыми насосами. Поэтому необходимы простые и гибкие методы построения специфических для рака микросред.
Технология 3D-печати клеток привлекла значительное внимание из-за ее точного контроля пространственного расположения биоматериалов для рекапитуляции нативных биологических архитектур12. В частности, эта технология преодолевает существующие ограничения моделей 3D-гипоксии благодаря своей высокой управляемости и возможности построения пространственных особенностей микроокружения рака. 3D-печать также облегчает автоматизированное производство с помощью послойного процесса, тем самым обеспечивая быстрое, точное и воспроизводимое построение сложных геометрий для имитации фактических архитектур тканей. В дополнение к преимуществам существующих стратегий производства 3D MPS, патофизиологические особенности прогрессирования рака могут быть воспроизведены путем паттернов биохимических, клеточных и биофизических компонентов13,14.
Здесь мы представляем стратегию 3D-печати клеток для гипоксического рака на чипе для рекапитуляции гетерогенности твердого рака(рисунок 1)15. Параметры изготовления были определены с помощью вычислительного моделирования образования центральной гипоксии в системе. Концентрические кольца Рака-Стромы были напечатаны с использованием коллагеновых биоинков, содержащих клетки глиобластомы и эндотелиальные клетки, чтобы имитировать патофизиологию глиобластомы, типа солидного рака. Образование радиального градиента кислорода усугубляет злокачественность рака, что свидетельствует об усилении агрессивности. Кроме того, мы указываем будущие перспективы применения чипа к доклиническим моделям, специфичным для пациента. Ожидается, что предлагаемый подход к созданию твердой миметической микрофизиологической системы рака преодолеет разрыв между моделями рака in vivo и in vitro.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Компьютерное моделирование образования градиента кислорода
-
Генерация 3D-геометрической модели для гипоксической печати рака на чипе
- Запустите программное обеспечение 3D CAD.
- Набросок геометрической модели гипоксического рака на чипе. Нажмите на Sketch и выберите нужную плоскость, чтобы нарисовать геометрию. Обратитесь к чертежу(рисунок 2A)для детального масштабирования каждой детали.
- Установите толщину геометрии, нажав на Feature-Protrusion Boss/Base. Введите желаемую толщину (см. рисунок 2A)в пустое поле и выберите зеленый значок галочки, чтобы сформировать 3D-геометрию.
ПРИМЕЧАНИЕ: Размер рака на чипе определяется на основе желаемых объемов среды и гидрогеля. В настоящем эксперименте желаемые объемы среды и гидрогеля составляли приблизительно 1 500 мкл и 500 мкл соответственно, исходя из предыдущего практического опыта разрешения биопринтера на основе экструзии. - Сохраните файл геометрии в формате 3D CAD (.prt или .stl).
-
Определение клеточной плотности для индукции гипоксического ядра
- Запустите программу моделирования физической диффузии.
- Нажмите на LiveLink и выберите используемую программу САПР. Нажмите «Синхронизировать», чтобы импортировать геометрию гипоксического рака на чипе в программе моделирования. Поскольку внутреннее пространство камеры будет заполнено питательной средой в реальных экспериментальных условиях, кислород будет диффундировать через внутреннее пространство камеры и клеточную конструкцию, которая будет состоять из нагруженных клетками гидрогелей.
ПРИМЕЧАНИЕ: Обратитесь к предыдущему исследованию для получения подробной информации о физических параметрах15. - Определите импортированную 3D-геометрию как контрольный объем пространства, в котором кислород диффундирует, а клетки потребляют кислород(рисунок 2B).
- Запустите компьютерный анализ для газодиффузионного анализа в соответствии с руководством пользователя и ранее установленными методами16,17.
- Из результатов компьютерного анализа экспортируйте данные о расчетной концентрации кислорода по поперечному сечению A-A' в каждый момент времени, следуя руководству пользователя. Управляющее уравнение основано на первом законе Фика, выраженном в Eq. (1)(Рисунок 2C).
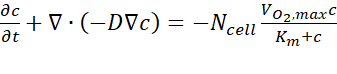
где c — концентрация, D — коэффициент диффузии кислорода, N-клетка — плотность клеток,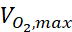 — максимальная скорость поступления кислорода, а Km — постоянная Михаэлиса-Ментена. Константы применялись так, как описано в предыдущей публикации15.
— максимальная скорость поступления кислорода, а Km — постоянная Михаэлиса-Ментена. Константы применялись так, как описано в предыдущей публикации15.
ПРИМЕЧАНИЕ: Каждая точка времени означает пошаговую точку для наблюдения за изменением диффузии кислорода с течением времени. - Оцените, достигает ли минимальный уровень кислорода порога гипоксии и повторите процесс компьютерного анализа с увеличением или снижением плотности клеток.
ПРИМЕЧАНИЕ: Определите, что градиент гипоксии образуется в конструкции, если уровень кислорода 80% в области гидрогеля составляет менее 0,02 мМ через 24 ч. - Подтвердите количество клеток, необходимых для генерации градиента кислорода, индуцируя гипоксию в центральной области, из первого закона Фика на шаге 1.2.5 и результатов моделирования из шага 1.2.6.
ПРИМЕЧАНИЕ: В этом протоколе номер ячейки составлял 2 × 106 ячеек / каждая конструкция.
2. Клеточная культура раковых клеток и стромальных клеток
-
Подготовка среды клеточной культуры во избежание физиологического стресса
- Для клеток U-87 MG (увековеченная клеточная линия глиобластомы человека) поместите 12 мл высокоуглекозаточной модифицированной среды Eagle от Dulbecco, содержащей 10% фетальной бычий сыворотки, 100 Ед / мл пенициллина и 100 мкг / мл стрептомицина в колбу для клеточной культуры T-75 в увлажненный инкубатор с температурой 37 ° C, 5% CO2 в течение 30 минут, чтобы свести к минимуму тепловое и щелочное воздействие среды на клетки.
ПРИМЕЧАНИЕ: Глиобластома была выбрана в качестве типа солидного рака, потому что она имеет агрессивные характеристики в гипоксической среде. Другие различные виды рака могут быть применены к этой модели. - Для эндотелиальных клеток пупочных вен человека (HUVECs) поместите 12 мл среды роста эндотелиальных клеток в колбу для культуры клеток Т-75 в 5%CO2 увлажненный инкубатор при 37 °C в течение 30 мин.
ПРИМЕЧАНИЕ: HUVEC были выбраны, потому что это одна из наиболее репрезентативных эндотелиальных клеточных линий. Различные типы стромальных клеток также могут быть применены к этой модели.
- Для клеток U-87 MG (увековеченная клеточная линия глиобластомы человека) поместите 12 мл высокоуглекозаточной модифицированной среды Eagle от Dulbecco, содержащей 10% фетальной бычий сыворотки, 100 Ед / мл пенициллина и 100 мкг / мл стрептомицина в колбу для клеточной культуры T-75 в увлажненный инкубатор с температурой 37 ° C, 5% CO2 в течение 30 минут, чтобы свести к минимуму тепловое и щелочное воздействие среды на клетки.
-
Быстрое оттаивание криоконсервных раковых клеток и стромальных клеток и их поддержание
- Переместите криовиалы, содержащие 5 x10 5 U-87 MG клеток и HUVEC, из контейнера с жидким азотом в ламинарную проточную тумба. Немедленно ослабьте и запрягьте колпачок, чтобы освободить внутреннее давление.
- Аккуратно поместите криоконсервированную клетку на водяную баню при 37 °C в течение 2 минут, не допуская крышку из воды. Промыть флаконы 70% этанолом под ламинарным потоком, чтобы предотвратить загрязнение.
- Переместите размороженные клетки в колбы, содержащие подготовленную питательную целлюлозу клеток, описанную на этапе 2.1, и поместите клеткосодержащие колбы в 5%CO2 увлажненный инкубатор при 37 °C для восстановления клеток.
- Обновляйте питательные среды каждые 2 дня и поддерживайте рост клеток.
- После 24 ч оттаивания замените питательную целлюлозу клеток, чтобы избежать цитотоксичности диметилсульфоксида (ДМСО), который использовался для замораживания клеток. Используйте HUVEC, который прошел менее 6 проходов.
3. Приготовление коллагенового прегелевого раствора
-
Солюбилизация коллагеновой губки соляной кислотой (HCl) 0,1 Н
- Подготовьте раствор 0,1 Н HCl и процедить его шприцевым фильтром 0,2 мкм.
- Для 3 мл 1% (мас./об.) нейтрализованного раствора коллагена предварительного геля готовят коллагеновые губки, нарезанные на 5 х 5 мм2 штуки и весом 30 мг.
- Переложите нарезанные кусочки коллагена в стерильный стеклянный флакон 10 мл.
ПРИМЕЧАНИЕ: Приготовьте в 1,5 раза больше объема необходимого гидрогеля коллагена, учитывая потерю гидрогеля из-за липкой характеристики раствора коллагена. - Добавьте 2,4 мл 0,1 N HCl в коллагенсодержащий стеклянный флакон и инкубирует его на коромысле при 15 об/мин и 4 °C в течение 3 дней.
ПРИМЕЧАНИЕ: Объем раствора 0,1 N HCl составлял четыре пятых от конечного объема требуемого гидрогеля коллагена. В этом случае было приготовлено 3 мл коллагена. - После пищеварения просейте непереваренные частицы коллагена с помощью клеточного ситечкового фильтра 40 мкм. Храните кислый раствор коллагена при 4 °C и используйте в течение 7 дней.
-
Коррекция pH для 1% нейтрализованного раствора коллагена
- Центрифугировать кислый раствор коллагена при 1224 х г в течение 5 мин при 4 °C.
- Добавьте 30 мкл фенольных красных растворов в качестве показателя рН к конечной концентрации 1% (v/v) и 300 мкл 10x фосфат-буферного солевого (PBS) буфера до конечной концентрации 10% (v/v) в растворе коллагена прегеля.
- Нейтрализуют рН до 7 с помощью 1 N гидроксида натрия (NaOH), проверяя изменение цвета.
ПРИМЕЧАНИЕ: Исходя из формулы, моли H+ = молярность H+ x объем H+ = моли OH-= молярность OH- x объем OH-, добавьте 240 мкл NaOH. - Добавьте дистиллированную воду для получения общего объема 3 мл.
- После корректировки pH храните 1% (мас./об.) нейтрализованный раствор коллагена при 4 °C и используйте в течение 3 дней.
ПРИМЕЧАНИЕ: Чтобы предварительно проверить гелеобразование нейтрализованного раствора коллагена предварительного геля, сделайте 50 мкл капель коллагена на небольшой посуде с использованием пипетки с положительным смещением и инкубировать их в инкубаторе 37 °C в течение 1 ч. Обратитесь к следующим трем методам для проверки перекрестной связи капель коллагена. - Проверьте, изменился ли цвет коллагена на непрозрачный белый с прозрачного цвета.
- Наклоните контейнер и проверьте, прилип ли коллаген к дну контейнера.
- Налейте 1x PBS на капли и проверьте, не нарушена ли конструкция коллагена в растворе.
4.3D печать газопроницаемого барьера
-
3D-печать жертвенной поли (этилен-винилацетатной) (PEVA) формы
- Сгенерируйте 3D-геометрию жертвенной формы PEVA, определенной на шаге 1, с помощью программного обеспечения 3D CAD(рисунок 3A).
ПРИМЕЧАНИЕ: 3D-геометрия и детальный масштаб модели, включая размеры, единицы измерения и типы линий, были показаны на рисунке 2A. - Конвертируйте файл 3D CAD в формат STL, нажав на файл | Сохранить тип файла как STL. Кроме того, нажмите на опцию | Форма вывода в виде ASCII для генерации G-кода.
- Нажмите на файл | Откройте STL-файл и выберите сохраненный STL-файл, чтобы импортировать сгенерированный STL-файл. Нажмите на Модель Slice STL-CAD обменника, чтобы автоматически сгенерировать G-код жертвенной формы PEVA(рисунок 3B,C).
ПРИМЕЧАНИЕ: Путь печати генерируется с соединением пересекающихся точек между фундаментальной фигурой STL-файла и плоскостью нарезки (т.е. слоем). По сути, фундаментальной фигурой фрагмента в STL-файле является треугольник, содержащий 3D-координаты. После получения пересекающихся точек между треугольником и слоем генерируется G-код для печати путем соединения каждой точки без перекрывающегося контура на слое18. Любой алгоритм генерации G-кода на борту программного обеспечения может быть использован для создания путей печати для изготовления чипа. - Подготовьте стерильный клей и гидрофильный гистологический слайд.
ПРИМЕЧАНИЕ: Гидрофильное слайд-стекло имеет решающее значение для постоянного связывания полидиметилсилоксана (PDMS) на стекле и адгезии коллагеновых конструкций, инкапсулирующих раковые клетки и стромальные клетки. - Печать жертвенной формы PEVA на слайде с помощью прецизионного сопла 50 G при пневматическом давлении 500 кПа при 110 °C.
ПРИМЕЧАНИЕ: Ширина линии зависит от скорости подачи, датчика сопла и температуры материала. Было использовано сопло 50 G и применена скорость подачи 400 для создания ширины линии 500 мкм для жертвенной стенки. Датчик сопла, пневматическое давление и скорость подачи определяются с практическими результатами19. Жертвенная стенка должна быть достаточно толстой, чтобы удерживать раствор PDMS, что является следующим этапом изготовления.
- Сгенерируйте 3D-геометрию жертвенной формы PEVA, определенной на шаге 1, с помощью программного обеспечения 3D CAD(рисунок 3A).
-
Литье полидиметилсилоксана (PDMS) барьера
- Однородно смешайте 6 мл эластомера на основе PDMS и отверждающего агента 0,6 мл в течение 5 мин в пластиковом резервуаре. Это может изготовить 6 гипоксических раковых чипов, учитывая потерю из-за липкой характеристики PDMS.
- Загрузите смешанный раствор PDMS в одноразовый шприц объемом 10 мл и подойдите к шприцевой головке с пластиковым коническим наконечником дозирования 20 г.
- Наполните жертвенную форму PEVA смешанным раствором PDMS в шприце. Смешанный PDMS наполнит жертвенную форму PEVA выпуклой поверхностью. Высота барьера PDMS будет выше, чем у пресс-формы PEVA.
- Отверждите барьер PDMS в печи при 40 °C в течение более 36 ч, чтобы избежать плавления PEVA. Не повышайте температуру до более чем 88 °C, что является температурой плавления PEVA.
- Отсоедините жертвенную форму PEVA парой прецизионных пинцетов и стерилизуйте газопроницаемый барьер при 120 °C в автоклаве.
5. Получение инкапсулированных в клетки коллагеновых биоин
-
Отслоение подготовленных раковых клеток и стромальных клеток
ПРИМЕЧАНИЕ: Учитывая жизнеспособность клеток, весь процесс печати должен быть завершен как можно скорее после отсоединения ячеек.- Промывайте раковые и стромальные клетки 10 мл 1x PBS с помощью серологической пипетки; лечить 2 мл 0,25% трипсин-этилендиаминтетрауксусной кислоты (ЭДТА) с помощью пипетки и инкубировать их в течение 3 мин при 37 °C.
- Нейтрализовать трипсинизированные клетки 3 мл клеточной культуральной среды; собирать суспензии клеток в конические трубки по 15 мл и центрифугу при 516 х г в течение 5 мин при 20 °С.
- Аспирировать супернатант медленно; повторно суспендируют клеточные гранулы в 5 мл клеточной культуры и подсчитывают количество клеток с помощью гемоцитометра.
- Переведите 5 x 106 клеток каждого типа клеток в новые конические трубки по 15 мл и центрифугируют их при 516 x g в течение 5 мин при 20 °C.
- Аспирировать супернатант и поместить его на влажный лед.
-
Смешивание каждого типа клеток с 1% нейтрализованным раствором прегеля коллагена
ПРИМЕЧАНИЕ: Чтобы избежать термического затвердевания 1% нейтрализованного раствора коллагена предварительного геля, этот процесс следует выполнять на влажном льду.- Повторно суспендируют каждый тип клеточных гранул, собранных на этапе 5.1.4, с 20 мкл клеточной культуры каждая.
- Добавьте 1 мл 1% нейтрализованного раствора коллагена прегеля в каждую из повторно суспензионных клеток и перемешайте их однородно, используя пипетку с положительным смещением. Конечная концентрация каждого типа клеток составит 5 х 106 клеток/мл.
- Переложите инкапсулированные коллагеновые биончасти в одноразовые шприцы объемом 3 мл с помощью положительной одноразовой пипетки и храните шприцы при 4 °C до 3D-печати клеток.
6.3D клеточная печать концентрических колец рак-строма
-
3D-клеточная печать коллагеновых биосинов, инкапсулирующих раковые клетки и стромальные клетки
- Сгенерируйте 3D-геометрию концентрических колец рак-строма, определенных на шаге 1.2, с помощью программного обеспечения 3D CAD.
ПРИМЕЧАНИЕ: Размеры концентрических колец стромы рака определяются с помощью смоделированных параметров. Окончательные размеры параметров размеров показаны на рисунке 3A. - Преобразуйте файл 3D CAD в формат файла STL и сгенерируйте G-код концентрических колец рак-строма с помощью обменника STL-CAD.
ПРИМЕЧАНИЕ: Обратитесь к примечанию на шаге 4.1.2 для алгоритма генерации G-кода. - Загрузите инкапсулированные в ячейки коллагеновые биоинки, содержащиеся в одноразовых шприцах по 3 мл, на головку 3D-принтера и установите температуру головки и пластины на 15 °C.
ПРИМЕЧАНИЕ: Если температура головки и пластины принтера достигает более 37 °C, биочернило становится сшитым и больше не печатается. - Загрузите сгенерированный путь печати в управляющая программа 3D-принтера.
- Нажав на кнопку «Пуск», распечатайте коллагеновые биочернила, инкапсулирующие раковые клетки и стромальные клетки на газопроницаемом барьере после загруженного G-кода пластиковой иглой 18 г при пневматическом давлении около 20 кПа при 15 °C.
- В конце каждой операции печати вручную поместите стерилизованную стеклянную крышку 22 мм x 50 мм поверх газопроницаемого барьера для создания гипоксического градиента.
ПРИМЕЧАНИЕ: Сравните две группы в зависимости от наличия стеклянной крышки (GR+) и отсутствия (GR-) этой группы для проверки генерации гипоксического градиента. - После генерации трех гипоксических раковых веществ на чипах перенесите чипы в инкубатор при 37 °C в течение 1 ч, чтобы сшивать коллагеновые биочернила.
- Сгенерируйте 3D-геометрию концентрических колец рак-строма, определенных на шаге 1.2, с помощью программного обеспечения 3D CAD.
-
Завершение процесса изготовления и обслуживания гипоксического рака на чипе
- После завершения всех процессов 3D-клеточной печати гипоксического рака на чипе аккуратно потрите покровные стекла поверх газопроницаемых барьеров с помощью скраппера для плотного склеивания(рисунок 4A,B).
ПРИМЕЧАНИЕ: Покровное стекло и газопроницаемый барьер собираются с помощью гидрофобного склеивания без химических клеев, просто соскребая склееную часть между защитным стеклом и барьером PDMS. - Введите 1,5 мл среды роста эндотелиальных клеток в каждый чип. Чтобы избежать отслоения раковой конструкции, вводят питательную среду клеток с одной стороны чипа. Наклоните чип, чтобы позволить среде клеточного культуры течь с помощью пипетки.
- Обновляйте питательные среды каждый день в течение недели. Используйте пипетку для аспирации клеточной культуры; не используйте напорный насос.
- После завершения всех процессов 3D-клеточной печати гипоксического рака на чипе аккуратно потрите покровные стекла поверх газопроницаемых барьеров с помощью скраппера для плотного склеивания(рисунок 4A,B).
7. Оценка жизнеспособности клеток после печати
-
Подготовка образцов и обработка кальцеином AM и раствором EthD-1
- Согрейте 1x PBS на водяной бане при 37 °C.
- Готовят пробирный раствор, добавляя 0,75 мкл кальциина ацетоксиметила (кальциин АМ) и 3 мкл гомодимера этидия (EthD-1) к 1,5 мл предварительно нагретого PBS.
- Осторожно аспирировать все носители из чипа с помощью пипетки.
- Промойте раковую конструкцию с помощью предварительного PBS. Заполните 1,5 мл PBS в чип с помощью пипетки и дайте ему постоять в течение 10 минут при комнатной температуре. Чтобы избежать деформации конструкции рака, введите 1x PBS с одной стороны чипов и наклоните чипы, чтобы позволить 1x PBS течь.
- Аспирировать PBS из чипа; обработать раствор для анализа 1,5 мл и инкубировать чип при 37 °C в течение 20 мин, используя фольгу для защиты от света. Используйте пипетку для аспирации 1x PBS; не используйте всасывающий насос.
-
Визуализация жизнеспособности клеток с помощью флуоресцентного микроскопа
- Просмотр и захват меченых клеток с помощью флуоресцентного микроскопа(рисунок 4C).
ПРИМЕЧАНИЕ: Calcein AM отмечает живые клетки с зеленой флуоресценцией (длина волны ~ 488 нм). EthD-1 представляет собой сигнал мертвых клеток с красной флуоресценцией (длина волны ~594 нм). - Подсчитайте количество живых и мертвых клеток с помощью программного обеспечения для визуализации, программы обработки изображений с открытым исходным кодом и рассчитайте жизнеспособность с цифрами.
- Просмотр и захват меченых клеток с помощью флуоресцентного микроскопа(рисунок 4C).
8. Иммунофлуоресценция для подтверждения образования центральной гипоксии и ее влияния на злокачественность рака
-
Фиксация, пермеабилизация и блокирование раковой конструкции
- Приготовьте 1x PBS, 4% параформальдегида (PFA), 0,1% (v/v) Triton X-100 и 2% (мас./об.) бычий сывороточный альбумин (BSA) при комнатной температуре.
- Тщательно аспирировать все носители из чипа с помощью пипетки и промыть чип три раза с помощью 1x PBS. Чтобы избежать деформации конструкции рака, введите 1x PBS с одной стороны чипов и наклоните чипы, чтобы позволить 1x PBS течь. Между каждым этапом промывки дайте чипу постоять с 1x PBS в течение 5 минут, чтобы удалить остаточные растворы.
ПРИМЕЧАНИЕ: 1x PBS был аспирирован с использованием пипетки, а не напорного насоса. - Добавьте 500 мкл 4% PFA к раковой конструкции на чипе с помощью пипетки; оставьте его на 15 минут и промыть три раза 1x PBS, чтобы исправить клетки в раковой конструкции.
- Лечите раковую конструкцию 500 мкл 0,1% Triton X-100 с помощью пипетки при комнатной температуре в течение 5 мин и трижды промывайте 1x PBS для солюбилизации и пермеабилизации клеточной мембраны.
- Лечите раковую конструкцию 500 мкл 2% BSA с помощью пипетки при комнатной температуре в течение 1 ч, чтобы блокировать реактивные эпитопы.
ПРИМЕЧАНИЕ: Накройте чип парафиновой пленкой для предотвращения испарения. - Через 1 ч промыть чип три раза с 1x PBS.
-
Лечение первичными антителами, вторичными антителами и DAPI и визуализация структуры с использованием конфокального микроскопа.
- Готовят контрольные антитела изотипа и коктейль первичных антител путем разведения антител в 1x PBS к каждой желаемой рабочей концентрации.
ПРИМЕЧАНИЕ: Конкретные детали антител перечислены в Таблице материалов. Следует использовать те же рабочие концентрации контрольных антител изотипа, что и первичных антител. - Осторожно аспирировать все 1x PBS из чипа с помощью пипетки и обработать чип 200 мкл раствором первичного антитела при 4 °C в течение ночи. Накройте стружку парафиновой пленкой, чтобы предотвратить испарение.
- Аспирировать раствор первичного антитела и промыть чип три раза 1x PBS.
- Разбавляют вторичные антитела и DAPI в 1x PBS до нужной рабочей концентрации.
ПРИМЕЧАНИЕ: В этом случае используется вторичное флуоресцентно-конъюгированное вторичное антитело Green в соотношении 1:200. DAPI использовался в соотношении 1:1000. - Осторожно аспирировать все 1x PBS из чипа с помощью пипетки и обработать чип 200 мкл вторичным раствором антитела-DAPI при 4 °C в течение 3 ч. Накройте чип парафиновой пленкой, чтобы предотвратить испарение, а затем оберните его алюминиевой фольгой, чтобы предотвратить фотоотбеливание.
- Аспирировать раствор вторичного антитела-DAPI и промыть чип три раза 1x PBS.
- После завершения этапа окрашивания перенесите раковую конструкцию в конфокальную посуду, аккуратно захватив щипцами.
- Визуализируйте и захватывайте меченые клетки с помощью конфокального микроскопа(рисунок 5).
ПРИМЕЧАНИЕ: Длина волны конфокального микроскопа была скорректирована в зависимости от типа флуоресцентных маркеров. Конкретные детали антител перечислены в Таблице материалов. Чтобы эффективно определить положение клетки, было бы лучше сначала наблюдать окрашенные ЯДРА КОНСТРУКЦИИ DAPI. Длины волн обнаружения возбуждения/излучения флуоресцентных сигналов составляли 358/461 нм (DAPI, синий), 494/517 нм (зеленый) и 590/617 нм (красный). Увеличение было 4x, 10x и 20x, скорректированное от самого низкого к самому высокому.
- Готовят контрольные антитела изотипа и коктейль первичных антител путем разведения антител в 1x PBS к каждой желаемой рабочей концентрации.
9. Статистический анализ
-
Подсчет ячеек с помощью программы обработки изображений
- Запустите программу обработки изображений, чтобы подсчитать количество живых и мертвых клеток.
- Откройте файлы флуоресцентных изображений. Нажмите на файл | Откройте и импортируйте изображения TIFF.
- Преобразуйте изображения в 16-битные изображения в градациях серого. Нажмите на | изображений Тип | 16-битные оттенки серого.
- Отрегулируйте пороговое значение, нажав на image | Отрегулируйте | Пороговое значение, а затем выберите черный цвет ячеек.
- Разрежьте объединенные ячейки, нажав на | Двоичные | Водораздел для точного подсчета клеток.
- Подсчитайте количество ячеек, нажав на Анализ, а затем на Анализ частиц три раза; рассчитать среднее значение и представить данные как среднее ± стандартной погрешности.
ПРИМЕЧАНИЕ: Иммунофлуоресцентные маркеры были проанализированы путем сравнения интенсивности флуоресценции.
Access restricted. Please log in or start a trial to view this content.
Результаты
Гипоксический рак на чипе был разработан с использованием автоматизированной технологии 3D-печати клеток для повторения гипоксии и патологии, связанной с раком(рисунок 1). Транспортировка и потребление кислорода моделировались с использованием 3D-геом...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В этом исследовании мы описываем процесс изготовления гипоксического рака на чипе на основе технологии 3D-печати клеток. Формирование гипоксического градиента в проектируемом чипе было предсказато с помощью компьютерного моделирования. Среда, которая может индуцировать гетерогенный...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы не раскрывают информацию.
Благодарности
Это исследование было поддержано Национальным исследовательским фондом Кореи (NRF), финансируемым Министерством образования (No 2020R1A6A1A03047902 и NRF-2018H1A2A1062091) и правительством Кореи (MSIT) (No. NRF-2019R1C1C1009606 и NRF-2019R1A3A3005437).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Cells | |||
| Human umbilical vein endothelial cells | Promocell | C-12200 | |
| U-87 MG cells | ATCC | ATCC HTB-14 | |
| Disposable | |||
| 0.2 μm syringe filter | Sartorius | 16534-K | |
| 10 mL disposable syringe | Jung Rim | 10ml 21G32 | |
| 10 mL glass vial | Hubena | A0039 | |
| 10 mL Serological pipette tip | SPL lifescience | 91010 | |
| 15 mL conical tube | SPL lifescience | 50015 | |
| 18G plastic needle | Musashi engineering | PN-18G-B | |
| 20G plastic tapered dispense tip | Musashi engineering | TPND-20G-U | |
| 22x50 glass cover | MARIENFIELD | 0101142 | |
| 25 mL Serological pipette tip | SPL lifescience | 90125 | |
| 3 mL disposable syringes | HENKE-JET | 4020-X00V0 | |
| 40 µm cell strainer | Falcon | 352360 | |
| 5 mL Serological pipette tip | SPL lifescience | 91005 | |
| 50 mL conical tube | SPL lifescience | 50050 | |
| 50 mL Serological pipette tip | SPL lifescience | 90150 | |
| 50N precision nozzle | Musashi engineering | HN-0.5ND | |
| Aluminum foil | SINKWANG | ||
| Capillary tips | Gilson | CP1000 | |
| Cell-scrapper | SPL lifescience | 90030 | |
| Confocal dish | SPL lifescience | 200350 | |
| Parafilm | Bemis | PM996 | |
| Pre-coated histology slide | MATSUNAMI | MAS-11 | |
| Reservoir | SPL lifescience | 23050 | |
| T-75 cell culture flask | SPL lifescience | 70075 | |
| Equipment | |||
| 3DX printer | T&R Biofab | ||
| Autoclave | JEIOTECH | AC-12 | |
| Centrifuger | Cyrozen | 1580MGR | |
| Confocal laser microscopy | Olympus Life Science | FV 1000 | |
| Fluorescence microscope | FISHER SCEINTIFIC | O221S366 | |
| Forcep | Korea Ace Scientific | HC.203-30 | |
| Hand tally counter | KTRIO | ||
| Hemocytometer | MARIENFIELD | 0650030 | |
| Incubator | Panasonic | MCO-170AIC | |
| Laminar flow cabinet | DAECHUNG SCIENCE | CB-BMMS C-001 | |
| Metal syringe | IWASHITA engineering | SUS BARREL 10CC | |
| Operating Scissors | Hirose | HC.13-122 | |
| Oven | JEIOTECH | OF-12, H070023 | |
| Positive displacement pipette | GILSON | NJ05652 | |
| Refrigerator | SAMSUNG | CRFD-1141 | |
| Voltex Mixer | DAIHAN scientific | VM-10 | |
| Water bath | DAIHAN SCIENTIFIC | WB-11 | |
| Water purifier | WASSER LAB | DI-GR | |
| Materials | |||
| 0.25 % Trypsin-EDTA | Gibco | 25200-072 | |
| 10x PBS | Intron | IBS-BP007a | |
| 4% Paraformaldehyde | Biosesang | ||
| 70% Ethanol | Daejung | 4018-4410 | |
| Anti-CD31 antibody | Abcam | ab28364 | |
| Anti-HIF-1 alpha antibody | Abcam | ab16066 | |
| Anti-SHMT2/SHMT antibody | Abcam | ab88664 | |
| Anti-SOX2 antibody | Abcam | ab75485 | |
| Bovine Serum Albumin | Thermo scientific | J10857-22 | |
| Collagen from porcine skin | Dalim tissen | PC-001-1g | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Thermofisher | D1306 | |
| Endothelial Cell Growth Medium-2 | Promocell | C22011 | |
| Fetal bovine serum | Gibco | 12483-020 | |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Theromofisher | A-11001 | |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | Theromofisher | A-11012 | |
| High-glucose Dulbecco’s Modified Eagle Medium(DMEM) | Hyclone | SH30243-0 | |
| Hydrochloric acid | Sigma-Aldrich | 311413-100ML | |
| Live/dead assay kit | Invitrogen | L3224 | |
| Mouse IgG1, kappa monoclonal [15-6E10A7] - Isotype Control | Abcam | ab170190 | |
| Penicillin/streptomycin | Gibco | 15140-122 | |
| Phenol red solution | Sigma-Aldrich | P0290-100ML | |
| Poly(ethylene-vinyl acetate) | Poly science | 06108-500 | |
| Polydimethylsiloxane | Dowhitech | sylgard 184 | |
| Rabbit IgG, polyclonal - Isotype Control | Abcam | ab37415 | |
| Sodium hydroxide solution | Samchun | S0610 | |
| Triton X-100 | Biosesang | TRI020-500-50 | |
| Trypan Blue | Sigma-Aldrich | T8154 | |
| Software | |||
| COMSOL Multiphysics 3.5a | COMSOL AB | ||
| IMS beamer | in-house software | ||
| SolidWorks Package | Dassault Systems SolidWorks Corporation |
Ссылки
- Jing, X., et al. Role of hypoxia in cancer therapy by regulating the tumor microenvironment. Molecular Cancer. 18 (1), 157(2019).
- Al Tameemi, W., Dale, T. P., Al-Jumaily, R. M. K., Forsyth, N. R. Hypoxia-modified cancer cell metabolism. Frontiers in Cell and Developmental Biology. 7, 4(2019).
- Petrova, V., Annicchiarico-Petruzzelli, M., Melino, G., Amelio, I. The hypoxic tumour microenvironment. Oncogenesis. 7 (1), 1-13 (2018).
- Hockel, M., Vaupel, P. Tumor hypoxia: definitions and current clinical, biologic, and molecular aspects. Journal of the National Cancer Institute. 93 (4), 266-276 (2001).
- Kim, H., Lin, Q., Glazer, P. M., Yun, Z. The hypoxic tumor microenvironment in vivo selects the cancer stem cell fate of breast cancer cells. Breast Cancer Research. 20 (1), 16(2018).
- Jeong, G. S., Lee, J., Yoon, J., Chung, S., Lee, S. -H. Viscoelastic lithography for fabricating self-organizing soft micro-honeycomb structures with ultra-high aspect ratios. Nature Communications. 7 (1), 1-9 (2016).
- Razian, G., Yu, Y., Ungrin, M. Production of large numbers of size-controlled tumor spheroids using microwell plates. Journal of Visualized Experiments:JoVE. (81), e50665(2013).
- Nunes, A. S., Barros, A. S., Costa, E. C., Moreira, A. F., Correia, I. J. 3D tumor spheroids as in vitro models to mimic in vivo human solid tumors resistance to therapeutic drugs. Biotechnology and Bioengineering. 116 (1), 206-226 (2019).
- Wan, L., Neumann, C., LeDuc, P. Tumor-on-a-chip for integrating a 3D tumor microenvironment: chemical and mechanical factors. Lab on a Chip. 20 (5), 873-888 (2020).
- Nam, H., Funamoto, K., Jeon, J. S. Cancer cell migration and cancer drug screening in oxygen tension gradient chip. Biomicrofluidics. 14 (4), 044107(2020).
- Palacio-Castañeda, V., Kooijman, L., Venzac, B., Verdurmen, W. P., Le Gac, S. Metabolic switching of tumor cells under hypoxic conditions in a tumor-on-a-chip model. Micromachines. 11 (4), 382(2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: a fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Mi, S., Du, Z., Xu, Y., Sun, W. The crossing and integration between microfluidic technology and 3D printing for organ-on-chips. Journal of Materials Chemistry B. 6 (39), 6191-6206 (2018).
- Yi, H. -G., Lee, H., Cho, D. -W. 3D printing of organs-on-chips. Bioengineering. 4 (1), 10(2017).
- Yi, H. -G., et al. A bioprinted human-glioblastoma-on-a-chip for the identification of patient-specific responses to chemoradiotherapy. Nature Biomedical Engineering. 3 (7), 509-519 (2019).
- Kang, T. -Y., Hong, J. M., Jung, J. W., Yoo, J. J., Cho, D. -W. Design and assessment of a microfluidic network system for oxygen transport in engineered tissue. Langmuir. 29 (2), 701-709 (2013).
- Woo Jung, J., et al. Evaluation of the effective diffusivity of a freeform fabricated scaffold using computational simulation. Journal of Biomechanical Engineering. 135 (8), (2013).
- Brown, A. C., De Beer, D. Development of a stereolithography (STL) slicing and G-code generation algorithm for an entry level 3-D printer. 2013 Africon (IEEE). , 1-5 (2013).
- Shim, J. -H., Lee, J. -S., Kim, J. Y., Cho, D. -W. Bioprinting of a mechanically enhanced three-dimensional dual cell-laden construct for osteochondral tissue engineering using a multi-head tissue/organ building system. Journal of Micromechanics and Microengineering. 22 (8), 085014(2012).
- Gillispie, G., et al. Assessment methodologies for extrusion-based bioink printability. Biofabrication. 12 (2), 022003(2020).
- Kim, B. S., Das, S., Jang, J., Cho, D. -W. Decellularized extracellular matrix-based bioinks for engineering tissue-and organ-specific microenvironments. Chemical Reviews. 120 (19), 10608-10661 (2020).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены