Method Article
إعداد عينة للتنميط الأيضي باستخدام التصوير الطيفي الشامل MALDI
* These authors contributed equally
In This Article
Summary
والهدف من هذا البروتوكول هو تقديم إرشادات مفصلة بشأن إعداد العينات عند التخطيط للتجارب باستخدام MALDI MSI لتحقيق أقصى قدر من الكشف الأيضي والجزيئي في العينات البيولوجية.
Abstract
وقد برز علم الأيض، وهو الدراسة لتحديد وتحديد الجزيئات الصغيرة والأيض الموجودة في عينة تجريبية، كأداة هامة للتحقيق في الأنشطة البيولوجية أثناء التنمية والأمراض. وتستخدم على نطاق واسع نهج Metabolomics في دراسة السرطان, التغذية / النظام الغذائي, مرض السكري, وغيرها من الظروف الفسيولوجية والمرضية التي تنطوي على عمليات التمثيل الغذائي. أداة مفيدة تساعد في التنميط الأيضي دعا في هذه الورقة هو مجفف الليزر بمساعدة مصفوفة / التأين التصوير الطيفي الشامل (MALDI MSI). قدرتها على الكشف عن الأيض في الموقع دون وضع العلامات, تعديلات هيكلية, أو غيرها من الكواشف المتخصصة, مثل تلك المستخدمة في استيلاد المناعة, يجعل من مرض التصلب العصبي المتعدد MALDI أداة فريدة من نوعها في تطوير المنهجيات ذات الصلة في مجال الأيض. وتعد عملية إعداد العينة المناسبة أمرا حاسما لتحقيق النتائج المثلى، وستكون محور تركيز هذه الورقة.
Introduction
الأيض، وسيطة أو المنتجات النهائية من التمثيل الغذائي، بما في ذلك النيوكليوتيدات والأحماض الأمينية أو العضوية، والدهون، هي المكونات الرئيسية للوظائف والعمليات البيولوجية. Metabolomics, دراسة الأيض, يسمح لاستكشاف التفاعلات الكيميائية الحيوية وفهم أدوارها في سياق البحوث الأساسية, ترجمة, والسريرية. وترتبط بقوة الأيض مع الأنماط الظاهرية للكائنات الحية وتوفير المعلومات عن الأنشطة الكيميائية الحيوية التي تحدث أثناء التمثيل الغذائي الخلوي1. لذلك ، بالإضافة إلى علم الجينوم والبروتيوميات ، برز علم الأيض كأداة مهمة في فهم الظروف الفسيولوجية والمرضية على حد سواء. على سبيل المثال، يستخدم الأيض في توضيح الآليات الكامنة وراء الأدوية الموجودة، فضلا عن التسامح معها. في تطوير الأدوية، والتمثيل الغذائي xenobiotic مفيد في تقييم نشاط أو سمية الأيض عبر الأنواع، والذي يترجم في وقت لاحق إلى دعم الطب الشخصي2. على الرغم من التطبيق الواسع من الأيض, التصوير من الأيض يمكن أن يكون تحديا بسبب تفاعلات الأيض الكيميائية, التغايرية الهيكلية, ومجموعة واسعة تركيز3. ومع ذلك، فإن تركيزات الأيض labile بما في ذلك مركبات الطاقة العالية، والجلوكوز، واللاكتات، والتحلل، ومسار تحويلة البنتوس، وTCA دورة وسيطة، فوسفوليبيدات، الناقلات العصبية، والمركبات الإشارات، يمكن أن تتغير في غضون ثوان والتقدم على مدى دقائق عندما تكون إنزيمات الأنسجة نشطة خلال إجراءات حصاد الأنسجة، مثل نقص التروية بعد الوفاة في الدماغ حصاد4،5،6 . لضمان الحصول على بيانات metabolomics دقيقة, إعداد عينة مناسبة ودقيقة أمر بالغ الأهمية7,8. وتشمل المنصات الحالية الثابتة لقياس الأيض NMR، ومقايسات الإنزيم، وقياس الطيف الكتلي (بما في ذلك الكروماتوغرافيا السائلة والغازية)، وآخرها يناقش أدناه.
MALDI-MSI هي تقنية حديثة تسمح بتحليل العينات المعقدة من خلال الكشف عن الأنواع الجزيئية الفردية. يمنح MALDI MSI فائدة القدرة على قياس المركبات الجزيئية المختلفة بسرعة وبصورة مستنسخة في العينات البيولوجية. يسمح التصوير الطيفي الكتلي كذلك بإنتاج الصور التي تمثل بيولوجيا الأنسجة استنادا إلى الأيض المركب ، ويفعل ذلك مع الحفاظ على التوزيع المكاني للمثيلات في العينة9. قدرة MALDI على الكشف عن التحليلات في عينة دون استخدام وضع العلامات على الأجسام المضادة ، والتعديلات الهيكلية ، أو غيرها من الكواشف المتخصصة ، مثل تلك المستخدمة في التضمين المناعي ، إلى جانب قدرتها على رصد مئات الجزيئات في تجربة واحدة لا تشكل سوى عدد قليل من المزايا التي يمنحها التصوير MS عندما يتعلق الأمر بالتنميط الأيضي10، 11. بالإضافة إلى مصفوفة شائعة الاستخدام مثل حمض ثنائي هيدروكسي بينزويك (DHB) و 9-aminoacridine (9-AA)، اكتشفت مؤخرا مصفوفة رواية N -(1-Naphthyl) الإيثيلينديامين ديهيدروكلورايد (NEDC)، والتي هي مناسبة تماما لتحليل مختلف الأيضات منخفضة الوزن الجزيئي، وقد تحسنت كذلك تطبيق MSI MALDI في التنميط الأيضي12.
وعلى الرغم من التطبيق الواسع النطاق للملف، فإن ارتفاع تكلفة الصك وتعقيد الإجراء التجريبي يحول دون تنفيذه على نطاق أوسع في مختبرات البحوث الفردية. ولذلك، فإن معظم دراسات مشروع ماليدي MSI مدعومة من خلال مرافق أساسية مشتركة. إعداد العينة، بما في ذلك إعداد الشرائح وطلاء المصفوفة، هو الخطوة الأكثر أهمية في MALDI MSI. ومع ذلك، عادة ما يتم إعداد الشريحة في مختبر الباحث الفردي، مما يخلق اختلافات محتملة في اكتساب MSI MALDI في وقت لاحق. هنا نهدف إلى توفير بروتوكول مفصل لإعداد عينة من العينات البيولوجية قبل الشروع في قياسات MSI MALDI، واستخدام التنميط الأيضي لدماغ الماوس التنموي كمثال.
Protocol
يتبع البروتوكول المبادئ التوجيهية لمركز أبحاث العلوم المتقدمة التابع لجامعة مدينة نيويورك (CUNY) التابع للجنة الرعاية والاستخدام المؤسسية للحيوانات (IACUC).
1. حصاد الأنسجة
- إعداد قارب الألومنيوم. إعداد مستطيل الألومنيوم 10cm × 20 سم، أضعاف في الوسط لجعل 10 سم مربع طبقة مزدوجة. تسمية المعلومات عينة على جانب واحد، وأضعاف الجانب الآخر لتشكيل قارب مع السطح السفلي حوالي 4 سم × 4 سم.
- Precool القارب على النيتروجين السائل (LN2)في مربع الستايروفوم.
ملاحظة: إذا كان القارب صغيرا جدا، فقد تسقط العينة من القارب وتصبح مجمدة عن طريق الاتصال مباشرة ب LN2،مما قد يؤدي إلى تجزئة أثناء عملية حفظ التبريد. - القتل الرحيم الحيوان عن طريق خلع عنق الرحم بعد المبادئ التوجيهية المؤسسية IACUC، تشريح على الفور من الأنسجة ذات الاهتمام.
- الحفاظ على الفاصل الزمني بين التخدير الحيواني وتجميد المفاجئة قصيرة قدر الإمكان، للحد من تغيير الأيض أثناء حصاد الأنسجة، وخاصة المستقلبات الشفرين في الدماغ بسبب نقص التروية بعد الوفاة.
ملاحظة: سوف Perfusion الحيوان مع الفوسفات العازلة المالحة (PBS) زيادة مدة نقص التروية، وتغيير مزيد من تركيزات الأيض labile والمبالغة في النتائج artifactual. لذلك، لا ينصح التغلغل أو غسل الأنسجة مع برنامج تلفزيوني، إلا إذا تلوث الدم أو سائل الجسم هو أكثر قلقا من تدهور الأيض أو غسل لمشروع فردي.
- الحفاظ على الفاصل الزمني بين التخدير الحيواني وتجميد المفاجئة قصيرة قدر الإمكان، للحد من تغيير الأيض أثناء حصاد الأنسجة، وخاصة المستقلبات الشفرين في الدماغ بسبب نقص التروية بعد الوفاة.
- ضع الأنسجة على الفور في قارب الألومنيوم العائم على النيتروجين السائل ، أغلق غطاء صندوق الستايروفوم ، وتجمد لمدة 2-10 دقائق اعتمادا على حجم الأنسجة: 2 دقيقة و 5 دقائق و 7 دقائق ليوم ما بعد الولادة 1 (P1) و P21 و P60 دماغ الماوس على التوالي و 10 دقائق لدماغ الفئران P60.
ملاحظة: لا تجمد الأنسجة لفترة طويلة (على سبيل المثال، 5 دقائق لدماغ فأر P1) لأن الإفراط في التجميد قد يؤدي إلى تفتيت الأنسجة أثناء عملية استئصال التبريد. - إزالة القارب عن طريق ملقط، أضعاف احباط لالتفاف الأنسجة، والنقل على الجليد الجاف وتخزينها في -80 درجة مئوية لاستخدامها في وقت لاحق. إذا تبعها تقسيم فوري، احمل العينات على الجليد الجاف إلى cryostat.
ملاحظة: للحفاظ على الأيض بشكل أفضل، يفضل تخزين العينة في الأنسجة السليمة وقسمها مباشرة قبل الشروع في تصوير MALDI. يمكن تخزين الأنسجة في -80 درجة مئوية لمدة تصل إلى 24 شهرا.
2. Cryosection النسيج
ملاحظة: ارتداء قفازات في جميع الأوقات عند التعامل مع الشرائح تينوإكسيد إنديوم (ITO). تجنب التنفس المباشر على الشريحة أو ارتداء أقنعة (اختياري) لمنع تلوث اللعاب البشري على قسم الأنسجة.
- قبل تقسيم الأنسجة، اجمع العدد المطلوب من الشرائح الزجاجية المغلفة المتوافقة مع MALDI ITO.
- اختبار الموصلية من الشريحة باستخدام مجموعة فولتميتر للمقاومة. تسمية الجانب حيث يتم قراءة قياس المقاومة: هذا سيكون الجانب الذي تلتزم أقسام الأنسجة. ضع الشريحة دائما على منشفة ورقية نظيفة لتجنب التلوث.
- قم بتهدئة الشرائح مسبقا في نظام جمع التبريد الذي تم ضبطه على -20 درجة مئوية.
- إذا تمت إزالة عينات الأنسجة من -80 درجة مئوية، دع الأنسجة تتوازن في غرفة cryostat لمدة 45-60 دقيقة تقريبا اعتمادا على حجم الأنسجة. إذا كانت العينات تزيل من الجليد الجاف، قم بتوازنها لمدة 30 دقيقة تقريبا.
- تنظيف تماما cryostat مع الإيثانول 70٪. قبل تبريد جميع الأدوات اللازمة بما في ذلك فرشاة الفنان رقيقة الرؤوس والملقط في غرفة cryostat.
- ضبط درجة حرارة غرفة cryostat ورأس العينة وفقا لنوع الأنسجة: -14 درجة مئوية للكبد، -20 درجة مئوية للعضلات و-25 درجة مئوية للبشرة9.
- جبل الأنسجة إلى تشاك باستخدام الأنسجة المبردة تضمين مركب أكتوبر، وتجنب أكتوبر من المنطقة ذات الاهتمام.
- ضع شفرة نظيفة في المسرح وقفل. ضبط موقف المرحلة وزاوية العينة لتحقيق زاوية القطع المطلوبة.
ملاحظة: إذا كان سيتم قطع أنواع/أنماط جينية مختلفة من الأنسجة، فتأكد من إعادة وضع العينة بحيث يتم استخدام جزء نظيف من النصل، أو تغيير النصل الجديد قبل قطع العينة التالية لمنع التلوث المتبادل. - استمر في القطع حتى يتم العثور على منطقة الاهتمام (على سبيل المثال، كالوسوم الجسم في الدماغ). تأكد من الحفاظ على نظافة المسرح عن طريق تنظيف القطع الإضافية بفرشاة فنان تم تهاونها في نظام cryostat.
- بمجرد الكشف عن المنطقة المطلوبة ، اقطع أقساما أصغر من سمك 10-12 ميكرومتر. إذا كان القسم يميل إلى تقشر أو تنهار بسهولة، ورفع درجة حرارة cryostat، والبقاء في نطاق -22 درجة مئوية إلى -11 درجة مئوية. لقد وجدنا أن درجة الحرارة المثلى لقطع أنسجة الدماغ هي -15 درجة مئوية إلى - 18 درجة مئوية.
- بمجرد قطع قسم جيد ، التزم بشريحة ITO (تعمل في غرفة cryostat).
- نقل قسم واحد من الأنسجة على الشرائح ITO باستخدام غيض من فرشاة الفنان.
- قم بتدفئة القسم بإصبعك بوضع إصبع تحت الشريحة لتسخين القسم لضمان التركيب الآمن. قسم الأنسجة سوف تتحول أولا إلى شفافة في 5-10 ق ومن ثم تتحول مبهمة في حوالي 30-60 ق.
- وضع الشريحة جانبا بعناية في cryostat.
- كرر الخطوات لعينات الأنسجة الأخرى، مع التأكد من أن كل قسم من الأنسجة يوضع بالتساوي على الشريحة ويتم محاذاته قدر الإمكان.
- وبما أن هدف MALDI يمكن أن يحمل ما يصل إلى شريحتين، ضع المقاطع من عينات متعددة من نفس المجموعة على شريحة واحدة أو على شريحتين، لضمان إمكانية تحليلها في نفس الوقت.
- عند الانتهاء، ضع شرائح ITO في صندوق فراغ ونقلها إلى مجفف مع المجفف. فراغ الجافة الشريحة لمدة 45-60 دقيقة.
ملاحظة: إذا كان فراغ desiccator غير متوفر في المختبر، والحفاظ على الشرائح تحت -20 درجة مئوية في كل وقت لتجنب تدهور الأيض. - تخزين الشرائح والشحن: ما لم يتم إعداد العينة من قبل المرافق الأساسية للتصوير MALDI للشروع مباشرة في التصوير MALDI، وتخزين الشرائح في -80 درجة مئوية أو السفينة إلى المرافق الأساسية أو مختبرات البحوث MALDI أخرى على الجليد الجاف.
- للحفاظ على أفضل العينات، ضع الشرائح في ناقل الشرائح، وملئها بالنيتروجين (اختياري)، وختم مع بارا فيلم، ووضعها في كيس الرمز البريدي، والتي يتم وضعها بعد ذلك في كيس آخر الرمز البريدي التي تحتوي على المجففة. تسمية حقيبة الرمز البريدي الخارجي.
- انتقل إلى التخزين عند -80 درجة مئوية (حتى 6 أشهر) أو الشحن مع الجليد الجاف الكافي.
3. إعداد المصفوفة
- إعداد المصفوفة.
ملاحظة: يجب أن تكون كافة الكواشف درجة HPLC.- إعداد NEDC بتركيز 10 ملغم/مل. إعداد 10 مل من مصفوفة المذاب في المذيبات من الميثانول 70٪ (100 ملغ من NEDC، 7 مل من الميثانول، 3 مل من H2O).
- بالإضافة إلى إعداد إضافية 10 مل من 70٪ الميثانول: محلول المياه لطرد نظام البخاخ قبل ملء المصفوفة.
- بمجرد أن يتم الجفاف الشرائح في الخطوة 2.17، ضع علامات "X" على مساحة فارغة من الشريحة الزجاجية خارج أقسام الأنسجة باستخدام علامة فضية نقطة جريئة، ومن ثم وضع علامة "x" الثانية مع علامة سوداء نقطة غرامة على رأس الفضة "X". الأسود "X" مع تباين حاد من الخلفية الفضية (الفضة الجريئة "X") سوف تكون في وقت لاحق بمثابة علامة ائتمانية للحصول على أطياف الكتلة في وقت لاحق في صك MALDI.
- تحميل الشريحة في الهدف المعدني الشريحة MALDI. استخدام الغطاء البلاستيكي ورسم / مخطط حيث العينات على الغطاء البلاستيكي. جانبا.
- مسح صورة الشريحة مع الهدف MALDI باستخدام الماسح الضوئي مسطح. المسامير على سطح الهدف ستكون بمثابة فاصل لمنع تلف أو تلوث قسم الأنسجة من قبل الماسح الضوئي. معاينة ومسح منطقة الشريحة المحددة بتدرج رمادي 16 بت و2400 نقطة في البوصة. حفظ الصورة لاستخدامها لاحقا في MSI MALDI.
4. ترسب مصفوفة
ملاحظة: هناك طرق متعددة لتطبيق طبقة حتى من مصفوفة في حجم الكريستال غرامة على الشريحة MALDI، بما في ذلك تسامي، طباعة الحبر قطرة، بخاخ مصفوفة التلقائي ورذاذ يدوي باستخدام الفنان airbush9. سوف نستخدم بخاخ مصفوفة التلقائي كمثال في هذا البروتوكول للاستنساخ عالية.
- بدء التشغيل: قم بتشغيل وحدة بخاخ المصفوفة، مع التأكد من وضع الصمام في LOAD وإطلاق برنامج البخاخ. تأكد من أن مروحة العادم تعمل بشكل جيد. لا تبدأ مضخة المذيبات إذا كان التنفيس النشط لا يعمل بشكل صحيح.
- تأكد من علامة التبويب Comms أن كل شيء يتواصل ، ثم ابدأ مضخة المذيبات عند 0.1 مل / دقيقة ، مع ضغط خلفي يبلغ ~ 500 psi (أو 3.4 MPa).
- بدء تدفق الهواء المضغوط إلى بخاخ مصفوفة عن طريق وضع خزان النيتروجين إلى 30 psi. ثم، ضبط منظم الضغط على الجزء الأمامي من البخاخ إلى 10 psi، وتعيين درجة حرارة فوهة البخاخ على النحو المطلوب.
ملاحظة: إذا كان ضغط الهواء في الصلاة أقل من 5 psi، فإن فوهة البخاخ لن تكون قادرة على تسخين للحماية. - مع صمام لا يزال في موقف LOAD، استخدم حقنة لطرد حلقة مع 7 مل من الميثانول 70٪، ومن ثم ملء حلقة مع 6 مل من المصفوفة.
- ضع شرائح الأنسجة في حاملات البخاخ ، وسجل كلا الطرفين لمنع الحركة ، وللحفاظ على حافة خالية من المصفوفات لتجنب تلوث المشبك المعدني على هدف MALDI بالمصفوفة.
ملاحظة: اختبار رذاذ مصفوفة على شريحة المجهر فارغة أولا قبل الشروع في الشرائح عينة الثمينة ينصح بشدة. - تأكد من أن معدل التدفق ودرجة الحرارة مستقرة لبدء الرش.
- حدد الطريقة المطلوبة التي تم اختبارها مسبقا باستخدام شريحة زجاجية فارغة.
- اضغط على بدء. وهذا سوف تعيين درجة حرارة فوهة وضبط معدل تدفق مضخة لتتناسب مع الطريقة المحددة. قم بتبديل الصمام من وضع التحميل إلى وضع الرش ثم تأكد من خلال النقر فوق Continue.
- السماح للنظام لتشغيل، والتي سوف يستغرق 5-20 دقيقة لكل شريحة اعتمادا على الأسلوب. قم بتبديل الصمام من Spray إلى وضع التحميل ثم تأكد من خلال النقر فوق Continue عند الانتهاء.
- إزالة الشريحة (ق) من البخاخ، ودراسة نمط طلاء مصفوفة تحت المجهر لضمان طبقة حتى من الكريستال مصفوفة غرامة.
- بعد ترسب المصفوفة، ضع الشريحة (الشرائح) في حامل MALDI المعدني للاستخدام الفوري. إذا كان هناك شريحة عينة واحدة فقط، إضافة شريحة فارغة أخرى لملء المسافات اثنين من حامل MALDI.
- تنظيف النظام مباشرة بعد الاستخدام بعد تعليمات الشركة المصنعة، لمنع انسداد فوهة البخاخ.
- بعد المغلفة الشريحة عينة مع مصفوفة، إما المضي قدما فورا إلى أداة التصوير MALDI، أو شحنها مع الجليد الجاف باستخدام نفس إعداد كيس الرمز البريدي المزدوج الموصوفة في الخطوة 2.19.
ملاحظة: في ظل ظروف الطوارئ مثل أداة MALDI غير متوفر للاستخدام الفوري، قم بتخزين الشريحة المغلفة في حالة فراغ أو عند -20 درجة مئوية لمدة تصل إلى 24 ساعة، على الرغم من أن تدهور بعض الأيض قد يحدث أثناء التخزين، والذي لم تتم دراسته بدقة.
النتائج
تم إجراء التجربة التمثيلية وفقا لسير العمل الموضح في الشكل 1. تم حصاد أدمغة الفئران البرية C57BL التنموية في اليوم التالي للولادة 1 و 21 و 60 (البالغ) كما هو موضح أعلاه وفقا لإرشادات CUNY IACUC وتم تجميدها لمدة 2 و 5 و 7 دقائق على التوالي على متن قارب ألمنيوم عائم على النيتروجين السائل. تم تخميد الأنسجة المجمدة في أقسام سمك 10 ميكرومتر في −15 درجة مئوية لكل من رأس العينة والغرفة. ثم تم نقل عمليات الأنسجة المبردة بلطف على الجانب التوصيلي المبرد مسبقا من الشرائح الزجاجية المغلفة ب ITO للتصوير MALDI. تم تصريف عمليات التبريد المثبتة على شرائح ITO في فراغ لمدة 45 دقيقة في درجة حرارة الغرفة ، تليها ترسب المصفوفة باستخدام بخاخ المصفوفة التلقائي. واستخدمت مصفوفة NEDC للكشف عن الأيض، وأودع محلول مصفوفة من 10 ملغم/مل في الميثانول/الماء (70/30، v/v) بمعدل تدفق قدره 0.1 مل/دقيقة ودرجة حرارة فوهة 75 درجة مئوية لمدة 12 دورة مع تجفيف 5 ق بين كل دورة. واستخدمت سرعة رش 1300 ملم/دقيقة، وتباعد المسارات من 2 مم، وضغط الغاز N2 من 10 psi ومعدل التدفق من 3 لتر / دقيقة وارتفاع فوهة من 40 ملم.
تم الحصول على أطياف الكتلة MALDI في وضع الأيونات السالبة بواسطة أداة MSI وقت الطيران (TOF) من MALDI. 0.5-1 ميكرولتر من الفوسفور الأحمر (مجموعات Pn مع n = 1 - 90) تم إيداع مستحلب في الميثانول على شرائح ITO ، بجانب الأنسجة المركبة ، واستخدم لمعايرة الجهاز في نطاق كتلة 100 - 1000 م / ض من خلال تطبيق منحنى المعايرة التربيعية13. وتركزت أقطار بقعة الليزر إلى "المتوسطة" التشكيل الجانبي شعاع مشروطة لعرض النقطية 50 ميكرومتر. تم الحصول على أطياف ضمن نطاق الكتلة من m/z 50 إلى 1000 في 1000 هرتز ل500 طلقة. وسجلت بيانات الأطياف الكتلية، وتم تحليل التصوير بصورة أكبر باستخدام برمجيات متقدمة لتحليل بيانات تكنولوجيا المعلومات والبيانات المتعلقة بالبيانات المتعلقة ب MALDI. تم إنشاء صور الأيونات مع تطبيع مربع الجذر المتوسط (RMS) بعرض سلة المهملات ±0.25 Da.
تظهر النتائج في الشكل 2 صور الإخراج من برنامج تحليل بيانات MALDI MSI لأطياف m/z التي تم اختيارها من كل فاصل زمني 100 دالتون ، مما يصور بوضوح فائدة تحديد الأطياف من الأيض جزيء صغير إلى الدهون عالية الوزن الجزيئي. يصور كل صف خرائط حرارية أيونية ذات صلة تحتوي على معلومات مكانية وطيفية لأنواع معينة من المستقلب عبر ثلاثة أنسجة تم جمعها في أيام ما بعد الولادة 1 و21 و60. ويمكن استخدام تحليل التوزيع الإقليمي ووفرة الأيونات لكل ممثل م/ض لمقارنة الكميات النسبية للأنواع المناظرة بين مختلف الأعمار. 10- ومن قوة منهجية مؤشر التنمية المتعدد الأنواع في مالدي القدرة على تمييز خصوصية أنواع معينة تحددها m/z إلى المعالم التنموية أو الهياكل التشريحية المحددة. ويلاحظ أن بعض الأيضات غنية بالمواليد داخليا P1 (m/z 320.1)، أو غنية في البالغين P60 (m/z 846.5)، أو موزعة بشكل موحد عبر الأعمار (m/z 480.3)؛ وتثرى الأنواع الجزيئية الأخرى على وجه التحديد في المادة الرمادية (م/ض 117.1؛ 524.3؛ 765.1)، المادة البيضاء (م/ض 673.4؛ 846.5)، أو CSF/البطينين (م/ض 239.0)(الشكل 2A). التوزيع المكاني للأيض التمثيلي بما في ذلك الهيبوكسينتين (م/ض 135.0)، حمض N-أسيتيل-L-الأسبارتيك (م/ض 174.0)، حمض الأراكيدونيك (م /z 303.2)، والعديد من الدهون مثل ليسوفوسفاتيديليثانولامين LPE (18:1) (م/ض 478.3)، LPE(18:1) (م/ض 478.3)، LPE(1 20:4) (م/ض 500.3)، LPE (22:6) (م/ض 524.3)، فوسفاتيديليثانلامينامين PE (44:1 0) (م / ض 838.5), فوسفاتيديلينوزيتول PI(38:4) (م / ض 885.6) كما تظهر (الشكل 2B).
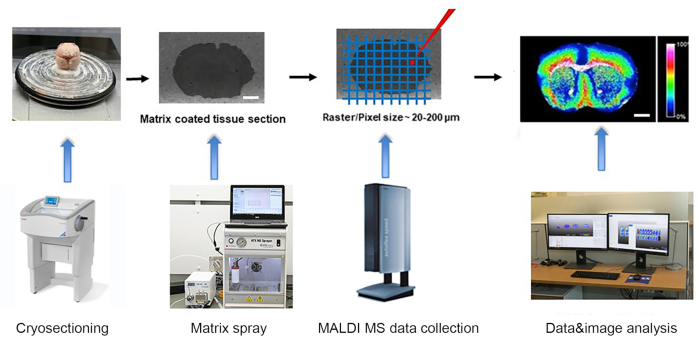
الشكل 1. سير العمل من MALDI- وقت الطيران (TOF) التصوير الطيفي الشامل. يتم زراعة الأنسجة المجمدة المفاجئة في cryostat وشنت على الشريحة ITO. → الشريحة مع أقسام الأنسجة هو المغلفة مع طبقة دقيقة من مصفوفة باستخدام بخاخ مصفوفة التلقائي. → يتم جمع أطياف الكتلة بواسطة جهاز MALDI-TOF MSI على النقطية من 20-200um. → يتم تحليل البيانات، ويتم إنشاء الصور باستخدام برنامج تحليل بيانات MSI المتقدم من MALDI. شريط المقياس: 2 مم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
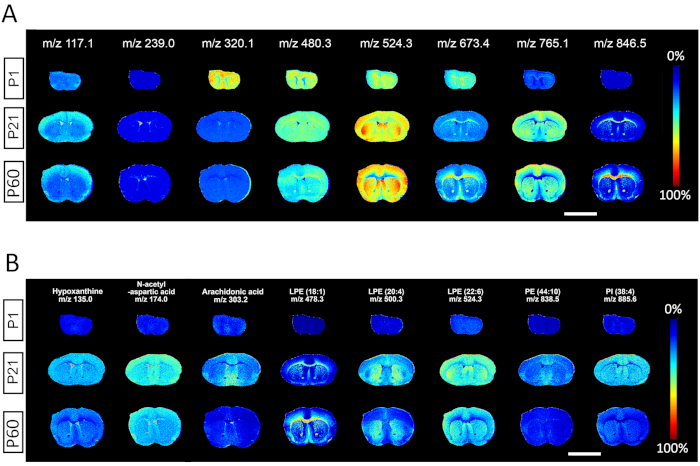
الشكل 2. إخراج تمثيلي مع أطياف m/z مختارة من قياس الطيف الكتلي تم الحصول عليها بدقة 50 ميكرومترا. (أ)تصور خريطة للحرارة التوزيع المكاني لأنواع محددة من المستقلبات المختارة من كل فاصل زمني قدره 100 دالتون م/ض عبر المعالم التنموية الثلاثة المحددة في P1 وP21 وP60. (ب)التوزيع المكاني للأيض التمثيلي في P1 و P21 و P60، بما في ذلك: نقص الأكسيد، حمض N-أسيتيل-L-الأسبارتيك، حمض الأراكيدونيك، والأنواع الدهنية المختلفة مثل اليسوبهوزفاتيليثانولامين (LPE)، فوسفاتيديليثانولامين (PE)، فوسفاتيوديوسيلينتول (PI). شريط المقياس، 500 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
MALDI-Imaging (MALDI-MSI) هي تقنية تصوير خالية من الملصقات تسمح للباحثين بالتحقيق في توزيع الجزيئات الحيوية المختلفة وتعديلاتها في الأنسجة ، وهي الأساس الجزيئي لعلم الأمراض. ويوفر الاستخدام المشترك للمالدي-MSI مع النهج التقليدية LC-MS لتحليل الأنسجة نفس العمق الجزيئي لسير عمل Omics التقليدي ولكنه يحتفظ أيضا بالعلاقة المكانية لتلك الإشارات داخل الشبكة الخلوية. إعداد العينة هو الخطوة الأكثر أهمية في MSI MALDI وحسابات للاختلاف في قراءات النهائي من دراسات الأيض التي أجريت في مختبراتمختلفة 4. هنا نقدم بروتوكول شامل وعملي لتوحيد إعداد العينة للتنميط الأيضي باستخدام MALDI MSI ، على أمل أن يفيد مجتمع بحثي واسع لتنفيذ MALDI MSI في أبحاثهم الحالية والمستقبلية من البيولوجيا الأساسية إلى الدراسات التحويلية.
يجب على المرء أن يضع في اعتباره دائما جميع الاحتياطات لتقليل التغيرات في الملامح الجزيئية (وفرة على حد سواء والتوزيع المكاني) أثناء إعداد العينات وتجنب التلوث. أولا، تقليل الوقت بين القتل الرحيم الحيواني وحصاد الأنسجة، مثل المجمدة في الموقع أو تسخينها عن طريق تثبيت الميكروويف لتثبيط الإنزيمات في الدماغ للحد من المسؤولية إلى نقص التروية بعد الوفاة4،5،6. ثانيا، حالة التجميد المفاجئة للعينة حرجة. سوف يسبب عدم كفاية التجميد تدهور وفقدان الأيض ، في حين أن الإفراط في التجميد سيؤدي إلى تفتيت الأنسجة أثناء عملية استئصال الشعر. يجب دائما اختبار وقت التجميد أولا وفقا للدراسات السابقة المبلغ عنها ، وتوفر دراسة دماغ الماوس التنموي المعروض في هذه الورقة النقاط المرجعية لأنسجة دماغ القوارض. ثالثا، يتطلب قطع الأنسجة البيولوجية ونقل أقسامها إلى شرائح ال ITO ممارسة كافية. من المهم ملاحظة أنه أثناء استخدام الفرشاة لالتقاط المقطع من المرحلة ، يجب استخدام الفرشاة بدقة. السماح للشعيرات من فرشاة فقط تأتي في اتصال مع حواف قسم الأنسجة للحد من خطر التلوث وتجزئة القسم. تسطيح المقطع على الشريحة قدر الإمكان، وهذا سوف يمنع الشباك من القسم أثناء الاحترار الاصبع. رابعا، أثناء تركيبه على شريحة ITO، تأكد من أن القسم بأكمله متصل بشكل جيد بشريحة ITO لأن مناطق مختلفة من الأنسجة قد تتطلب وقتا مختلفا لتدفئة الإصبع. على سبيل المثال، تتطلب أنسجة ورم الدماغ وقتا أطول من أنسجة الدماغ العادية. قد يؤدي ضعف التركيب إلى انفصال الأنسجة وتفتيتها أثناء مسح MALDI-MS. نضع في اعتبارنا أن الاحترار الاصبع قد تمكن عمل الانزيم والتمثيل الغذائي مما تسبب في تغييرات artifactual من الأيض. خامسا، يؤدي الترسب الدقيق والموحد لمصفوفة MALDI دورا هاما في تحقيق معلومات مكانية دقيقة وإشارة قوية من MALDI-MS. فمن المستحسن لاختبار الرش مصفوفة على شريحة فارغة، ومراقبة نمط الكريستال تحت المجهر للتحقق من التغطية المناسبة، قبل الشروع في طلاء الشريحة عينة الثمينة. وأخيرا ، بما أن الباحث الفردي ينفذ حصاد الأنسجة وإعداد الشرائح بسرعات مختلفة ، فسيكون من المثالي أن يكون هناك شخص واحد للتعامل مع إعداد العينة للعينة في نفس الفوج ، لتقليل الاختلاف.
ويفصل البروتوكول الوارد أعلاه الإجراءات المعيارية التي يمكن تكييفها لتلبية احتياجات تجارب معينة. على سبيل المثال ، يمكن استخدام جل مقطع التبريد OCT ، والذي يستخدم عادة في قسم التبريد للعينة ، كغراء متصاعد لتشاك الأنسجة (كما هو موضح في الدراسة المذكورة أعلاه). وقد أظهرت الدراسات السابقة أن عنصر البوليمر في أكتوبر يسبب قمع أيون قوي14. ومع ذلك ، قد يكون تضمين العينة أمرا لا مفر منه في الحالات التي يكون فيها النسيج هشا جدا بحيث لا يمكن قطعه دون دعم إضافي من هلام البوليمر. من أجل مكافحة قمع الإشارات في هذه الحالات ، قد تحتاج الأنسجة إلى غسلها بالغسيل المتسلسل في الإيثانول بنسبة 70٪ والإيثانول بنسبة 95٪ لإزالة OCT المتبقية للكشف عن البروتينات أو الدهون ، في حين لا ينصح بالغسيل للكشف عن المستقلبات الجزيئية الصغيرة9.
وقد ازدادت أهمية هذا الملدي في كل من مختبر البحوث والممارسات السريرية. على سبيل المثال، أثبتت MALDI MSI مؤخرا مفيدة في دراسات البروتيوميات من أجل توصيف الحالة الوظيفية phenotypic من كائنحي 15،وفي العمل كعامل لتحديد الميكروبات وتشخيص المرض اللاحق16. وفي حين أن مشروع ماليدي MSI يدعم مجموعة واسعة من التطبيقات، فإن هناك بعض القيود المرتبطة بالاعتماد فقط على هذه التقنية، لا سيما عندما يتعلق الأمر بالتفرقة بين الأنواع المماثلة أو الأيض، وتحديد أهداف محددة. وثمة تحد آخر يتمثل في تحديد كمي لتركيز الأيض وفقا لإشارات مرض مالدي MSI. وكثيرا ما يفترض أن وفرة الأيونات في أطياف مرض مالدي MSI والتوزيع المكاني (أو الوفرة النسبية) للأنواع الجزيئية المقابلة عبر الأنسجة المفرخة مترابطة بشكل جيد. ومع ذلك ، ينبغي للمرء أن يضع في اعتباره دائما أن العلاقة بين كثافة الأيونات وكمية الأنواع الجزيئية المقابلة معقدة بسبب العديد من العوامل بما في ذلك ، على سبيل المثال لا الحصر ، آثار قمع الأيونات ، والتغيرات في بنية الأنسجة وردود الفعل الأيونية جزيء17. ويمكن تنفيذ التقنيات التي تستخدم المعايير الداخلية للقياس الكمي المطلق (μmol / ز الأنسجة) في MALDI-MSI18. وعادة ما يتم التصدي لهذين التحديين مع سير العمل المشترك ل MALDI MSI مع تقنيات MS (LC-MS/MS) الترادفية اللونية السائلة ، حيث يسمح MALDI-MS برسم خرائط للمنطقة ذات الاهتمام ، والتي تخضع لاحقا للتصريف الدقيق وLC-MS / MS لتوفير مزيد من المعلومات لتحديد المستقلب19.
تم تطوير طرق التصوير المستندة إلى MS في السنوات الأخيرة كوسيلة بديلة للتقنيات السابقة لتصوير الأيض جزيء صغير. مع التقدم وتزايد شعبية MSI MALDI ، فمن المتوقع أن يصبح التصوير MALDI أداة قياسية جديدة لتصور الجزيئات الصغيرة. تصوير جزيئات صغيرة الدهون وال الذاتية (مثل الناقلات العصبية والأيض) في السياق البيولوجي، وكذلك تصوير الزينوبيوتكس لتطوير العوامل الصيدلانية الجديدة هي ذات أهمية خاصة. ومن المتوقع أن تحقق هذه المجالات الثلاثة تقدما سريعا في تطبيق مشروع ماليدي MSI في المستقبل القريب20.
Disclosures
ولا يعلن صاحبا البلاغ عن وجود مصالح مالية متنافسة.
Acknowledgements
يي هو ورينات أبزاليموف مدعومان من قبل برنامج جائزة أبحاث مؤتمر الموظفين المحترفين - جامعة مدينة نيويورك (PSC-CUNY). يتم دعم يوكي تشن وكيلي فيراسامي من قبل مؤسسة ألفريد سلون CUNY برنامج البحوث الجامعية الصيفية.
Materials
| Name | Company | Catalog Number | Comments |
| Andwin Scientific Tissue-Tek CRYO-OCT Compound | Fisher Scientific | 14-373-65 | |
| Artist brush MSC #5 1/8 X 9/16 TRIM RED SABLE | Fisher Scientific | 50-111-2302 | |
| Autoflex speed MALDI-TOF MS system | Bruker Daltonics Inc | MALDI-TOF MS instrument | |
| BD Syringe with Luer-Lok Tips | Fisher Scientific | 14-823-16E | |
| BD Vacutainer General Use Syringe Needles | Fisher Scientific | 23-021-020 | |
| Bruker Daltonics GLASS SLIDES MALDI IMAGNG | Fisher Scientific | NC0380464 | |
| Drierite, with indicator, 8 mesh, ACROS Organics | Fisher Scientific | AC219095000 | |
| Epson Perfection V600 Photo Scanner | Amazon | Perfection V600 | |
| Fisherbrand 5-Place Slide Mailer | Fisher Scientific | HS15986 | |
| Fisherbrand Digital Auto-Range Multimeter | Fisher Scientific | 01-241-1 | |
| FlexImaging v3.0 | Bruker Daltonics Inc | Bruker MS imaging analysis software | |
| HPLC Grade Methanol | Fisher Scientific | MMX04751 | |
| HPLC Grade Water | Fisher Scientific | W5-1 | |
| HTX M5 Sprayer | HTX Technologies, LLC | Automatic heated matrix sprayer | |
| Kimberly-Clark Professional Kimtech Science Kimwipes Delicate Task Wipers | Fisher Scientific | 06-666A | |
| MSC Ziploc Freezer Bag | Fisher Scientific | 50-111-3769 | |
| N -(1-Naphthyl) Ethylenediamine Dihydrochloride (NEDC) | Millipore Sigma Aldrich | 222488 | |
| SCiLS Lab (2015b) | SCiLS Lab | Advanced MALDI MSI data analysis software | |
| Thermo Scientific CryoStar NX50 Cryostat | Fisher Thermo Scientific | 95-713-0 | |
| Thermo Scientific Nalgene Transparent Polycarbonate Classic Design Desiccator | Fisher Scientific | 08-642-7 |
References
- Watkins, S. M., German, J. B. Metabolomics and biochemical profiling in drug discovery and development. Current Opinion in Molecular Therapeutics. 4, 224-228 (2002).
- Fernie, A. R., Trethewey, R. N., Krotzky, A. J., Willmitzer, L. Metabolite profiling: from diagnostics to systems biology. Nature Reviews Molecular Cell Biology. 5, 763-769 (2004).
- Theodoridis, G. A., Gika, H. G., Want, E. J., Wilson, I. D. Liquid chromatography-mass spectrometry based global metabolite profiling: a review. Analytica Chimica Acta. 711, 7-16 (2012).
- Dienel, G. A. Metabolomic and Imaging Mass Spectrometric Assays of Labile Brain Metabolites: Critical Importance of Brain Harvest Procedures. Neurochemistry Research. 45, 2586-2606 (2020).
- Dienel, G. A. Metabolomic Assays of Postmortem Brain Extracts: Pitfalls in Extrapolation of Concentrations of Glucose and Amino Acids to Metabolic Dysregulation In Vivo in Neurological Diseases. Neurochemistry Research. 44, 2239-2260 (2019).
- Wasek, B., Arning, E., Bottiglieri, T. The use of microwave irradiation for quantitative analysis of neurotransmitters in the mouse brain. Journal of Neuroscience Methods. 307, 188-193 (2018).
- Andres, D. A., et al. Improved workflow for mass spectrometry-based metabolomics analysis of the heart. Journal of Biological Chemistry. 295, 2676-2686 (2020).
- Lu, W., et al. Metabolite Measurement: Pitfalls to Avoid and Practices to Follow. Annual Review of Biochemistry. 86, 277-304 (2017).
- Norris, J. L., Caprioli, R. M. Analysis of tissue specimens by matrix-assisted laser desorption/ionization imaging mass spectrometry in biological and clinical research. Chemical Reviews. 113, 2309-2342 (2013).
- Miura, D., et al. Ultrahighly sensitive in situ metabolomic imaging for visualizing spatiotemporal metabolic behaviors. Analytical Chemistry. 82, 9789-9796 (2010).
- Han, J., et al. Towards high-throughput metabolomics using ultrahigh-field Fourier transform ion cyclotron resonance mass spectrometry. Metabolomics. 4, 128-140 (2008).
- Wang, J., et al. MALDI-TOF MS imaging of metabolites with a N-(1-naphthyl) ethylenediamine dihydrochloride matrix and its application to colorectal cancer liver metastasis. Analytical Chemistry. 87, 422-430 (2015).
- Sladkova, K., Houska, J., Havel, J. Laser desorption ionization of red phosphorus clusters and their use for mass calibration in time-of-flight mass spectrometry. Rapid Communication in Mass Spectrometry. 19, 3114-3118 (2019).
- Schwartz, S. A., Reyzer, M. L., Caprioli, R. M. Direct tissue analysis using matrix-assisted laser desorption/ionization mass spectrometry: practical aspects of sample preparation. Journal of Mass Spectrometry. 38, 699-708 (2003).
- Greco, V., et al. Applications of MALDI-TOF mass spectrometry in clinical proteomics. Expert Review of Proteomics. 15, 683-696 (2018).
- Singhal, N., Kumar, M., Kanaujia, P. K., Virdi, J. S. MALDI-TOF mass spectrometry: an emerging technology for microbial identification and diagnosis. Frontiers in Microbiology. 6, 791 (2015).
- Hankin, J. A., Murphy, R. C. Relationship between MALDI IMS intensity and measured quantity of selected phospholipids in rat brain sections. Analytical Chemistry. 82 (20), 8476-8484 (2010).
- Prentice, B. M., Chumbley, C. W., Caprioli, R. M. Absolute Quantification of Rifampicin by MALDI Imaging Mass Spectrometry Using Multiple TOF/TOF Events in a Single Laser Shot. Journal of the American Society for Mass Spectrometry. 28 (1), 136-144 (2017).
- Quanico, J., Franck, J., Wisztorski, M., Salzet, M., Fournier, I. Combined MALDI Mass Spectrometry Imaging and Parafilm-Assisted Microdissection-Based LC-MS/MS Workflows in the Study of the Brain. Methods in Molecular Biology. 1598, 269-283 (2017).
- Trim, P. J., Snel, M. F. Small molecule MALDI MS imaging: Current technologies and future challenges. Methods. 104, 127-141 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved