Method Article
Preparación de muestras para perfiles metabólicos utilizando imágenes de espectrometría de masas MALDI
* Estos autores han contribuido por igual
En este artículo
Resumen
El objetivo de este protocolo es proporcionar una guía detallada sobre la preparación de la muestra al planificar experimentos con MALDI MSI para maximizar la detección metabólica y molecular en muestras biológicas.
Resumen
La metabolómica, el estudio para identificar y cuantificar pequeñas moléculas y metabolitos presentes en una muestra experimental, se ha convertido en una herramienta importante para investigar las actividades biológicas durante el desarrollo y las enfermedades. Los enfoques metabolómicos se emplean ampliamente en el estudio del cáncer, la nutrición / dieta, la diabetes y otras afecciones fisiológicas y patológicas que involucran procesos metabólicos. Una herramienta ventajosa que ayuda en el perfil metabolómico defendido en este documento es la imagen de espectrometría de masas de desorción / ionización asistida por láser asistida por matriz (MALDI MSI). Su capacidad para detectar metabolitos in situ sin etiquetado, modificaciones estructurales u otros reactivos especializados, como los utilizados en inmunotinción, hace de MALDI MSI una herramienta única en el avance de metodologías relevantes en el campo de la metabolómica. Un proceso apropiado de preparación de muestras es fundamental para producir resultados óptimos y será el foco de este documento.
Introducción
Los metabolitos, los productos intermedios o finales del metabolismo, incluidos los nucleótidos, los aminoácidos o ácidos orgánicos, los lípidos, son componentes clave para las funciones y procesos biológicos. La metabolómica, el estudio de los metabolitos, permite la exploración de sus interacciones bioquímicas y la comprensión de sus funciones en el contexto de la investigación básica, traslacional y clínica. Los metabolitos están fuertemente asociados con los fenotipos de los organismos y proporcionan información sobre las actividades bioquímicas que ocurren durante el metabolismo celular1. Por lo tanto, además de la genómica y la proteómica, la metabolómica se ha convertido en una herramienta importante para comprender las condiciones fisiológicas y patológicas. Por ejemplo, la metabolómica se utiliza para dilucidar los mecanismos detrás de los medicamentos existentes, así como su tolerancia. En el desarrollo de fármacos, el metabolismo xenobiótico es útil para evaluar la actividad o toxicidad de los metabolitos entre especies, lo que luego se traduce en apoyar la medicina personalizada2. A pesar de la amplia aplicación de la metabolómica, la obtención de imágenes de metabolitos puede ser un desafío debido a la reactividad química de los metabolitos, la heterogeneidad estructural y el amplio rango de concentración3. Sin embargo, las concentraciones de metabolitos lábiles, incluidos compuestos de alta energía, glucosa, lactato, glicolítico, vía de derivación de pentosa e intermedios del ciclo TCA, fosfolípidos, neurotransmisores, compuestos de señalización, pueden cambiar en cuestión de segundos y progresar durante minutos cuando las enzimas tisulares están activas durante los procedimientos de recolección de tejidos, como la isquemia postmortem en la recolección cerebral4,5,6 . Para garantizar una adquisición precisa de datos metabolómicos, la preparación adecuada y cuidadosa de la muestra es crítica7,8. Las plataformas establecidas actualmente para medir metabolitos incluyen RMN, ensayos enzimáticos y espectrometría de masas (incluida la cromatografía líquida y de gases), la última de las cuales se analiza más adelante.
MALDI-MSI es una técnica de vanguardia que permite el análisis de muestras complejas a través de la detección de especies moleculares individuales. MALDI MSI otorga el beneficio de poder medir rápida y reproduciblemente varios compuestos moleculares en muestras biológicas. Las imágenes de espectrometría de masas permiten además la producción de imágenes que representan la biología tisular basada en sus metabolitos compuestos, y lo hacen preservando la distribución espacial de los metabolitos en la muestra9. La capacidad de MALDI para detectar analitos en una muestra sin el uso de etiquetas de anticuerpos, modificaciones estructurales u otros reactivos especializados, como los utilizados en inmunotinción, junto con su capacidad para monitorear cientos de moléculas dentro de un solo experimento comprenden solo algunas de las ventajas que otorga la imagen de EM cuando se trata de perfiles metabólicos10, 11. Además de la matriz de uso común como el ácido 2,5-dihidroxibenzoico (DHB) y la 9-aminoacridina (9-AA), recientemente se descubrió una nueva matriz N -(1-Naftil) etilendiamina diclorhidrato (NEDC), que es muy adecuada para el análisis de varios metabolitos de bajo peso molecular, ha mejorado aún más la aplicación de MALDI MSI en el perfil metabólico12.
A pesar de la amplia aplicación de MALDI MSI, el alto costo del instrumento y la complejidad del procedimiento experimental impiden su implementación más amplia en laboratorios de investigación individuales. Por lo tanto, la mayoría de los estudios MALDI MSI son apoyados a través de instalaciones básicas compartidas. La preparación de la muestra, incluida la preparación de diapositivas y el recubrimiento de la matriz, es el paso más crítico en MALDI MSI. Sin embargo, la preparación de la diapositiva se lleva a cabo normalmente en el laboratorio del investigador individual, lo que crea variaciones potenciales en la adquisición posterior de MALDI MSI. Aquí nuestro objetivo es proporcionar un protocolo detallado para la preparación de muestras biológicas antes de proceder a las mediciones de MALDI MSI, y utilizar un perfil metabolómico del cerebro de ratón en desarrollo como ejemplo.
Protocolo
El protocolo sigue las pautas del Comité Institucional de Cuidado y Uso de Animales (IACUC) del Centro de Investigación científica avanzada (ASRC) de la Universidad de la Ciudad de Nueva York (CUNY).
1. Cosecha el tejido
- Prepara el bote de aluminio. Prepara un rectángulo de aluminio de 10cm x 20 cm, dobla en el medio para hacer cuadrados de doble capa de 10 cm. Etiquete la información de la muestra en un lado y doble el otro lado para formar un bote con una superficie inferior de aproximadamente 4 cm x 4 cm.
- Preenfóque el barco en el nitrógeno líquido (LN2)en una caja de espuma de poliestireno.
NOTA: Si el bote es demasiado pequeño, la muestra puede caerse del bote y congelarse al contactar directamente con LN2,lo que puede resultar en fragmentación durante la crioseccionamiento. - La eutanasia del animal por luxación cervical siguiendo las pautas institucionales de la IACUC, disecciona inmediatamente el tejido de interés.
- Mantenga el intervalo entre la anestesia animal y la congelación instantánea lo más corto posible, para minimizar la alteración de los metabolitos durante la recolección de tejidos, especialmente los metabolitos labiales en el cerebro debido a la isquemia postmortem.
NOTA: La perfusión del animal con solución salina tamponada con fosfato (PBS) aumentará la duración de la isquemia, alterando aún más las concentraciones de metabolitos lábiles y exagerando los resultados artificiosos. Por lo tanto, no se recomienda la perfusión o el lavado del tejido con PBS, a menos que la contaminación de la sangre o el fluido corporal sea más preocupante que el deterioro o lavado de metabolitos para el proyecto individual.
- Mantenga el intervalo entre la anestesia animal y la congelación instantánea lo más corto posible, para minimizar la alteración de los metabolitos durante la recolección de tejidos, especialmente los metabolitos labiales en el cerebro debido a la isquemia postmortem.
- Coloque inmediatamente el tejido en el bote de aluminio que flota en nitrógeno líquido, cierre la tapa de la caja de espuma de poliestireno y congele durante 2-10 minutos dependiendo del tamaño del tejido: 2 min, 5 min, 7 min para el día postnatal 1 (P1), P21, P60 cerebro de ratón, respectivamente, y 10 min para cerebro de rata P60.
NOTA: No congele el tejido durante un tiempo prolongado (por ejemplo, 5 minutos para el cerebro de ratón P1) ya que el sobrecongelado podría provocar la fragmentación del tejido durante la crioseccionación. - Retire el bote con fuerceps, doble la lámina para envolver el tejido, transporte sobre hielo seco y guárdelo a -80 °C para su uso posterior. Si le sigue una seccionamiento inmediato, lleve las muestras sobre hielo seco hasta el criostato.
NOTA: Para preservar mejor los metabolitos, se prefiere almacenar la muestra en tejido intacto y seccionarla justo antes de proceder a la imagen MALDI. El tejido se puede almacenar en -80 °C durante un plazo de hasta 24 meses.
2. Criosectación del tejido
NOTA: Use guantes en todo momento cuando manipule los portaobjetos de tinóxido de indio (ITO). Evite la respiración directa en el portaobjetos o use máscaras (opcional) para evitar la contaminación de la saliva humana en la sección de tejido.
- Antes de seccionar el tejido, reúna el número deseado de portaobjetos de vidrio recubiertos con ITO compatibles con MALDI.
- Pruebe la conductividad de la corredera con un voltímetro ajustado a la resistencia. Etiquete el lado donde se lee una medición de resistencia: este será el lado al que se adhieren las secciones de tejido. Siempre coloque el tobogán sobre una toalla de papel limpia para evitar la contaminación.
- Enfríe previamente las diapositivas en un criostato ajustado a -20 °C.
- Si se extrajeron muestras de tejido de los -80 °C, deje que el tejido se equilibre en la cámara de criostato durante unos 45-60 minutos, dependiendo del tamaño del tejido. Si las muestras se están retirando del hielo seco, equilibre durante unos 30 minutos.
- Limpie a fondo el criostato con etanol al 70%. Enfríe previamente todas las herramientas necesarias, incluido el pincel de artista de punta delgada y las forrcepciones en la cámara del criostato.
- Ajuste la temperatura de la cámara criostato y la cabeza de la muestra según el tipo de tejido: -14 ° C para el hígado, -20 ° C para el músculo y -25 ° C para la piel9.
- Monte el tejido en el mandril utilizando el tejido criostático que incrusta el compuesto OCT, evitando la OCT de la región de interés.
- Coloque una cuchilla limpia en el escenario y bloquee. Ajuste la posición del escenario y el ángulo de la muestra para lograr el ángulo de corte deseado.
NOTA: Si se van a cortar diferentes tipos/genotipos de tejido, asegúrese de reposicionar la muestra para que se use una parte limpia de la cuchilla o cambiar a una cuchilla nueva antes de cortar la siguiente muestra para evitar la contaminación cruzada. - Continúe cortando hasta que se encuentre la región de interés (por ejemplo, el cuerpo calloso en el cerebro). Asegúrese de mantener el escenario limpio cepillando las piezas adicionales con un pincel de artista que se haya equilibrado en el criostato.
- Una vez que se revela la región deseada, corte secciones más pequeñas de 10-12 μm de espesor. Si la sección tiende a desprenderse o desmoronarse fácilmente, eleve la temperatura del criostato, manteniéndose en el rango de -22 °C a -11 °C. Hemos encontrado que la temperatura de corte óptima para el tejido cerebral es de -15 ° C a - 18 ° C.
- Una vez cortada una buena sección, adherirla a la diapositiva ITO (operar en la cámara criostato).
- Transfiera una sección del tejido a las diapositivas ITO usando la punta del pincel artista.
- Caliente la sección con los dedos colocando un dedo debajo de la corredera para calentar la sección y garantizar un montaje seguro. La sección de tejido primero se volverá transparente en 5-10 s y luego se volverá opaca en aproximadamente 30-60 s.
- Aparta cuidadosamente la diapositiva en el criostato.
- Repita los pasos para otras muestras de tejido, asegurándose de que cada sección del tejido se coloque uniformemente en el portaobjetos y esté lo más alineada posible.
- Dado que el objetivo MALDI puede contener hasta dos diapositivas, coloque las secciones de varias muestras de la misma cohorte en una sola diapositiva o en dos diapositivas, para garantizar que se puedan analizar al mismo tiempo.
- Cuando termine, coloque las diapositivas ITO en una caja de vacío y transfiéralos a un desecador con desecante. Seque al vacío el portaobjetos durante 45-60 min.
NOTA: Si un desecador de vacío no está disponible en el laboratorio, mantenga las diapositivas por debajo de -20 ° C todo el tiempo para evitar el deterioro de los metabolitos. - Almacenamiento y envío de diapositivas: a menos que la muestra sea preparada por las instalaciones centrales de imágenes maldi para proceder directamente a las imágenes MALDI, almacenar las diapositivas a -80 ° C o enviar a las instalaciones centrales u otros laboratorios de investigación MALDI en hielo seco.
- Para preservar mejor las muestras, coloque las diapositivas en el transportador de diapositivas, llénelo con nitrógeno (opcional), selle con parafilm, colóquelo en una bolsa con cremallera, que luego se coloca en otra bolsa con cremallera que contenga desecante. Etiquete la bolsa exterior con cremallera.
- Proceda al almacenamiento a -80 ° C (hasta 6 meses) o al envío con hielo seco adecuado.
3. Preparación de la matriz
- Preparar la matriz.
NOTA: Todos los reactivos deben ser de grado HPLC.- Preparar NEDC a una concentración de 10 mg/ml. Preparar 10 mL de matriz disuelta en un disolvente de metanol al 70% (100 mg de NEDC, 7 mL de metanol, 3 mL de H2O).
- Además, prepare 10 ml adicionales de solución de metanol: agua al 70% para enjuagar el sistema de pulverización antes de rellenar la matriz.
- Una vez que las diapositivas estén deshidratadas en el paso 2.17, coloque las marcas "X" en el espacio en blanco de la diapositiva de vidrio fuera de las secciones de tejido usando un marcador plateado de punto en negrita, y luego coloque una segunda "x" con un marcador negro de punto fino en la parte superior de la "X" plateada. La "X" negra con un fuerte contraste fuera del fondo plateado (la negrita plateada "X") servirá más tarde como marcador fiduciario para la posterior adquisición de espectros de masas en el instrumento MALDI.
- Cargue la diapositiva en el objetivo metálico de la diapositiva MALDI. Use una cubierta de plástico y dibuje / delinee donde las muestras están en la cubierta de plástico. Reservar.
- Escanee la imagen de la diapositiva junto con el objetivo MALDI utilizando un escáner plano. Los tornillos en la superficie del objetivo servirán como espaciador para evitar el daño o la contaminación de la sección de tejido por parte del escáner. Obtenga una vista previa y escanee el área de diapositiva seleccionada en escala de grises de 16 bits y 2400 ppp. Guarde la imagen para su uso posterior en MALDI MSI.
4. Deposición matricial
NOTA: Existen múltiples métodos para aplicar una capa uniforme de matriz en tamaño de cristal fino en la diapositiva MALDI, incluida la sublimación, la impresión de inyección de tinta de gotas, el pulverizador automático de matriz y el pulverizador manual utilizando artist airbush9. Utilizaremos el pulverizador automático de matriz como ejemplo en este protocolo por su alta reproducibilidad.
- Arranque: Encienda la unidad de pulverización matricial, asegurándose de que la válvula esté colocada en LOAD y lance el software de pulverización. Compruebe que el ventilador de escape funciona bien. No encienda la bomba de disolvente si la ventilación activa no funciona correctamente.
- Confirme en la pestaña Comunicaciones que todo se está comunicando y luego inicie la bomba de solvente a .1 mL / min, con una contrapresión de ~ 500 psi (o 3.4 MPa).
- Inicie el flujo de aire comprimido al pulverizador de matriz configurando el tanque de nitrógeno a 30 psi. Luego, ajuste el regulador de presión en la parte frontal del pulverizador a 10 psi y ajuste la temperatura de la boquilla del pulverizador como desee.
NOTA: Si la presión del aire en la oración es inferior a 5 psi, la boquilla del pulverizador no podrá calentarse para protegerse. - Con la válvula todavía en la posición LOAD, use una jeringa para enjuagar el bucle con 7 ml de metanol al 70% y luego llene el bucle con 6 ml de matriz.
- Coloque los deslizamientos de tejido en los soportes en el pulverizador, pegando con cinta adhesiva ambos extremos para evitar el movimiento y preservar un borde libre de matriz para evitar la contaminación de la abrazadera de metal en el objetivo MALDI por la matriz.
NOTA: Se recomienda encarecidamente probar el spray de matriz en un portaobjetos de microscopio en blanco antes de proceder a las preciosas diapositivas de muestra. - Verifique que el caudal y la temperatura sean estables para comenzar la pulverización.
- Seleccione el método deseado previamente probado con una diapositiva de vidrio en blanco.
- Pulse Inicio. Esto establecerá la temperatura de la boquilla y ajustará el caudal de la bomba para que coincida con el método seleccionado. Cambie la válvula de la posición de carga a pulverización y luego confirme haciendo clic en Continuar.
- Permita que el sistema se ejecute, lo que tomará de 5 a 20 minutos por diapositiva dependiendo del método. Cambie la válvula de la posición De pulverización a Carga y luego confirme haciendo clic en Continuar cuando haya terminado.
- Retire la(s) diapositiva(s) del pulverizador, examine el patrón de recubrimiento de la matriz bajo el microscopio para asegurar una capa uniforme de cristal de matriz fina.
- Después de la deposición de la matriz, coloque la(s) diapositiva(s) en el soporte de metal MALDI para su uso inmediato. Si solo hay una diapositiva de muestra, agregue otra diapositiva en blanco para llenar los dos espacios del soporte MALDI.
- Limpie el sistema inmediatamente después del uso siguiendo las instrucciones del fabricante, para evitar la obstrucción de la boquilla del pulverizador.
- Después de recubrir el portaobjetos de muestra con matriz, proceda inmediatamente al instrumento de imágenes MALDI o envíelo con hielo seco utilizando la misma preparación de bolsa de doble cremallera descrita en el paso 2.19.
NOTA: En circunstancias de emergencia, como que el instrumento MALDI no está disponible para su uso inmediato, guarde la corredera recubierta en condiciones de vacío o a -20 ° C durante un período de hasta 24 horas, aunque el deterioro de algunos metabolitos puede ocurrir durante el almacenamiento, que no se ha estudiado a fondo.
Resultados
El experimento representativo se realizó de acuerdo con el flujo de trabajo que se muestra en la Figura 1. Los cerebros de ratón de tipo salvaje C57BL en desarrollo de los días postnatal 1, 21, 60 (adultos) se cosecharon como se describió anteriormente siguiendo las pautas de CUNY IACUC y se congelaron durante 2, 5 y 7 minutos, respectivamente, en un bote de aluminio flotando sobre nitrógeno líquido. Los tejidos congelados se crioseccionaron a secciones de 10 μm de espesor a -15 °C establecidas tanto para la cabeza de la muestra como para la cámara. Las criosecciones de tejido se transfirieron suavemente al lado conductor preenfriado de los portaobjetos de vidrio recubiertos de ITO para imágenes MALDI. Las criosecciones montadas en portaobjetos ITO se desecaron al vacío durante 45 minutos a temperatura ambiente, seguidas de la deposición de la matriz utilizando un pulverizador de matriz automático. Se utilizó la matriz NEDC para detectar metabolitos, y se depositó una solución matricial de 10 mg/mL en metanol/agua (70/30, v/v) a un caudal de 0,1 mL/min y a una temperatura de boquilla de 75 °C durante 12 ciclos con 5 s de secado entre cada ciclo. Se utilizó una velocidad de pulverización de 1300 mm/min, espaciado de vías de 2 mm, presión de gasN 2 de 10 psi y caudal de 3 L/min y altura de boquilla de 40 mm.
Los espectros de masas MALDI fueron adquiridos en modo de iones negativos por el instrumento MALDI time of flight (TOF) MSI. 0.5-1 μL de fósforo rojo (grupos de Pn con n = 1 - 90) emulsión en metanol se depositó en las diapositivas ITO, junto a los tejidos montados, y se utilizó para calibrar el instrumento en el rango de masa de 100 - 1000 m / z mediante la aplicación de la curva de calibración cuadrática13. Los diámetros de los puntos láser se enfocaron al perfil de haz modulado "Medio" para un ancho ráster de 50 μm. Los espectros dentro del rango de masa de m/z 50 a 1000 fueron adquiridos a 1000 Hz para 500 disparos. Se registraron los datos de espectros de masas y las imágenes se analizaron más a fondo utilizando el software avanzado de análisis de datos MALDI MSI. Las imágenes de iones se generaron con normalización de cuadrado medio de raíz (RMS) a un ancho de contenedor de ±0,25 Da.
Los resultados de la Figura 2 muestran imágenes de salida del software de análisis de datos MALDI MSI de espectros m/z seleccionados de cada intervalo de 100 Dalton, representando claramente la utilidad para la identificación de espectros desde metabolitos de moléculas pequeñas hasta lípidos de alto peso molecular. Cada fila representa los respectivos mapas de calor iónico que contienen información espacial y espectral de una determinada especie de metabolitos en tres tejidos recolectados en los días postnatales 1, 21 y 60. Para cada m/z representativo, se puede utilizar el análisis de la distribución regional y las abundancias de iones para comparar cantidades relativas de especies correspondientes entre diferentes edades. Una fortaleza de la metodología MALDI MSI es la capacidad de discernir la especificidad de ciertas especies identificadas por m / z a hitos de desarrollo o estructuras anatómicas específicas. Se observa que algunos metabolitos están enriquecidos en neonatos P1 (m/z 320,1), enriquecidos en adultos P60 (m/z 846,5) o distribuidos uniformemente entre edades (m/z 480,3); otras especies moleculares están específicamente enriquecidas en materia gris (m/z 117.1; 524.3; 765.1), materia blanca (m/z 673.4; 846.5) o CSF/ventrículos (m/z 239.0) (Figura 2A). También se muestra la distribución espacial de metabolitos representativos que incluyen hipoxantina (m/z 135.0), ácido N-acetil-L-aspártico (m/z 174.0), ácido araquidónico (m/z 303.2) y varios lípidos como lisofosfatidiletanolamina LPE (18:1) (m/z 478.3), LPE(20:4) (m/z 500.3), LPE (22:6) (m/z 524.3), fosfatidiletanolamina PE (44:10) (m/z 838,5), fosfatidilinositol PI(38:4) (m/z 885,6) (Figura 2B).
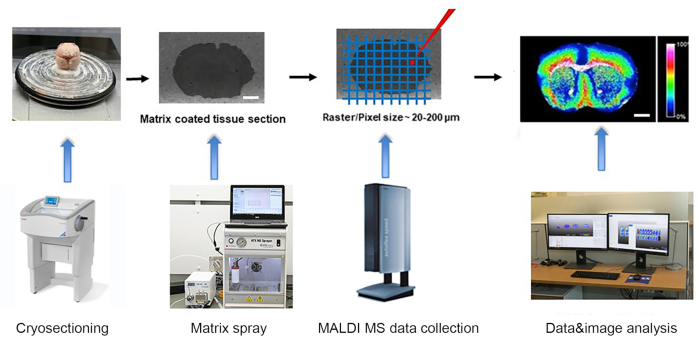
Figura 1. Flujo de trabajo de imágenes de espectrometría de masas maldi-tiempo de vuelo (TOF). El tejido congelado a presión se crirosecciona en criostato y se monta en la diapositiva ITO. → El portaobjetos con secciones de tejido está recubierto con una fina capa de matriz utilizando pulverizador automático de matriz. → espectros de masas es recogido por el instrumento MALDI-TOF MSI a una ráster de 20-200um. → Los datos se analizan y las imágenes se generan utilizando el avanzado software de análisis de datos MALDI MSI. Barra de escala: 2 mm. Haga clic aquí para ver una versión más grande de esta figura.
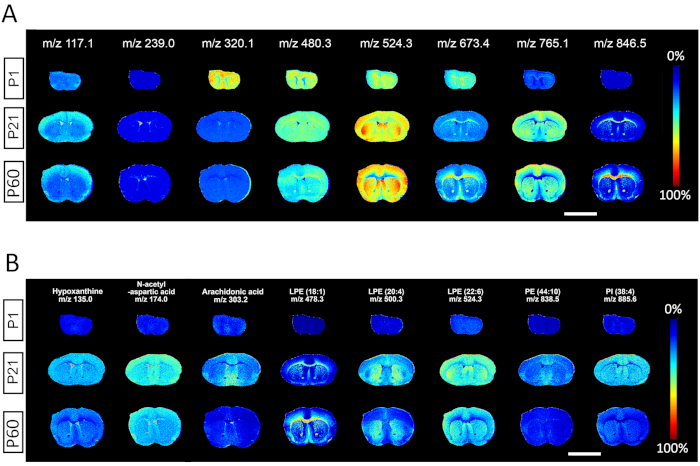
Figura 2. Salida representativa con espectros m/z seleccionados de espectrometría de masas adquirida a una resolución lateral de 50 μm. (A) Un mapa de calor representa la distribución espacial de especies de metabolitos específicos seleccionados de cada intervalo de 100 Dalton m/z a través de los tres hitos de desarrollo identificados en P1, P21 y P60. (B) La distribución espacial de metabolitos representativos en P1, P21 y P60, incluyendo: hipoxantina, ácido N-acetil-L-aspártico, ácido araquidónico, y diferentes especies de lípidos como lisofosfatidiletanolamina (LPE), fosfatidiletanolamina (PE), fosfatidilinositol (PI). Barra de escala, 500 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
MALDI-Imaging (MALDI-MSI) es una técnica de imagen sin etiquetas que permite a los investigadores investigar la distribución de varias biomoléculas y sus modificaciones en el tejido, la base molecular de la patología. El uso combinado de MALDI-MSI con los enfoques tradicionales de LC-MS para el análisis de tejidos proporciona la misma profundidad molecular que los flujos de trabajo ómicos tradicionales, pero también conserva la relación espacial de esas señales dentro de la red celular. La preparación de la muestra es el paso más crítico en MALDI MSI y explica la variación en las lecturas finales de los estudios de metabolómica realizados en diferentes laboratorios4. Aquí proporcionamos un protocolo completo pero práctico para estandarizar la preparación de la muestra para el perfil metabolómico utilizando MALDI MSI, con la esperanza de que beneficie a una amplia comunidad de investigación implementar MALDI MSI en sus investigaciones actuales y futuras, desde la biología básica hasta los estudios traslacionales.
Siempre hay que tener en cuenta todas las precauciones para minimizar los cambios en los perfiles moleculares (tanto de abundancia como de distribución espacial) durante la preparación de las muestras y evitar la contaminación. En primer lugar, minimizar el tiempo entre la eutanasia animal y la recolección de tejidos, como congelados in situ o calentados por fijación de microondas para inactivar enzimas en el cerebro para reducir la responsabilidad de la isquemia postmortem4,5,6. En segundo lugar, la condición de congelación instantánea de la muestra es crítica. La congelación inadecuada causará la degradación y pérdida de los metabolitos, mientras que la congelación excesiva conducirá a la fragmentación del tejido durante la criosecciona. El tiempo de congelación siempre debe probarse primero de acuerdo con estudios informados anteriormente, y el estudio del cerebro de ratón en desarrollo presentado en este documento proporciona los puntos de referencia para el tejido cerebral de roedores. En tercer lugar, el corte de tejidos biológicos y la transferencia de sus secciones a los portaobjetos ITO requerirán una práctica adecuada. Es importante tener en cuenta que mientras se usa el pincel para recoger la sección del escenario, el cepillo debe usarse con delicadeza. Permita que las cerdas del cepillo solo entren en contacto con los bordes de la sección de tejido para disminuir el riesgo de contaminación y fragmentación de la sección. Aplanar la sección en la diapositiva tanto como sea posible, esto evitará el rizo de la sección durante el calentamiento de los dedos. En cuarto lugar, mientras se monta en la diapositiva ITO, asegúrese de que toda la sección esté bien unida a la diapositiva ITO, ya que las diferentes regiones del tejido pueden requerir diferentes tiempos de calentamiento de los dedos. Por ejemplo, el tejido tumoral cerebral requiere un tiempo de calentamiento más largo que el tejido cerebral normal. Un montaje deficiente puede provocar desprendimiento y fragmentación del tejido durante la exploración MALDI-MS. Tenga en cuenta que el calentamiento de los dedos podría permitir la acción enzimática y el metabolismo causando cambios artificiosos de metabolitos. En quinto lugar, una deposición fina y uniforme de la matriz MALDI juega un papel importante en el logro de información espacial precisa y una fuerte señal MALDI-MS. Se recomienda probar la pulverización de la matriz en un portaobjetos en blanco y observar el patrón de cristal bajo un microscopio para verificar la cobertura adecuada, antes de proceder al recubrimiento de la preciosa diapositiva de muestra. Y por último, dado que un investigador individual ejecuta la recolección de tejidos y la preparación de diapositivas a diferentes velocidades, sería ideal tener una persona que maneje la preparación de la muestra para la muestra en la misma cohorte, para minimizar la variación.
El protocolo proporcionado anteriormente detalla los procedimientos estándar, que se pueden adaptar a las necesidades de experimentos particulares. Por ejemplo, un gel crio-seccionador OCT, que normalmente se utiliza en la crio-sección de la muestra, se puede utilizar además como un pegamento de montaje para el mandril de tejido (como en el estudio descrito anteriormente). Estudios previos han demostrado que el componente polimérico en oct causa una fuerte supresión deiones 14. Sin embargo, la incrustación de la muestra puede ser inevitable en los casos en que el tejido es demasiado frágil para ser cortado sin el apoyo adicional de un gel de polímero. Para combatir la supresión de señales en estos casos, los tejidos pueden necesitar ser lavados con lavado en serie en etanol al 70% y etanol al 95% para eliminar la OCT residual para la detección de proteínas o lípidos, mientras que el lavado no se recomienda para la detección de metabolitos moleculares pequeños9.
MALDI MSI se ha vuelto cada vez más relevante tanto en el laboratorio de investigación como en el entorno de la práctica clínica. Por ejemplo, MALDI MSI ha demostrado recientemente ser útil en estudios de proteómica con el fin de caracterizar el estado funcional fenotípico de un organismo15, y en actuar como agente para la identificación microbiana y el diagnóstico de enfermedades posteriores16. Si bien MALDI MSI admite una amplia gama de aplicaciones, existen algunas limitaciones asociadas con confiar únicamente en esta técnica, especialmente cuando se trata de diferenciar entre especies o metabolitos similares, y la identificación de objetivos específicos. Otro desafío es la cuantificación de la concentración de metabolitos de acuerdo con las señales MALDI MSI. A menudo se asume que las abundancias de iones en los espectros MALDI MSI y la distribución espacial (o abundancias relativas) de las especies moleculares correspondientes a través de tejidos disecados están bien correlacionadas. Sin embargo, siempre se debe tener en cuenta que la relación entre la intensidad de los iones y la cantidad de especies moleculares correspondientes se complica por numerosos factores, incluidos, entre otros, los efectos de la supresión de iones, los cambios en la estructura del tejido y las reacciones iónico-molécula17. Las técnicas que hacen uso de estándares internos se pueden implementar para la cuantificación absoluta (tejido μmol/g) en MALDI-MSI18. Estos dos desafíos se abordan típicamente con el flujo de trabajo combinado de MALDI MSI con técnicas de cromatografía líquida en tándem MS (LC-MS / MS), mediante las cuales MALDI-MS permite el mapeo de la región de interés, que luego se somete a microextracción y LC-MS / MS para proporcionar más información para identificar el metabolito19.
Los métodos de imagen basados en la EM se han desarrollado en los últimos años como una modalidad alternativa a las técnicas anteriores para obtener imágenes de metabolitos de moléculas pequeñas. Con los avances y la creciente popularidad de MALDI MSI, se espera que las imágenes MALDI se conviertan en una nueva herramienta estándar para visualizar moléculas pequeñas. Las imágenes de lípidos y moléculas pequeñas endógenas (por ejemplo, neurotransmisores y metabolitos) en el contexto biológico, así como las imágenes de xenobióticos para el desarrollo de nuevos agentes farmacéuticos son de particular interés. Se espera que estas tres áreas tengan rápidos avances con la aplicación de MALDI MSI en un futuro próximo20.
Divulgaciones
Los autores no declaran intereses financieros contrapuestos.
Agradecimientos
Ye He y Rinat Abzalimov cuentan con el apoyo del Programa de Premios de Investigación del Congreso del Personal Profesional-Universidad de la Ciudad de Nueva York (PSC-CUNY). Yuki Chen y Kelly Veerasammy cuentan con el apoyo del Programa de Investigación de Pregrado de Verano de la Fundación Alfred P. Sloan CUNY.
Materiales
| Name | Company | Catalog Number | Comments |
| Andwin Scientific Tissue-Tek CRYO-OCT Compound | Fisher Scientific | 14-373-65 | |
| Artist brush MSC #5 1/8 X 9/16 TRIM RED SABLE | Fisher Scientific | 50-111-2302 | |
| Autoflex speed MALDI-TOF MS system | Bruker Daltonics Inc | MALDI-TOF MS instrument | |
| BD Syringe with Luer-Lok Tips | Fisher Scientific | 14-823-16E | |
| BD Vacutainer General Use Syringe Needles | Fisher Scientific | 23-021-020 | |
| Bruker Daltonics GLASS SLIDES MALDI IMAGNG | Fisher Scientific | NC0380464 | |
| Drierite, with indicator, 8 mesh, ACROS Organics | Fisher Scientific | AC219095000 | |
| Epson Perfection V600 Photo Scanner | Amazon | Perfection V600 | |
| Fisherbrand 5-Place Slide Mailer | Fisher Scientific | HS15986 | |
| Fisherbrand Digital Auto-Range Multimeter | Fisher Scientific | 01-241-1 | |
| FlexImaging v3.0 | Bruker Daltonics Inc | Bruker MS imaging analysis software | |
| HPLC Grade Methanol | Fisher Scientific | MMX04751 | |
| HPLC Grade Water | Fisher Scientific | W5-1 | |
| HTX M5 Sprayer | HTX Technologies, LLC | Automatic heated matrix sprayer | |
| Kimberly-Clark Professional Kimtech Science Kimwipes Delicate Task Wipers | Fisher Scientific | 06-666A | |
| MSC Ziploc Freezer Bag | Fisher Scientific | 50-111-3769 | |
| N -(1-Naphthyl) Ethylenediamine Dihydrochloride (NEDC) | Millipore Sigma Aldrich | 222488 | |
| SCiLS Lab (2015b) | SCiLS Lab | Advanced MALDI MSI data analysis software | |
| Thermo Scientific CryoStar NX50 Cryostat | Fisher Thermo Scientific | 95-713-0 | |
| Thermo Scientific Nalgene Transparent Polycarbonate Classic Design Desiccator | Fisher Scientific | 08-642-7 |
Referencias
- Watkins, S. M., German, J. B. Metabolomics and biochemical profiling in drug discovery and development. Current Opinion in Molecular Therapeutics. 4, 224-228 (2002).
- Fernie, A. R., Trethewey, R. N., Krotzky, A. J., Willmitzer, L. Metabolite profiling: from diagnostics to systems biology. Nature Reviews Molecular Cell Biology. 5, 763-769 (2004).
- Theodoridis, G. A., Gika, H. G., Want, E. J., Wilson, I. D. Liquid chromatography-mass spectrometry based global metabolite profiling: a review. Analytica Chimica Acta. 711, 7-16 (2012).
- Dienel, G. A. Metabolomic and Imaging Mass Spectrometric Assays of Labile Brain Metabolites: Critical Importance of Brain Harvest Procedures. Neurochemistry Research. 45, 2586-2606 (2020).
- Dienel, G. A. Metabolomic Assays of Postmortem Brain Extracts: Pitfalls in Extrapolation of Concentrations of Glucose and Amino Acids to Metabolic Dysregulation In Vivo in Neurological Diseases. Neurochemistry Research. 44, 2239-2260 (2019).
- Wasek, B., Arning, E., Bottiglieri, T. The use of microwave irradiation for quantitative analysis of neurotransmitters in the mouse brain. Journal of Neuroscience Methods. 307, 188-193 (2018).
- Andres, D. A., et al. Improved workflow for mass spectrometry-based metabolomics analysis of the heart. Journal of Biological Chemistry. 295, 2676-2686 (2020).
- Lu, W., et al. Metabolite Measurement: Pitfalls to Avoid and Practices to Follow. Annual Review of Biochemistry. 86, 277-304 (2017).
- Norris, J. L., Caprioli, R. M. Analysis of tissue specimens by matrix-assisted laser desorption/ionization imaging mass spectrometry in biological and clinical research. Chemical Reviews. 113, 2309-2342 (2013).
- Miura, D., et al. Ultrahighly sensitive in situ metabolomic imaging for visualizing spatiotemporal metabolic behaviors. Analytical Chemistry. 82, 9789-9796 (2010).
- Han, J., et al. Towards high-throughput metabolomics using ultrahigh-field Fourier transform ion cyclotron resonance mass spectrometry. Metabolomics. 4, 128-140 (2008).
- Wang, J., et al. MALDI-TOF MS imaging of metabolites with a N-(1-naphthyl) ethylenediamine dihydrochloride matrix and its application to colorectal cancer liver metastasis. Analytical Chemistry. 87, 422-430 (2015).
- Sladkova, K., Houska, J., Havel, J. Laser desorption ionization of red phosphorus clusters and their use for mass calibration in time-of-flight mass spectrometry. Rapid Communication in Mass Spectrometry. 19, 3114-3118 (2019).
- Schwartz, S. A., Reyzer, M. L., Caprioli, R. M. Direct tissue analysis using matrix-assisted laser desorption/ionization mass spectrometry: practical aspects of sample preparation. Journal of Mass Spectrometry. 38, 699-708 (2003).
- Greco, V., et al. Applications of MALDI-TOF mass spectrometry in clinical proteomics. Expert Review of Proteomics. 15, 683-696 (2018).
- Singhal, N., Kumar, M., Kanaujia, P. K., Virdi, J. S. MALDI-TOF mass spectrometry: an emerging technology for microbial identification and diagnosis. Frontiers in Microbiology. 6, 791 (2015).
- Hankin, J. A., Murphy, R. C. Relationship between MALDI IMS intensity and measured quantity of selected phospholipids in rat brain sections. Analytical Chemistry. 82 (20), 8476-8484 (2010).
- Prentice, B. M., Chumbley, C. W., Caprioli, R. M. Absolute Quantification of Rifampicin by MALDI Imaging Mass Spectrometry Using Multiple TOF/TOF Events in a Single Laser Shot. Journal of the American Society for Mass Spectrometry. 28 (1), 136-144 (2017).
- Quanico, J., Franck, J., Wisztorski, M., Salzet, M., Fournier, I. Combined MALDI Mass Spectrometry Imaging and Parafilm-Assisted Microdissection-Based LC-MS/MS Workflows in the Study of the Brain. Methods in Molecular Biology. 1598, 269-283 (2017).
- Trim, P. J., Snel, M. F. Small molecule MALDI MS imaging: Current technologies and future challenges. Methods. 104, 127-141 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados