Method Article
عزل والتصوير لايف، سليمة مناطق منظم ضربات القلب من الحوض الكلوي الماوس عن طريق تقسيم الهزاز
In This Article
Summary
الهدف من هذا البروتوكول هو عزل مناطق منظم ضربات القلب سليمة من الحوض الكلوي الماوس باستخدام قسم الهزاز. ويمكن بعد ذلك استخدام هذه المقاطع للتصوير في الموقع Ca2 + لتوضيح خصائص Ca2 + العابرة لخلايا تنظيم ضربات القلب وغيرها من الخلايا الخلالية في شرائح الهزاز.
Abstract
الحوض الكلوي (RP) هو بنية عضلية سلسة على شكل قمع تسهل نقل البول الطبيعي من الكلى إلى الحالب عن طريق الانقباضات المنتظمة الدفعية. تعتمد تقلصات RP العادية على نشاط منظم ضربات القلب ، الذي ينبع من المنطقة الأكثر وضوحا من RP عند تقاطع الحوض والكلى (PKJ). نظرا لصعوبة الوصول إلى الاستعدادات السليمة ل PKJ والحفاظ عليها ، ركزت معظم التحقيقات على صنع ضربات القلب RP على الفيزيولوجيا الكهربية أحادية الخلية وتجارب التصوير Ca2+ . على الرغم من أن الكشف عن المهم على RP وتيرة ظهرت من هذا العمل، وهذه التجارب لديها العديد من القيود الجوهرية، بما في ذلك عدم القدرة على تحديد الهوية الخلوية بدقة في تعليق مختلط وعدم وجود التصوير في الموقع من نشاط منظم ضربات القلب RP. وقد أدت هذه العوامل إلى فهم محدود للآليات التي تكمن وراء تقلصات RP الإيقاعية العادية. في هذه الورقة، يتم وصف بروتوكول لإعداد أجزاء سليمة من PKJ الماوس باستخدام تقنية تقسيم هزاز. من خلال الجمع بين هذا النهج والفئران التي تعبر عن المراسلين الخلايا الخاصة والمؤشرات المشفرة وراثيا Ca2 + ، قد يكون المحققون قادرين على دراسة أكثر دقة لأنواع الخلايا المحددة والآليات المسؤولة عن تقلصات RP التجؤمي التي تعتبر حيوية لنقل البول العادي.
Introduction
الحوض الكلوي (RP) هو بنية عضلية سلسة على شكل قمع تنقل البول من الكلى إلى الحالب. ينقل RP البول عن طريق توليد انقباضات إيقاعية منتظمة (التأصيلي)1،2،3،4،5، مما يدفع بولوس البول من الكلى إلى الحالب وفي النهاية إلى المثانة ، حيث يتم تخزينه حتى يحدث micturition6،7. فقدان هذا النشاط المنتظم له عواقب وخيمة، بما في ذلك التهابات الرحم والفشل الكلوي1،3،8؛ وبالتالي ، هناك حاجة ماسة لدراسة الآليات الكامنة وراء تقلصات RP العادية والإيقاعية. تنبثق الانقباضات التعظمية من المنطقة الأكثر ارتباطا من RP-in تقاطع الحوض والكلى (PKJ)9و10و11و12و13و14و15 ( الشكل1A-C) و تنتشر بشكل distally لدفع البول من الحليمة إلى RP ( الشكل1B). يتم تسجيل نشاط منظم ضربات القلب الكهربائية في PKJ كما إزالة الاستقطابات العابرة العفوية10،11،12،13،15،16،17، والتي يعتقد أنها تنشأ من خلايا تنظيم ضربات القلب المتخصصة. ويعتقد أن هذه الخلايا منظم ضربات القلب، ودعا سابقا خلايا العضلات الملساء غير نمطية (ASMCs)، لتوليد أو تنسيق نشاط منظم ضربات القلب ودفع تقلصات خلايا العضلات الملساء "نموذجية" (SMCs)9،10،11،18،19،20،21،22،23.
ASMCs هي الأكثر وفرة في RP القريبة، في PKJ (الشكل 1A-C)،حيث الانقباضات التجؤمية ونشاط منظم ضربات القلب الكهربائية تنشأ5،7 ،8،9،12،13،14،16،17،18،19،20،21 ,22. حددت دراسة نشرت مؤخرا من قبل هذه المجموعة مستقبلات عامل النمو المشتقة من الصفائح الدموية ألفا (PDGFRα)، بالاشتراك مع سلسلة العضلات الميوسين الثقيلة الملساء (smMHC)، كعلامة بيولوجية فريدة من نوعها لهذه الخلايا الخلالية (ICs)24، وهي النتيجة التي أكدتها مجموعات أخرى25. استنادا إلى نمطها المتحول والتعبير البروتيني ، كانت تسمى هذه الخلايا PDGFRα+ IC النوع 1 (PIC1)24،26. PIC1s يقيمون في طبقة العضلات من PKJ حيث أنها عرض عالية التردد، قصيرة الأجل Ca2 + العابرين، ويعتقد أن تكمن وراء توليد إمكانات منظم ضربات القلب24. ومع ذلك، توجد أنواع خلايا أخرى في PKJ، بما في ذلك PDGFRα+ ICs غير المعبرة عن smMHC (PIC2s) في الطبقة السبتية. وقد أشارت تقارير سابقة إلى أن المركبات غير SMMHC ICs قد تشارك في تنظيم نشاط منظم ضربات القلب19. ومع ذلك، فإن إجراء مزيد من الدراسات للمركبات غير الكيمية الهيدروفلورية يعوقه ضعف التمييز خلال دراسات التصوير Ca2+. عادة، يتم تحميل أنواع الخلايا غير المتجانسة داخل الاستعدادات RP بشكل عشوائي مع الأصباغ Ca2+الحساسة (على سبيل المثال، فلوو-4). للتغلب على هذه التحديات ودراسة مجموعة متنوعة من أنواع الخلايا في RP، يمكن استخدام مؤشرات Ca2+ المشفرة وراثيا (GECIs) للتعبير بشكل انتقائي عن الفلوروفوريس Ca2+الحساس في أنواع الخلايا ذات الاهتمام.
تم تحقيق غالبية الدراسات التي توضح خصائص Ca2 + العابرة في PIC1s / ASMCs من خلال تصوير مستحضرات أنسجة RP المسطحةالورقة 19و21و27. كما PIC1s هي نوع الخلية الوحيدة في PKJ للتعبير عن smMHC، التعبير الشرطي من GECI، GCaMP، في smMHC+ الخلايا المناسبة لدراسة PIC1s في هذا التكوين. ومع ذلك، كما PIC1s وPIC2s على حد سواء التعبير PDGFRα، والتعبير المشروط للمتغيرات GCaMP في PDGFRα+ الخلايا تحظر التمييز الخلية في الاستعدادات ورقة مسطحة. للتحايل على هذه المشكلة، تم استخدام نهج تقسيم الهزاز للتمييز PIC1s و PIC2s عبر جدار الأنسجة PKJ24. للكشف عن هذه المجموعات الخلوية المنفصلة ، تم تقسيم RP بشكل إكليلي ، مما يجعل من الممكن تحديد PIC2s في adventitia و PIC1s في جدار العضلات استنادا إلى العلامات الكيميائية المناعية المعروفة وأنماط التعبير GECI. ونتيجة لهذا النهج الجديد التصوير PKJ، تم العثور على PIC1s وPIC2s لعرض خصائص متميزة Ca2 + الإشارات24. وعلاوة على ذلك، من خلال عزل الأقسام الأكثر وضوحا في منطقة PKJ (الشكل 2)، تم الحفاظ على منطقة منظم ضربات القلب في RP بطريقة لم تكن قد أنجزت من قبل. هنا ، يتم وصف بروتوكول لإظهار كيفية عزل استعدادات PKJ من كلية الماوس باستخدام قسم الهزاز ، وكيفية إعداد هذه الاستعدادات لتجارب التصوير Ca2 + ، وكيفية التمييز بين أنواع الخلايا المختلفة عبر جدار PKJ.
Protocol
جميع الفئران المستخدمة والبروتوكولات الموصوفة في هذه الدراسة كانت وفقا للمعاهد الوطنية للدليل الصحي لرعاية واستخدام المختبر، واللجنة المؤسسية لاستخدام الحيوانات ورعايتها في جامعة نيفادا، رينو، NV. التجارب واستخدام الحيوانات كما يتفق مع المبادئ واللوائح كما وصفها غروندي28.
1. توليد PDGFRα-GCaMP6f والفئران SMCGCaMP3
- عبر GCaMP6flox /+ الفئران (B6؛ 129S-Gt(ROSA)26Sortm95.1 (CAG-GCaMP6f)Hze/J) مع الفئران PDGFRαCre (C57BL/6-Tg (Pdgfra-cre)1Clc/J) لتوليد فئران PDGFRα-GCaMP6f.
- عبر GCaMP3lox / + الفئران (B6.129S -Gt(ROSA)26Sortm38 (CAG-GCaMP3)Hze/ J) مع الفئران الذكور smMHCCreERT2 (B6. FVB-Tg (Myh11-cre/ER T2)1Soff/J) لتوليد فئران SMC-GCaMP3.
ملاحظة: يمكن استخدام الفئران الذكور فقط من الصليب(GCaMP3lox / + الفئران والفئران smMHCCreERT2) كما هو مدفوع التعبير كري من الكروموسوم Y. ويمكن أيضا أن تكون عبرت الفئران smMHCCreERT2 مع GCaMP6fلوكس / + الفئران لتحسين Ca2 + نسبة الإشارة إلى الضوضاء وأسرع Ca2 + خصائص إشارة الزمنية.
2. إعداد وحقن الفئران المعدلة وراثيا مع تاموكسيفين للحث على التعبير المشروط عن GCaMP
- تنشيط cre غير قابل للانسياط recombinase للتعبير GCaMP الخاصة بالخلايا في أنواع خلايا معينة، كما هو موضح سابقا29.
3. إعداد الحلول
- إعداد 1 لتر من كريبس-رينغر بيكربونات (KRB) حل يحتوي على 120.35 mM NaCl, 5.9 m M KCl, 15.5 mM NaHCO3,1.2 mM Na2HPO4,1.2 mM MgCl2, 11.5 mM الجلوكوز, و 2.5 mM CaCl2. في يوم الاستخدام، حافظ على حل KRB على الجليد.
ملاحظة: يمكن تخزين KRB عند 4 درجات مئوية لمدة تصل إلى أسبوع واحد ويجب أن يتم تداعيه مسبقا بمزيج من 97٪ O2 و 3٪ CO2 لمدة 10 دقائق على الأقل قبل الاستخدام.
4. إعداد السيليكون المغلفة باللدائن تشريح وأطباق التصوير المجهر
- مزيج مكونات الاستومر السيليكون وفقا لتعليمات الشركة المصنعة. ملء طبق بيتري 35 ملم × 10 ملم وطبق بيتري 60 ملم × 15 ملم ما يقرب من ربع كامل من الاستومر السيليكون السائل لتجارب التصوير وتشريح، على التوالي. بلمرة الاستومر السيليكون في 37 درجة مئوية لمدة 1 يوم قبل الاستخدام.
ملاحظة: لتعزيز التباين بين أقسام الكلى الرقيقة، ضع دائرة ورق سوداء صغيرة على قاعدة طبق بيتري التصويري قبل تعبئتها بإلدائن السيليكون.
5. تشريح الكلى
- تخدير الفئران عن طريق استنشاق 3-4٪ isoflurane في غطاء التهوية. تأكيد تحريض التخدير العميق عن طريق فقدان إصبع القدم و / أو منعكس قرصة الذيل ، ومن ثم القتل الرحيم للفئران عن طريق خلع عنق الرحم.
- تطبيق الإيثانول 70٪ على الصدر لتهدئة الفراء. باستخدام مقص تشريح خارجي ، افتح تجويف البطن عن طريق شق طولي ، مع شفرات مقصية الزاوية بعيدا عن الحيوان لمنع تلف الأعضاء الداخلية.
- باستخدام ملقط الأنسجة الداخلية ومقص التشريح الداخلي، قرصة الأمعاء ورفعها بعيدا عن جدار البطن. أثناء رفع الأمعاء ، اقطع الجانب السفلي من الأمعاء الخالية من الجسم عند الاثني عشر القريب والقولون البعيدة للوصول إلى المساحة الرجعية التي تحتوي على الكلى.
- بمجرد تعرض الكلى، استخراجها بشكل فردي. قرصة بلطف ورفع نهاية البعيدة من الحالب (~ 4mm بعيدا عن الكلى) مع ملقط الأنسجة. باستخدام مقص تشريح، وقطع تحت الحالب مقروص نحو الكلى. استمر في قطعها تحت الكلى حتى يتم تحريرها من النسيج الضام المحيط بها.
ملاحظة: لتحقيق أقصى قدر من سلامة الأنسجة والاتساق القطع أثناء تقسيم الهزاز، يجب أن تكون الكلية سليمة قدر الإمكان. لضمان ذلك، تجنب قرص أو قطع الكلى باستخدام ملقط ومقص تشريح. - ضع الكلى مع الحالب المرفقة في محلول KRB البارد. كرر الخطوتين 5.4 و 5.5 مع الكلى الكونترال. الحفاظ على الكلى في محلول KRB على الجليد.
ملاحظة: انتقل فورا إلى المقطع التالي من البروتوكول للحفاظ على صلاحية الأنسجة PKJ. بسبب موقعها التشريحي في عمق كلية parenchyma ، يحرم PKJ من الاتصال مع محلول KRB.
6. إعداد الكلى لقسم الهزاز
- نقل الكلى إلى طبق تشريح مغلفة بالسيلكون الاستومر (60 ملم × 15 ملم)، وملئها بمحلول KRB بارد الجليد حتى تغمر الكلية تماما.
- تحت المجهر تشريح, مرساة الكلى إلى قاعدة الطبق عن طريق إدخال دبابيس minutien في الحالب القريبة ومن خلال كبسولة الكلى الأمامية رقيقة أو الأنسجة الدهنية المحيطة بها.
ملاحظة: الحرص على عدم ثقب أنسجة الكلى parenchyma. - استخدام مقص الربيع غرامة والملقط الداخلي لإزالة الأنسجة الدهنية من قاعدة الكلى لفضح RP البعيدة والمجر القريب.
- إزالة الحالب القريبة وجزء من RP البعيدة من قاعدة RP باستخدام مقص الربيع غرامة.
ملاحظة: الحرص على عدم قطع parenchyma الكلى المحيطة بها. يشير الخط الأسود المتقطع في الشكل 1A إلى الموضع التقريبي لهذا القطع. هذا القطع يخلق قاعدة مسطحة على الكلى لمزيد من تقسيم الأنسجة موحدة. عند تشريح الكلى ، يجب على المرء أن يكون على بينة من الموقف التشريحي لمنطقة PKJ. الشكل 1B يظهر أن الكلى سليمة يمكن قطع على طول الطائرة القوس لفضح النخاع، الحليمة (النخاع البعيدة حيث تجمع القنوات تتلاقى) وRP القريبة والقاصية. إذا كان الحليمة أن يتعرض تماما، كما هو الحال في الشكل 1C، يمكن تصور PKJ وRP القريبة (بريكس RP). ومع ذلك، لا ينبغي أن يتم ذلك لتقنية الهزاز. هذا الوصف هو لتوجيه القارئ إلى موقع PKJ عموما ، وأكد في الفرق التشريحي هو مبين في الصور الضوئية المرسلة من منطقة PKJ ومنتصف RP المنطقة في الشكل 1D، هاء. - بيرس كبسولة الكلى الخارجي مع ملقط غرامة تلميح، والصيد نصائح بعيدا عن الجسم الكلي. باستخدام ملقط مع كل يد، قرصة نهايات فضفاضة من الكبسولة وقشر لهم بعيدا. الاستمرار في تقشير الظهر غشاء كبسولة الكلى المتبقية حتى تتم إزالته تماما.
ملاحظة: الكبسولة الكلوية هي طبقة ليفية صعبة تحيط بالكلى. يجب إزالته قبل تقسيم الهزاز للقطع الأمثل.
7. إعداد ومعايرة أداة هزاز
- أدخل شفرة حلاقة في حامل النصل لأداة الهزاز، واضبط زاوية إزالة النصل إلى ~18 درجة.
ملاحظة: كخطوة اختيارية لقسمة ذات جودة أعلى، يجب استخدام كتلة المعايرة (المزودة ببعض أدوات الهزاز) لضبط موضع النصل لكل شفرة جديدة تستخدم وفقا لتعليمات الشركة المصنعة. وهذا يضمن تحديد المواقع الأمثل للشفرة وتقليل الاهتزاز الرأسي. - ضبط سرعة التقدم شفرة إلى 0.2 ملم / ثانية، والاهتزاز الأفقي / محض من النصل إلى سعة 2.00 ملم، وحجم Z-الخطوة من النصل إلى ~ 100-150 ميكرومتر. تأكد من أن سمك مقطع الكلى لا يتجاوز 150 ميكرومتر لأن هذا سيؤثر سلبا على تجارب التصوير Ca2 + (لأن جدار PKJ غالبا ما يتدحرج ويطوى على نفسه إذا كان سميكا جدا).
ملاحظة: يجب على المستخدم ضبط معلمات القطع هذه لأن الإعدادات ستختلف بين مستحضرات الكلى الفردية وأدوات الهزاز. يجب أن يتم الضبط الدقيق أثناء المقطع عندما يمكن للمستخدم فحص الأقسام بصريا تحت المجهر ، كما هو موضح في الخطوة 7.2. - تثبيت حمام الجليد وعلبة عازلة على أداة هزاز. ملء حمام الجليد مع الجليد سحقت، وملء منطقة المرحلة الداخلية مع الجليد الباردة KRB الحل (ملء إلى ما يقرب من نصف كامل). أثناء تقسيم الهزاز، رصد واستبدال الجليد سحقت التي ذابت.
8. هزاز تقسيم الكلى
- استخدام ملقط حادة النهاية لفهم بلطف وإزالة الكلى المعدة من محلول KRB الجليد الباردة. ضع الكلى فورا على ورق ماصة لمدة 2-4 ق لإزالة الرطوبة الخارجية الزائدة. لفة بلطف الكلى عبر ورقة ماصة لضمان أن جميع جوانب parenchyma قد جفت بحيث يكون هناك التصاق الأمثل للكلى إلى مرحلة الهزاز.
ملاحظة: بما أن RP يقع داخل الكلى وبالتالي يحميه البارينشيما الخارجي ، فإن فترة التجفيف القصيرة هذه لن تضر بسلامة الأنسجة. - تطبيق طبقة رقيقة على الفور من الغراء سيانواكريلات (~ 1 سم2) إلى قاعدة لوحة عينة هزاز، واستخدام ملقط حادة انتهت لوضع الكلى، الجانب الحالب إلى أسفل، على المنطقة المغطاة في الغراء. تطبيق بلطف الضغط النزولي إلى أعلى الكلى مع حافة مسطحة من ملقط لحوالي 10-20 ق لتجفيف الغراء.
ملاحظة: لتثبيت الكلى أثناء هذا الإجراء، استخدم زوجا إضافيا من ملقط للحفاظ على الكلى تستقيم كما يجف الغراء. من المهم أن تلتزم الكلية بلوحة العينة في وضع مستقيم بحيث يتم قطع المقاطع مباشرة. لضمان أن الكلى قد انضمت بنجاح إلى لوحة العينة، ادفع بلطف جانب الكلى. إذا نجحت الكلية في الالتزام بالصفيحة ، فيجب أن تبقى قاعدة الكلى آمنة في الطبق. - تأمين بحزم لوحة عينة إلى الجزء السفلي من علبة عازلة. ضبط مستوى محلول KRB بحيث يتم غمر الجزء العلوي من الكلى بالكامل. أثناء خطوات الأقسام، وبينما تتحرك شفرة الهزاز بشكل أعمق في درج المخزن المؤقت، قم بإزالة محلول KRB بحيث لا يصبح حامل النصل مغمورا في المحلول.
ملاحظة: إذا لم يجف الغراء تماما قبل المضي قدما في هذه الخطوة، فإن الغراء غالبا ما تتحرك صعودا من القاعدة وعلى لparenchyma الكلى. هذا الغراء الزائد سيجعل تقسيم أكثر متغير. إذا حدث هذا، قم بإزالة الكلى من الطبق والمضي قدما في إعداد الكلى الطازجة. - بالنسبة لقسم الهزاز التلقائي، حدد موضعي بداية ونهاية دورة قطع الشفرة الهزازية. تحقق من أن هذه المواقف هي ~ 0.5-1 سم واضحة من الكلى لضمان أنه مع كل تقدم شفرة، يتم تقسيم الطائرة الكلى بأكملها.
- إعداد لوحة متعددة الآبار (24- أو 48 جيدا) عن طريق ملء الآبار مع حل KRB ووضع لوحة على الجليد.
ملاحظة: عند إنشاء، يجب وضع المقاطع الفردية في آبار منفصلة لتتبع عمق المقطع. - بدء عملية القطع التلقائي. أثناء التمرير الأولي للشفرة، تأكد من أن النصل يتواصل مع الجزء العلوي من الكلى. إذا لم يتم إجراء الاتصال، ضبط بداية Z-موقف من النصل.
- باستخدام ملقط، وجمع المقاطع التي يتم تحريرها من الكلى. نقل الأقسام فورا إلى الآبار الفردية، ونلاحظ Z-عمق المقاطع لقياس موقع PKJ التقريبي داخل أقسام الكلى.
ملاحظة: اعتمادا على معلمات القطع، قد لا يتم قطع بعض المقاطع خالية من كتلة الكلى. إذا حدث هذا، استخدم بعناية مقص الربيع الدقيق لقطع أجزاء من كتلة الكلى. كما يتم تشجيع المستخدمين على تصور الأقسام بنشاط تحت المجهر الخفيف أثناء الطفو الحر في الآبار الفردية لضمان إعدادات القطع المثلى وموقع الأنسجة. عادة ما يتم اشتقاق المقاطع التي تحتوي على PKJ ~ 1000-1500 ميكرومتر من أعلى الكلى. - متابعة بروتوكول المقطع حتى تصبح مناطق PKJ أكثر وضوحا. راجع قسم النتائج التمثيلية للاطلاع على وصف مناطق PKJ كعائدات قسمة.
- عند هذه النقطة، تحسين معلمات المقطع لضمان تحرير المقاطع من كتلة الكلى بشكل موحد وسليمة. بالإضافة إلى ذلك، تأكد من أن مناطق PKJ مستمرة وغير منقطعة لأن جدران PKJ المكسورة لن تسمح بالتصوير الكافي للخلايا داخل الجدار بسبب الانهيار. إذا أصبحت الجدران مكسورة، تقليل سرعة المقطع وزيادة سمك القسم، والاستمرار في مراقبة أقسام تحت المجهر الخفيف لضبط المعلمات القطع.
- تخزين المقاطع عند 4 درجة مئوية في حل KRB حتى يبدأ التجريب.
9. شريحة الكلى Ca2 + اقتناء الصور
- نقل شريحة الكلى الفردية إلى طبق تصوير مغلفة بالأستومر السيليكون (35 ملم × 10 ملم)، وملء الطبق على الفور مع الطازجة، والجليد الباردة KRB الحل.
- أدخل دبابيس دقيقة حول محيط شريحة الكلى لتأمين القسم إلى قاعدة طبق التصوير.
ملاحظة: هذه الخطوة ضرورية لمنع المقطع من التحرك عندما يتم perfused الحلول الفسيولوجية عبر الشريحة أثناء التصوير. - ضع طبق التصوير على خشبة مسرح المجهر الكونفوجال الغزل القرص تستقيم وتبدأ على الفور perfusing مع حل KRB.
ملاحظة: في هذا البروتوكول، تم استخدام مجهر مستقيم مجهز بوحدة ماسح ضوئي كونفوجال قرص الغزل نيبكو عالية السرعة. - حافظ على معدل التغلغل عند 3 مل/دقيقة ودرجة حرارة محلول KRB عند 36 ± 1 درجة مئوية. قبل التصوير، اسمح للشريحة بالتوازن لمدة ساعة واحدة.
- حدد مكعب التصوير ديكهرويك المناسبة وأشعة الليزر. الحصول على الصور باستخدام جهاز الشحن المقترن بالإلكترونات (EMCCD) أو كاميرا علمية تكميلية لأكسيد المعادن وأشباه الموصلات.
ملاحظة: تم تجهيز نظام confocal في هذا البروتوكول مع ليزر 488 نانومتر لإثارة GCaMP6f أو GCaMP3. تم الحصول على الصور باستخدام كاميرا EMCCD 512 بكسل × 512 بكسل. - استخدم عدسة منخفضة التكبير، هدف الغمر بالماء (4x أو 10x) لتحديد موقع شريحة الكلى. مركز حقل التصوير على مناطق من شريحة حيث PKJ موجود. تحديد المعالم، كما هو مبين في الشكل 2D، لتحديد موقع PKJ (أي نصف دائرية من الأنسجة العضلية المعلقة بين الأنسجة البينشيمالية).
- بمجرد تحديد موقع PKJ ، استخدم عدسة هدف التكبير الأعلى (20x أو 40x أو 60x) لتكبير منطقة الاهتمام.
ملاحظة: في هذا البروتوكول، كانت الفتحة العددية الهدف 20x (NA) 1.0، وكان الهدف 40x NA 0.8، وكان الهدف 60x NA 1.0. - تمييز الخلايا المختلفة ذات الاهتمام في جدار PKJ باستخدام الفئران المعدلة وراثيا التي تعبر عن GCaMP6f أو GCaMP3 في PDGFRα+ الخلايا أو الشركات الصغيرة والمتوسطة ، على التوالي. مراقبة أنواع مختلفة من Ca2 + فترات عابرة في PDGFRα+ الخلايا في جدار PKJ في PDGFRα+ GCaMP6f+ شرائح الكلى (الشكل 3C، انظر النتائج التمثيلية للوصف) وفي GCaMP3+ SMCs في SMC GCaMP3+ شرائح الكلى (الشكل 3D، انظر النتائج التمثيلية للوصف).
- بمجرد تحديد الخلايا ذات الاهتمام في جدار PKJ ، قم بتعديل كثافة الليزر لتسفر عن نسبة إشارة إلى ضوضاء جيدة. تسجيل الصور على تردد أخذ العينات الزمنية بين 16 هرتز و 32 هرتز باستخدام برامجيات الاستحواذ المناسبة.
ملاحظة: اعتمادا على كثافة الليزر المستخدمة أثناء التصوير، يوصى بالحد من عدد التسجيلات بسبب تأثيرات التبييض على الفلوروفوريس Ca2+. يجب على المستخدم اختيار طول التسجيل استنادا إلى الأهداف التجريبية المحددة.
10. Ca2 + تحليل التصوير
- إجراء Ca2 + تحليل التصوير لأنواع مختلفة من الخلايا في مناطق منظم ضربات القلب PKJ عن طريق رسم الخرائط الصدغية كما هو موضح سابقا لمستحضرات تنظيم ضربات القلب سليمة أخرى في الجهاز الهضمي29،30.
النتائج
في الموقع Ca2 + التصوير من PKJ يمكن أن تكشف عن النشاط الخلوي المهم من خلايا منظم ضربات القلب RP. باستخدام الفئران التي تعبر عن ترميز وراثيا Ca2 + المؤشرات (مثل GCaMP) ، مدفوعا promotors الخلايا الخاصة ، يمكن الحصول على معلومات حول RP pacemaking بدقة والتفاصيل التي ليست ممكنة من تجارب التصوير Ca2 + من الاستعدادات RP ورقة مسطحة. وتتميز بداية PKJ من خلال ظهور مفاجئ من شبه دوائر العضلات المعلقة بين الأنسجة الكلى parenchymal (الشكل 2C; PKJ القريبة المغلقة في مربع متقطعة). خلال الجولات اللاحقة من الأقسام ، يصبح النخاع الداخلي مميزا عن الأنسجة القشرية المحيطة. تحت المجهر الخفيف ، يبدو النخاع الداخلي مخططا في المناطق ، أخف لونا مقارنة بالأنسجة القشرية ومتوقفا على محوره الطويل مع بقية الكلى(الشكل 2B، D). عند هذه النقطة، سيبدأ ظهور المزيد من مناطق PKJ. وترد أمثلة على ذلك في الشكل 2D (مستطيلات متقطعة، H و G) حيث يتم تعليق 3 شبه دوائر من العضلات عن طريق الأنسجة parenchymal. سيتم تطبيق هذه العصابات العضلات عن كثب إلى الحليمة الداخلية وسوف عادة جار الشريان الكلوي (الشكل 2D, مستطيلات متقطعة; الشكل 2F-H، رؤوس الأسهم السوداء). كما يتم اشتقاق المزيد من المقاطع البعيدة، وهذه العصابات من العضلات تتكامل لتشكيل أكثر اكتمالا، وهيكل موحد، مما يدل على نهاية منطقة PKJ(الشكل 2E).
الشكل 3A، B يظهر قسم PKJ في انخفاض الطاقة (4-10x) من الماوس التعبير عن GCaMP في PDGFRα+ الخلايا (GCaMP6f التي أعرب عنها cre-recombinase غير قابل للانقسام يقودها Pdgfra). باستخدام معالم مثل الشريان الكلوي(الشكل 3A; النجمة), وينبغي أن يكون المجربين قادرة على التمييز بسهولة جدار PKJ رقيقة معلقة بين الأنسجة parenchymal (الشكل 3B; النجمة). وينتشر التعبير عن GCaMP6f في هذا النسيج المعدلة وراثيا محددة عبر العرض الكامل للPKJ، عبر كل من العضلات والطبقات السبتية(الشكل 3C).
في PDGFRα+ GCaMP6f+ شرائح الكلى ، شبكة من الخلايا التي تمتد عادة على عرض جدار PKJ ستكون فلورية(الشكل 3C)وعرض Ca2 + عابرين متذبذبين من مختلف المدد والترددات. PDGFRα+ الخلايا في جدار PKJ عرض نوعين مختلفين من Ca2 + فترات عابرة. في الطبقة السبتية (موجهة أقرب إلى القشرة) ، يتم تعريف PDGFRα+ الخلايا الموجودة كشبكة من الخلايا وعملياتها. Adventitial PDGFRα+ الخلايا تظهر منخفضة التردد (4 ± 2.7 هرتز) وطويلة المدة (1 ± 0.67 ق) Ca2 + العابرين. الطبقة الثانية من PDGFRα+ الخلايا، موجودة في طبقة العضلات (موجهة أقرب إلى النخاع)، يحمل مماثلة Ca2+ ترددات عابرة والمدد كما SMC GCaMP3+ الخلايا (وصفها أدناه) كما هي نفس نوع الخلية.
في SMC GCaMP3+ شرائح الكلى، طبقة من GCaMP3+ الخلايا موجودة في طبقة العضلات(الشكل 3D). لن تكون هناك إشارة فلورية في الطبقة السبتية(الشكل 3D؛ النجمة). GCaMP3+ الشركات الصغيرة والمتوسطة في طبقة العضلات عادة ما تظهر عالية التردد (10 ± 4 هرتز) وقصيرة المدة (632 ± 74 ق) Ca2 + العابرين. PDGFRα+ الخلايا الموجودة في السبتية PKJ تثير طويلة الأمد، وانخفاض التردد Ca2+ العابرين (الشكل 3E، فيديو 1). ومع ذلك ، يقتصر Ca2 + تجارب التصوير من الأنسجة التي تعبر عن GCaMP3 مدفوعا الترويجي Myh11 إلى الجانب العضلي من PKJ (الشكل 3D). بالمقارنة مع PDGFRα+ الخلايا في adventitia، أطلقت الشركات الصغيرة والمتوسطة أقصر مدة Ca2+ العابرين أكثر تواترا(الشكل 3F،فيديو 2).
بالإضافة إلى فهم خصائص الإشارات في PKJ PDGFRα+ ICs ، تم إثبات تطبيق هذه التقنية لدراسة أنواع الخلايا الأخرى في الكلى المقطعة بالهزاز في هذه الورقة. عند الفحص الدقيق للمولة الكلوية (في الفئران التي تعبر عن GCaMP6f في PDGFRα+ الخلايا) ، لوحظت مجموعة من إشارات Ca2 + الفلورية داخل قنوات التجميع المحيطة بها (Video 3). أطلقت خلايا Medullary PDGFRα+ 2+ العابرين التلقائيين من التردد والمدة المتغيرين. ويمكن أيضا أن هذه الدراسات Ca2 + التصوير من أقسام الهزاز الكلى يمكن أيضا أن تتوسع لدراسة الشرايين الكلوية (~ 50-80 مم القطر) التي غالبا ما الجار PKJ قطاعات العضلات (الشكل 2F, G ; السهام البيضاء). Ca2+ تصوير الشرايين الكلوية (من الأنسجة التي تعبر عن GCaMP في خلايا العضلات الملساء) يوضح المتذبذبة Ca2+ عابرين في الشركات الصغيرة والمتوسطة (فيديو 4).
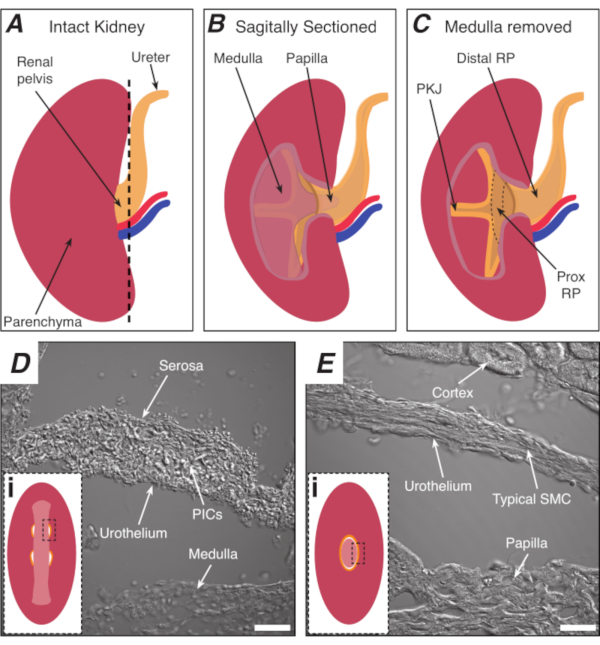
الشكل 1: تشريح الكلى الأساسية وموقع منطقة PKJ منظم ضربات القلب. (أ) رسم تخطيطي للكلى سليمة تبين اتجاه RP والمجر. يتم عرض الشريان الكلوي والوريد الكلوي باللونين الأحمر والأزرق على التوالي. (ب)يمكن قطع الكلى سليمة على طول الطائرة القوس لفضح الجانب الداخلي من الكلى، بما في ذلك النخاع، الحليمة (النخاع القاصي حيث تجمع القنوات تتلاقى)، وRP القريبة والقاصية. (ج)يمكن استئصال النخاع والبابيات لفضح PKJ وRP prox تماما. (D و E)تمثل الصور الضوئية المرسلة من منطقة منظم ضربات القلب PKJ وRP البعيدة، على التوالي. تقسيم متتابعة نحو نهاية البعيدة من الحوض النتائج في نصف دائريات العضلات في منطقة PKJ (دي) الجمع بين واحد، حلقة العضلات سمكا(Ei) التي تغلف الحليمة بأكملها. تظهر المستطيلات السوداء المتقطعة في Di و Ei مناطق تقريبية في أقسام الكلى التاجية حيث تم الحصول على صور ضوئية منقولة. اتجاه الصور D و E هي 90 درجة عكس اتجاه عقارب الساعة إلى insets كل منها (دي وEi). أشرطة المقياس في D و E = 20 ميكرومتر. المختصرات: RP = الحوض الكلوي. بريكس RP = الحوض الكلوي القريبة; PKJ = تقاطع الحوض والكلى؛ PICs = الصفائح الدموية المشتقة من عامل النمو مستقبلات ألفا إيجابية الخلايا الخلالية; SMC = خلايا العضلات الملساء. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
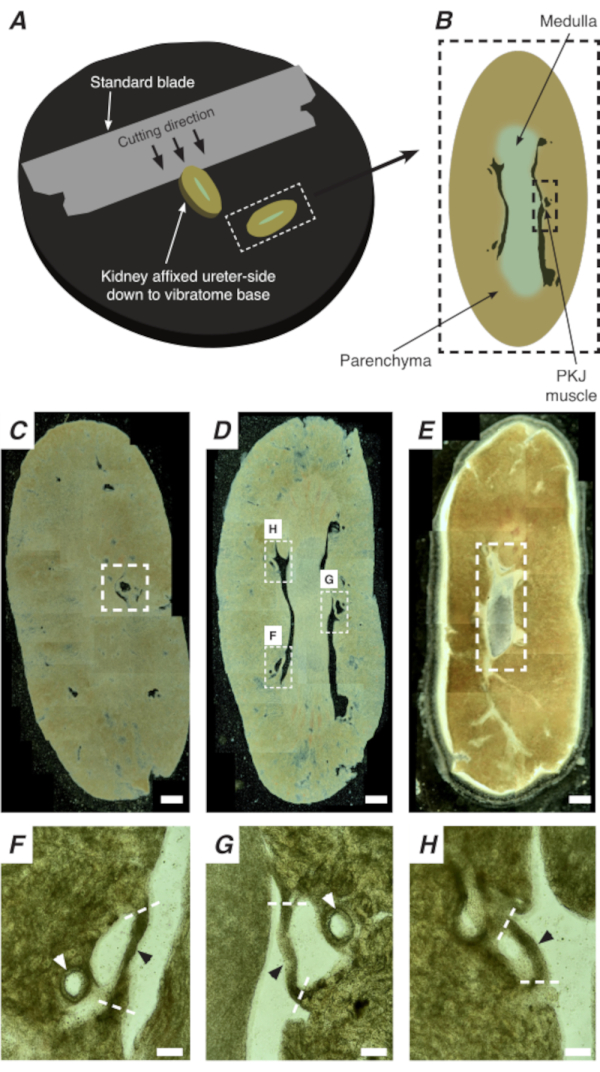
الشكل 2: يتم تركيبقسم الهزاز من الكلى الكاملة لتوليد أقسام رقيقة. (A)يتم تركيب الكلى على جانب الحالب وصولا إلى قاعدة أداة الهزاز ، ويتم استخدام شفرة قياسية (متصلة برأس الهزاز) لقطع المقاطع المتتابعة من الطرف القريب إلى الطرف البعيدة من الكلى. (ب) تمثيل تخطيطي لقسم رفيع مقطوع من الكلى بأكملها مع معالم مشروحة. غالبا ما يتم العثور على شرائح العضلات PKJ (مستطيل أسود متقطع) معلقة بين الأنسجة parenchymal. (ج) صورة مجهرية خفيفة لقسم الكلى القريبة. يشير ظهور أربطة العضلات المعلقة بين الأنسجة البينشيمالية إلى بداية إسقاطات PKJ القريبة (المشار إليها داخل المستطيل الأبيض المتقطع). (D) صورة مجهرية خفيفة تمثل المنطقة المثلى حيث يمكن العثور على عدة مقاطع PKJ (2-3) (مناطق داخل مستطيلات بيضاء متقطعة). يتم تعليق شرائط العضلات PKJ رقيقة بين parenchyma الكلى وتتماشى بشكل وثيق مع الشرايين الكلوية و medulla. (ه) صورة مجهرية خفيفة لقسم الكلى البعيدة. اندمجت شرائح العضلات الفردية لتشكيل شريط عضلي واحد مستمر (مستطيل أبيض متقطع) يحيط بالبابيمة الداخلية (غير موجود في هذه الصورة). أشرطة مقياس C-E = 500 ميكرومتر F-H المناطق التكبير (20x) من لوحة D تشير إلى موقع PKJ (رؤوس الأسهم السوداء)، الشرايين الكلوية (رؤوس الأسهم البيضاء)، وقطع مواقع لعزل PKJ (خطوط بيضاء متقطعة). أشرطة المقياس F-H = 100 ميكرومتر. اختصار: PKJ = تقاطع الحوض والكلى. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
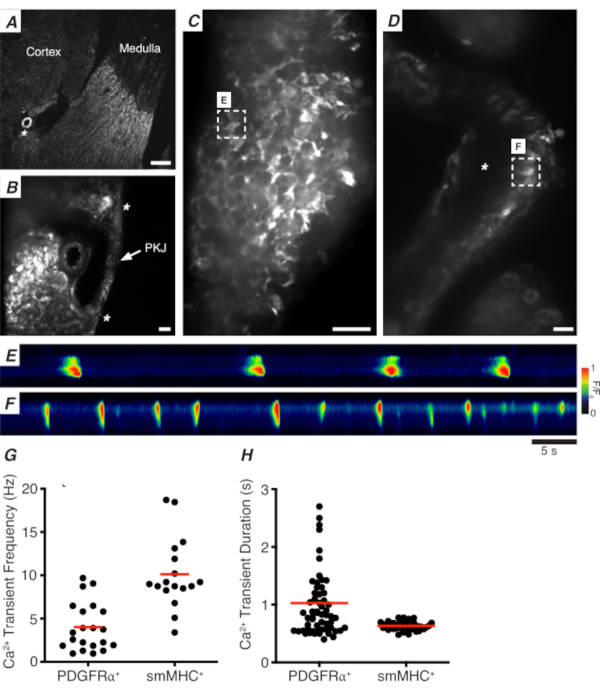
الشكل 3: Ca2+ تصوير أقسام الهزاز. (أ) صورة تمثيلية منخفضة الطاقة (4x) لقسم هزاز يشير إلى موقع الشريان الكلوي (النجمة). شريط مقياس = 200 ميكرومتر (ب) صورة تمثيلية مكبرة (20x) ل PKJ (المسمى) معلقة بين الأنسجة الكلى التماثلية تدل على مواقع عضلة PKJ (رأس السهم الأبيض)، الشريان الكلوي (النجمة). شريط المقياس = 50 ميكرومتر (C) صورة عالية الطاقة (40x) من PKJ تعبر عن GCaMP في PDGFRα+ الخلايا. شريط مقياس = 20 ميكرومتر (D) صورة عالية الطاقة (20x) من PKJ التعبير عن GCaMP في خلايا العضلات الملساء. شريط المقياس = 20 ميكرومتر (E) خريطة سباتيوتيمبورال من Ca2 + العابرين عينات من GCaMP+ PDGFRα+ الخلية المشار إليها في لوحة C. ابحث عن جدول مرمز ل F/F0. (F) خريطة سباتيوتمبورالية من Ca2+ العابرين عينات من GCaMP+ PDGFRα+ الخلية المشار إليها في لوحة D. ابحث عن جدول مرمز ل F/F0. (G) بيانات تمثيلية لتردد Ca2+ عابر (Hz) ل GCaMP+ PDGFRα+ خلايا وخلايا GCaMP+ smMHC. (H) بيانات تمثيلية ل Ca2+ مدة عابرة (ق) لGCaMP+ PDGFRα+ الخلايا وGCaMP+ smMHC الخلايا. المختصرات: PKJ = تقاطع الحوض والكلى؛ PDGFRα+ = الصفائح الدموية المشتقة من عامل النمو مستقبلات ألفا إيجابية; smMHC = السلس العضلات myosin سلسلة ثقيلة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
فيديو 1: عفوية Ca2 + العابرين في GCaMP+ PDGFRα+ الخلايا في أقسام الهزاز PKJ. المختصرات: PKJ = تقاطع الحوض والكلى؛ PDGFRα+ = الصفائح الدموية المشتقة من عامل النمو مستقبلات ألفا إيجابية. الرجاء الضغط هنا لعرض هذا الفيديو. (انقر بزر الماوس الأيمن للتحميل.)
فيديو 2: عفوية Ca2 + العابرين في GCaMP+ خلايا العضلات الملساء في أقسام الهزاز تقاطع الحوض والكلى. الرجاء الضغط هنا لعرض هذا الفيديو. (انقر بزر الماوس الأيمن للتحميل.)
فيديو 3: عفوية كا2 + العابرين في GCaMP+ PDGFRα+ الخلايا في أقسام الهزاز النخاعي الكلوي. اختصار: PDGFRα+ = الصفائح الدموية المشتقة من عامل النمو مستقبلات ألفا إيجابية. الرجاء الضغط هنا لعرض هذا الفيديو. (انقر بزر الماوس الأيمن للتحميل.)
فيديو 4: انخفاض السعة Ca2+ نشاط عابر في أقسام الهزاز من الشريان الكلوي. الرجاء الضغط هنا لعرض هذا الفيديو. (انقر بزر الماوس الأيمن للتحميل.)
Discussion
يتكون RP من مجموعة غير متجانسة من الخلايا ذات الكثافات الخلايا التفاضلية التي لوحظت في مناطق RP المختلفة. PIC1s (يشار إليها سابقا باسم ASMCs) هي الأكثر وفرة في PKJ، حيث ينشأ نشاط منظم ضربات القلب24. يسمح البروتوكول، الموصوف هنا، للمحققين بعزل منطقة تنظيم ضربات القلب عن بقية كلية الفأر. عن طريق قطع أجزاء من PKJ باستخدام هزاز، يتم الاحتفاظ مناطق منظم ضربات القلب من RP (التي تم تحديدها على أنها عصابات العضلات تعلق على parenchyma) سليمة، وبالتالي توفير استخدام التصوير في الموقع لدراسة بدقة خلايا منظم ضربات القلب RP عند دمجها مع المراسلين الفلورية الخاصة بالخلايا.
في حين أن هذا النهج يمكن أن يوفر رؤى جديدة في عملية صنع سرعة RP ، هناك بعض الاعتبارات التي يجب أن يكون المجربين على دراية بها لتحسين نتائج التصوير وكفاءة القسمة. بالنسبة للمستخدم غير المدرب ، فإن هذه الطريقة في عزل PKJ والتصوير أسهل في التعلم من التشريح الحاد النموذجي لتحضيرات RP ذات الورق المسطح. تشريح حاد من RP من الكلى كلها يتطلب أسابيع من الممارسة المستمرة لعزل بنجاح الأنسجة قابلة للحياة لتجارب علم وظائف الأعضاء. وبما أن بروتوكول تقسيم الهزاز هذا يتطلب القليل من المعرفة الحادة بالتشريح ، فإنه يمكن للمستخدمين الذين ليس لديهم خبرة في تشريح هياكل العضلات الملساء الأخرى.
ومع ذلك، هناك بعض النقاط الهامة التي يجب ملاحظتها لهذا البروتوكول. يتطلب الالتزام بنجاح الكلى إلى لوحة عينة هزاز البراعة والصبر. إذا تم توجيه الكلى بشكل غير صحيح ويميل إلى جانب واحد، سيتم قطع مائل بدلا من أقسام مستقيمة. نظرا للطبيعة الحساسة ل PKJ ، يمكن للزاوية المائلة في كثير من الأحيان تدمير عصابات العضلات في منطقة تنظيم ضربات القلب. وعلاوة على ذلك، يؤدي تصوير المقاطع المائلة إلى ضعف الحصول على التصوير لأن شبكات الخلايا ليست عادة في نفس المستوى البؤري. يستغرق الإجراء أيضا وقتا طويلا ، حيث يستغرق تقسيم الكلى الواحدة في كثير من الأحيان ما يصل إلى ساعة لإكماله ، وخلال هذه الفترة يتطلب الإعداد المراقبة.
في حين يمكن تسريع حركة الهزاز ، إذا زادت السرعة أكثر من اللازم (>20٪ مما هو موصى به في البروتوكول) ، فإن النصل سيمزق الكلى بدلا من قطعها بشكل نظيف ، مما يؤدي إلى فقدان هياكل PKJ الحساسة. وبالمثل، يمكن أن تتسبب سرعة القطع المنخفضة جدا في أن يصبح القسم خشنا. تحسين سرعة القطع وسعة النصل أمر ضروري. يجب أيضا توخي الحذر في التعامل مع أقسام الهزاز. نظرا لطبيعتها الحساسة ، يتم تعطيل عضلات PKJ بسهولة أثناء التعامل معها ويمكن أن تمزق. سيتمكن المستخدم المدرب تدريبا جيدا من حصاد ما يقرب من 1-2 منطقة PKJ لكل 4 شرائح كلية مناسبة لتجارب التصوير Ca2+ . عادة، تحتوي أقسام PKJ التي لا تفي بمعايير التصوير Ca2+ على: 1) تعبير GCaMP ضعيف، 2) جدار PKJ ملتوي، أو 3) جدار PKJ مكسور. لتحليل البيانات، يمكن أخذ عينات من حوالي 3-4 خلايا لكل مجال من مجالات الرؤية (FOV).
في حين أن هناك العديد من الخلايا في FOV من PDGFRα-GCaMP6f وSMC-GCaMP3 PKJ أقسام, حركات الأنسجة الصغيرة غالبا ما تستبعد الخلايا من التحليل. يمكن حل هذا عادة عن طريق تطبيق بروتوكول تثبيت على الصور. في ظل الظروف التي لا تتحرك فيها الاستعدادات، يمكن أخذ عينات من 3-5 خلايا على الأقل من أقسام PDGFRα-GCaMP6f و5-6 خلايا من أقسام SMC-GCaMP3. عادة ، فإن الوقت المستغرق من التضحية الحيوانية (العمر الأمثل للفئران هو 8-16 أسبوعا) إلى إجراء تجارب التصوير Ca2 + هو 2-3 ساعة ، وهو ما يكفي لضمان سلامة الأنسجة ، إذا تم احتضان الأنسجة في حلول البرد الجليدي طوال الإجراء عند الحاجة. باختصار ، تم وصف بروتوكول قطع الهزاز هنا لتوليد الاستعدادات السليمة لمناطق RP PKJ من كلية الماوس. تسمح هذه التقنية بالحفاظ على مناطق تنظيم ضربات القلب RP لدراسات التصوير في الموقع Ca2+ للتحقيق في آليات تنظيم ضربات القلب RP.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
تم تمويل هذا المشروع من قبل R01 DK124509 من NIDDK.
Materials
| Name | Company | Catalog Number | Comments |
| 24-well culture plate | ThermoFisher Scientific | 142485 | To store kidney slices in |
| 35 mm x 10 mm Petri dishes | Sigma Aldrich | CLS430165 | Kidney slice calcium imaging dish |
| 48-well culture plate | ThermoFisher Scientific | 152640 | To store kidney slices in |
| 60 mm x 15 mm Petri dish | Sigma Aldrich | P5481 | Kidney sharp dissection dish |
| Absorbent paper | Fisher Scientific | 06-666A | To dry the kidney before applying glue |
| B6;129S-Gt(ROSA)26Sor/J | The Jackson Laboratory | 13148 | GCaMP3 Mice |
| B6;129S-Gt(ROSA)26Sor/J | The Jackson Laboratory | 24105 | GCaMP6f Mice |
| B6.FVB-Tg(Myh11-cre/ERT2)1Soff/J | The Jackson Laboratory | 19079 | smMHC-CRE Mice |
| C57BL/6-Tg(Pdgfra-cre)1Clc/J | The Jackson Laboratory | 13148 | PDGFRa-CRE Mice |
| Cyanoacrylate glue | Amazon | B001PILFVY | For adhering the kidney to the specimen plate |
| Ethanol | Phamco-Aaper | SDA 2B-6 | For dissection |
| Extra-Fine Bonn Scissors | Fine Science Tools | 14083-08 | Used for internal dissecting scissors |
| Fine scissors | Fine Science Tools | 14060-09 | Used for external dissecting scissors |
| Fine-tip forceps | Fine Science Tools | 11254-20 | Used for fine dissection of kidney |
| Gillette Silver Blue double-edge blades | Amazon | B009XHQGYO | For insertion into blade holder of vibratome |
| ImageJ | NIH | For calcium imaging analysis | |
| Isoflurane | Baxter | NDC 1001936060 | For anesthesia |
| Minutien pins | Fisher Scientific | NC9677548 | Pins were cut in half to reduce their length |
| Silicon elastomer | Fisher Scientific | NC9285739 | Sylgard 184 |
| Student Adson Forceps | Fine Science Tools | 91106-12 | For gently holding and moving the kidney |
| Student Dumont Forceps | Fine Science Tools | 91150-20 | Used for internal dissecting forceps |
| Vannas spring scissors | Fine Science Tools | 15000-03 | For sharp dissection and cleanup of isolated kidney |
| Vibrocheck | Leica | 14048142075 | Optional component for calibrating blade movement during cutting |
| VT1200 S Vibrating Blade Microtome | Leica | 14912000001 | Configuration 1 is used in our protocol |
References
- Constantinou, C. E., Djurhuus, J. C. Pyeloureteral dynamics in the intact and chronically obstructed multicalyceal kidney. The American Journal of Physiology. 241 (5), 398-411 (1981).
- Constantinou, C. E., Yamaguchi, O. Multiple-coupled pacemaker system in renal pelvis of the unicalyceal kidney. TheAmerican Journal of Physiology. 241 (5), 412-418 (1981).
- Constantinou, C. E., Hrynczuk, J. R. Urodynamics of the upper urinary tract. Investigative Urology. 14 (3), 233-240 (1976).
- Schmidt-Nielsen, B., Schmidt-Nielsen, B. On the function of the mammalian renal papilla and the peristalsis of the surrounding pelvis. Acta Physiologica. 202 (3), 379-385 (2011).
- Dwyer, T. M., Schmidt-Nielsen, B. The renal pelvis: machinery that concentrates urine in the papilla. Physiology. 18 (1), 1-6 (2003).
- Hill, W. G. Control of urinary drainage and voiding. Clinical Journal of the American Society of Nephrology. 10 (3), 480-492 (2015).
- Brading, A. F. The physiology of the mammalian urinary outflow tract. Experimental Physiology. 84 (1), 215-221 (1999).
- Dixon, J. S., Gosling, J. A. The musculature of the human renal calices, pelvis and upper ureter. Journal of Anatomy. 135, 129-137 (1982).
- Lang, R. J., et al. Pyeloureteric peristalsis: role of atypical smooth muscle cells and interstitial cells of Cajal-like cells as pacemakers. The Journal of Physiology. 576, 695-705 (2006).
- Lang, R. J., Takano, H., Davidson, M. E., Suzuki, H., Klemm, M. F. Characterization of the spontaneous electrical and contractile activity of smooth muscle cells in the rat upper urinary tract. Journal of Urology. 166 (1), 329-334 (2001).
- Lang, R. J., Exintaris, B., Teele, M. E., Harvey, J., Klemm, M. F. Electrical basis of peristalsis in the mammalian upper urinary tract. Clinical and Experimental Pharmacology & Physiology. 25 (5), 310-321 (1998).
- Morita, T., Ishizuka, G., Tsuchida, S. Initiation and propagation of stimulus from the renal pelvic pacemaker in pig kidney. Investigative Urology. 19 (3), 157-160 (1981).
- Tsuchida, S., Morita, T., Harada, T., Kimura, Y. Initiation and propagation of canine renal pelvic peristalsis. Urologia Internationalis. 36 (5), 307-314 (1981).
- Yamaguchi, O. A., Constantinou, C. E. Renal calyceal and pelvic contraction rhythms. American Journal of Physiology - Regulatory Integrative and Comparative Physiology. 257 (4), 788-795 (1989).
- Klemm, M. F., Exintaris, B., Lang, R. J. Identification of the cells underlying pacemaker activity in the guinea-pig upper urinary tract. Journal of Physiology. 519 (3), 867-884 (1999).
- Lang, R. J., et al. Spontaneous electrical and Ca2+ signals in the mouse renal pelvis that drive pyeloureteric peristalsis. Clinical and Experimental Pharmacology & Physiology. 37 (4), 509-515 (2010).
- Lutzeyer, W. Pacemaker process of ureteral peristalsis in multicalyceal kidneys. Urologia Internationalis. 37 (4), 240-246 (1982).
- Lang, R. J., Hashitani, H. Pacemaker mechanisms driving pyeloureteric peristalsis: modulatory role of interstitial cells. Advances in Experimental Medicine and Biology. 1124, 77-101 (2019).
- Hashitani, H., et al. Interstitial cell modulation of pyeloureteric peristalsis in the mouse renal pelvis examined using FIBSEM tomography and calcium indicators. Pflugers Archiv: European Journal of Physiology. 469 (5-6), 797-813 (2017).
- Lang, R. J., Hashitani, H., Tonta, M. A., Suzuki, H., Parkington, H. C. Role of Ca2+ entry and Ca2+ stores in atypical smooth muscle cell autorhythmicity in the mouse renal pelvis. British Journal of Pharmacology. 152 (8), 1248-1259 (2007).
- Lang, R. J., Hashitani, H., Tonta, M. A., Parkington, H. C., Suzuki, H. Spontaneous electrical and Ca2+ signals in typical and atypical smooth muscle cells and interstitial cell of Cajal-like cells of mouse renal pelvis. The Journal of Physiology. 583, 1049-1068 (2007).
- Hashitani, H., Lang, R. J., Mitsui, R., Mabuchi, Y., Suzuki, H. Distinct effects of CGRP on typical and atypical smooth muscle cells involved in generating spontaneous contractions in the mouse renal pelvis. British Journal of Pharmacology. 158 (8), 2030-2045 (2009).
- Iqbal, J., et al. Potassium and ANO1/ TMEM16A chloride channel profiles distinguish atypical and typical smooth muscle cells from interstitial cells in the mouse renal pelvis. British Journal of Pharmacology. 165 (7), 2389-2408 (2012).
- Grainger, N., et al. Identification and classification of interstitial cells in the mouse renal pelvis. Journal of Physiology. 598 (15), 3283-3307 (2020).
- Hashitani, H., Mitsui, R., Lang, R. Functional heterogeneity of PDGFRα (+) cells in spontaneously active urogenital tissues. Neurourology and Urodynamics. 39 (6), 1667-1678 (2020).
- Hashitani, H., Lang, R. J. ATYPICAL or INTERSTITIAL, take your PIC. Journal of Physiology. 598 (15), 3061-3062 (2020).
- Lang, R. J., Hashitani, H., Tonta, M. A., Suzuki, H., Parkington, H. C. Role of Ca2+ entry and Ca2+ stores in atypical smooth muscle cell autorhythmicity in the mouse renal pelvis. British Journal of Pharmacology. 152 (8), 1248-1259 (2007).
- Grundy, D. Principles and standards for reporting animal experiments in The Journal of Physiology and Experimental Physiology. Experimental Physiology. 100 (7), 755-758 (2015).
- Drumm, B. T., Hennig, G. W., Baker, S. A., Sanders, K. M. Applications of spatio-temporal mapping and particle analysis techniques to quantify intracellular Ca 2+ signaling in situ. Journal of Visualized Experiments. 2019 (143), 1-13 (2019).
- Leigh, W. A., et al. A high throughput machine-learning driven analysis of Ca2+ spatio-temporal maps. Cell Calcium. 91, 102260 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved