Method Article
Isolando e Imagens Ao Vivo, Regiões de Marcapasso Intacta da Pelve Renal do Rato por Vibratome Sectioning
Neste Artigo
Resumo
O objetivo deste protocolo é isolar regiões de marca-passo intactas da pelve renal do rato usando seção de vibratome. Essas seções podem então ser usadas para imagens in situ Ca2+ para elucidar propriedades transitórias ca2+ de células marcapassos e outras células intersticiais em fatias de vibratome.
Resumo
A pelve renal (RP) é uma estrutura muscular lisa em forma de funil que facilita o transporte normal de urina do rim para o ureter por contrações regulares e propulsivas. As contrações regulares de RP dependem da atividade do marca-passo, que se origina da região mais proximal do RP na junção pélvis-renal (PKJ). Devido à dificuldade de acesso e preservação de preparações intactas do PKJ, a maioria das investigações sobre o pacemaking de RP se concentrou em eletrofisiologia unicelular e experimentos de imagem Ca2+. Embora revelações importantes sobre o pacemaking RP tenham emergido de tal trabalho, esses experimentos têm várias limitações intrínsecas, incluindo a incapacidade de determinar com precisão a identidade celular em suspensões mistas e a falta de imagens in situ da atividade do marca-passo RP. Esses fatores resultaram em uma compreensão limitada dos mecanismos que estão por trás das contrações normais de RP rítmico. Neste artigo, um protocolo é descrito para preparar segmentos intactos do PKJ do mouse usando uma técnica de secção de vibratome. Combinando essa abordagem com camundongos expressando repórteres específicos de células e indicadores ca2+ geneticamente codificados, os pesquisadores podem ser capazes de estudar com mais precisão os tipos e mecanismos específicos de células responsáveis pelas contrações peristálticas de RP que são vitais para o transporte normal de urina.
Introdução
A pelve renal (RP) é uma estrutura muscular lisa em forma de funil que transporta urina do rim para o ureter. O RP transporta urina gerando contrações rítmica regulares (peristalse)1,2,3,4,5, que impulsiona um bolus de urina do rim distally para o ureter e, finalmente, para a bexiga, onde é armazenado até que ocorra a micturição6,7. A perda dessa atividade regular tem consequências terríveis, incluindo hidronefrose e insuficiência renal1,3,8; portanto, há uma necessidade crítica de estudar os mecanismos subjacentes às contrações regulares e rítmicas de RP. As contrações peristálticas originam-se da região mais proximal da junção pélvis-renal (PKJ)9,10,11,12,13,14,15 (Figura 1A-C) e propagam distalmente para empurrar urina da papila para o RP ( Figura1B). A atividade do marca-passo elétrico é registrada no PKJ como despolarizações transitórias espontâneas10,11,12,13,15,16,17, que são consideradas decorrentes de células-passo especializadas. Acredita-se que essas células marca-passo, antes chamadas de células musculares lisas atípicas (ASMCs), gerem ou coordenem a atividade do marca-passo e conduzam as contrações de células musculares lisas "típicas" (SMCs)9,10,11,18,19,20,21,22,23.
Os ASMCs são mais abundantes no RP proximal, no PKJ (Figura 1A-C),onde contrações peristálticas e atividade de marca-passo elétrico originam-se5,7,8,9,12,13,14,16,17,18,19,20,21 ,22. Um estudo publicado recentemente por este grupo identificou o receptor-alfa do fator de crescimento derivado de plaquetas (PDGFRα), em combinação com a cadeia pesada de miosina muscular lisa (smMHC), como um biomarcador único para essas células intersticiciais (ICs)24, um achado que foi corroborado por outros grupos25. Com base em seu padrão de morfologia e expressão proteica, essas células foram chamadas PDGFRα+ IC tipo 1 (PIC1)24,26. Pic1s residem na camada muscular do PKJ onde exibem transitórios ca2+ de alta frequência, de curta duração, pensados para fundamentar a geração de potenciais marca-passo24. No entanto, existem outros tipos de células no PKJ, incluindo PDGFRα+ ICs (PIC2s) expressos não smMHC na camada adventienta. Relatórios anteriores sugerem que as ICs não-smMHC podem participar da regulamentação da atividade de marca-passo19. No entanto, um estudo mais aprofundado das ICs não-smHC é dificultado pela baixa distinção durante os estudos de imagem ca2+. Normalmente, os tipos de células heterogêneas dentro das preparações de RP são indiscriminadamente carregados com corantes sensíveis ao Ca2+(por exemplo, Fluo-4). Para superar esses desafios e estudar uma variedade de tipos de células no RP, indicadores ca2+ codificados geneticamente podem ser utilizados para expressar seletivamente fluoroforos sensíveis ca2 emtipos de interesse celular.
A maioria dos estudos que elucidam propriedades transitórias Ca2+ em PIC1s/ASMCs foram realizados por meio de preparações de tecido RP de folhas planas de imagem19,21,27. Como pic1s são o único tipo de célula no PKJ para expressar smMHC, a expressão condicional do GECI, GCaMP, em células smMHC+ é apropriada para estudar PIC1s nesta configuração. No entanto, como PIC1s e PIC2s expressam PDGFRα, a expressão condicional das variantes GCaMP em células PDGFRα+ proíbe a distinção celular em preparações de folhas planas. Para contornar essa questão, uma abordagem de seção de vibratome foi usada para distinguir PIC1s e PIC2s através da parede de tecido PKJ24. Para revelar essas populações celulares discretas, o RP foi seccionado coronally, possibilitando identificar PIC2s na adventitia e PIC1s na parede muscular com base na rotulagem imunohistoquímica conhecida e padrões de expressão GECI. Como resultado desta nova abordagem de imagem PKJ, pic1s e PIC2s foram encontrados para exibir distintas propriedades de sinalização Ca2+ 24. Além disso, ao isolar as seções mais proximais da região do PKJ (Figura 2),a região do marca-passo do RP foi preservada de forma que não havia sido realizada anteriormente. Aqui, um protocolo é descrito para mostrar como isolar as preparações de PKJ do rim do rato usando seção de vibratome, como configurar essas preparações para experimentos de imagem Ca2+ e como distinguir os diferentes tipos de células através da parede PKJ.
Protocolo
Todos os camundongos utilizados e os protocolos descritos neste estudo foram de acordo com o Guia Nacional de Saúde para o Cuidado e Uso de Animais de Laboratório, e o Comitê Institucional de Uso e Cuidado animal da Universidade de Nevada, Reno, NV. Experimentos e uso de animais também se conformavam com os princípios e regulamentos descritos por Grundy28.
1. Gerar ratos PDGFRα-GCaMP6f e SMCGCaMP3
- Ratos cross GCaMP6flox/+ (B6; 129S-Gt(ROSA)26Sortm95.1(CAG-GCaMP6f)Hze/J) com ratos PDGFRαCre (C57BL/6-Tg(Pdgfra-cre)1Clc/J) para gerar ratos PDGFRα-GCaMP6f.
- Camundongos Cross GCaMP3lox/+ (B6.129S-Gt(ROSA)26Sortm38(CAG-GCaMP3)Hze/J) com ratos smHCCreERT2 masculino (B6. FVB-Tg(Myh11-cre/ERT2)1Soff/J) para gerar ratos SMC-GCaMP3.
NOTA: Apenas ratos machos da cruz (ratosGCaMP3lox/+ e camundongos smMHCCreERT2) podem ser usados à medida que a expressão Cre é impulsionada do cromossomo Y. os ratos smMHCCreERT2 também podem ser cruzados com ratos GCaMP6flox/+ para melhor relação sinal-ruído Ca2+ e propriedades temporais de sinal Ca2+ mais rápidas.
2. Prepare e injete camundongos transgênicos com tamoxifeno para induzir expressão condicional de GCaMP
- Ative a recombinação de Cre indutível para expressão GCaMP específica de células em tipos de células específicas, como descrito anteriormente29.
3. Preparar soluções
- Prepare 1 L de solução de bicarbonato Krebs-Ringer (KRB) contendo 120,35 mM NaCl, 5,9 mM KCl, 15,5 mM NaHCO3, 1,2 mM Na2HPO4, 1,2 mM MgCl2, 11,5 mM de glicose e 2,5 mM CaCl2. No dia do uso, mantenha a solução KRB no gelo.
NOTA: O KRB pode ser armazenado a 4 °C por até uma semana e deve ser pré-bolhado com uma mistura de 97% O2 e 3% de CO2 por pelo menos 10 minutos antes de usar.
4. Prepare a dissecção revestida de elastômero de silício e pratos de imagem de microscópio
- Misture os componentes do elastômero de silício de acordo com as instruções do fabricante. Encha uma placa de Petri de 35 mm x 10 mm e uma placa de Petri de 60 mm x 15 mm aproximadamente um quarto cheia de elastômero de silício líquido para experimentos de imagem e dissecção, respectivamente. Polímerize o elastômero de silício a 37 °C durante 1 dia antes do uso.
NOTA: Para melhorar o contraste das seções finas dos rins, aplique um pequeno círculo de papel preto na base da placa de Petri de imagem antes de encher com elastômero de silício.
5. Dissecção renal
- Anestesize camundongos por inalação de 3-4% de isoflurano em um capô ventilado. Confirme a indução de anestesia profunda por perda de reflexo de dedo do dedo e/ou pinça da cauda e, em seguida, eutanize os camundongos por deslocamento cervical.
- Aplique 70% de etanol no peito para amortecer a pele. Utilizando uma tesoura de dissecção externa, abra a cavidade abdominal através de uma incisão longitudinal, com lâminas de tesoura anguladas longe do animal para evitar danos aos órgãos internos.
- Usando fórceps internos e tesouras internas de dissecção, belisque os intestinos e levante-os para longe da parede abdominal. Enquanto levanta os intestinos, corte a parte inferior do intestino livre do corpo no duodeno proximal e no cólon distal para ter acesso ao espaço retroperitoneal que contém os rins.
- Uma vez que os rins são expostos, extraia-os individualmente. Belisque suavemente e levante a extremidade distal do ureter (~4mm de distância do rim) com fórceps teciduais. Usando a tesoura de dissecção, corte por baixo do ureter beliscado em direção ao rim. Continue cortando debaixo do rim até que ele se liberte do tecido conjuntivo circundante.
NOTA: Para maximizar a integridade do tecido e a consistência de corte durante a secção do vibratome, o rim deve estar o mais intacto possível. Para garantir isso, evite beliscar ou cortar o rim com fórceps e tesouras de dissecção. - Coloque o rim com ureter anexado na solução KRB gelada. Repita as etapas 5.4 e 5.5 com o rim contralateral. Mantenha os rins na solução KRB no gelo.
NOTA: Prossiga imediatamente para a próxima seção do protocolo para preservar a viabilidade do tecido PKJ. Devido à sua localização anatômica no interior do parênquimo renal, o PKJ é privado de contato com a solução KRB.
6. Prepare o rim para seção de vibratome
- Transfira o rim para um prato de dissecção revestido de elastômero de silício (60 mm x 15 mm), e encha-o com solução de KRB gelada até que o rim esteja completamente submerso.
- Sob um microscópio dissecando, ancorra o rim à base do prato inserindo pinos minutien no ureter proximal e através da fina cápsula renal anterior ou tecido adiposo circundante.
NOTA: Tome cuidado para não perfurar o tecido de parenchyma renal. - Use uma tesoura de mola fina e fórceps internos para remover tecido adiposo da base do rim para expor o RP distal e o ureter proximal.
- Remova o ureter proximal e uma porção do RP distal da base da RP usando uma tesoura de mola fina.
NOTA: Tome cuidado para não cortar o parênquim do rim circundante. A linha tracejada preta na Figura 1A indica a posição aproximada deste corte. Este corte cria uma base plana no rim para seção de tecido mais uniforme. Ao dissecar o rim, deve-se estar atento à posição anatômica da região do PKJ. A Figura 1B mostra que o rim intacto pode ser cortado ao longo de um plano sagital para expor a medula, a papila (medula distal onde os dutos coletores convergem) e rp proximal e distal. Se a papila for exposta completamente, como na Figura 1C, o PKJ e o RP proximal (prox RP) podem ser visualizados. No entanto, isso não deve ser feito para a técnica vibratome; esta descrição é orientar o leitor para a localização PKJ em geral, enfatizada na diferença anatômica mostrada nas imagens de luz transmitidas da região PKJ e região mid-RP na Figura 1D,E. - Fure a cápsula renal externa com fórceps finos, afastando as pontas do corpo dos rins. Usando fórceps com cada mão, aperte as pontas soltas da cápsula e descasque-as. Continue a descascar a membrana restante da cápsula renal até que ela seja totalmente removida.
NOTA: A cápsula renal é uma camada dura e fibrosa que envolve o rim. Deve ser removido antes da seção vibratome para um corte ideal.
7. Prepare e calibra o instrumento vibratome
- Insira uma lâmina de barbear no suporte da lâmina do instrumento vibratome e ajuste o ângulo de desembaraço da lâmina para ~18°.
NOTA: Como um passo opcional para uma seção de maior qualidade, um bloco de calibração (fornecido com alguns instrumentos de vibratome) deve ser usado para ajustar a posição da lâmina para cada nova lâmina usada de acordo com as instruções do fabricante. Isso garantirá o melhor posicionamento da lâmina e minimizará a vibração vertical. - Ajuste a velocidade de avanço da lâmina para 0,2 mm/s, a vibração/sheering horizontal da lâmina para uma amplitude de 2,00 mm, e o tamanho do passo Z da lâmina para ~100-150 μm. Certifique-se de que a espessura da seção renal não exceda 150 μm, pois isso afetará negativamente os experimentos de imagem Ca2+ (porque a parede PKJ muitas vezes rolará e dobrará em si mesma se for muito grossa).
NOTA: O usuário deve ajustar esses parâmetros de corte, pois as configurações variam entre preparações renais individuais e instrumentos vibratome. O ajuste fino deve ocorrer durante a secção quando o usuário pode inspecionar visualmente seções sob um microscópio, conforme descrito na etapa 7.2. - Instale um banho de gelo e uma bandeja de tampão no instrumento vibratome. Encha o banho de gelo com gelo esmagado e encha a área interna do palco com solução KRB gelada (encha aproximadamente meio cheio). Durante a seção vibratome, monitore e substitua o gelo esmagado que derreteu.
8. Vibratome seccionando o rim
- Use fórceps sem corte para agarrar suavemente e remover o rim preparado da solução KRB gelada. Coloque imediatamente o rim em papel absorvente para ~2-4 s para remover o excesso de umidade externa. Role suavemente o rim através do papel absorvente para garantir que todos os lados do parênquim tenham secado para que haja uma ótima adesão do rim ao estágio vibratome.
NOTA: Como o RP está localizado dentro do rim e, portanto, protegido pelo parenchyma externo, este curto período de secagem não seria prejudicial à integridade do tecido. - Aplique imediatamente uma fina camada de cola cianoacrilato (~1 cm2) na base da placa da amostra de vibratome, e use fórceps sem corte para colocar o lado rim, ureter para baixo, na área coberta de cola. Aplique suavemente pressão para baixo na parte superior do rim com a borda plana dos fórceps por aproximadamente 10-20 s para secar a cola.
NOTA: Para estabilizar o rim durante este procedimento, use um par adicional de fórceps para manter o rim ereto à medida que a cola seca. É fundamental que o rim adere à placa da amostra em posição vertical para que as seções sejam cortadas em linha reta. Para garantir que o rim tenha aderido com sucesso à placa da amostra, empurre suavemente o lado do rim. Se o rim tiver aderido com sucesso à placa, a base do rim deve permanecer presa à placa. - Fixar firmemente a placa do espécime na parte inferior da bandeja de tampão. Ajuste o nível da solução KRB para que a parte superior do rim esteja totalmente imersa. Durante as etapas de secção, à medida que a lâmina vibratome se move mais profundamente na bandeja de buffer, remova a solução KRB para que o suporte da lâmina não fique imerso na solução.
NOTA: Se a cola não tiver secado completamente antes de prosseguir com esta etapa, a cola muitas vezes se moverá da base e para o parênquim do rim. Esse excesso de cola tornará a secção mais variável. Se isso acontecer, remova o rim da placa e prossiga com uma preparação renal fresca. - Para seção automática de vibratome, selecione as posições de início e extremidade do ciclo de corte da lâmina vibratome. Verifique se essas posições estão ~0,5-1 cm claras do rim para garantir que, a cada avanço da lâmina, todo o plano renal seja seccionado.
- Prepare uma placa multi-welled (24 ou 48-well) preenchendo poços com solução KRB e coloque a placa no gelo.
NOTA: Quando geradas, seções individuais devem ser colocadas em poços separados para acompanhar a profundidade da seção. - Inicie o processo de corte automático. Durante a passagem inicial da lâmina, certifique-se de que a lâmina faça contato com a parte superior do rim. Se o contato não for feito, ajuste a posição Z inicial da lâmina.
- Usando fórceps, colete seções que são liberadas do rim. Transfira imediatamente as seções para poços individuais e observe a profundidade Z das seções para medir a localização aproximada do PKJ dentro das seções renais.
NOTA: Dependendo dos parâmetros de corte, algumas seções podem não ser cortadas livre do bloco renal. Se isso ocorrer, use cuidadosamente uma tesoura de mola fina para cortar seções do bloco renal. Os usuários também são encorajados a visualizar ativamente seções sob um microscópio leve, enquanto flutuam livremente em poços individuais para garantir configurações de corte ideais e localização do tecido. Seções contendo o PKJ serão tipicamente derivadas ~ 1000-1500 μm do topo do rim. - Continue o protocolo de secção até que as regiões do PKJ se tornem mais aparentes. Consulte a seção de resultados representativos para descrição das regiões do PKJ à medida que a secção prossegue.
- Neste ponto, otimize os parâmetros de secção para garantir que as seções sejam liberadas do bloco renal uniformemente e estejam intactas. Além disso, certifique-se de que as regiões do PKJ sejam contínuas e ininterruptas porque paredes PKJ quebradas não permitirão imagens adequadas de células dentro da parede devido ao colapso. Se as paredes forem quebradas, diminua a velocidade de seção e aumente a espessura da seção e continue a observar seções sob um microscópio leve para ajustar os parâmetros de corte.
- Armazene seções a 4°C na solução KRB até que a experimentação comece.
9. Fatia de rim Ca2+ aquisição de imagem
- Transfira uma fatia de rim individual para um prato de imagem revestido de elastômero de silício (35 mm x 10 mm), e preencha imediatamente o prato com uma solução KRB fresca e gelada.
- Insira pinos minutien ao redor da periferia de uma fatia de rim para fixar a seção na base do prato de imagem.
NOTA: Esta etapa é fundamental para evitar que a seção se mova quando soluções fisiológicas são perfundidas sobre a fatia durante a imagem. - Coloque o prato de imagem no palco de um microscópio confocal de disco giratório vertical e comece imediatamente a perfumar com a solução KRB.
NOTA: Neste protocolo, foi utilizado um microscópio vertical equipado com uma unidade de scanner confocal de disco de alta velocidade Nipkow. - Mantenha a taxa de perfusão em 3 mL/min e a temperatura da solução KRB em 36 ± 1 °C. Antes da imagem, deixe a fatia equilibrar por 1h.
- Selecione o cubo de imagem dicroica apropriado e lasers. Adquira imagens com um dispositivo acoplado a cargas multiplicadora de elétrons (EMCCD) ou câmera científica complementar de óxido de metal-semicondutor.
NOTA: O sistema confocal neste protocolo está equipado com um laser de 488 nm para excitar GCaMP6f ou GCaMP3. As imagens foram adquiridas usando uma câmera EMCCD de 512 pixels x 512 pixels. - Use uma lente objetiva de baixa ampliação e imersão em água (4x ou 10x) para localizar a fatia renal. Centralizar o campo de imagem em áreas da fatia onde o PKJ está presente. Identificar marcos, como descrito na Figura 2D,para localizar o PKJ (ou seja, semicírculos de tecidos musculares suspensos entre tecido paríno).
- Uma vez que o PKJ esteja localizado, use uma lente objetiva de imersão de água de ampliação (20x, 40x ou 60x) para ampliar a área de interesse.
NOTA: Neste protocolo, a abertura numérica objetiva de 20x (NA) foi de 1,0, a NA 40x objetiva foi de 0,8 e a NA objetiva de 60x foi de 1,0. - Distingue diferentes células de interesse na parede PKJ usando camundongos transgênicos expressando GCaMP6f ou GCaMP3 em células PDGFRα+ ou SMCs, respectivamente. Observe os diferentes tipos de durações transitórias ca2+ em células PDGFRα+ na parede PKJ em PDGFRα+ GCaMP6f+ fatias de rim (Figura 3C, ver resultados representativos para descrição) e em GCaMP3+ SMCs em SMC GCaMP3+ fatias de rim(Figura 3D, ver resultados representativos para descrição).
- Uma vez identificadas células de interesse na parede PKJ, ajuste a intensidade do laser para produzir uma boa relação sinal-ruído. Registo de imagens em uma frequência de amostragem temporal entre 16 Hz e 32 Hz usando software de aquisição adequado.
NOTA: Dependendo da intensidade do laser utilizada durante a imagem, recomenda-se limitar o número de gravações devido aos efeitos de branqueamento em ca2+ fluoroforos. O usuário deve escolher o comprimento de gravação com base nos objetivos experimentais específicos.
10. Análise de imagem ca2+
- Realize a análise de imagem Ca2+ de diferentes tipos de células nas regiões do marca-passo PKJ por mapeamento espacial, como descrito anteriormente para outras preparações de marca-passo intactas no trato gastrointestinal29,30.
Resultados
In situ Ca2+ imagens do PKJ podem revelar importante atividade celular de células pacemaker RP. Usando camundongos que expressam indicadores ca2+ geneticamente codificados (como GCaMP), impulsionados por promotores específicos de células, informações sobre o pacemaking de RP podem ser obtidas com precisão e detalhes que não são possíveis a partir de experimentos de imagem Ca2+ a partir de preparações de RP de folhas planas. O início do PKJ é distinguido pelo aparecimento repentino de semi-círculos de músculo suspenso entre tecido parênco renal(Figura 2C; PKJ proximal fechado em caixa tracejada). Durante as rodadas subsequentes de secção, a medula interna torna-se distinguível do tecido cortical circundante. Sob um microscópio leve, a medula interna aparece estriada em regiões, de cor mais clara em comparação com o tecido cortical e descontínua em seu longo eixo com o resto do rim (Figura 2B,D). Neste ponto, mais regiões de PKJ começarão a aparecer. Exemplos disso são mostrados na Figura 2D (retângulos tracejados, H e G) onde 3 semi-círculos de músculo são suspensos por tecido paríno. Estas bandas musculares serão intimamente appostas à papila interna e normalmente vizinham de uma arteriola renal (Figura 2D, retângulos tracejados; Figura 2F-H, pontas de flecha preta). À medida que mais seções distais são derivadas, essas faixas musculares se integrarão para formar uma estrutura mais completa e unificada, indicando o fim da região do PKJ(Figura 2E).
Figura 3A, B mostra uma seção PKJ em baixa potência (4-10x) de um mouse expressando GCaMP em células PDGFRα+ (GCaMP6f expressa por Cre-recombinase indutível impulsionado por Pdgfra). Usando marcos como a arteriola renal (Figura 3A; asterisco), os experimentadores devem ser capazes de distinguir prontamente a fina parede PKJ suspensa entre tecido parenchímico(Figura 3B; asteriscos). A expressão de GCaMP6f neste tecido transgênico específico é espalhada por toda a largura do PKJ, tanto através das camadas musculares quanto aventuradas(Figura 3C).
Em PDGFRα+ GCaMP6f+ fatias de rim, uma rede de células que normalmente se estende sobre a largura da parede PKJ será fluorescente(Figura 3C) e exibirá transitórios ca2+ oscilantes de várias durações e frequências. As células PDGFRα+ na parede PKJ exibem dois tipos diferentes de durações transitórias ca2+. Na camada aventureira (orientada mais próxima do córtex), as células PDGFRα+ presentes como uma rede de células e seus processos são definidos. As células Aveniitial PDGFRα+ apresentam transitórios de baixa frequência (4 ± 2,7 Hz) e de longa duração (1 ± 0,67 s) Ca2+. A segunda camada de células PDGFRα+, presente na camada muscular (orientada mais próxima da medula), exibe frequências e durações transitórias semelhantes como células SMC GCaMP3+ (descritas abaixo) por serem do mesmo tipo de célula.
No SMC GCaMP3+ fatias de rim, uma camada de células GCaMP3+ está presente na camada muscular(Figura 3D). Não haverá sinal fluorescente na camada aventureira(Figura 3D; asterisco). GCaMP3+ SMCs na camada muscular normalmente apresentam transitórios de alta frequência (10 ± 4 Hz) e de curta duração (632 ± 74 s) Ca2+. Células PDGFRα+ localizadas no PKJ adventitia provocam transientes ca2+ de longa duração e baixa frequência(Figura 3E, Vídeo 1). No entanto, os experimentos de imagem Ca2+ do tecido que expressa GCaMP3 impulsionados pelo promotor Myh11 estão restritos ao aspecto muscular do PKJ (Figura 3D). Em comparação com as células PDGFRα+ na adventitia, os SMCs dispararam transicionários ca2+ de menor duração com mais frequência(Figura 3F, Vídeo 2).
Além de entender as propriedades de sinalização em PKJ PDGFRα+ ICs, a aplicação desta técnica para estudar outros tipos de células no rim seccionado de vibratome foi demonstrada neste artigo. Após um exame minucial da medula renal (em camundongos expressando GCaMP6f em células PDGFRα+), observou-se uma matriz de sinais fluorescentes ca2+ dentro e ao redor de dutos coletores(Vídeo 3). Células PDGFRα+ medullary dispararam transitórios espontâneos Ca2+ de frequência e duração variável. Estes estudos de imagem Ca2+ de seções de vibratome renal também poderiam ser expandidos para o estudo de arteriolas renais (~50-80 mm de diâmetro) que muitas vezes vizinhos segmentos musculares PKJ(Figura 2F, G; setas brancas). A imagem de Ca2+ de arterioles renais (de tecido expressando GCaMP em células musculares lisas) demonstra transientes ca2+ oscilantes em SMCs(Vídeo 4).
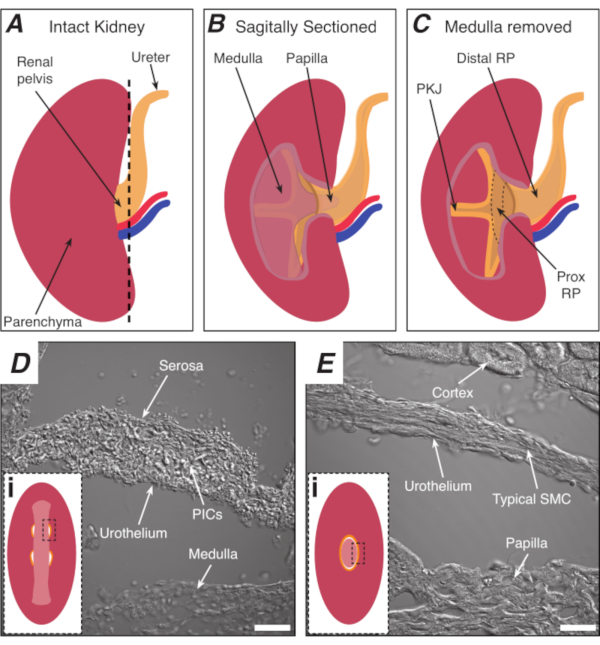
Figura 1: Anatomia renal básica e localização da região do marca-passo PKJ. (A) Diagrama do rim intacto mostrando a orientação do RP e ureter. A artéria renal e a veia renal são exibidas em vermelho e azul, respectivamente. (B) O rim intacto pode ser cortado ao longo de um plano sagital para expor o aspecto interno do rim, incluindo a medula, a papila (medula distal onde os dutos coletores convergem), e rp proximal e distal. (C) A medula e a papila podem ser extirpadas para expor completamente o PKJ e prox RP. (D e E) representam imagens de luz transmitidas da região do marca-passo PKJ e rp distal, respectivamente. A secção sequencial para a extremidade distal da pelve resulta nos semicírculos do músculo na região PKJ(Di)combinando em um anel muscular mais espesso(Ei) que encapsula toda a papila. Retângulos pretos e tracejados em Di e Ei mostram áreas aproximadas em seções de rim coronal onde imagens de luz transmitidas foram adquiridas. Orientação das imagens D e E são 90° no sentido anti-horário para os respectivos insets(Di e Ei). Barras de escala em D e E = 20 μm. Abreviaturas: RP = pélvis renal; prox RP = pélvis renal proximal; PKJ = junção pélvica-renal; PICs = fator de crescimento derivado de plaquetas receptor-alfa-positiva células intersticiais; SMC = célula muscular lisa. Clique aqui para ver uma versão maior desta figura.
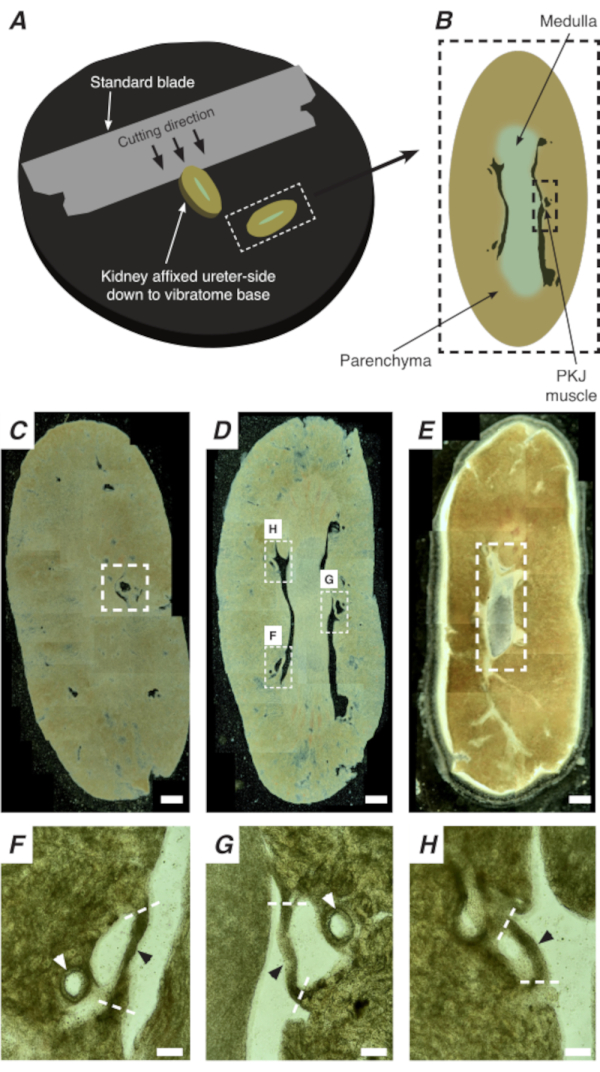
Figura 2: A seção de vibratome de rins inteiros para gerar seções finas. (A) Os rins são montados lado ureter até a base do instrumento vibratome, e uma lâmina padrão (presa à cabeça do vibratome) é usada para cortar seções sequenciais da extremidade proximal e distal do rim. (B) Representação diagramática de uma seção fina cortada de todo o rim com marcos anotados. Segmentos musculares PKJ (retângulo preto) são frequentemente encontrados suspensos entre tecido parênquimo. (C) Imagem microscópica leve de uma seção renal proximal. O aparecimento de faixas musculares suspensas entre tecido parenchímico indica o início das projeções proximais de PKJ (indicadas dentro do retângulo branco tracejado). (D) Imagem microscópica leve representando a região ideal onde podem ser encontrados múltiplos (2-3) segmentos de PKJ (áreas dentro de retângulos brancos). As tiras musculares finas do PKJ são suspensas entre o parenchyma renal e se alinham estreitamente com as artérias renais e a medula. (E) Imagem microscópica leve de uma seção renal distal. Segmentos musculares individuais fundiram-se para formar uma única faixa muscular contínua (retângulo branco tracejado) que envolve a papila interna (não presente nesta imagem). Barras de escala C-E = 500 μm. F-H As regiões ampliadas (20x) do painel D indicam a localização do PKJ (pontas de flecha preta), arterioles renais (pontas de flecha branca) e locais de corte para isolar o PKJ (linhas brancas tracejadas). Barras de escala F-H = 100 μm. Abreviação: PKJ = junção pélvica-renal. Clique aqui para ver uma versão maior desta figura.
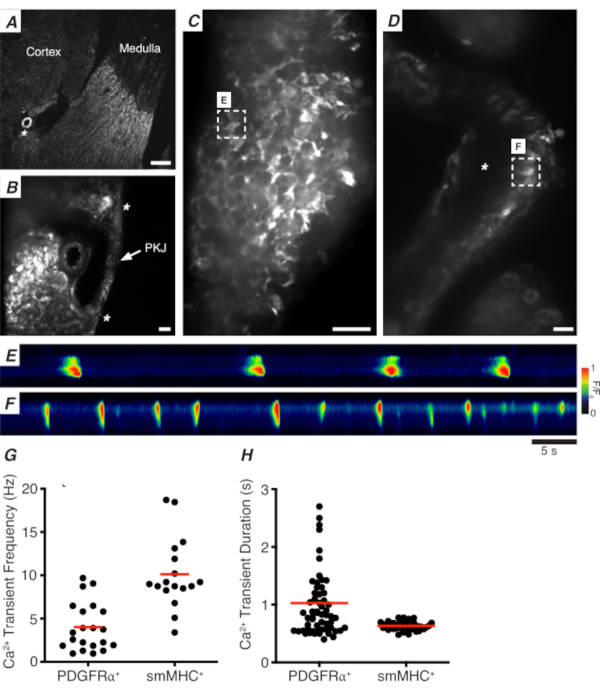
Figura 3: Imagem ca2+ de seções de vibratome. (A) Imagem representativa de baixa potência (4x) de uma seção vibratome denotando a localização da artéria renal (asterisco). Barra de escala = 200 μm. (B) Imagem representativa ampliada (20x) do PKJ (rotulado) suspensa entre tecido parcário renal denotando locais do músculo PKJ (ponta de flecha branca), arteriole renal (asterisco). Barra de escala = 50 μm. (C) Imagem de alta potência (40x) do PKJ expressando GCaMP em células PDGFRα+ . Barra de escala = 20 μm. (D) Imagem de alta potência (20x) do PKJ expressando GCaMP em células musculares lisas. Barra de escala = 20 μm. (E) Mapa espacial de transitórios Ca2+ amostrados de uma célula GCaMP+ PDGFRα+ indicada no painel C. Procure a tabela codificada para F/F0. (F) Mapa espesso de transintes Ca2+ amostrados de uma célula GCaMP+ PDGFRα+ indicada no painel D. Procure a tabela codificada para F/F0. (G) Dados representativos para ca2+ frequência transitória (Hz) para células GCaMP+ PDGFRα+ e células GCaMP+ smMHC. (H) Dados representativos para ca2+ duração transitória (s) para células GCaMP+ PDGFRα+ e células GCaMP+ smMHC. Abreviaturas: PKJ = junção pélvico-renal; PDGFRα+ = fator de crescimento derivado da plaqueta receptor-alfa-positivo; smMHC = músculo liso myosin cadeia pesada. Clique aqui para ver uma versão maior desta figura.
Vídeo 1: Transitórios espontâneos Ca2+ em células GCaMP+ PDGFRα+ em seções de vibratome PKJ. Abreviaturas: PKJ = junção pélvico-renal; PDGFRα+ = fator de crescimento derivado da plaqueta receptor-alfa-positivo. Clique aqui para ver este vídeo. (Clique com o botão direito do download.)
Vídeo 2: Transitórios espontâneos Ca2+ em GCaMP+ células musculares lisas em seções vibratome de junção pélvica-renal. Clique aqui para ver este vídeo. (Clique com o botão direito do download.)
Vídeo 3: Transitórios espontâneos Ca2+ em células GCaMP+ PDGFRα+ em seções de vibratome medular renal. Abreviação: PDGFRα+ = fator de crescimento derivado de plaquetas receptor-alfa-positivo. Clique aqui para ver este vídeo. (Clique com o botão direito do download.)
Vídeo 4: Atividade transitória Ca2+ de baixa amplitude nas seções vibratome da arteriola renal. Clique aqui para ver este vídeo. (Clique com o botão direito do download.)
Discussão
O RP consiste em uma população heterogênea de células com densidades celulares diferenciadas observadas em várias regiões de RP. Pic1s (anteriormente referidos como ASMCs) são mais abundantes no PKJ, onde a atividade do marca-passo se origina24. O protocolo, descrito aqui, permite que os investigadores isolem a região do marca-passo do resto do rim do rato. Ao cortar seções de PKJ usando um vibratome, as regiões de marca-passo do RP (identificadas como faixas musculares ligadas ao parenchyma) são mantidas intactas, permitindo assim o uso de imagens in situ para estudar com precisão células marcapassos RP quando combinadas com repórteres de fluorescência específicas de células.
Embora essa abordagem possa fornecer novas informações sobre o pacemaking de RP, existem algumas considerações com as que os experimentadores devem estar familiarizados para melhorar os resultados de imagem e a eficiência de secção. Para um usuário destreinado, este método de isolamento e imagem PKJ é mais fácil de aprender do que a dissecção afiada típica de preparações de RP de folhas planas. Dissecção acentuada de RP de rins inteiros requer semanas de prática consistente para isolar com sucesso tecidos viáveis para experimentos de fisiologia. Como este protocolo de secção vibratome requer pouco conhecimento de dissecção nítida, é acessível a usuários que não têm experiência em dissecar outras estruturas musculares lisas.
No entanto, há alguns pontos críticos a serem observados para este protocolo. A adesão com sucesso dos rins à placa do espécime vibratome requer destreza e paciência. Se o rim for orientado incorretamente e inclinar-se para um lado, oblíquo em vez de seções retas será cortado. Devido à natureza delicada do PKJ, o ângulo oblíquo pode muitas vezes destruir as faixas musculares da região do marca-passo. Além disso, a imagem de seções oblíquas resulta em má aquisição de imagens, pois as redes celulares não estão tipicamente no mesmo plano focal. O procedimento também é demorado, com a secção de um único rim muitas vezes levando até uma hora para ser concluída, período durante o qual a configuração requer monitoramento.
Enquanto o movimento do vibratome pode ser acelerado, se a velocidade for aumentada demais (>20% do que o recomendado no protocolo), a lâmina vai rasgar em vez de cortar o rim de forma limpa, resultando na perda de delicadas estruturas PKJ. Da mesma forma, uma velocidade de corte muito baixa pode fazer com que a seção fique irregular. A otimização da velocidade de corte e da amplitude da lâmina é essencial. Deve-se também ter cuidado no manuseio de seções vibratome. Devido à sua natureza delicada, os músculos PKJ são facilmente interrompidos durante o manuseio e podem rasgar. Um usuário bem treinado será capaz de colher aproximadamente 1-2 regiões PKJ por 4 fatias de rim que são adequadas para experimentos de imagem Ca2+. Normalmente, seções PKJ que não atendem aos critérios de imagem Ca2+ têm: 1) má expressão GCaMP, 2) uma parede PKJ contorcida, ou 3) uma parede PKJ quebrada. Para análise de dados, aproximadamente 3-4 células por campo de visão (FOV) poderiam ser amostradas.
Embora existam muitas células no FOV das seções PDGFRα-GCaMP6f e SMC-GCaMP3 PKJ, pequenos movimentos teciduais frequentemente excluem as células da análise. Isso geralmente pode ser resolvido aplicando um protocolo de estabilização às imagens. Em condições em que as preparações não se movam, pelo menos 3-5 células podem ser amostradas das seções PDGFRα-GCaMP6f e 5-6 células das seções SMC-GCaMP3. Normalmente, o tempo retirado do sacrifício animal (idade ideal para camundongos é de 8 a 16 semanas) para realizar experimentos de imagem Ca2+ é de 2-3 h, o que é adequado para garantir a integridade do tecido, se os tecidos forem incubados em soluções geladas durante todo o procedimento quando necessário. Em resumo, um protocolo de corte de vibratome foi descrito aqui para gerar preparações intactas das regiões RP PKJ do rim do rato. Esta técnica permite a preservação de regiões de marca-passo RP para estudos de imagem in situ Ca2+ para investigar mecanismos de marca-passo RP.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este projeto foi financiado por R01 DK124509 da NIDDK.
Materiais
| Name | Company | Catalog Number | Comments |
| 24-well culture plate | ThermoFisher Scientific | 142485 | To store kidney slices in |
| 35 mm x 10 mm Petri dishes | Sigma Aldrich | CLS430165 | Kidney slice calcium imaging dish |
| 48-well culture plate | ThermoFisher Scientific | 152640 | To store kidney slices in |
| 60 mm x 15 mm Petri dish | Sigma Aldrich | P5481 | Kidney sharp dissection dish |
| Absorbent paper | Fisher Scientific | 06-666A | To dry the kidney before applying glue |
| B6;129S-Gt(ROSA)26Sor/J | The Jackson Laboratory | 13148 | GCaMP3 Mice |
| B6;129S-Gt(ROSA)26Sor/J | The Jackson Laboratory | 24105 | GCaMP6f Mice |
| B6.FVB-Tg(Myh11-cre/ERT2)1Soff/J | The Jackson Laboratory | 19079 | smMHC-CRE Mice |
| C57BL/6-Tg(Pdgfra-cre)1Clc/J | The Jackson Laboratory | 13148 | PDGFRa-CRE Mice |
| Cyanoacrylate glue | Amazon | B001PILFVY | For adhering the kidney to the specimen plate |
| Ethanol | Phamco-Aaper | SDA 2B-6 | For dissection |
| Extra-Fine Bonn Scissors | Fine Science Tools | 14083-08 | Used for internal dissecting scissors |
| Fine scissors | Fine Science Tools | 14060-09 | Used for external dissecting scissors |
| Fine-tip forceps | Fine Science Tools | 11254-20 | Used for fine dissection of kidney |
| Gillette Silver Blue double-edge blades | Amazon | B009XHQGYO | For insertion into blade holder of vibratome |
| ImageJ | NIH | For calcium imaging analysis | |
| Isoflurane | Baxter | NDC 1001936060 | For anesthesia |
| Minutien pins | Fisher Scientific | NC9677548 | Pins were cut in half to reduce their length |
| Silicon elastomer | Fisher Scientific | NC9285739 | Sylgard 184 |
| Student Adson Forceps | Fine Science Tools | 91106-12 | For gently holding and moving the kidney |
| Student Dumont Forceps | Fine Science Tools | 91150-20 | Used for internal dissecting forceps |
| Vannas spring scissors | Fine Science Tools | 15000-03 | For sharp dissection and cleanup of isolated kidney |
| Vibrocheck | Leica | 14048142075 | Optional component for calibrating blade movement during cutting |
| VT1200 S Vibrating Blade Microtome | Leica | 14912000001 | Configuration 1 is used in our protocol |
Referências
- Constantinou, C. E., Djurhuus, J. C. Pyeloureteral dynamics in the intact and chronically obstructed multicalyceal kidney. The American Journal of Physiology. 241 (5), 398-411 (1981).
- Constantinou, C. E., Yamaguchi, O. Multiple-coupled pacemaker system in renal pelvis of the unicalyceal kidney. TheAmerican Journal of Physiology. 241 (5), 412-418 (1981).
- Constantinou, C. E., Hrynczuk, J. R. Urodynamics of the upper urinary tract. Investigative Urology. 14 (3), 233-240 (1976).
- Schmidt-Nielsen, B., Schmidt-Nielsen, B. On the function of the mammalian renal papilla and the peristalsis of the surrounding pelvis. Acta Physiologica. 202 (3), 379-385 (2011).
- Dwyer, T. M., Schmidt-Nielsen, B. The renal pelvis: machinery that concentrates urine in the papilla. Physiology. 18 (1), 1-6 (2003).
- Hill, W. G. Control of urinary drainage and voiding. Clinical Journal of the American Society of Nephrology. 10 (3), 480-492 (2015).
- Brading, A. F. The physiology of the mammalian urinary outflow tract. Experimental Physiology. 84 (1), 215-221 (1999).
- Dixon, J. S., Gosling, J. A. The musculature of the human renal calices, pelvis and upper ureter. Journal of Anatomy. 135, 129-137 (1982).
- Lang, R. J., et al. Pyeloureteric peristalsis: role of atypical smooth muscle cells and interstitial cells of Cajal-like cells as pacemakers. The Journal of Physiology. 576, 695-705 (2006).
- Lang, R. J., Takano, H., Davidson, M. E., Suzuki, H., Klemm, M. F. Characterization of the spontaneous electrical and contractile activity of smooth muscle cells in the rat upper urinary tract. Journal of Urology. 166 (1), 329-334 (2001).
- Lang, R. J., Exintaris, B., Teele, M. E., Harvey, J., Klemm, M. F. Electrical basis of peristalsis in the mammalian upper urinary tract. Clinical and Experimental Pharmacology & Physiology. 25 (5), 310-321 (1998).
- Morita, T., Ishizuka, G., Tsuchida, S. Initiation and propagation of stimulus from the renal pelvic pacemaker in pig kidney. Investigative Urology. 19 (3), 157-160 (1981).
- Tsuchida, S., Morita, T., Harada, T., Kimura, Y. Initiation and propagation of canine renal pelvic peristalsis. Urologia Internationalis. 36 (5), 307-314 (1981).
- Yamaguchi, O. A., Constantinou, C. E. Renal calyceal and pelvic contraction rhythms. American Journal of Physiology - Regulatory Integrative and Comparative Physiology. 257 (4), 788-795 (1989).
- Klemm, M. F., Exintaris, B., Lang, R. J. Identification of the cells underlying pacemaker activity in the guinea-pig upper urinary tract. Journal of Physiology. 519 (3), 867-884 (1999).
- Lang, R. J., et al. Spontaneous electrical and Ca2+ signals in the mouse renal pelvis that drive pyeloureteric peristalsis. Clinical and Experimental Pharmacology & Physiology. 37 (4), 509-515 (2010).
- Lutzeyer, W. Pacemaker process of ureteral peristalsis in multicalyceal kidneys. Urologia Internationalis. 37 (4), 240-246 (1982).
- Lang, R. J., Hashitani, H. Pacemaker mechanisms driving pyeloureteric peristalsis: modulatory role of interstitial cells. Advances in Experimental Medicine and Biology. 1124, 77-101 (2019).
- Hashitani, H., et al. Interstitial cell modulation of pyeloureteric peristalsis in the mouse renal pelvis examined using FIBSEM tomography and calcium indicators. Pflugers Archiv: European Journal of Physiology. 469 (5-6), 797-813 (2017).
- Lang, R. J., Hashitani, H., Tonta, M. A., Suzuki, H., Parkington, H. C. Role of Ca2+ entry and Ca2+ stores in atypical smooth muscle cell autorhythmicity in the mouse renal pelvis. British Journal of Pharmacology. 152 (8), 1248-1259 (2007).
- Lang, R. J., Hashitani, H., Tonta, M. A., Parkington, H. C., Suzuki, H. Spontaneous electrical and Ca2+ signals in typical and atypical smooth muscle cells and interstitial cell of Cajal-like cells of mouse renal pelvis. The Journal of Physiology. 583, 1049-1068 (2007).
- Hashitani, H., Lang, R. J., Mitsui, R., Mabuchi, Y., Suzuki, H. Distinct effects of CGRP on typical and atypical smooth muscle cells involved in generating spontaneous contractions in the mouse renal pelvis. British Journal of Pharmacology. 158 (8), 2030-2045 (2009).
- Iqbal, J., et al. Potassium and ANO1/ TMEM16A chloride channel profiles distinguish atypical and typical smooth muscle cells from interstitial cells in the mouse renal pelvis. British Journal of Pharmacology. 165 (7), 2389-2408 (2012).
- Grainger, N., et al. Identification and classification of interstitial cells in the mouse renal pelvis. Journal of Physiology. 598 (15), 3283-3307 (2020).
- Hashitani, H., Mitsui, R., Lang, R. Functional heterogeneity of PDGFRα (+) cells in spontaneously active urogenital tissues. Neurourology and Urodynamics. 39 (6), 1667-1678 (2020).
- Hashitani, H., Lang, R. J. ATYPICAL or INTERSTITIAL, take your PIC. Journal of Physiology. 598 (15), 3061-3062 (2020).
- Lang, R. J., Hashitani, H., Tonta, M. A., Suzuki, H., Parkington, H. C. Role of Ca2+ entry and Ca2+ stores in atypical smooth muscle cell autorhythmicity in the mouse renal pelvis. British Journal of Pharmacology. 152 (8), 1248-1259 (2007).
- Grundy, D. Principles and standards for reporting animal experiments in The Journal of Physiology and Experimental Physiology. Experimental Physiology. 100 (7), 755-758 (2015).
- Drumm, B. T., Hennig, G. W., Baker, S. A., Sanders, K. M. Applications of spatio-temporal mapping and particle analysis techniques to quantify intracellular Ca 2+ signaling in situ. Journal of Visualized Experiments. 2019 (143), 1-13 (2019).
- Leigh, W. A., et al. A high throughput machine-learning driven analysis of Ca2+ spatio-temporal maps. Cell Calcium. 91, 102260 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados