Method Article
Vibratom Kesitleme ile Fare Renal Pelvisin Canlı, Sağlam Kalp Pili Bölgelerini İzolasyon ve Görüntüleme
Bu Makalede
Özet
Bu protokolün amacı, vibratom kesitlerini kullanarak fare renal pelvisinin sağlam kalp pili bölgelerini izole etmektir. Bu bölümler daha sonra vibratom dilimlerinde kalp pili hücrelerinin ve diğer geçiş hücrelerinin Ca 2+ geçici özelliklerini aydınlatmak için in situCa 2+ görüntüleme için kullanılabilir.
Özet
Renal pelvis (RP), düzenli, itici kasılmalarla böbrekten üretece normal idrar naklini kolaylaştıran huni şeklinde, düz bir kas yapısıdır. Düzenli RP kasılmaları, pelvis-böbrek kavşağında (PKJ) RP'nin en proksimal bölgesinden kaynaklanan kalp pili aktivitesini denir. PKJ'nin sağlam preparatlarına erişme ve bunları korumadaki zorluk nedeniyle, RP hızlandırma ile ilgili araştırmaların çoğu tek hücreli elektrofizyoloji ve Ca2+ görüntüleme deneylerine odaklanmıştır. RP hızlandırma ile ilgili önemli keşifler bu tür çalışmalardan ortaya çıkmış olsa da, bu deneylerin karışık süspansiyonlarda hücresel kimliğin doğru bir şekilde belirlenememesi ve RP kalp pili aktivitesinin yerinde görüntülenmesinin olmaması da dahil olmak üzere çeşitli içsel sınırlamaları vardır. Bu faktörler, normal ritmik RP kasılmalarının altında yatan mekanizmaların sınırlı bir şekilde anlaşılmasına neden oldu. Bu makalede, vibratom kesit tekniği kullanılarak fare PKJ'nin bozulmamış parçalarını hazırlamak için bir protokol açıklanmıştır. Bu yaklaşımı hücreye özgü muhabirleri ve genetik olarak kodlanmış Ca2+ göstergelerini ifade eden farelerle birleştirerek, araştırmacılar normal idrar nakli için hayati önem taşıyan peristaltik RP kasılmalarından sorumlu spesifik hücre tiplerini ve mekanizmalarını daha doğru bir şekilde inceleyebilirler.
Giriş
Renal pelvis (RP), idrarı böbrekten üretece taşıyan huni şeklinde, düz bir kas yapısıdır. RP, düzenli ritmikkasılmalar (peristalsis) 1,2,3 ,4,5, üretece ve nihayetinde miktürasyon gerçekleşene kadar depolandığı mesaneye bir idrar bolus iterek idrarıtaşır. Bu düzenli aktivitenin kaybı, hidronefroz ve böbrek yetmezliği1,3,8dahil olmak üzere korkunç sonuçlar doğurur; bu nedenle, düzenli, ritmik RP kasılmalarının altında kalan mekanizmaları incelemek için kritik bir ihtiyaç vardır. Peristaltik kasılmalar pelvis-böbrek birleşiminde (PKJ) RP'nin en proksimal bölgesinden kaynaklanır9,10,11,12,13,14,15 ( Şekil1A-C) ve idrarı papilladan RP'ye itmek için distal olarak yayılır ( Şekil1B). Elektriksel kalp pili aktivitesi PKJ'de, özel kalp pili hücrelerinden kaynaklandığı düşünülen spontan geçici depolarizasyonlar10,11,12,13 , 15,16,17olarak kaydedilir. Daha önce atipik düz kas hücreleri (ASMC) olarak adlandırılan bu kalp pili hücrelerinin, kalp pili aktivitesi oluşturduğu veya koordine ettiği ve "tipik" düz kas hücrelerinin (SMC) 9 , 10 , 11,18 , 19,20,21,22,23kasılmalarını yönlendirdiği düşünülmektedir.
ASMC'ler en çok proksimal RP'de, peristaltik kasılmalar ve elektriksel kalp pili aktivitesinin 5 , 7 , 8 ,9,12, 13,14,16,17,18,19,20,21kaynaklı olduğu PKJ'de ( Şekil 1A-C) bol miktardabulunur. ,22. Bu grup tarafından yakın zamanda yayınlanan bir çalışmada, trombosit türevi büyüme faktörü reseptörü-alfa (PDGFRα), düz kas miyosin ağır zinciri (smMHC) ile birlikte, bu geçiş hücreleri (IC)24için benzersiz bir biyobelirteç olarak tanımlanmıştır , diğer gruplar tarafından doğrulanmış bir bulgu25. Morfoloji ve protein ekspresyon modellerine dayanarak, bu hücrelere PDGFRα+ IC tip 1 (PIC1)24,26denirdi. PIC1'ler PKJ'nin kas tabakasında yer almaktadır ve burada kalp pili potansiyellerinin neslinin altında olduğu düşünülen yüksek frekanslı, kısa süreli Ca2+ geçicileri gösterirler24. Bununla birlikte, PKJ'de, macera katmanında smMHC ifade etmeyen PDGFRα+ IC'ler (PIC2'ler) dahil olmak üzere diğer hücre tipleri mevcuttur. Önceki raporlar, smMHC olmayan IC'lerin kalp pili aktivitesinin düzenlenmesine katılabileceğini öne sürtünd19. Bununla birlikte, smMHC olmayan IC'lerin daha fazla incelenmesi, Ca2+ görüntüleme çalışmaları sırasında zayıf ayrım ile engellenmiştir. Tipik olarak, RP preparatları içindeki heterojen hücre tipleri ayrım gözetmeksizin Ca2+duyarlı boyalarla yüklenir (örneğin, Fluo-4). Bu zorlukların üstesinden gelmek ve RP'deki çeşitli hücre tiplerini incelemek için, ca2+ duyarlı floroforları hücre ilgi türlerinde seçici olarak ifade etmek için genetik olarak kodlanmış Ca2+göstergeleri (GECI'ler) kullanılabilir.
PIC1s/ASMC'lerde Ca2+ geçici özelliklerini aydınlatan çalışmaların çoğunluğu düz sayfa RP doku preparatlarının görüntülenmesi ile elde edilmiştir19,21,27. PIC1'ler PKJ'de smMHC'yi ifade eden tek hücre tipi olduğundan, geci, GCaMP'nin smMHC+ hücrelerindeki koşullu ifadesi bu konfigürasyondaki PIC1'leri incelemek için uygundur. Bununla birlikte, PIC1'ler ve PIC2'ler PDGFRα'yı ifade ettikçe, PDGFRα+ hücrelerindeki GCaMP varyantlarının koşullu ifadesi düz sayfa preparatlarında hücre ayrımıyı yasaklar. Bu sorunu atlatmak için, PKJ doku duvarı24boyunca PIC1'leri ve PIC2'leri ayırt etmek için bir vibratom kesitleme yaklaşımı kullanılmıştır. Bu ayrık hücresel popülasyonları ortaya çıkarmak için, RP koronal olarak bölümlendi ve bilinen immünohistokimyasal etiketleme ve GECI ifade kalıplarına dayanarak kas duvarındaki adventitia ve PIC1'lerdeki PIC2'leri tanımlamayı mümkün kıldı. Bu yeni PKJ görüntüleme yaklaşımının bir sonucu olarak, PIC1'lerin ve PIC2'lerin farklı Ca2 + sinyal özellikleri gösterdiği bulunmuştur24. Ayrıca, PKJ bölgesinin en proksimal bölümleri izole ederek (Şekil 2), RP'nin kalp pili bölgesi daha önce gerçekleştirilmemiş bir şekilde korunmuştur. Burada, vibratom kesiti kullanılarak fare böbreği PKJ preparatlarının nasıl izole edilir, Ca2+ görüntüleme deneyleri için bu preparatların nasıl kurulanın ve PKJ duvarı boyunca farklı hücre tiplerinin nasıl ayırt edilir olduğunu gösteren bir protokol açıklanmıştır.
Protokol
Kullanılan tüm fareler ve bu çalışmada açıklanan protokoller, Laboratuvar Hayvanlarının Bakımı ve Kullanımı için Ulusal Sağlık Enstitüleri Rehberi ve Nevada Üniversitesi, Reno, NV'deki Kurumsal Hayvan Kullanımı ve Bakım Komitesi'ne uygundu. Deneyler ve hayvan kullanımı da Grundy28tarafından açıklanan ilke ve yönetmeliklere uygundur.
1. PDGFRα-GCaMP6f ve SMCGCaMP3 fareleri oluşturun
- PDGFRα-GCaMP6f fareleri oluşturmak için PDGFRαCre fareleri(C57BL/6-Tg(Pdgfra-cre)1Clc/J) ile ÇAPRAZ GCaMP6flox/+ fareler (B6; 129S-Gt(ROSA)26Sor tm95.1(CAG-GCaMP6f)Hze /J).
- Çapraz GCaMP3lox/+ fareler (B6.129S-Gt(ROSA)26Sortm38(CAG-GCaMP3)Hze/J) erkek smMHCCreERT2 fareler (B6). SMC-GCaMP3 fareleri oluşturmak için FVB-Tg (Myh11-cre/ERT2)1Soff/J).
NOT: Cre ifadesi Y kromozomundan tahrik edilirken sadece haçın erkek fareleri(GCaMP3lox/+ fareler ve smMHCCreERT2 fareleri) kullanılabilir. smMHCCreERT2 fareler, geliştirilmiş Ca2+ sinyal-gürültü oranı ve daha hızlı Ca 2+ sinyal zamansal özellikleri için GCaMP6flox/+ farelerle de geçilebilir.
2. GCaMP'nin koşullu ifadesini teşvik etmek için transgenik fareleri tamoksifen ile hazırlayın ve enjekte edin
- Daha önce açıklandığı gibi, belirli hücre türlerinde hücreye özgü GCaMP ifadesi için indüküle Cre rekombinazınıetkinleştirin.
3. Çözümler hazırlayın
- 120,35 mM NaCl, 5,9 mM KCl, 15,5 mM NaHCO3,1,2 mM Na 2 HPO4,1,2 mM MgCl2, 11,5 mM glikoz ve 2,5 mM CaCl2içeren1L Krebs-Ringer bikarbonat (KRB) çözeltisi hazırlayın. Kullanım gününde, KRB çözeltisini buz üzerinde koruyun.
NOT: KRB bir haftaya kadar 4 °C'de saklanabilir ve kullanımdan önce en az 10 dakika boyunca% 97 O2 ve% 3 CO2 karışımı ile önceden kabarcıklanmalıdır.
4. Silikon elastomer kaplı diseksiyon ve mikroskop görüntüleme yemekleri hazırlayın
- Silikon elastomer bileşenlerini üreticinin talimatlarına göre karıştırın. Görüntüleme deneyleri ve diseksiyon için sırasıyla 35 mm x 10 mm Petri kabı ve 60 mm x 15 mm Petri kabının yaklaşık dörtte birini sıvı silikon elastomer ile doldurun. Silikon elastomer'i kullanımdan önce 1 gün boyunca 37 °C'de polimerize edin.
NOT: İnce böbrek bölümlerinin kontrastını arttırmak için silikon elastomer ile doldurmadan önce görüntüleme Petri kabının tabanına küçük, siyah bir kağıt çemberi uygulayın.
5. Böbrek diseksiyonu
- Havalandırılmış bir kaputta% 3-4 izofluran soluyarak fareleri uyuşturun. Derin anestezinin indüksiyonunu parmak ve/veya kuyruk sıkışma refleksi kaybı ile onaylayın ve ardından servikal çıkık ile fareleri ötenazileyin.
- Kürkü nemlendirmek için göğsüne% 70 etanol uygulayın. Dış diseksiyon makası kullanarak, iç organların zarar görmesini önlemek için hayvandan uzağa açılı makas bıçakları ile karın boşluğunu uzunlamasına bir kesi ile açın.
- İç doku peripsleri ve iç diseksiyon makası kullanarak bağırsakları çimdikleyin ve karın duvarından uzaklaştırın. Bağırsakları kaldırırken, böbrekleri içeren retroperitoneal alana erişmek için bağırsakların alt kısmını proksimal duodenum ve distal kolonda vücuttan serbest kesin.
- Böbrekler açığa çıktıktan sonra, bunları ayrı ayrı çıkarın. Üretterin distal ucunun (~ böbrekten ~ 4mm uzakta) doku tokmalarıyla hafifçe çimdikleyin ve kaldırın. Diseksiyon makasını kullanarak, sıkışan üretterin altında böbreğe doğru kesin. Çevredeki bağ dokusundan kurtarılana kadar böbreğin altını kesmeye devam edin.
NOT: Vibratom kesiti sırasında doku bütünlüğünü ve kesme kıvamını en üst düzeye çıkarmak için böbrek mümkün olduğunca sağlam olmalıdır. Bunu sağlamak için, böbreğin uzunlatır veya kesilmekten kaçının. - Böbreği bağlı üretter ile buz gibi KRB çözeltisine yerleştirin. Kontrallateral böbrek ile 5.4 ve 5.5 adımlarını tekrarlayın. Böbrekleri buzda KRB çözeltisinde tut.
NOT: PKJ doku canlılığını korumak için hemen protokolün bir sonraki bölümüne geçin. Böbrek parankiminin derinliklerindeki anatomik konumu nedeniyle, PKJ KRB çözeltisi ile temastan mahrumdur.
6. Böbreği vibratom kesiti için hazırlayın
- Böbreği silikon elastomer kaplı bir diseksiyon kabına (60 mm x 15 mm) aktarın ve böbrek tamamen suya batırılana kadar buz gibi KRB çözeltisi ile doldurun.
- Diseksiyon mikroskobu altında, proksimal üretere ve ince ön böbrek kapsülüne veya çevresindeki yağ dokusuna minutien pimleri yerleştirerek böbreği kabın tabanına tutturun.
NOT: Böbrek parenkim dokusunu delmemeye özen edin. - Distal RP ve proksimal üreteri ortaya çıkarmak için böbrek tabanından yağ dokusunu çıkarmak için ince yay makası ve iç toparlama kullanın.
- İnce yay makası kullanarak proksimal üreter ve distal RP'nin bir kısmını RP tabanından çıkarın.
NOT: Çevredeki böbrek polizimini kesmemeye özenin. Şekil 1A'daki siyah kesikli çizgi, bu kesimin yaklaşık konumunu gösterir. Bu kesim, daha düzgün doku kesiği için böbrek üzerinde düz bir taban oluşturur. Böbreği parçalarken, PKJ bölgesinin anatomik konumunun farkında olmak gerekir. Şekil 1B, sağlam böbreğin medulla, papilla (toplama kanallarının birleştiği distal medulla) ve proksimal ve distal RP'yi ortaya çıkarmak için sagittal düzlem boyunca kesilebileceğini göstermektedir. Papilla tamamen açığa çıkarsa, Şekil 1C'deolduğugibi, PKJ ve proksimal RP (prox RP) görselleştirilebilir. Ancak, bu vibratom tekniği için yapılmamalıdır; bu açıklama, PKJ bölgesinin ve Orta RP bölgesinin şekil 1D,E'deki iletilen ışık görüntülerinde gösterilen anatomik farklılıkta vurgulanan okuyucuyu genel olarak PKJ konumunayönlendirmektir. - Dış böbrek kapsülü ince uçlu asalarla delin, uçları böbrek vücudundan uzaklaştırın. Her elinizle kümes uçlarını kullanarak kapsülün gevşek uçlarını kıstırın ve soyun. Kalan renal kapsül membranını tamamen çıkarılana kadar soymaya devam edin.
NOT: Böbrek kapsülü böbreği çevreleyen sert, lifli bir tabakadır. Optimum kesim için vibratom kesiti öncesinde çıkarılmalıdır.
7. Vibratom aletini hazırlayın ve kalibre edin
- Vibratom aletinin bıçak tutucusuna bir jilet yerleştirin ve bıçak temizleme açısını ~18° olarak ayarlayın.
NOT: Daha yüksek kaliteli kesitleme için isteğe bağlı bir adım olarak, üreticinin talimatlarına göre kullanılan her yeni bıçağın bıçak konumunu ayarlamak için bir kalibrasyon bloğu (bazı vibratom aletleri ile birlikte verilir) kullanılmalıdır. Bu, bıçağın optimum şekilde konumlandırılmasını sağlayacak ve dikey titreşimi en aza indirecektir. - Bıçak ilerleme hızını 0,2 mm/s'ye, bıçağın yatay titreşimini/saflığını 2,00 mm'lik bir genlikte ve bıçağın Z-adım boyutunu ~100-150 μm'ye ayarlayın. Böbrek bölümü kalınlığının 150 μm'yi geçmemesini sağlayın, çünkü bu Ca2+ görüntüleme deneylerini olumsuz yönde etkileyecektir (çünkü PKJ duvarı çok kalınsa genellikle kendi üzerine yuvarlanır ve katlanır).
NOT: Ayarlar bireysel böbrek preparatları ve vibratom aletleri arasında değişeceğinden, kullanıcı bu kesme parametrelerine ince ayar yapmalıdır. İnce ayar, kullanıcının 7.2 adımında açıklandığı gibi mikroskop altındaki bölümleri görsel olarak inceleyebildiği bölümleme sırasında gerçekleşmelidir. - Vibratom cihazına bir buz banyosu ve tampon tepsisi takın. Buz banyosunu ezilmiş buzla doldurun ve iç sahne alanını buz gibi KRB çözeltisi ile doldurun (yaklaşık yarı doluya doldurun). Vibratom kesiti sırasında erimiş ezilmiş buzları izleyin ve değiştirin.
8. Böbreğin bölümleme vibratomu
- Hazırlanan böbreği buz gibi KRB çözeltisinden hafifçe kavramak ve çıkarmak için künt uçlu forseps kullanın. Fazla dış nemi gidermek için böbreği hemen ~2-4 s emici kağıda yerleştirin. Parankiminin tüm taraflarının kurumasını sağlamak için böbreği emici kağıt boyunca hafifçe yuvarlayın, böylece böbreğin vibratom aşamasına en uygun şekilde yapıştırılması sağlanır.
NOT: RP böbreğin içinde yer aldığı ve bu nedenle dış parenkim tarafından korunduğu için, bu kısa kuruma süresi doku bütünlüğüne zarar vermeyecektir. - Vibratom numune plakasının tabanına hemen ince bir siyanoakrilat tutkal tabakası (~1 cm2)uygulayın ve böbreği, üreter tarafını tutkalla kaplı alana yerleştirmek için künt uçlu tokalar kullanın. Tutkalın kurutulan yaklaşık 10-20 sn boyunca forsepslerin düz kenarı ile böbreğin üstüne aşağı doğru basınç uygulayın.
NOT: Bu işlem sırasında böbreği stabilize etmek için, tutkal kurudukça böbreği dik tutmak için ek bir çift ön ayak kullanın. Böbreğin numune plakasına dik pozisyonda yapışması, bölümlerin düz kesilmesi için kritik öneme sahiptir. Böbreğin numune plakasına başarıyla yapışmasını sağlamak için, böbreğin yan tarafını hafifçe itin. Böbrek plakaya başarıyla yapışmışsa, böbreğin tabanı plakaya sabitlenmelidir. - Numune plakasını tampon tepsisinin altına sıkıca sabitleyin. KRB çözeltisinin seviyesini, böbreğin üst kısmı tamamen daldırılmış olacak şekilde ayarlayın. Kesit adımları sırasında, vibratom bıçağı tampon tepsisinin daha derinlerine doğru ilerlerken, bıçak tutucunun çözeltiye daldırılmadıkça KRB çözeltisini çıkarın.
NOT: Bu adıma devam etmeden önce tutkal tamamen kurumamışsa, tutkal genellikle tabandan yukarı ve böbrek parenkimine geçer. Bu fazla tutkal kesitleri daha değişken hale getirecektir. Bu olursa, böbreği plakadan çıkarın ve taze bir böbrek hazırlığına devam edin. - Otomatik vibratom kesiti için vibratom bıçağı kesme döngüsünün başlangıç ve bitiş konumlarını seçin. Her bıçak ilerlemesinde tüm böbrek düzleminin kesitli olduğundan emin olmak için bu pozisyonların böbreklerden ~0,5-1 cm temiz olduğunu doğrulayın.
- Kuyuları KRB çözeltisi ile doldurarak çok iyi bir plaka (24 veya 48 kuyu) hazırlayın ve plakayı buza yerleştirin.
NOT: Oluşturulduğunda, bölüm derinliğini takip etmek için ayrı kuyulara ayrı bölümler yerleştirilmelidir. - Otomatik kesme işlemini başlatın. Bıçağın ilk geçişi sırasında, bıçağın böbreğin en üst kısmıyla temas ettiğinden emin olun. Temas kurulmazsa, bıçağın başlangıç Z pozisyonunu ayarlayın.
- Toparlağı kullanarak böbrekten kurtarılan bölümleri toplayın. Bölümleri hemen tek tek kuyulara aktarın ve böbrek bölümlerindeki yaklaşık PKJ konumunu ölçmek için bölümlerin Z derinliğini not edin.
NOT: Kesme parametrelerine bağlı olarak, bazı bölümler böbrek bloğundan kesilmeyebilir. Bu durumda, böbrek bloğundan bölümleri kesmek için dikkatlice ince yay makası kullanın. Kullanıcılar ayrıca, optimum kesim ayarlarını ve doku konumunu sağlamak için tek tek kuyularda serbest yüzerken bölümleri hafif bir mikroskop altında aktif olarak görselleştirmeleri teşvik edilir. PKJ içeren bölümler tipik olarak böbreğin üstünden ~ 1000-1500 μm türetilecektir. - PKJ bölgeleri belirginleşene kadar bölümleme protokolüne devam edin. Bölümleme gelirleri olarak PKJ bölgelerinin açıklaması için temsili sonuçlar bölümüne bakın.
- Bu noktada, bölümlerin böbrek bloğundan eşit şekilde kurtarıldığından ve sağlam olduğundan emin olmak için bölümleme parametrelerini optimize edin. Ayrıca, PKJ bölgelerinin sürekli ve kırılmamış olduğundan emin olun, çünkü kırık PKJ duvarları çökme nedeniyle duvar içindeki hücrelerin yeterli görüntülenmesine izin vermeyecektir. Duvarlar kırılırsa, kesit hızını azaltın ve kesit kalınlığını artırın ve kesme parametrelerine ince ayar yapmak için hafif bir mikroskop altında bölümleri gözlemlemeye devam edin.
- Deneyler başlayana kadar bölümleri KRB çözeltisinde 4°C'de saklayın.
9. Böbrek dilimi Ca2+ görüntü alımı
- Tek bir böbrek dilimini silikon elastomer kaplı bir görüntüleme kabına (35 mm x 10 mm) aktarın ve tabağı hemen taze, buz gibi KRB çözeltisi ile doldurun.
- Bölümü görüntüleme kabının tabanına sabitlemek için böbrek diliminin çevresine minutien pimleri yerleştirin.
NOT: Bu adım, görüntüleme sırasında fizyolojik çözümler dilime perfüzyon edildiğinde bölümün hareket etmesini önlemek için kritik öneme sahiptir. - Görüntüleme kabını dik bir dönen disk konfokal mikroskop sahnesine yerleştirin ve hemen KRB çözeltisi ile perfüzyona başlayın.
NOT: Bu protokolde, yüksek hızlı Nipkow iplik disk konfokal tarayıcı ünitesi ile donatılmış dik bir mikroskop kullanılmıştır. - Perfüzyon oranını 3 mL/dk'da ve KRB çözelti sıcaklığını 36 ± 1 °C'de koruyun. Görüntülemeden önce, dilimin 1 saat boyunca aşındırmasına izin verin.
- Uygun dikroik görüntüleme küpünü ve lazerleri seçin. Elektronla çarpan yük bağlantılı bir cihaz (EMCCD) veya bilimsel tamamlayıcı metal-oksit-yarı iletken kamera ile görüntüler elde edin.
NOT: Bu protokoldeki konfokal sistem, GCaMP6f veya GCaMP3'i heyecanlandırmak için 488 nm lazer ile donatılmıştır. Görüntüler 512 piksel x 512 piksel EMCCD kamera kullanılarak elde edildi. - Böbrek dilimini bulmak için düşük büyütme, suya batırma objektif lensi (4x veya 10x) kullanın. Görüntüleme alanını dilimin PKJ'nin bulunduğu alanlara ortaleyin. PKJ'yi (yani, parenkimal doku arasında asılı kas dokularının yarım dairecikleri) bulmak için Şekil 2D'degösterildiği gibi yer işaretlerini tanımlayın.
- PKJ bulunduktan sonra, ilgi alanını büyütmek için daha yüksek bir büyütme suyu daldırma objektif lensi (20x, 40x veya 60x) kullanın.
NOT: Bu protokolde, 20x objektif sayısal diyafram (NA) 1.0, 40x hedef NA 0.8 ve 60x hedef NA 1.0 idi. - SıRASıYLA PDGFRα+ hücrelerde veya SMC'lerde GCaMP6f veya GCaMP3'ü ifade eden transgenik fareler kullanarak PKJ duvarındaki farklı ilgi hücrelerini ayırt edin. PDGFRα+ GCaMP6f + böbrek dilimlerindeki PKJ duvarındaki PDGFRα + hücrelerde (Şekil 3C,açıklama için temsili sonuçlara bakın) ve SMC GCaMP3 + böbrek dilimlerinde GCaMP3+ SMC'lerde farklı Ca2 + geçici sürelerini gözlemleyin (Şekil 3D, açıklama için temsili sonuçlara bakın).
- PKJ duvarındaki ilgi hücreleri belirlendikten sonra, lazer yoğunluğunu iyi bir sinyal-gürültü oranı sağlamak için ayarlayın. Uygun alım yazılımını kullanarak görüntüleri 16 Hz ile 32 Hz arasında zamansal örnekleme frekansı ile kaydedin.
NOT: Görüntüleme sırasında kullanılan lazer yoğunluğuna bağlı olarak, Ca2+ floroforları üzerindeki ağartma etkileri nedeniyle kayıt sayısının sınırlandırılması önerilir. Kullanıcı, belirli deneysel hedeflere göre kayıt uzunluğunu seçmelidir.
10. Ca2+ görüntüleme analizi
- Gastrointestinal sistemdeki diğer sağlam kalp pili preparatları için daha önce açıklandığı gibi mekansal haritalama ile PKJ kalp pili bölgelerindeki farklı hücre tiplerinin Ca2+ görüntüleme analizini yapın29,30.
Sonuçlar
PKJ'nin yerinde Ca2+ görüntülenmesi, RP kalp pili hücrelerinin önemli hücresel aktivitesini ortaya getirebilir. Hücreye özgü promotörler tarafından yönlendirilen genetik olarak kodlanmış Ca2+ göstergelerini (GCaMP gibi) ifade eden fareler kullanılarak, düz sayfa RP preparatlarından Ca2+ görüntüleme deneylerinden mümkün olmayan doğruluk ve ayrıntı ile RP hızlandırma hakkında bilgi elde edilebilir. PKJ'nin başlangıcı, böbrek parenkimal dokusu arasında askıya alınan kas yarı dairelerinin ani görünümü ile ayırt edilir(Şekil 2C; kesikli kutuya kapatılmış proksimal PKJ). Sonraki kesit turları sırasında, iç medulla çevredeki kortikal dokudan ayırt edilebilir hale gelir. Hafif bir mikroskop altında, iç medulla bölgelerde çizgili, kortikal dokuya göre daha açık renkte ve böbreğin geri kalanıyla uzun ekseninde süreksiz görünür (Şekil 2B,D). Bu noktada, daha fazla PKJ bölgesi görünmeye başlayacaktır. Bunun örnekleri, 3 yarı kas çemberinin parenkimal doku tarafından askıya alındığı Şekil 2D'de (kesikli dikdörtgenler, H ve G) gösterilmiştir. Bu kas bantları iç papillaya yakından uygulanacak ve tipik olarak bir renal arteriye komşu olacaktır (Şekil 2D, kesikli dikdörtgenler; Şekil 2F-H, siyah ok uçları). Daha fazla distal bölüm türetildikçe, bu kas bantları PKJ bölgesinin sonunu gösteren daha eksiksiz, birleşik bir yapı oluşturmak için entegre olacaktır (Şekil 2E).
Şekil 3A,B, PDGFRα+ hücrelerinde GCaMP'yi ifade eden bir fareden düşük güçte (4-10x) bir PKJ bölümünü gösterir (Pdgfratarafından yönlendirilen indüküle Cre-recombinaz ile ifade edilen GCaMP6f). Renal arteriole (Şekil 3A; yıldız işareti) gibi yer işaretlerini kullanarak, deneyciler parankimal doku arasında asılı ince PKJ duvarını kolayca ayırt edebilmelidir (Şekil 3B; yıldız işaretleri). Bu spesifik transgenik dokuda GCaMP6f ifadesi PKJ'nin tüm genişliğine, hem kas hem de macera katmanları boyunca yayılır (Şekil 3C).
PDGFRα+ GCaMP6f+ böbrek dilimlerinde, tipik olarak PKJ duvarının genişliğine uzanan bir hücre ağı floresan olacaktır (Şekil 3C) ve çeşitli süre ve frekanslarda salınımlı Ca2 + geçicileri gösterecektir. PKJ duvarındaki PDGFRα+ hücreleri iki farklı Ca2+ geçici süre tipi görüntüler. Adventitial tabakada (kortekse daha yakın yönlendirilmiş), PDGFRα+ hücreleri bir hücre ağı olarak bulunur ve süreçleri tanımlanır. Adventitial PDGFRα+ hücreleri düşük frekanslı (4 ± 2.7 Hz) ve uzun süreli (1 ± 0.67 s) Ca2+ geçicidir. Kas tabakasında bulunan PDGFRα+ hücrelerinin ikinci tabakası (medullaya daha yakın yönlendirilmiş), aynı hücre tipi oldukları için SMC GCaMP3 + hücreleri (aşağıda açıklanan) ile benzer Ca2 + geçici frekansları ve süreleri sergiler.
SMC GCaMP3+ böbrek dilimlerinde, kas tabakasında bir GCaMP3+ hücre tabakası bulunur (Şekil 3D). Adventitial katmanda floresan sinyal olmayacaktır(Şekil 3D; yıldız işareti). Kas tabakasındaki GCaMP3+ SMC'ler tipik olarak yüksek frekanslı (10 ± 4 Hz) ve kısa süreli (632 ± 74 s) Ca2+ geçicidir. PDGFRα+ PKJ adventitia'da bulunan hücreler uzun süreli, düşük frekanslı Ca2+ geçicileri ortaya çıkarır (Şekil 3E, Video 1). Bununla birlikte, Myh11 promotörü tarafından yönlendirilen GCaMP3'ü ifade eden dokudan Ca2+ görüntüleme deneyleri PKJ'nin kas yönüyle sınırlıdır (Şekil 3D). Adventitia'daki PDGFRα+ hücreleri ile karşılaştırıldığında, SMC'ler daha kısa süreli Ca2 + geçicileri daha sık ateşledi (Şekil 3F, Video 2).
PKJ PDGFRα+ IC'lerdeki sinyal özelliklerini anlamanın yanı sıra, bu tekniğin vibratom kesitli böbrekteki diğer hücre tiplerini incelemek için uygulanması bu makalede gösterilmiştir. Renal medullanın (PDGFRα+ hücrelerde GCaMP6f'yi ifade eden farelerde) yakından incelenmesi üzerine, toplama kanalları içinde ve çevresinde bir dizi floresan Ca2+ sinyali gözlendi (Video 3). Medüller PDGFRα+ hücreler değişken frekans ve sürenin spontan Ca2+ geçicilerini ateşledi. Böbrek vibratom bölümlerinin bu Ca2+ görüntüleme çalışmaları, genellikle PKJ kas segmentlerine komşu olan renal arteriyolların (~50-80 mm çapı) incelenmesine de genişletilebilir(Şekil 2F,G; beyaz oklar). Renal arteriyüllerin Ca2+ görüntülemesi (düz kas hücrelerinde GCaMP'yi ifade eden dokudan) SMC'lerde Salınımlı Ca2+ geçicilerini göstermektedir (Video 4).
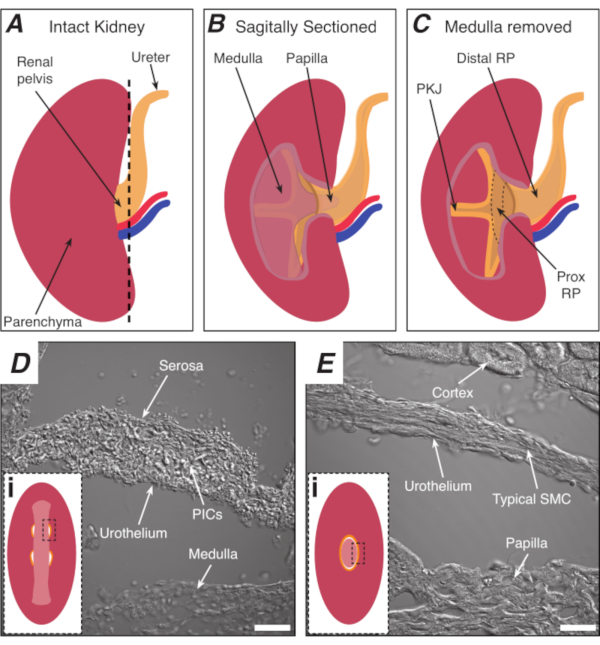
Şekil 1: Temel böbrek anatomisi ve PKJ kalp pili bölgesinin yeri. (A) RP ve üretterin yönünü gösteren sağlam böbreğin şeması. Renal arter ve renal damar sırasıyla kırmızı ve mavi olarak görüntülenir. (B) Sağlam böbrek, medulla, papilla (kanalların toplandığı distal medulla) ve proksimal ve distal RP dahil olmak üzere böbreğin iç yönünü açığa çıkarmak için sagittal düzlem boyunca kesilebilir. (C) Medulla ve papilla, PKJ ve prox RP'yi tamamen açığa çıkarmak için ekscislenebilir. (D ve E) sırasıyla PKJ kalp pili bölgesinden ve distal RP'den iletilen ışık görüntülerini temsil eder. Pelvis distal ucuna doğru sıralı kesit, PKJ bölgesindeki(Di)kas yarım dairelerinin tüm papillayı kaplayan daha kalın kas halkasında(Ei) birleşmesi ile sonuçlanır. Di ve Ei'deki siyah, kesikli dikdörtgenler, bulaşan ışık görüntülerinin elde edildiği koronal böbrek bölümlerinde yaklaşık alanları göstermektedir. D ve E görüntülerinin yönü, ilgili insets(Di ve Ei)için saat yönünün 90°'dir. Ölçek çubukları D ve E = 20 μm. Kısaltmalar: RP = renal pelvis; prox RP = proksimal renal pelvis; PKJ = pelvik-böbrek birleşim; PIC'ler = trombosit türevli büyüme faktörü reseptörü-alfa-pozitif geçiş hücreleri; SMC = düz kas hücresi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
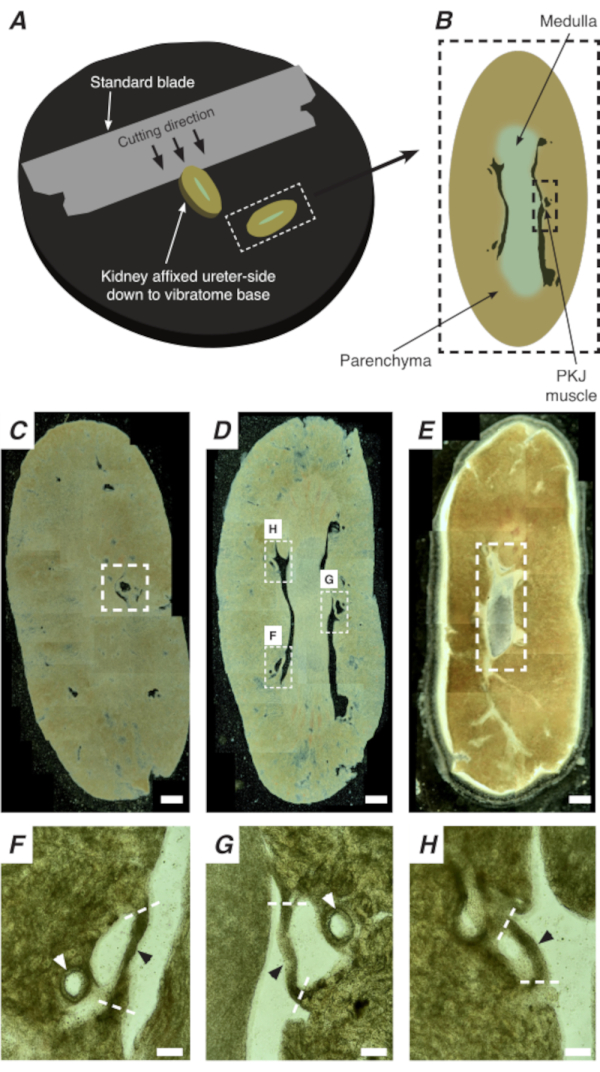
Şekil 2: İnce kesitler oluşturmak için tüm böbreklerin vibratom kesiti. (A) Böbrekler vibratom aletinin tabanına kadar üreter tarafına monte edilir ve böbreğin proksimalden distal ucuna sıralı bölümleri kesmek için standart bir bıçak (vibratom kafasına bağlı) kullanılır. (B) Açıklamalı yer işaretleri ile tüm böbrek kesilmiş ince bir bölümün diyagramsal gösterimi. PKJ kas segmentleri (siyah kesikli dikdörtgen) genellikle parenkimal doku arasında asılı bulunur. (C) Proksimal böbrek bölümünün hafif mikroskobik görüntüsü. Parinkimal doku arasında askıya alınan kas bantlarının görünümü proksimal PKJ projeksiyonlarının başlangıcını gösterir (beyaz kesikli dikdörtgenin içinde belirtilir). (D) Birden fazla (2-3) PKJ segmentinin bulunabileceği en uygun bölgeyi temsil eden hafif mikroskobik görüntü (beyaz kesikli dikdörtgenler içindeki alanlar). İnce PKJ kas şeritleri böbrek parenkim arasında askıya alınır ve böbrek arteriyülleri ve medulla ile yakından hizalanır. (E) Distal böbrek bölümünün hafif mikroskobik görüntüsü. Bireysel kas segmentleri, iç papillayı çevreleyen (bu görüntüde bulunmayan) tek, sürekli bir kas bandı (beyaz kesikli dikdörtgen) oluşturmak için birleşti. C -E = 500 μm. Fölçek çubukları-D panelindenH Yakınlaştırılmış (20x) bölgeler PKJ'nin (siyah ok uçları), renal arteriollerin (beyaz ok uçları) ve PKJ'yi izole etmek için kesilmiş bölgelerin (kesik beyaz çizgiler) konumunu gösterir. Ölçek çubukları F-H = 100 μm. Kısaltma: PKJ = pelvik-böbrek birleşimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
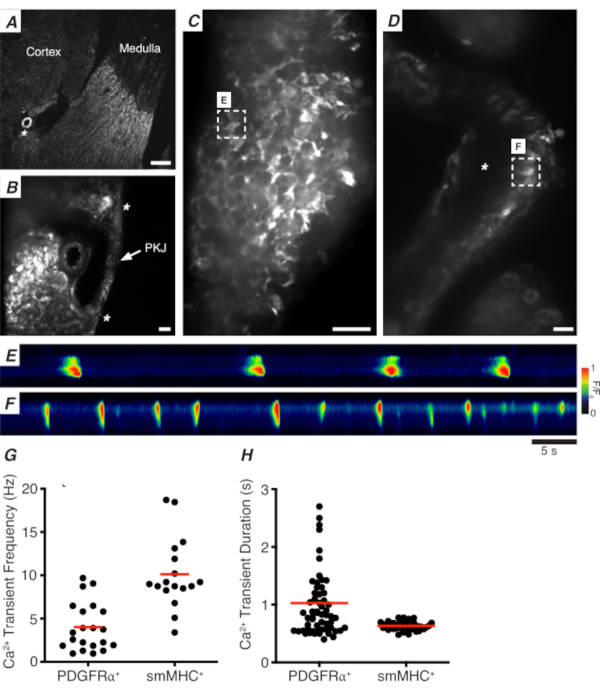
Şekil 3: Vibratom bölümlerinin ca2+ görüntülenmesi. (A) Renal arterikülün (yıldız işareti) yerini gösteren vibratom bölümünün temsili düşük güçlü görüntüsü (4x). Ölçek çubuğu = 200 μm. (B) PKJ kasının (beyaz ok ucu), renal arteriole (yıldız işareti) konumlarını gösteren böbrek parinkimal doku deteleme yerleri arasında asılı PKJ 'nin (etiketli) yakınlaştırılmış (20x) temsili görüntüsü. Ölçek çubuğu = 50 μm. (C) PDGFRα+ hücrelerde GCaMP'yi ifade eden PKJ'nin yüksek güçlü (40x) görüntüsü. Ölçek çubuğu = 20 μm. (D) PKJ'nin düz kas hücrelerinde GCaMP'yi ifade eden yüksek güçlü (20x) görüntüsü. Ölçek çubuğu = 20 μm. (E) Cpanelinde belirtilen bir GCaMP+ PDGFRα + hücresinden örneklenen Ca2 + geçicilerinin mekansal haritası. F/F0için kodlanmış tabloyu arayın. (F) Dpanelinde belirtilen bir GCaMP + PDGFRα+ hücresinden örneklenen Ca2 + geçicilerinin mekansal haritası. F/F0için kodlanmış tabloyu arayın. (G) GCaMP + PDGFRα + hücreleri ve GCaMP+ smMHC hücreleri için Ca2+ geçici frekans (Hz) için temsili veriler. (H) GCaMP + PDGFRα + hücreleri ve GCaMP+ smMHC hücreleri için Ca 2+ geçici süre (ler) için temsili veriler. Kısaltmalar: PKJ = pelvik-böbrek birleşimi; PDGFRα+ = trombosit türevi büyüme faktörü reseptörü-alfa-pozitif; smMHC = düz kas miyozin ağır zincir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Video 1: GCaMP + PDGFRα+ PKJ vibratom bölümlerindeki hücrelerde spontan Ca2+ geçicidir. Kısaltmalar: PKJ = pelvik-böbrek birleşimi; PDGFRα+ = trombosit türevi büyüme faktörü reseptörü-alfa-pozitif. Bu videoyu görüntülemek için lütfen tıklayınız. (İndirmek için sağ tıklatın.)
Video 2: GCaMP'de spontan Ca2+ geçici + pelvik-böbrek birleşim vibratom bölümlerinde düz kas hücreleri. Bu videoyu görüntülemek için lütfen tıklayınız. (İndirmek için sağ tıklatın.)
Video 3: GCaMP + PDGFRα+ hücrelerde renal medüller vibratom bölümlerinde spontan Ca2+ geçicidir. Kısaltma: PDGFRα+ = trombosit türevi büyüme faktörü reseptörü-alfa-pozitif. Bu videoyu görüntülemek için lütfen tıklayınız. (İndirmek için sağ tıklatın.)
Video 4: Renal arteriolün vibratom bölümlerinde düşük genlikli Ca2+ geçici aktivite. Bu videoyu görüntülemek için lütfen tıklayınız. (İndirmek için sağ tıklatın.)
Tartışmalar
RP, çeşitli RP bölgelerinde gözlenen diferansiyel hücre yoğunluklarına sahip heterojen bir hücre popülasyonundan oluşur. PIC1'ler (daha önce ASMC olarak adlandırılır) kalp pili aktivitesinin24'e kaynaklandığı PKJ'de en bol miktarda bulunur. Burada açıklanan protokol, müfettişlerin kalp pili bölgesini fare böbreğinin geri kalanından izole etmelerine izin veriyor. Bir vibratom kullanarak PKJ'nin bölümlerini keserek, RP'nin kalp pili bölgeleri (parankime bağlı kas bantları olarak tanımlanır) bozulmadan tutulur, böylece hücreye özgü floresan muhabirleri ile birleştirildiğinde RP kalp pili hücrelerini doğru bir şekilde incelemek için yerinde görüntülemenin kullanımını sağlar.
Bu yaklaşım RP hızlandırma hakkında yeni içgörüler sağlayabilir, ancak deneycilerin görüntüleme sonuçlarını ve bölümleme verimliliğini artırmak için aşina olmaları gereken bazı hususlar vardır. Eğitimsiz bir kullanıcı için, bu PKJ yalıtım ve görüntüleme yöntemini öğrenmek, düz sayfa RP preparatlarının tipik keskin diseksiyonuna göre daha kolaydır. RP'nin tüm böbreklerden keskin bir şekilde diseksiyonu, fizyoloji deneyleri için canlı dokuları başarıyla izole etmek için haftalarca tutarlı bir uygulama gerektirir. Bu vibratom kesit protokolü çok az keskin diseksiyon bilgisi gerektirdiği için, diğer düz kas yapılarını parçalama deneyimi olmayan kullanıcılar tarafından erişilebilir.
Ancak, bu protokol için dikkat etmesi gereken bazı kritik noktalar vardır. Böbrekleri vibratom numune plakasına başarıyla bağlı kalmak el becerisi ve sabır gerektirir. Böbrek yanlış yönlendirilirse ve bir tarafa yaslanırsa, düz kesitler yerine eğik kesilir. PKJ'nin hassas doğası nedeniyle, eğik açı genellikle kalp pili bölgesinin kas bantlarını tahrip edebilir. Ayrıca, eğik bölümlerin görüntülenmesi, hücre ağları genellikle aynı odak düzleminde olmadığı için kötü görüntüleme alımına neden olur. Prosedür aynı zamanda zaman alıcıdır, tek bir böbreğin bölümlenmesi genellikle tamamlanması bir saat kadar sürer ve bu süre zarfında kurulum izleme gerektirir.
Vibratonun hareketi hızlandırılabilirken, hız çok fazla artırılırsa (protokolde önerilenden >20%), bıçak böbreği temiz bir şekilde kesmek yerine parçalanır ve hassas PKJ yapılarının kaybına neden olur. Benzer şekilde, çok düşük bir kesme hızı bölümün pürüzlü olmasına neden olabilir. Kesme hızı ve bıçak genliğinin optimizasyonu esastır. Vibratom bölümlerinin işlenmesine de dikkat edilmelidir. Hassas doğası nedeniyle, PKJ kasları yol tutuş sırasında kolayca bozulur ve yırtılabilir. İyi eğitimli bir kullanıcı, Ca 2+ görüntüleme deneyleri için uygun olan 4 böbrek dilimi başına yaklaşık1-2 PKJ bölgesi hasat edebilecektir. Tipik olarak, Ca2+ görüntüleme kriterlerini karşılamayan PKJ bölümleri şunları içerir: 1) zayıf GCaMP ifadesi, 2) contorted PKJ duvarı veya 3) kırık bir PKJ duvarı. Veri analizi için görüş alanı başına yaklaşık 3-4 hücre (FOV) örneklenebilir.
PDGFRα-GCaMP6f ve SMC-GCaMP3 PKJ bölümlerinin FOV'unda birçok hücre bulunurken, küçük doku hareketleri genellikle hücreleri analizden dışlar. Bu genellikle görüntülere bir sabitleme protokolü uygulanarak çözülebilir. Preparatların hareket etmediği koşullarda PDGFRα-GCaMP6f bölümlerinden en az 3-5 hücre, SMC-GCaMP3 bölümlerinden ise 5-6 hücre örneklenebilir. Tipik olarak, hayvan kurban etme (fareler için optimum yaş 8-16 haftadır) Ca2+ görüntüleme deneylerinin yapılmasına kadar geçen süre, dokular gerektiğinde işlem boyunca buz gibi çözeltilerde inkübe edilirse, doku bütünlüğünü sağlamak için yeterli olan 2-3 saattir. Özetle, fare böbreği RP PKJ bölgelerinin sağlam preparatlarını oluşturmak için burada bir vibratom kesme protokolü tanımlanmıştır. Bu teknik, RP kalp pili mekanizmalarını araştırmak için in situ Ca2+ görüntüleme çalışmaları için RP kalp pili bölgelerinin korunmasını sağlar.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu proje NIDDK'dan R01 DK124509 tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 24-well culture plate | ThermoFisher Scientific | 142485 | To store kidney slices in |
| 35 mm x 10 mm Petri dishes | Sigma Aldrich | CLS430165 | Kidney slice calcium imaging dish |
| 48-well culture plate | ThermoFisher Scientific | 152640 | To store kidney slices in |
| 60 mm x 15 mm Petri dish | Sigma Aldrich | P5481 | Kidney sharp dissection dish |
| Absorbent paper | Fisher Scientific | 06-666A | To dry the kidney before applying glue |
| B6;129S-Gt(ROSA)26Sor/J | The Jackson Laboratory | 13148 | GCaMP3 Mice |
| B6;129S-Gt(ROSA)26Sor/J | The Jackson Laboratory | 24105 | GCaMP6f Mice |
| B6.FVB-Tg(Myh11-cre/ERT2)1Soff/J | The Jackson Laboratory | 19079 | smMHC-CRE Mice |
| C57BL/6-Tg(Pdgfra-cre)1Clc/J | The Jackson Laboratory | 13148 | PDGFRa-CRE Mice |
| Cyanoacrylate glue | Amazon | B001PILFVY | For adhering the kidney to the specimen plate |
| Ethanol | Phamco-Aaper | SDA 2B-6 | For dissection |
| Extra-Fine Bonn Scissors | Fine Science Tools | 14083-08 | Used for internal dissecting scissors |
| Fine scissors | Fine Science Tools | 14060-09 | Used for external dissecting scissors |
| Fine-tip forceps | Fine Science Tools | 11254-20 | Used for fine dissection of kidney |
| Gillette Silver Blue double-edge blades | Amazon | B009XHQGYO | For insertion into blade holder of vibratome |
| ImageJ | NIH | For calcium imaging analysis | |
| Isoflurane | Baxter | NDC 1001936060 | For anesthesia |
| Minutien pins | Fisher Scientific | NC9677548 | Pins were cut in half to reduce their length |
| Silicon elastomer | Fisher Scientific | NC9285739 | Sylgard 184 |
| Student Adson Forceps | Fine Science Tools | 91106-12 | For gently holding and moving the kidney |
| Student Dumont Forceps | Fine Science Tools | 91150-20 | Used for internal dissecting forceps |
| Vannas spring scissors | Fine Science Tools | 15000-03 | For sharp dissection and cleanup of isolated kidney |
| Vibrocheck | Leica | 14048142075 | Optional component for calibrating blade movement during cutting |
| VT1200 S Vibrating Blade Microtome | Leica | 14912000001 | Configuration 1 is used in our protocol |
Referanslar
- Constantinou, C. E., Djurhuus, J. C. Pyeloureteral dynamics in the intact and chronically obstructed multicalyceal kidney. The American Journal of Physiology. 241 (5), 398-411 (1981).
- Constantinou, C. E., Yamaguchi, O. Multiple-coupled pacemaker system in renal pelvis of the unicalyceal kidney. TheAmerican Journal of Physiology. 241 (5), 412-418 (1981).
- Constantinou, C. E., Hrynczuk, J. R. Urodynamics of the upper urinary tract. Investigative Urology. 14 (3), 233-240 (1976).
- Schmidt-Nielsen, B., Schmidt-Nielsen, B. On the function of the mammalian renal papilla and the peristalsis of the surrounding pelvis. Acta Physiologica. 202 (3), 379-385 (2011).
- Dwyer, T. M., Schmidt-Nielsen, B. The renal pelvis: machinery that concentrates urine in the papilla. Physiology. 18 (1), 1-6 (2003).
- Hill, W. G. Control of urinary drainage and voiding. Clinical Journal of the American Society of Nephrology. 10 (3), 480-492 (2015).
- Brading, A. F. The physiology of the mammalian urinary outflow tract. Experimental Physiology. 84 (1), 215-221 (1999).
- Dixon, J. S., Gosling, J. A. The musculature of the human renal calices, pelvis and upper ureter. Journal of Anatomy. 135, 129-137 (1982).
- Lang, R. J., et al. Pyeloureteric peristalsis: role of atypical smooth muscle cells and interstitial cells of Cajal-like cells as pacemakers. The Journal of Physiology. 576, 695-705 (2006).
- Lang, R. J., Takano, H., Davidson, M. E., Suzuki, H., Klemm, M. F. Characterization of the spontaneous electrical and contractile activity of smooth muscle cells in the rat upper urinary tract. Journal of Urology. 166 (1), 329-334 (2001).
- Lang, R. J., Exintaris, B., Teele, M. E., Harvey, J., Klemm, M. F. Electrical basis of peristalsis in the mammalian upper urinary tract. Clinical and Experimental Pharmacology & Physiology. 25 (5), 310-321 (1998).
- Morita, T., Ishizuka, G., Tsuchida, S. Initiation and propagation of stimulus from the renal pelvic pacemaker in pig kidney. Investigative Urology. 19 (3), 157-160 (1981).
- Tsuchida, S., Morita, T., Harada, T., Kimura, Y. Initiation and propagation of canine renal pelvic peristalsis. Urologia Internationalis. 36 (5), 307-314 (1981).
- Yamaguchi, O. A., Constantinou, C. E. Renal calyceal and pelvic contraction rhythms. American Journal of Physiology - Regulatory Integrative and Comparative Physiology. 257 (4), 788-795 (1989).
- Klemm, M. F., Exintaris, B., Lang, R. J. Identification of the cells underlying pacemaker activity in the guinea-pig upper urinary tract. Journal of Physiology. 519 (3), 867-884 (1999).
- Lang, R. J., et al. Spontaneous electrical and Ca2+ signals in the mouse renal pelvis that drive pyeloureteric peristalsis. Clinical and Experimental Pharmacology & Physiology. 37 (4), 509-515 (2010).
- Lutzeyer, W. Pacemaker process of ureteral peristalsis in multicalyceal kidneys. Urologia Internationalis. 37 (4), 240-246 (1982).
- Lang, R. J., Hashitani, H. Pacemaker mechanisms driving pyeloureteric peristalsis: modulatory role of interstitial cells. Advances in Experimental Medicine and Biology. 1124, 77-101 (2019).
- Hashitani, H., et al. Interstitial cell modulation of pyeloureteric peristalsis in the mouse renal pelvis examined using FIBSEM tomography and calcium indicators. Pflugers Archiv: European Journal of Physiology. 469 (5-6), 797-813 (2017).
- Lang, R. J., Hashitani, H., Tonta, M. A., Suzuki, H., Parkington, H. C. Role of Ca2+ entry and Ca2+ stores in atypical smooth muscle cell autorhythmicity in the mouse renal pelvis. British Journal of Pharmacology. 152 (8), 1248-1259 (2007).
- Lang, R. J., Hashitani, H., Tonta, M. A., Parkington, H. C., Suzuki, H. Spontaneous electrical and Ca2+ signals in typical and atypical smooth muscle cells and interstitial cell of Cajal-like cells of mouse renal pelvis. The Journal of Physiology. 583, 1049-1068 (2007).
- Hashitani, H., Lang, R. J., Mitsui, R., Mabuchi, Y., Suzuki, H. Distinct effects of CGRP on typical and atypical smooth muscle cells involved in generating spontaneous contractions in the mouse renal pelvis. British Journal of Pharmacology. 158 (8), 2030-2045 (2009).
- Iqbal, J., et al. Potassium and ANO1/ TMEM16A chloride channel profiles distinguish atypical and typical smooth muscle cells from interstitial cells in the mouse renal pelvis. British Journal of Pharmacology. 165 (7), 2389-2408 (2012).
- Grainger, N., et al. Identification and classification of interstitial cells in the mouse renal pelvis. Journal of Physiology. 598 (15), 3283-3307 (2020).
- Hashitani, H., Mitsui, R., Lang, R. Functional heterogeneity of PDGFRα (+) cells in spontaneously active urogenital tissues. Neurourology and Urodynamics. 39 (6), 1667-1678 (2020).
- Hashitani, H., Lang, R. J. ATYPICAL or INTERSTITIAL, take your PIC. Journal of Physiology. 598 (15), 3061-3062 (2020).
- Lang, R. J., Hashitani, H., Tonta, M. A., Suzuki, H., Parkington, H. C. Role of Ca2+ entry and Ca2+ stores in atypical smooth muscle cell autorhythmicity in the mouse renal pelvis. British Journal of Pharmacology. 152 (8), 1248-1259 (2007).
- Grundy, D. Principles and standards for reporting animal experiments in The Journal of Physiology and Experimental Physiology. Experimental Physiology. 100 (7), 755-758 (2015).
- Drumm, B. T., Hennig, G. W., Baker, S. A., Sanders, K. M. Applications of spatio-temporal mapping and particle analysis techniques to quantify intracellular Ca 2+ signaling in situ. Journal of Visualized Experiments. 2019 (143), 1-13 (2019).
- Leigh, W. A., et al. A high throughput machine-learning driven analysis of Ca2+ spatio-temporal maps. Cell Calcium. 91, 102260 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır