Method Article
Isolierung und Bildgebung von live, intakten Herzschrittmacherregionen des Nierenbeckens der Maus durch Vibratom-Schnitte
In diesem Artikel
Zusammenfassung
Ziel dieses Protokolls ist es, intakte Herzschrittmacherregionen des Nierenbeckens der Maus mittels Vibratomschnitt zu isolieren. Diese Abschnitte können dann für die in situ Ca2+ Bildgebung verwendet werden, um Ca2+ transiente Eigenschaften von Herzschrittmacherzellen und anderen interstitiellen Zellen in Vibratomscheiben aufzuklären.
Zusammenfassung
Das Nierenbecken (RP) ist eine trichterförmige, glatte Muskelstruktur, die durch regelmäßige, treibende Kontraktionen den normalen Urintransport von der Niere zum Harnleiter erleichtert. Regelmäßige RP-Kontraktionen beruhen auf der Herzschrittmacheraktivität, die aus der proximalsten Region des RP an der Becken-Nieren-Verbindung (PKJ) stammt. Aufgrund der Schwierigkeit, auf intakte Präparate des PKJ zuzugreifen und diese zu erhalten, konzentrierten sich die meisten Untersuchungen zur RP-Schrittmacherei auf Einzelzell-Elektrophysiologie und Ca2+ Bildgebungsexperimente. Obwohl aus solchen Arbeiten wichtige Enthüllungen über rp-Schrittmacher hervorgegangen sind, haben diese Experimente mehrere intrinsische Einschränkungen, einschließlich der Unfähigkeit, die zelluläre Identität in gemischten Suspensionen genau zu bestimmen, und des Fehlens einer In-situ-Bildgebung der RP-Schrittmacheraktivität. Diese Faktoren haben zu einem begrenzten Verständnis der Mechanismen geführt, die normalen rhythmischen RP-Kontraktionen zugrunde liegen. In diesem Artikel wird ein Protokoll beschrieben, um intakte Segmente von Maus-PKJ mit einer Vibratom-Schnitttechnik vorzubereiten. Durch die Kombination dieses Ansatzes mit Mäusen, die zellspezifische Reporter und genetisch kodierte Ca2+ Indikatoren exprimieren, können die Forscher möglicherweise die spezifischen Zelltypen und Mechanismen, die für peristaltische RP-Kontraktionen verantwortlich sind, die für den normalen Urintransport unerlässlich sind, genauer untersuchen.
Einleitung
Das Nierenbecken (RP) ist eine trichterförmige, glatte Muskelstruktur, die Urin von der Niere zum Harnleiter transportiert. Das RP transportiert Urin durch die Erzeugung regelmäßiger rhythmischer Kontraktionen (Peristaltik)1,2,3,4,5, die einen Urinbolus aus der Niere distal zum Harnleiter und schließlich zur Blase treibt, wo er gespeichert wird, bis die Miktion auftritt6,7. Der Verlust dieser regelmäßigen Aktivität hat schlimme Folgen, einschließlich Hydronephrose und Nierenversagen1,3,8; Daher besteht die dringende Notwendigkeit, die Mechanismen zu untersuchen, die regelmäßigen, rhythmischen RP-Kontraktionen zugrunde liegen. Peristaltische Kontraktionen stammen aus der proximalsten Region des RP-in der Becken-Nieren-Verbindung (PKJ)9,10,11 ,12,13,14,15 ( Abbildung1A-C) und breiten sich distal aus, um Urin aus der Papille in die RP zu drücken ( Abbildung1B). Die elektrische Schrittmacheraktivität wird im PKJ als spontane transiente Depolarisationen10,11,12,13,15,16 ,17aufgezeichnet, von denen angenommenwird,dass sie aus spezialisierten Herzschrittmacherzellen entstehen. Es wird angenommen, dass diese Herzschrittmacherzellen, früher als atypische glatte Muskelzellen (ASMCs) bezeichnet, die Schrittmacheraktivität erzeugen oder koordinieren und die Kontraktionen der "typischen" glatten Muskelzellen (SMCs)9,10,11,18,19,20,21,22,23antreiben.
ASMCs sind am häufigsten in der proximalen RP, am PKJ (Abbildung 1A-C), wo peristaltische Kontraktionen und elektrische Schrittmacheraktivität5,7,8,9,12,13,14,16,17,18,19,20,21 ,22. Eine kürzlich veröffentlichte Studie dieser Gruppe identifizierte den aus Plättchen abgeleiteten Wachstumsfaktorrezeptor-alpha (PDGFRα) in Kombination mit der myosinschweren Kette der glatten Muskulatur (smMHC) als einzigartigen Biomarker für diese interstitiellen Zellen (ICs)24, ein Befund, der von anderen Gruppen bestätigt wurde25. Basierend auf ihrer Morphologie und ihrem Proteinexpressionsmuster wurden diese Zellen PDGFRα+ IC Typ 1 (PIC1)24,26genannt. PIC1s befinden sich in der Muskelschicht des PKJ, wo sie hochfrequente, kurzzeitige Ca2+ Transienten aufweisen, von denen angenommen wird, dass sie der Erzeugung von Schrittmacherpotentialenzugrunde liegen 24. Es gibt jedoch andere Zelltypen im PKJ, einschließlich nicht-smMHC-exprimierender PDGFRα+ ICs (PIC2s) in der adventitialen Schicht. Frühere Berichte haben vorgeschlagen, dass Nicht-smMHC-ICs an der Regulierung der Herzschrittmacheraktivität teilnehmen können19. Die weitere Untersuchung von Nicht-smMHC-ICs wird jedoch durch eine schlechte Unterscheidung während ca2+ Bildgebungsstudien behindert. Typischerweise werden heterogene Zelltypen innerhalb der RP-Präparate wahllos mitCa2+-empfindlichenFarbstoffen (z.B. Fluo-4) beladen. Um diese Herausforderungen zu meistern und eine Vielzahl von Zelltypen im RP zu untersuchen, können genetisch kodierte Ca2+ Indikatoren (GECIs) verwendet werden, um SelektivCa2+ -sensitiveFluorophore in Zelltypen von Interesse zu exprimieren.
Die Mehrzahl der Studien zur Aufklärung der transienten Eigenschaften von Ca2+ in PIC1s/ASMCs wurde durch die Abbildung von Flachblatt-RP-Gewebepräparaten19,21,27erreicht. Da PIC1s der einzige Zelltyp im PKJ sind, der smMHC exprimiert, ist die bedingte Expression des GECI, GCaMP, in smMHC+ -Zellen geeignet, PIC1s in dieser Konfiguration zu untersuchen. Da jedoch sowohl PIC1s als auch PIC2s PDGFRα exprimieren, verbietet die bedingte Expression von GCaMP-Varianten in PDGFRα+-Zellen die Zellunterscheidung in Flachblattpräparaten. Um dieses Problem zu umgehen, wurde ein Vibratom-Schnittansatz verwendet, um PIC1s und PIC2s über die PKJ-Gewebewand24zu unterscheiden. Um diese diskreten zellulären Populationen aufzudecken, wurde der RP koronal durchschnitten, so dass es möglich war, PIC2s in den Adventitia und PIC1s in der Muskelwand basierend auf bekannten immunhistochemischen Markierungs- und GECI-Expressionsmustern zu identifizieren. Als Ergebnis dieses neuartigen PKJ-Bildgebungsansatzes wurde festgestellt, dass PIC1s und PIC2s unterschiedliche Ca2+ Signaleigenschaftenaufweisen 24. Darüber hinaus wurde durch die Isolierung der proximalsten Abschnitte der PKJ-Region (Abbildung 2) die Schrittmacherregion des RP in einer Weise erhalten, die zuvor nicht erreicht worden war. Hier wird ein Protokoll beschrieben, um zu zeigen, wie PKJ-Präparate mithilfe von Vibratomschnitten aus der Mausniere isoliert werden, wie diese Präparate für Ca2+ Bildgebungsexperimente eingerichtet werden und wie die verschiedenen Zelltypen über die PKJ-Wand hinweg unterschieden werden können.
Protokoll
Alle verwendeten Mäuse und die in dieser Studie beschriebenen Protokolle entsprachen dem National Institutes of Health Guide for the Care and Use of Laboratory Animals und dem Institutional Animal Use and Care Committee an der University of Nevada, Reno, NV. Versuche und Tierversuche entsprachen auch den Grundsätzen und Vorschriften, wie sie in Grundy28beschrieben sind.
1. PDGFRα-GCaMP6f- und SMCGCaMP3-Mäuse erzeugen
- Kreuzen Sie GCaMP6flox/+ Mäuse (B6; 129S-Gt(ROSA)26Sortm95.1(CAG-GCaMP6f)Hze/J) mit PDGFRαCre Mäusen (C57BL/6-Tg(Pdgfra-cre)1Clc/J), um PDGFRα-GCaMP6f Mäuse zu erzeugen.
- Kreuzen Sie GCaMP3lox/+ Mäuse (B6.129S-Gt(ROSA)26Sortm38(CAG-GCaMP3)Hze/J) mit männlichen smMHCCreERT2 Mäusen (B6. FVB-Tg(Myh11-cre/ERT2)1Soff/J) zur Erzeugung von SMC-GCaMP3-Mäusen.
HINWEIS: Nur männliche Mäuse des Kreuzes(GCaMP3lox/+ Mäuse und smMHCCreERT2 Mäuse) können verwendet werden, da die Cre-Expression vom Y-Chromosom angetrieben wird. smMHCCreERT2-Mäuse können auch mit GCaMP6flox/+-Mäusen gekreuzt werden, um ein verbessertes Ca2+ Signal-Rausch-Verhältnis und schnellere Ca2+ Signal-Temporaleigenschaften zu erzielen.
2. Vorbereitung und Injektion von transgenen Mäusen mit Tamoxifen, um eine bedingte Expression von GCaMP zu induzieren
- Aktivieren Sie die induzierbare Cre-Rekombinationsase für die zellspezifische GCaMP-Expression in bestimmten Zelltypen, wie zuvor beschrieben29.
3. Lösungen vorbereiten
- 1 L Krebs-Ringer-Bicarbonat (KRB)-Lösung mit 120,35 mM NaCl, 5,9 mM KCl, 15,5 mM NaHCO3,1,2 mMNa2HPO4,1,2 mM MgCl2, 11,5 mM Glucose und 2,5 mM CaCl2werden enthält. Halten Sie die KRB-Lösung am Tag der Verwendung auf Eis.
HINWEIS: KRB kann bis zu einer Woche bei 4 °C gelagert werden und sollte vor Gebrauch mindestens 10 min lang mit einer Mischung aus 97% O2 und 3% CO2 vorgespudelt werden.
4. Bereiten Sie silikonelastomerbeschichtete Dissektions- und Mikroskopbildgebungsschalen vor
- Mischen Sie Siliziumelastomerkomponenten gemäß den Anweisungen des Herstellers. Füllen Sie eine 35 mm x 10 mm große Petrischale und eine 60 mm x 15 mm große Petrischale etwa zu einem Viertel mit Flüssigsiliciumelastomer für bildgebende Experimente bzw. Dissektionen. Polymerisieren Sie das Silikonelastomer bei 37 °C für 1 Tag vor dem Gebrauch.
HINWEIS: Um den Kontrast dünner Nierenabschnitte zu verbessern, tragen Sie einen kleinen, schwarzen Papierkreis auf die Basis der bildgebenden Petrischale auf, bevor Sie ihn mit Silikonelastomer füllen.
5. Nierendissektion
- Betäubung von Mäusen durch Inhalation von 3-4% Isofluran in einer belüfteten Haube. Bestätigen Sie die Induktion einer Tiefenanästhesie durch Verlust des Zehen- und / oder Schwanzquetschreflexes und euthanasieren Sie dann die Mäuse durch zervikale Luxation.
- Tragen Sie 70% Ethanol auf die Brust auf, um das Fell zu dämpfen. Öffnen Sie mit einer externen Dissektionsschere die Bauchhöhle über einen Längsschnitt, wobei die Scherenklingen vom Tier abgewinkelt sind, um Schäden an den inneren Organen zu verhindern.
- Mit einer internen Gewebepinzette und einer inneren Dissektionsschere den Darm einklemmen und von der Bauchdecke wegheben. Schneiden Sie beim Anheben des Darms die Unterseite des Darms am proximalen Zwölffingerdarm und am distalen Dickdarm vom Körper frei, um Zugang zum retroperitonealen Raum zu erhalten, der die Nieren enthält.
- Sobald die Nieren freigelegt sind, extrahieren Sie sie einzeln. Kneifen und heben Sie das distale Ende des Harnleiters (~ 4 mm von der Niere entfernt) vorsichtig mit einer Gewebezette an. Schneiden Sie mit der Sezierschere unter dem eingeklemmten Harnleiter in Richtung Niere. Schneiden Sie weiter unter der Niere, bis sie sich vom umgebenden Bindegewebe befreit hat.
HINWEIS: Um die Gewebeintegrität und schnittliche Konsistenz während des Vibratomschnitts zu maximieren, muss die Niere so intakt wie möglich sein. Um dies zu gewährleisten, vermeiden Sie ein Einklemmen oder Schneiden der Niere mit einer Zette und einer Sezierschere. - Legen Sie die Niere mit aufgesetztem Harnleiter in eiskalte KRB-Lösung. Wiederholen Sie die Schritte 5.4 und 5.5 mit der kontralateralen Niere. Halten Sie die Nieren in KRB-Lösung auf Eis.
HINWEIS: Fahren Sie sofort mit dem nächsten Abschnitt des Protokolls fort, um die Lebensfähigkeit des PKJ-Gewebes zu erhalten. Aufgrund seiner anatomischen Lage tief im Nierenparenchym wird dem PKJ der Kontakt mit KRB-Lösung entzogen.
6. Bereiten Sie die Niere für die Vibrationsschnitte vor
- Die Niere in eine mit Silikonelastomer beschichtete Sezierschale (60 mm x 15 mm) geben und mit eiskalter KRB-Lösung füllen, bis die Niere vollständig untergetaucht ist.
- Verankern Sie unter einem Seziermikroskop die Niere an der Basis der Schale, indem Sie Minutien-Stifte in den proximalen Harnleiter und durch die dünne vordere Nierenkapsel oder das umgebende Fettgewebe einführen.
HINWEIS: Achten Sie darauf, das Nierenparenchymgewebe nicht zu punktieren. - Verwenden Sie eine feine Federschere und eine innere Zette, um Fettgewebe von der Basis der Niere zu entfernen, um die distale RP und den proximalen Harnleiter freizulegen.
- Entfernen Sie den proximalen Harnleiter und einen Teil des distalen RP mit einer feinen Federschere von der Basis des RP.
HINWEIS: Achten Sie darauf, das umgebende Nierenparenchym nicht zu schneiden. Die schwarze gestrichelte Linie in Abbildung 1A zeigt die ungefähre Position dieses Schnitts an. Dieser Schnitt schafft eine flache Basis auf der Niere für eine gleichmäßigere Gewebeschnitte. Beim Sezieren der Niere muss man sich der anatomischen Position der PKJ-Region bewusst sein. Abbildung 1B zeigt, dass die intakte Niere entlang einer sagittalen Ebene geschnitten werden kann, um die Medulla, papille (distale Medulla, wo Sammelkanäle zusammenlaufen) und proximale und distale RP freizulegen. Sollte die Papille vollständig exponiert werden, wie in Abbildung 1C, können PKJ und proximale RP (prox RP) visualisiert werden. Dies sollte jedoch nicht für die Vibratomtechnik erfolgen; Diese Beschreibung soll den Leser im Allgemeinen auf den PKJ-Standort ausrichten, der in der anatomischen Differenz hervorgehoben wird, die in den Durchlichtbildern der PKJ-Region und der mittleren RP-Region in Abbildung 1D, Egezeigt wird . - Stechen Sie die äußere Nierenkapsel mit einer Feinspitzenzette durch und angeln Sie die Spitzen vom Nierenkörper weg. Mit einer Handzette die losen Enden der Kapsel zusammendrücken und auseinander schälen. Die verbleibende Nierenkapselmembran wird weiter geschält, bis sie vollständig entfernt ist.
HINWEIS: Die Nierenkapsel ist eine zähe, faserige Schicht, die die Niere umgibt. Es muss vor dem Vibratomschnitt entfernt werden, um ein optimales Schneiden zu finden.
7. Vorbereiten und Kalibrieren des Vibratominstruments
- Setzen Sie eine Rasierklinge in den Klingenhalter des Vibratominstruments ein und stellen Sie den Klingenabstandswinkel auf ~ 18 ° ein.
HINWEIS: Als optionaler Schritt für eine qualitativ hochwertigere Schnitte sollte ein Kalibrierblock (bei einigen Vibrationsinstrumenten enthalten) verwendet werden, um die Klingenposition für jedes neue Blatt gemäß den Anweisungen des Herstellers einzustellen. Dies gewährleistet eine optimale Positionierung der Klinge und minimiert vertikale Vibrationen. - Stellen Sie die Vorschubgeschwindigkeit des Blattes auf 0,2 mm/s, die horizontale Vibration/Scherung des Blattes auf eine Amplitude von 2,00 mm und die Z-Schrittgröße des Blattes auf ~100-150 μm ein. Stellen Sie sicher, dass die Nierenschnittdicke 150 μm nicht überschreitet, da dies die Bildgebungsexperimente von Ca2+ negativ beeinflusst (da sich die PKJ-Wand oft auf sich selbst rollt und faltet, wenn sie zu dick ist).
HINWEIS: Der Benutzer sollte diese Schnittparameter fein abstimmen, da die Einstellungen zwischen einzelnen Nierenpräparaten und Vibratominstrumenten variieren. Die Feinabstimmung sollte während des Schnitts erfolgen, wenn der Benutzer Die Abschnitte unter einem Mikroskop visuell inspizieren kann, wie in Schritt 7.2 beschrieben. - Installieren Sie ein Eisbad und eine Pufferschale auf das Vibratominstrument. Füllen Sie das Eisbad mit Crushed Ice und füllen Sie den inneren Bühnenbereich mit eiskalter KRB-Lösung (bis etwa halb voll). Überwachen und ersetzen Sie während des Vibratomschnitts das geschmolzene Crushed Ice.
8. Vibratom, das die Niere durchschnitt
- Verwenden Sie eine stumpfe Zette, um die vorbereitete Niere vorsichtig zu greifen und aus der eiskalten KRB-Lösung zu entfernen. Legen Sie die Niere sofort für ~ 2-4 s auf saugfähiges Papier, um überschüssige äußere Feuchtigkeit zu entfernen. Rollen Sie die Niere vorsichtig über das saugfähige Papier, um sicherzustellen, dass alle Seiten des Parenchyms getrocknet sind, so dass eine optimale Haftung der Niere im Vibrationsstadium besteht.
HINWEIS: Da sich das RP in der Niere befindet und daher durch das äußere Parenchym geschützt ist, wäre diese kurze Trocknungszeit nicht schädlich für die Gewebeintegrität. - Tragen Sie sofort eine dünne Schicht Cyanacrylatkleber (~ 1 cm2) auf die Basis der Vibratomprobenplatte auf und verwenden Sie eine stumpfe Zeder, um die Niere, den Harnleiter mit der Seite nach unten, auf die mit Klebstoff bedeckte Fläche zu legen. Drücken Sie vorsichtig druckabwärts auf die Oberseite der Niere mit der flachen Kante der Zette für ca. 10-20 s, um den Kleber zu trocknen.
HINWEIS: Um die Niere während dieses Verfahrens zu stabilisieren, verwenden Sie eine zusätzliche Zange, um die Niere aufrecht zu halten, während der Kleber trocknet. Es ist wichtig, dass die Niere in aufrechter Position an der Probenplatte haftet, so dass die Abschnitte gerade geschnitten werden. Um sicherzustellen, dass die Niere erfolgreich an der Probenplatte haftet, drücken Sie vorsichtig die Seite der Niere. Wenn die Niere erfolgreich an der Platte haftet, sollte die Basis der Niere an der Platte befestigt bleiben. - Befestigen Sie die Probenplatte fest am Boden der Pufferschale. Stellen Sie den Füllstand der KRB-Lösung so ein, dass die Oberseite der Niere vollständig eingetaucht ist. Entfernen Sie während der Schnittschritte, wenn sich die Vibrationsschaufel tiefer in die Pufferschale bewegt, die KRB-Lösung, damit der Klingenhalter nicht in Lösung eingetaucht wird.
HINWEIS: Wenn der Kleber vor diesem Schritt nicht vollständig getrocknet ist, bewegt sich der Kleber oft von der Basis zum Nierenparenchym. Dieser überschüssige Kleber macht das Schnitten variabler. Wenn dies geschieht, entfernen Sie die Niere von der Platte und fahren Sie mit einer frischen Nierenvorbereitung fort. - Für die automatische Vibratomschnitte wählen Sie die Start- und Endpositionen des Vibratom-Klingenschneidzyklus. Stellen Sie sicher, dass diese Positionen ~ 0,5-1 cm von der Niere entfernt sind, um sicherzustellen, dass bei jedem Blattvorschub die gesamte Nierenebene durchschnitten wird.
- Bereiten Sie eine Mehrbrunnenplatte (24- oder 48-Well) vor, indem Sie die Vertiefungen mit KRB-Lösung füllen und die Platte auf Eis legen.
HINWEIS: Wenn sie generiert werden, sollten einzelne Abschnitte in separaten Bohrbrunnen platziert werden, um die Abschnittstiefe zu verfolgen. - Starten Sie den automatischen Schneidevorgang. Stellen Sie während des ersten Durchgangs der Klinge sicher, dass die Klinge mit der Oberseite der Niere in Kontakt kommt. Wenn kein Kontakt hergestellt wird, stellen Sie die Z-Startposition der Klinge ein.
- Sammeln Sie mit einer Zette Abschnitte, die von der Niere befreit sind. Übertragen Sie die Abschnitte sofort auf einzelne Vertiefungen und notieren Sie die Z-Tiefe der Abschnitte, um die ungefähre PKJ-Position innerhalb der Nierenabschnitte zu messen.
HINWEIS: Abhängig von den Schnittparametern können einige Abschnitte nicht vom Nierenblock befreit werden. Wenn dies der Fall ist, verwenden Sie vorsichtig eine feine Federschere, um Abschnitte aus dem Nierenblock zu schneiden. Benutzer werden auch ermutigt, Abschnitte unter einem Lichtmikroskop aktiv zu visualisieren, während sie in einzelnen Vertiefungen frei schweben, um optimale Schnitteinstellungen und Gewebeposition zu gewährleisten. Abschnitte, die das PKJ enthalten, werden typischerweise ~ 1000-1500 μm von der Oberseite der Niere abgeleitet. - Setzen Sie das Schnittprotokoll fort, bis die PKJ-Regionen deutlicher werden. Im Abschnitt "Repräsentative Ergebnisse" finden Sie eine Beschreibung der PKJ-Regionen, während die Abschnittsausschnitte fortschreiten.
- Optimieren Sie an dieser Stelle die Schnittparameter, um sicherzustellen, dass die Abschnitte gleichmäßig aus dem Nierenblock befreit und intakt sind. Stellen Sie außerdem sicher, dass die PKJ-Regionen kontinuierlich und ununterbrochen sind, da gebrochene PKJ-Wände aufgrund eines Kollapses keine angemessene Bildgebung von Zellen innerhalb der Wand ermöglichen. Wenn Wände gebrochen werden, verringern Sie die Schnittgeschwindigkeit und erhöhen Sie die Schnittdicke und beobachten Sie weiterhin Abschnitte unter einem Lichtmikroskop, um die Schnittparameter zu verfeinern.
- Lagern Sie Abschnitte bei 4 ° C in KRB-Lösung, bis die Experimente beginnen.
9. Nierenscheibe Ca2+ Bildaufnahme
- Eine einzelne Nierenscheibe in eine mit Silikonelastomer beschichtete Bildschale (35 mm x 10 mm) geben und die Schüssel sofort mit frischer, eiskalter KRB-Lösung füllen.
- Setzen Sie Minutien-Stifte um die Peripherie einer Nierenscheibe ein, um den Abschnitt an der Basis der Bildgebungsschale zu befestigen.
HINWEIS: Dieser Schritt ist wichtig, um zu verhindern, dass sich der Abschnitt bewegt, wenn physiologische Lösungen während der Bildgebung über die Scheibe perfundiert werden. - Stellen Sie die Bildgebungsschale auf die Bühne eines aufrechten Konfokalmikroskops mit Spinnscheibe und beginnen Sie sofort mit dem Durchschnässen mit KRB-Lösung.
HINWEIS: In diesem Protokoll wurde ein aufrechtes Mikroskop verwendet, das mit einer Konfokalscannereinheit mit Hochgeschwindigkeits-Nipkow-Spinnscheibe ausgestattet war. - Halten Sie die Perfusionsrate bei 3 ml/min und die KRB-Lösungstemperatur bei 36 ± 1 °C. Lassen Sie die Scheibe vor der Bildgebung 1 h lang ausgleichen.
- Wählen Sie den passenden dichroitischen Bildgebungswürfel und Laser aus. Erfassen Sie Bilder mit einem elektronenvermehrenden ladungsgekoppelten Gerät (EMCCD) oder einer wissenschaftlichen komplementären Metalloxid-Halbleiterkamera.
HINWEIS: Das konfokale System in diesem Protokoll ist mit einem 488-nm-Laser ausgestattet, um GCaMP6f oder GCaMP3 anzuregen. Die Bilder wurden mit einer EMCCD-Kamera mit 512 Pixel x 512 Pixel aufgenommen. - Verwenden Sie ein Objektiv mit geringer Vergrößerung und Wasserimmersion (4x oder 10x), um die Nierenscheibe zu lokalisieren. Zentrieren Sie das Abbildungsfeld auf Bereiche des Slices, in denen der PKJ vorhanden ist. Identifizieren Sie Landmarken, wie in Abbildung 2Ddargestellt, um die PKJ zu lokalisieren (d. H. Halbkreise von Muskelgewebe, die zwischen Parenchymgewebe schweben).
- Sobald der PKJ lokalisiert ist, verwenden Sie ein Wasserimmersionsobjektiv mit höherer Vergrößerung (20x, 40x oder 60x), um den interessierenden Bereich zu vergrößern.
HINWEIS: In diesem Protokoll betrug die numerische 20-fache Objektivapertur (NA) 1,0, die 40-fache Objektiv-NA 0,8 und die 60-fache Objektiv-NA 1,0. - Unterscheiden Sie verschiedene Zellen von Interesse in der PKJ-Wand mit transgenen Mäusen, die GCaMP6f oder GCaMP3 in PDGFRα+ -Zellen bzw. SMCs exprimieren. Beobachten Sie die verschiedenen Arten von Ca2+ transienten Dauern in PDGFRα+ Zellen in der PKJ-Wand in PDGFRα+ GCaMP6f+ Nierenscheiben (Abbildung 3C, siehe repräsentative Ergebnisse zur Beschreibung) und in GCaMP3+ SMCs in SMC GCaMP3+ Nierenscheiben (Abbildung 3D, siehe repräsentative Ergebnisse zur Beschreibung).
- Sobald Zellen von Interesse in der PKJ-Wand identifiziert wurden, passen Sie die Laserintensität an, um ein gutes Signal-Rausch-Verhältnis zu erhalten. Nehmen Sie Bilder mit einer zeitlichen Abtastfrequenz zwischen 16 Hz und 32 Hz mit einer geeigneten Erfassungssoftware auf.
HINWEIS: Abhängig von der Laserintensität, die während der Bildgebung verwendet wird, wird empfohlen, die Anzahl der Aufnahmen aufgrund der Bleicheffekte auf Ca2+ Fluorophoren zu begrenzen. Der Benutzer sollte die Aufzeichnungslänge basierend auf den spezifischen experimentellen Zielen auswählen.
10. Ca2+ bildgebende Analyse
- Durchführung einer ca2+ bildgebenden Analyse verschiedener Zelltypen in PKJ-Herzschrittmacherregionen durch raumzeitliche Kartierung, wie zuvor für andere intakte Herzschrittmacherpräparate im Magen-Darm-Trakt beschrieben29,30.
Ergebnisse
In situ Ca2+ Bildgebung des PKJ kann wichtige zelluläre Aktivität von RP-Schrittmacherzellen aufdecken. Durch die Verwendung von Mäusen, die genetisch kodierte Ca2+-Indikatoren (wie GCaMP) exprimieren, die von zellspezifischen Promotoren angetrieben werden, können Informationen über rp-Herzschrittmacherei mit Genauigkeit und Detailgenauigkeit gewonnen werden, die aus Ca2+ Bildgebungsexperimenten aus Flachfolien-RP-Präparaten nicht möglich sind. Der Beginn der PKJ zeichnet sich durch das plötzliche Auftreten von Muskelhalbkreisen aus, die zwischen Nierenparenchymgewebe suspendiert sind (Abbildung 2C; proximales PKJ in gestrichelter Box eingeschlossen). Während der nachfolgenden Schnittrunden wird die innere Medulla vom umgebenden kortikalen Gewebe unterscheidbar. Unter einem Lichtmikroskop erscheint die innere Medulla in Regionen gestreift, heller in der Farbe im Vergleich zu kortikalem Gewebe und diskontinuierlich auf ihrer langen Achse mit dem Rest der Niere (Abbildung 2B, D). An diesem Punkt werden weitere PKJ-Regionen erscheinen. Beispiele hierfür sind in Abbildung 2D (gestrichelte Rechtecke, H und G) dargestellt, wo 3 Muskelhalbkreise durch Parenchymgewebe suspendiert sind. Diese Muskelbänder sind eng mit der inneren Papille verbunden und nachbarn typischerweise eine Nierenarteriole (Abbildung 2D, gestrichelte Rechtecke; Abbildung 2F-H, schwarze Pfeilspitzen). Wenn mehr distale Abschnitte abgeleitet werden, integrieren sich diese Muskelbänder zu einer vollständigeren, einheitlicheren Struktur, die das Ende der PKJ-Region anzeigt (Abbildung 2E).
Abbildung 3A,B zeigt einen PKJ-Abschnitt mit geringer Leistung (4-10x) von einer Maus, die GCaMP in PDGFRα+ -Zellen exprimiert (GCaMP6f ausgedrückt durch induzierbare Cre-Rekombinase, angetrieben durch Pdgfra). Anhand von Landmarken wie der Nierenarteriole (Abbildung 3A; Sternchen) sollten die Experimentatoren in der Lage sein, die dünne PKJ-Wand, die zwischen Parenchymgewebe hängt, leicht zu unterscheiden (Abbildung 3B; Sternchen). Die Expression von GCaMP6f in diesem spezifischen transgenen Gewebe ist über die gesamte Breite des PKJ verteilt, sowohl über die Muskel- als auch über die Adventitialschichten (Abbildung 3C).
In PDGFRα+ GCaMP6f+ Nierenscheiben ist ein Netzwerk von Zellen, das sich typischerweise über die Breite der PKJ-Wand erstreckt, fluoreszierend (Abbildung 3C) und zeigt oszillierende Ca2+ Transienten unterschiedlicher Dauer und Frequenz. PDGFRα+ Zellen in der PKJ-Wand zeigen zwei verschiedene Arten von Ca2+ transienten Dauern an. In der adventitialen Schicht (näher am Kortex orientiert) sind PDGFRα+ Zellen als Netzwerk von Zellen vorhanden und ihre Prozesse definiert. Adventitielle PDGFRα+ Zellen weisen niederfrequente (4 ± 2,7 Hz) und langdauerige (1 ± 0,67 s) Ca2+ Transienten auf. Die zweite Schicht von PDGFRα+ -Zellen, die in der Muskelschicht vorhanden sind (näher an der Medulla ausgerichtet), weisen ähnliche Ca2+ transiente Frequenzen und Dauern wie SMC GCaMP3+ -Zellen (unten beschrieben) auf, da sie den gleichen Zelltyp aufweisen.
In SMC GCaMP3+ Nierenscheiben ist eine Schicht von GCaMP3+ Zellen in der Muskelschicht vorhanden ( Abbildung3D). In der adventitialen Schicht gibt es kein fluoreszierendes Signal(Abbildung 3D;Sternchen). GCaMP3+ SMCs in der Muskelschicht weisen typischerweise hochfrequente (10 ± 4 Hz) und kurzzeitige (632 ± 74 s) Ca2+ Transienten auf. PDGFRα+ Zellen, die sich in der PKJ adventitia befinden, lösen langanhaltende, niederfrequente Ca2+ Transienten aus (Abbildung 3E, Video 1). Ca2+ Bildgebungsexperimente aus Gewebe, das GCaMP3 exprimiert, das vom Myh11-Promotor angetrieben wird, sind jedoch auf den muskulären Aspekt des PKJ beschränkt (Abbildung 3D). Im Vergleich zu PDGFRα+ Zellen in der Adventitia feuerten SMCs häufiger Transienten mit kürzerer Dauer Ca2+ ab (Abbildung 3F, Video 2).
Neben dem Verständnis der Signaleigenschaften in PKJ PDGFRα+ ICs wurde in diesem Artikel die Anwendung dieser Technik zur Untersuchung anderer Zelltypen in der Vibratom-schnittigen Niere gezeigt. Bei genauer Untersuchung des Nierenmarks (bei Mäusen, die GCaMP6f in PDGFRα+ -Zellen exprimieren) wurde eine Reihe von fluoreszierenden Ca2+ -Signalen innerhalb und um die sammelnden Kanäle (Video 3) beobachtet. Medulläre PDGFRα+ Zellen feuerten spontane Ca2+ Transienten variabler Frequenz und Dauer ab. Diese Ca2+ Bildgebungsstudien von Nierenvibratomschnitten könnten auch auf die Untersuchung von Nierenarteriolen (~ 50-80 mm Durchmesser) ausgeweitet werden, die oft an PKJ-Muskelsegmente ankennen(Abbildung 2F,G; weiße Pfeile). Ca2+ Bildgebung von Nierenarteriolen (aus Gewebe, das GCaMP in glatten Muskelzellen exprimiert) zeigt oszillierende Ca2+ Transienten in SMCs (Video 4).
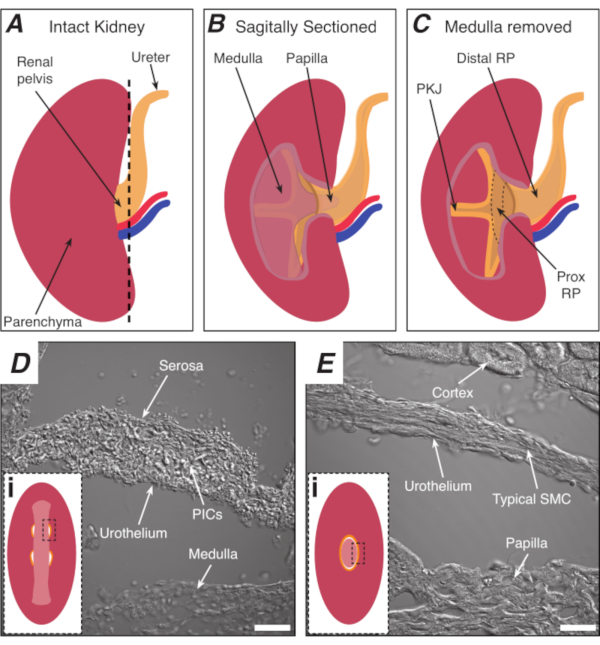
Abbildung 1: Grundlegende Nierenanatomie und Lage der PKJ-Herzschrittmacherregion. (A) Diagramm der intakten Niere, das die Ausrichtung des RP und des Harnleiters zeigt. Die Nierenarterie und die Nierenvene sind rot bzw. blau dargestellt. (B) Die intakte Niere kann entlang einer sagittalen Ebene geschnitten werden, um den inneren Aspekt der Niere freizulegen, einschließlich der Medulla, der Papille (distale Medulla, wo Sammelkanäle zusammenlaufen) und der proximalen und distalen RP. (C) Die Medulla und die Papille können herausgeschnitten werden, um PKJ und Prox RP vollständig freizulegen. (D und E) stellen durchgelassene Lichtbilder aus der PKJ-Schrittmacherregion bzw. der distalen RP dar. Die sequentielle Schnitte zum distalen Ende des Beckens führt dazu, dass sich die Muskelhalbkreise in der PKJ-Region (Di) zu einem dickeren Muskelring (Ei ) verbinden, der die gesamte Papille einkapselt. Schwarze, gestrichelte Rechtecke in Di und Ei zeigen ungefähre Bereiche in koronalen Nierenabschnitten, in denen Durchlichtbilder aufgenommen wurden. Die Ausrichtung der Bilder D und E ist 90° gegen den Uhrzeigersinn zu den jeweiligen Einsätzen (Di und Ei). Skalenbalken in D und E = 20 μm. Abkürzungen: RP = Nierenbecken; prox RP = proximales Nierenbecken; PKJ = Becken-Nieren-Verbindung; PICs = Thrombozyten-abgeleiteter Wachstumsfaktor-Rezeptor-alpha-positive interstitielle Zellen; SMC = glatte Muskelzelle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
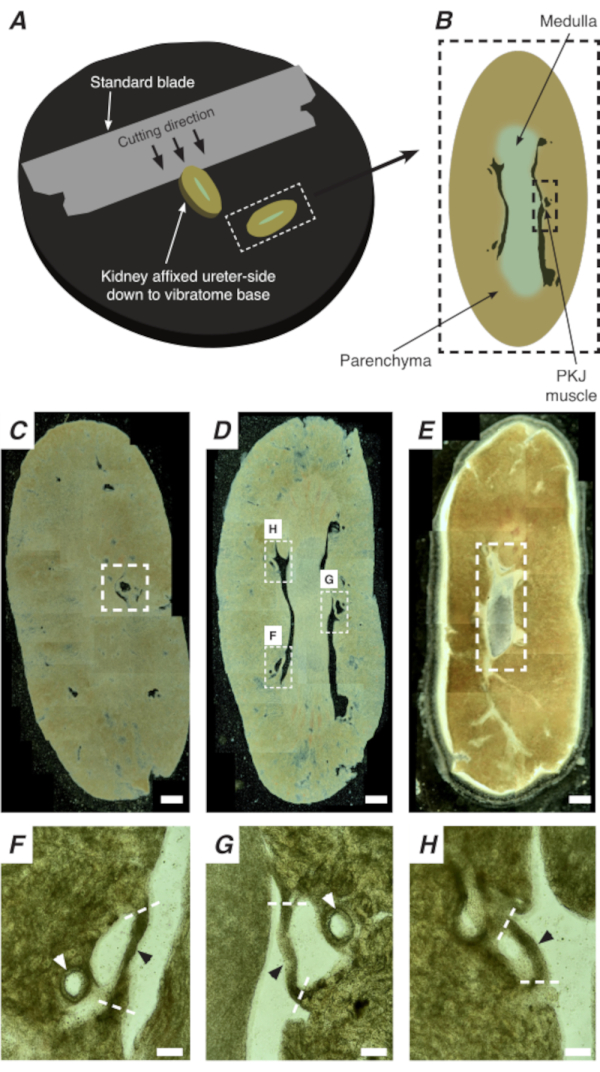
Abbildung 2: Vibratom-Schnitte ganzer Nieren, um dünne Abschnitte zu erzeugen. (A) Nieren werden mit der Harnleiterseite bis zur Basis des Vibratominstruments montiert, und eine Standardklinge (am Vibratomkopf befestigt) wird verwendet, um sequenzielle Abschnitte vom proximalen bis distalen Ende der Niere zu schneiden. (B) Diagrammatische Darstellung eines dünnen Schnitts aus der gesamten Niere mit kommentierten Landmarken. PKJ-Muskelsegmente (schwarzes gestricheltes Rechteck) werden oft zwischen Parenchymgewebe suspendiert gefunden. (C) Lichtmikroskopische Aufnahme eines proximalen Nierenabschnitts. Das Auftreten von Muskelbändern, die zwischen Parenchymgewebe schweben, zeigt den Beginn der proximalen PKJ-Projektionen an (innerhalb des weiß gestrichelten Rechtecks angegeben). (D) Lichtmikroskopisches Bild, das den optimalen Bereich darstellt, in dem mehrere (2-3) PKJ-Segmente zu finden sind (Bereiche innerhalb weißer gestrichelter Rechtecke). Dünne PKJ-Muskelstreifen sind zwischen dem Nierenparenchym suspendiert und richten sich eng an den Nierenarteriolen und dem Medulla aus. (E) Lichtmikroskopische Aufnahme eines distalen Nierenabschnitts. Einzelne Muskelsegmente haben sich zu einem einzigen, durchgehenden Muskelband (weiß gestricheltes Rechteck) verschmolzen, das die innere Papille umgibt (in diesem Bild nicht vorhanden). Maßstabsbalken C-E = 500 μm. F-H Gezoomte (20x) Bereiche aus Panel D zeigen die Position der PKJ (schwarze Pfeilspitzen), der Nierenarteriolen (weiße Pfeilspitzen) und der Schnittstellen zur Isolierung der PKJ (gestrichelte weiße Linien) an. Skalenbalken F-H = 100 μm. Abkürzung: PKJ = Becken-Nieren-Verbindung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
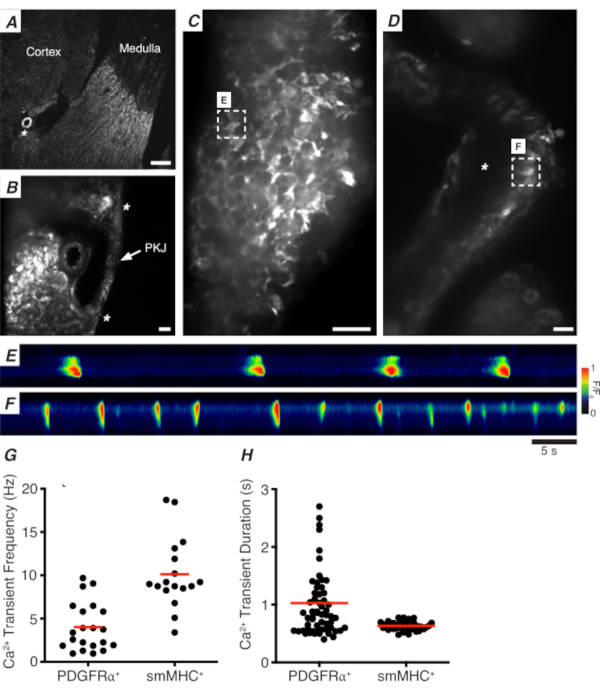
Abbildung 3: Ca2+ Bildgebung von Vibratomschnitten. (A) Repräsentatives Low-Power-Bild (4x) eines Vibratomabschnitts, der die Position der Nierenarteriole (Sternchen) anbezeigt. Maßstabsbalken = 200 μm. (B) Gezoomtes (20x) repräsentatives Bild des PKJ (markiert), das zwischen Nierenparenchymgewebe suspendiert ist und die Stellen des PKJ-Muskels (weiße Pfeilspitze), der Nierenarteriol (Sternchen) bezeichnet. Maßstabsbalken = 50 μm. (C) Hochleistungsbild (40x) des PKJ, das GCaMP in PDGFRα+ Zellen exprimiert. Skalenbalken = 20 μm. (D) Hochleistungsbild (20x) des PKJ, das GCaMP in glatten Muskelzellen exprimiert. Maßstabsbalken = 20 μm. (E) Raumzeitliche Karte von Ca2+ Transienten, die von einer GCaMP+ PDGFRα+ Zelle abgetastet wurden, die in Panel Cangegeben ist. Tabelle mit F/F0codiert nachschlagen. (F) Raumzeitliche Karte von Ca2+ Transienten, die aus einer GCaMP+ PDGFRα+ Zelle abgetastet wurden, die in Panel Dangegeben ist. Tabelle mit F/F0codiert nachschlagen. (G) Repräsentative Daten für Ca2+ Transientenfrequenz (Hz) für GCaMP+ PDGFRα+ Zellen und GCaMP+ smMHC-Zellen. (H) Repräsentative Daten für Ca2+ transiente Dauer(en) für GCaMP+ PDGFRα+ Zellen und GCaMP+ smMHC-Zellen. Abkürzungen: PKJ = Becken-Nieren-Verbindung; PDGFRα+ = Thrombozyten-abgeleiteter Wachstumsfaktor-Rezeptor-alpha-positiv; smMHC = glatte Muskel Myosin schwere Kette. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Video 1: Spontane Ca2+ Transienten in GCaMP+ PDGFRα+ Zellen in PKJ-Vibratomabschnitten. Abkürzungen: PKJ = Becken-Nieren-Verbindung; PDGFRα+ = Thrombozyten-abgeleiteter Wachstumsfaktor-Rezeptor-alpha-positiv. Bitte klicken Sie hier, um dieses Video anzusehen. (Klicken Sie mit der rechten Maustaste zum Herunterladen.)
Video 2: Spontane Ca2+ Transienten in GCaMP+ glatte Muskelzellen in Becken-Nieren-Junction-Vibratom-Abschnitten. Bitte klicken Sie hier, um dieses Video anzusehen. (Klicken Sie mit der rechten Maustaste zum Herunterladen.)
Video 3: Spontane Ca2+ Transienten in GCaMP+ PDGFRα+ Zellen in renalen medullären Vibratomschnitten. Abkürzung: PDGFRα+ = Thrombozyten-abgeleiteter Wachstumsfaktor-Rezeptor-alpha-positiv. Bitte klicken Sie hier, um dieses Video anzusehen. (Klicken Sie mit der rechten Maustaste zum Herunterladen.)
Video 4: Transiente Aktivität von Ca2+ mit niedriger Amplitude in den Vibratomabschnitten der Nierenarteriole. Bitte klicken Sie hier, um dieses Video anzusehen. (Klicken Sie mit der rechten Maustaste zum Herunterladen.)
Diskussion
Das RP besteht aus einer heterogenen Population von Zellen mit differentiellen Zelldichten, die in verschiedenen RP-Regionen beobachtet werden. PIC1s (früher als ASMCs bezeichnet) sind am häufigsten in der PKJ, wo die Schrittmacheraktivität ihren Ursprunghat 24. Das hier beschriebene Protokoll ermöglicht es den Ermittlern, die Herzschrittmacherregion vom Rest der Mausniere zu isolieren. Durch das Schneiden von PKJ-Abschnitten mit einem Vibratom werden die Schrittmacherregionen des RP (identifiziert als Muskelbänder, die an Parenchym gebunden sind) intakt gehalten, wodurch die Verwendung von In-situ-Bildgebung zur genauen Untersuchung von RP-Schrittmacherzellen in Kombination mit zellspezifischen Fluoreszenzreportern ermöglicht wird.
Während dieser Ansatz neue Einblicke in die RP-Schrittmacherei liefern kann, gibt es einige Überlegungen, mit denen Experimentatoren vertraut sein sollten, um die Bildgebungsergebnisse und die Schnitteffizienz zu verbessern. Für einen ungeschulten Anwender ist diese Methode der PKJ-Isolierung und Bildgebung leichter zu erlernen als die typische scharfe Dissektion von Flat-Sheet-RP-Präparaten. Eine scharfe Dissektion von RP aus ganzen Nieren erfordert wochenlanges konsequentes Üben, um lebensfähige Gewebe für physiologische Experimente erfolgreich zu isolieren. Da dieses Vibratom-Schnittprotokoll wenig scharfeS Dissektionswissen erfordert, ist es für Benutzer zugänglich, die keine Erfahrung mit dem Sezieren anderer glatter Muskelstrukturen haben.
Es gibt jedoch einige kritische Punkte, die für dieses Protokoll zu beachten sind. Das erfolgreiche Anhaften der Nieren an der Vibratomprobenplatte erfordert Geschicklichkeit und Geduld. Wenn die Niere falsch ausgerichtet ist und sich zur Seite neigt, werden eher schräge als gerade Abschnitte geschnitten. Aufgrund der empfindlichen Natur des PKJ kann der schräge Winkel oft die Muskelbänder der Herzschrittmacherregion zerstören. Darüber hinaus führt die Bildgebung von schrägen Schnitten zu einer schlechten Bilderfassung, da sich Zellnetzwerke typischerweise nicht in derselben Fokusebene befinden. Das Verfahren ist auch zeitaufwendig, wobei die Sektionierung einer einzelnen Niere oft bis zu einer Stunde dauert, während der die Einrichtung überwacht werden muss.
Während die Bewegung des Vibratoms beschleunigt werden kann, wenn die Geschwindigkeit zu stark erhöht wird (>20% als im Protokoll empfohlen), wird die Klinge die Niere eher zerkleinern als sauber schneiden, was zum Verlust empfindlicher PKJ-Strukturen führt. Ebenso kann eine zu niedrige Schnittgeschwindigkeit dazu führen, dass der Abschnitt gezackt wird. Die Optimierung der Schnittgeschwindigkeit und der Klingenamplitude ist unerlässlich. Auch beim Umgang mit Vibratomabschnitten ist Vorsicht geboten. Aufgrund ihrer empfindlichen Natur sind PKJ-Muskeln während der Handhabung leicht gestört und können reißen. Ein gut ausgebildeter Benutzer wird in der Lage sein, etwa 1-2 PKJ-Regionen pro 4 Nierenscheiben zu ernten, die für Ca2+ Bildgebungsexperimente geeignet sind. Typischerweise haben PKJ-Abschnitte, die die Ca2+ Bildgebungskriterien nicht erfüllen: 1) schlechte GCaMP-Expression, 2) eine verzerrte PKJ-Wand oder 3) eine gebrochene PKJ-Wand. Für die Datenanalyse konnten ca. 3-4 Zellen pro Sichtfeld (FOV) abgetastet werden.
Während es im Sichtfeld der PKJ-Abschnitte PDGFRα-GCaMP6f und SMC-GCaMP3 viele Zellen gibt, schließen kleine Gewebebewegungen Zellen oft von der Analyse aus. Dies kann normalerweise durch Anwenden eines Stabilisierungsprotokolls auf Bilder behoben werden. Unter Bedingungen, bei denen sich die Präparate nicht bewegen, können mindestens 3-5 Zellen aus PDGFRα-GCaMP6f-Abschnitten und 5-6 Zellen aus SMC-GCaMP3-Abschnitten entnommen werden. Typischerweise beträgt die Zeit vom Tieropfer (optimales Alter für Mäuse beträgt 8-16 Wochen) bis zur Durchführung von Ca2+ Bildgebungsexperimenten 2-3 h, was ausreichend ist, um die Gewebeintegrität zu gewährleisten, wenn Gewebe während des gesamten Verfahrens bei Bedarf in eiskalten Lösungen inkubiert werden. Zusammenfassend wurde hier ein Vibratom-Schneideprotokoll beschrieben, um intakte Präparate von RP-PKJ-Regionen aus der Mausniere zu erzeugen. Diese Technik ermöglicht die Erhaltung von RP-Schrittmacherregionen für in situ Ca2+ Bildgebungsstudien zur Untersuchung von RP-Herzschrittmachermechanismen.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Dieses Projekt wurde gefördert durch R01 DK124509 von NIDDK.
Materialien
| Name | Company | Catalog Number | Comments |
| 24-well culture plate | ThermoFisher Scientific | 142485 | To store kidney slices in |
| 35 mm x 10 mm Petri dishes | Sigma Aldrich | CLS430165 | Kidney slice calcium imaging dish |
| 48-well culture plate | ThermoFisher Scientific | 152640 | To store kidney slices in |
| 60 mm x 15 mm Petri dish | Sigma Aldrich | P5481 | Kidney sharp dissection dish |
| Absorbent paper | Fisher Scientific | 06-666A | To dry the kidney before applying glue |
| B6;129S-Gt(ROSA)26Sor/J | The Jackson Laboratory | 13148 | GCaMP3 Mice |
| B6;129S-Gt(ROSA)26Sor/J | The Jackson Laboratory | 24105 | GCaMP6f Mice |
| B6.FVB-Tg(Myh11-cre/ERT2)1Soff/J | The Jackson Laboratory | 19079 | smMHC-CRE Mice |
| C57BL/6-Tg(Pdgfra-cre)1Clc/J | The Jackson Laboratory | 13148 | PDGFRa-CRE Mice |
| Cyanoacrylate glue | Amazon | B001PILFVY | For adhering the kidney to the specimen plate |
| Ethanol | Phamco-Aaper | SDA 2B-6 | For dissection |
| Extra-Fine Bonn Scissors | Fine Science Tools | 14083-08 | Used for internal dissecting scissors |
| Fine scissors | Fine Science Tools | 14060-09 | Used for external dissecting scissors |
| Fine-tip forceps | Fine Science Tools | 11254-20 | Used for fine dissection of kidney |
| Gillette Silver Blue double-edge blades | Amazon | B009XHQGYO | For insertion into blade holder of vibratome |
| ImageJ | NIH | For calcium imaging analysis | |
| Isoflurane | Baxter | NDC 1001936060 | For anesthesia |
| Minutien pins | Fisher Scientific | NC9677548 | Pins were cut in half to reduce their length |
| Silicon elastomer | Fisher Scientific | NC9285739 | Sylgard 184 |
| Student Adson Forceps | Fine Science Tools | 91106-12 | For gently holding and moving the kidney |
| Student Dumont Forceps | Fine Science Tools | 91150-20 | Used for internal dissecting forceps |
| Vannas spring scissors | Fine Science Tools | 15000-03 | For sharp dissection and cleanup of isolated kidney |
| Vibrocheck | Leica | 14048142075 | Optional component for calibrating blade movement during cutting |
| VT1200 S Vibrating Blade Microtome | Leica | 14912000001 | Configuration 1 is used in our protocol |
Referenzen
- Constantinou, C. E., Djurhuus, J. C. Pyeloureteral dynamics in the intact and chronically obstructed multicalyceal kidney. The American Journal of Physiology. 241 (5), 398-411 (1981).
- Constantinou, C. E., Yamaguchi, O. Multiple-coupled pacemaker system in renal pelvis of the unicalyceal kidney. TheAmerican Journal of Physiology. 241 (5), 412-418 (1981).
- Constantinou, C. E., Hrynczuk, J. R. Urodynamics of the upper urinary tract. Investigative Urology. 14 (3), 233-240 (1976).
- Schmidt-Nielsen, B., Schmidt-Nielsen, B. On the function of the mammalian renal papilla and the peristalsis of the surrounding pelvis. Acta Physiologica. 202 (3), Oxford, England. 379-385 (2011).
- Dwyer, T. M., Schmidt-Nielsen, B. The renal pelvis: machinery that concentrates urine in the papilla. Physiology. 18 (1), 1-6 (2003).
- Hill, W. G. Control of urinary drainage and voiding. Clinical Journal of the American Society of Nephrology. 10 (3), 480-492 (2015).
- Brading, A. F. The physiology of the mammalian urinary outflow tract. Experimental Physiology. 84 (1), 215-221 (1999).
- Dixon, J. S., Gosling, J. A. The musculature of the human renal calices, pelvis and upper ureter. Journal of Anatomy. 135, Pt 1 129-137 (1982).
- Lang, R. J., et al. Pyeloureteric peristalsis: role of atypical smooth muscle cells and interstitial cells of Cajal-like cells as pacemakers. The Journal of Physiology. 576, 695-705 (2006).
- Lang, R. J., Takano, H., Davidson, M. E., Suzuki, H., Klemm, M. F. Characterization of the spontaneous electrical and contractile activity of smooth muscle cells in the rat upper urinary tract. Journal of Urology. 166 (1), 329-334 (2001).
- Lang, R. J., Exintaris, B., Teele, M. E., Harvey, J., Klemm, M. F. Electrical basis of peristalsis in the mammalian upper urinary tract. Clinical and Experimental Pharmacology & Physiology. 25 (5), 310-321 (1998).
- Morita, T., Ishizuka, G., Tsuchida, S. Initiation and propagation of stimulus from the renal pelvic pacemaker in pig kidney. Investigative Urology. 19 (3), 157-160 (1981).
- Tsuchida, S., Morita, T., Harada, T., Kimura, Y. Initiation and propagation of canine renal pelvic peristalsis. Urologia Internationalis. 36 (5), 307-314 (1981).
- Yamaguchi, O. A., Constantinou, C. E. Renal calyceal and pelvic contraction rhythms. American Journal of Physiology - Regulatory Integrative and Comparative Physiology. 257 (4), 788-795 (1989).
- Klemm, M. F., Exintaris, B., Lang, R. J. Identification of the cells underlying pacemaker activity in the guinea-pig upper urinary tract. Journal of Physiology. 519 (3), 867-884 (1999).
- Lang, R. J., et al. Spontaneous electrical and Ca2+ signals in the mouse renal pelvis that drive pyeloureteric peristalsis. Clinical and Experimental Pharmacology & Physiology. 37 (4), 509-515 (2010).
- Lutzeyer, W. Pacemaker process of ureteral peristalsis in multicalyceal kidneys. Urologia Internationalis. 37 (4), 240-246 (1982).
- Lang, R. J., Hashitani, H. Pacemaker mechanisms driving pyeloureteric peristalsis: modulatory role of interstitial cells. Advances in Experimental Medicine and Biology. 1124, 77-101 (2019).
- Hashitani, H., et al. Interstitial cell modulation of pyeloureteric peristalsis in the mouse renal pelvis examined using FIBSEM tomography and calcium indicators. Pflugers Archiv: European Journal of Physiology. 469 (5-6), 797-813 (2017).
- Lang, R. J., Hashitani, H., Tonta, M. A., Suzuki, H., Parkington, H. C. Role of Ca2+ entry and Ca2+ stores in atypical smooth muscle cell autorhythmicity in the mouse renal pelvis. British Journal of Pharmacology. 152 (8), 1248-1259 (2007).
- Lang, R. J., Hashitani, H., Tonta, M. A., Parkington, H. C., Suzuki, H. Spontaneous electrical and Ca2+ signals in typical and atypical smooth muscle cells and interstitial cell of Cajal-like cells of mouse renal pelvis. The Journal of Physiology. 583, 1049-1068 (2007).
- Hashitani, H., Lang, R. J., Mitsui, R., Mabuchi, Y., Suzuki, H. Distinct effects of CGRP on typical and atypical smooth muscle cells involved in generating spontaneous contractions in the mouse renal pelvis. British Journal of Pharmacology. 158 (8), 2030-2045 (2009).
- Iqbal, J., et al. Potassium and ANO1/ TMEM16A chloride channel profiles distinguish atypical and typical smooth muscle cells from interstitial cells in the mouse renal pelvis. British Journal of Pharmacology. 165 (7), 2389-2408 (2012).
- Grainger, N., et al. Identification and classification of interstitial cells in the mouse renal pelvis. Journal of Physiology. 598 (15), 3283-3307 (2020).
- Hashitani, H., Mitsui, R., Lang, R. Functional heterogeneity of PDGFRα (+) cells in spontaneously active urogenital tissues. Neurourology and Urodynamics. 39 (6), 1667-1678 (2020).
- Hashitani, H., Lang, R. J. ATYPICAL or INTERSTITIAL, take your PIC. Journal of Physiology. 598 (15), 3061-3062 (2020).
- Lang, R. J., Hashitani, H., Tonta, M. A., Suzuki, H., Parkington, H. C. Role of Ca2+ entry and Ca2+ stores in atypical smooth muscle cell autorhythmicity in the mouse renal pelvis. British Journal of Pharmacology. 152 (8), 1248-1259 (2007).
- Grundy, D. Principles and standards for reporting animal experiments in The Journal of Physiology and Experimental Physiology. Experimental Physiology. 100 (7), 755-758 (2015).
- Drumm, B. T., Hennig, G. W., Baker, S. A., Sanders, K. M. Applications of spatio-temporal mapping and particle analysis techniques to quantify intracellular Ca 2+ signaling in situ. Journal of Visualized Experiments. 2019 (143), 1-13 (2019).
- Leigh, W. A., et al. A high throughput machine-learning driven analysis of Ca2+ spatio-temporal maps. Cell Calcium. 91, 102260(2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten