Method Article
진동 및 이미징 라이브, 진동 절제에 의해 마우스 신장 골반의 그대로 페이스 메이커 영역
요약
이 프로토콜의 목표는 진동 절면을 사용하여 마우스 신장 골반의 그대로 심박 동기 영역을 분리하는 것입니다. 이러한 섹션은 시투 Ca2+ 이미징에서G박 조정기 세포 및 진동 성 슬라이스의 다른 중간 세포의 일시적인 특성을 해명하는 데 사용할 수 있습니다.
초록
신장 골반 (RP)은 일반 추진 수축에 의해 신장에서 요관으로 정상적인 소변 수송을 용이하게하는 깔때기 모양의 부드러운 근육 구조입니다. 정기적인 RP 수축은 골반 신장 접합부(PKJ)에서 RP의 가장 근접한 영역에서 비롯된 심박동기 활동에 의존합니다. PKJ의 온전한 준비에 접근하고 보존하는 어려움때문에, RP 페이스메이킹에 대한 대부분의 조사는 단세포 전기생리학과 Ca2+ 이미징 실험에 초점을 맞추고 있습니다. RP 페이스 메이킹에 대한 중요한 계시가 이러한 작업에서 나타났지만, 이러한 실험에는 혼합 현탁액의 세포 정체성을 정확하게 판단할 수 없는 것과 RP 맥박 조정기 활동의 시상 이미징 부족을 포함하여 몇 가지 본질적인 한계가 있습니다. 이러한 요인은 정상적인 리듬 RP 수축의 기초메커니즘에 대한 제한된 이해의 결과. 이 백서에서, 진동 절개 기술을 사용하여 마우스 PKJ의 그대로 세그먼트를 준비하는 프로토콜이 설명된다. 이 접근법을 세포별 기자 및 유전적으로 인코딩된 Ca2+ 지표를 표현하는 마우스와 결합함으로써, 조사자는 정상적인 소변 수송에 필수적인 연동 RP 수축을 담당하는 특정 세포 유형 및 메커니즘을 보다 정확하게 연구할 수 있습니다.
서문
신장 골반 (RP)은 신장에서 요관으로 소변을 수송하는 깔때기 모양의 부드러운 근육 구조입니다. RP는 일반 리듬 수축(연동)을 생성하여 소변을 수송하여1,2,3,4,5,신장에서 요관으로 소변의 볼러스를 추진하고 궁극적으로 방광까지 소변을 프로포밍하여6,7이발생할 때까지 저장된다. 이 정규 활동의 손실은 수성 신전 및 신부전1,3,8을포함하여 끔찍한 결과를 가지고; 따라서, 기본 메커니즘을 연구 하는 중요 한 필요가 있다 일반, 리듬 RP 수축. 연골 수축은 골반-신장 접합(PKJ)9,10,11,12,13,14,15(도 1A-C)및 전파의 가장 근접적인 영역에서 유래하여 유두야로부터 소변을 RP(도1B)로밀어넣는다. 전기 맥박 조정기 활동은 PKJ에서 자발적인 과도 탈극화10,11,12,13,15,16,17로PKJ에 기록되며, 이는 전문 심박동기 세포에서 발생하는 것으로 생각된다. 이러한 심박동기 세포는 이전에 비정형 평활근 세포(ASMC)라고 불리며, 맥박 조정기 활성을 생성 또는 조정하고 "전형적인" 평활근 세포(SMC)9,10,11,18,19,20,21,22,23의수축을유도하는 것으로 생각된다.
ASMC는 PKJ(그림 1A-C)에서근위 RP에서 가장 풍부하며, 연동 수축 및 전기 맥박 조정기 활동은5,7,8,9,12, 13,14,16,17,18,19,20,21에서 기원합니다. ,22. 이 그룹에 의해 최근에 발표된 연구는 혈소판 유래 성장 인자 수용체-알파(PDGFRα)를 순질근육 미오신 중형사슬(smMHC)과 결합하여이들 간질세포(IC)(24)에 대한 독특한 바이오마커로서, 다른그룹(25)에의해 확증된 것을 발견하였다. 이들의 형태와 단백질 발현 패턴에 기초하여, 이들 세포는 PDGFRα+ IC 타입 1(PIC1)24,26이라고불렸다. PIC1s는 PKJ의 근육 층에 상주하여 고주파, 단기 Ca2+ 과도를 표시하며, 페이스 메이커 잠재력24의생성을 기초로 생각됩니다. 그러나, 다른 세포 유형은 PKJ에 존재하며, 이는 출현층에서 비-smMHC-발현 PDGFRα+ IC(PIC2s)를 포함한다. 이전 보고서는 비 smMHC IC가 심박 조율기 활동의 규제에 참여할 수 있음을 제안했다19. 그러나, 비 smMHC IC의 추가 연구 결과는 Ca2+ 화상 진찰 연구 도중 나쁜 구별에 의해 방해됩니다. 전형적으로, RP 제제 내의 이질성 세포 유형은 Ca2+-민감한 염료(예를 들어, 플루오-4)로 무차별적으로 로드됩니다. 이러한 과제를 극복하고 RP에서 다양한 세포 유형을 연구하기 위해, 유전자 적으로 인코딩된 Ca2+ 지표(GECIs)는 관심 있는 세포 유형에서 Ca2+-민감한 형광을 선택적으로 발현하는 데 활용될 수 있다.
PIC1s/ASMC에서 Ca2+ 과도 특성을 해명하는 대부분의 연구는 평면 시트 RP 조직 제제19,21,27을이미징하여 달성되었다. PIC1s는 PKJ에서 유일한 세포 유형이기 때문에 smMHC, GCaMP의 조건부 발현, smMHC+ 세포에서 이 구성에서 PIC1s를 연구하는 것이 적절하다. 그러나, PIC1s와 PIC2s 모두 PDGFRα를 발현함에 따라 PDGFRα+ 세포에서 GCaMP 변이체의 조건부 발현은 플랫 시트 제제에서 세포 구별을 금지한다. 이 문제를 회피하기 위해, 진동기 단면 접근 법은 PKJ 조직 벽(24)에걸쳐 PIC1s와 PIC2s를 구별하는 데 사용되었다. 이러한 이산 세포 집단을 밝히기 위해 RP는 관상으로 분리되어 알려진 면역 조직화학 라벨링 및 GECI 발현 패턴을 기반으로 근육 벽의 출현 및 PIC1s에서 PIC2s를 식별할 수 있게 했습니다. 이 새로운 PKJ 이미징 접근법의 결과로 PIC1s와 PIC2s는 뚜렷한 Ca2+ 신호 특성24를표시하는 것으로 나타났습니다. 더욱이, PKJ영역(그림 2)의가장 근접한 부분을 격리시킴으로써, RP의 맥박 조정기 영역은 이전에 달성되지 않은 방식으로 보존되었다. 여기서, 프로토콜은 진동 절면을 사용하여 마우스 신장으로부터 PKJ 제제를 분리하는 방법, Ca2+ 이미징 실험을 위한 이러한 제제를 설정하는 방법, 그리고 PKJ 벽을 통해 상이한 세포 유형을 구별하는 방법을 보여주기 위해 설명된다.
프로토콜
이 연구에서 사용된 모든 마우스와 프로토콜은 실험실 동물의 관리 및 사용을 위한 국립 보건 원 가이드와 네바다 대학, 리노, NV의 기관 동물 사용 및 관리 위원회에 따라 사용되었습니다. 실험 및 동물 사용은 또한 그런디28에의해 설명된 원리와 규정을 준수합니다.
1. PDGFRα-GCaMP6f 및 SMCGCaMP3 마우스 생성
- 크로스 GCaMP6f록스/+ 마우스(B6; 129S-Gt(ROSA)26Sortm95.1(CAG-GCaMP6f))Hze/J)와PDGFRαCre 마우스(C57BL/6-Tg(Pdgfra-cre)1Clc/J)를 생성하여 PDGFRα-GCaMP6생을 생성합니다.
- 크로스 GCaMP3록스 /+ 마우스 (B6.129S-Gt(ROSA)26Sortm38 (CAG-GCaMP3)Hze/J) 남성 smMHCCreERT2 마우스 (B6. FVB-Tg(Myh11-cre/ERT2)1Soff/J)를 생성하여 SMC-GCaMP3 마우스를 생성합니다.
참고: 십자가의 수컷마우스(GCaMP3록/+ 마우스 및 smMHCCreERT2 마우스)만이 Y 염색체로부터 구동되는 Cre 발현으로 사용될 수 있다. smMHCCreERT2 마우스는 또한 향상된 Ca2+ 신호 대 잡음 비율 및 빠른 Ca2+ 신호 측두속성을 위한 GCaMP6f록스/+ 마우스와 교차할 수 있습니다.
2. GCaMP의 조건부 발현을 유도하기 위해 타목시펜으로 형질전환생쥐를 준비하고 주입합니다.
- 이전에 설명된29와같이 특정 세포 유형에서 세포 별 GCaMP 발현을 위한 유도형 Cre 재조합을 활성화한다.
3. 솔루션 준비
- 120.35mMM NaCl, 5.9mMM MCl, 15.5m 나HCO3,1.2mMNa2HPO4,1.2mM MgCl 2, 11.5mMMMgCl 2, 11.5mMM MgCl 2, 11.5mMM MgCl2,11.5mMM 의 KCl2를함유한 크렙스 링거 중탄산염(KRB) 용액 1L을 준비한다. 사용 당일, 얼음에 대한 KRB 솔루션을 유지하십시오.
참고: KRB는 최대 1주일 동안 4°C에 보관할 수 있으며 사용하기 전에 최소 10분 동안 97% O2 및 3%CO2를 혼합하여 미리 버블링해야 한다.
4. 실리콘 엘라스토머 코팅 해부 및 현미경 이미징 접시 준비
- 제조업체의 지침에 따라 실리콘 엘라스토머 성분을 혼합합니다. 35mm x 10mm 페트리 접시와 60mm x 15mm 페트리 접시를 각각 이미징 실험 및 해부를 위한 액체 실리콘 엘라스토머의 약 4분의 1을 채웁니다. 실리콘 탄성 중합체를 사용하기 1 일 전에 37 °C에서 중합합니다.
참고: 얇은 신장 섹션의 대비를 향상시키기 위해 실리콘 엘라스토머를 채우기 전에 이미징 페트리 접시의 베이스에 작은 검은 색 종이 원을 바르세요.
5. 신장 해부
- 통풍이 잘 되는 후드에서 3-4%의 이소플루란을 흡입하여 마우스를 마취시합니다. 발가락 및/또는 꼬리 핀치 반사의 손실에 의해 깊은 마취의 유도를 확인하고 자궁 경부 탈구에 의해 마우스를 안락사시.
- 70% 에탄올을 가슴에 바르면 털을 약화시다. 외부 해부 가위를 사용하여, 내부 장기의 손상을 방지하기 위해 동물에서 기울어진 가위 블레이드와 세로 절개를 통해 복강을 엽니 다.
- 내부 조직 집게와 내부 해부 가위를 사용하여 내장을 꼬집어 복부 벽에서 들어 올립니다. 내장을 들어 올리는 동안, 신장을 포함하는 레트로 페톤 론에 대한 액세스를 얻기 위해 근위 십이지장과 말단 결장에서 몸에서 무료로 장의 밑면을 잘라.
- 일단 신장이 드러나면 개별적으로 추출하십시오. 요관의 말단을 부드럽게 꼬집고 들어 올립니다 (신장에서 4mm 떨어진) 조직 집게로. 해부 가위를 사용하여 핀치 된 요관 아래에서 신장쪽으로 잘라냅니다. 그것은 주변 결합 조직에서 해방 될 때까지 신장 아래 절단 계속.
참고: 진동 절편 시 조직의 무결성과 절단 일관성을 최대화하려면 신장이 가능한 한 손상되지 않아야 합니다. 이를 보장하기 위해, 집게와 해부 가위로 신장의 꼬집거나 절단을 피하십시오. - 얼음 차가운 KRB 용액에 부속 된 요관이있는 신장을 놓습니다. 반대로 신장을 가진 단계 5.4 및 5.5를 반복합니다. 얼음에 대한 KRB 용액의 신장을 유지합니다.
참고: PKJ 조직 생존가능성을 보존하기 위해 프로토콜의 다음 섹션으로 즉시 진행합니다. 신장 완두엽증 깊숙이 해부학적 위치 때문에 PKJ는 KRB 용액과의 접촉을 박탈합니다.
6. 진동기 절제에 대한 신장준비
- 신장을 실리콘 엘라스토머 코팅 해부 접시(60mm x 15mm)로 옮기고 신장이 완전히 물에 잠길 때까지 얼음처럼 차가운 KRB 용액으로 채웁니다.
- 해부 현미경으로, 근위 우초에 미누티엔 핀을 삽입하고 얇은 전방 신장 캡슐 또는 주변 지방 조직을 통해 접시의 기지에 신장을 고정.
참고 : 신장 빈혈증 조직을 뚫지 않도록주의하십시오. - 미세한 스프링 가위와 내부 집게를 사용하여 신장 기저에서 지방 조직을 제거하여 탈구 RP 및 근위 우위를 노출시하십시오.
- 미세스프링 가위를 사용하여 RP의 기지에서 근위 우초자와 탈실 RP의 일부를 제거합니다.
참고 : 주변 신장 빈충종을 절단하지 않도록주의하십시오. 그림 1A의 검은색 파선은 이 절단의 대략적인 위치를 나타냅니다. 이 컷은 더 균일 한 조직 단면에 대한 신장에 평평한 기반을 만듭니다. 신장을 해부할 때, 하나는 PKJ 지역의 해부학적 위치를 알고 있어야합니다. 도 1B는 그대로 신장이 수질, 유두(덕트 수집이 수렴되는 실사 수질)와 근위 및 탈구 RP를 노출하기 위해 수축기 평면을 따라 절단될 수 있음을 보여준다. 도 1C에서와 같이 유두가 완전히 노출될 경우 PKJ 및 근위 RP(prox RP)를 시각화할 수 있다. 그러나, 이것은 진동 기술에 대 한 수행 하지 않아야; 본 설명은 도 1D,E에서 PKJ 영역 및 중간 RP 영역의 전송된 광 이미지에 도시된 해부학적 차이에서 강조되는 PKJ 위치에독자를일반적으로 지향하는 것이다. - 미세 팁 집게로 외부 신장 캡슐을 관통하고 신장 몸에서 팁을 기울입니다. 각 손으로 집게를 사용하여 캡슐의 느슨한 끝을 꼬집어 따로 벗깁니다. 완전히 제거 될 때까지 나머지 신장 캡슐 멤브레인을 다시 껍질을 벗깁니다.
참고: 신장 캡슐은 신장을 둘러싸고 있는 단단하고 섬유질적인 층입니다. 최적의 절단을 위해 진동 절편 전에 제거해야 합니다.
7. 진동 악기를 준비하고 교정합니다.
- 진동 악기의 블레이드 홀더에 면도날을 삽입하고 블레이드 클리어런스 각도를 ~18°로 조정합니다.
참고: 더 높은 품질의 단면을 위한 선택적 단계로, 제조업체의 지침에 따라 사용되는 새 블레이드의 블레이드 위치를 조정하기 위해 교정 블록(일부 진동계 계측기 제공)을 사용해야 합니다. 이를 통해 블레이드의 최적의 위치를 보장하고 수직 진동을 최소화할 수 있습니다. - 블레이드 진행 속도를 0.2mm/s로 조정하고, 블레이드의 수평 진동/깎는 속도를 2.00mm의 진폭으로 조정하고, 블레이드의 Z 단계 크기를 ~100-150 μm로 조정합니다. 신장 단면도 두께가 150 μm를 초과하지 않도록 하는 것은 Ca2+ 이미징 실험에 부정적인 영향을 미치게 됩니다(PKJ 벽이 너무 두꺼워지면 종종 자체적으로 굴러 접히기 때문입니다).
참고: 설정은 개별 신장 제제와 진동 기구마다 다르기 때문에 사용자는 이러한 절삭 매개변수를 미세 조정해야 합니다. 미세 조정은 사용자가 7.2 단계에서 설명된 바와 같이 현미경 의 밑에 단면도를 육안으로 검사할 수 있을 때 단면 조정 하는 동안 일어납니다. - 진동 기구에 얼음 욕조와 버퍼 트레이를 설치합니다. 얼음 목욕을 분쇄 된 얼음으로 채우고, 얼음 차가운 KRB 용액으로 내부 단계 영역을 채웁니다 (약 절반만 채워라). 진동 절개 중에 녹은 분쇄된 얼음을 모니터링하고 교체합니다.
8. 신장을 절개하는 진동
- 무딘 단면의 집게를 사용하여 얼음 차가운 KRB 용액에서 준비된 신장을 부드럽게 잡고 제거하십시오. 즉시 과잉 외부 수분을 제거하기 위해 ~ 2-4 초 용 흡수 성 용지에 신장을 놓습니다. 흡수성 종이를 통해 신장을 부드럽게 굴려, 완충종의 모든 면이 건조되어 신장이 진동 단계에 최적의 접착력을 갖도록 합니다.
참고: RP는 신장 안쪽에 위치하므로 외부 parenchyma에 의해 보호되므로이 짧은 건조 기간은 조직의 무결성에 해롭지 않을 것입니다. - 즉시 시아노아크라일트 접착제 (~1cm2)의얇은 층을 진동 시편 플레이트의 베이스에 바르고 무딘 단면포를 사용하여 접착제로 덮인 부위에 신장, 우레 옆구리를 내려 놓습니다. 약 10-20s의 집게 가장자리로 신장 상단에 하향 압력을 부드럽게 적용하여 접착제를 건조시다.
참고: 이 시술 중에 신장을 안정시키기 위해 추가 한 쌍의 포셉을 사용하여 접착제가 건조할 때 신장을 똑바로 유지하십시오. 신장이 직선으로 절단되도록 똑바로 자세로 시편 판을 부착하는 것이 중요합니다. 신장이 성공적으로 표본 판에 부착되었는지 확인하기 위해 신장의 측면을 부드럽게 밀어 넣습니다. 신장이 성공적으로 접시에 부착된 경우 신장의 기저는 플레이트에 고정되어 있어야 합니다. - 완충용지 의 바닥에 표본 판을 단단히 고정합니다. 신장의 상단이 완전히 침지되도록 KRB 용액의 수준을 조정합니다. 단면 단계 동안 진동 블레이드가 버퍼 트레이 깊숙이 이동함에 따라 KRB 용액을 제거하여 블레이드 홀더가 용액에 침지되지 않도록 합니다.
참고: 이 단계를 진행하기 전에 접착제가 완전히 건조되지 않은 경우 접착제는 종종 기지에서 신장 완두엽종으로 이동합니다. 이 과도한 접착제는 단면화가 더 가변적입니다. 이런 일이 발생하면, 접시에서 신장을 제거하고 신선한 신장 준비를 진행합니다. - 자동 진동 절개의 경우 진동 블레이드 절단 사이클의 시작 및 끝 위치를 선택합니다. 이러한 위치는 신장의 ~0.5-1cm 가 분명하여 각 블레이드가 발전할 때마다 전체 신장 평면이 단면되었는지 확인합니다.
- KRB 용액으로 우물을 채우고 접시를 얼음 위에 놓음으로써 멀티웰 플레이트(24-또는 48웰)를 준비합니다.
참고: 생성되면 개별 섹션을 별도의 우물에 배치하여 단면 깊이를 추적해야 합니다. - 자동 절단 공정을 시작합니다. 블레이드의 초기 패스 동안 블레이드가 신장 의 맨 꼭대기와 접촉하도록하십시오. 접촉이 이루어지지 않으면 블레이드의 시작 Z 위치를 조정합니다.
- 집게를 사용하여 신장에서 해방되는 섹션을 수집합니다. 즉시 개별 우물로 섹션을 전송하고, 신장 섹션 내에서 대략적인 PKJ 위치를 측정하기 위해 섹션의 Z 깊이를 주의한다.
참고: 절단 매개 변수에 따라 일부 섹션은 신장 블록에서 무료로 절단되지 않을 수 있습니다. 이 경우, 조심스럽게 신장 블록에서 섹션을 잘라 미세 스프링 가위를 사용합니다. 사용자는 또한 최적의 절단 설정 및 조직 위치를 보장하기 위해 개별 우물에서 자유 부동동안 가벼운 현미경으로 섹션을 적극적으로 시각화하는 것이 좋습니다. PKJ를 포함하는 단면도는 전형적으로 신장의 상부에서 1000-1500 μm의 파생될 것입니다. - PKJ 영역이 더 명백해질 때까지 단면 프로토콜을 계속합니다. 섹션화 수익금으로 PKJ 지역에 대한 설명을 위한 대표 결과 섹션을 참조하십시오.
- 이 시점에서 단면 매개 변수를 최적화하여 섹션이 신장 블록에서 균일하게 해방되고 손상되지 않도록 합니다. 또한, 깨진 PKJ 벽으로 인해 벽 내의 세포의 적절한 이미징을 허용하지 않기 때문에 PKJ 영역이 연속적이고 끊어지지 않았는지 확인하십시오. 벽이 부러지면 단면 속도를 줄이고 단면 두께를 증가시키고 경 현미경 아래의 섹션을 계속 관찰하여 절단 매개 변수를 미세 조정합니다.
- 실험이 시작될 때까지 KRB 솔루션에 4°C의 섹션을 저장합니다.
9. 신장 슬라이스 Ca2+ 이미지 수집
- 개별 신장 슬라이스를 실리콘 엘라스토머 코팅 이미징 접시(35mm x 10mm)로 옮기고, 즉시 신선한 얼음처럼 차가운 KRB 용액으로 접시를 채웁니다.
- 신장 슬라이스 주변의 미누티엔 핀을 삽입하여 이미징 접시의 밑면까지 부분을 고정하십시오.
참고: 이 단계는 이미징 중에 생리적 용액이 슬라이스 에 퍼플 때 섹션이 이동하는 것을 방지하는 데 중요합니다. - 똑바로 회전 디스크 공초점 현미경의 무대에 이미징 접시를 배치하고 즉시 KRB 솔루션과 침투 시작합니다.
참고 : 이 프로토콜에서는 고속 Nipkow 회전 디스크 공초점 스캐너 장치가 장착 된 직립 현미경이 사용되었습니다. - 3mL/min 및 KRB 용액 온도에서 36 ± 1°C에서 관류 속도를 유지합니다. 이미징전에 슬라이스가 1시간 동안 평형화되도록 합니다.
- 적절한 이색 이미징 큐브와 레이저를 선택합니다. 전자곱전하전소(EMCCD) 또는 과학적 보완금속-산화물-반도체 카메라로 이미지를 획득한다.
참고 : 이 프로토콜의 공초점 시스템은 GCaMP6f 또는 GCaMP3를 자극하는 488 nm 레이저를 갖추고 있습니다. 이미지는 512 픽셀 x 512 픽셀 EMCCD 카메라를 사용하여 획득되었습니다. - 낮은 배율, 수분 침지 목표 렌즈(4배 또는 10배)를 사용하여 신장 슬라이스를 찾습니다. PKJ가 존재하는 슬라이스의 영역에 이미징 필드를 집중합니다. 그림 2D에묘사 된 바와 같이 랜드 마크를 식별하여 PKJ (즉, 근위 조직 사이에 중단 된 근육 조직의 반원)을 찾습니다.
- PKJ가 위치한 후에는 더 높은 배율 수침 목표 렌즈(20배, 40배 또는 60x)를 사용하여 관심 영역을 확대합니다.
참고: 이 프로토콜에서는 20배 목표 수치 조리개(NA)가 1.0이고, 40배 목표 NA는 0.8이었고, 60배 목표 NA는 1.0이었다. - PDGFRα+ 세포 또는 SMC에서 GCaMP6f 또는 GCaMP3를 발현하는 형질전환 마우스를 사용하여 PKJ 벽에 대한 다양한 관심 세포를 구별한다. PDGFRα + GCaMP6f + 신장 슬라이스의 PKJ 벽내의 PDGFRα+ 세포의 다양한 유형의 Ca2+ 과도 지속 시간을 관찰하고(그림3C,설명에 대한 대표적인 결과 참조) 및 SMC GCaMP3 + 신장 슬라이스의 GCaMP3 + SMC에서 SMCMP3+ SMC에서 의 SMCMP3 +SMC(그림 3D,설명을 위한 대표적인 결과 참조).
- PKJ 벽에 대한 관심 있는 세포가 확인되면 레이저 강도를 조정하여 좋은 신호 대 잡음 비율을 산출합니다. 적절한 수집 소프트웨어를 사용하여 16Hz에서 32Hz 사이의 시간 샘플링 주파수에서 이미지를 기록합니다.
참고: 이미징 중에 사용되는 레이저 강도에 따라 Ca2+ 형광에 대한 표백 효과로 인해 기록 수를 제한하는 것이 좋습니다. 사용자는 특정 실험 목표에 따라 기록 길이를 선택해야 합니다.
10. Ca2+ 이미징 분석
- PKJ 맥박조정기 영역에서 다른 세포 유형에 대한 Ca2+ 이미징 분석을 수행한 것은위장관(29)및30에서다른 온전한 맥박 조정기 제제에 대해 이전에 설명된 바와 같이 주각측량 매핑에 의해 수행된다.
결과
PKJ의 시투 Ca2+ 이미징에서 RP 맥박 조정기 세포의 중요한 세포 활성을 나타낼 수 있습니다. 세포별 프로모터에 의해 구동되는 유전자 인코딩된 Ca2+ 지표(예: GCaMP)를 발현하는 마우스를 사용하여, RP 페이스메이킹에 대한 정보는 플랫 시트 RP 제제에서 Ca2+ 이미징 실험에서 불가능한 정확성과 세부 사항으로 얻을 수 있다. PKJ의 시작은 신장 빈약한 조직 사이에 중단된 근육의 반원의 갑작스런 출현에 의해 구별된다(도2C;파선상자에 동봉된 근위 PKJ). 단면의 후속 라운드 도중, 내부 medulla는 주변 피질 조직에서 구별됩니다. 가벼운 현미경하에서, 내부 수질은 피질 조직에 비해 색이 가볍고 신장의 나머지 부분과 함께 긴 축에서 불연속되는 부위에 있는 것으로나타난다(도 2B,D). 이 시점에서 더 많은 PKJ 영역이 나타나기 시작합니다. 이것의 예는 도 2D (대시 직사각형, H 및 G)에 표시되며 근육의 3 반 원은 부렌치 조직에 의해 중단됩니다. 이러한 근육 밴드는 밀접하게 내부 유두에 포지셔드리고 일반적으로 신장 동맥(그림 2D,대시 사각형을 이웃합니다; 그림 2F-H,검은 색 화살촉). 더 많은 단면이 파생됨에 따라, 이러한 근육 밴드는 PKJ영역(그림 2E)의끝을 나타내는 보다 완전하고 통일된 구조를 형성하기 위해 통합됩니다.
도 3A,B는 PDGFRα+ 세포에서 GCaMP를 발현하는 마우스로부터 저전력(4-10x)에서 PKJ 섹션을 나타낸다(GCaMP6f는 Pdgfra에의해 구동되는 유도가능한 Cre-recombinase에 의해 표현). 신장 동맥(도 3A;별표)과 같은 랜드 마크를 사용하여 실험자는 빈약한 조직(도 3B;별표)사이에 매달린 얇은 PKJ 벽을 쉽게 구별 할 수 있어야합니다. 이러한 특정 형질전환 조직에서 GCaMP6f의 발현은 PKJ의 전체 폭을 가로질러 근육과 출현층(도 3C)에걸쳐 퍼져 있다.
PDGFRα+ GCaMP6f+ 신장 슬라이스에서, 전형적으로 PKJ 벽의 폭을 통해 확장되는 세포의 네트워크는 형광(도3C)이될 것이며, 다양한 지속 시간 및 주파수의 진동 Ca2+ 과도를 표시한다. PKJ 벽의 PDGFRα+ 세포는 Ca2+ 과도 지속 시간의 두 가지 유형을 표시합니다. 출현 층 (피질에 가까운 방향) 에서, PDGFRα+ 세포의 네트워크로 존재하는 세포와 그 과정은 정의된다. 재림 PDGFRα+ 세포는 저주파(4± 2.7Hz) 및 장기(1± 0.67s) Ca2+ 과도를 나타낸다. PDGFRα+ 세포의 두 번째 층은 근육 층 (수질에 가깝게 방향화됨)에 존재하며, 동일한 세포 유형과 마찬가지로 SMC GCaMP3 + 세포 (아래에 설명된)와 유사한 Ca2 + 과도 주파수 및 지속 시간을 나타낸다.
SMC GCaMP3+ 신장 슬라이스에서, GCaMP3+ 세포의 층은 근육 층(도3D)에존재한다. 출현 층(도 3D; 별표)에는 형광 신호가 없습니다. 근층의 GCaMP3+ SMC는 일반적으로 고주파(10± 4Hz) 및 단기(632 ± 74s) Ca2+ 과도를 나타낸다. PKJ 내림탈에 위치한 PDGFRα+ 세포는 장기간, 저주파 Ca2+ 과도(그림3E,비디오 1)를유도한다. 그러나, Myh11 프로모터에 의해 구동되는 GCaMP3를 발현하는 조직에서 Ca2+ 이미징 실험은 PKJ(도3D)의근육 양상으로 제한된다. 출현시 PDGFRα+ 세포에 비해, SMC는 더 짧은 기간 Ca2+ 과도를 더 자주 발사하였다(그림3F,비디오 2).
PKJ PDGFRα+ IC에서 신호 특성을 이해하는 것 외에도, 진동절면 신장에서 다른 세포 유형을 연구하는 이 기술의 적용이 이 논문에서 입증되었다. 신장 수질(PDGFRα+ 세포에서 GCaMP6f를 발현하는 마우스에서)을 면밀히 살펴보면, 형광 Ca2+ 신호의 배열이 내및 주변 수집 덕트(Video3)를관찰하였다. 수질 PDGFRα+ 세포는 가변 주파수 및 지속 시간의 자발적인 Ca2+ 과도를 발사하였다. 신장 진동 절개에 대한 이러한 Ca2+ 이미징 연구는 종종 PKJ 근육 세그먼트(그림 2F,G; 흰색 화살표)를 이웃 신장 동맥 (~50-80mm 직경)을 연구하는 것으로 확장 될 수 있습니다. 신장 동맥의 Ca2+ 화상 진찰 (부드러운 근육 세포에서 GCaMP를 표현하는 조직에서) SMC에서 발진 Ca2+ 과도를 보여줍니다(비디오 4).
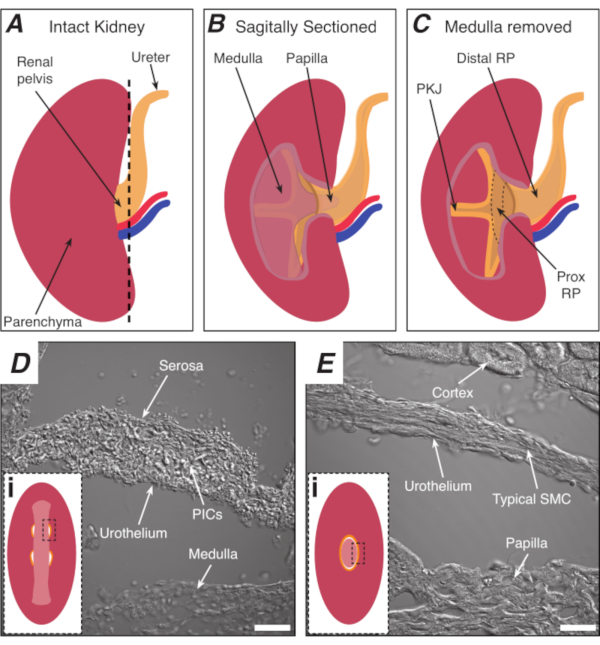
그림 1: PKJ 심박동기 영역의 기본 신장 해부학 및 위치. (A)RP 및 요관의 방향을 나타내는 온전한 신장의 다이어그램. 신장 동맥과 신장 정맥은 각각 빨간색과 파란색으로 표시됩니다. (b)그대로 신장은 수질, 유두(덕트 수집이 수렴되는 실손 수질), 근위 및 단종 RP를 포함하여 신장의 내측 면을 노출하기 위해 처진 평면을 따라 절단될 수 있다. (C)수질과 유두는 PKJ및 프록시 RP를 완전히 노출하도록 절제될 수 있다. (D 및 E)는PKJ 심박동기 영역 및 단면 RP로부터 각각 전송된 광 이미지를 나타낸다. 골반의 말단을 향한 순차적 단면은 PKJ영역(Di)에서근육의 반원을 결합하여 전체 유두를 캡슐화하는 1개의 두꺼운 근육순환(Ei)으로 결합한다. Di와 Ei의 검은색, 파선 직사각형은 전염된 빛 이미지를 획득한 관상 신장 섹션의 대략적인 영역을 보여줍니다. 이미지 D및 E의 방향은 각각의 인세트(Di 및 Ei)에대해 시계 반대 방향으로 90° 입니다. D 및 E = 20 μm의 스케일 막대. 약어 : RP = 신장 골반; 프록시 RP = 근해 신장 골반; PKJ = 골반 신장 접합; PIC = 혈소판 유래 성장 인자 수용체-알파 양성 간질 세포; SMC = 부드러운 근육 세포. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
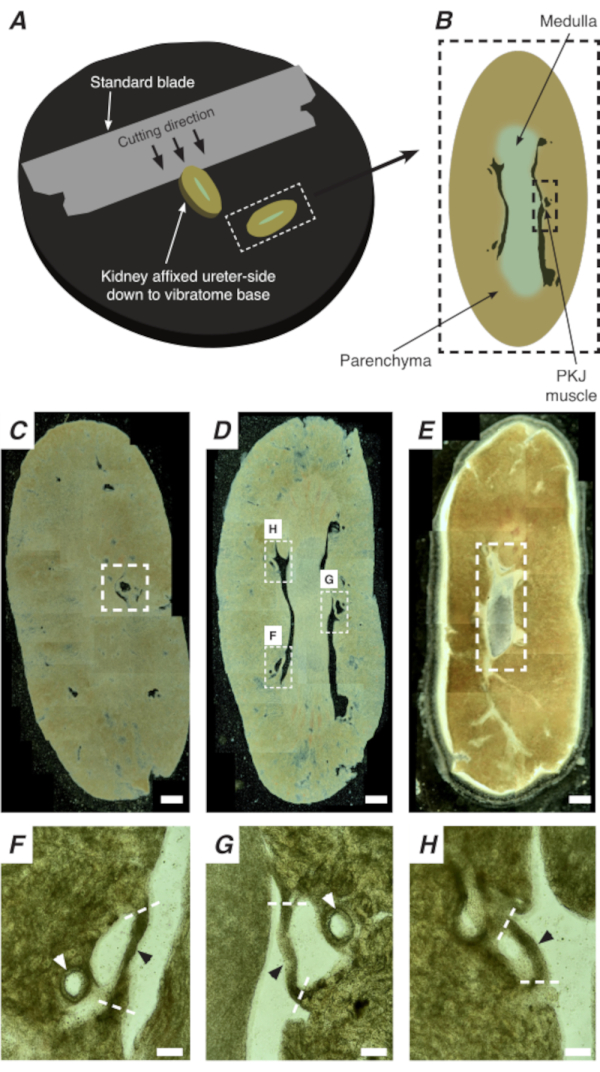
도 2: 전체 신장의 진동 절편은 얇은 부분을 생성합니다. (A)신장은 진동기계의 기저까지 우관 측에 장착되어, 표준 블레이드(진동수 헤드에 부착)는 신장의 하부 끝에서 하부측으로 순차적인 부분을 절단하는 데 사용된다. (B)부가된 랜드마크가 있는 신장 전체에서 잘라낸 얇은 단면의 다이어그램 표현. PKJ 근육 세그먼트 (검은 대시 사각형) 종종 빈약한 조직 사이 일시 중단 발견. (C)근위 신장 섹션의 가벼운 현미경 이미지. 완두엽 조직 사이에 매달린 근육 밴드의 출현은 근위 PKJ 투영의 시작을 나타냅니다 (흰색 대시 직사각형 내부표시). (D)여러 (2-3) PKJ 세그먼트가 발견 될 수있는 최적의 영역을 나타내는 가벼운 현미경 이미지 (흰색 대시 사각형 내의 영역). 얇은 PKJ 근육 스트립 신장 parenchyma 사이 일시 중단 하 고 신장 동맥 및 수 질과 밀접 하 게 정렬. (E)말단 신장 섹션의 가벼운 현미경 이미지. 개별 근육 세그먼트는 내부 유두를 둘러싸고 있는 단일 연속 근육 밴드(흰색 대시 직사각형)를 형성하기 위해 병합되었습니다(이 이미지에는 존재하지 않음). 스케일 바 C-E = 500 μm. F-패널 D에서H 줌(20x) 영역은 PKJ(검은 색 화살촉), 신장 동맥(흰색 화살촉)의 위치를 나타내며 PKJ(파선 된 흰색 선)를 격리하기 위한 절단 부위를 나타냅니다. 스케일 바 F-H = 100 μm. 약어: PKJ = 골반 신장 접합. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
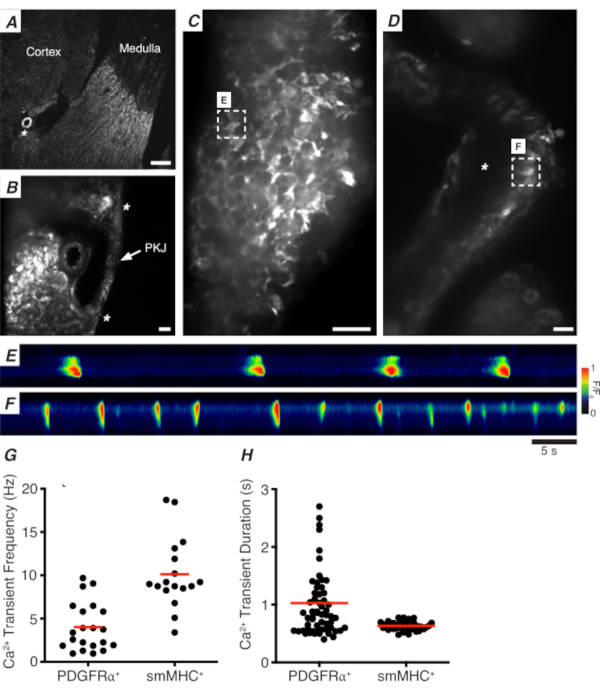
그림 3: 진동기 섹션의 Ca2+ 이미징. (A)신장 동맥(별표)의 위치를 나타내는 진동부 섹션의 대표적인 저전력 이미지(4x). 스케일 바 = 200 μm.(B)PKJ (라벨)의 대표적인 이미지는 PKJ 근육 (흰색 화살촉), 신장 동맥 (별표)의 위치를 나타내는 신장 완두콩 조직 사이에 일시 중단된다. 비늘 바 = 50 μm.(C)PDGFRα+ 세포에서 GCaMP를 발현하는 PKJ의 고출력(40x) 영상. 스케일 바 = 20 μm.(D)PKJ의 고출력(20x) 이미지는 부드러운 근육 세포에서 GCaMP를 발현한다. 스케일 바 = 20 μm.(E)패널 C에표시된 GCaMP+ PDGFRα+ 셀에서 샘플링된 Ca2+ 과도의 스파티오 측도맵. F/F0으로코딩된 테이블을 찾아보세요. (F)패널 D에표시된 GCaMP+ PDGFRα + 셀에서 샘플링된 Ca2+ 과도의 스파티오 측도 맵. F/F0으로코딩된 테이블을 찾아보세요. (G)GCaMP+ PDGFRα+ 세포 및 GCaMP + smMHC 셀에 대한 Ca2+ 과도 주파수(Hz)에 대한 대표적인 데이터. (H)GCaMP+ PDGFRα+ 세포 및 GCaMP + smMHC 셀에 대한 Ca2+ 과도 지속 시간(들)에 대한 대표적인 데이터. 약어: PKJ = 골반 신장 접합; PDGFRα+ = 혈소판 유래 성장 인자 수용체-양성; smMHC = 부드러운 근육 미신 무거운 체인. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
비디오 1: PKJ 진동 절개내내 의 GCaMP+ PDGFRα+ 세포에서 자발적인 Ca2+ 과도. 약어: PKJ = 골반 신장 접합; PDGFRα+ = 혈소판 유래 성장 인자 수용체-알파 양성. 이 비디오를 보려면 여기를 클릭하십시오. (다운로드하려면 마우스 오른쪽 클릭)
비디오 2: GCaMP + 골반 신장 접합 진동 섹션의 부드러운 근육 세포에서 자발적인 Ca2+ 과도. 이 비디오를 보려면 여기를 클릭하십시오. (다운로드하려면 마우스 오른쪽 클릭)
비디오 3: 신장 수질 진동 절개에 있는 GCaMP+ PDGFRα+ 세포에 있는 자발적인 Ca2+ 과도. 약어: PDGFRα+ = 혈소판 유래 성장 인자 수용체-알파 양성. 이 비디오를 보려면 여기를 클릭하십시오. (다운로드하려면 마우스 오른쪽 클릭)
비디오 4: 신장 동맥의 진동기 섹션에서 낮은 진폭 Ca2+ 일시적인 활성. 이 비디오를 보려면 여기를 클릭하십시오. (다운로드하려면 마우스 오른쪽 클릭)
토론
RP는 다양한 RP 영역에서 관찰되는 차동 세포 밀도를 가진 세포의 이기종 집단으로 구성됩니다. PIC1s(이전에 ASMC라고 함)는 PKJ에서 가장 풍부하며, 여기서 맥박 조정기 활동은24에서시작됩니다. 여기에 설명된 프로토콜은, 조사관이 마우스 신장의 나머지 부분에서 심박동기 지역을 격리할 수 있습니다. 진동을 사용하여 PKJ의 섹션을 절단함으로써 RP의 심박동기 영역(parenchyma에 부착된 근육 밴드로 식별)은 그대로 유지되므로 세포별 형광 기자와 결합될 때 RP 심박동기 세포를 정확하게 연구하기 위해 시투 이미징을 사용할 수 있습니다.
이 방법은 RP 페이스 메이킹에 대한 새로운 통찰력을 제공할 수 있지만, 실험자가 이미징 결과 와 단면 효율을 개선하기 위해 잘 알고 있어야 하는 몇 가지 고려 사항이 있습니다. 숙련되지 않은 사용자의 경우 PKJ 격리 및 이미징이 방법은 플랫 시트 RP 제제의 일반적인 날카로운 해부보다 쉽게 배울 수 있습니다. 전체 신장에서 RP의 날카로운 해부는 성공적으로 생리 실험을 위한 실행 가능한 조직을 격리하기 위하여 일관된 사례의 주를 요구합니다. 이 진동 절제 프로토콜은 거의 날카로운 해부 지식을 필요로하므로, 그것은 다른 부드러운 근육 구조를 해부 경험이없는 사용자가 액세스 할 수 있습니다.
그러나 이 프로토콜에 대해 몇 가지 중요한 점이 있습니다. 성공적으로 진동성 표본 판에 신장을 준수하는 것은 손재주와 인내심이 필요합니다. 신장이 잘못 방향을 지정하고 한쪽에 기울어지면 직선 섹션이 아닌 경사가 절단됩니다. PKJ의 섬세한 특성으로 인해 경사 각도는 종종 심박 조율기 영역의 근육 밴드를 파괴 할 수 있습니다. 더욱이, 경사 섹션의 화상 진찰은 세포 네트워크가 전형적으로 동일 초점 평면에 있지 않기 때문에 나쁜 화상 진찰 취득 결과. 절차는 또한 시간이 많이 소요됩니다, 단일 신장의 단면은 수시로 완료하는 데 1 시간까지 걸리는, 그 동안 설치는 감시를 필요로 합니다.
진동의 움직임이 가속화될 수 있지만 속도가 너무 증가하면 (프로토콜에서 권장되는 것보다 >20% 증가), 블레이드는 신장을 깨끗하게 자르기보다는 파쇄되어 섬세한 PKJ 구조의 손실을 초래합니다. 마찬가지로, 너무 낮은 절삭 속도는 단면도될 수 있습니다. 절삭 속도와 블레이드 진폭의 최적화는 필수적입니다. 진동 섹션을 처리하는 데도 주의를 기울여야 합니다. 그들의 섬세한 성격 때문에, PKJ 근육은 취급 도중 쉽게 중단되고 찢을 수 있습니다. 잘 훈련된 사용자는 Ca2+ 이미징 실험에 적합한 4개의 신장 조각당 대략 1-2 PKJ 지구를 수확할 수 있을 것입니다. 일반적으로 Ca2+ 이미징 기준을 충족하지 않는 PKJ 섹션에는 1) GCaMP 발현이 좋지 않거나 2) 왜곡된 PKJ 벽 또는 3) 깨진 PKJ 벽이 있습니다. 데이터 분석을 위해, 시야당 약 3-4세포(FOV)를 샘플링할 수 있었다.
PDGFRα-GCaMP6f 및 SMC-GCaMP3 PKJ 섹션의 FOV에 많은 세포가 있는 동안, 작은 조직 운동은 수시로 분석에서 세포를 제외합니다. 일반적으로 이미지에 안정화 프로토콜을 적용하여 해결할 수 있습니다. 준비가 움직이지 않는 조건에서, 적어도 3-5 세포는 SMC-GCaMP3 단면도에서 PDGFRα-GCaMP6f 단면도 및 5-6 세포에서 샘플링될 수 있다. 전형적으로, 동물 희생에서 취한 시간 (마우스에 대한 최적의 나이는 8-16 주입니다) Ca2+ 이미징 실험을 수행하기 위해 2-3 시간이며, 조직이 필요할 때 시술 내내 얼음 차가운 솔루션에서 배양되는 경우 조직의 무결성을 보장하기에 적합합니다. 요약하자면, 진동기 절단 프로토콜은 마우스 신장으로부터 RP PKJ 영역의 그대로 제제를 생성하기 위해 여기에 설명되었다. 이 기술은 Situ Ca2+ 이미징 연구에서 RP 심박동기 영역을 보존하여 RP 심박조율기 메커니즘을 조사할 수 있도록 합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 프로젝트는 NIDDK에서 R01 DK124509에 의해 투자되었다.
자료
| Name | Company | Catalog Number | Comments |
| 24-well culture plate | ThermoFisher Scientific | 142485 | To store kidney slices in |
| 35 mm x 10 mm Petri dishes | Sigma Aldrich | CLS430165 | Kidney slice calcium imaging dish |
| 48-well culture plate | ThermoFisher Scientific | 152640 | To store kidney slices in |
| 60 mm x 15 mm Petri dish | Sigma Aldrich | P5481 | Kidney sharp dissection dish |
| Absorbent paper | Fisher Scientific | 06-666A | To dry the kidney before applying glue |
| B6;129S-Gt(ROSA)26Sor/J | The Jackson Laboratory | 13148 | GCaMP3 Mice |
| B6;129S-Gt(ROSA)26Sor/J | The Jackson Laboratory | 24105 | GCaMP6f Mice |
| B6.FVB-Tg(Myh11-cre/ERT2)1Soff/J | The Jackson Laboratory | 19079 | smMHC-CRE Mice |
| C57BL/6-Tg(Pdgfra-cre)1Clc/J | The Jackson Laboratory | 13148 | PDGFRa-CRE Mice |
| Cyanoacrylate glue | Amazon | B001PILFVY | For adhering the kidney to the specimen plate |
| Ethanol | Phamco-Aaper | SDA 2B-6 | For dissection |
| Extra-Fine Bonn Scissors | Fine Science Tools | 14083-08 | Used for internal dissecting scissors |
| Fine scissors | Fine Science Tools | 14060-09 | Used for external dissecting scissors |
| Fine-tip forceps | Fine Science Tools | 11254-20 | Used for fine dissection of kidney |
| Gillette Silver Blue double-edge blades | Amazon | B009XHQGYO | For insertion into blade holder of vibratome |
| ImageJ | NIH | For calcium imaging analysis | |
| Isoflurane | Baxter | NDC 1001936060 | For anesthesia |
| Minutien pins | Fisher Scientific | NC9677548 | Pins were cut in half to reduce their length |
| Silicon elastomer | Fisher Scientific | NC9285739 | Sylgard 184 |
| Student Adson Forceps | Fine Science Tools | 91106-12 | For gently holding and moving the kidney |
| Student Dumont Forceps | Fine Science Tools | 91150-20 | Used for internal dissecting forceps |
| Vannas spring scissors | Fine Science Tools | 15000-03 | For sharp dissection and cleanup of isolated kidney |
| Vibrocheck | Leica | 14048142075 | Optional component for calibrating blade movement during cutting |
| VT1200 S Vibrating Blade Microtome | Leica | 14912000001 | Configuration 1 is used in our protocol |
참고문헌
- Constantinou, C. E., Djurhuus, J. C. Pyeloureteral dynamics in the intact and chronically obstructed multicalyceal kidney. The American Journal of Physiology. 241 (5), 398-411 (1981).
- Constantinou, C. E., Yamaguchi, O. Multiple-coupled pacemaker system in renal pelvis of the unicalyceal kidney. TheAmerican Journal of Physiology. 241 (5), 412-418 (1981).
- Constantinou, C. E., Hrynczuk, J. R. Urodynamics of the upper urinary tract. Investigative Urology. 14 (3), 233-240 (1976).
- Schmidt-Nielsen, B., Schmidt-Nielsen, B. On the function of the mammalian renal papilla and the peristalsis of the surrounding pelvis. Acta Physiologica. 202 (3), 379-385 (2011).
- Dwyer, T. M., Schmidt-Nielsen, B. The renal pelvis: machinery that concentrates urine in the papilla. Physiology. 18 (1), 1-6 (2003).
- Hill, W. G. Control of urinary drainage and voiding. Clinical Journal of the American Society of Nephrology. 10 (3), 480-492 (2015).
- Brading, A. F. The physiology of the mammalian urinary outflow tract. Experimental Physiology. 84 (1), 215-221 (1999).
- Dixon, J. S., Gosling, J. A. The musculature of the human renal calices, pelvis and upper ureter. Journal of Anatomy. 135, 129-137 (1982).
- Lang, R. J., et al. Pyeloureteric peristalsis: role of atypical smooth muscle cells and interstitial cells of Cajal-like cells as pacemakers. The Journal of Physiology. 576, 695-705 (2006).
- Lang, R. J., Takano, H., Davidson, M. E., Suzuki, H., Klemm, M. F. Characterization of the spontaneous electrical and contractile activity of smooth muscle cells in the rat upper urinary tract. Journal of Urology. 166 (1), 329-334 (2001).
- Lang, R. J., Exintaris, B., Teele, M. E., Harvey, J., Klemm, M. F. Electrical basis of peristalsis in the mammalian upper urinary tract. Clinical and Experimental Pharmacology & Physiology. 25 (5), 310-321 (1998).
- Morita, T., Ishizuka, G., Tsuchida, S. Initiation and propagation of stimulus from the renal pelvic pacemaker in pig kidney. Investigative Urology. 19 (3), 157-160 (1981).
- Tsuchida, S., Morita, T., Harada, T., Kimura, Y. Initiation and propagation of canine renal pelvic peristalsis. Urologia Internationalis. 36 (5), 307-314 (1981).
- Yamaguchi, O. A., Constantinou, C. E. Renal calyceal and pelvic contraction rhythms. American Journal of Physiology - Regulatory Integrative and Comparative Physiology. 257 (4), 788-795 (1989).
- Klemm, M. F., Exintaris, B., Lang, R. J. Identification of the cells underlying pacemaker activity in the guinea-pig upper urinary tract. Journal of Physiology. 519 (3), 867-884 (1999).
- Lang, R. J., et al. Spontaneous electrical and Ca2+ signals in the mouse renal pelvis that drive pyeloureteric peristalsis. Clinical and Experimental Pharmacology & Physiology. 37 (4), 509-515 (2010).
- Lutzeyer, W. Pacemaker process of ureteral peristalsis in multicalyceal kidneys. Urologia Internationalis. 37 (4), 240-246 (1982).
- Lang, R. J., Hashitani, H. Pacemaker mechanisms driving pyeloureteric peristalsis: modulatory role of interstitial cells. Advances in Experimental Medicine and Biology. 1124, 77-101 (2019).
- Hashitani, H., et al. Interstitial cell modulation of pyeloureteric peristalsis in the mouse renal pelvis examined using FIBSEM tomography and calcium indicators. Pflugers Archiv: European Journal of Physiology. 469 (5-6), 797-813 (2017).
- Lang, R. J., Hashitani, H., Tonta, M. A., Suzuki, H., Parkington, H. C. Role of Ca2+ entry and Ca2+ stores in atypical smooth muscle cell autorhythmicity in the mouse renal pelvis. British Journal of Pharmacology. 152 (8), 1248-1259 (2007).
- Lang, R. J., Hashitani, H., Tonta, M. A., Parkington, H. C., Suzuki, H. Spontaneous electrical and Ca2+ signals in typical and atypical smooth muscle cells and interstitial cell of Cajal-like cells of mouse renal pelvis. The Journal of Physiology. 583, 1049-1068 (2007).
- Hashitani, H., Lang, R. J., Mitsui, R., Mabuchi, Y., Suzuki, H. Distinct effects of CGRP on typical and atypical smooth muscle cells involved in generating spontaneous contractions in the mouse renal pelvis. British Journal of Pharmacology. 158 (8), 2030-2045 (2009).
- Iqbal, J., et al. Potassium and ANO1/ TMEM16A chloride channel profiles distinguish atypical and typical smooth muscle cells from interstitial cells in the mouse renal pelvis. British Journal of Pharmacology. 165 (7), 2389-2408 (2012).
- Grainger, N., et al. Identification and classification of interstitial cells in the mouse renal pelvis. Journal of Physiology. 598 (15), 3283-3307 (2020).
- Hashitani, H., Mitsui, R., Lang, R. Functional heterogeneity of PDGFRα (+) cells in spontaneously active urogenital tissues. Neurourology and Urodynamics. 39 (6), 1667-1678 (2020).
- Hashitani, H., Lang, R. J. ATYPICAL or INTERSTITIAL, take your PIC. Journal of Physiology. 598 (15), 3061-3062 (2020).
- Lang, R. J., Hashitani, H., Tonta, M. A., Suzuki, H., Parkington, H. C. Role of Ca2+ entry and Ca2+ stores in atypical smooth muscle cell autorhythmicity in the mouse renal pelvis. British Journal of Pharmacology. 152 (8), 1248-1259 (2007).
- Grundy, D. Principles and standards for reporting animal experiments in The Journal of Physiology and Experimental Physiology. Experimental Physiology. 100 (7), 755-758 (2015).
- Drumm, B. T., Hennig, G. W., Baker, S. A., Sanders, K. M. Applications of spatio-temporal mapping and particle analysis techniques to quantify intracellular Ca 2+ signaling in situ. Journal of Visualized Experiments. 2019 (143), 1-13 (2019).
- Leigh, W. A., et al. A high throughput machine-learning driven analysis of Ca2+ spatio-temporal maps. Cell Calcium. 91, 102260 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유