Method Article
隔离和成像现场, 通过颤音分割老鼠肾佩尔维斯的精致起搏器区域
摘要
此协议的目标是使用振动切除隔离小鼠肾骨盆的完整心脏起搏器区域。然后,这些部分可用于原位 Ca2+ 成像,以阐明心脏起搏器细胞和振动切片中其他间质细胞的 Ca2+ 瞬态特性。
摘要
肾骨盆 (RP) 是一种漏斗形状的光滑肌肉结构,通过定期的推进性收缩促进正常尿液从肾脏输送到输尿管。定期的RP收缩依赖于心脏起搏器活性,它源于骨盆肾结(PKJ)的RP最近区域。由于难以获得和保存PKJ的完整制剂,大多数关于RP制动的调查都集中在单细胞电生理学和Ca2+ 成像实验上。虽然这些实验在RP起搏方面已经有了重要的启示,但有几个内在的局限性,包括无法准确确定混合悬架中的细胞身份,以及RP心脏起搏器活性的缺乏就地成像。这些因素导致对正常节奏RP收缩背后的机制的理解有限。本文描述了一个协议,使用振动切除技术准备鼠标PKJ的完整片段。通过将这种方法与表达细胞特异性报告和基因编码的Ca2+ 指标相结合,研究人员或许能够更准确地研究对正常尿液运输至关重要的渗透性RP收缩的特定细胞类型和机制。
引言
肾骨盆 (RP) 是一种漏斗状的光滑肌肉结构,将尿液从肾脏输送到输尿管。RP通过产生定期的节律收缩(腹膜收缩)1,2,3,4,5来输送尿液,从而将尿液从肾脏远射到输尿管,并最终输送到膀胱,在那里储存,直到6,7发生麦克风。失去这种正常活动有可怕的后果,包括肾上腺肿和肾衰竭1,3,8:因此,迫切需要研究定期、有节奏的RP收缩背后的机制。腹膜收缩源于RP最近的区域-在骨盆肾结(PKJ)9,10,11,12,13,14,15(图1A-C),并传播远,推动尿液从乳香草进入RP(图1B)。PKJ 记录为自发瞬态去极化 10、11、12、13、15、16、17,这些电起搏器活动被认为来自专用心脏起搏器细胞。这些心脏起搏器细胞,以前称为非典型平滑肌肉细胞(ASMCs),被认为产生或协调心脏起搏器活动,并推动收缩"典型的"平滑肌肉细胞(SMCs)9,10,11,18,19,20,21,22,23。
ASMC在PKJ(图1A-C)的近身RP中最为丰富,其中渗透收缩和电起搏器活动起源于5、7、8、9、12、13、14、16、17、18、19、20、21 ,22.该组最近发表的一项研究确定血小板衍生生长因子受体-阿尔法(PDGFR+),结合平滑肌肌素重链(smMHC),作为这些间质细胞(ICs)24的独特生物标志物,这一发现已被其他组25证实。根据它们的形态和蛋白质表达模式,这些细胞被称为PDGFR®+ IC类型1(PIC1)24,26。PIC1位于PKJ的肌肉层,在那里它们显示高频,短持续时间Ca2+瞬态,被认为是心脏起搏器潜力24生成的基础。但是,PKJ 中还存在其他细胞类型,包括冒险层中非 smMHC 表达 PDGFR®和IC (PIC2s)。此前有报道称,非mMHCIC可参与心脏起搏器活动的监管。然而,在Ca2+成像研究中,对非mMHCIC的进一步研究因差异差而受阻。通常,RP 制剂中的异质细胞类型不分青红皂白地装载 Ca2+敏感染料(例如 Fluo-4)。为了克服这些挑战并研究RP中的各种细胞类型,可以使用基因编码的Ca2+指标(GECIs)选择性地表达Ca2+敏感荧光在细胞类型的兴趣。
大多数研究阐明了PIC1s/ASMC中Ca2+瞬态特性,是通过成像平板RP组织制剂19、21、27实现的。由于 PIC1 是 PKJ 中唯一表达 smMHC 的细胞类型,因此 GECI、GCaMP 在 smMHC®细胞中的有条件表达适合在此配置中研究 PIC1。然而,由于PIC1和PIC2都表示PDGFR®,PDGFR®细胞中GCAMP变异的有条件表达禁止平板制剂中的细胞区分。为了规避这个问题,使用振动切除方法来区分PKJ组织壁24的PIC1和PIC2。为了揭示这些离散的细胞群,RP 被切开冠状,从而有可能根据已知的免疫造血标记和 GECI 表达模式识别肌肉壁中的 PIC2 和 PIC1。由于这种新的PKJ成像方法,PIC1和PIC2被发现显示独特的Ca2+信号属性24。此外,通过隔离PKJ地区最近的部分(图2),RP的心脏起搏器区域以以前没有完成的方式被保存下来。在这里,一个协议被描述,以显示如何使用颤音切除分离PKJ制剂从小鼠肾脏,如何设置这些准备Ca2+成像实验,以及如何区分不同的细胞类型跨越PKJ壁。
研究方案
本研究中使用的所有小鼠和协议均符合《国家卫生研究院实验室动物护理和使用指南》和内华达州里诺内华达大学机构动物使用和护理委员会。实验和动物使用也符合格兰迪28号所述的原则和规定。
1. 生成PDGFR®-GCAMP6f和SMCGCAMP3小鼠
- 交叉 GCaMP6flox/+ 小鼠 (B6; 129S-Gt (ROSA)26Sortm95.1 (CAG-GCAMP6f)hze/J)与 PDGFR®Cre 小鼠 (C57BL/6-Tg (Pdgfra-cre)1Clc/J) 生成 PDGFR® -GCAMP6f 小鼠。
- 交叉 GCAMP3lox/+ 小鼠 (B6.129S-Gt (ROSA)26Sortm38 (CAG-GCAMP3)hze/J) 与雄性 smMHCCreERT2 小鼠 (B6.FVB-Tg(Myh11-cre/ERT2)1Soff/J)生成SMC-GCAMP3小鼠。
注:只有雄性小鼠的十字架(GCaMP3lox/+ 小鼠和smMHCCreERT2 小鼠)可以使用,因为 Cre 表达是从Y染色体驱动。smMHCCreERT2 小鼠也可以与 GCaMP6flox/+ 小鼠交叉,以改善 Ca2+ 信号与噪声比,并更快地达到 Ca2+ 信号时间属性。
2. 准备和注射转基因小鼠与塔莫西芬诱导有条件的表达GCAMP
- 激活诱导的Cre重组,用于特定细胞类型的细胞特异性GCaMP表达,如前所述29。
3. 准备解决方案
- 准备 1 L 的克雷布斯-林格碳酸氢酸酯 (KRB) 溶液,包含 120.35 mM NaCl, 5.9 mM KCl, 15.5 m M NaHCO3, 1.2 m M Na2HPO4, 1.2 m M MgCl2, 11.5 m 葡萄糖, 和 2.5 m M CaCl2。使用当天,在冰上维护 KRB 溶液。
注:KRB 可在 4 °C 下存储长达一周,使用前至少 10 分钟应与 97% O2 和 3% CO2 混合。
4. 准备硅弹性体涂层解剖和显微镜成像盘
- 根据制造商的说明混合硅弹性体组件。分别填充一个 35 mm x 10 mm 的培养皿和一个 60 毫米 x 15 mm 的培养皿,分别装满四分之一的液体硅弹性体进行成像实验和解剖。在使用前 1 天,在 37 °C 处聚合硅弹性体。
注:为了增强薄肾部分的对比度,在填充硅弹性体之前,在成像培养皿的底座上涂上一小圈黑色纸圈。
5. 肾脏解剖
- 通过吸入通风罩中的3-4%异黄素对小鼠进行麻醉。确认深度麻醉通过失去脚趾和/或尾巴捏反射,然后安乐死小鼠子宫颈错位。
- 将 70% 乙醇涂在胸部以抑制毛皮。使用外部解剖剪刀,通过纵向切口打开腹腔,用剪刀刀片从动物身上倾斜,以防止对内脏器官的损害。
- 使用内组织钳和内部解剖剪刀,捏肠,并解除他们从腹壁。在提升肠道时,在近十二指肠和远端结肠处将肠子的下侧从体内切开,以进入含有肾脏的回胃空间。
- 一旦肾脏暴露,单独提取。用组织钳轻轻捏合并抬起尿道的远端(离肾脏 4 毫米远)。使用解剖剪刀,将捏紧的尿管下方切向肾脏。继续切割肾脏下面,直到它从周围的结缔组织解放出来。
注:为了在颤音切除过程中最大限度地提高组织完整性和切割一致性,肾脏必须尽可能完好无损。为了确保这一点,避免用钳子和解剖剪刀捏或切肾。 - 将肾脏与附加的尿管放在冰冷的KRB溶液中。重复步骤 5.4 和 5.5 与反向肾脏。在冰上保持 KRB 溶液中的肾脏。
注:立即进入协议的下一节,以保持PKJ组织的生存能力。由于其解剖位置深在肾脏帕伦奇马,PKJ被剥夺了与KRB解决方案的接触。
6. 准备肾脏进行颤音切除
- 将肾脏转移到硅弹性体涂层解剖盘(60 毫米 x 15 mm),并填充冰冷的 KRB 溶液,直到肾脏完全淹没。
- 在解剖显微镜下,通过将细小的针脚插入近体输尿管,并通过薄前肾胶囊或周围的脂肪组织将肾脏锚定在盘底。
注意:注意不要刺穿肾脏帕伦奇马组织。 - 使用细弹簧剪刀和内钳从肾脏底部取出脂肪组织,以暴露远期RP和近体尿道。
- 使用细弹簧剪刀将近近导管和部分远距离 RP 从 RP 底部取出。
注意:注意不要切开周围的肾脏帕伦奇马。图 1A中的黑色虚线表示此切口的近似位置。此切口在肾脏上创建一个扁平的碱基,用于更均匀的组织切口。在解剖肾脏时,必须了解PKJ区域的解剖位置。图 1B显示,完整的肾脏可以沿着下垂平面切割,以暴露美杜拉,(收集管道汇合的异位美杜拉)和近缘和基质 RP 。如果乳香完全暴露,如图1C,PKJ和近亲RP(前RP)可以可视化。然而,这不应该为振动技术:此描述是将读者一般地定向到 PKJ 位置,在图 1D、E中 PKJ 区域和中 RP 区域传输的光图像中显示的解剖差异中强调。 - 用细尖钳刺穿外肾胶囊,将尖端从肾脏身体中取出。用钳子用每只手,捏胶囊的松散末端,并把它们剥开。继续剥去剩余的肾胶囊膜,直到它被完全去除。
注:肾胶囊是一个坚硬的纤维层,围绕肾脏。它必须在振动切除之前删除,以获得最佳切割。
7. 准备和校准振动仪
- 将剃须刀刀片插入振动器的叶片支架,并将刀片间隙角度调整为 +18°。
注:作为更高质量的分割的可选步骤,应使用校准块(提供一些振动仪)来调整根据制造商说明使用的每一个新刀片的刀片位置。这将确保刀片的最佳定位,并最大限度地减少垂直振动。 - 将刀片的推进速度调整为 0.2 mm/s,刀片的水平振动/振幅调整为 2.00 mm,刀片的 Z 步尺寸调整为 ±100-150 μm。确保肾脏部分厚度不超过 150 μm,因为这将对 Ca2+ 成像实验产生负面影响(因为 PKJ 壁在太厚时通常会自行滚动和折叠)。
注:用户应微调这些切割参数,因为设置会因肾脏制剂和颤音仪而异。在剖腹产期间应进行微调,以便用户可以在显微镜下目视检查剖面,如第 7.2 步所述。 - 在振动仪上安装冰浴和缓冲盘。用碎冰填充冰浴,用冰冷的KRB溶液填充内部舞台区域(填充到大约半满)。在振动切除过程中,监测并替换已融化的碎冰。
8. 切除肾脏的颤音
- 使用钝器将准备好的肾脏轻轻地从冰冷的 KRB 溶液中取出并取出。立即将肾脏放在吸水纸上 2-4 s,以去除多余的外部水分。轻轻地将肾脏滚动到吸附纸上,以确保肾的四面都干燥,使肾脏与振动器阶段有最佳粘附。
注:由于RP位于肾脏内,因此受到外皮瘤的保护,因此这个短暂的干燥期不会对组织完整性造成损害。 - 立即将一层薄薄的氰丙烯酸酯胶水(+1 cm2)涂抹到振动体标本板的底座上,并用钝杆将肾脏、输尿管侧向下放置,放在胶水覆盖的区域。用钳子的平边轻轻地将向下压力施加到肾脏顶部约 10-20s,以干燥胶水。
注意:为了在手术过程中稳定肾脏,在胶水干燥时,使用额外的钳子保持肾脏直立。关键是肾脏以直立位置粘附在标本板上,以便将部分切成直。为确保肾脏成功粘附在标本板上,轻轻推肾侧。如果肾脏已成功粘附在板上,则肾脏底部应保持固定在板上。 - 将标本板牢牢地固定在缓冲盘的底部。调整 KRB 溶液的水平,使肾脏顶部完全浸入。在分割步骤中,当颤音刀片深入缓冲托盘时,移除 KRB 溶液,使刀片支架不会沉浸在溶液中。
注意:如果胶水在继续这一步骤之前尚未完全干燥,胶水通常会从底座向上移动,然后转移到肾脏帕伦奇马。这种多余的胶水将使分割更具变量。如果真的发生了,从盘子里取出肾脏,然后进行新的肾脏准备。 - 对于自动振动切除,请选择振动切除周期的起始和结束位置。验证这些位置是 +0.5-1 厘米的肾脏,以确保随着每个刀片的推进,整个肾脏平面被分割。
- 通过用 KRB 溶液填充油井并将板放在冰上,准备多井板(24 井或 48 井)。
注:生成时,应将各个部分放置到单独的井中,以跟踪剖面深度。 - 开始自动切割过程。在刀片的初始通过过程中,确保刀片与肾脏顶部接触。如果不进行接触,请调整刀片的启动 Z 位置。
- 使用钳子,收集从肾脏中解放出的部分。立即将部分转移到各个井,并注意各节的 Z 深度,以测量肾脏部分内的近似 PKJ 位置。
注意:根据切口参数,某些部分可能无法从肾块中分离。如果发生这种情况,请小心使用细弹簧剪刀从肾块切开部分。还鼓励用户在光显微镜下主动可视化部分,同时在个别井中自由浮动,以确保最佳切割设置和组织位置。包含 PKJ 的部分通常从肾脏顶部派生 1000-1500 μm。 - 继续分区协议,直到PKJ区域变得更加明显。请参阅代表结果部分,以描述 PKJ 区域作为分区收益。
- 此时,优化剖面参数,确保部分均匀地从肾块中解放,并完好无损。此外,确保 PKJ 区域连续且不间断,因为破裂的 PKJ 墙壁不允许对墙内因坍塌而导致的细胞进行适当的成像。如果墙壁损坏,降低剖面速度并增加剖面厚度,并在光显微镜下继续观察部分,以微调切割参数。
- 在 KRB 溶液中以 4°C 存储部分,直到实验开始。
9. 肾脏切片 Ca2+ 图像采集
- 将单个肾片转移到硅弹性体涂层成像盘(35 mm x 10 mm)上,并立即用新鲜、冰冷的 KRB 溶液填充该盘。
- 在肾切片的外围周围插入细枝末节,将部分固定到成像盘的底座上。
注:此步骤对于防止在成像过程中将生理解决方案灌注在切片上时,该切块移动至关重要。 - 将成像盘放在直立旋转盘共聚焦显微镜的舞台上,并立即开始与 KRB 解决方案进行渗透。
注:在此协议中,使用了直立显微镜,该显微镜配备了高速 Nipkow 旋转盘共焦扫描仪单元。 - 将灌注速率保持在 3 mL/min,KRB 溶液温度保持在 36 ± 1 °C。 在成像之前,让切片平衡 1 小时。
- 选择合适的二色成像立方体和激光。使用电子倍增电荷耦合器件 (EMCCD) 或科学互补的金属氧化物半导体相机获取图像。
注:本协议中的共聚焦系统配备 488 nm 激光,可激发 GCaMP6f 或 GCaMP3。图像是使用 512 像素 x 512 像素 EMCCD 摄像机获取的。 - 使用低放大倍率、浸水客观透镜(4 倍或 10 倍)定位肾片。将成像场集中在 PKJ 存在的切片区域。识别图 2D中描述的地标,以定位 PKJ(即悬浮在肌肉组织之间的肌肉组织的半环)。
- 一旦PKJ定位,使用更高的放大倍率浸水客观镜头(20倍,40倍或60倍)放大感兴趣的区域。
注:本协议中,20 倍目标数值孔径 (NA) 为 1.0,40 倍目标 NA 为 0.8,60 倍目标 NA 为 1.0。 - 分别使用在PDGFR® 细胞或 SMC 中表达 GCAMP6f 或 GCAMP3 的转基因小鼠来区分 PKJ 壁上感兴趣的不同细胞。观察 PDGFR® PKJ 壁中 PDGFR®和肾切片中 PKJ 壁中的不同类型的 Ca2+瞬态持续时间(图 3C,见有代表性的描述结果),在SMC GCAMP3+肾切片中的 GCAMP3+ SMC 中观察不同类型的 Ca 3 + 细胞(图 3D,请参阅具有代表性的结果以供描述)。
- 一旦PKJ壁感兴趣的细胞被识别出来,调整激光强度,产生良好的信号与噪声比。使用适当的采集软件,以 16 Hz 至 32 Hz 之间的时间采样频率记录图像。
注:根据成像过程中使用的激光强度,建议限制由于对 Ca2+ 荧光的漂白影响而增加的录音次数。用户应根据特定的实验目标选择录制长度。
10. Ca2+ 成像分析
- 通过空间间图对PKJ心脏起搏器区域不同细胞类型进行Ca2+成像分析,如先前描述的胃肠道29、30中其他完好无损的心脏起搏器制剂制剂。
结果
PKJ 的原位 Ca2+成像可以揭示 RP 心脏起搏器细胞的重要细胞活性。通过使用在细胞特异性推进器驱动下表达基因编码 Ca2+指标(如 GCaMP)的小鼠,可以从 Ca2+成像实验中从平板 RP 制剂中获取有关 RP 制动的信息,这是不可能获得的。PKJ的开始是突出的突然出现半圆的肌肉悬浮在肾脏帕伦奇马尔组织(图2C:近端PKJ封闭在破折号盒)之间。在随后的几轮切除过程中,内线与周围的皮质组织变得可区分。在光显微镜下,内线在区域出现磨损,颜色较皮质组织轻,其长轴与肾脏其余部分不连续(图2B,D)。此时,将开始出现更多的 PKJ 区域。这方面的例子显示在图2D(破折号矩形,H和G),其中3个半圆的肌肉被悬浮在帕伦奇组织。这些肌肉带将密切贴在内帕皮拉,通常会邻肾动脉(图2D,破折号矩形:图2F-H,黑色箭头)。随着更多的基段被派生,这些肌肉带将整合,形成一个更完整,统一的结构,表明PKJ区域的结束(图2E)。
图3A,B显示PKJ部分在低功率(4-10倍)从小鼠表达GCAMP在PDGFR+细胞(GCAMP6f表示由Pdgfra驱动的诱导克雷重组)。使用肾动脉(图3A:星号)等地标,实验者应该能够轻易地区分悬浮在腹膜组织(图3B:星号)之间的薄PKJ壁。GCaMP6f在这个特定的转基因组织中的表达分布在整个PKJ的宽度,跨越肌肉和冒险层(图3C)。
在PDGFR® GCaMP6f=肾脏切片中,通常延伸到PKJ壁宽度的细胞网络将是荧光(图3C),并显示不同持续时间和频率的振荡 Ca2+瞬态。PDGFR® PKJ 壁中的细胞显示两种不同类型的 Ca2+瞬态持续时间。在临界层(方向更接近皮层),PDGFR® 细胞作为细胞网络存在,其过程被定义。冒险PDGFR®细胞表现出低频(4±2.7赫兹)和长期(1±0.67 s)Ca2+瞬态。PDGFR® 细胞的第二层存在于肌肉层(方向更接近美杜拉),表现出与 SMC GCaMP3®细胞(如下所述)相似的 Ca2+瞬态频率和持续时间,因为它们是同一细胞类型。
在SMC GCAMP3+肾脏切片中,肌肉层中存在一层GCAMP3+细胞(图3D)。在冒险层(图3D:星号)中不会有荧光信号。GCaMP3–肌肉层中的SMC通常表现出高频(10 ± 4 Hz)和短持续时间(632 ±74s)Ca2+瞬态。PDGFR®位于 PKJ 冒险中的细胞引起长期、低频 Ca2+瞬态(图 3E,视频 1)。然而,由Myh11促销器驱动的表达GCaMP3的组织进行的Ca2+成像实验仅限于PKJ的肌肉方面(图3D)。与冒险中的 PDGFR® 细胞相比,SMC 发射的持续时间更短 Ca2+瞬时更频繁(图 3F,视频 2)。
除了了解PKJ PDGFR®和IC中的信号特性外,本文还证明了该技术在研究振动切除肾脏中其他细胞类型的应用。在仔细检查肾麦地亚(在PDGFR+细胞中表达GCaMP6f的小鼠中),观察到收集管道内和周围收集管道内的荧光Ca2+信号阵列(视频3)。医疗PDGFR+细胞发射自发Ca2+变频和持续时间瞬态。这些Ca2+肾脏颤音部分成像研究也可以扩展到研究肾动脉(+50-80毫米直径),经常邻PKJ肌肉段(图2F,G;白箭头)。Ca2+肾动脉成像(来自在平滑肌肉细胞中表达GCaMP的组织)显示SMC中振荡Ca2+瞬态(视频4)。
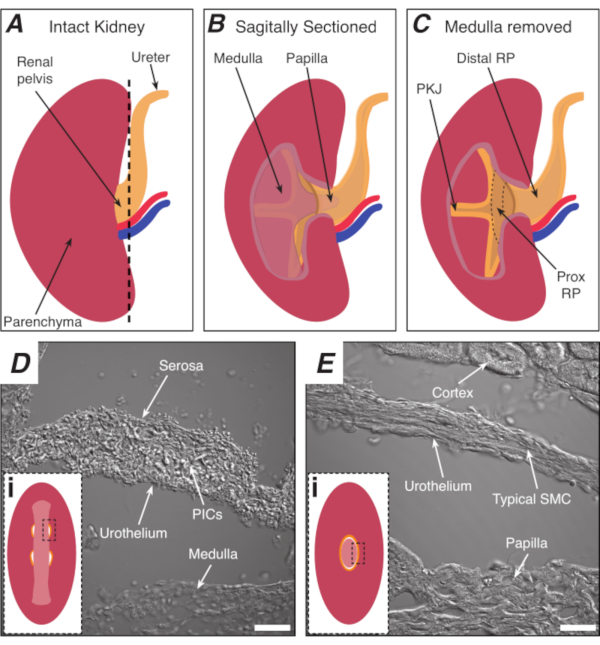
图1:PKJ心脏起搏器区域的基本肾脏解剖和位置。 (A) 完整肾脏图,显示RP和尿道的方向。肾动脉和肾静脉分别以红色和蓝色显示。( B)完整的肾脏可以沿着下垂平面切割,以暴露肾脏的内侧,包括美杜拉、(收集管道聚集的异位美杜拉)和近视和基座 RP 。(C) 甲基安定和乳香可以切除,以完全暴露PKJ和proxRP。(D 和 E)分别代表来自PKJ心脏起搏器区域和远距离RP的传输光图像。朝骨盆远端的连续分割导致 PKJ 区域( Di )肌肉的半周合并成一个较厚的肌肉环( Ei ), 封装整个瘤。 Di 和 Ei 中的黑色、破折号矩形显示冠状肾脏部分的大致区域,其中获得了传输的光图像。图像 D 和 E 的对照方向是 90° 逆时针到各自的插图(Di 和 Ei)。 D 和 E 的秤条 = 20 μm。缩写: RP = 肾骨盆;prox RP = 近鼻骨盆;PKJ = 骨盆肾结;PIC = 血小板衍生生长因子受体-阿尔法-阳性间歇细胞;SMC = 平滑肌肉细胞。 请单击此处查看此图的较大版本。
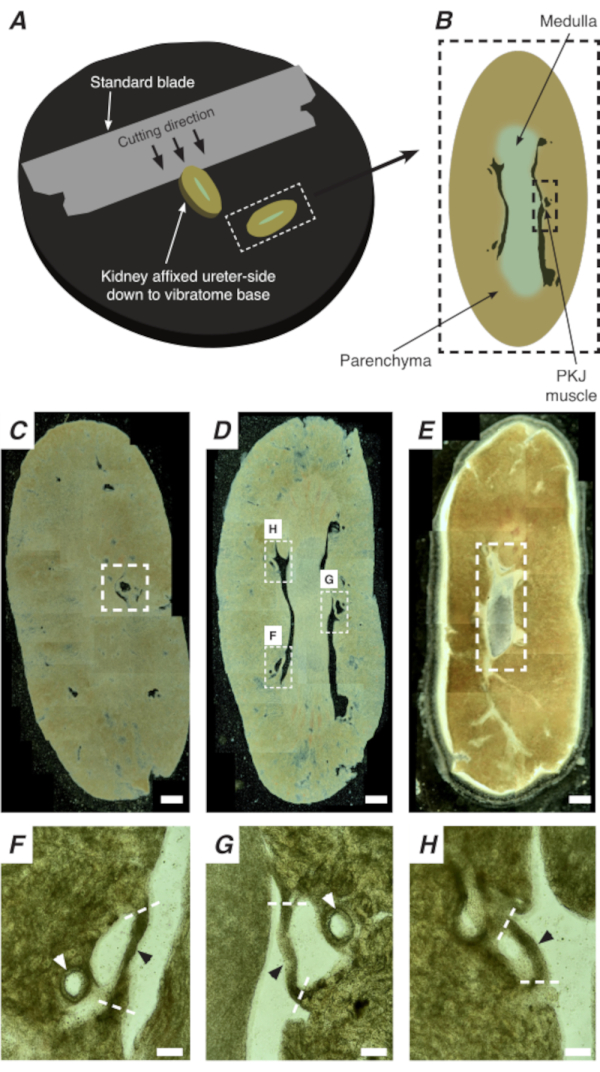
图2:整个肾脏的颤音切除产生薄部分。 (A) 肾脏安装在输尿管侧,直至颤音仪底部,标准刀片(附着在颤音头上)用于切割从肾脏近端到远端的连续部分。(B) 从整个肾脏切开的细段的图表表示,并附有注释的地标。PKJ肌肉段(黑色破折号矩形)经常被发现悬浮在帕伦奇马尔组织之间。(C) 近肾脏部分的光微观图像。悬浮在帕伦奇马尔组织之间的肌肉带的外观表示近端 PKJ 投影的开始(指示在白色破折号矩形内)。(D) 代表可找到多个 (2-3) PKJ 段的最佳区域(白色破折号矩形内的区域)的光微观图像。细PKJ肌肉条悬浮在肾脏帕伦奇马之间,并与肾动脉和美杜拉紧密对齐。(E) 远程肾脏部分的光微观图像。单个肌肉段已合并,形成一个单一的,连续的肌肉带(白色破折号矩形),围绕内帕皮拉(不存在于此图像中)。比例尺条 C-E = 500 μm. F-H 放大缩小字体功能 放大缩小字体功能 从面板 D 指示 PKJ(黑色箭头)、肾动脉(白色箭头)的位置,以及隔离 PKJ(破白线)的切口位置。比例尺条 F-H = 100 μm。缩写:PKJ = 骨盆肾结。 请单击此处查看此图的较大版本。
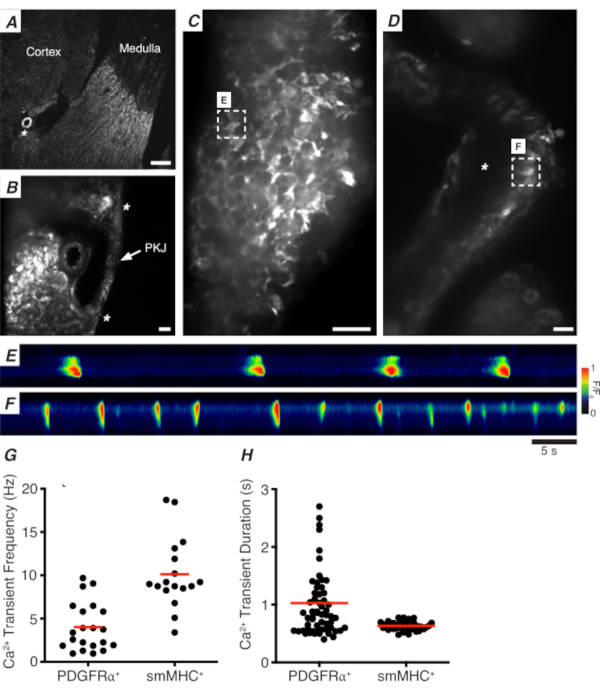
图3: 振动部分的Ca2+成像。(A) 代表低功率图像 (4 倍) 的颤音部分表示肾脏动脉(星号)的位置。比例栏 = 200 μm.(B) 放大缩小字体功能 放大缩小字体功能 PKJ(标记)的代表性图像悬浮在肾脏帕伦奇马尔组织之间,表示PKJ肌肉(白箭头)、肾动脉(星号)的位置。比例栏 = 50 μm.(C)PKJ 在 PDGFR® 细胞中表达 GCaMP的高功率 (40 倍) 图像。比例杆 = 20 μm.(D)PKJ 在平滑肌肉细胞中表达 GCaMP 的高功率 (20 倍) 图像。比例条 = 20 μm.(E)从 C面板中指示的 GCAMP+ PDGFR® 细胞中采样的 Ca2+瞬态空间图。查找编码为 F/F0 的表。(F) 从GCAMP[PDGFR]单元中示例的Ca2+瞬态空间图。。查找编码为 F/F0 的表。(G) G2+瞬态频率 (Hz) 代表数据, 用于 Gcamp= Pdgfr+细胞和 Gcamp= smmhc 细胞。(H ) Gcamp + PDGFR®细胞和 Gcamp + smmhc 细胞的 Ca2 +瞬态持续时间 (s) 的代表数据。缩写:PKJ = 骨盆肾结;PDGFR=血小板衍生生长因子受体-阿尔法阳性;smmhc = 光滑的肌肉肌素重链。请单击此处查看此图的较大版本。
视频 1:PKJ 颤音部分的自发 Ca 2 +瞬态。缩写:PKJ = 骨盆肾结;PDGFR+ • 血小板衍生生长因子受体-阿尔法阳性。请点击这里查看此视频。(右键单击下载。
视频 2: GCaMP 中的自发 Ca2+ 瞬态- 骨盆肾结颤动部分的平滑肌肉细胞。 请点击这里查看此视频。(右键单击下载。
视频 3:自发 Ca2 +在 Gcamp 中瞬态+ Pdgfr + 肾脏经体振动部分的细胞。缩写: PDGFR+ + 血小板衍生生长因子受体-阿尔法阳性。请点击这里查看此视频。(右键单击下载。
视频 4: 肾动脉振动部分的低振幅 Ca2+ 瞬态活动。 请点击这里查看此视频。(右键单击下载。
讨论
RP由不同RP区域观察到的具有不同细胞密度的细胞的异质群组成。PIC1(以前称为ASMC)在PKJ最为丰富,心脏起搏器活动起源于24。此处描述的协议允许调查人员将心脏起搏器区域与小鼠肾脏的其他部分隔离。通过使用颤音切割PKJ部分,RP的心脏起搏器区域(被确定为附着在帕伦奇马的肌肉带)保持完好无损,从而提供使用原位成像技术,在与细胞特异性荧光照点结合时准确研究RP心脏起搏器细胞。
虽然这种方法可以为RP的制路提供新的见解,但实验者应该熟悉一些考虑,以提高成像结果和分割效率。对于未经培训的用户来说,这种 PKJ 隔离和成像方法比典型的平板 RP 制剂的典型锐度解剖更容易学习。从整个肾脏中对RP进行尖锐解剖需要数周的一致实践,才能成功地分离出可行的组织进行生理实验。由于此颤音切除方案几乎不需要尖锐的解剖知识,因此没有解剖其他平滑肌肉结构经验的用户可以访问该方案。
但是,此协议需要注意一些关键点。成功地将肾脏粘附在振动体标本板上需要灵巧和耐心。如果肾脏方向不正确,并倾斜到一边,倾斜,而不是直部分将被削减。由于PKJ的微妙性质,斜角经常会破坏心脏起搏器区域的肌肉带。此外,倾斜部分的成像导致成像采集不良,因为细胞网络通常不在同一焦点平面上。这个过程也很费时,单个肾脏的分割通常需要长达一个小时来完成,在此期间,设置需要监测。
虽然振动器的运动可以加快,但如果速度增加太多(比协议中建议的>20%),刀片会碎裂,而不是干净地切开肾脏,导致细腻的PKJ结构的丧失。同样,切割速度过低会导致该节变得锯齿状。优化切割速度和刀片振幅至关重要。在处理振动器部分时也必须小心。由于其微妙的性质,PKJ肌肉很容易在处理过程中中断,并可能撕裂。训练有素的用户将能够收获大约1-2 PKJ区域每4个肾脏片,适合Ca2+ 成像实验。通常,不符合 Ca2+ 成像标准的 PKJ 部分具有:1) 不良的 GCaMP 表达,2) 扭曲的 PKJ 墙,或 3) 损坏的 PKJ 墙。对于数据分析,可以采样每个视场 (FOV) 大约 3-4 个细胞。
虽然 PDGFR®-GCAMP6f 和 SMC-GCAMP3 PKJ 部分的 FOV 中有许多细胞,但小组织运动通常将细胞排除在分析之外。这通常可以通过对图像应用稳定协议来解决。在制剂不移动的情况下,至少可以从PDGFR®-GCaMP6f部分取样3-5个细胞,从SMC-GCAMP3部分取样5-6个细胞。通常,从动物牺牲(小鼠的最佳年龄为 8-16 周)到进行 Ca2+ 成像实验所占用的时间为 2-3 小时,如果组织在需要时在冰冷溶液中孵育,则足以确保组织完整性。总之,这里描述了一个振动切除方案,从小鼠肾脏生成RP PKJ区域的完整制剂。该技术允许保留RP心脏起搏器区域,进行原位Ca2+ 成像研究,以研究RP起搏器机制。
披露声明
作者没有什么可透露的。
致谢
该项目由 NIDDK 的 R01 DK124509 资助。
材料
| Name | Company | Catalog Number | Comments |
| 24-well culture plate | ThermoFisher Scientific | 142485 | To store kidney slices in |
| 35 mm x 10 mm Petri dishes | Sigma Aldrich | CLS430165 | Kidney slice calcium imaging dish |
| 48-well culture plate | ThermoFisher Scientific | 152640 | To store kidney slices in |
| 60 mm x 15 mm Petri dish | Sigma Aldrich | P5481 | Kidney sharp dissection dish |
| Absorbent paper | Fisher Scientific | 06-666A | To dry the kidney before applying glue |
| B6;129S-Gt(ROSA)26Sor/J | The Jackson Laboratory | 13148 | GCaMP3 Mice |
| B6;129S-Gt(ROSA)26Sor/J | The Jackson Laboratory | 24105 | GCaMP6f Mice |
| B6.FVB-Tg(Myh11-cre/ERT2)1Soff/J | The Jackson Laboratory | 19079 | smMHC-CRE Mice |
| C57BL/6-Tg(Pdgfra-cre)1Clc/J | The Jackson Laboratory | 13148 | PDGFRa-CRE Mice |
| Cyanoacrylate glue | Amazon | B001PILFVY | For adhering the kidney to the specimen plate |
| Ethanol | Phamco-Aaper | SDA 2B-6 | For dissection |
| Extra-Fine Bonn Scissors | Fine Science Tools | 14083-08 | Used for internal dissecting scissors |
| Fine scissors | Fine Science Tools | 14060-09 | Used for external dissecting scissors |
| Fine-tip forceps | Fine Science Tools | 11254-20 | Used for fine dissection of kidney |
| Gillette Silver Blue double-edge blades | Amazon | B009XHQGYO | For insertion into blade holder of vibratome |
| ImageJ | NIH | For calcium imaging analysis | |
| Isoflurane | Baxter | NDC 1001936060 | For anesthesia |
| Minutien pins | Fisher Scientific | NC9677548 | Pins were cut in half to reduce their length |
| Silicon elastomer | Fisher Scientific | NC9285739 | Sylgard 184 |
| Student Adson Forceps | Fine Science Tools | 91106-12 | For gently holding and moving the kidney |
| Student Dumont Forceps | Fine Science Tools | 91150-20 | Used for internal dissecting forceps |
| Vannas spring scissors | Fine Science Tools | 15000-03 | For sharp dissection and cleanup of isolated kidney |
| Vibrocheck | Leica | 14048142075 | Optional component for calibrating blade movement during cutting |
| VT1200 S Vibrating Blade Microtome | Leica | 14912000001 | Configuration 1 is used in our protocol |
参考文献
- Constantinou, C. E., Djurhuus, J. C. Pyeloureteral dynamics in the intact and chronically obstructed multicalyceal kidney. The American Journal of Physiology. 241 (5), 398-411 (1981).
- Constantinou, C. E., Yamaguchi, O. Multiple-coupled pacemaker system in renal pelvis of the unicalyceal kidney. TheAmerican Journal of Physiology. 241 (5), 412-418 (1981).
- Constantinou, C. E., Hrynczuk, J. R. Urodynamics of the upper urinary tract. Investigative Urology. 14 (3), 233-240 (1976).
- Schmidt-Nielsen, B., Schmidt-Nielsen, B. On the function of the mammalian renal papilla and the peristalsis of the surrounding pelvis. Acta Physiologica. 202 (3), Oxford, England. 379-385 (2011).
- Dwyer, T. M., Schmidt-Nielsen, B. The renal pelvis: machinery that concentrates urine in the papilla. Physiology. 18 (1), 1-6 (2003).
- Hill, W. G. Control of urinary drainage and voiding. Clinical Journal of the American Society of Nephrology. 10 (3), 480-492 (2015).
- Brading, A. F. The physiology of the mammalian urinary outflow tract. Experimental Physiology. 84 (1), 215-221 (1999).
- Dixon, J. S., Gosling, J. A. The musculature of the human renal calices, pelvis and upper ureter. Journal of Anatomy. 135, Pt 1 129-137 (1982).
- Lang, R. J., et al. Pyeloureteric peristalsis: role of atypical smooth muscle cells and interstitial cells of Cajal-like cells as pacemakers. The Journal of Physiology. 576, 695-705 (2006).
- Lang, R. J., Takano, H., Davidson, M. E., Suzuki, H., Klemm, M. F. Characterization of the spontaneous electrical and contractile activity of smooth muscle cells in the rat upper urinary tract. Journal of Urology. 166 (1), 329-334 (2001).
- Lang, R. J., Exintaris, B., Teele, M. E., Harvey, J., Klemm, M. F. Electrical basis of peristalsis in the mammalian upper urinary tract. Clinical and Experimental Pharmacology & Physiology. 25 (5), 310-321 (1998).
- Morita, T., Ishizuka, G., Tsuchida, S. Initiation and propagation of stimulus from the renal pelvic pacemaker in pig kidney. Investigative Urology. 19 (3), 157-160 (1981).
- Tsuchida, S., Morita, T., Harada, T., Kimura, Y. Initiation and propagation of canine renal pelvic peristalsis. Urologia Internationalis. 36 (5), 307-314 (1981).
- Yamaguchi, O. A., Constantinou, C. E. Renal calyceal and pelvic contraction rhythms. American Journal of Physiology - Regulatory Integrative and Comparative Physiology. 257 (4), 788-795 (1989).
- Klemm, M. F., Exintaris, B., Lang, R. J. Identification of the cells underlying pacemaker activity in the guinea-pig upper urinary tract. Journal of Physiology. 519 (3), 867-884 (1999).
- Lang, R. J., et al. Spontaneous electrical and Ca2+ signals in the mouse renal pelvis that drive pyeloureteric peristalsis. Clinical and Experimental Pharmacology & Physiology. 37 (4), 509-515 (2010).
- Lutzeyer, W. Pacemaker process of ureteral peristalsis in multicalyceal kidneys. Urologia Internationalis. 37 (4), 240-246 (1982).
- Lang, R. J., Hashitani, H. Pacemaker mechanisms driving pyeloureteric peristalsis: modulatory role of interstitial cells. Advances in Experimental Medicine and Biology. 1124, 77-101 (2019).
- Hashitani, H., et al. Interstitial cell modulation of pyeloureteric peristalsis in the mouse renal pelvis examined using FIBSEM tomography and calcium indicators. Pflugers Archiv: European Journal of Physiology. 469 (5-6), 797-813 (2017).
- Lang, R. J., Hashitani, H., Tonta, M. A., Suzuki, H., Parkington, H. C. Role of Ca2+ entry and Ca2+ stores in atypical smooth muscle cell autorhythmicity in the mouse renal pelvis. British Journal of Pharmacology. 152 (8), 1248-1259 (2007).
- Lang, R. J., Hashitani, H., Tonta, M. A., Parkington, H. C., Suzuki, H. Spontaneous electrical and Ca2+ signals in typical and atypical smooth muscle cells and interstitial cell of Cajal-like cells of mouse renal pelvis. The Journal of Physiology. 583, 1049-1068 (2007).
- Hashitani, H., Lang, R. J., Mitsui, R., Mabuchi, Y., Suzuki, H. Distinct effects of CGRP on typical and atypical smooth muscle cells involved in generating spontaneous contractions in the mouse renal pelvis. British Journal of Pharmacology. 158 (8), 2030-2045 (2009).
- Iqbal, J., et al. Potassium and ANO1/ TMEM16A chloride channel profiles distinguish atypical and typical smooth muscle cells from interstitial cells in the mouse renal pelvis. British Journal of Pharmacology. 165 (7), 2389-2408 (2012).
- Grainger, N., et al. Identification and classification of interstitial cells in the mouse renal pelvis. Journal of Physiology. 598 (15), 3283-3307 (2020).
- Hashitani, H., Mitsui, R., Lang, R. Functional heterogeneity of PDGFRα (+) cells in spontaneously active urogenital tissues. Neurourology and Urodynamics. 39 (6), 1667-1678 (2020).
- Hashitani, H., Lang, R. J. ATYPICAL or INTERSTITIAL, take your PIC. Journal of Physiology. 598 (15), 3061-3062 (2020).
- Lang, R. J., Hashitani, H., Tonta, M. A., Suzuki, H., Parkington, H. C. Role of Ca2+ entry and Ca2+ stores in atypical smooth muscle cell autorhythmicity in the mouse renal pelvis. British Journal of Pharmacology. 152 (8), 1248-1259 (2007).
- Grundy, D. Principles and standards for reporting animal experiments in The Journal of Physiology and Experimental Physiology. Experimental Physiology. 100 (7), 755-758 (2015).
- Drumm, B. T., Hennig, G. W., Baker, S. A., Sanders, K. M. Applications of spatio-temporal mapping and particle analysis techniques to quantify intracellular Ca 2+ signaling in situ. Journal of Visualized Experiments. 2019 (143), 1-13 (2019).
- Leigh, W. A., et al. A high throughput machine-learning driven analysis of Ca2+ spatio-temporal maps. Cell Calcium. 91, 102260(2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。