A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الطبقة الظهارية الأحادية المشتقة من المواد العضوية: نموذج ذو صلة سريريا في المختبر لوظيفة الحاجز المعوي
In This Article
Summary
هنا ، نصف إعداد الطبقات الأحادية الظهارية المعوية المشتقة من الأعضاء البشرية لدراسة وظيفة الحاجز المعوي والنفاذية والنقل. نظرا لأن المواد العضوية تمثل استجابة الأنسجة الظهارية الأصلية للمحفزات الخارجية ، فإن هذه النماذج تجمع بين مزايا قابلية تمدد خطوط الخلايا وأهمية الأنسجة الأولية وتعقيدها.
Abstract
في الماضي ، كانت أنظمة النماذج الظهارية المعوية تقتصر على خطوط الخلايا المتحولة والأنسجة الأولية. هذه الأنظمة النموذجية لها قيود متأصلة لأن الأولى لا تمثل بأمانة فسيولوجيا الأنسجة الأصلية ، وتوافر الأخير محدود. وبالتالي ، فإن تطبيقها يعيق البحوث الأساسية وتطوير الأدوية. المواد العضوية القائمة على الخلايا الجذعية البالغة (يشار إليها من الآن فصاعدا باسم المواد العضوية) هي منمنمات من الأنسجة الظهارية الطبيعية أو المريضة التي تشتق منها. يمكن إنشاؤها بكفاءة عالية من مناطق الجهاز الهضمي المختلفة (GI) ، ولها قابلية للتوسع على المدى الطويل ، وتحاكي الاستجابات الخاصة بالأنسجة والمريض للعلاجات في المختبر. هنا ، تم إثبات إنشاء طبقات أحادية ظهارية مشتقة من الأمعاء العضوية جنبا إلى جنب مع طرق لقياس سلامة الحاجز الظهاري ، والنفاذية والنقل ، وإفراز البروتين المضاد للميكروبات ، وكذلك علم الأنسجة. علاوة على ذلك ، يمكن إثراء الطبقات الأحادية المشتقة من المواد العضوية المعوية بالخلايا الجذعية المنتشرة والخلايا المضخمة العابرة وكذلك بالخلايا الظهارية الرئيسية المتباينة. لذلك ، فهي تمثل نظاما نموذجيا يمكن تصميمه لدراسة آثار المركبات على الخلايا المستهدفة وطريقة عملها. على الرغم من أن الثقافات العضوية أكثر تطلبا من الناحية الفنية من خطوط الخلايا ، إلا أنها بمجرد إنشائها ، يمكنها تقليل الفشل في المراحل اللاحقة من تطوير الدواء لأنها تمثل حقا تعقيد ظهارة الجسم الحي وعدم التجانس بين المرضى.
Introduction
تعمل الظهارة المعوية كحاجز مادي بين المحتوى اللمعاني للأمعاء والأنسجة الكامنة. يتكون هذا الحاجز من طبقة ظهارية واحدة من الخلايا المعوية الاستيعابية بشكل رئيسي والتي ترتبط بتقاطعات ضيقة ، والتي تنشئ روابط قوية بين الخلايا بين الخلايا المتجاورة. تشكل هذه الخلايا بطانة ظهارية مستقطبة تفصل بين الجانبين القمي (التجويف) والقاعدي الجانبي للأمعاء ، بينما تنظم في نفس الوقت النقل شبه الخلوي للمغذيات والأيضات المهضومة. بالإضافة إلى الخلايا المعوية ، تساهم الخلايا الظهارية المهمة الأخرى مثل الكأس والبانيث والخلايا المعوية الصماوية أيضا في التوازن المعوي عن طريق إنتاج المخاط والببتيدات المضادة للميكروبات والهرمونات ، على التوالي. يتم تجديد الظهارة المعوية باستمرار عن طريق تقسيم الخلايا الجذعية الغنية بالليوسين التي تحتوي على بروتين G المقترن بالبروتين 5 إيجابية (LGR5 +) في الجزء السفلي من الخبايا المعوية التي تنتج خلايا تضخيم العبور (TA) التي تهاجر لأعلى وتتمايز إلى أنواع أخرى من الخلايا1. يؤدي اضطراب التوازن الظهاري المعوي بسبب العوامل الوراثية والبيئية ، مثل التعرض لمسببات الحساسية الغذائية والمركبات الطبية ومسببات الأمراض الميكروبية ، إلى تعطيل وظيفة الحاجز المعوي. تسبب هذه الحالات العديد من الأمراض المعوية بما في ذلك مرض التهاب الأمعاء (IBD) ومرض الاضطرابات الهضمية وسمية الجهاز الهضمي الناجمة عن الأدوية2.
يتم إجراء الدراسات على الظهارة المعوية باستخدام العديد من أنظمة المنصات في المختبر مثل إدراج الغشاء ، وأنظمة الأعضاء على رقاقة ، وغرف الاستخدام ، والحلقات المعوية. هذه المنصات مناسبة لإنشاء طبقات أحادية ظهارية مستقطبة مع إمكانية الوصول إلى كل من الجوانب القمية والقاعدية الجانبية للغشاء ، باستخدام خطوط الخلايا المحولة أو الأنسجة الأولية كنماذج. على الرغم من أن خطوط الخلايا المتحولة ، مثل خطوط خلايا سرطان القولون والمستقيم (الغدي) Caco-2 و T84 و HT-29 ، قادرة على التمايز إلى خلايا معوية معوية مستقطبة أو خلايا منتجة للمخاط إلى حد ما ، إلا أنها لا تمثل ظهارة الجسم الحي حيث أن العديد من أنواع الخلايا مفقودة ، ويتم التعبير عن المستقبلات والناقلات المختلفة بشكل شاذ3 . بالإضافة إلى ذلك ، نظرا لأن خطوط الخلايا مشتقة من متبرع واحد ، فإنها لا تمثل عدم تجانس بين المرضى وتعاني من انخفاض التعقيد والأهمية الفسيولوجية. على الرغم من أن الأنسجة الأولية المستخدمة في غرف Ussing وكحلقات معوية أكثر تمثيلا للحالة في الجسم الحي ، إلا أن توافرها المحدود وقابليتها للحياة على المدى القصير وعدم قابليتها للتوسع يجعلها غير مناسبة كوسيلة للدراسات عالية الإنتاجية (HT).
المواد العضوية هي في الثقافات الظهارية المختبرية التي أنشئت من أعضاء مختلفة مثل الأمعاء والكلى والكبد والبنكرياس والرئة. وقد ثبت أن لديها قابلية توسع طويلة الأجل ومستقرة بالإضافة إلى الاستقرار الوراثي والمظهري ، وبالتالي فهي منمنمات بيولوجية تمثيلية لظهارة العضو الأصلي مع استجابات مخلصة للمحفزات الخارجية4،5،6،7،8،9. يتم إنشاء المواد العضوية بكفاءة من الأنسجة الطبيعية أو المريضة أو الملتهبة أو السرطانية المستأنفة أو المستأنفة أو المستوفاة ، والتي تمثل استجابات غير متجانسة خاصة بالمريض10،11،12،13،14،15،16. توضح هذه الورقة كيفية إنشاء طبقات أحادية ظهارية معوية مشتقة من الثقافات العضوية. تم إنشاء الطبقات الأحادية بنجاح من الثقافات العضوية المعوية الصغيرة وكذلك القولون والمستقيم. يخلق هذا النموذج فرصة لدراسة انتقال الخلايا الظهارية ونفاذيتها إلى الأدوية وكذلك آثارها السمية على الظهارة. علاوة على ذلك ، يسمح النموذج للزراعة المشتركة مع الخلايا المناعية والبكتيريا بدراسة تفاعلاتها مع الظهارة المعوية 17،18،19. علاوة على ذلك، يمكن استخدام هذا النموذج لدراسة الاستجابات للعلاجات بطريقة خاصة بالمريض وبدء جهود الفحص للبحث عن الموجة التالية من العلاجات التي تركز على الحواجز الظهارية. يمكن توسيع نطاق هذا النهج ليشمل العيادة ويمهد الطريق نحو علاجات شخصية.
على الرغم من أن الطبقات الأحادية الظهارية في هذا البروتوكول يتم إعدادها من المواد العضوية المعوية الطبيعية البشرية ، إلا أنه يمكن تطبيق البروتوكول وتحسينه للنماذج العضوية الأخرى. يتم استزراع الطبقات الأحادية العضوية الظهارية في وسط توسع عضوي معوي يحتوي على Wnt لدعم تكاثر الخلايا الجذعية وتمثيل التركيب الخلوي للسرداب المعوي. يمكن إثراء المواد العضوية المعوية للحصول على مصائر ظهارية معوية مختلفة ، مثل الخلايا المعوية ، و Paneth ، و goblet ، والخلايا الصماء المعوية ، عن طريق تعديل مسارات Wnt و Notch و Epidermal Growth factor (EGF). هنا ، بعد إنشاء طبقات أحادية في وسط التمدد ، يتم دفعها نحو خلايا ظهارية معوية أكثر تمايزا ، كما هو موضح سابقا20،21،22،23،24،25. لأغراض الفحص ، اعتمادا على طريقة عمل المركب محل الاهتمام ، وخلاياه المستهدفة ، والظروف التجريبية ، يمكن دفع الطبقات الأحادية نحو التركيب الخلوي المفضل لقياس تأثيرات المركب مع القراءات الوظيفية ذات الصلة.
Protocol
1. إعداد كواشف للثقافة
ملاحظة: نفذ جميع الخطوات داخل خزانة السلامة الأحيائية واتبع الإرشادات القياسية للعمل مع مزارع الخلايا. يتم استخدام الأشعة فوق البنفسجية لمدة 10 دقائق قبل بدء تشغيل خزانة السلامة الأحيائية. قبل وبعد الاستخدام ، يتم تنظيف سطح خزانة السلامة البيولوجية باستخدام ورق مناديل مبلل بالإيثانول بنسبة 70٪. لتسهيل تكوين قطرات ثلاثية الأبعاد من المصفوفة خارج الخلية (ECM) ، احتفظ بمخزون مسخن مسبقا من لوحات 96 و 24 و 6 بئر جاهزة في الحاضنة عند 37 درجة مئوية.
- إعداد الوسط القاعدي
- قم بتحضير الوسط القاعدي (BM) في وسط النسر المعدل من دولبيكو المتقدم سعة 500 مل مع زجاجة متوسطة من خليط المغذيات F-12 (Ad-DF) من لحم الخنزير عن طريق إضافة 5 مل من الجلوتامين 200 مللي متر ، و 5 مل من 1 م 4-(2-هيدروكسيثيل) -1 بيبرازين إيثانسلفونيك حمض (HEPES) ، و 5 مل من البنسلين / الستربتومايسين (القلم / العقدية) (10000 U / mL أو 10000 ميكروغرام / مل). يمكن تخزين هذا في الثلاجة عند 4 درجات مئوية لمدة 4 أسابيع على الأقل.
- مصادر Wnt
- تحضير وسط مشروط Wnt3a (Wnt3aCM) وفقا للطريقة الموصوفة سابقا26.
ملاحظة: في الآونة الأخيرة ، تم إنشاء الجيل التالي من Wnt البديل (NGS-Wnt) ، والذي يدعم أيضا توسيع المواد العضوية المعوية البشرية ،27.
- تحضير وسط مشروط Wnt3a (Wnt3aCM) وفقا للطريقة الموصوفة سابقا26.
- إعداد متوسط القاعدة العضوية المعوية
ملاحظة: استخدم جميع عوامل النمو والكواشف وفقا لتوصيات الشركة المصنعة. استخدام aliquots صغيرة وتجنب دورات التجميد والذوبان ؛ عوامل النمو الوظيفية ضرورية لنجاح الثقافة العضوية.- تحضير وسط القاعدة العضوية المعوية المركز 2x (2x IBM) عن طريق استكمال BM مع 1 ميكرومتر A83-01 ، 2.5 mM N-acetylcysteine ، 2x B27 الملحق ، 100 نانوغرام / مل عامل نمو البشرة البشرية (hEGF) ، 10 نانومتر غاسترين ، 200 نانوغرام / مل hNoggin ، و 100 ميكروغرام / مل من تركيبة مضادة للميكروبات للخلايا الأولية (انظر جدول المواد).
- Aliquot 2x IBM وتجميده عند -20 درجة مئوية لمدة تصل إلى 4 أشهر. عند الحاجة ، قم بإذابة أليكوت بين عشية وضحاها عند 4 درجات مئوية أو لعدة ساعات في درجة حرارة الغرفة (RT).
- لإعداد وسط التمدد العضوي المعوي (IEM) ، استكمل 2x IBM إما بنسبة 50٪ Wnt3aCM أو 50٪ BM و 0.5 نانومتر NGS-Wnt ، و 250 نانوغرام / مل الإنسان Rspondin-3 (hRspo3) ، و 10 mM nicotinamide ، و 10 μM SB202190.
- إعداد متوسط التمايز العضوي المعوي
- قم بإعداد وسط تمايز الخلايا المعوية (eDM) عن طريق استكمال 2x IBM بنسبة BM بنسبة 50٪ ، و 250 نانوغرام / مل hRspo3 ، ومثبط مسار Wnt 1.5 ميكرومتر (IWP-2). قم بتخزين eDM على درجة حرارة 4 درجات مئوية لمدة تصل إلى 10 أيام.
- قم بإعداد وسط تمايز مركب (cDM) عن طريق استكمال 2x IBM إما ب 40٪ BM و 10٪ Wnt3aCM أو 50٪ BM و 0.1 nM NGS-Wnt و 250 ng/mL hRspo3 و 10 μM DAPT و 100 nM PD0325901. قم بتخزين cDM على درجة حرارة 4 درجات مئوية لمدة تصل إلى 10 أيام.
- معالجة المصفوفة خارج الخلية (ECM)
ملاحظة: قم بإعداد المصفوفة خارج الخلية (ECM) (انظر جدول المواد) وفقا لتوصية الشركة المصنعة.- ذوبان ECM بين عشية وضحاها على الجليد. انقل ECM من الزجاجة إلى أنبوب مخروطي 15 مل باستخدام ماصة 5 مل ، وكلاهما مبرد مسبقا عند -20 درجة مئوية. إعادة تجميد aliquots مرة واحدة فقط عند -20 درجة مئوية. بمجرد إذابته ، قم بتخزين ECM في ثلاجة عند 4 درجات مئوية لمدة تصل إلى 7 أيام. احتضان لمدة 30 دقيقة على الأقل على الثلج قبل الاستخدام.
ملاحظة: امزج ECM بشكل صحيح وتأكد من أنه بارد قبل تضمين الخبايا أو المواد العضوية.
- ذوبان ECM بين عشية وضحاها على الجليد. انقل ECM من الزجاجة إلى أنبوب مخروطي 15 مل باستخدام ماصة 5 مل ، وكلاهما مبرد مسبقا عند -20 درجة مئوية. إعادة تجميد aliquots مرة واحدة فقط عند -20 درجة مئوية. بمجرد إذابته ، قم بتخزين ECM في ثلاجة عند 4 درجات مئوية لمدة تصل إلى 7 أيام. احتضان لمدة 30 دقيقة على الأقل على الثلج قبل الاستخدام.
2. الثقافات العضوية
- إنشاء ثقافات من المواد العضوية المجمدة
ملاحظة: دع BM يصل إلى RT ، واحتفظ ب 12 مل من الليكوت ، الذي تم تسخينه إلى 37 درجة مئوية ، جاهزا قبل البدء في إجراء إذابة أحد الكريوفيات التي تحتوي على عضويات مجمدة.- قم بإذابة التجميد العضوي بسرعة عن طريق الإثارة في حمام مائي 37 درجة مئوية حتى تبقى قطعة من الجليد فقط. أضف على الفور 500 ميكرولتر من BM الدافئ إلى المبرد ، وقم بسحبه لأعلى ولأسفل عدة مرات لتخفيف وسط التجميد وخلط المحتويات بعناية.
- باستخدام ماصة P1000 ، انقل المواد العضوية إلى أنبوب مخروطي 15 مل ، وأضف 1 مل أخرى من BM الدافئ بقطرة أثناء خلط الجزء السفلي من الأنبوب بلطف. ضع لأعلى ولأسفل عدة مرات لتخفيف وسط التجميد وخلط المحتويات بعناية.
- أضف ما يصل إلى 12 مل من BM الدافئ قطرة إلى الأنبوب المخروطي سعة 15 مل الذي يحتوي على المواد العضوية ، وقم بسحبه لأعلى ولأسفل باستخدام ماصة معقمة سعة 10 مل لإعادة تعليق المواد العضوية بلطف.
- الطرد المركزي للتعليق العضوي لمدة 5 دقائق عند 85 × جم و 8 درجات مئوية. تخلص من المادة الفائقة بعناية دون إزعاج الكريات ، وأعد تعليق المواد العضوية في 30٪ v / v من IEM المكمل ب 10 μM Y27632 أو مثبطات بروتين سيرين / ثريونين كيناز الأخرى المرتبطة ب rho الملفوفة المكونة للبروتين. ضع الأنبوب على الثلج.
- أضف 70٪ v / v من ECM في الأنبوب المخروطي 15 مل الذي يحتوي على المواد العضوية. امزج التعليق العضوي مع الحفاظ على الأنبوب المخروطي 15 مل على الجليد ، والبذور 5 ميكرولتر من التعليق للتحقق من الكثافة (الشكل 1A). استمر في الطلاء إذا كانت الكثافة مناسبة ؛ إذا كانت الكثافة عالية جدا ، فأضف المزيد من حل IEM / ECM بنفس النسبة من 30-70٪ v / v ، على التوالي.
- في كل بئر من صفيحة 24 بئرا تم تسخينها مسبقا ، بذور 50 ميكرولتر من التعليق العضوي عن طريق سحب 5 قطرات منفصلة من 10 ميكرولتر (الشكل 1 ب). اقلب اللوحة رأسا على عقب ، واتركها في خزانة السلامة البيولوجية لمدة 5 دقائق. انقل اللوحة التي لا تزال مقلوبة رأسا على عقب إلى الحاضنة التي تبلغ درجة حرارتها 37 درجة مئوية ، واتركها لمدة 30 دقيقة أخرى.
- أضف 500 ميكرولتر من IEM مع مثبط 10 μM ROCK إلى كل بئر ، وانقل اللوحة إلى الحاضنة. قم بتصوير قطرة واحدة بانتظام لمراقبة النمو ، وتحديث IEM كل 2-3 أيام عن طريق شفط الوسط القديم وإضافة 500 ميكرولتر من IEM الطازج.
- مرور المواد العضوية بمجرد تعافيها بشكل صحيح من الذوبان ووصولها إلى الحجم المناسب لمعالجتها (الشكل 1C) ، كما هو موضح في القسم 2.2.
- تمرير المواد العضوية المعوية
ملاحظة: قم بتبريد ECM على الجليد لمدة 30 دقيقة على الأقل، واحتفظ ب IEM في RT لمدة 1 ساعة على الأقل قبل الاستخدام.- استخدم الوسط من بئر ثقافة واحدة لتفتيت القباب العضوية باستخدام طرف مرشح منخفض الاحتفاظ بسعة 1250 ميكرولتر ، ونقل محتويات البئر إلى أنبوب مخروطي 15 مل. اغسل البئر ب 1 مل من BM ، وانقله إلى نفس الأنبوب المخروطي سعة 15 مل.
- كرر الخطوتين 2.2.1 و 2.2.2 مع جميع الآبار الأخرى (يمكن غسل نصف صفيحة كحد أقصى أو 600 ميكرولتر من قطرات ECM وإضافتها إلى أنبوب مخروطي واحد سعة 15 مل).
- أضف BM لملء الأنبوب حتى 12 مل ، وقم بسحب ماصة لأعلى ولأسفل 10x باستخدام ماصة 10 مل. جهاز طرد مركزي عند 85 × جم لمدة 5 دقائق عند 8 درجات مئوية.
- قبل إزالة BM ، تحقق تحت المجهر لمعرفة ما إذا كانت جميع المواد العضوية يتم تكويرها في الجزء السفلي من الأنبوب المخروطي 15 مل (الشكل 1D). إذا لم يكن هناك ECM تراكب الكريات العضوية أو كانت طبقة ECM إما نظيفة أو تحتوي فقط على حطام أو خلايا مفردة أو عدد قليل جدا من المواد العضوية مقارنة بالمواد العضوية الحبيبية ، فقم بشفط الحبيبات الفائقة وماصة ECM التي تغطي الكريات العضوية بعناية فائقة باستخدام ماصة P200.
ملاحظة: يمكن أن تعلق المواد العضوية في ECM ولا ترسب كحبيبات مدمجة بسبب انخفاض قوة الطرد المركزي. إذا كان ECM يحتوي على عضويات ، فقم بطرد مركزي للأنبوب مرة أخرى عند 450 × جم لمدة 5 دقائق عند 8 درجات مئوية ، وقم بإزالة السوبرناتانت بعناية كما هو موضح في 2.2.4. إذا كان هناك عدة أنابيب مخروطية 15 مل ، فيمكن تجميعها بعد الخطوة 2.2.4. - أضف 1 مل من BM إلى كل حبيبة (بحجم 50-200 ميكرولتر ، اعتمادا على الثقافة العضوية والكثافة) ، وأعد تعليقها بعناية. ضع المواد العضوية صعودا وهبوطا على الأقل 5x لقصها ، وتجنب تكوين الرغوة. تحقق تحت المجهر لمعرفة ما إذا كانت المواد العضوية قد تعطلت (الشكل 2A). إذا تعطلت المواد العضوية ، فانتقل إلى الخطوة 2.2.7 ؛ إذا لم يتم تعطيل المواد العضوية ، ماصة لهم 5x أخرى. هذه المرة ، المس جدار الأنبوب البلاستيكي بطرف الماصة لممارسة المزيد من القوة الميكانيكية لتعطيل المواد العضوية.
ملاحظة: يمكن القص الميكانيكي للعضويات الكيسية (الشكل 1C) والناشئة (الشكل 1E) إما باستخدام طرف ماصة بلاستيكية 200 ميكرولتر أو 10 ميكرولتر مثبت على طرف مرشح منخفض الاستبقاء 1250 ميكرولتر (الشكل 1F) ، اعتمادا على الحجم المطلوب لتعطيل المواد العضوية. يوصى باستخدام ماصة زجاجية ضيقة (الشكل 1F) عند معالجة أكثر من 200 ميكرولتر من ECM تحتوي على المواد العضوية (بئر واحد من لوحة 6 آبار أو 4 آبار من صفيحة 24 بئر). - تحقق تحت المجهر مرة أخرى لمعرفة ما إذا كانت المواد العضوية قد تعطلت. إذا تعطلت ، تابع الخطوة التالية ؛ إذا لم يكن الأمر كذلك ، ماصة المواد العضوية تصل إلى 20x ، والتحقق من المواد العضوية تحت المجهر بانتظام. إذا كانت المواد العضوية لا تزال غير معطلة ، فأضف 25٪ من كاشف تفكك الخلايا v / v 1 (انظر جدول المواد) إلى التعليق ، واحتضنها في الحمام المائي عند 37 درجة مئوية لمدة دقيقتين ، وقم بماصة المواد العضوية حتى 20x ، وتحقق من المواد العضوية تحت المجهر بانتظام للتأكد من عدم هضمها إلى خلايا مفردة.
- أضف ما يصل إلى 12 مل من BM إلى الأنبوب المخروطي 15 مل ، واغسل الكريات العضوية عن طريق السحب لأعلى ولأسفل. جهاز طرد مركزي عند 85 × جم لمدة 5 دقائق عند 8 درجات مئوية. تخلص من السوبرناتانت ، واضبط التركيز النهائي على 70٪ v / v ECM عن طريق إضافة IEM و ECM إلى بيليه العضوية.
- ابدأ في تعليق الكريات العضوية بضعف حجم IEM / ECM الذي تم جمعه للمرور ، والبذور 5 ميكرولتر من التعليق للتحقق من الكثافة. مواصلة الطلاء إذا كانت الكثافة مناسبة (الشكل 2 ب) ؛ أضف المزيد من حل IEM / ECM إذا كانت الكثافة عالية جدا. أضف 200 ميكرولتر من التعليق إلى كل بئر من صفيحة 6 آبار تم تسخينها مسبقا ، مما يجعل قطرات منفصلة بحجم 10 ميكرولتر.
- اقلب اللوحة رأسا على عقب ، واتركها في خزانة السلامة البيولوجية لمدة 5 دقائق. انقل اللوحة رأسا على عقب إلى الحاضنة التي تبلغ درجة حرارتها 37 درجة مئوية ، واتركها لمدة 30 دقيقة أخرى. أضف 2 مل من IEM مع مثبط 10 μM ROCK إلى كل بئر ، وانقل اللوحة إلى الحاضنة.
- قم بتصوير قطرة واحدة بانتظام لمراقبة النمو ، وتحديث IEM كل 2-3 أيام عن طريق شفط الوسط القديم وإضافة 2 مل من IEM الطازج.
- تمرير المواد العضوية المعوية لإعداد الطبقة الظهارية الأحادية
- مرور المواد العضوية قبل 3 أيام من الحصاد لإعداد أحادي الطبقة باتباع نفس بروتوكول المرور الموضح في القسم 2.2 باستثناء واحد. في الخطوة 2.2.7 ، أعد تعليق المواد العضوية في 1-1.5x حجم بدء IEM / ECM للحصول على كثافة أعلى وإمكانات توسع عند حصادها لإعداد أحادي الطبقة (الشكل 3A).
3. إعداد أحادي الطبقة الظهارية
- الطبقات الأحادية الظهارية المستنبتة على كل من غشاء 24 بئرا و 96 بئرا مع مجموعة متنوعة من أنواع الألواح المتاحة (الجدول 1). استخدم إدخالات غشاء نظام الإنتاجية العالية (HTS) لكلا الحجمين لأنها تحتوي على درج متكامل مع إدخالات الغشاء ولوحة استقبال. بالنسبة لتنسيق 24 بئرا ، يمكن أيضا استخدام الألواح ذات الإدخالات الغشائية القابلة للإزالة المنفصلة.
ملاحظة: تتوفر أنواع مختلفة من الأغشية (البولي إيثيلين تيريفثاليت (PET) أو البولي كربونات) وأحجام المسام (0.4-8.0 ميكرومتر) ويمكن استخدامها اعتمادا على الاحتياجات التجريبية. لا يمكن تصوير الطبقات الأحادية إلا بواسطة brightfield عند استخدام الإدخالات ذات أغشية PET. تمنع الأغشية الضيقة الضوء تسرب ضوء الفلورسنت من القمي إلى المقصورة القاعدية ويمكن أخذها في الاعتبار عند دراسة النقل الديناميكي أو نفاذية الركائز ذات العلامات الفلورية. يستخدم البروتوكول الحالي إدراج غشاء 24 بئرا. ويرد وصف للتعديلات على إدراج غشاء 96 بئرا في القسم 5. اعتمادا على كثافة ومورفولوجيا وحجم المواد العضوية (الشكل 3A) ، تكفي 6 آبار من صفيحة 6 آبار (كما هو موضح في القسم 2.3) لبذر صفيحة كاملة من 24 بئرا من إدراج الغشاء. - إدراج غشاء الطلاء مع ECM
ملاحظة: إذا كانت هناك شكوك حول وجود عدد كاف من الخلايا، فقم بتغطية الإدخالات بعد حساب الخلايا. هذا هو لمنع الطلاء غير الضروري وفقدان إدراج غشاء باهظ الثمن.- ضع إدخالات الغشاء في لوحة الدعم في خزانة السلامة الأحيائية. قم بتخفيف ECM 40x في محلول ملحي مخزن بالفوسفات (DPBS) من Dulbecco البارد المثلج مع Ca 2+ و Mg2+ ، وماصة 150 ميكرولتر من ECM المخفف في المقصورة القمية لكل إدراج. احتضن اللوحة عند 37 درجة مئوية لمدة 1 ساعة على الأقل.
- إعداد الخلايا للبذر
- اليسخن المسبق لكاشف تفكك الخلية 2 في الحمام المائي (37 درجة مئوية). تحضير 2 مل من الكاشف لكل بئر من لوحة 6 آبار.
- انقل لوحة الاستزراع التي تحتوي على المواد العضوية (المعدة في القسم 2.3) من الحاضنة إلى خزانة السلامة الأحيائية. معالجة المواد العضوية ، كما هو موضح في الخطوات 2.2.1.-2.2.4. لا تجمع أنابيب متعددة في أنبوب واحد.
- املأ الأنبوب ، الذي يحتوي على عضويات من 3 آبار كحد أقصى من لوحة 6 آبار ، حتى 12 مل مع DPBS (بدون Ca 2 + و Mg2 +) ، وماصة لأعلى ولأسفل 10x باستخدام ماصة 10 مل. جهاز طرد مركزي عند 85 × جم لمدة 5 دقائق عند 8 درجات مئوية ، وشفط supernatant دون إزعاج الكريات العضوية.
- أضف 2 مل من كاشف تفكك الخلايا المسخن مسبقا 2 لكل بئر من صفيحة 6 آبار تستخدم كمادة أولية وإنعاش. احتضن الأنابيب قطريا أو أفقيا لمدة 5 دقائق في الحمام المائي عند 37 درجة مئوية ، لمنع غرق المواد العضوية في قاع الأنبوب.
- Pipet لأعلى ولأسفل 10x باستخدام ماصة بلاستيكية معقمة سعة 5 مل أو ماصة P1000 ، اعتمادا على الحجم الإجمالي لكاشف تفكك الخلية. تحقق من التعليق العضوي تحت المجهر لمعرفة ما إذا كان قد تشكل خليط من الخلايا المفردة وبعض كتل الخلايا التي تتكون من 2-4 خلايا (الشكل 3B). إذا لزم الأمر ، استمر في الهضم عن طريق تكرار الخطوات 3.3.4-3.3.5 (لا تزيد من حجم كاشف تفكك الخلايا) حتى يبدو الخليط مشابها للشكل 3B.
ملاحظة: تجنب هضم المواد العضوية بالكامل إلى خلايا مفردة. من الضروري أن يكون لديك بعض المجموعات الصغيرة من الخلايا (أي مجموعات من 2-4 خلايا). - أوقف تفكك الخلايا عن طريق إضافة ما يصل إلى 12 مل من BM بما في ذلك مثبط 10 μM ROCK إلى تعليق الخلية. جهاز طرد مركزي عند 450 × جم لمدة 5 دقائق عند 8 درجات مئوية ، وقم بشفط السوبرنات دون إزعاج حبيبات الخلية. عند التعامل مع نفس الثقافة العضوية في عدة أنابيب مخروطية سعة 15 مل ، قم بتجميع كريات الخلايا وإعادة تعليقها في 12 مل من BM.
- قم بتصفية تعليق الخلية من خلال مصفاة 40 ميكرومتر مبللة مسبقا ب BM ، وحصاد التدفق في أنبوب مخروطي سعة 50 مل. اغسل المصفاة ب 10 مل من BM ، وقم بحصاد التدفق في نفس الأنبوب المخروطي سعة 50 مل.
- انقل تعليق الخلية المتوترة إلى أنبوبين مخروطيين جديدين بسعة 15 مل. جهاز طرد مركزي عند 450 × جم لمدة 5 دقائق عند 8 درجات مئوية ، وقم بشفط السوبرنات دون إزعاج حبيبات الخلية. أعد تعليق الخلايا في 4 مل من IEM مكملة بمثبط ROCK 10 ميكرومتر لكل لوحة زراعة كاملة تستخدم كمواد أولية.
- امزج كمية صغيرة من تعليق الخلايا بنسبة 1: 1 مع التربان الأزرق للعد. احسب الخلايا الحية، وليس الزرقاء، (الشكل 3C)، واحسب العدد الإجمالي للخلايا الحية. في كتل صغيرة ، عد كل خلية على حدة.
- قم بإعداد تعليق خلوي يحتوي على 3 × 106 خلايا حية لكل مل من IEM مكمل بمثبط 10 ميكرومتر ROCK.
- خلايا البذر على إدراج غشاء البوليستر
- قم بشفط DPBS بعناية من الإدخالات المطلية ب ECM (الخطوة 3.2.1) ، مع الحفاظ على اللوحة أفقيا. Pipet 800 ميكرولتر من IEM تستكمل مع مثبط ROCK في كل حجرة بازوجانبية. Pipet 150 ميكرولتر من تعليق الخلية المحضر في الخطوة 3.3.10 على الغشاء المطلي ب ECM في المقصورة القمية قطرة. لكل لوحة ، تأكد من وجود بئر "فارغ" واحد على الأقل مع BM فقط.
- بمجرد أن ترسب الخلايا على الغشاء ، قم بقياس المقاومة الكهربائية عبر الظهارية (TEER) ، كما هو موضح في القسم 4.1 ، وقم بتصوير الغشاء الذي يدرجه باستخدام المجهر. ضع اللوحة في الحاضنة عند 37 درجة مئوية و 5٪ CO2. قم بقياس TEER كل يوم ، واحصل على صور بانتظام لمراقبة تكوين الطبقة الأحادية (الشكل 4A-D).
- الطبقات الأحادية المنعشة
ملاحظة: قم بتحديث الوسط كل 2-3 أيام ، مع الالتزام بالترتيب التالي للحفاظ على ضغط هيدروستاتيكي إيجابي فوق الخلايا ومنع دفع الخلايا خارج الغشاء. أثناء تحديث الوسط ، تأكد من أن الطبقة الأحادية ، التي تكون مرئية عند شفط الوسط ، لا تتضرر من طرف الماصة.- قم بإزالة الوسط من المقصورات القاعدية الجانبية للصفيحة التي تحتوي على إدخالات الغشاء. ثم ، استنشق الوسط بعناية من المقصورات القمية لإدراج الغشاء.
- أضف 150 ميكرولتر من IEM الطازج إلى كل حجرة قمية ، ثم أضف 800 ميكرولتر من IEM الطازج إلى كل حجرة بازوجانبية.
- إثراء الطبقة الأحادية لأنواع الخلايا الظهارية المعوية المرغوبة
- اسمح للطبقة الأحادية بأن تصبح ملتقية في IEM ، المقابلة لقيمة TEER البالغة حوالي 100 Ω ·cm² (كما هو محسوب في الخطوة 4.1.1.4). تحقق تحت المجهر لتحديد ما إذا كانت الطبقات الأحادية قد تشكلت بالكامل (الشكل 4D) ولعدم وجود ثقوب (كما هو موضح في الشكل 4B ، C).
- قم بإزالة IEM بعناية من المقصورات القاعدية والقمية لإدخالات الغشاء ، واستبدلها إما ب eDM أو cDM كما هو معد في القسم 1.4. قم بزراعة الطبقة الأحادية لمدة 3-4 أيام أخرى في وسط التمايز المحدد للحصول على الخلايا العضوية المخصب بنوع الخلية المحدد المطلوب. قم بتحديث الوسيط كل 2-3 أيام ، كما هو موضح في القسم 3.4.
- قم بقياس TEER يوميا ، واحصل على الصور بانتظام إذا رغبت في ذلك (الشكل 5A-C).
ملاحظة: تختلف قيمة TEER التي تشير إلى طبقة أحادية غنية منظمة تنظيما كاملا حسب الثقافة العضوية. عادة ما تزيد قيم TEER إلى 600 ويمكن أن تزيد إلى 1000 Ω · سم2 (كما هو محسوب في الخطوة 4.1.1.4) بعد 3 أيام في وسائط التمايز وتكون مستقرة لمدة 3-5 أيام.
4. قراءات فحص الطبقة الأحادية الظهارية
- قياس المقاومة الكهربائية عبر الظهارية (TEER)
ملاحظة: يتم قبول قياسات TEER على نطاق واسع كوسيلة لتحليل ديناميكيات التقاطع الضيقة وسلامة وظيفة الحاجز في النماذج البيولوجية للحواجز الفسيولوجية ، مثل الطبقات الأحادية الظهارية28,29. يمكن قياس الزيادة في TEER بعد التمايز بسبب زيادة التفاعل الخلوي عند التقاطعات الضيقة باستخدام مقياس TEER يدوي أو روبوت قياس TEER آلي.- قياس TEER باستخدام مقياس TEER يدوي
- نظف القطب الكهربائي بنسبة 70٪ من الإيثانول ، واتركه يجف في الهواء داخل خزانة السلامة الأحيائية. ضع القطب الكهربائي في أنبوب يحتوي على BM. قم بتوصيل القطب الكهربائي بمقياس TEER اليدوي. أدر مفتاح الوظيفة للقياس بأوم (Ω). قم بتشغيل مفتاح الطاقة .
- ضع القطب القصير في المقصورة القمية للإدراج ، بينما يتم وضع القطب الطويل في المقصورة القاعدية (الشكل 6A). تجنب لمس الطبقة الأحادية.
- قم بقياس المقاومة في البئر الفارغ (Rblank) ، ثم قم بقياس العينات المتبقية (عينة R) بنفس الطريقة. اغسل القطب الكهربائي باستخدام BM بين العينات ذات الظروف المختلفة. نظف القطب أولا بماء ديمي ثم بالإيثانول بنسبة 70٪ واتركه يجف في الهواء.
- احسب TEER (Ω·cm 2): [عينة R (Ω) - Rفارغة (Ω)] مساحة الغشاء × (سم2) (الجدول 1 والشكل 6B).
- قياس TEER باستخدام روبوت قياس TEER الآلي (جدول المواد)
- قم بإجراء قياسات TEER الآلية عند استخدام أنظمة HTS للوحات HTS ذات 96 بئرا و 24 بئرا تحتوي على إدخالات غشائية. استخدم أقطاب كهربائية مختلفة لقياس TEER لكلا النوعين (إدراج غشاء 24 و 96 HTS). لقياس TEER باستخدام روبوت قياس TEER آلي، اتبع تعليمات الشركة المصنعة.
- قياس TEER باستخدام مقياس TEER يدوي
- قياس سلامة الحاجز الظهاري ونفاذيته
ملاحظة: يقدم هذا البروتوكول نفاذية لوسيفر الصفراء من المقصورة القمية إلى المقصورة القاعدية كمؤشر على سلامة الطبقة الأحادية. يصف هذا القسم قياس التألق في المقصورة القاعدية الجانبية بعد خطوة حضانة لمدة 1 ساعة لتقييم نفاذية الطبقة الأحادية وبالتالي سلامة الحاجز. هذا القياس هو اختبار نقطة النهاية وهو مفيد بشكل خاص عند اختبار المركبات لتأثيرها على سلامة الحاجز.- قم بإذابة لوسيفر الأصفر على الجليد ، ودع BM يتوازن مع RT. للحصول على صفيحة واحدة من 24 بئرا من إدراج الغشاء ، قم بإعداد 5 مل من محلول العمل من 60 ميكرومتر لوسيفر الأصفر في BM.
ملاحظة: الأصفر لوسيفر حساس للضوء. قم بإعداد التخفيفات في أنابيب معقمة مظلمة سعة 1.5 مل وقم بتنفيذ جميع الخطوات مع إطفاء ضوء خزانة السلامة الأحيائية. - قم بإزالة الوسط بعناية من المقصورات القاعدية والقمية لإدراج الغشاء ، كما هو موضح في الخطوة 3.5.1. إذا رغبت في ذلك ، قم بخدش طبقة أحادية واحدة غير معالجة باستخدام طرف ماصة كعنصر تحكم إيجابي في تسرب Lucifer Yellow من خلال حاجز تالف.
- أضف 150 ميكرولتر من BM مع 60 ميكرومتر لوسيفر أصفر إلى كل حجرة قمية ، وأضف 800 ميكرولتر من BM بدون أصفر لوسيفر إلى كل حجرة بازوجانبية. ضع اللوحة على شاكر عند 37 درجة مئوية ، 50 دورة في الدقيقة لمدة 60 دقيقة.
- في غضون ذلك ، قم بإعداد منحنى قياسي من Lucifer Yellow في BM بدءا من حل العمل المعد في الخطوة 4.2.1. تمييع 1: 3 في كل خطوة حتى يتم الوصول إلى تركيز 3 نانومتر. قم بتضمين عنصر تحكم سلبي (BM فقط).
- انقل 100 ميكرولتر من كل معيار في ثلاثة أضعاف إلى لوحة شفافة بسعة 96 بئرا. بعد 60 دقيقة من الحضانة ، قم بإزالة إدخالات الغشاء ونقل 100 ميكرولتر من كل بئر بازو جانبي (الخطوة 4.2.3) في ثلاثة أضعاف إلى لوحة شفافة 96 بئرا. قم بقياس تألق اللوحة باستخدام قارئ لوحة بطول موجي مثير يبلغ 430 نانومتر وطول موجي للانبعاثات يبلغ 530 نانومتر.
- بعد تصحيح قيمة التحكم السالبة (BM فقط)، استخدم قيم المنحنى القياسية لحساب تركيز لوسيفر الأصفر في المقصورة القاعدية (تركيز المستقبل النهائي (μM)).
- احسب معامل النفاذية الظاهري (Papp) وفقا للصيغة التالية (الشكل 6C):

- بالنسبة لصفيحة 24 بئرا تحتوي على حشوات غشائية، استخدم الصيغة التالية:
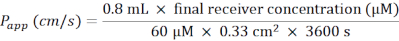
- قم بإذابة لوسيفر الأصفر على الجليد ، ودع BM يتوازن مع RT. للحصول على صفيحة واحدة من 24 بئرا من إدراج الغشاء ، قم بإعداد 5 مل من محلول العمل من 60 ميكرومتر لوسيفر الأصفر في BM.
- إصلاح الطبقات الأحادية وإعداد كتل البارافين لعلم الأنسجة
ملاحظة: يمكن استخدام الطبقات الأحادية الظهارية للتلطيخ النسيجي لتقييم تركيبها الخلوي وقطبية والتعبير عن البروتينات المختلفة ذات الأهمية مثل البروتينات الموصلة أو الانتشار أو علامات التمايز. يصف هذا القسم إعداد كتلة البارافين للتلطيخ النسيجي.- قم بإزالة الوسط بعناية من المقصورات القاعدية والقمية لإدراج الغشاء ، كما هو موضح في الخطوات 3.5.1.
- اغسل الطبقات الأحادية بإضافة 150 ميكرولتر من DPBS (بدون Ca 2+ و Mg2+) إلى كل حجرة قمية و 800 ميكرولتر إلى كل حجرة قاعدية. استنشق DPBS بعناية مرة أخرى ، أولا من المقصورة القاعدية الجانبية ثم من المقصورة القمي.
ملاحظة: ستبقى المقصورة القاعدية الجانبية فارغة من هذه الخطوة. - في غطاء الدخان ، أضف 150 ميكرولتر من 4٪ paraformaldehyde إلى كل حجرة قمية ، واحتضنها لمدة 30 دقيقة في RT.
ملاحظة: من هذه الخطوة فصاعدا ، قم بتنفيذ جميع الإجراءات في هذا القسم داخل غطاء الدخان ، لأن بارافورمالديهايد سام. - استنشق المثبت بعناية من المقصورات القمية لإدراج الغشاء ، وتخلص منه كنفايات هالوجين سائلة.
ملاحظة: من هذه الخطوة فصاعدا، تخلص من جميع النفايات السائلة كنفايات هالوجين سائلة. - اغسل الطبقات الأحادية بإضافة 200 ميكرولتر من DPBS (بدون Ca 2+ و Mg2+) إلى كل حجرة قمية ، واستنشق DPBS بعناية مرة أخرى. كرر هذه الخطوة مرة أخرى.
- أضف 200 ميكرولتر من الكحول الإيثيلي بنسبة 25٪ (EtOH) إلى كل حجرة قمية ، واحتضنها لمدة 15 دقيقة في RT. بعد 15 دقيقة ، قم بشفط 25٪ EtOH بعناية من المقصورات القمية لإدراج الغشاء. كرر ذلك باستخدام محلول EtOH بنسبة 50٪ وبعد ذلك باستخدام محلول EtOH بنسبة 70٪.
- أضف 200 ميكرولتر من 70٪ EtOH إلى كل حجرة قمية ، ولف اللوحة بالبارافيلم. قم بتخزينه على درجة حرارة 4 درجات مئوية حتى يتم استخدامه مرة أخرى.
- استنشق بعناية 70٪ EtOH ، واستخدم مشرطا لقطع الأغشية أحادية الطبقة بعناية من الإدراجات. قطع من الجانب القاعدي ، حول حافة الإدراج.
- تحضير كتل البارافين باتباع الإجراء القياسي.
- عندما لا يزال البارافين دافئا ، خذ الطبقة الأحادية من البارافين باستخدام ملاقط ، وضعها على سطح مبرد مسبقا.
- احرص على عدم إتلاف الطبقة الأحادية. قطع الطبقة الأحادية إلى نصفين باستخدام شفرة حافة واحدة.
- عندما يبدأ البارافين في الجزء السفلي من الكاسيت في التصلب ، استخدم ملاقط ساخنة لوضع جزأين أحاديي الطبقة في البارافين ، بجانب بعضهما البعض مع الجانب المستقيم لأسفل وفي اتجاه رأسي لضمان أن الطبقة الأحادية ستكون عمودية في الكوبيه.
- عندما تكون كتل البارافين جاهزة ، قم بقطع الكتل باستخدام ميكروتوم ، وقم بعمل شرائح من مقاطع بسماكة 4 ميكرومتر باتباع الإجراء القياسي. تأكد من أن الطبقات الأحادية تنتهي رأسيا في الكوبيه.
- أداء البقع النسيجية كما هو موضح سابقا 7,9. استخدم الهيماتوكسيلين والإيوسين (H & E) و Ki67 و mucin-2 (MUC2) و Alcian Blue لإظهار المورفولوجيا العامة والخلايا التكاثرية وإنتاج المخاط والخلايا الكأسية ، على التوالي (الشكل 6E).
ملاحظة: يمكن أيضا استخدام علامات تمايز إضافية، مثل الليزوزيم لخلايا بانيث. لم يتم تقديم هذه العلامة في الشكل 6E لأن خلايا Paneth موجودة في ظهارة معوية صغيرة بدلا من ظهارة القولون.
- قياس البروتين المفرز في supernatant المتوسطة
- قم بقياس مستويات الليزوزيم في الطبقة الفوقية القمية للطبقات الأحادية اللفائفية (انظر الشكل 6D) باستخدام المجموعة المدرجة في جدول المواد. إذا رغبت في ذلك ، قم بقياس مستويات السيتوكينات المختلفة والبروتينات الأخرى ذات الاهتمام.
- تحليل التعبير الجيني
- تحديد آثار وسائط التمايز على التعبير عن جينات علامات الخلايا الظهارية باستخدام تفاعل البوليميراز المتسلسل الكمي للنسخ العكسي (qRT-PCR).
- قم بتحليل الطبقات الأحادية في 350 ميكرولتر من المخزن المؤقت لتحلل الحمض النووي الريبي متبوعا بعزل الحمض النووي الريبي وفقا لتعليمات الشركة المصنعة. قم بإجراء تخليق cDNA و qPCRs ، كما هو موضح سابقا 7,9 ، باستخدام مجموعات توليف cDNA ، والمزيج الرئيسي ، و oligonucleotides المدرجة في جدول المواد.
- تحديد آثار وسائط التمايز على التعبير عن جينات علامات الخلايا الظهارية باستخدام تفاعل البوليميراز المتسلسل الكمي للنسخ العكسي (qRT-PCR).
5. الارتقاء إلى 96 لوحة بئر تحتوي على إدراج غشاء
ملاحظة: قم بإعداد طبقات أحادية ظهارية لفحوصات الأدوية ذات الإنتاجية العالية أو الظروف المتوسطة المتعددة باستخدام ألواح HTS 96-well التي تحتوي على إدخالات غشائية.
- التعديلات عند إعداد الطبقات الأحادية في شكل 96 بئرا
- اتبع جميع الخطوات الموضحة في هذا البروتوكول للوحات 24 بئرا تحتوي على إدخالات غشائية ، وتغيير الأحجام وأرقام الخلايا إلى تلك الموضحة في الجدول 1. لإعداد طبقات أحادية على لوحات 96 بئرا مع إدراج غشاء ، تابع كما هو موضح في القسم 3 مع الاختلافات التالية.
- هناك حاجة إلى ما يقرب من 9 آبار من صفيحة استزراع 6 آبار ذات كثافة عضوية ممثلة في الشكل 3A لزرع صفيحة كاملة من 96 بئرا مع إدراج غشاء. في الخطوة 3.2.1 ، قم بتغطية الأغشية مسبقا ب 67 ميكرولتر من ECM المخفف 40x في DPBS (مع Ca 2+ و Mg2+).
- في القسم 3.5 ، قم أولا بنقل اللوحة المتكاملة لإدخالات الغشاء إلى لوحة أخرى من 96 بئرا للسماح بالمرطبات المتوسطة لكل من المقصورات القمية والقاعدية.
- اتبع جميع الخطوات الموضحة في هذا البروتوكول للوحات 24 بئرا تحتوي على إدخالات غشائية ، وتغيير الأحجام وأرقام الخلايا إلى تلك الموضحة في الجدول 1. لإعداد طبقات أحادية على لوحات 96 بئرا مع إدراج غشاء ، تابع كما هو موضح في القسم 3 مع الاختلافات التالية.
النتائج
يوضح الشكل 1A صورة سطعة تمثيلية للعضويات المعوية بعد إذابتها من التبريد. من المهم إذابة المواد العضوية بكثافة عالية لضمان الشفاء الأمثل. يتم طلاء المواد العضوية في لوحات 24 أو 6 آبار في قباب ECM تبلغ حوالي 10 ميكرولتر (الشكل 1B). معظم المواد العضوية المعوية الطبيع...
Discussion
يصف هذا البروتوكول التلاعب العام وصيانة المواد العضوية المعوية بالإضافة إلى التحضير والتطبيقات المحتملة للطبقات الأحادية الظهارية المشتقة من هذه المواد العضوية. حتى الآن ، تم إعداد الطبقات الأحادية بنجاح من الاثني عشر والدقاق ومناطق مختلفة من عضويات القولون المشتقة من الأنسجة المعوية ...
Disclosures
ويعلن صاحبا البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
يتم دعم هذا العمل من قبل Topsector Life Sciences & Health - Topconsortium voor Kennis en Innovatie Health ~ Holland (LSH-TKI ) للشراكات بين القطاعين العام والخاص (PPP) بدل قطاع LSH الهولندي مع رقم المشروع LSHM16021 Organoids كأداة جديدة لنمذجة علم السموم لتكنولوجيا Hubrecht Organoid Technology (HUB) والتمويل الداخلي HUB لقسم نمذجة الأمراض والسموم. نشكر مختبرات سابين ميدندورب (قسم أمراض الجهاز الهضمي لدى الأطفال ، مستشفى فيلهلمينا للأطفال ، UMC ، أوتريخت) وهوغو ر. دي جونغ ومارسيل جي سي بيجلدز (قسم أمراض الجهاز الهضمي والكبد ، Erasmus MC ، روتردام) على تقديم الدعم الفني الأولي لإعداد طبقات أحادية على إدراج الغشاء.
Materials
| Name | Company | Catalog Number | Comments |
| 100% ethanol | Fisher Emergo | 10644795 | |
| 1250, 300, and 20 µL low-retention filter-tips | Greiner bio-one | 732-1432 / 732-1434 / 732-2383 | |
| 15 mL conical tubes | Greiner bio-one | 188271 | |
| 24-well cell culture plates | Greiner bio-one | 662160 | |
| 24-well HTS Fluoroblok Transwell plate (light-tight) | Corning | 351156 | |
| 24-well HTS Transwell plates (Table 1) | Corning | 3378 | |
| 24-well plate with Transwell inserts | Corning | 3470 | |
| 40 µm cell strainer | PluriSelect | 43-50040-01 | |
| 50 mL conical tubes | Greiner bio-one | 227261 | |
| 6-well cell culture plates | Greiner bio-one | 657160 | |
| 96-well black plate transparent bottom | Greiner bio-one | 655090 | |
| 96-well fast thermal cycling plates | Life Technologies Europe BV | 4346907 | |
| 96-well HTS Fluoroblok Transwell plate | Corning | 351162 | |
| 96-well HTS Transwell plates (Table 1) | Corning | 7369 | |
| 96-well transparent culture plate | Greiner bio-one | 655180 | |
| A83-01 | Bio-Techne Ltd | 2939 | |
| Accutase Cell Dissociation Reagent | Life Technologies Europe BV | A11105-01 | Cell dissociation reagent 2 |
| Advanced DMEM/F-12 | Life Technologies Europe BV | 12634028 | |
| B27 supplement | Life Technologies Europe BV | 17504001 | |
| Cell culture microscope (light / optical microscope) | Leica | ||
| CellTiter-Glo | Promega | G9683 | |
| Centrifuge | Eppendorf | ||
| CO2 incubator | PHCBI | ||
| DAPT | Sigma-Aldrich | D5942 | |
| DEPC treated H2O | Life Technologies Europe BV | 750024 | |
| Dulbecco's phosphate-buffered saline (DPBS) with Ca2+ and Mg2+ | Life Technologies Europe BV | 14040091 | |
| DPBS, powder, no calcium, no magnesium | Life Technologies Europe BV | 21600069 | |
| EnzChek Lysozyme Assay Kit | Life Technologies Europe BV | E22013 | |
| EVOM2 meter with STX electrode | WTI | ||
| Gastrin | Bio-Techne Ltd | 3006 | |
| Glass pipettes | Volac | ||
| GlutaMAX | Life Technologies Europe BV | 35050038 | |
| hEGF | Peprotech | AF-100-15 | |
| HEPES | Life Technologies Europe BV | 15630056 | |
| Human Noggin | Peprotech | 120-10C | |
| Human Rspo3 | Bio-Techne Ltd | 3500-RS/CF | |
| IWP-2 | Miltenyi Biotec | 130-105-335 | |
| Ki67 primary antibody | Sanbio | BSH-7302-100 | |
| Ki67 secondary antibody | Agilent | K400111-2 | |
| Kova International Glasstic Slide with Counting grids | Fisher Emergo | 10298483 | |
| Laminar flow hood | Thermo scientific | ||
| Lucifer Yellow CH dilithium salt | Sigma-Aldrich | L0259 | |
| Matrigel, Growth Factor Reduced (GFR) | Corning | 356231 | extracellular matrix (ECM) |
| MicroAmp Fast 8-Tube Strip, 0.1 mL | Life Technologies Europe BV | 4358293 | |
| MicroAmp Optical 8-Cap Strips | Life Technologies Europe BV | 4323032 | |
| Microcentrifuge tubes | Eppendorf | 0030 120 086 | |
| Micropipettes (1000, 200, and 20 µL) | Gilson | ||
| Microtome | Leica | ||
| MUC2 primary antibody | Santa Cruz Biotechnology | sc-15334 | |
| MUC2 secondary antibody | VWR | VWRKS/DPVR-HRP | |
| Multichannel pipette (200 µL) | Gilson | ||
| N-acetylcysteine | Sigma-Aldrich | A9165 | |
| NGS Wnt | U-Protein Express | N001-0.5mg | |
| Nicotinamide | Sigma-Aldrich | N0636 | |
| Oligonucleotide ALPI1/Forward | Custom-made | GGAGTTATCCTGCTCCCCAC | |
| Oligonucleotide ALPI1/Reverse | Custom-made | CTAGGAGGTGAAGGTCCAACG | |
| Oligonucleotide LGR5/Forward | Custom-made | ACACGTACCCACAGAAGCTC | |
| Oligonucleotide LGR5/Reverse | Custom-made | GGAATGCAGGCCACTGAAAC | |
| Oligonucleotide MUC2/Forward | Custom-made | AGGATCTGAAGAAGTGTGTCACTG | |
| Oligonucleotide MUC2/Reverse | Custom-made | TAATGGAACAGATGTTGAAGTGCT | |
| Oligonucleotide TBP/Forward | Custom-made | ACGCCGAATATAATCCCAAGCG | |
| Oligonucleotide TBP/Reverse | Custom-made | AAATCAGTGCCGTGGTTCGTG | |
| Optical adhesive covers | Life Technologies Europe BV | 4311971 | |
| PD0325901 | Stemcell Technologies | 72184 | |
| Penicillin/streptomycin | Life Technologies Europe BV | 15140122 | |
| Plate shaker | Panasonic | ||
| PowerUp SYBR Green Master Mix | Fisher Emergo | A25776 | |
| Primocin | InvivoGen | ANT-PM-2 | antimicrobial formulation for primary cells |
| Qubit RNA HS Assay Kit | Life Technologies Europe BV | Q32852 | |
| Reagent reservoir for multichannel pipet | Sigma-Aldrich | CLS4870 | |
| REMS AutoSampler with 24-probe or 96C-probe | WTI | ||
| Richard-Allan Scientific Alcian Blue/PAS Special Stain Kit | Thermo scientific | 87023 | |
| RNase-Free DNase Set | Qiagen | 79254 | |
| RNeasy Mini Kit | Qiagen | 74106 | |
| SB202190 | Sigma-Aldrich | S7076 | |
| Serological pipettes | Greiner bio-one | 606180 / 607180 / 760180 | |
| Serological pipettor (Pipet-Aid) | Drummond | ||
| Single edge razor blade | GEM Scientific | ||
| Superscript 1st strand system for RT-PCR | Life Technologies Europe BV | 11904018 | |
| Tecan Spark 10M plate reader | Tecan | ||
| Trypan Blue Solution, 0.4% | Life Technologies Europe BV | 15250-061 | |
| TrypLE Express Enzyme (1x) | Life Technologies Europe BV | 12605-010 | Cell dissociation reagent 1 |
| Water bath | Grant | ||
| Y27632 (ROCK inhibitor) | AbMole | M1817 |
References
- Haegebarth, A., Clevers, H. Wnt signaling, lgr5, and stem cells in the intestine and skin. The American Journal of Pathology. 174 (3), 715-721 (2009).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. V. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9 (8), 1909 (2020).
- Martínez-Maqueda, D., Miralles, B., Recio, I., Verhoeckx, K. HT29 Cell Line. The Impact of Food Bio-Actives on Gut Health: In Vitro and Ex Vivo Models. , 113-124 (2015).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Huch, M., et al. In vitro expansion of single Lgr5(+) liver stem cells induced by Wnt-driven regeneration. Nature. 11 (2), 179-194 (2013).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 1-20 (2019).
- Karthaus, W. R., et al. Identification of multipotent luminal progenitor cells in human prostate organoid cultures. Cell. 159 (1), 163-175 (2014).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Van De Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Driehuis, E., et al. Pancreatic cancer organoids recapitulate disease and allow personalized drug screening. Proceedings of the National Academy of Sciences of the United States of America. 116 (52), 26580-26590 (2019).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- d'Aldebert, E., et al. Characterization of human colon organoids from inflammatory bowel disease patients. Frontiers in Cell and Developmental Biology. 8, 363 (2020).
- Dotti, I., et al. Alterations in the epithelial stem cell compartment could contribute to permanent changes in the mucosa of patients with ulcerative colitis. Gut. 66 (12), 2069-2079 (2017).
- VanDussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. 64 (6), 911-920 (2015).
- Noel, G., et al. A primary human macrophage-enteroid co-culture model to investigate mucosal gut physiology and host-pathogen interactions. Scientific Reports. 7, 45270 (2017).
- Bartfeld, S., et al. In vitro expansion of human gastric epithelial stem cells and their responses to bacterial infection. Gastroenterology. 148 (1), 126-136 (2015).
- van Es, J. H., et al. Wnt signalling induces maturation of Paneth cells in intestinal crypts. Nature Cell Biology. 7 (4), 381-386 (2005).
- van Es, J. H., et al. Dll1 marks early secretory progenitors in gut crypts that can revert to stem cells upon tissue damage. Nature Cell Biology. 14 (10), 1099-1104 (2012).
- de Lau, W. B. M., Snel, B., Clevers, H. C. The R-spondin protein family. Genome Biology. 13 (3), 1-10 (2012).
- Basak, O., Beumer, J., Wiebrands, K., Seno, H., van Oudenaarden, A., Clevers, H. Induced quiescence of Lgr5+ stem cells in intestinal organoids enables differentiation of hormone-producing enteroendocrine cells. Cell Stem Cell. 20 (2), 177-190 (2017).
- Beumer, J., et al. Enteroendocrine cells switch hormone expression along the crypt-to-villus BMP signalling gradient. Nature Cell Biology. 20 (8), 909-916 (2018).
- Yin, X., Farin, H. F., van Es, J. H., Clevers, H., Langer, R., Karp, J. M. Niche-independent high-purity cultures of Lgr5+ intestinal stem cells and their progeny. Nature Methods. 11 (1), 106-112 (2014).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: An in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments. (120), (2017).
- Miao, Y., et al. Next-generation surrogate Wnts support organoid growth and deconvolute Frizzled pleiotropy in vivo. Cell Stem Cell. 27 (5), 840-851 (2020).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- Blume, L. -. F., Denker, M., Gieseler, F., Kunze, T. Temperature corrected transepithelial electrical resistance (TEER) measurement to quantify rapid changes in paracellular permeability. Die Pharmazie. 65 (1), 19-24 (2010).
- Lea, T., Verhoeckx, K., et al. Caco-2 cell line. The Impact of Food Bio-Actives on Gut Health: In Vitro and Ex Vivo Models. , 103-111 (2015).
- Heo, I., et al. Modelling Cryptosporidium infection in human small intestinal and lung organoids. Nature Microbiology. 3 (7), 814-823 (2018).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved