É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Monocameira epitelial derivada organoide: um modelo in vitro clinicamente relevante para a função da barreira intestinal
Neste Artigo
Resumo
Aqui, descrevemos a preparação de monocamadas epiteliais intestinais derivadas de organoides humanos para estudar a função da barreira intestinal, a permeabilidade e o transporte. Como os organoides representam a resposta original do tecido epitelial a estímulos externos, esses modelos combinam as vantagens da expansão das linhas celulares e a relevância e complexidade do tecido primário.
Resumo
No passado, os sistemas de modelo epitelial intestinal limitavam-se a linhas celulares transformadas e tecido primário. Esses sistemas de modelos têm limitações inerentes, pois os primeiros não representam fielmente a fisiologia do tecido original, e a disponibilidade deste último é limitada. Assim, sua aplicação dificulta pesquisas fundamentais e de desenvolvimento de medicamentos. Organoides adultos à base de células-tronco (a partir de agora referidos como organoides) são miniaturas de tecido epitelial normal ou doente do qual são derivados. Eles podem ser estabelecidos de forma muito eficiente a partir de diferentes regiões gastrointestinais (GI), têm expansão a longo prazo e simulam respostas específicas de tecidos e pacientes para tratamentos in vitro. Aqui, o estabelecimento de monocamadas epiteliais derivadas de organoides intestinais tem sido demonstrado juntamente com métodos para medir a integridade da barreira epitelial, permeabilidade e transporte, secreção de proteína antimicrobiana, bem como histologia. Além disso, as monocamadas derivadas de organoides intestinais podem ser enriquecidas com células de tronco e amplificadores de trânsito, bem como com células epiteliais diferenciadas. Portanto, eles representam um sistema modelo que pode ser adaptado para estudar os efeitos dos compostos nas células alvo e seu modo de ação. Embora as culturas organoides sejam tecnicamente mais exigentes do que as linhas celulares, uma vez estabelecidas, elas podem reduzir falhas nos estágios posteriores do desenvolvimento de medicamentos, pois representam verdadeiramente a complexidade do epitélio vivo e a heterogeneidade interpatente.
Introdução
O epitélio intestinal age como uma barreira física entre o conteúdo luminal dos intestinos e o tecido subjacente. Esta barreira compreende uma única camada epitelial de enterócitos principalmente absortivos que são conectados por junções apertadas, que estabelecem fortes conexões intercelulares entre células adjacentes. Essas células formam um revestimento epitelial polarizado que separa os lados apical (lúmen) e basolateral do intestino, ao mesmo tempo em que regulam o transporte paracelular de nutrientes e metabólitos digeridos. Além dos enterócitos, outras células epiteliais importantes, como cálice, paneto e células enteroendócrinas também contribuem para a homeostase intestinal produzindo muco, peptídeos antimicrobianos e hormônios, respectivamente. O epitélio intestinal é constantemente reabastecido dividindo células-tronco de receptor 5-positivo (LGR5+) na parte inferior das criptas intestinais que produzem células amplificadoras de trânsito (TA) que migram para cima e se diferenciam em outros tipos de células1. A interrupção da homeostase epitelial intestinal por fatores genéticos e ambientais, como exposição a alérgenos alimentares, compostos medicinais e patógenos microbianos, leva à interrupção da função da barreira intestinal. Essas condições causam várias doenças intestinais, incluindo doença inflamatória intestinal (DII), doença celíaca e toxicidade gi induzida por drogas2.
Estudos sobre o epitélio intestinal são realizados usando vários sistemas de plataforma in vitro, como inserções de membrana, sistemas de órgãos em um chip, câmaras de Ussing e anéis intestinais. Essas plataformas são adequadas para estabelecer monocamadas epiteliais polarizadas com acesso a lados apical e basolateral da membrana, utilizando linhas celulares transformadas ou tecido primário como modelos. Embora as linhas celulares transformadas, como as linhas celulares colorretal (adeno)carcinoma Caco-2, T84 e HT-29, sejam capazes de se diferenciar em enterócitos intestinais polarizados ou células produtoras de muco até certo ponto, elas não são representativas do epitélio in vivo, pois vários tipos de células estão faltando, e vários receptores e transportadores são expressosarantberly 3 . Além disso, como as linhas celulares são derivadas de um único doador, elas não representam heterogeneidade interpata e sofrem de menor complexidade e relevância fisiológica. Embora os tecidos primários usados nas câmaras de Ussing e como anéis intestinais sejam mais representativos da situação in vivo, sua disponibilidade limitada, viabilidade a curto prazo e falta de expansão os tornam inadequados como um meio para estudos de alta produtividade (HT).
Organoides são culturas epiteliais in vitro estabelecidas a partir de diferentes órgãos, como intestino, rim, fígado, pâncreas e pulmão. Comprovadamente, possuem expansão estável e de longo prazo, bem como estabilidade genética e fenotípica e, portanto, são miniaturas biológicas representativas do epitélio do órgão original com respostas fiéis a estímulos externos 4,5,6,7,8,9. Os organoides são eficientemente estabelecidos a partir de tecido normal, doente, inflamado ou cancerígeno, representando respostas heterogêneas específicas do paciente 10,11,12,13,14,15,16. Este artigo demonstra como estabelecer monocamadas epiteliais intestinais derivadas de culturas organoides. Monocamadas foram estabelecidas com sucesso a partir de pequenas culturas intestinais, bem como culturas organoides coloniais e retal. Este modelo cria uma oportunidade de estudar o transporte e a permeabilidade das células epiteliais para drogas, bem como seus efeitos toxicológicos sobre o epitélio. Além disso, o modelo permite que a cocultura com células imunes e bactérias estude suas interações com o epitélio intestinal 17,18,19. Além disso, esse modelo pode ser usado para estudar respostas a terapias de forma específica do paciente e iniciar esforços de triagem para procurar a próxima onda de terapêuticas focadas em barreiras epiteliais. Tal abordagem poderia ser estendida à clínica e abrir caminho para tratamentos personalizados.
Embora as monocamadas epiteliais neste protocolo sejam preparadas a partir de organoides intestinais normais humanos, o protocolo pode ser aplicado e otimizado para outros modelos organoides. As monocamadas organoides epitelial são cultivadas em meio de expansão organoide intestinal contendo Wnt para apoiar a proliferação de células-tronco e representar a composição celular criptoina intestinal. Organoides intestinais podem ser enriquecidos para ter diferentes destinos epiteliais intestinais, como enterócitos, panéstas, cálices e células enteroendócrinas, modulando vias Wnt, Notch e fator de crescimento epidérmico (EGF). Aqui, após o estabelecimento de monocamadas em meio de expansão, elas são conduzidas para células epiteliais intestinais mais diferenciadas, como descrito anteriormente 20,21,22,23,24,25. Para fins de triagem, dependendo do modo de ação do composto de interesse, suas células-alvo e as condições experimentais, as monocamadas podem ser conduzidas em direção à composição celular de escolha para medir os efeitos do composto com leituras funcionais relevantes.
Protocolo
1. Preparando reagentes para a cultura
NOTA: Execute todas as etapas dentro de um armário de biossegurança e siga as diretrizes padrão para trabalhar com culturas celulares. A luz ultravioleta é usada por 10 minutos antes de iniciar o armário de biossegurança. Antes e depois do uso, a superfície do armário de biossegurança é limpa com um papel de tecido encharcado em 70% de etanol. Para facilitar a formação de gotas tridimensionais de matriz extracelular (ECM), mantenha um estoque pré-enlatado de placas de 96, 24 e 6 poços prontas na incubadora a 37 °C.
- Preparação média basal
- Prepare o meio basal (BM) em um meio de águia modificado de 500 mL Avançado Dulbecco com a mistura de nutrientes F-12 (Ad-DF) garrafa média adicionando 5 mL de glutamina de 200 mM, 5 mL de soluções de 1 M 4-(2-hidroxiethil)-1piperazineetanesulfonic (HEPES) e 5 mL de penicilina/estreptomicina (caneta/estreptomia) (10.000 U/mL ou 10.000 μg/mL). Isso pode ser armazenado na geladeira a 4 °C por pelo menos 4 semanas.
- Fontes do WNT
- Prepare o meio condicionado Wnt3a (Wnt3aCM) de acordo com o método descrito anteriormente26.
NOTA: Recentemente, um Wnt substituto de última geração (NGS-Wnt), que também apoia a expansão de organoides intestinais humanos, foi gerado27.
- Prepare o meio condicionado Wnt3a (Wnt3aCM) de acordo com o método descrito anteriormente26.
- Preparação média da base organoide intestinal
NOTA: Use todos os fatores de crescimento e reagentes de acordo com as recomendações do fabricante. Use alíquotas pequenas e evite ciclos de degelo congelado; fatores de crescimento funcional são essenciais para o sucesso da cultura organoide.- Prepare o meio concentrado de base organoide intestinal 2x (2x IBM) suplementando BM com 1 μM A83-01, 2,5 mM N-acetilcisteína, suplemento 2x B27, fator de crescimento epidérmico humano de 100 ng/mL (hEGF), gastrina de 10 nM, 200 ng/mL hNoggin e 100 μg/mL de uma formulação antimicrobiana para células primárias (ver a Tabela de Materiais).
- Aliquot o IBM 2x e congele a -20 °C por até 4 meses. Quando necessário, descongele uma alíquota durante a noite a 4 °C ou por várias horas em temperatura ambiente (RT).
- Para preparar o meio de expansão organoide intestinal (IEM), suplementar 2x IBM com 50% de Wnt3aCM ou 50% BM e 0,5 nM NGS-Wnt, 250 ng/mL humano Rspondin-3 (hRspo3), 10 mM nicotinamida e 10 μM SB202190.
- Preparação média de diferenciação organoide intestinal
- Prepare o meio de diferenciação de enterocíte (eDM) suplementando 2x IBM com 50% de BM, 250 ng/mL hRspo3 e inibidor de via wnt de 1,5 μM (IWP-2). Armazenar eDM a 4 °C por até 10 dias.
- Prepare o meio de diferenciação de combinação (cDM) suplementando 2x IBM com 40% de BM e 10% Wnt3aCM ou 50% BM e 0,1 nM NGS-Wnt, 250 ng/mL hRspo3, 10 μM DAPT e 100 nM PD0325901. Armazenar cDM a 4 °C por até 10 dias.
- Manipulação da matriz extracelular (ECM)
NOTA: Prepare a matriz extracelular (ECM) (ver a Tabela de Materiais) de acordo com a recomendação do fabricante.- Descongelar eCM durante a noite no gelo; transfira o ECM da garrafa para um tubo cônico de 15 mL usando uma pipeta de 5 mL, ambas pré-resfriadas a -20 °C. Recongelar alíquotas apenas uma vez a -20 °C. Uma vez descongelado, armazene o ECM em uma geladeira a 4 °C por até 7 dias. Incubar por pelo menos 30 minutos no gelo antes de usar.
NOTA: Misture o ECM corretamente e certifique-se de que está frio antes de incorporar criptas ou organoides.
- Descongelar eCM durante a noite no gelo; transfira o ECM da garrafa para um tubo cônico de 15 mL usando uma pipeta de 5 mL, ambas pré-resfriadas a -20 °C. Recongelar alíquotas apenas uma vez a -20 °C. Uma vez descongelado, armazene o ECM em uma geladeira a 4 °C por até 7 dias. Incubar por pelo menos 30 minutos no gelo antes de usar.
2. Culturas organoides
- Estabelecendo culturas a partir de organoides congelados
NOTA: Deixe o BM chegar ao RT, e mantenha uma alíquota de 12 mL, aquecida a 37 °C, pronta antes de iniciar o procedimento de descongelamento de um criovial contendo organoides congelados.- Descongele o criovial organoide rapidamente agitando-se em um banho de água de 37 °C até que apenas um pedaço de gelo permaneça. Adicione imediatamente 500 μL de BM quente em gota ao criovial, e encove algumas vezes para diluir o meio de congelamento e misturar o conteúdo cuidadosamente.
- Usando uma pipeta P1000, transfira os organoides para um tubo cônico de 15 mL e adicione mais 1 mL de BM quente dropwise enquanto mistura suavemente a parte inferior do tubo. Encolé-lo algumas vezes para diluir o meio de congelamento e misturar o conteúdo cuidadosamente.
- Adicione até 12 mL de BM quente dropwise ao tubo cônico de 15 mL contendo os organoides, e encobre para cima e para baixo com uma pipeta estéril de 10 mL para resuspensar suavemente os organoides.
- Centrifugar a suspensão organoide por 5 min a 85 × g e 8 °C. Descarte o supernatante cuidadosamente sem perturbar a pelota, e resuspenque os organoides em 30% v/v de IEM suplementado com 10 μM Y27632 ou outro inibidor de proteína de codação de bobina/troonina (inibidor de quinase de 10 μM Y27632 ou outro inibidor de proteína de coina-coada associada à roda). Coloque o tubo no gelo.
- Adicione 70% v/v de ECM no tubo cônico de 15 mL contendo os organoides. Misture a suspensão organoide mantendo o tubo cônico de 15 mL no gelo, e sementes 5 μL da suspensão para verificar a densidade (Figura 1A). Continuar a chapeamento se a densidade for apropriada; se a densidade for muito alta, adicione mais solução IEM/ECM na mesma proporção de 30-70% v/v, respectivamente.
- Em cada poço de uma placa pré-armada de 24 poços, sementes 50 μL da suspensão organoide por pipetação 5 gotas separadas de 10 μL (Figura 1B). Vire a placa de cabeça para baixo, e deixe-a no armário de biossegurança por 5 minutos. Transfira a placa ainda de cabeça para baixo para a incubadora de 37 °C e deixe-a por mais 30 minutos.
- Adicione 500 μL de IEM com inibidor de ROCK de 10 μM a cada poço e transfira a placa para a incubadora. Imagem uma gota regularmente para monitorar o crescimento e atualizar o IEM a cada 2-3 dias aspirando o médio antigo e adicionando 500 μL de IEM fresco.
- Passagem os organoides uma vez que eles se recuperaram adequadamente do descongelamento e atingiram o tamanho certo a ser processado (Figura 1C), conforme descrito na seção 2.2.
- Passagem de organoides intestinais
NOTA: Esfrie o ECM no gelo por pelo menos 30 minutos e mantenha o IEM no RT por pelo menos 1h antes de usar.- Use bem o meio de uma cultura para quebrar as cúpulas organoides usando uma ponta de filtro de baixa retenção de 1250 μL e transfira o conteúdo do poço para um tubo cônico de 15 mL rotulado. Lave o poço com 1 mL de BM, e transfira-o para o mesmo tubo cônico de 15 mL.
- Repetir as etapas 2.2.1 e 2.2.2 com todos os outros poços (um máximo de meia placa ou 600 μL de gotas de ECM pode ser lavado e adicionado a um tubo cônico de 15 mL).
- Adicione BM para encher o tubo até 12 mL, e encoste para cima e para baixo 10x usando uma pipeta de 10 mL. Centrifugar a 85 × g por 5 min a 8 °C.
- Antes de remover o BM, verifique sob o microscópio para ver se todos os organoides são pelotas na parte inferior do tubo cônico de 15 mL (Figura 1D). Se não houver ECM sobrepondo a pelota organoide ou a camada ECM estiver limpa ou conter apenas detritos, células únicas ou muito poucos organoides em comparação com os organoides pelleted, aspire o supernatante e pipeta fora do ECM sobrepondo a pelota organoide com muito cuidado usando uma pipeta P200.
NOTA: Os organoides podem ficar presos no ECM e não sedimentar como uma pelota compacta devido à baixa força de centrifugação. Se o ECM contiver organoides, centrifugar o tubo novamente a 450 × g por 5 min a 8 °C, e remover cuidadosamente o sobrenante como descrito em 2.2.4. Se houver vários tubos cônicos de 15 mL, eles podem ser agrupados após a etapa 2.2.4. - Adicione 1 mL de MM a cada pelota (de volume de 50-200 μL, dependendo da cultura e densidade organoide), e resuspende cuidadosamente. Pipet os organoides para cima e para baixo pelo menos 5x para corte-los, evitando a formação de espuma. Verifique sob o microscópio para ver se os organoides estão interrompidos (Figura 2A). Se os organoides forem interrompidos, proceda à etapa 2.2.7; se os organoides não forem interrompidos, pipeto-os mais 5x. Desta vez, toque na parede do tubo plástico com a ponta da pipeta para exercer mais força mecânica para interromper os organoides.
NOTA: O cisto mecânico de organoides císticos (Figura 1C) e de brotação (Figura 1E) é possível com uma ponta de pipeta de plástico de 200 μL ou 10 μL instalada em uma ponta de filtro de 1250 μL de baixa retenção (Figura 1F), dependendo do volume necessário para interromper os organoides. Recomenda-se o uso de uma pipeta de vidro estreita (Figura 1F) quando mais de 200 μL de ECM contendo os organoides são processados (um poço de uma placa de 6 poços ou 4 poços de uma placa de 24 poços). - Verifique sob o microscópio novamente para ver se os organoides estão interrompidos. Se interrompido, prossiga com o próximo passo; se não, encarregam os organoides em até 20x, verificando os organoides sob o microscópio regularmente. Se os organoides ainda não estiverem interrompidos, adicione 25% de reagente de dissociação celular v/v 1 (veja a Tabela de Materiais) à suspensão, incubar no banho de água a 37 °C por 2 min e intubar os organoides em até 20x, verificando os organoides sob o microscópio regularmente para garantir que eles não sejam digeridos em células únicas.
- Adicione até 12 mL de BM ao tubo cônico de 15 mL e lave a pelota organoide por tubulação para cima e para baixo. Centrifugar a 85 × g por 5 min a 8 °C. Descarte o supernasce e ajuste a concentração final para 70% v/v ECM adicionando IEM e ECM à pelota organoide.
- Comece a reutilizar a pelota organoide com o dobro do volume de IEM/ECM coletado para a passagem, e sementes 5 μL da suspensão para verificar a densidade. Continuar a chapeamento se a densidade for apropriada (Figura 2B); adicionar mais solução IEM/ECM se a densidade for muito alta. Adicione 200 μL da suspensão a cada poço de uma placa pré-armada de 6 poços, fazendo gotas separadas de 10 μL de volume.
- Vire a placa de cabeça para baixo, e deixe-a no armário de biossegurança por 5 minutos. Transfira a placa ainda de cabeça para baixo para a incubadora de 37 °C, deixando-a por mais 30 minutos. Adicione 2 mL de IEM com inibidor rock de 10 μM a cada poço e transfira a placa para a incubadora.
- Imagem uma gota regularmente para monitorar o crescimento e atualizar o IEM a cada 2-3 dias aspirando o antigo meio e adicionando 2 mL de IEM fresco.
- Passagem de organoides intestinais para preparação de monocamadas epiteliais
- Organoides de passagem 3 dias antes da colheita para preparação de monocamadas seguindo o mesmo protocolo de passagem descrito na seção 2.2 com uma exceção. Na etapa 2.2.7, resuspenncie os organoides em 1-1,5x o volume inicial do IEM/ECM para ter maior densidade e potencial de expansão quando forem colhidos para preparação de monocamadas (Figura 3A).
3. Preparação de monocamadas epiteliais
- Monocamadas epiteliais de cultura em inserções de membrana de 24 poços e 96 poços com uma variedade de tipos de placas disponíveis (Tabela 1). Use pastilhas de membrana de alto rendimento (HTS) para ambos os tamanhos, pois estas contêm uma bandeja integral com as pastilhas de membrana e uma placa receptora. Para o formato de 24 poços, o uso de placas com pastilhas de membrana removíveis separadas também é possível.
NOTA: Diferentes tipos de membrana (tereftalato de polietileno (PET) ou policarbonato) e tamanhos de poros (0,4-8,0 μm) estão disponíveis e podem ser usados dependendo das necessidades experimentais. Monocamadas só podem ser imagens por brightfield quando as pastilhas com membranas PET são usadas. Membranas leves bloqueiam o vazamento de luz fluorescente do apical para o compartimento basolateral e podem ser consideradas quando o transporte dinâmico ou a permeabilidade de substratos rotulados fluorescentes são estudados. O protocolo atual utiliza inserções de membrana de 24 poços; adaptações para pastilhas de membrana de 96 poços são descritas na seção 5. Dependendo da densidade, morfologia e tamanho dos organoides (Figura 3A), 6 poços de uma placa de 6 poços (como semeado na seção 2.3) são suficientes para semear uma placa completa de 24 poços de inserções de membrana. - Revestimento de membrana inserções com ECM
NOTA: Se houver dúvidas sobre ter células suficientes, cubra as pastilhas após a contagem das células. Isto é para evitar o revestimento desnecessário e a perda das pastilhas de membrana caras.- Coloque as pastilhas de membrana na placa de suporte no armário de biossegurança. Diluir o ECM 40x no frio do gelo Dulbecco tamponado salina (DPBS) com Ca2+ e Mg2+, e tubo de 150 μL do ECM diluído no compartimento apical de cada inserção. Incubar a placa a 37 °C por pelo menos 1 h.
- Preparação de células para semeadura
- Alíquotas pré-inquem do reagente de dissociação celular 2 no banho de água (37 °C). Prepare 2 mL do reagente para cada poço de uma placa de 6 poços.
- Transfira a placa de cultura contendo os organoides (preparados na seção 2.3) da incubadora para o armário de biossegurança. Processe os organoides, conforme descrito nas etapas 2.2.1.-2.2.4. Não possua vários tubos em um tubo.
- Encha o tubo, contendo organoides de no máximo 3 poços de uma placa de 6 poços, até 12 mL com DPBS (sem Ca2+ e Mg2+), e tubos para cima e para baixo 10x usando uma pipeta de 10 mL. Centrifugar a 85 × g por 5 min a 8 °C, e aspirar o supernante sem perturbar a pelota organoide.
- Adicione 2 mL do reagente de dissociação celular pré-armado 2 por poço de uma placa de 6 poços usada como material inicial e resuspend. Incubar os tubos diagonal ou horizontalmente por 5 minutos no banho de água a 37 °C, para evitar o naufrágio dos organoides até o fundo do tubo.
- Encoque 10x usando uma pipeta de plástico estéril de 5 mL ou uma pipeta P1000, dependendo do volume total do reagente de dissociação celular. Verifique a suspensão organoide sob o microscópio para ver se uma mistura de células únicas e algumas células compostas por 2-4 células se formou (Figura 3B). Se necessário, continue a digestão repetindo as etapas 3.3.4-3.3.5 (não aumente o volume do reagente de dissociação celular) até que a mistura se pareça com a Figura 3B.
NOTA: Evite digerir totalmente os organoides em células únicas. É necessário ter alguns pequenos grupos de células (ou seja, grupos de 2-4 células). - Pare a dissociação celular adicionando até 12 mL de BM, incluindo o inibidor de 10 μM ROCK à suspensão celular. Centrifugar a 450 × g por 5 min a 8 °C, e aspirar o supernatante sem perturbar a pelota celular. Ao manusear a mesma cultura organoide em vários tubos cônicos de 15 mL, acumule as pelotas celulares e resuspensá-las em 12 mL de BM.
- Filtre a suspensão da célula através de um coador de 40 μm pré-equipado com BM e colmeia o fluxo através de um tubo cônico de 50 mL. Lave o coador com 10 mL de BM e colhe o fluxo através do mesmo tubo cônico de 50 mL.
- Transfira a suspensão da célula tensa para dois novos tubos cônicos de 15 mL. Centrifugar a 450 × g por 5 min a 8 °C, e aspirar o supernatante sem perturbar a pelota celular. Resuspenque as células em 4 mL de IEM suplementadas com inibidor rock de 10 μM por placa de cultura completa usada como material de partida.
- Misture uma pequena quantidade de suspensão celular em uma proporção de 1:1 com o azul trypan para contar. Conte as células vivas, não azuis (Figura 3C), e calcule o número total de células vivas. Em pequenos aglomerados, conte cada célula individual.
- Prepare uma suspensão celular contendo 3 × 106 células vivas por mL de IEM suplementada com inibidor rock de 10 μM.
- Células de semeadura em pastilhas de membrana de poliéster
- Aspire cuidadosamente o DPBS das pastilhas revestidas de ECM (etapa 3.2.1), mantendo a placa horizontalmente. Pipet 800 μL de IEM complementado com inibidor de ROCHA em cada compartimento basolateral. Pipet 150 μL da suspensão celular preparada na etapa 3.3.10 para a membrana revestida de ECM no compartimento apical dropwise. Por placa, certifique-se de ter pelo menos um "branco" bem com apenas BM.
- Uma vez que as células tenham sedimentado na membrana, meça resistência elétrica transepitelial (TEER), conforme descrito na seção 4.1, e imagem que a membrana insere usando um microscópio. Coloque a placa na incubadora a 37 °C e 5% de CO2. Meça o TEER todos os dias e adquira imagens regularmente para monitorar a formação de monocamadas (Figura 4A-D).
- Monocamadas refrescantes
NOTA: Atualize o meio a cada 2-3 dias, aderindo à seguinte ordem para manter uma pressão hidrostática positiva acima das células e evitar que as células sejam empurradas para fora da membrana. Enquanto refrescar o meio, certifique-se de que a monocameira, que é visível na aspiração do meio, não seja danificada pela ponta da pipeta.- Remova o meio dos compartimentos basolaterais da placa que contém as pastilhas de membrana. Em seguida, aspire cuidadosamente o meio dos compartimentos apical das pastilhas de membrana.
- Adicione 150 μL de IEM fresco dropwise a cada compartimento apical e, em seguida, adicione 800 μL de IEM fresco a cada compartimento basolateral.
- Enriquecimento da monocamada para os tipos de células epiteliais intestinais desejadas
- Permita que a monocamada se torne confluente no IEM, correspondendo a um valor TEER de cerca de 100 Ω·cm² (conforme calculado na etapa 4.1.1.4). Verifique sob o microscópio para determinar se as monocamadas se formaram completamente (Figura 4D) e para a ausência de furos (como visto na Figura 4B,C).
- Remova cuidadosamente o IEM dos compartimentos basolaterais e apical das pastilhas de membrana e substitua-se por eDM ou cDM conforme preparado na seção 1.4. Cultume a monocamada por mais 3-4 dias no meio de diferenciação específico para obter as células organoides enriquecidas com o tipo celular específico desejado. Atualize o meio a cada 2-3 dias, conforme descrito na seção 3.4.
- Meça o TEER diariamente e adquira imagens regularmente, se desejar (Figura 5A-C).
NOTA: O valor teer que indica uma monocamada enriquecida totalmente organizada varia de acordo com a cultura organoide; tipicamente os valores teer aumentam para 600 e podem aumentar até 1000 Ω·cm2 (conforme calculado na etapa 4.1.1.4) após 3 dias em mídia de diferenciação e estão estáveis por 3-5 dias.
4. Leituras de ensaios de monocamadas epitelial
- Medição da resistência elétrica transepitenelial (TEER)
NOTA: As medidas de TEER são amplamente aceitas como um método para analisar a dinâmica de junção apertada e a integridade da função de barreira em modelos biológicos de barreiras fisiológicas, como monocamadas epiteliais28,29. O aumento do TEER após a diferenciação devido ao aumento da interação celular em junções apertadas pode ser medido usando um medidor TEER manual ou um robô de medição TEER automatizado.- Medição do TEER usando um medidor TEER manual
- Limpe o eletrodo com 70% de etanol, e deixe-o seco dentro do armário de biossegurança. Coloque o eletrodo em um tubo contendo BM. Conecte o eletrodo ao medidor TEER manual. Gire o interruptor Função para medir em Ohms (Ω). Ligue o interruptor De energia .
- Coloque o eletrodo curto no compartimento apical da pastilha, enquanto o eletrodo longo está posicionado no compartimento basolateral (Figura 6A). Evite tocar na monocamadas.
- Meça a resistência no poço em branco (Rem branco) e, em seguida, meça as amostras restantes (amostra R) da mesma forma. Lave o eletrodo com BM entre amostras com condições diferentes. Limpe o eletrodo primeiro com água demi e depois com 70% de etanol e deixe-o secar ao ar.
- Calcular TEER (Ω·cm2): [Amostra de R (Ω) - Rem branco (Ω)] × área da membrana (cm2) (Tabela 1 e Figura 6B).
- Medição do TEER usando um robô de medição TEER automatizado (Tabela de Materiais)
- Realize medições automatizadas de TEER ao usar sistemas HTS para placas HTS de 96 poços e 24 poços contendo pastilhas de membrana. Use diferentes eletrodos para medição de TEER para ambos os tipos (inserções de membrana 24 e 96- HTS). Para medir o TEER usando um robô de medição TEER automatizado, siga as instruções do fabricante.
- Medição do TEER usando um medidor TEER manual
- Medição da integridade e permeabilidade da barreira epitelial
NOTA: Este protocolo introduz a permeabilidade Lúcifer Amarelo do compartimento apical para basolateral como uma indicação da integridade da monocamada. Esta seção descreve a medição da fluorescência no compartimento basolateral após uma etapa de incubação de 1 h para avaliar a permeabilidade da monocamada e, portanto, a integridade da barreira. Esta medição é um ensaio de ponto final e é especialmente útil ao testar compostos para seu efeito na integridade da barreira.- Descongele Lucifer Yellow no gelo, e deixe o BM equilibrar-se à RT. Para uma placa de 24 poços de pastilhas de membrana, prepare 5 mL de solução de trabalho de 60 μM Lúcifer Amarelo em BM.
NOTA: Lucifer Yellow é sensível à luz. Prepare as diluições em tubos estéreis escuros de 1,5 mL e realize todas as etapas com a luz do armário de biossegurança desligada. - Remova cuidadosamente o meio dos compartimentos basolaterais e apical das pastilhas de membrana, conforme descrito na etapa 3.5.1. Se desejar, arranhe uma monocamada não tratada usando uma ponta de pipeta como controle positivo para o vazamento amarelo de Lúcifer através de uma barreira danificada.
- Adicione 150 μL de BM com 60 μM Lúcifer Amarelo a cada compartimento apical, e adicione 800 μL de BM sem Amarelo Lúcifer a cada compartimento basolateral. Coloque a placa em um shaker a 37 °C, 50 rpm por 60 min.
- Enquanto isso, prepare uma curva padrão de Lucifer Yellow em BM começando com a solução de trabalho preparada na etapa 4.2.1. Diluir 1:3 em cada etapa até que uma concentração de 3 nM seja atingida. Inclua um controle negativo (somente BM).
- Transfira 100 μL de cada padrão em triplicado para uma placa transparente de 96. Após a incubação de 60 min, remova as pastilhas de membrana e transfira 100 μL de cada poço basolateral (etapa 4.2.3) em triplicado para a placa transparente de 96 poços. Meça fluorescência da placa usando um leitor de placas em um comprimento de onda de excitação de 430 nm e um comprimento de onda de emissão de 530 nm.
- Após a correção para o valor de controle negativo (somente BM), utilize os valores de curva padrão para calcular a concentração de Lúcifer Amarelo no compartimento basolateral (concentração final do receptor (μM).
- Calcule o coeficiente de permeabilidade aparente (aplicativo P) de acordo com a seguinte fórmula (Figura 6C):

- Para uma placa de 24 poços contendo pastilhas de membrana, use a seguinte fórmula:
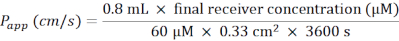
- Descongele Lucifer Yellow no gelo, e deixe o BM equilibrar-se à RT. Para uma placa de 24 poços de pastilhas de membrana, prepare 5 mL de solução de trabalho de 60 μM Lúcifer Amarelo em BM.
- Fixação de monocamadas e preparação de blocos de parafina para histologia
NOTA: As monocamadas epiteliais podem ser usadas para coloração histólógica para avaliação de sua composição celular, polaridade e expressão de diferentes proteínas de interesse, como proteínas juncionais, proliferação ou marcadores de diferenciação. Esta seção descreve a preparação do bloco de parafina para coloração histólógica.- Remova cuidadosamente o meio dos compartimentos basolaterais e apical das pastilhas de membrana, conforme descrito nas etapas 3.5.1.
- Lave as monocamadas adicionando 150 μL de DPBS (sem Ca2+ e Mg2+) a cada compartimento apical e 800 μL a cada compartimento basolateral. Aspire cuidadosamente o DPBS novamente, primeiro a partir do compartimento basolateral e depois do compartimento apical.
NOTA: O compartimento basolateral permanecerá vazio a partir deste degrau. - Em um capô de fumaça, adicione 150 μL de 4% de paraformaldeído a cada compartimento apical, e incubar por 30 min no RT.
NOTA: A partir deste passo em diante, realize todas as ações nesta seção dentro de um capô de fumaça, pois o paraformaldeído é tóxico. - Aspire cuidadosamente o fixador dos compartimentos apical das pastilhas de membrana, e descarte-o como resíduos líquidos halógenos.
NOTA: A partir deste passo em diante, descarte todos os resíduos líquidos como resíduos líquidos halógenos. - Lave as monocamadas adicionando 200 μL de DPBS (sem Ca2+ e Mg2+) a cada compartimento apical, e aspire cuidadosamente o DPBS novamente. Repita este passo mais uma vez.
- Adicione 200 μL de 25% de álcool etílico (EtOH) a cada compartimento apical e incubar por 15 min na RT. Após 15 min, aspire cuidadosamente o EtOH de 25% dos compartimentos apical das pastilhas de membrana. Repita com 50% de solução EtOH e, posteriormente, com solução EtOH de 70%.
- Adicione 200 μL de 70% DeSE a cada compartimento apical e enrole a placa com parafilm. Armazene-o a 4 °C até que use mais.
- Aspire cuidadosamente o EtOH de 70%, e use um bisturi para cortar cuidadosamente as membranas da monocamadas das pastilhas. Corte do lado basolateral, ao redor da borda da pastilha.
- Prepare blocos de parafina seguindo o procedimento padrão.
- Quando a parafina ainda estiver quente, pegue a monocamada da parafina com pinças, e coloque-a em uma superfície pré-moldada.
- Tenha cuidado para não danificar a monocamheira. Corte a monocamada ao meio usando uma única lâmina de borda.
- Quando a parafina na parte inferior do começar a se solidificar, use pinças aquecidas para colocar as duas partes monocamadas na parafina, uma ao lado da outra com o lado reto para baixo e em uma direção vertical para garantir que a monocamada será vertical no cupê.
- Quando os blocos de parafina estiverem prontos, corte os blocos usando um microtome e faça slides de seções de 4 μm de espessura após o procedimento padrão. Certifique-se de que as monocamadas acabem na vertical no cupê.
- Realizar manchas histológicas como descrito anteriormente 7,9. Use hematoxilina e eosina (H&E), Ki67, mucin-2 (MUC2) e Azul Alciano para mostrar morfologia geral, células proliferativas, produção de muco e células de cálice, respectivamente (Figura 6E).
NOTA: Também podem ser utilizados marcadores adicionais de diferenciação, como a lysozyme para células Paneth. Este marcador não é apresentado na Figura 6E , pois as células paneth estão presentes em pequeno epitélio intestinal em vez de epitélio de cólon.
- Medição de proteína secreta em supernascido médio
- Meça os níveis de liseozímica no supernatante apical de monocamadas ileais (ver Figura 6D) usando o kit listado na Tabela de Materiais. Se desejar, meça níveis de diferentes citocinas e outras proteínas de interesse.
- Análise de expressão genética
- Quantifique os efeitos da mídia de diferenciação na expressão de genes marcadores de células epiteliais usando reação quantitativa de cadeia de transcrição reversa-polimerase (qRT-PCR).
- Lyse as monocamadas em 350 μL de tampão de rna lysis seguido de isolamento de RNA de acordo com as instruções do fabricante. Realize a síntese de CDNA e qPCRs, conforme descrito anteriormente 7,9, utilizando os kits de síntese de cDNA, mix mestre e oligonucleotídeos listados na Tabela de Materiais.
- Quantifique os efeitos da mídia de diferenciação na expressão de genes marcadores de células epiteliais usando reação quantitativa de cadeia de transcrição reversa-polimerase (qRT-PCR).
5. Upscaling para placas de 96 poços contendo pastilhas de membrana
NOTA: Prepare monócamas epiteliais para triagens de medicamentos de maior rendimento ou múltiplas condições médias usando placas de HTS 96-well contendo pastilhas de membrana.
- Adaptações ao preparar monocamadas em formato 96-well
- Siga todas as etapas descritas neste protocolo para placas de 24 poços contendo inserções de membrana, volumes alterados e números de células aos descritos na Tabela 1. Para a preparação de monocamadas em placas de 96 poços com pastilhas de membrana, proceda conforme descrito na seção 3 com as seguintes diferenças.
- Aproximadamente 9 poços de uma placa de cultura de 6 poços com densidade organoide representada na Figura 3A são necessários para semear uma placa completa de 96 poços com inserções de membrana. Na etapa 3.2.1, precoat as membranas com 67 μL de ECM diluído de 40x em DPBS (com Ca2+ e Mg2+).
- Na seção 3.5, primeiro transfira a placa integral de pastilhas de membrana para outra placa de 96 poços para permitir o refresco médio de compartimentos apical e basolateral.
- Siga todas as etapas descritas neste protocolo para placas de 24 poços contendo inserções de membrana, volumes alterados e números de células aos descritos na Tabela 1. Para a preparação de monocamadas em placas de 96 poços com pastilhas de membrana, proceda conforme descrito na seção 3 com as seguintes diferenças.
Resultados
A Figura 1A mostra uma imagem representativa de organoides intestinais depois de descongelá-los de um criovial. É importante descongelar organoides em alta densidade para garantir uma recuperação ideal. Organoides são banhados em placas de 24 ou 6 poços em cúpulas ECM de aproximadamente 10 μL (Figura 1B). A maioria dos organoides intestinais normais tem uma morfologia cística. Após a recuperação do processo de descongelamento, os organoides crescem a...
Discussão
Este protocolo descreve a manipulação geral e manutenção de organoides intestinais, bem como a preparação e possíveis aplicações de monocamadas epiteliais derivadas desses organoides. Até o momento, as monocamadas foram preparadas com sucesso a partir do duodeno, íleo e diferentes regiões de organoides de cólon derivados do tecido intestinal normal, bem como anteriormente e ativamente inflamado (dados inéditos). A aplicação de monocamadas organoides derivadas do paciente facilita o estudo da função de b...
Divulgações
Os autores não declaram conflito de interesses.
Agradecimentos
Este trabalho é apoiado pelo Topsector Life Sciences & Health - Topconsortium voor Kennis en Innovatie Health~Holland (LSH-TKI) subsídio de parcerias público-privadas (PPP) do setor holandês LSH com o número do Projeto LSHM16021 Organoids como nova ferramenta para modelagem toxicológica para a Tecnologia Organoide Hubrecht (HUB) e financiamento interno hub para modelagem de doenças e departamento de toxicologia. Agradecemos aos laboratórios da Sabine Middendorp (Divisão de Gastroenterologia Pediátrica, Hospital Infantil Wilhelmina, UMC, Utrecht) e Hugo R. de Jonge e Marcel J.C. Bijvelds (Departamento de Gastroenterologia e Hepatologia, Erasmus MC, Roterdã) por fornecerem suporte técnico inicial para a configuração de monocamadas em pastilhas de membrana.
Materiais
| Name | Company | Catalog Number | Comments |
| 100% ethanol | Fisher Emergo | 10644795 | |
| 1250, 300, and 20 µL low-retention filter-tips | Greiner bio-one | 732-1432 / 732-1434 / 732-2383 | |
| 15 mL conical tubes | Greiner bio-one | 188271 | |
| 24-well cell culture plates | Greiner bio-one | 662160 | |
| 24-well HTS Fluoroblok Transwell plate (light-tight) | Corning | 351156 | |
| 24-well HTS Transwell plates (Table 1) | Corning | 3378 | |
| 24-well plate with Transwell inserts | Corning | 3470 | |
| 40 µm cell strainer | PluriSelect | 43-50040-01 | |
| 50 mL conical tubes | Greiner bio-one | 227261 | |
| 6-well cell culture plates | Greiner bio-one | 657160 | |
| 96-well black plate transparent bottom | Greiner bio-one | 655090 | |
| 96-well fast thermal cycling plates | Life Technologies Europe BV | 4346907 | |
| 96-well HTS Fluoroblok Transwell plate | Corning | 351162 | |
| 96-well HTS Transwell plates (Table 1) | Corning | 7369 | |
| 96-well transparent culture plate | Greiner bio-one | 655180 | |
| A83-01 | Bio-Techne Ltd | 2939 | |
| Accutase Cell Dissociation Reagent | Life Technologies Europe BV | A11105-01 | Cell dissociation reagent 2 |
| Advanced DMEM/F-12 | Life Technologies Europe BV | 12634028 | |
| B27 supplement | Life Technologies Europe BV | 17504001 | |
| Cell culture microscope (light / optical microscope) | Leica | ||
| CellTiter-Glo | Promega | G9683 | |
| Centrifuge | Eppendorf | ||
| CO2 incubator | PHCBI | ||
| DAPT | Sigma-Aldrich | D5942 | |
| DEPC treated H2O | Life Technologies Europe BV | 750024 | |
| Dulbecco's phosphate-buffered saline (DPBS) with Ca2+ and Mg2+ | Life Technologies Europe BV | 14040091 | |
| DPBS, powder, no calcium, no magnesium | Life Technologies Europe BV | 21600069 | |
| EnzChek Lysozyme Assay Kit | Life Technologies Europe BV | E22013 | |
| EVOM2 meter with STX electrode | WTI | ||
| Gastrin | Bio-Techne Ltd | 3006 | |
| Glass pipettes | Volac | ||
| GlutaMAX | Life Technologies Europe BV | 35050038 | |
| hEGF | Peprotech | AF-100-15 | |
| HEPES | Life Technologies Europe BV | 15630056 | |
| Human Noggin | Peprotech | 120-10C | |
| Human Rspo3 | Bio-Techne Ltd | 3500-RS/CF | |
| IWP-2 | Miltenyi Biotec | 130-105-335 | |
| Ki67 primary antibody | Sanbio | BSH-7302-100 | |
| Ki67 secondary antibody | Agilent | K400111-2 | |
| Kova International Glasstic Slide with Counting grids | Fisher Emergo | 10298483 | |
| Laminar flow hood | Thermo scientific | ||
| Lucifer Yellow CH dilithium salt | Sigma-Aldrich | L0259 | |
| Matrigel, Growth Factor Reduced (GFR) | Corning | 356231 | extracellular matrix (ECM) |
| MicroAmp Fast 8-Tube Strip, 0.1 mL | Life Technologies Europe BV | 4358293 | |
| MicroAmp Optical 8-Cap Strips | Life Technologies Europe BV | 4323032 | |
| Microcentrifuge tubes | Eppendorf | 0030 120 086 | |
| Micropipettes (1000, 200, and 20 µL) | Gilson | ||
| Microtome | Leica | ||
| MUC2 primary antibody | Santa Cruz Biotechnology | sc-15334 | |
| MUC2 secondary antibody | VWR | VWRKS/DPVR-HRP | |
| Multichannel pipette (200 µL) | Gilson | ||
| N-acetylcysteine | Sigma-Aldrich | A9165 | |
| NGS Wnt | U-Protein Express | N001-0.5mg | |
| Nicotinamide | Sigma-Aldrich | N0636 | |
| Oligonucleotide ALPI1/Forward | Custom-made | GGAGTTATCCTGCTCCCCAC | |
| Oligonucleotide ALPI1/Reverse | Custom-made | CTAGGAGGTGAAGGTCCAACG | |
| Oligonucleotide LGR5/Forward | Custom-made | ACACGTACCCACAGAAGCTC | |
| Oligonucleotide LGR5/Reverse | Custom-made | GGAATGCAGGCCACTGAAAC | |
| Oligonucleotide MUC2/Forward | Custom-made | AGGATCTGAAGAAGTGTGTCACTG | |
| Oligonucleotide MUC2/Reverse | Custom-made | TAATGGAACAGATGTTGAAGTGCT | |
| Oligonucleotide TBP/Forward | Custom-made | ACGCCGAATATAATCCCAAGCG | |
| Oligonucleotide TBP/Reverse | Custom-made | AAATCAGTGCCGTGGTTCGTG | |
| Optical adhesive covers | Life Technologies Europe BV | 4311971 | |
| PD0325901 | Stemcell Technologies | 72184 | |
| Penicillin/streptomycin | Life Technologies Europe BV | 15140122 | |
| Plate shaker | Panasonic | ||
| PowerUp SYBR Green Master Mix | Fisher Emergo | A25776 | |
| Primocin | InvivoGen | ANT-PM-2 | antimicrobial formulation for primary cells |
| Qubit RNA HS Assay Kit | Life Technologies Europe BV | Q32852 | |
| Reagent reservoir for multichannel pipet | Sigma-Aldrich | CLS4870 | |
| REMS AutoSampler with 24-probe or 96C-probe | WTI | ||
| Richard-Allan Scientific Alcian Blue/PAS Special Stain Kit | Thermo scientific | 87023 | |
| RNase-Free DNase Set | Qiagen | 79254 | |
| RNeasy Mini Kit | Qiagen | 74106 | |
| SB202190 | Sigma-Aldrich | S7076 | |
| Serological pipettes | Greiner bio-one | 606180 / 607180 / 760180 | |
| Serological pipettor (Pipet-Aid) | Drummond | ||
| Single edge razor blade | GEM Scientific | ||
| Superscript 1st strand system for RT-PCR | Life Technologies Europe BV | 11904018 | |
| Tecan Spark 10M plate reader | Tecan | ||
| Trypan Blue Solution, 0.4% | Life Technologies Europe BV | 15250-061 | |
| TrypLE Express Enzyme (1x) | Life Technologies Europe BV | 12605-010 | Cell dissociation reagent 1 |
| Water bath | Grant | ||
| Y27632 (ROCK inhibitor) | AbMole | M1817 |
Referências
- Haegebarth, A., Clevers, H. Wnt signaling, lgr5, and stem cells in the intestine and skin. The American Journal of Pathology. 174 (3), 715-721 (2009).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. V. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9 (8), 1909 (2020).
- Martínez-Maqueda, D., Miralles, B., Recio, I., Verhoeckx, K. HT29 Cell Line. The Impact of Food Bio-Actives on Gut Health: In Vitro and Ex Vivo Models. , 113-124 (2015).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Huch, M., et al. In vitro expansion of single Lgr5(+) liver stem cells induced by Wnt-driven regeneration. Nature. 11 (2), 179-194 (2013).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 1-20 (2019).
- Karthaus, W. R., et al. Identification of multipotent luminal progenitor cells in human prostate organoid cultures. Cell. 159 (1), 163-175 (2014).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Van De Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Driehuis, E., et al. Pancreatic cancer organoids recapitulate disease and allow personalized drug screening. Proceedings of the National Academy of Sciences of the United States of America. 116 (52), 26580-26590 (2019).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- d'Aldebert, E., et al. Characterization of human colon organoids from inflammatory bowel disease patients. Frontiers in Cell and Developmental Biology. 8, 363 (2020).
- Dotti, I., et al. Alterations in the epithelial stem cell compartment could contribute to permanent changes in the mucosa of patients with ulcerative colitis. Gut. 66 (12), 2069-2079 (2017).
- VanDussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. 64 (6), 911-920 (2015).
- Noel, G., et al. A primary human macrophage-enteroid co-culture model to investigate mucosal gut physiology and host-pathogen interactions. Scientific Reports. 7, 45270 (2017).
- Bartfeld, S., et al. In vitro expansion of human gastric epithelial stem cells and their responses to bacterial infection. Gastroenterology. 148 (1), 126-136 (2015).
- van Es, J. H., et al. Wnt signalling induces maturation of Paneth cells in intestinal crypts. Nature Cell Biology. 7 (4), 381-386 (2005).
- van Es, J. H., et al. Dll1 marks early secretory progenitors in gut crypts that can revert to stem cells upon tissue damage. Nature Cell Biology. 14 (10), 1099-1104 (2012).
- de Lau, W. B. M., Snel, B., Clevers, H. C. The R-spondin protein family. Genome Biology. 13 (3), 1-10 (2012).
- Basak, O., Beumer, J., Wiebrands, K., Seno, H., van Oudenaarden, A., Clevers, H. Induced quiescence of Lgr5+ stem cells in intestinal organoids enables differentiation of hormone-producing enteroendocrine cells. Cell Stem Cell. 20 (2), 177-190 (2017).
- Beumer, J., et al. Enteroendocrine cells switch hormone expression along the crypt-to-villus BMP signalling gradient. Nature Cell Biology. 20 (8), 909-916 (2018).
- Yin, X., Farin, H. F., van Es, J. H., Clevers, H., Langer, R., Karp, J. M. Niche-independent high-purity cultures of Lgr5+ intestinal stem cells and their progeny. Nature Methods. 11 (1), 106-112 (2014).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: An in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments. (120), (2017).
- Miao, Y., et al. Next-generation surrogate Wnts support organoid growth and deconvolute Frizzled pleiotropy in vivo. Cell Stem Cell. 27 (5), 840-851 (2020).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- Blume, L. -. F., Denker, M., Gieseler, F., Kunze, T. Temperature corrected transepithelial electrical resistance (TEER) measurement to quantify rapid changes in paracellular permeability. Die Pharmazie. 65 (1), 19-24 (2010).
- Lea, T., Verhoeckx, K., et al. Caco-2 cell line. The Impact of Food Bio-Actives on Gut Health: In Vitro and Ex Vivo Models. , 103-111 (2015).
- Heo, I., et al. Modelling Cryptosporidium infection in human small intestinal and lung organoids. Nature Microbiology. 3 (7), 814-823 (2018).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados