需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
类器官来源的上皮单层:临床相关的肠道屏障功能体外模型
摘要
在这里,我们描述了用于研究肠屏障功能,通透性和运输的人类器官衍生的肠上皮单层的制备。由于类器官代表原始的上皮组织对外部刺激的反应,这些模型结合了细胞系可扩增性的优势以及原代组织的相关性和复杂性。
摘要
过去,肠道上皮模型系统仅限于转化的细胞系和原代组织。这些模型系统具有固有的局限性,因为前者不能忠实地代表原始组织生理学,并且后者的可用性有限。因此,它们的应用阻碍了基础和药物开发研究。基于成体干细胞的类器官(以下简称类器官)是正常或患病上皮组织的缩影,它们来自这些组织。它们可以从不同的胃肠道(GI)区域非常有效地建立,具有长期可扩展性,并模拟组织和患者对体外治疗的特定反应。在这里,已经证明了肠类器官来源的上皮单层的建立以及测量上皮屏障完整性,通透性和运输,抗菌蛋白分泌以及组织学的方法。此外,肠道类器官来源的单层可以富含增殖的干细胞和运输扩增细胞以及关键的分化上皮细胞。因此,它们代表了一个模型系统,可以定制以研究化合物对靶细胞的影响及其作用方式。虽然类器官培养在技术上比细胞系要求更高,但一旦建立,它们可以减少药物开发后期阶段的失败,因为它们真正代表了体内上皮的复杂性和患者间异质性。
引言
肠上皮充当肠腔含量与下层组织之间的物理屏障。该屏障包括主要由吸收性肠细胞组成的单个上皮层,这些肠细胞通过紧密的连接连接,在相邻细胞之间建立强大的细胞间连接。这些细胞形成极化上皮衬里,分离肠的顶端(腔)和基底外侧,同时调节消化的营养物质和代谢物的副细胞运输。除肠细胞外,其他重要的上皮细胞(如高脚杯、Paneth和肠内分泌细胞)也分别通过产生粘液、抗菌肽和激素来促进肠道稳态。通过在肠隐窝底部分裂富含亮氨酸的含有G蛋白偶联受体5阳性(LGR5 +)干细胞来不断补充肠上皮,产生向上迁移并分化成其他细胞类型的1的富含亮氨酸的重复物。遗传和环境因素(例如暴露于食物过敏原、药物化合物和微生物病原体)破坏肠道上皮稳态,导致肠道屏障功能破坏。这些疾病可引起多种肠道疾病,包括炎症性肠病 (IBD)、乳糜泻和药物诱发的胃肠道毒性2。
使用几种体外平台系统(例如膜插入物,芯片上器官系统,Ussing室和肠环)对肠上皮进行研究。这些平台适用于建立极化上皮单层,具有进入膜的顶端和基外侧,使用转化的细胞系或原代组织作为模型。虽然转化的细胞系,如结直肠(腺)癌细胞系Caco-2,T84和HT-29,能够在一定程度上分化成极化肠肠细胞或产生粘液的细胞,但它们并不代表体内上皮细胞,因为缺少几种细胞类型,并且各种受体和转运蛋白异常表达3.此外,由于细胞系来源于单个供体,因此它们不代表患者间异质性,并且复杂性和生理相关性降低。虽然用于Ussing室和作为肠环的原代组织更能代表体内情况,但它们的可用性有限,短期生存能力和缺乏可膨胀性使它们不适合作为高通量(HT)研究的介质。
类器官是从不同器官(如肠、肾、肝、胰腺和肺)建立的体外上皮培养物。它们被证明具有长期,稳定的可扩展性以及遗传和表型稳定性,因此是原始器官上皮的代表性生物学微缩模型,对外部刺激具有忠实的反应4,5,6,7,8,9。从切除或活检的正常、患病、发炎或癌组织中有效地建立类器官,代表异质性患者特异性反应10,11,12,13,14,15,16。本文展示了如何建立来自类器官培养物的肠上皮单层。单层已经成功地从小肠以及结肠和直肠类器官培养物中建立。该模型为研究上皮细胞对药物的运输和通透性及其对上皮的毒理学影响创造了机会。此外,该模型允许与免疫细胞和细菌共培养以研究它们与肠上皮的相互作用17,18,19。此外,该模型可用于以患者特异性方式研究对治疗的反应,并开始筛查工作以寻找下一波上皮屏障聚焦的治疗方法。这种方法可以扩展到诊所,并为个性化治疗铺平道路。
尽管该方案中的上皮单层是由人类正常肠道类器官制备的,但该方案可以应用于其他类器官模型并进行优化。上皮类器官单层在含有Wnt的肠道类器官扩张培养基中培养,以支持干细胞增殖并代表肠隐窝细胞组成。通过调节 Wnt、Notch 和表皮生长因子 (EGF) 途径,可以富集肠道类器官以具有不同的肠上皮命运,例如肠细胞、Paneth、高脚杯和肠内分泌细胞。在这里,在扩增培养基中建立单层后,它们被驱动向更分化的肠上皮细胞,如前面描述的20,21,22,23,24,25。出于筛选目的,根据目标化合物的作用模式,其靶细胞和实验条件,单层可以被驱动到所选的细胞组成,以测量具有相关功能读数的化合物的效果。
研究方案
1. 制备培养试剂
注意:在生物安全柜内执行所有步骤,并遵循使用细胞培养物的标准指南。在启动生物安全柜之前使用紫外线10分钟。使用前后,用浸有70%乙醇的薄纸清洁生物安全柜的表面。为了促进细胞外基质(ECM)的三维液滴的形成,请在37°C的培养箱中保持96孔,24孔和6孔板的预热储备。
- 基础培养基制备
- 通过添加5 mL 200 mM谷氨酰胺,5 mL 1 M4-(2-羟基乙硫基)-1哌嗪烷磺酸(HEPES)和5 mL青霉素/链霉素(笔/链球菌)溶液(10,000 U / mL或10,000μg/ mL),在500 mL高级Dulbecco的改良鹰培养基中制备基础培养基(BM)与火腿的营养混合物F-12(Ad-DF)培养基。这可以储存在4°C的冰箱中至少4周。
- 来源
- 根据前面描述的方法26制备Wnt3a条件培养基(Wnt3aCM)。
注意:最近,已经产生了下一代代替代物Wnt(NGS-Wnt),它也支持人类肠道类器官的扩张,已经产生了27。
- 根据前面描述的方法26制备Wnt3a条件培养基(Wnt3aCM)。
- 肠道类器官基质培养基制备
注意:根据制造商的建议使用所有生长因子和试剂。使用小等分试样,避免冻融循环;功能性生长因子对于成功的类器官培养至关重要。- 通过用1μM A83-01,2.5mM N-乙酰半胱氨酸,2x B27补充剂,100ng / mL人表皮生长因子(hEGF),10 nM胃泌素,200ng / mL hNoggin和100μg / mL原代细胞抗菌制剂补充BM来制备浓缩的2x肠道类器官碱基培养基(2x IBM)(参见 材料表)。
- 等分2x IBM并在-20°C下冷冻长达4个月。需要时,将等分试样在4°C下解冻过夜或在室温(RT)下解冻数小时。
- 为了制备肠道类器官扩张培养基(IEM),用50%Wnt3aCM或50%BM和0.5 nM NGS-Wnt,250 ng / mL人Rspondin-3(hRspo3),10 mM烟酰胺和10μM SB202190补充2x IBM。
- 肠道类器官分化培养基制备
- 通过用50%BM,250ng / mL hRspo3和1.5μM Wnt途径抑制剂(IWP-2)补充2x IBM来制备肠细胞分化培养基(eDM)。将eDM在4°C下储存长达10天。
- 通过用40%BM和10%Wnt3aCM或50%BM和0.1 nM NGS-Wnt,250 ng / mL hRspo3,10μM DAPT和100 nM PD0325901补充2x IBM来制备组合鉴别培养基(cDM)。将cDM储存在4°C下长达10天。
- 细胞外基质的操作 (ECM)
注意:根据制造商的建议准备细胞外基质(ECM)(参见 材料表)。- 在冰上解冻ECM过夜;使用5 mL移液器将ECM从瓶子转移到15 mL锥形管中,两者都在-20°C下预冷。 在-20°C下仅重新冷冻等分试样一次。 解冻后,将ECM储存在4°C的冰箱中长达7天。使用前在冰上孵育至少30分钟。
注意:在嵌入隐窝或类器官之前,正确混合 ECM 并确保它是冷的。
- 在冰上解冻ECM过夜;使用5 mL移液器将ECM从瓶子转移到15 mL锥形管中,两者都在-20°C下预冷。 在-20°C下仅重新冷冻等分试样一次。 解冻后,将ECM储存在4°C的冰箱中长达7天。使用前在冰上孵育至少30分钟。
2. 类器官培养
- 从冷冻类器官建立培养物
注意:让BM达到室温,并保持12mL等分试样,加热至37°C,在开始解冻含有冷冻类器官的冷冻管程序之前准备好。- 通过在37°C水浴中搅拌快速解冻类器官冷冻管,直到只剩下一小块冰。立即向冷冻管中滴加500μL温热BM,并上下移液几次以稀释冷冻培养基并仔细混合内容物。
- 使用P1000移液器,将类器官转移到15 mL锥形管中,然后滴加另1 mL温热BM,同时轻轻混合管的底部。上下移液几次以稀释冷冻培养基并仔细混合内容物。
- 将多达 12 mL 温热的 BM 滴加到装有类器官的 15 mL 锥形管中,然后用 10 mL 无菌移液管上下移液,以轻轻地重悬类器官。
- 在85× g 和8°C下离心类器官悬浮液5分钟。 在不干扰沉淀的情况下小心地丢弃上清液,并将类器官重悬于30%v / v的IEM中,补充有10μM Y27632或其他rho相关的卷曲形成蛋白丝氨酸/苏氨酸激酶抑制剂(ROCK抑制剂)。将管子放在冰上。
- 在含有类器官的15 mL锥形管中加入70%v / v的ECM。混合类器官悬浮液,将15mL锥形管保持在冰上,并播种5μL悬浮液以检查密度(图1A)。如果密度合适,继续电镀;如果密度太高,请分别以30-70% v / v的相同比例添加更多IEM / ECM溶液。
- 在预热的24孔板的每个孔中,通过移液5个单独的10μL滴剂来培养50μL类器官悬浮液(图1B)。将板倒置,并将其放在生物安全柜中5分钟。将仍然倒置的板转移到37°C培养箱中,并再放置30分钟。
- 向每个孔中加入500μL具有10μM ROCK抑制剂的IEM,并将板转移到培养箱中。定期成像一滴以监测生长,并通过吸出旧培养基并添加500μL新鲜IEM每2-3天刷新一次IEM。
- 一旦类器官从解冻中正确恢复并达到要处理的正确尺寸(图1C),如2.2节所述,通过类器官。
- 肠道类器官的传代
注意:将 ECM 在冰上冷却至少 30 分钟,并在使用前将 IEM 保持在室温下至少 1 小时。- 使用来自一个培养孔的培养基,使用1250μL低保留率过滤器尖端破碎类器官圆顶,并将孔内容物转移到标记的15mL锥形管中。用1 mL BM洗涤孔,并将其转移到相同的15 mL锥形管中。
- 用所有其他孔重复步骤2.2.1和2.2.2(最多可以洗涤半个板或600μLECM滴并添加到一个15mL锥形管中)。
- 加入BM以填充高达12 mL的试管,并使用10 mL移液器上下移液10倍。在8°C下以85× g 离心5分钟。
- 在取出BM之前,在显微镜下检查是否所有类器官都在15 mL锥形管的底部沉淀(图1D)。如果没有ECM覆盖类器官沉淀或ECM层是干净的或仅包含碎片,单细胞或与颗粒类器官相比非常少的类器官,则吸出上清液并使用P200移液管非常小心地将ECM移出覆盖类器官沉淀物。
注意:类器官可以被困在ECM中,并且由于离心力低,不会作为紧凑的颗粒沉淀。如果ECM含有类器官,则在8°C下以450× g 再次离心管5分钟,并按照2.2.4中所述小心地除去上清液。如果有多个15 mL锥形管,则可以在步骤2.2.4之后将它们合并。 - 向每个沉淀(体积为50-200μL,取决于类器官培养物和密度)中加入1mL BM,并小心地重悬。将类器官上下移液至少5倍以剪切它们,避免形成泡沫。在显微镜下检查类器官是否被破坏(图2A)。如果类器官被破坏,请继续执行步骤2.2.7;如果类器官没有被破坏,请再移液5倍。这一次,用移液器尖端触摸塑料管的壁,以施加更大的机械力来破坏类器官。
注意:将200 μL或10 μL塑料移液器吸头安装在低保留率1250 μL滤嘴(图1F)上,可以机械剪切囊性(图1C)和出芽(图1E)类器官,具体取决于破坏类器官所需的体积。当处理超过200μL含有类器官的ECM(6孔板的一孔或24孔板的4孔)时,建议使用窄玻璃移液器(图1F)。 - 再次在显微镜下检查,看看类器官是否被破坏。如果中断,请继续执行下一步;如果没有,将类器官移液至20倍,定期在显微镜下检查类器官。如果类器官仍未被破坏,则向悬浮液中加入25%v / v细胞解离试剂1(参见 材料表),在37°C的水浴中孵育2分钟,并将类器官移液至20倍,定期在显微镜下检查类器官以确保它们不会被消化到单个细胞中。
- 向15 mL锥形管中加入多达12 mL BM,并通过上下移液来洗涤类器官沉淀。在8°C下以85× g 离心5分钟。 弃去上清液,并通过向类器官沉淀中加入IEM和ECM将最终浓度调节至70%v / v ECM。
- 开始重悬类器官沉淀,其体积是收集用于传代的IEM / ECM的两倍,并接种5μL悬浮液以检查密度。如果密度合适,继续电镀(图2B);如果密度太高,请添加更多 IEM/ECM 解决方案。将200μL悬浮液加入预热6孔板的每个孔中,单独滴出10μL体积。
- 将板倒置,并将其放在生物安全柜中5分钟。将仍然倒置的板转移到37°C培养箱中,再放置30分钟。向每个孔中加入2mL IEM和10μM ROCK抑制剂,并将板转移到培养箱中。
- 定期对一滴进行图像以监测生长,并通过吸出旧培养基并添加2 mL新鲜IEM每2-3天刷新一次IEM。
- 用于上皮单层制备的肠道类器官传代
- 在收获前3天通过单层制备通过传递类器官,遵循第2.2节中描述的相同传代方案,但有一个例外。在步骤2.2.7中,将类器官重悬于IEM / ECM起始体积的1-1.5倍中,以便在收获用于单层制备时具有更高的密度和膨胀潜力(图3A)。
3. 上皮单层制剂
- 在具有各种可用板类型的24孔和96孔膜插入物上培养上皮单层(表1)。两种尺寸均使用高通量系统 (HTS) 膜插件,因为这些插件包含一个带有膜插件和接收板的集成托盘。对于 24 孔格式,也可以使用带有单独可拆卸膜插入物的板。
注意:提供不同的膜类型(聚对苯二甲酸乙二醇酯(PET)或聚碳酸酯)和孔径(0.4-8.0μm),可根据实验需要使用。当使用带有PET膜的插入物时,单层只能通过明场成像。光密膜可阻挡从顶端到基底外侧隔室的荧光光泄漏,在研究荧光标记底物的动态传输或渗透性时可以考虑。目前的方案使用24孔膜插入物;96 孔膜插入物的适应性在第 5 节中描述。根据类器官的密度,形态和大小(图3A),6孔板的6孔(如第2.3节所述)足以接种完整的24孔板膜插入物。 - 使用 ECM 涂覆膜插件
注意:如果对是否有足够的细胞有疑问,请在计数细胞后涂覆插入物。这是为了防止不必要的涂层和昂贵的膜插入件的损失。- 将膜插入物放入生物安全柜的支撑板中。用Ca 2 +和Mg2 + 在冰冷的Dulbecco磷酸盐缓冲盐水(DPBS)中稀释ECM 40x,并将150μL稀释的ECM移液到每个插入物的顶端室中。将板在37°C下孵育至少1小时。
- 用于接种的细胞制备
- 将细胞解离试剂2的预等分试样置于水浴(37°C)中。为6孔板的每个孔制备2mL试剂。
- 将含有类器官(在第2.3节中制备)的培养板从培养箱转移到生物安全柜中。处理类器官,如步骤2.2.1.-2.2.4中所述。不要将多个管子池化为一个管子。
- 填充管子,含有来自6孔板中最多3个孔的类器官,使用DPBS(不含Ca 2 +和Mg2 + )最多12 mL,并使用10 mL移液器上下移液10倍。在8°C下以85× g 离心5分钟,并在不干扰类器官沉淀的情况下吸出上清液。
- 每孔加入2mL预热细胞解离试剂2的6孔板用作起始材料并重悬。将管在37°C的水浴中对角线或水平孵育5分钟,以防止类器官沉入管的底部。
- 使用5 mL无菌塑料移液器或P1000移液器上下移液10倍,具体取决于细胞解离试剂的总体积。在显微镜下检查类器官悬浮液,以查看是否已经形成单细胞和由2-4个细胞组成的一些细胞团块的混合物(图3B)。如果需要,通过重复步骤3.3.4-3.3.5(不要增加细胞解离试剂的体积)继续消化,直到混合物看起来类似于 图3B。
注意:避免将类器官完全消化到单个细胞。有必要有一些小的细胞组(即2-4个细胞的组)。 - 通过向细胞悬浮液中添加多达12 mL 的BM(包括10μM ROCK抑制剂 )来阻止细胞解离。在8°C下以450× g 离心5分钟,并在不干扰细胞沉淀的情况下吸出上清液。当在几个15 mL锥形管中处理相同的类器官培养物时,将细胞沉淀池并将它们重悬于12 mL BM中。
- 通过预先掺杂了BM的40μm过滤器过滤细胞悬浮液,并将流通液收集到50mL锥形管中。用10 mL BM清洗过滤器,并将流通量收集到相同的50 mL锥形管中。
- 将应变细胞悬浮液转移到两个新的15 mL锥形管中。在8°C下以450× g 离心5分钟,并在不干扰细胞沉淀的情况下吸出上清液。将细胞重悬于4mL IEM中,每个用作起始原料的全培养板补充10μM ROCK抑制剂。
- 以1:1的比例将少量细胞悬浮液与台盼蓝混合以进行计数。计数活的,而不是蓝色的细胞(图3C),并计算活细胞的总数。在小团块中,计数每个单独的细胞。
- 制备含有3个细胞悬液,每毫升IEM含有3×10个6 活细胞,并补充10μM ROCK抑制剂。
- 在聚酯膜嵌件上接种细胞
- 小心地从 ECM 涂层嵌件中吸出 DPBS(步骤 3.2.1),同时保持板水平放置。将800μL补充有ROCK抑制剂的IEM移液到每个基底外侧隔室中。将步骤3.3.10制备的150μL细胞悬浮液滴送到顶端隔室中的ECM包被膜上。每个板,确保至少有一个"空白"孔,仅与BM。
- 一旦细胞沉降到膜上,如第4.1节所述,测量跨上皮电阻(TEER),并使用显微镜对膜插入物进行成像。将板置于37°C和5%CO2的培养箱中。每天测量TEER,并定期采集图像以监测单层形成(图4A-D)。
- 清爽的单层
注意:每2-3天刷新一次培养基,遵循以下顺序,以保持细胞上方的正静水压力,防止细胞被推离膜。在刷新培养基时,请确保在吸入培养基时可见的单层未被移液器吸头损坏。- 从含有膜嵌件的板的基底外侧隔室中取出培养基。然后,小心地从膜嵌件的顶端隔室中吸取培养基。
- 向每个顶端隔室滴加150μL新鲜IEM,然后向每个基底外侧隔室加入800μL新鲜IEM。
- 富集所需肠上皮细胞类型的单层
- 让单层在IEM中融合,对应于约100 Ω·cm²的TEER值(如步骤4.1.1.4中计算)。在显微镜下检查以确定单层是否完全形成(图4D)和没有孔(如图 4B,C所示)。
- 小心地从膜嵌件的基底外侧和顶端隔室中取出IEM,并用第1.4节中准备的eDM或cDM替换。在特定的分化培养基中再培养单层3-4天,以使类器官细胞富含所需的特定细胞类型。每 2-3 天刷新一次培养基,如第 3.4 节中所述。
- 每天测量TEER,并根据需要定期采集图像(图5A-C)。
注意:表示完全组织富集的单层的TEER值因类器官培养物而异;通常TEER值在分化培养基中3天后增加到600,并且可以增加至1000 Ω·cm2 (如步骤4.1.1.4中计算),并且稳定3-5天。
4. 上皮单层测定读数
- 测量跨上皮电阻 (TEER)
注:TEER测量被广泛接受为在生理屏障的生物学模型中分析紧密连接动力学和屏障功能完整性的方法,例如上皮单层28,29。由于紧密连接处的细胞相互作用增加,分化后TEER的增加可以使用手动TEER仪表或自动TEER测量机器人进行测量。- 使用手动 TEER 仪表测量 TEER
- 用70%乙醇清洁电极,并在生物安全柜内风干。将电极放入装有 BM 的管中,将电极连接到手动 TEER 仪表。打开 功能 开关以欧 姆为单位进行测量(Ω)。打开 电源 开关。
- 将短电极放在插入物的顶端室中,而长电极位于基底外侧室中(图6A)。避免触摸单层。
- 测量空白孔中的电阻(R空白),然后以相同的方式测量剩余的样品(R样品)。在具有不同条件的样品之间用BM洗涤电极。首先用半水清洁电极,然后用70%乙醇清洁电极,让它风干。
- 计算TEER(Ω·cm2):[R样品 (Ω)-R空白 (Ω)]×膜面积(cm2)(表1 和 图6B)。
- 使用自动 TEER 测量机器人测量 TEER(物料表)
- 当使用高温超导系统对含有膜嵌件的 96 孔和 24 孔高温超导板进行自动 TEER 测量时。对于两种类型(24 和 96- HTS 膜插入件),使用不同的电极进行 TEER 测量。要使用自动 TEER 测量机器人测量 TEER,请遵循制造商的说明。
- 使用手动 TEER 仪表测量 TEER
- 测量上皮屏障的完整性和通透性
注意:该协议引入了从顶端到基底外侧隔室的路西法黄渗透性,作为单层完整性的指示。本节描述了在1小时孵育步骤后基底外侧隔室中的荧光测量,以评估单层渗透性,从而评估屏障完整性。该测量是一种终点测定,在测试化合物对屏障完整性的影响时特别有用。- 在冰上解冻路西法黄,让BM平衡到RT。对于一块24孔板的膜插入物,在BM中制备5mL 60μM荧光素黄的工作溶液。
注意:路西法黄对光敏感。在深色1.5 mL无菌管中制备稀释液,并在关闭生物安全柜灯的情况下执行所有步骤。 - 小心地从膜插入物的基底外侧和顶端室中取出培养基,如步骤3.5.1所述。如果需要,使用移液器吸头刮擦一个未经处理的单层,作为路西法黄通过受损屏障泄漏的阳性对照。
- 向每个顶端隔室加入150μL带有60μM路西法黄的BM,并向每个基底外侧隔室中加入800μL不含路西法黄的BM。将板置于37°C的振荡器上,50rpm60分钟。
- 同时,从步骤4.2.1中制备的工作溶液开始,在BM中制备路西法黄的标准曲线。在每个步骤中稀释1:3,直到达到3nM的浓度。包括阴性对照(仅限 BM)。
- 将100μL每种标准品一式三份转移到96孔透明板上。孵育60分钟后,取出膜插入物并从每个基底外侧孔(步骤4.2.3)一式三份转移到96孔透明板中。使用板读数器在430nm的激发波长和530nm的发射波长下测量板的荧光。
- 校正阴性对照值(仅BM)后,使用标准曲线值计算基底外侧隔室中的路西法黄浓度(最终接收器浓度(μM))。
- 根据以下公式计算表观渗透系数(Papp)(图6C):

- 对于含有膜插入物的24孔板,请使用以下公式:
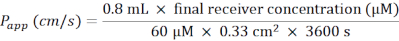
- 在冰上解冻路西法黄,让BM平衡到RT。对于一块24孔板的膜插入物,在BM中制备5mL 60μM荧光素黄的工作溶液。
- 固定单层并制备用于组织学的石蜡块
注意:上皮单层可用于组织学染色,以评估其细胞组成,极性和不同目标蛋白(如连接蛋白,增殖或分化标志物)的表达。本节介绍用于组织学染色的石蜡阻滞制剂。- 小心地从膜嵌件的基底外侧和顶端隔室中取出培养基,如步骤3.5.1中所述。
- 通过向每个顶端隔室添加150μLDPBS(不含Ca2 + 和Mg2 +)和向每个基外侧隔室添加800μL来洗涤单层。再次小心地再次吸出DPBS,首先从基底外侧隔室,然后从顶端隔室吸出。
注意:从这一步开始,基底外侧隔室将保持空。 - 在通风橱中,向每个顶端室加入150μL4%多聚甲醛,并在室温下孵育30分钟。
注意:从此步骤开始,在通风橱内执行本节中的所有操作,因为多聚甲醛是有毒的。 - 小心地从膜嵌件的顶端隔室中吸出固定剂,并将其作为液态卤素废物处理。
注意:从此步骤开始,将所有液体废物作为液体卤素废物处理。 - 通过向每个顶端隔室添加200μLDPBS(不含Ca2 + 和Mg2 +)来洗涤单层,并再次小心地吸出DPBS。再次重复此步骤。
- 向每个顶端隔室中加入200μL25%乙醇(EtOH),并在室温下孵育15分钟。15分钟后,小心地从膜插入物的顶端室中吸取25%的EtOH。用50%EtOH溶液重复,然后用70%EtOH溶液重复。
- 向每个顶端隔室中加入200μL70%EtOH,并用parafilm包裹板。将其储存在4°C直至进一步使用。
- 小心地吸出70%的EtOH,并用手术刀小心地从插入物上切下单层膜。从基底外侧切开,围绕刀片的边缘。
- 按照标准程序制备石蜡块。
- 当石蜡仍然温暖时,用镊子从石蜡中取出单层,并将其放在预冷的表面上。
- 注意不要损坏单层。使用单刃刀片将单层切成两半。
- 当盒底部的石蜡开始凝固时,使用加热的镊子将两个单层部件放在石蜡中,彼此相邻,直面朝下,垂直方向,以确保单层在轿跑车中垂直。
- 当石蜡块准备就绪时,使用切片机切割块,并按照标准程序制作4μm厚切片的载玻片。确保单层最终在轿跑中垂直。
- 进行组织学染色,如前所述7,9。使用苏木精和曙红(H&E),Ki67,粘蛋白-2(MUC2)和Alcian Blue分别显示一般形态,增殖细胞,粘液产生和高脚杯细胞(图6E)。
注意:也可以使用其他分化标志物,例如用于Paneth细胞的溶菌酶。该标志物未在 图6E 中出现,因为Paneth细胞存在于小肠上皮而不是结肠上皮中。
- 培养基上清液中的分泌蛋白测量
- 使用材料表中列出的试剂盒测量回肠单层顶端上清液中的溶菌酶水平(参见图6D)。如果需要,测量不同细胞因子和其他目标蛋白质的水平。
- 基因表达分析
- 使用定量逆转录 - 聚合酶链反应(qRT-PCR)量化分化培养基对上皮细胞标志物基因表达的影响。
- 在350μLRNA裂解缓冲液中裂解单层,然后根据制造商的说明进行RNA分离。如前所述,使用材料表中列出的cDNA合成试剂盒,预混液和寡核苷酸进行cDNA合成和qPCRs。
- 使用定量逆转录 - 聚合酶链反应(qRT-PCR)量化分化培养基对上皮细胞标志物基因表达的影响。
5. 放大至含有膜插入物的 96 孔板
注意:使用含有膜插入物的HTS 96孔板制备上皮单层,用于更高通量的药物筛选或多种培养基条件。
- 制备 96 孔单层时的适应性
- 对于含有膜插入物的24孔板,请遵循该协议中描述的所有步骤,将体积和细胞号更改为 表1中描述的体积和细胞号。为了在带有膜插入物的96孔板上制备单层,请按照第3节所述进行,并具有以下差异。
- 需要大约9个具有 图3A 所示类器官密度的6孔培养板来接种具有膜插入物的完整96孔板。在步骤3.2.1中,用67μL在DPBS中稀释的40倍稀释的ECM(用Ca2 + 和Mg2 +)预涂覆膜。
- 在第3.5节中,首先将膜插入物的整体板转移到另一个96孔板上,以允许顶端和基底外侧室的介质刷新。
- 对于含有膜插入物的24孔板,请遵循该协议中描述的所有步骤,将体积和细胞号更改为 表1中描述的体积和细胞号。为了在带有膜插入物的96孔板上制备单层,请按照第3节所述进行,并具有以下差异。
结果
图1A 显示了从冷冻管中解冻后肠道类器官的代表性明场图像。重要的是要以高密度解冻类器官,以确保最佳恢复。将类器官电镀在约10μL的ECM圆顶中的24孔或6孔板中(图1B)。大多数正常肠道类器官具有囊性形态。从解冻过程中恢复后,类器官生长到更大的尺寸,并准备在3-7天后传代,具体取决于类器官培养物(图1C)。在收获类?...
讨论
该协议描述了肠道类器官的一般操作和维持,以及来自这些类器官的上皮单层的制备和可能的应用。迄今为止,已经成功地从十二指肠,回肠和结肠类器官的不同区域制备了单层,这些区域来自正常以及先前和主动发炎的肠组织(未发表的数据)。患者衍生的类器官单层的应用有助于以疾病和患者特异性方式研究屏障功能,以及研究患者对各种药物治疗的特异性反应。虽然细胞系可以形成含有肠?...
披露声明
作者声明没有利益冲突。
致谢
这项工作得到了 荷兰LSH部门的Topsector Life Sciences & Health - Topconsortium voor Kennis en Innovatie Health~Holland (LSH-TKI)公私合作伙伴关系(PPP)津贴的支持,项目编号LSHM16021 Organoids作为Hubrecht Organoid Technology(HUB)的毒理学建模新工具,以及HUB内部资助疾病建模和毒理学部门。我们感谢Sabine Middendorp(威廉明娜儿童医院儿科胃肠病学科,UMC,乌得勒支)和Hugo R. de Jonge和Marcel J.C. Bijvelds(鹿特丹伊拉斯谟MC胃肠病学和肝病学系)的实验室为在膜插入物上设置单层提供了初步技术支持。
材料
| Name | Company | Catalog Number | Comments |
| 100% ethanol | Fisher Emergo | 10644795 | |
| 1250, 300, and 20 µL low-retention filter-tips | Greiner bio-one | 732-1432 / 732-1434 / 732-2383 | |
| 15 mL conical tubes | Greiner bio-one | 188271 | |
| 24-well cell culture plates | Greiner bio-one | 662160 | |
| 24-well HTS Fluoroblok Transwell plate (light-tight) | Corning | 351156 | |
| 24-well HTS Transwell plates (Table 1) | Corning | 3378 | |
| 24-well plate with Transwell inserts | Corning | 3470 | |
| 40 µm cell strainer | PluriSelect | 43-50040-01 | |
| 50 mL conical tubes | Greiner bio-one | 227261 | |
| 6-well cell culture plates | Greiner bio-one | 657160 | |
| 96-well black plate transparent bottom | Greiner bio-one | 655090 | |
| 96-well fast thermal cycling plates | Life Technologies Europe BV | 4346907 | |
| 96-well HTS Fluoroblok Transwell plate | Corning | 351162 | |
| 96-well HTS Transwell plates (Table 1) | Corning | 7369 | |
| 96-well transparent culture plate | Greiner bio-one | 655180 | |
| A83-01 | Bio-Techne Ltd | 2939 | |
| Accutase Cell Dissociation Reagent | Life Technologies Europe BV | A11105-01 | Cell dissociation reagent 2 |
| Advanced DMEM/F-12 | Life Technologies Europe BV | 12634028 | |
| B27 supplement | Life Technologies Europe BV | 17504001 | |
| Cell culture microscope (light / optical microscope) | Leica | ||
| CellTiter-Glo | Promega | G9683 | |
| Centrifuge | Eppendorf | ||
| CO2 incubator | PHCBI | ||
| DAPT | Sigma-Aldrich | D5942 | |
| DEPC treated H2O | Life Technologies Europe BV | 750024 | |
| Dulbecco's phosphate-buffered saline (DPBS) with Ca2+ and Mg2+ | Life Technologies Europe BV | 14040091 | |
| DPBS, powder, no calcium, no magnesium | Life Technologies Europe BV | 21600069 | |
| EnzChek Lysozyme Assay Kit | Life Technologies Europe BV | E22013 | |
| EVOM2 meter with STX electrode | WTI | ||
| Gastrin | Bio-Techne Ltd | 3006 | |
| Glass pipettes | Volac | ||
| GlutaMAX | Life Technologies Europe BV | 35050038 | |
| hEGF | Peprotech | AF-100-15 | |
| HEPES | Life Technologies Europe BV | 15630056 | |
| Human Noggin | Peprotech | 120-10C | |
| Human Rspo3 | Bio-Techne Ltd | 3500-RS/CF | |
| IWP-2 | Miltenyi Biotec | 130-105-335 | |
| Ki67 primary antibody | Sanbio | BSH-7302-100 | |
| Ki67 secondary antibody | Agilent | K400111-2 | |
| Kova International Glasstic Slide with Counting grids | Fisher Emergo | 10298483 | |
| Laminar flow hood | Thermo scientific | ||
| Lucifer Yellow CH dilithium salt | Sigma-Aldrich | L0259 | |
| Matrigel, Growth Factor Reduced (GFR) | Corning | 356231 | extracellular matrix (ECM) |
| MicroAmp Fast 8-Tube Strip, 0.1 mL | Life Technologies Europe BV | 4358293 | |
| MicroAmp Optical 8-Cap Strips | Life Technologies Europe BV | 4323032 | |
| Microcentrifuge tubes | Eppendorf | 0030 120 086 | |
| Micropipettes (1000, 200, and 20 µL) | Gilson | ||
| Microtome | Leica | ||
| MUC2 primary antibody | Santa Cruz Biotechnology | sc-15334 | |
| MUC2 secondary antibody | VWR | VWRKS/DPVR-HRP | |
| Multichannel pipette (200 µL) | Gilson | ||
| N-acetylcysteine | Sigma-Aldrich | A9165 | |
| NGS Wnt | U-Protein Express | N001-0.5mg | |
| Nicotinamide | Sigma-Aldrich | N0636 | |
| Oligonucleotide ALPI1/Forward | Custom-made | GGAGTTATCCTGCTCCCCAC | |
| Oligonucleotide ALPI1/Reverse | Custom-made | CTAGGAGGTGAAGGTCCAACG | |
| Oligonucleotide LGR5/Forward | Custom-made | ACACGTACCCACAGAAGCTC | |
| Oligonucleotide LGR5/Reverse | Custom-made | GGAATGCAGGCCACTGAAAC | |
| Oligonucleotide MUC2/Forward | Custom-made | AGGATCTGAAGAAGTGTGTCACTG | |
| Oligonucleotide MUC2/Reverse | Custom-made | TAATGGAACAGATGTTGAAGTGCT | |
| Oligonucleotide TBP/Forward | Custom-made | ACGCCGAATATAATCCCAAGCG | |
| Oligonucleotide TBP/Reverse | Custom-made | AAATCAGTGCCGTGGTTCGTG | |
| Optical adhesive covers | Life Technologies Europe BV | 4311971 | |
| PD0325901 | Stemcell Technologies | 72184 | |
| Penicillin/streptomycin | Life Technologies Europe BV | 15140122 | |
| Plate shaker | Panasonic | ||
| PowerUp SYBR Green Master Mix | Fisher Emergo | A25776 | |
| Primocin | InvivoGen | ANT-PM-2 | antimicrobial formulation for primary cells |
| Qubit RNA HS Assay Kit | Life Technologies Europe BV | Q32852 | |
| Reagent reservoir for multichannel pipet | Sigma-Aldrich | CLS4870 | |
| REMS AutoSampler with 24-probe or 96C-probe | WTI | ||
| Richard-Allan Scientific Alcian Blue/PAS Special Stain Kit | Thermo scientific | 87023 | |
| RNase-Free DNase Set | Qiagen | 79254 | |
| RNeasy Mini Kit | Qiagen | 74106 | |
| SB202190 | Sigma-Aldrich | S7076 | |
| Serological pipettes | Greiner bio-one | 606180 / 607180 / 760180 | |
| Serological pipettor (Pipet-Aid) | Drummond | ||
| Single edge razor blade | GEM Scientific | ||
| Superscript 1st strand system for RT-PCR | Life Technologies Europe BV | 11904018 | |
| Tecan Spark 10M plate reader | Tecan | ||
| Trypan Blue Solution, 0.4% | Life Technologies Europe BV | 15250-061 | |
| TrypLE Express Enzyme (1x) | Life Technologies Europe BV | 12605-010 | Cell dissociation reagent 1 |
| Water bath | Grant | ||
| Y27632 (ROCK inhibitor) | AbMole | M1817 |
参考文献
- Haegebarth, A., Clevers, H. Wnt signaling, lgr5, and stem cells in the intestine and skin. The American Journal of Pathology. 174 (3), 715-721 (2009).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. V. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9 (8), 1909 (2020).
- Martínez-Maqueda, D., Miralles, B., Recio, I., Verhoeckx, K. HT29 Cell Line. The Impact of Food Bio-Actives on Gut Health: In Vitro and Ex Vivo Models. , 113-124 (2015).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Huch, M., et al. In vitro expansion of single Lgr5(+) liver stem cells induced by Wnt-driven regeneration. Nature. 11 (2), 179-194 (2013).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 1-20 (2019).
- Karthaus, W. R., et al. Identification of multipotent luminal progenitor cells in human prostate organoid cultures. Cell. 159 (1), 163-175 (2014).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Van De Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Driehuis, E., et al. Pancreatic cancer organoids recapitulate disease and allow personalized drug screening. Proceedings of the National Academy of Sciences of the United States of America. 116 (52), 26580-26590 (2019).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- d'Aldebert, E., et al. Characterization of human colon organoids from inflammatory bowel disease patients. Frontiers in Cell and Developmental Biology. 8, 363 (2020).
- Dotti, I., et al. Alterations in the epithelial stem cell compartment could contribute to permanent changes in the mucosa of patients with ulcerative colitis. Gut. 66 (12), 2069-2079 (2017).
- VanDussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. 64 (6), 911-920 (2015).
- Noel, G., et al. A primary human macrophage-enteroid co-culture model to investigate mucosal gut physiology and host-pathogen interactions. Scientific Reports. 7, 45270 (2017).
- Bartfeld, S., et al. In vitro expansion of human gastric epithelial stem cells and their responses to bacterial infection. Gastroenterology. 148 (1), 126-136 (2015).
- van Es, J. H., et al. Wnt signalling induces maturation of Paneth cells in intestinal crypts. Nature Cell Biology. 7 (4), 381-386 (2005).
- van Es, J. H., et al. Dll1 marks early secretory progenitors in gut crypts that can revert to stem cells upon tissue damage. Nature Cell Biology. 14 (10), 1099-1104 (2012).
- de Lau, W. B. M., Snel, B., Clevers, H. C. The R-spondin protein family. Genome Biology. 13 (3), 1-10 (2012).
- Basak, O., Beumer, J., Wiebrands, K., Seno, H., van Oudenaarden, A., Clevers, H. Induced quiescence of Lgr5+ stem cells in intestinal organoids enables differentiation of hormone-producing enteroendocrine cells. Cell Stem Cell. 20 (2), 177-190 (2017).
- Beumer, J., et al. Enteroendocrine cells switch hormone expression along the crypt-to-villus BMP signalling gradient. Nature Cell Biology. 20 (8), 909-916 (2018).
- Yin, X., Farin, H. F., van Es, J. H., Clevers, H., Langer, R., Karp, J. M. Niche-independent high-purity cultures of Lgr5+ intestinal stem cells and their progeny. Nature Methods. 11 (1), 106-112 (2014).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: An in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments. (120), (2017).
- Miao, Y., et al. Next-generation surrogate Wnts support organoid growth and deconvolute Frizzled pleiotropy in vivo. Cell Stem Cell. 27 (5), 840-851 (2020).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- Blume, L. -. F., Denker, M., Gieseler, F., Kunze, T. Temperature corrected transepithelial electrical resistance (TEER) measurement to quantify rapid changes in paracellular permeability. Die Pharmazie. 65 (1), 19-24 (2010).
- Lea, T., Verhoeckx, K., et al. Caco-2 cell line. The Impact of Food Bio-Actives on Gut Health: In Vitro and Ex Vivo Models. , 103-111 (2015).
- Heo, I., et al. Modelling Cryptosporidium infection in human small intestinal and lung organoids. Nature Microbiology. 3 (7), 814-823 (2018).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。