A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מונו-שכבת אפיתל שמקורה באורגנואידים: מודל במבחנה רלוונטי מבחינה קלינית לתפקוד מחסום המעי
In This Article
Summary
כאן, אנו מתארים את ההכנה של מונו-שכבות אפיתל מעיים שמקורן באורגנואידים אנושיים לחקר תפקוד מחסום המעיים, חדירות והובלה. מכיוון שאורגנואידים מייצגים את התגובה המקורית של רקמת האפיתל לגירויים חיצוניים, מודלים אלה משלבים את היתרונות של יכולת ההרחבה של קווי התאים ואת הרלוונטיות והמורכבות של הרקמה הראשונית.
Abstract
בעבר, מערכות מודל אפיתל מעיים היו מוגבלות לקווי תאים שעברו טרנספורמציה ולרקמות ראשוניות. למערכות מודל אלה יש מגבלות אינהרנטיות שכן הראשונות אינן מייצגות נאמנה פיזיולוגיה של רקמות מקוריות, וזמינותן של האחרונות מוגבלת. לפיכך, היישום שלהם מעכב מחקר בסיסי ופיתוח תרופות. אורגנואידים בוגרים המבוססים על תאי גזע (המכונים מעתה אורגנואידים) הם מיניאטורות של רקמת אפיתל תקינה או חולה שממנה הם נגזרים. ניתן לבסס אותם ביעילות רבה מאזורים שונים במערכת העיכול (GI), להיות בעלי יכולת הרחבה ארוכת טווח ולדמות תגובות ספציפיות לרקמות ולמטופלים לטיפולים במבחנה. כאן, הודגם כי הקמת מונו-שכבות אפיתל שמקורן באורגנואידים במעיים יחד עם שיטות למדידת שלמות מחסום אפיתל, חדירות והובלה, הפרשת חלבונים אנטי-מיקרוביאלית, כמו גם היסטולוגיה. יתר על כן, מונו-שכבות שמקורן באורגנואידים במעיים יכולות להיות מועשרות בתאי גזע מתרבים ומגבירי מעבר, כמו גם עם תאי אפיתל ממוינים מרכזיים. לכן, הם מייצגים מערכת מודל שניתן להתאים אותה כדי לחקור את ההשפעות של תרכובות על תאי המטרה ואת אופן הפעולה שלהם. למרות שתרביות אורגנואידים הן מבחינה טכנית תובעניות יותר מקווי תאים, לאחר שהן נוצרות, הן יכולות להפחית כשלים בשלבים מאוחרים יותר של פיתוח תרופות מכיוון שהן באמת מייצגות מורכבות אפיתל in vivo והטרוגניות בין-אשפוזית.
Introduction
אפיתל המעיים פועל כמחסום פיזי בין התוכן הזוהר של המעיים לבין הרקמה הבסיסית. מחסום זה מורכב משכבת אפיתל אחת של אנטרוציטים ספיגה בעיקר המחוברים על ידי צמתים הדוקים, היוצרים קשרים בין-תאיים חזקים בין תאים סמוכים. תאים אלה יוצרים רירית אפיתל מקוטבת המפרידה בין הצדדים האפיקליים (לומן) והבזולטרליים של המעי, ובמקביל מווסתת את ההובלה הפרא-תאית של חומרים מזינים ומטבוליטים מעוכלים. בנוסף לאנטרוציטים, תאי אפיתל חשובים אחרים כגון גביע, פאנת' ותאים אנטרואנדוקריניים תורמים גם הם להומאוסטזיס של המעיים על ידי ייצור ריר, פפטידים אנטי-מיקרוביאליים והורמונים, בהתאמה. אפיתל המעיים מתחדש כל הזמן על ידי חלוקת תאי גזע מצומדים לקולטן 5-חיובי (LGR5+) עשירים בלאוצין המכילים לאוצין המכילים חלבון G (LGR5+) בתחתית קריפטות המעיים המייצרים תאים מגבירי מעבר (TA) הנודדים כלפי מעלה ומתמיינים לסוגי תאים אחרים1. הפרעה להומאוסטזיס של אפיתל המעיים על ידי גורמים גנטיים וסביבתיים, כגון חשיפה לאלרגנים במזון, תרכובות רפואיות ופתוגנים מיקרוביאליים, מובילה להפרעה בתפקוד מחסום המעיים. מצבים אלה גורמים למספר מחלות מעיים, כולל מחלות מעי דלקתיות (IBD), צליאק ורעילות מערכת העיכול הנגרמת על ידי תרופות2.
מחקרים על אפיתל המעיים מבוצעים באמצעות מספר מערכות פלטפורמה במבחנה כגון תוספות ממברנה, מערכות איברים על שבב, תאי Ussing וטבעות מעיים. פלטפורמות אלה מתאימות לביסוס חד-שכבתיות אפיתל מקוטבות עם גישה הן לצדדים האפיים והן לצדדים הבזולטרליים של הממברנה, תוך שימוש בקווי תאים שעברו טרנספורמציה או ברקמה ראשונית כמודלים. אף על פי שקווי תאים שעברו טרנספורמציה, כגון קווי תאי קרצינומה של המעי הגס (אדנו) Caco-2, T84 ו- HT-29, מסוגלים להתמיין לאנטרוציטים מקוטבים במעיים או לתאים המייצרים ריר במידה מסוימת, הם אינם מייצגים את האפיתל in vivo מכיוון שחסרים מספר סוגי תאים, וקולטנים ומובילים שונים מבוטאים באופן חריג3 . בנוסף, מכיוון שקווי תאים נגזרים מתורם יחיד, הם אינם מייצגים הטרוגניות בין-אשפוזית וסובלים מירידה במורכבות וברלוונטיות הפיזיולוגית. אף על פי שרקמות ראשוניות המשמשות בתאי Ussing וכטבעות מעיים מייצגות יותר את מצב ה- in vivo, הזמינות המוגבלת שלהן, הכדאיות לטווח הקצר וחוסר יכולת ההרחבה שלהן הופכים אותן לבלתי מתאימות כמדיום למחקרי תפוקה גבוהה (HT).
אורגנואידים הם תרביות אפיתל במבחנה הנוצרות מאיברים שונים כגון המעי, הכליה, הכבד, הלבלב והריאות. הם הוכחו כבעלי יכולת הרחבה ארוכת טווח ויציבה כמו גם יציבות גנטית ופנוטיפית ולכן הם מיניאטורות ביולוגיות מייצגות של האפיתל של האיבר המקורי עם תגובות נאמנות לגירויים חיצוניים 4,5,6,7,8,9. אורגנואידים מבוססים ביעילות מרקמות תקינים, חולים, מודלקים או סרטניים שנכרתו או שעברו ביופסיה, המייצגים תגובות הטרוגניות ספציפיות לחולה 10,11,12,13,14,15,16. מאמר זה מדגים כיצד לבסס מונו-שכבות אפיתל מעיים שמקורן בתרביות אורגנואידים. מונו-שכבות הוקמו בהצלחה מתרביות אורגנואידים במעיים קטנים כמו גם מתרביות אורגנואידים במעי הגס ובפי הטבעת. מודל זה יוצר הזדמנות לחקור את ההובלה והחדירות של תאי האפיתל לתרופות, כמו גם את ההשפעות הטוקסיקולוגיות שלהם על האפיתל. יתר על כן, המודל מאפשר לתרבית משותפת עם תאי חיסון וחיידקים לחקור את האינטראקציות שלהם עם אפיתלהמעיים 17,18,19. יתר על כן, מודל זה יכול לשמש כדי לחקור תגובות לטיפולים באופן ספציפי למטופל וליזום מאמצי סינון כדי לחפש את הגל הבא של טיפולים ממוקדי מחסום אפיתל. גישה כזו יכולה להיות מורחבת למרפאה ולסלול את הדרך לטיפולים מותאמים אישית.
למרות שמונולי האפיתל בפרוטוקול זה מוכנים מאורגנואידים במעיים רגילים אנושיים, ניתן ליישם את הפרוטוקול ולהתאים אותו למודלים אורגנואידיים אחרים. מונו-שכבות אורגנואידיות אפיתל עוברות תרבית במדיום התפשטות אורגנואידי במעיים המכיל Wnt כדי לתמוך בשגשוג תאי גזע ולייצג את הרכב תאי המעיים. ניתן להעשיר את האורגנואידים במעיים כך שיהיו להם גורלות אפיתל מעיים שונים, כגון אנטרוציטים, פאנת', גביע ותאים אנטרואנדוקריניים, על ידי ויסות מסלולי Wnt, Notch וגורם גדילה אפידרמלי (EGF). כאן, לאחר הקמתם של חד-שכבתיים במדיום התפשטות, הם מונעים לעבר תאי אפיתל מעיים ממוינים יותר, כפי שתואר קודם לכן 20,21,22,23,24,25. למטרות הקרנה, בהתאם לאופן הפעולה של תרכובת העניין, תאי המטרה שלה ותנאי הניסוי, ניתן להניע את החד-שכבתיים לכיוון ההרכב התאי המועדף כדי למדוד את ההשפעות של התרכובת באמצעות קריאות פונקציונליות רלוונטיות.
Protocol
1. הכנת ריאגנטים לתרבות
הערה: בצע את כל השלבים בתוך ארון בטיחות ביולוגית ופעל לפי ההנחיות הסטנדרטיות לעבודה עם תרביות תאים. אור אולטרה סגול משמש במשך 10 דקות לפני הפעלת ארון הבטיחות הביולוגית. לפני ואחרי השימוש, פני השטח של ארון הבטיחות הביולוגית מנוקים עם נייר טישו ספוג 70% אתנול. כדי להקל על היווצרות של טיפות תלת מימדיות של מטריצה חוץ-תאית (ECM), שמור על מלאי מוכן מראש של לוחות 96, 24 ו-6 בארות מוכנים באינקובטור בטמפרטורה של 37 מעלות צלזיוס.
- הכנה בינונית בזלתית
- הכינו את מדיום הנשרים המהונדסים של דולבקו (BM) ב-500 מ"ל של Dulbecco's Advanced Dulbecco's Modified Eagle Medium Medium עם בקבוק בינוני של תערובת חומרי הזנה F-12 (Ad-DF) על ידי הוספת 5 מ"ל של 200 מ"ל גלוטמין, 5 מ"ל של תמיסות עט/סטרפטומיצין (עט/סטרפ) של 5 מ"ל של 10,000 U/mL או 10,000 מיקרוגרם/מ"ל(10,000 מיקרוגרם/מ"ל). ניתן לאחסן זאת במקרר בטמפרטורה של 4 מעלות צלזיוס למשך 4 שבועות לפחות.
- מקורות Wnt
- הכן את המדיום מותנה Wnt3a (Wnt3aCM) על פי השיטה שתוארה קודם לכן26.
הערה: לאחרונה, הדור הבא של Wnt פונדקאית (NGS-Wnt), התומך גם בהרחבה של אורגנואידים במעיים אנושיים, נוצר27.
- הכן את המדיום מותנה Wnt3a (Wnt3aCM) על פי השיטה שתוארה קודם לכן26.
- הכנה בינונית של בסיס אורגנואידי במעיים
הערה: השתמש בכל גורמי הצמיחה והריאגנטים בהתאם להמלצות היצרן. השתמשו באליקוטים קטנים והימנעו ממחזורי הפשרה בהקפאה; גורמי גדילה פונקציונליים חיוניים לתרבית אורגנואידית מוצלחת.- הכן מרוכז 2x תווך בסיס אורגנואידי במעיים (2x IBM) על ידי תוספת BM עם 1 μM A83-01, 2.5 mM N-אצטילציסטאין, 2x B27 תוסף, 100 ng/mL גורם גדילה אפידרמלי אנושי (hEGF), 10 ננומטר גסטרין, 200 ננומטר / מ"ל hNoggin, ו- 100 מיקרוגרם / מ"ל של נוסחה אנטי מיקרוביאלית לתאים ראשוניים (ראה את טבלת החומרים).
- Aliquot את IBM 2x ומקפיא ב -20 °C (74 °F) למשך עד 4 חודשים. בעת הצורך, להפשיר אליקוט לילה ב 4 °C (64 °F) או במשך מספר שעות בטמפרטורת החדר (RT).
- כדי להכין מדיום להרחבת אורגנואידים במעיים (IEM), יש להשלים 2x IBM עם 50% Wnt3aCM או 50% BM ו-0.5 ננומטר NGS-Wnt, 250 ng/mL אנושי Rspondin-3 (hRspo3), 10 mM ניקוטינמיד ו-10 μM SB202190.
- הכנה בינונית של התמיינות אורגנואידית במעיים
- הכן מדיום התמיינות אנטרוציטים (eDM) על ידי תוספת של 2x IBM עם 50% BM, 250 ננוגרם /מ"ל hRspo3, ומעכב מסלול Wnt של 1.5 μM Wnt (IWP-2). אחסן את eDM בטמפרטורה של 4 °C (4 °F) למשך עד 10 ימים.
- הכן מדיום התמיינות משולבת (cDM) על ידי השלמת 2x IBM עם 40% BM ו- 10% Wnt3aCM או 50% BM ו- 0.1 ננומטר NGS-Wnt, 250 ng/mL hRspo3, 10 μM DAPT ו- 100 ננומטר PD0325901. אחסן cDM בטמפרטורה של 4 מעלות צלזיוס למשך עד 10 ימים.
- מניפולציה של מטריצה חוץ-תאית (ECM)
הערה: הכן את המטריצה החוץ-תאית (ECM) (ראה טבלת החומרים) בהתאם להמלצת היצרן.- להפשיר ECM לילה על קרח; להעביר את ה- ECM מהבקבוק לצינור חרוטי של 15 מ"ל באמצעות פיפטה של 5 מ"ל, שניהם מקוררים מראש ב -20 מעלות צלזיוס. להקפיא מחדש את ההקפאה רק פעם אחת בטמפרטורה של -20 מעלות צלזיוס. לאחר ההפשרה, אחסן את ה- ECM במקרר בטמפרטורה של 4 °C (7 °F) למשך עד 7 ימים. דגירה למשך 30 דקות לפחות על קרח לפני השימוש.
הערה: ערבבו את ECM כראוי וודאו שהוא קר לפני הטבעת קריפטות או אורגנואידים.
- להפשיר ECM לילה על קרח; להעביר את ה- ECM מהבקבוק לצינור חרוטי של 15 מ"ל באמצעות פיפטה של 5 מ"ל, שניהם מקוררים מראש ב -20 מעלות צלזיוס. להקפיא מחדש את ההקפאה רק פעם אחת בטמפרטורה של -20 מעלות צלזיוס. לאחר ההפשרה, אחסן את ה- ECM במקרר בטמפרטורה של 4 °C (7 °F) למשך עד 7 ימים. דגירה למשך 30 דקות לפחות על קרח לפני השימוש.
2. תרביות אורגנואידיות
- יצירת תרביות מאורגנואידים קפואים
הערה: תן ל- BM להגיע ל- RT, ושמור על 12 מ"ל aliquot, מחומם ל - 37 ° C, מוכן לפני תחילת ההליך של הפשרה קריוביאלית אחת המכילה אורגנואידים קפואים.- להפשיר את הקריוביה האורגנואידית במהירות על ידי תסיסה באמבט מים של 37 מעלות צלזיוס עד שנותר רק רסיס קרח. מיד להוסיף 500 μL של BM חם טיפה טיפה ל cryovial, ולטפטף למעלה ולמטה כמה פעמים כדי לדלל את המדיום הקפוא ולערבב את התוכן בזהירות.
- באמצעות פיפטה P1000, מעבירים את האורגנואידים לצינור חרוטי של 15 מ"ל, ומוסיפים עוד 1 מ"ל של BM חם באופן טיפתי תוך ערבוב עדין של תחתית הצינור. פיפטו למעלה ולמטה כמה פעמים כדי לדלל את המדיום הקפוא ולערבב את התכולה בזהירות.
- יש להוסיף עד 12 מ"ל של BM חם באופן טיפתי לצינור החרוטי של 15 מ"ל המכיל את האורגנואידים, ולטפטף למעלה ולמטה עם פיפטה סטרילית של 10 מ"ל כדי להחיות בעדינות את האורגנואידים.
- צנטריפוגה ההשעיה האורגנואידית למשך 5 דקות ב 85 × גרם ו 8 מעלות צלזיוס. השליכו את הסופרנאטנט בזהירות מבלי להפריע לכדור, ובצעו החייאה של האורגנואידים ב-30% v/v של IEM בתוספת 10 μM Y27632 או מעכב חלבון סליל סליל אחר הקשור ל-rho, serine/threonine kinase מעכב (מעכב ROCK). הניחו את הצינור על קרח.
- הוסף 70% v/v של ECM בצינור החרוטי 15 מ"ל המכיל את האורגנואידים. מערבבים את התרחיף האורגנואידי ששומר על הצינור החרוטי של 15 מ"ל על קרח, וזורעים 5 μL של ההשעיה כדי לבדוק את הצפיפות (איור 1A). המשך ציפוי אם הצפיפות מתאימה; אם הצפיפות גבוהה מדי, הוסף פתרון IEM/ECM נוסף באותו יחס של 30-70% v/v, בהתאמה.
- בכל באר של צלחת בת 24 בארות, זרע 50 μL של התרחיף האורגנואידי על ידי צנרת 5 טיפות נפרדות של 10 μL (איור 1B). סובבו את הצלחת במהופך, והשאירו אותה בארון הבטיחות הביולוגית למשך 5 דקות. העבירו את הצלחת עדיין הפוכה לחממה של 37 מעלות צלזיוס, והשאירו אותה לעוד 30 דקות.
- הוסיפו 500 μL של IEM עם מעכב 10 μM ROCK לכל באר, והעבירו את הצלחת לחממה. תמונה טיפה אחת באופן קבוע כדי לנטר את הצמיחה, ולרענן את IEM כל 2-3 ימים על ידי שאיפת המדיום הישן והוספת 500 μL של IEM טרי.
- מעבירים את האורגנואידים לאחר שהתאוששו כראוי מהפשרה והגיעו לגודל הנכון לעיבוד (איור 1C), כפי שמתואר בסעיף 2.2.
- מעבר של אורגנואידים במעיים
הערה: צנן את ה- ECM על קרח למשך 30 דקות לפחות, ושמור את ה- IEM ב- RT למשך שעה אחת לפחות לפני השימוש.- השתמש במדיום מבאר תרבית אחת כדי לשבור את הכיפות האורגנואידיות באמצעות קצה מסנן בעל שמירה נמוכה של 1250 μL, ולהעביר את תכולת הבאר לצינור חרוטי מסומן של 15 מ"ל. לשטוף את הבאר עם 1 מ"ל של BM, ולהעביר אותו לאותו צינור חרוטי 15 מ"ל.
- חזור על שלבים 2.2.1 ו- 2.2.2 עם כל שאר הבארות (ניתן לשטוף לכל היותר חצי צלחת או 600 μL של טיפות ECM ולהוסיף לצינור חרוטי אחד של 15 מ"ל).
- הוסיפו BM כדי למלא את הצינור עד 12 מ"ל, וטפטפו למעלה ולמטה פי 10 באמצעות פיפטה של 10 מ"ל. צנטריפוגה ב 85 × גרם במשך 5 דקות ב 8 °C (8 °F).
- לפני הסרת ה-BM, בדקו מתחת למיקרוסקופ אם כל האורגנואידים נכפים בתחתית הצינור החרוטי בגודל 15 מ"ל (איור 1D). אם אין ECM המכסה את כדור האורגנואידים או ששכבת ה-ECM נקייה או מכילה רק פסולת, תאים בודדים או מעט מאוד אורגנואידים בהשוואה לאורגנואידים המכוסים, שאפו לסופרנט והוציאו את ה-ECM שמכסה את כדור האורגנואידים בזהירות רבה באמצעות פיפטה P200.
הערה: אורגנואידים יכולים להילכד ב- ECM ואינם משקעים ככדור קומפקטי עקב כוח צנטריפוגה נמוך. אם ה-ECM מכיל אורגנואידים, צנטריפוגה שוב ב-450 × גרם למשך 5 דקות ב-8 מעלות צלזיוס, והסירו בזהירות את ה-supernatant כמתואר ב-2.2.4. אם ישנם מספר צינורות חרוטיים של 15 מ"ל, ניתן לאגד אותם לאחר שלב 2.2.4. - מוסיפים 1 מ"ל של BM לכל כדור (בנפח של 50-200 μL, תלוי בתרבית האורגנואידית ובצפיפותם), ועושים החייאה בזהירות. פיפטו את האורגנואידים למעלה ולמטה לפחות פי 5 כדי לגזוז אותם, תוך הימנעות מהיווצרות קצף. בדקו מתחת למיקרוסקופ כדי לראות אם האורגנואידים מופרעים (איור 2A). אם האורגנואידים מופרעים, המשך לשלב 2.2.7; אם האורגנואידים אינם מופרעים, טפטפו אותם עוד פי 5. הפעם, געו בקיר של צינור הפלסטיק עם קצה הפיפטה כדי להפעיל כוח מכני רב יותר כדי לשבש את האורגנואידים.
הערה: גזירה מכנית של אורגנואידים ציסטיים (איור 1C) וניצנים (איור 1E) אפשרית עם קצה פיפטה מפלסטיק של 200 μL או 10 μL המותקן על קצה מסנן בעל 1250 μL בעל שמירה נמוכה (איור 1F), בהתאם לנפח הנדרש לשיבוש האורגנואידים. השימוש בפיפטה מזכוכית צרה (איור 1F) מומלץ כאשר מעובדים יותר מ-200 μL של ECM המכיל את האורגנואידים (באר אחת של צלחת של 6 בארות או 4 בארות של צלחת בעלת 24 בארות). - בדוק שוב מתחת למיקרוסקופ כדי לראות אם האורגנואידים מופרעים. אם הופרע, המשך לשלב הבא; אם לא, פיפט את האורגנואידים עד פי 20, בודק את האורגנואידים מתחת למיקרוסקופ באופן קבוע. אם האורגנואידים עדיין לא מופרעים, הוסיפו ריאגנט דיסוציאציה של 25% v/v לתאים 1 (ראו טבלת החומרים) לתרחיף, דגרו באמבט המים בטמפרטורה של 37 מעלות צלזיוס למשך 2 דקות, וטפטפו את האורגנואידים עד פי 20, ובדקו את האורגנואידים שמתחת למיקרוסקופ באופן קבוע כדי לוודא שהם לא מתעכלים לתאים בודדים.
- הוסיפו עד 12 מ"ל של BM לצינור החרוטי של 15 מ"ל, ושטפו את הכדור האורגנואידי על ידי צנרת למעלה ולמטה. צנטריפוגה ב 85 × גרם במשך 5 דקות ב 8 °C (8 °F). יש להשליך את הסופרנטנט, ולהתאים את הריכוז הסופי ל-70% v/v ECM על ידי הוספת IEM ו-ECM לכדור האורגנואידי.
- התחילו לעשות שימוש חוזר בכדור האורגנואידי עם נפח כפול של IEM/ECM שנאסף לצורך מסירה, וזרע 5 μL של ההשעיה כדי לבדוק את הצפיפות. המשך ציפוי אם הצפיפות מתאימה (איור 2B); הוסף פתרון IEM/ECM נוסף אם הצפיפות גבוהה מדי. הוסיפו 200 μL של ההשעיה לכל באר של לוחית 6 בארות מוכנה מראש, ויצרו טיפות נפרדות של נפח של 10 מיקרול'.
- סובבו את הצלחת במהופך, והשאירו אותה בארון הבטיחות הביולוגית למשך 5 דקות. מעבירים את הצלחת שעדיין הפוכה לחממה של 37 מעלות צלזיוס, ומשאירים אותה לעוד 30 דקות. הוסיפו 2 מ"ל של IEM עם מעכב 10 μM ROCK לכל באר, והעבירו את הצלחת לחממה.
- תמונה אחת טיפה אחת באופן קבוע כדי לנטר את הצמיחה, ולרענן את IEM כל 2-3 ימים על ידי שאיפת המדיום הישן והוספת 2 מ"ל של IEM טרי.
- העברת אורגנואידים במעיים להכנת חד-שכבתי אפיתל
- אורגנואידים של מעבר 3 ימים לפני הקטיף להכנת מונולאייר על ידי ביצוע אותו פרוטוקול מעבר המתואר בסעיף 2.2 עם יוצא מן הכלל אחד. בשלב 2.2.7, בצעו החייאה של האורגנואידים ב-1-1.1.5x מנפח ההתחלה של IEM/ECM כדי שיהיה להם פוטנציאל צפיפות והתפשטות גבוה יותר כאשר הם נקטפים להכנת חד-שכבתי (איור 3A).
3. הכנת חד-שכבת אפיתל
- מונו-שכבות אפיתל תרבית הן על ממברנת 24-באר והן על ממברנה של 96 בארות עם מגוון סוגי צלחות זמינים (טבלה 1). השתמש בתוספות ממברנה של מערכת תפוקה גבוהה (HTS) לשני הגדלים מכיוון שהן מכילות מגש אינטגרלי עם תוספות הממברנה ולוחית מקלט. עבור פורמט 24-באר, השימוש בלוחות עם תוספות ממברנה נשלפות נפרדות אפשרי גם כן.
הערה: סוגי ממברנות שונים (פוליאתילן טרפתלט (PET) או פוליקרבונט) וגדלי נקבוביות (0.4-8.0 מיקרומטר) זמינים וניתן להשתמש בהם בהתאם לצרכים ניסיוניים. ניתן לצלם מונו-שכבות רק על ידי ברייטפילד כאשר נעשה שימוש בתוספות עם ממברנות PET. ממברנות אטומות לאור חוסמות דליפת אור פלואורסצנטית מהאפיקל לתא הבזולטרלי וניתן לקחת אותן בחשבון כאשר חוקרים הובלה דינמית או חדירות של מצעים המסומנים בפלואורסצנטיות. הפרוטוקול הנוכחי משתמש בתוספות ממברנה של 24 בארות; התאמות עבור תוספות ממברנה 96 באר מתוארות בסעיף 5. בהתאם לצפיפות, למורפולוגיה ולגודל של האורגנואידים (איור 3A), 6 בארות של צלחת בת 6 בארות (כפי שנזרע בסעיף 2.3) מספיקות לזריעה של צלחת מלאה של 24 בארות של תוספות ממברנה. - ציפוי ממברנה מוסיף עם ECM
הערה: אם יש ספקות לגבי מספיק תאים, ציפו את התוספות לאחר ספירת התאים. זאת כדי למנוע ציפוי מיותר ואובדן של תוספות הממברנה היקרות.- מניחים את הממברנה לתוך לוחית התמיכה בארון הבטיחות הביולוגית. דיללו את ה-ECM 40x בתמיסת הפוספטים (DPBS) של דולבקו הקרה כקרח עם Ca2+ ו-Mg2+, ו-pipet 150 μL של ה-ECM המדולל לתוך התא האפיקלי של כל תוסף. דגירה של הצלחת בטמפרטורה של 37 מעלות צלזיוס למשך שעה אחת לפחות.
- הכנת תאים לזריעה
- אליקוטים לפני המלחמה של מגיב דיסוציאציה של התא 2 באמבט המים (37 מעלות צלזיוס). הכן 2 מ"ל של המגיב עבור כל באר של צלחת 6 באר.
- מעבירים את צלחת התרבית המכילה את האורגנואידים (שהוכנו בסעיף 2.3) מהחממה אל ארון הבטיחות הביולוגית. לעבד את האורגנואידים, כמתואר בשלבים 2.2.1.-2.2.4. אין לאגד מספר צינורות לצינור אחד.
- מלאו את הצינור, והכילו אורגנואידים מ-3 בארות לכל היותר של צלחת בעלת 6 בארות, עד 12 מ"ל עם DPBS (ללא Ca2+ ו-Mg2+), וצינור למעלה ולמטה פי 10 באמצעות פיפטה של 10 מ"ל. צנטריפוגה ב 85 × גרם במשך 5 דקות ב 8 °C (8 °F), ולשאוף את supernatant מבלי להפריע את הכדור האורגנואידי.
- הוסף 2 מ"ל של מגיב דיסוציאציה של תאים טרום-מלוחים 2 לכל באר של צלחת בעלת 6 בארות המשמשת כחומר ההתחלה והחייאה. דגירה של הצינורות באלכסון או אופקית במשך 5 דקות באמבט המים בטמפרטורה של 37 מעלות צלזיוס, כדי למנוע את שקיעת האורגנואידים לתחתית הצינור.
- פיפטה למעלה ולמטה פי 10 באמצעות פיפטת פלסטיק סטרילית של 5 מ"ל או פיפטה P1000, בהתאם לנפח הכולל של מגיב דיסוציאציית התאים. בדקו את ההשעיה האורגנואידית מתחת למיקרוסקופ כדי לראות אם נוצרה תערובת של תאים בודדים וכמה גושי תאים המורכבים מ-2-4 תאים (איור 3B). במידת הצורך, המשיכו את העיכול על ידי חזרה על שלבים 3.3.4-3.3.5 (אין להגדיל את נפח מגיב הדיסוציאציה של התאים) עד שהתערובת תיראה דומה לאיור 3B.
הערה: הימנעו מעיכול האורגנואידים באופן מלא לתאים בודדים. יש צורך בכמה קבוצות קטנות של תאים (כלומר, קבוצות של 2-4 תאים). - יש להפסיק את דיסוציאציית התאים על ידי הוספת עד 12 מ"ל של BM כולל מעכב 10 μM ROCK לתרחיף התא. צנטריפוגה ב 450 × גרם במשך 5 דקות ב 8 °C (8 °F), ולשאוף את supernatant מבלי להפריע לכדור התא. כאשר מטפלים באותה תרבית אורגנואידית במספר צינורות חרוטיים של 15 מ"ל, אחסנו את כדורי התאים והחזירו אותם ל-12 מ"ל של BM.
- מסננים את תרחיף התא דרך מסננת של 40 מיקרומטר עם BM, וקוצרים את הזרימה החוצה לצינור חרוטי של 50 מ"ל. שטפו את המסננת עם 10 מ"ל של BM, וקטפו את הזרימה-דרך לאותו צינור חרוטי של 50 מ"ל.
- מעבירים את תרחיף התא המאומץ לשני צינורות חרוטיים חדשים של 15 מ"ל. צנטריפוגה ב 450 × גרם במשך 5 דקות ב 8 °C (8 °F), ולשאוף את supernatant מבלי להפריע את גלולת התא. יש להחיות את התאים ב-4 מ"ל של IEM בתוספת מעכב 10 μM ROCK לכל צלחת תרבית מלאה המשמשת כחומר התחלתי.
- ערבבו כמות קטנה של מתלי תאים ביחס של 1:1 עם טריפאן כחול לספירה. ספרו את התאים החיים, לא הכחולים, (איור 3C), וחשבו את המספר הכולל של התאים החיים. בגושים קטנים, ספרו כל תא בנפרד.
- הכינו תרחיף תא המכיל 3 × 106 תאים חיים לכל מ"ל של IEM בתוספת מעכב 10 μM ROCK.
- זריעת תאים על ממברנת פוליאסטר מוסיף
- שאפו בזהירות ל-DPBS מהתוספות מצופות ה-ECM (שלב 3.2.1), תוך שמירה על הצלחת אופקית. Pipet 800 μL של IEM בתוספת מעכב ROCK לתוך כל תא basolateral. Pipet 150 μL של תרחיף התא שהוכן בשלב 3.3.10 על הממברנה המצופה ECM בתא האפיקלי בצורה טיפתית. לכל צלחת, הקפד שיהיה לפחות "ריק" אחד היטב עם BM בלבד.
- לאחר שהתאים שקעו על הממברנה, מדוד את ההתנגדות החשמלית הטרנס-פיתלית (TEER), כמתואר בסעיף 4.1, ודמיין את הממברנה מכניסה באמצעות מיקרוסקופ. הניחו את הצלחת באינקובטור בטמפרטורה של 37 מעלות צלזיוס ו-5% CO2. מדוד TEER מדי יום, וצור תמונות באופן קבוע כדי לנטר היווצרות חד-שכבתית (איור 4A-D).
- מונו-שכבות מרעננות
הערה: רענן את המדיום כל 2-3 ימים, תוך הקפדה על הסדר הבא כדי לשמור על לחץ הידרוסטטי חיובי מעל התאים ולמנוע מהתאים להידחף מהממברנה. בעת רענון המדיום, יש לוודא שהמולטייר, הנראה לעין עם שאיפת המדיום, אינו נפגע מקצה הפיפטה.- הסר את המדיום מהתאים הבסולטרליים של הצלחת המכילה את תוספות הממברנה. לאחר מכן, לשאוף בזהירות את המדיום מן התאים apical של הממברנה מוסיף.
- הוסיפו 150 μL של IEM טרי באופן טיפתי לכל תא אפיקל, ולאחר מכן הוסיפו 800 μL של IEM טרי לכל תא בזולטרלי.
- העשרת החד-שכבתי לסוגי תאי אפיתל המעי הרצויים
- אפשר למונולאי להפוך למפגש ב- IEM, המתאים לערך TEER של כ- 100 Ω·cm² (כפי שחושב בשלב 4.1.1.1.4). בדקו מתחת למיקרוסקופ כדי לקבוע אם החד-שכבתיים נוצרו לחלוטין (איור 4D) והיעדר חורים (כפי שניתן לראות באיור 4B,C).
- הסר בזהירות את IEM מהתאים הבסולטרליים והאפיקליים של תוספות הממברנה, והחלף ב- eDM או ב- cDM כפי שהוכן בסעיף 1.4. תרבית את החד-שכבתי למשך 3-4 ימים נוספים במדיום ההתמיינות הספציפי כדי להעשיר את התאים האורגנואידים בסוג התא הספציפי הרצוי. רענן את המדיום כל 2-3 ימים, כמתואר בסעיף 3.4.
- מדוד את TEER מדי יום, ורכוש תמונות באופן קבוע אם תרצה בכך (איור 5A-C).
הערה: ערך TEER המציין חד-שכבתי מועשר מאורגן במלואו משתנה בהתאם לתרבית האורגנואידים; בדרך כלל ערכי TEER עולים ל- 600 ויכולים לעלות עד 1000 Ω·cm2 (כפי שחושב בשלב 4.1.1.4) לאחר 3 ימים במדיית הבחנה והם יציבים למשך 3-5 ימים.
4. קריאות בדיקה חד-שכבתיות אפיתליאליות
- מדידת התנגדות חשמלית טרנס-פיתלית (TEER)
הערה: מדידות TEER מקובלות באופן נרחב כשיטה לניתוח דינמיקה של צמתים הדוקים ושלמות תפקודי מחסום במודלים ביולוגיים של מחסומים פיזיולוגיים, כגון חד-שכבתיים אפיתליאליים28,29. ניתן למדוד עלייה ב- TEER לאחר התמיינות עקב אינטראקציה תאית מוגברת בצמתים הדוקים באמצעות מד TEER ידני או רובוט מדידת TEER אוטומטי.- מדידת TEER באמצעות מד TEER ידני
- נקו את האלקטרודה עם 70% אתנול, ותנו לה להתייבש באוויר בתוך ארון הבטיחות הביולוגית. מקם את האלקטרודה בצינור המכיל BM. חבר את האלקטרודה למד TEER הידני. הפוך את מתג הפונקציה למדוד באוהם (Ω). הפעל את מתג ההפעלה .
- מקם את האלקטרודה הקצרה בתא האפיקלי של התוספת, בעוד האלקטרודה הארוכה ממוקמת בתא הבזולטרלי (איור 6A). הימנע מלגעת במונולייר.
- מדוד את ההתנגדות בבאר הריקה (Rריק), ולאחר מכן מדוד את הדגימות הנותרות (דגימת R) באותו אופן. לשטוף את האלקטרודה עם BM בין דגימות עם תנאים שונים. נקו את האלקטרודה תחילה עם מים דמי ולאחר מכן עם 70% אתנול ותנו לה להתייבש באוויר.
- חישוב TEER (Ω·cm2): [דגימת R (Ω) - Rריק (Ω)] × שטח הממברנה (cm2) (טבלה 1 ואיור 6B).
- מדידת TEER באמצעות רובוט מדידה אוטומטי של TEER (טבלת חומרים)
- בצע מדידות TEER אוטומטיות בעת שימוש במערכות HTS עבור לוחות HTS של 96 בארות ו-24 בארות המכילות תוספות ממברנה. השתמש באלקטרודות שונות למדידת TEER עבור שני הסוגים (תוספות ממברנה 24 ו-96- HTS). כדי למדוד TEER באמצעות רובוט מדידה אוטומטי של TEER, בצע את הוראות היצרן.
- מדידת TEER באמצעות מד TEER ידני
- מדידת שלמות וחדירות של מחסום אפיתל
הערה: פרוטוקול זה מציג חדירות צהובה של לוציפר מהתא האפיקלי לתא הבזולטרלי כאינדיקציה לשלמות חד-שכבתית. סעיף זה מתאר מדידת פלואורסצנציה בתא הבזולטרלי לאחר שלב דגירה של שעה אחת כדי להעריך חדירות חד-שכבתית ובכך, שלמות המחסום. מדידה זו היא בדיקת נקודת קצה והיא שימושית במיוחד כאשר בודקים תרכובות את השפעתן על שלמות המחסום.- להפשיר את לוציפר צהוב על הקרח, ולתת ל-BM להשתוות ל-RT. עבור צלחת אחת של 24-באר של תוספות ממברנה, להכין 5 מ"ל של תמיסת עבודה של 60 μM לוציפר צהוב ב- BM.
הערה: לוציפר צהוב רגיש לאור. הכינו דילולים בצינורות סטריליים כהים של 1.5 מ"ל ובצעו את כל השלבים כאשר אור ארון הבטיחות הביולוגית כבוי. - הסר בזהירות את המדיום מהתאים הבזולטרליים והאפיקליים של תוספות הממברנה, כמתואר בשלב 3.5.1. אם תרצה, שרוט מונו-שכבתי אחד שלא טופל באמצעות קצה פיפטה כבקרה חיובית לדליפת לוציפר צהוב דרך מחסום פגום.
- הוסף 150 μL של BM עם 60 μM לוציפר צהוב לכל תא אפיקלי, והוסף 800 μL של BM ללא לוציפר צהוב לכל תא basolateral. הניחו את הצלחת על שייקר בטמפרטורה של 37 מעלות צלזיוס, 50 סל"ד למשך 60 דקות.
- בינתיים, הכינו עקומה סטנדרטית של לוציפר צהוב ב-BM החל מפתרון העבודה שהוכן בשלב 4.2.1. דיללו 1:3 בכל צעד עד שיגיעו לריכוז של 3 ננומטר. כלול פקד שלילי (BM בלבד).
- העבר 100 μL מכל תקן במשולש לצלחת שקופה של 96 היטב. לאחר 60 דקות דגירה, הסירו את תוספות הממברנה והעבירו 100 μL מכל באר בזולטרלית (שלב 4.2.3) במשולש לצלחת השקופה של 96 בארות. מדוד פלואורסצנטיות של הלוח באמצעות קורא צלחת באורך גל עירור של 430 ננומטר ואורך גל פליטה של 530 ננומטר.
- לאחר תיקון עבור ערך הבקרה השלילית (BM בלבד), השתמש בערכי העקומה הסטנדרטיים כדי לחשב את ריכוז לוציפר צהוב בתא הבזולטרלי (ריכוז המקלט הסופי (μM)).
- חשב את מקדם החדירות לכאורה (אפליקציית P) לפי הנוסחה הבאה (איור 6C):

- עבור צלחת של 24 בארות המכילה תוספות ממברנה, השתמש בנוסחה הבאה:
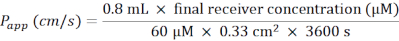
- להפשיר את לוציפר צהוב על הקרח, ולתת ל-BM להשתוות ל-RT. עבור צלחת אחת של 24-באר של תוספות ממברנה, להכין 5 מ"ל של תמיסת עבודה של 60 μM לוציפר צהוב ב- BM.
- תיקון מונו-שכבות והכנת גושי פרפין להיסטולוגיה
הערה: ניתן להשתמש ב-Epithelial monolayers לצביעה היסטולוגית להערכת הרכב התאים שלהם, קוטביותם וביטוי של חלבונים שונים בעלי עניין כגון חלבונים צמתים, התפשטות או סמני דיפרנציאציה. חלק זה מתאר הכנת בלוק פרפין לכתמים היסטולוגיים.- הסר בזהירות את המדיום מהתאים הבזולטרליים והאפיקליים של תוספות הממברנה, כמתואר בשלבים 3.5.1.
- שטפו את החד-שכבתיים על ידי הוספת 150 μL של DPBS (ללא Ca2+ ו-Mg2+) לכל תא אפיקלי ו-800 μL לכל תא בזולטרלי. יש לשאוף בזהירות שוב ל-DPBS, תחילה מהתא הבזולטרלי ולאחר מכן מהתא האפיקלי.
הערה: התא הבסולטרלי יישאר ריק משלב זה ואילך. - במכסה אדים, מוסיפים 150 μL של 4% paraformaldehyde לכל תא אפיקלי, ודגירה למשך 30 דקות ב-RT.
הערה: מצעד זה ואילך, בצע את כל הפעולות בסעיף זה בתוך מכסה אדים, שכן paraformaldehyde הוא רעיל. - יש לשאוף בזהירות את הקיבוע מהתאים האפיקליים של מכניסות הממברנה, ולהשליך אותו כפסולת הלוגן נוזלית.
הערה: משלב זה ואילך, השליכו את כל הפסולת הנוזלית כפסולת הלוגן נוזלית. - שטפו את החד-שכבתיים על ידי הוספת 200 μL של DPBS (ללא Ca2+ ו-Mg2+) לכל תא אפיקלי, ושאפו שוב בזהירות ל-DPBS. חזור על שלב זה פעם נוספת.
- הוסיפו 200 μL של 25% אלכוהול אתילי (EtOH) לכל תא אפיקלי, ודגרו למשך 15 דקות ב-RT. לאחר 15 דקות, שאפו בזהירות את ה- EtOH של 25% מהתאים האפיקליים של תוספות הממברנה. חזור על הפעולה עם פתרון EtOH של 50% ולאחר מכן עם פתרון EtOH של 70%.
- הוסיפו 200 μL של 70% EtOH לכל תא אפיקל, ועטפו את הצלחת בפרפילם. אחסנו אותו בטמפרטורה של 4 מעלות צלזיוס עד לשימוש נוסף.
- שאפו בזהירות ל-EtOH של 70%, והשתמשו באזמל כדי לחתוך בזהירות את הקרומים החד-שכבתיים יותר מהתוספות. חותכים מהצד הבסולטרלי, סביב קצה התוספת.
- הכן בלוקי פרפין בהתאם להליך הרגיל.
- כאשר הפרפין עדיין חם, קחו את המונולייה מהפרפין עם פינצטה, והניחו אותה על משטח מוכן מראש.
- היזהרו שלא לפגוע במונולייר. חותכים את המונולאייה לשניים באמצעות להב קצה יחיד.
- כאשר הפרפין בתחתית הקלטת מתחיל להתמצק, השתמש בפינצטה מחוממת כדי למקם את שני החלקים החד-שכבתיים בפרפין, זה ליד זה עם הצד הישר למטה ובכיוון אנכי כדי להבטיח שהחד-שכבתי יהיה אנכי בקופה.
- כאשר בלוקי פרפין מוכנים, חותכים את הבלוקים באמצעות מיקרוטום, ויוצרים שקופיות של מקטעים בעובי 4 מיקרומטר בהתאם להליך סטנדרטי. ודא כי monolayers בסופו של דבר אנכית ב coupe.
- בצע כתמים היסטולוגיים כפי שתואר קודם לכן 7,9. השתמשו בהמטוקסילין ובאאוזין (H&E), ב-Ki67, ב-mucin-2 (MUC2) וב-Alcian Blue כדי להראות מורפולוגיה כללית, תאים מתרבים, ייצור ריר ותאי גביע, בהתאמה (איור 6E).
הערה: ניתן להשתמש גם בסמני הבחנה נוספים, כגון lysozyme עבור תאי Paneth. סמן זה אינו מוצג באיור 6E מכיוון שתאי פאנת' נמצאים באפיתל המעי הדק ולא באפיתל המעי הגס.
- מדידת חלבונים מופרשים בסופרנטנט בינוני
- מדוד את רמות הליזוזים בסופרנט האפיקלי של חד-שכבתיים איליאליים (ראו איור 6D) באמצעות הערכה המופיעה בטבלת החומרים. אם תרצה, מדוד רמות של ציטוקינים שונים וחלבונים אחרים בעלי עניין.
- ניתוח ביטוי גנים
- לכמת את ההשפעות של מדיית ההתמיינות על הביטוי של גנים של סמן תאי אפיתל באמצעות תגובת שרשרת כמותית של שעתוק הפוך-פולימראז (qRT-PCR).
- Lyse את monolayers ב 350 μL של מאגר RNA lysis ואחריו בידוד RNA על פי הוראות היצרן. בצע סינתזת cDNA ו- qPCRs, כפי שתואר קודם לכן 7,9, באמצעות ערכות הסינתזה של cDNA, תערובת המאסטר ואוליגונוקלאוטידים המפורטים בטבלת החומרים.
- לכמת את ההשפעות של מדיית ההתמיינות על הביטוי של גנים של סמן תאי אפיתל באמצעות תגובת שרשרת כמותית של שעתוק הפוך-פולימראז (qRT-PCR).
5. שדרוג ללוחות 96 באר המכילים תוספות ממברנה
הערה: הכינו חד-שכבתיים אפיתליאליים להקרנות תרופות בתפוקה גבוהה יותר או למספר מצבים בינוניים באמצעות צלחות HTS 96-well המכילות תוספות ממברנה.
- עיבודים בעת הכנת מונו-שכבות בפורמט 96-well
- בצע את כל השלבים המתוארים בפרוטוקול זה עבור לוחות של 24 בארות המכילים תוספות ממברנה, שינוי נפחים ומספרי תאים לאלה המתוארים בטבלה 1. להכנת מונו-שכבות על לוחות 96-באר עם תוספות ממברנה, המשך כמתואר בסעיף 3 עם ההבדלים הבאים.
- כ-9 בארות של צלחת תרבית בת 6 בארות עם צפיפות אורגנואידית המיוצגת באיור 3A נחוצות כדי לזרוע צלחת מלאה של 96 בארות עם תוספות ממברנה. בשלב 3.2.1, ענקו מראש את הממברנות עם 67 μL של ECM מדולל פי 40 ב-DPBS (עם Ca2+ ו-Mg2+).
- בסעיף 3.5, העבר תחילה את הלוח האינטגרלי של תוספות הממברנה לצלחת נוספת של 96 בארות כדי לאפשר רענון בינוני של תאים אפיקליים ובזולטרליים כאחד.
- בצע את כל השלבים המתוארים בפרוטוקול זה עבור לוחות של 24 בארות המכילים תוספות ממברנה, שינוי נפחים ומספרי תאים לאלה המתוארים בטבלה 1. להכנת מונו-שכבות על לוחות 96-באר עם תוספות ממברנה, המשך כמתואר בסעיף 3 עם ההבדלים הבאים.
תוצאות
איור 1A מראה תמונה מייצגת של אורגנואידים במעיים לאחר שהפשירו אותם מקריוביאל. חשוב להפשיר אורגנואידים בצפיפות גבוהה כדי להבטיח התאוששות אופטימלית. האורגנואידים מצופים בלוחות של 24 או 6 בארות בכיפות ECM של כ-10 מיקרול' (איור 1B). לרוב האורגנואידים הנורמליים במעיים...
Discussion
פרוטוקול זה מתאר את המניפולציה הכללית והתחזוקה של אורגנואידים במעיים, כמו גם את ההכנה והיישומים האפשריים של מונו-שכבות אפיתל שמקורן באורגנואידים אלה. עד כה, מונו-שכבות הוכנו בהצלחה מהתריסריון, האילאום ואזורים שונים של אורגנואידים במעי הגס שמקורם ברקמת מעיים רגילה כמו גם בעבר ובאופן פעיל ...
Disclosures
המחברים מצהירים על היעדר ניגוד עניינים.
Acknowledgements
עבודה זו נתמכת על ידי Topsector מדעי החיים והבריאות - Topconsortium voor Kennis en Innovatie Health ~ הולנד (LSH-TKI) שותפויות ציבוריות-פרטיות (PPP) של מגזר LSH ההולנדי עם מספר פרויקט LSHM16021 Organoids ככלי חדשני למידול טוקסיקולוגיה לטכנולוגיית האורגנואידים של Hubrecht (HUB) ומימון פנימי של HUB למחלקת מידול מחלות וטוקסיקולוגיה. אנו מודים למעבדות של סבין מידנדורפ (המחלקה לגסטרואנטרולוגיה של ילדים, בית החולים לילדים וילהלמינה, UMC, אוטרכט) והוגו ר' דה יונגה ומרסל J.C. Bijvelds (המחלקה לגסטרואנטרולוגיה והפטולוגיה, ארסמוס MC, רוטרדם) על מתן תמיכה טכנית ראשונית להקמת מונו-שכבות על תוספות ממברנה.
Materials
| Name | Company | Catalog Number | Comments |
| 100% ethanol | Fisher Emergo | 10644795 | |
| 1250, 300, and 20 µL low-retention filter-tips | Greiner bio-one | 732-1432 / 732-1434 / 732-2383 | |
| 15 mL conical tubes | Greiner bio-one | 188271 | |
| 24-well cell culture plates | Greiner bio-one | 662160 | |
| 24-well HTS Fluoroblok Transwell plate (light-tight) | Corning | 351156 | |
| 24-well HTS Transwell plates (Table 1) | Corning | 3378 | |
| 24-well plate with Transwell inserts | Corning | 3470 | |
| 40 µm cell strainer | PluriSelect | 43-50040-01 | |
| 50 mL conical tubes | Greiner bio-one | 227261 | |
| 6-well cell culture plates | Greiner bio-one | 657160 | |
| 96-well black plate transparent bottom | Greiner bio-one | 655090 | |
| 96-well fast thermal cycling plates | Life Technologies Europe BV | 4346907 | |
| 96-well HTS Fluoroblok Transwell plate | Corning | 351162 | |
| 96-well HTS Transwell plates (Table 1) | Corning | 7369 | |
| 96-well transparent culture plate | Greiner bio-one | 655180 | |
| A83-01 | Bio-Techne Ltd | 2939 | |
| Accutase Cell Dissociation Reagent | Life Technologies Europe BV | A11105-01 | Cell dissociation reagent 2 |
| Advanced DMEM/F-12 | Life Technologies Europe BV | 12634028 | |
| B27 supplement | Life Technologies Europe BV | 17504001 | |
| Cell culture microscope (light / optical microscope) | Leica | ||
| CellTiter-Glo | Promega | G9683 | |
| Centrifuge | Eppendorf | ||
| CO2 incubator | PHCBI | ||
| DAPT | Sigma-Aldrich | D5942 | |
| DEPC treated H2O | Life Technologies Europe BV | 750024 | |
| Dulbecco's phosphate-buffered saline (DPBS) with Ca2+ and Mg2+ | Life Technologies Europe BV | 14040091 | |
| DPBS, powder, no calcium, no magnesium | Life Technologies Europe BV | 21600069 | |
| EnzChek Lysozyme Assay Kit | Life Technologies Europe BV | E22013 | |
| EVOM2 meter with STX electrode | WTI | ||
| Gastrin | Bio-Techne Ltd | 3006 | |
| Glass pipettes | Volac | ||
| GlutaMAX | Life Technologies Europe BV | 35050038 | |
| hEGF | Peprotech | AF-100-15 | |
| HEPES | Life Technologies Europe BV | 15630056 | |
| Human Noggin | Peprotech | 120-10C | |
| Human Rspo3 | Bio-Techne Ltd | 3500-RS/CF | |
| IWP-2 | Miltenyi Biotec | 130-105-335 | |
| Ki67 primary antibody | Sanbio | BSH-7302-100 | |
| Ki67 secondary antibody | Agilent | K400111-2 | |
| Kova International Glasstic Slide with Counting grids | Fisher Emergo | 10298483 | |
| Laminar flow hood | Thermo scientific | ||
| Lucifer Yellow CH dilithium salt | Sigma-Aldrich | L0259 | |
| Matrigel, Growth Factor Reduced (GFR) | Corning | 356231 | extracellular matrix (ECM) |
| MicroAmp Fast 8-Tube Strip, 0.1 mL | Life Technologies Europe BV | 4358293 | |
| MicroAmp Optical 8-Cap Strips | Life Technologies Europe BV | 4323032 | |
| Microcentrifuge tubes | Eppendorf | 0030 120 086 | |
| Micropipettes (1000, 200, and 20 µL) | Gilson | ||
| Microtome | Leica | ||
| MUC2 primary antibody | Santa Cruz Biotechnology | sc-15334 | |
| MUC2 secondary antibody | VWR | VWRKS/DPVR-HRP | |
| Multichannel pipette (200 µL) | Gilson | ||
| N-acetylcysteine | Sigma-Aldrich | A9165 | |
| NGS Wnt | U-Protein Express | N001-0.5mg | |
| Nicotinamide | Sigma-Aldrich | N0636 | |
| Oligonucleotide ALPI1/Forward | Custom-made | GGAGTTATCCTGCTCCCCAC | |
| Oligonucleotide ALPI1/Reverse | Custom-made | CTAGGAGGTGAAGGTCCAACG | |
| Oligonucleotide LGR5/Forward | Custom-made | ACACGTACCCACAGAAGCTC | |
| Oligonucleotide LGR5/Reverse | Custom-made | GGAATGCAGGCCACTGAAAC | |
| Oligonucleotide MUC2/Forward | Custom-made | AGGATCTGAAGAAGTGTGTCACTG | |
| Oligonucleotide MUC2/Reverse | Custom-made | TAATGGAACAGATGTTGAAGTGCT | |
| Oligonucleotide TBP/Forward | Custom-made | ACGCCGAATATAATCCCAAGCG | |
| Oligonucleotide TBP/Reverse | Custom-made | AAATCAGTGCCGTGGTTCGTG | |
| Optical adhesive covers | Life Technologies Europe BV | 4311971 | |
| PD0325901 | Stemcell Technologies | 72184 | |
| Penicillin/streptomycin | Life Technologies Europe BV | 15140122 | |
| Plate shaker | Panasonic | ||
| PowerUp SYBR Green Master Mix | Fisher Emergo | A25776 | |
| Primocin | InvivoGen | ANT-PM-2 | antimicrobial formulation for primary cells |
| Qubit RNA HS Assay Kit | Life Technologies Europe BV | Q32852 | |
| Reagent reservoir for multichannel pipet | Sigma-Aldrich | CLS4870 | |
| REMS AutoSampler with 24-probe or 96C-probe | WTI | ||
| Richard-Allan Scientific Alcian Blue/PAS Special Stain Kit | Thermo scientific | 87023 | |
| RNase-Free DNase Set | Qiagen | 79254 | |
| RNeasy Mini Kit | Qiagen | 74106 | |
| SB202190 | Sigma-Aldrich | S7076 | |
| Serological pipettes | Greiner bio-one | 606180 / 607180 / 760180 | |
| Serological pipettor (Pipet-Aid) | Drummond | ||
| Single edge razor blade | GEM Scientific | ||
| Superscript 1st strand system for RT-PCR | Life Technologies Europe BV | 11904018 | |
| Tecan Spark 10M plate reader | Tecan | ||
| Trypan Blue Solution, 0.4% | Life Technologies Europe BV | 15250-061 | |
| TrypLE Express Enzyme (1x) | Life Technologies Europe BV | 12605-010 | Cell dissociation reagent 1 |
| Water bath | Grant | ||
| Y27632 (ROCK inhibitor) | AbMole | M1817 |
References
- Haegebarth, A., Clevers, H. Wnt signaling, lgr5, and stem cells in the intestine and skin. The American Journal of Pathology. 174 (3), 715-721 (2009).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. V. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9 (8), 1909 (2020).
- Martínez-Maqueda, D., Miralles, B., Recio, I., Verhoeckx, K. HT29 Cell Line. The Impact of Food Bio-Actives on Gut Health: In Vitro and Ex Vivo Models. , 113-124 (2015).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Huch, M., et al. In vitro expansion of single Lgr5(+) liver stem cells induced by Wnt-driven regeneration. Nature. 11 (2), 179-194 (2013).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 1-20 (2019).
- Karthaus, W. R., et al. Identification of multipotent luminal progenitor cells in human prostate organoid cultures. Cell. 159 (1), 163-175 (2014).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Van De Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Driehuis, E., et al. Pancreatic cancer organoids recapitulate disease and allow personalized drug screening. Proceedings of the National Academy of Sciences of the United States of America. 116 (52), 26580-26590 (2019).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- d'Aldebert, E., et al. Characterization of human colon organoids from inflammatory bowel disease patients. Frontiers in Cell and Developmental Biology. 8, 363 (2020).
- Dotti, I., et al. Alterations in the epithelial stem cell compartment could contribute to permanent changes in the mucosa of patients with ulcerative colitis. Gut. 66 (12), 2069-2079 (2017).
- VanDussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. 64 (6), 911-920 (2015).
- Noel, G., et al. A primary human macrophage-enteroid co-culture model to investigate mucosal gut physiology and host-pathogen interactions. Scientific Reports. 7, 45270 (2017).
- Bartfeld, S., et al. In vitro expansion of human gastric epithelial stem cells and their responses to bacterial infection. Gastroenterology. 148 (1), 126-136 (2015).
- van Es, J. H., et al. Wnt signalling induces maturation of Paneth cells in intestinal crypts. Nature Cell Biology. 7 (4), 381-386 (2005).
- van Es, J. H., et al. Dll1 marks early secretory progenitors in gut crypts that can revert to stem cells upon tissue damage. Nature Cell Biology. 14 (10), 1099-1104 (2012).
- de Lau, W. B. M., Snel, B., Clevers, H. C. The R-spondin protein family. Genome Biology. 13 (3), 1-10 (2012).
- Basak, O., Beumer, J., Wiebrands, K., Seno, H., van Oudenaarden, A., Clevers, H. Induced quiescence of Lgr5+ stem cells in intestinal organoids enables differentiation of hormone-producing enteroendocrine cells. Cell Stem Cell. 20 (2), 177-190 (2017).
- Beumer, J., et al. Enteroendocrine cells switch hormone expression along the crypt-to-villus BMP signalling gradient. Nature Cell Biology. 20 (8), 909-916 (2018).
- Yin, X., Farin, H. F., van Es, J. H., Clevers, H., Langer, R., Karp, J. M. Niche-independent high-purity cultures of Lgr5+ intestinal stem cells and their progeny. Nature Methods. 11 (1), 106-112 (2014).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: An in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments. (120), (2017).
- Miao, Y., et al. Next-generation surrogate Wnts support organoid growth and deconvolute Frizzled pleiotropy in vivo. Cell Stem Cell. 27 (5), 840-851 (2020).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- Blume, L. -. F., Denker, M., Gieseler, F., Kunze, T. Temperature corrected transepithelial electrical resistance (TEER) measurement to quantify rapid changes in paracellular permeability. Die Pharmazie. 65 (1), 19-24 (2010).
- Lea, T., Verhoeckx, K., et al. Caco-2 cell line. The Impact of Food Bio-Actives on Gut Health: In Vitro and Ex Vivo Models. , 103-111 (2015).
- Heo, I., et al. Modelling Cryptosporidium infection in human small intestinal and lung organoids. Nature Microbiology. 3 (7), 814-823 (2018).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved