Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Organoid-abgeleitete Epithel-Monolayer: Ein klinisch relevantes In-vitro-Modell für die Darmbarrierefunktion
In diesem Artikel
Zusammenfassung
Hier beschreiben wir die Herstellung von humanen Organoid-abgeleiteten intestinalen Epithel-Monolayern zur Untersuchung der Darmbarrierefunktion, Permeabilität und des Transports. Da Organoide die ursprüngliche Reaktion des Epithelgewebes auf äußere Reize darstellen, kombinieren diese Modelle die Vorteile der Erweiterbarkeit von Zelllinien und die Relevanz und Komplexität von Primärgewebe.
Zusammenfassung
In der Vergangenheit waren intestinale Epithelmodellsysteme auf transformierte Zelllinien und Primärgewebe beschränkt. Diese Modellsysteme haben inhärente Einschränkungen, da erstere die ursprüngliche Gewebephysiologie nicht getreu darstellen und die Verfügbarkeit der letzteren begrenzt ist. Daher behindert ihre Anwendung die Grundlagen- und Arzneimittelentwicklungsforschung. Adulte Stammzell-basierte Organoide (im Folgenden als Organoide bezeichnet) sind Miniaturen von normalem oder erkranktem Epithelgewebe, aus dem sie gewonnen werden. Sie können sehr effizient aus verschiedenen gastrointestinalen (GI) Traktregionen etabliert werden, haben eine langfristige Erweiterbarkeit und simulieren gewebe- und patientenspezifische Reaktionen auf Behandlungen in vitro. Hier wurde die Etablierung von intestinalen organoidabgeleiteten epithelialen Monoschichten zusammen mit Methoden zur Messung der Integrität, Permeabilität und des Transports der Epithelbarriere, der antimikrobiellen Proteinsekretion sowie der Histologie demonstriert. Darüber hinaus können intestinale Organoid-abgeleitete Monoschichten mit proliferierenden Stamm- und Transit-amplifizierenden Zellen sowie mit wichtigen differenzierten Epithelzellen angereichert werden. Daher stellen sie ein Modellsystem dar, das darauf zugeschnitten werden kann, die Auswirkungen von Verbindungen auf Zielzellen und deren Wirkungsweise zu untersuchen. Obwohl Organoidkulturen technisch anspruchsvoller sind als Zelllinien, können sie, sobald sie sich etabliert haben, Fehler in den späteren Stadien der Arzneimittelentwicklung reduzieren, da sie wirklich die Komplexität des In-vivo-Epithels und die interpatientische Heterogenität darstellen.
Einleitung
Das Darmepithel fungiert als physikalische Barriere zwischen dem luminalen Gehalt des Darms und dem darunter liegenden Gewebe. Diese Barriere besteht aus einer einzigen Epithelschicht von hauptsächlich absorbierenden Enterozyten, die durch Tight Junctions verbunden sind, die starke interzelluläre Verbindungen zwischen benachbarten Zellen herstellen. Diese Zellen bilden eine polarisierte Epithelauskleidung, die die apikale (Lumen) und die basolaterale Seite des Darms trennt und gleichzeitig den parazellulären Transport von verdauten Nährstoffen und Metaboliten reguliert. Neben den Enterozyten tragen auch andere wichtige Epithelzellen wie Kelch-, Paneth- und enteroendokrine Zellen zur intestinalen Homöostase bei, indem sie Schleim, antimikrobielle Peptide bzw. Hormone produzieren. Das Darmepithel wird ständig durch die Teilung von Leucin-reichen wiederholungshaltigen G-Protein-gekoppelten Rezeptor-5-positiven (LGR5+) Stammzellen im Boden von Darmkrypten aufgefüllt, die transit-amplifizierende (TA) Zellen produzieren, die nach oben wandern und sich in andere Zelltypendifferenzieren 1. Eine Störung der intestinalen Epithelhomöostase durch genetische und Umweltfaktoren wie die Exposition gegenüber Nahrungsmittelallergenen, medizinischen Verbindungen und mikrobiellen Krankheitserregern führt zu einer Störung der Darmbarrierefunktion. Diese Bedingungen verursachen mehrere Darmerkrankungen, einschließlich entzündlicher Darmerkrankungen (IBD), Zöliakie und medikamenteninduzierter GI-Toxizität2.
Studien am Darmepithel werden mit verschiedenen In-vitro-Plattformsystemen wie Membraneinsätzen, Organ-on-a-Chip-Systemen, Ussing-Kammern und Darmringen durchgeführt. Diese Plattformen eignen sich für die Etablierung polarisierter epithelialer Monoschichten mit Zugang zu apikalen und basolateralen Seiten der Membran, wobei transformierte Zelllinien oder Primärgewebe als Modelle verwendet werden. Obwohl transformierte Zelllinien, wie die kolorektalen (Adeno-)Karzinom-Zelllinien Caco-2, T84 und HT-29, in der Lage sind, sich bis zu einem gewissen Grad in polarisierte Darmenterozyten oder schleimproduzierende Zellen zu differenzieren, sind sie nicht repräsentativ für das In-vivo-Epithel, da mehrere Zelltypen fehlen und verschiedene Rezeptoren und Transporter abweichend exprimiertwerden 3 . Da Zelllinien von einem einzelnen Spender abgeleitet werden, stellen sie zudem keine interstationäre Heterogenität dar und leiden unter reduzierter Komplexität und physiologischer Relevanz. Obwohl primäre Gewebe, die in Ussing-Kammern und als Darmringe verwendet werden, repräsentativer für die In-vivo-Situation sind, machen ihre begrenzte Verfügbarkeit, kurzfristige Lebensfähigkeit und mangelnde Erweiterbarkeit sie als Medium für Hochdurchsatzstudien (HT) ungeeignet.
Organoide sind in vitro Epithelkulturen, die aus verschiedenen Organen wie Darm, Niere, Leber, Bauchspeicheldrüse und Lunge hergestellt werden. Sie weisen nachweislich eine langfristige, stabile Erweiterbarkeit sowie genetische und phänotypische Stabilität auf und sind daher repräsentative biologische Miniaturen des Epithels des ursprünglichen Organs mit treuen Reaktionen auf äußere Reize 4,5,6,7,8,9. Organoide werden effizient aus entweder reseziertem oder biopsiertem normalem, erkranktem, entzündetem oder krebsartigem Gewebe hergestellt, das heterogene patientenspezifische Reaktionen 10,11,12,13,14,15,16 darstellt. Diese Arbeit zeigt, wie man intestinale Epithelmonoschichten etabliert, die von organoiden Kulturen abgeleitet sind. Monolayer wurden erfolgreich aus Dünndarm-, Kolon- und Rektalorganoidkulturen etabliert. Dieses Modell schafft die Möglichkeit, den Transport und die Permeabilität der Epithelzellen für Medikamente sowie ihre toxikologischen Wirkungen auf das Epithel zu untersuchen. Darüber hinaus ermöglicht das Modell der Kokultur mit Immunzellen und Bakterien, ihre Wechselwirkungen mit dem Darmepithel17,18,19 zu untersuchen. Darüber hinaus kann dieses Modell verwendet werden, um das Ansprechen auf Therapien patientenspezifisch zu untersuchen und Screening-Bemühungen einzuleiten, um nach der nächsten Welle von epithelialen Barriere-fokussierten Therapeutika zu suchen. Ein solcher Ansatz könnte auf die Klinik ausgeweitet werden und den Weg zu personalisierten Behandlungen ebnen.
Obwohl die epithelialen Monoschichten in diesem Protokoll aus normalen Darmorganoiden des Menschen hergestellt werden, kann das Protokoll für andere Organoidmodelle angewendet und optimiert werden. Epithel-Organoid-Monoschichten werden in intestinalem Organoid-Expansionsmedium, das Wnt enthält, kultiviert, um die Stammzellproliferation zu unterstützen und die zelluläre Zusammensetzung der Darmkrypta darzustellen. Darmorganoide können angereichert werden, um verschiedene intestinale Epithelschicksale wie Enterozyten, Paneth-, Kelch- und enteroendokrine Zellen zu haben, indem Wnt-, Notch- und epidermale Wachstumsfaktor (EGF) -Signalwege moduliert werden. Hier werden sie nach der Etablierung von Monoschichten im Expansionsmedium zu differenzierteren Darmepithelzellen getrieben, wie zuvor beschrieben 20,21,22,23,24,25. Für Screening-Zwecke können die Monoschichten abhängig von der Wirkungsweise der interessierenden Verbindung, ihren Zielzellen und den experimentellen Bedingungen in Richtung der Zellzusammensetzung der Wahl getrieben werden, um die Auswirkungen der Verbindung mit relevanten funktionellen Messwerten zu messen.
Protokoll
1. Herstellung von Reagenzien für die Kultur
HINWEIS: Führen Sie alle Schritte in einer Biosicherheitskabine durch und befolgen Sie die Standardrichtlinien für die Arbeit mit Zellkulturen. Ultraviolettes Licht wird 10 Minuten lang verwendet, bevor die Biosicherheitskabine in Betrieb genommen wird. Vor und nach dem Gebrauch wird die Oberfläche der Biosicherheitswerkbank mit einem Seidenpapier gereinigt, das mit 70% Ethanol getränkt ist. Um die Bildung dreidimensionaler Tropfen extrazellulärer Matrix (ECM) zu erleichtern, halten Sie einen vorgewärmten Bestand von 96-, 24- und 6-Well-Platten im Inkubator bei 37 ° C bereit.
- Basale Mediumszubereitung
- Bereiten Sie Basalmedium (BM) in einer 500 ml Advanced Dulbecco's Modified Eagle Medium with Ham's Nutrient Mixture F-12 (Ad-DF) Medium-Flasche vor, indem Sie 5 ml 200 mM Glutamin, 5 ml 1 M 4-(2-hydroxyethil)-1piperazinethansulfonsäure (HEPES) und 5 ml Penicillin/Streptomycin (Pen/Streptoreptokokken)-Lösungen (10.000 U/ml oder 10.000 μg/ml) hinzufügen. Dieser kann mindestens 4 Wochen bei 4 °C im Kühlschrank gelagert werden.
- Wnt-Quellen
- Wnt3a-konditioniertes Medium (Wnt3aCM) nach der zuvor beschriebenen Methode26 herzustellen.
HINWEIS: Vor kurzem wurde ein Surrogat der nächsten Generation Wnt (NGS-Wnt) erzeugt, das auch die Expansion menschlicher Darmorganoide unterstützt,27.
- Wnt3a-konditioniertes Medium (Wnt3aCM) nach der zuvor beschriebenen Methode26 herzustellen.
- Mediumpräparation für Darmorganoid-Basen
HINWEIS: Verwenden Sie alle Wachstumsfaktoren und Reagenzien gemäß den Empfehlungen des Herstellers. Verwenden Sie kleine Aliquots und vermeiden Sie Frost-Tau-Zyklen; Funktionelle Wachstumsfaktoren sind essentiell für eine erfolgreiche Organoidkultur.- Bereiten Sie konzentriertes 2x intestinales Organoid-Basismedium (2x IBM) vor, indem Sie BM mit 1 μM A83-01, 2,5 mM N-Acetylcystein, 2x B27-Ergänzung, 100 ng / ml humanem epidermalem Wachstumsfaktor (hEGF), 10 nM Gastrin, 200 ng / ml hNoggin und 100 μg / ml einer antimikrobiellen Formulierung für Primärzellen (siehe Materialtabelle) ergänzen.
- Aliquot die 2x IBM und bei -20 °C für bis zu 4 Monate einfrieren. Bei Bedarf ein Aliquot über Nacht bei 4 °C oder für mehrere Stunden bei Raumtemperatur (RT) auftauen.
- Zur Herstellung des intestinalen organoiden Expansionsmediums (IEM) ergänzen Sie 2x IBM entweder mit 50% Wnt3aCM oder 50% BM und 0,5 nM NGS-Wnt, 250 ng/ml humanem Rspondin-3 (hRspo3), 10 mM Nicotinamid und 10 μM SB202190.
- Vorbereitung des Darmorganoid-Differenzierungsmediums
- Bereiten Sie das Enterozyten-Differenzierungsmedium (eDM) vor, indem Sie 2x IBM mit 50% BM, 250 ng/ml hRspo3 und 1,5 μM Wnt-Signalweginhibitor (IWP-2) ergänzen. Lagern Sie eDM bis zu 10 Tage bei 4 °C.
- Bereiten Sie ein Kombinationsdifferenzierungsmedium (cDM) vor, indem Sie 2x IBM entweder mit 40% BM und 10% Wnt3aCM oder 50% BM und 0,1 nM NGS-Wnt, 250 ng/mL hRspo3, 10 μM DAPT und 100 nM PD0325901 ergänzen. Lagern Sie cDM bei 4 °C für bis zu 10 Tage.
- Manipulation der extrazellulären Matrix (ECM)
HINWEIS: Bereiten Sie die extrazelluläre Matrix (ECM) (siehe Materialtabelle) gemäß der Empfehlung des Herstellers vor.- Auftauen von ECM über Nacht auf Eis; Übertragen Sie das ECM von der Flasche auf ein konisches 15-ml-Rohr mit einer 5-ml-Pipette, die beide bei -20 ° C vorgekühlt sind. Aliquots nur einmal bei -20 °C wieder einfrieren. Nach dem Auftauen das ECM bis zu 7 Tage bei 4 °C im Kühlschrank aufbewahren. Vor Gebrauch mindestens 30 min auf Eis inkubieren.
HINWEIS: Mischen Sie ECM richtig und stellen Sie sicher, dass es kalt ist, bevor Sie Krypten oder Organoide einbetten.
- Auftauen von ECM über Nacht auf Eis; Übertragen Sie das ECM von der Flasche auf ein konisches 15-ml-Rohr mit einer 5-ml-Pipette, die beide bei -20 ° C vorgekühlt sind. Aliquots nur einmal bei -20 °C wieder einfrieren. Nach dem Auftauen das ECM bis zu 7 Tage bei 4 °C im Kühlschrank aufbewahren. Vor Gebrauch mindestens 30 min auf Eis inkubieren.
2. Organoide Kulturen
- Etablierung von Kulturen aus gefrorenen Organoiden
HINWEIS: Lassen Sie BM RT erreichen und halten Sie ein 12 ml Aliquot, erwärmt auf 37 ° C, bereit, bevor Sie mit dem Auftauen eines Kryovials beginnen, das gefrorene Organoide enthält.- Tauen Sie das Organoid Kryoviale schnell auf, indem Sie es in einem 37 ° C-Wasserbad rühren, bis nur noch ein Eisstreifen übrig bleibt. Geben Sie sofort 500 μL warmes BM tropfenweise in das Kryo und pipettieren Sie es einige Male auf und ab, um das Gefriermedium zu verdünnen und den Inhalt vorsichtig zu mischen.
- Übertragen Sie die Organoide mit einer P1000-Pipette auf eine konische 15-ml-Röhre und fügen Sie weitere 1 ml warmes BM tropfenweise hinzu, während Sie den Boden der Röhre vorsichtig mischen. Pipettieren Sie einige Male auf und ab, um das Gefriermedium zu verdünnen, und mischen Sie den Inhalt sorgfältig.
- Fügen Sie bis zu 12 ml warmes BM tropfenweise zu dem 15 ml konischen Röhrchen hinzu, das die Organoide enthält, und pipettieren Sie mit einer sterilen 10-ml-Pipette auf und ab, um die Organoide sanft zu resuspendieren.
- Die Organoid-Suspension wird 5 min bei 85 × g und 8 °C zentrifugiert. Entsorgen Sie den Überstand vorsichtig, ohne das Pellet zu stören, und suspendieren Sie die Organoide in 30% v/v IEM, ergänzt mit 10 μM Y27632 oder einem anderen Rho-assoziierten spiralförmigen Protein Serin / Threoninkinase-Inhibitor (ROCK-Hemmer). Stellen Sie die Röhre auf Eis.
- Fügen Sie 70% v/v ECM in das 15 ml konische Röhrchen hinzu, das die Organoide enthält. Mischen Sie die Organoid-Suspension, halten Sie die 15 ml konische Röhre auf Eis, und säen Sie 5 μL der Suspension, um die Dichte zu überprüfen (Abbildung 1A). Fahren Sie mit der Beschichtung fort, wenn die Dichte angemessen ist. Wenn die Dichte zu hoch ist, fügen Sie weitere IEM/ECM-Lösungen im gleichen Verhältnis von 30-70% v/v hinzu.
- In jeder Vertiefung einer vorgewärmten 24-Well-Platte werden 50 μL der Organoidsuspension durch Pipettieren von 5 separaten Tropfen von 10 μL entkernt (Abbildung 1B). Drehen Sie die Platte auf den Kopf und lassen Sie sie 5 Minuten in der Biosicherheitskabine. Übertragen Sie die Platte noch verkehrt herum in den 37 °C Inkubator und lassen Sie sie weitere 30 Minuten stehen.
- Fügen Sie 500 μL IEM mit 10 μM ROCK-Inhibitor zu jeder Vertiefung hinzu und übertragen Sie die Platte in den Inkubator. Bild einen Tropfen regelmäßig, um das Wachstum zu überwachen, und aktualisieren Sie IEM alle 2-3 Tage, indem Sie das alte Medium absaugen und 500 μL frisches IEM hinzufügen.
- Lassen Sie die Organoide passieren, sobald sie sich nach dem Auftauen ordnungsgemäß erholt haben und die richtige Größe für die Verarbeitung erreicht haben (Abbildung 1C), wie in Abschnitt 2.2 beschrieben.
- Passaging von Darmorganoiden
HINWEIS: Kühlen Sie das ECM mindestens 30 Minuten lang auf Eis und halten Sie das IEM vor dem Gebrauch mindestens 1 Stunde lang auf RT.- Verwenden Sie das Medium aus einer Kulturquelle, um die Organoidkuppeln mit einer 1250 μL Low-Retention-Filterspitze aufzubrechen und den Bohrlochinhalt auf ein beschriftetes 15 mL konisches Rohr zu übertragen. Waschen Sie den Brunnen mit 1 ml BM und geben Sie ihn in den gleichen 15 ml konischen Schlauch.
- Wiederholen Sie die Schritte 2.2.1 und 2.2.2 mit allen anderen Vertiefungen (maximal eine halbe Platte oder 600 μL ECM-Tropfen können gewaschen und zu einem konischen 15-ml-Röhrchen hinzugefügt werden).
- Fügen Sie BM hinzu, um das Rohr bis zu 12 ml zu füllen, und pipettieren Sie 10x mit einer 10 ml Pipette auf und ab. Zentrifuge bei 85 × g für 5 min bei 8 °C.
- Bevor Sie den BM entfernen, überprüfen Sie unter dem Mikroskop, ob alle Organoide am Boden des 15 ml konischen Röhrchens pelletiert sind (Abbildung 1D). Wenn das Organoidpellet nicht von ECM überlagert wird oder die ECM-Schicht entweder sauber ist oder nur Ablagerungen, einzelne Zellen oder sehr wenige Organoide im Vergleich zu den pelletierten Organoiden enthält, aspirieren Sie den Überstand und pipettieren Sie das ECM, das das Organoidpellet überlagert, sehr vorsichtig mit einer P200-Pipette aus.
HINWEIS: Organoide können im ECM eingeschlossen werden und aufgrund der geringen Zentrifugationskraft nicht als kompaktes Pellet sedimentieren. Enthält das ECM Organoide, so wird das Röhrchen 5 min lang bei 8 °C erneut bei 450 × g zentrifugiert und der Überstand vorsichtig wie in 2.2.4 beschrieben entfernt. Wenn mehrere konische 15-ml-Röhrchen vorhanden sind, können diese nach Schritt 2.2.4 gepoolt werden. - Fügen Sie jedem Pellet 1 ml BM hinzu (mit einem Volumen von 50-200 μL, abhängig von der Organoidkultur und -dichte) und resuspendieren Sie vorsichtig. Pipetieren Sie die Organoide mindestens 5x auf und ab, um sie zu scheren und Schaumbildung zu vermeiden. Überprüfen Sie unter dem Mikroskop, ob die Organoide gestört sind (Abbildung 2A). Wenn die Organoide gestört sind, fahren Sie mit Schritt 2.2.7 fort. Wenn die Organoide nicht gestört sind, pipettieren Sie sie noch 5x. Berühren Sie diesmal die Wand des Kunststoffrohrs mit der Pipettenspitze, um mehr mechanische Kraft auszuüben, um die Organoide zu stören.
HINWEIS: Das mechanische Scheren von zystischen (Abbildung 1C) und knospenden (Abbildung 1E) Organoiden ist entweder mit einer 200 μL oder 10 μL Kunststoffpipettenspitze möglich, die auf einer 1250 μL Filterspitze mit geringer Retention angebracht ist (Abbildung 1F), abhängig von dem Volumen, das zum Stören der Organoide erforderlich ist. Die Verwendung einer verengten Glaspipette (Abbildung 1F) wird empfohlen, wenn mehr als 200 μL ECM, die die Organoide enthalten, verarbeitet werden (eine Vertiefung einer 6-Well-Platte oder 4 Wells einer 24-Well-Platte). - Überprüfen Sie erneut unter dem Mikroskop, ob die Organoide gestört sind. Wenn Sie gestört werden, fahren Sie mit dem nächsten Schritt fort. Wenn nicht, pipettieren Sie die Organoide bis zu 20x und überprüfen Sie die Organoide regelmäßig unter dem Mikroskop. Wenn die Organoide immer noch nicht gestört sind, fügen Sie 25% v / v-Zelldissoziationsreagenz 1 (siehe Materialtabelle) zur Suspension hinzu, inkubieren Sie im Wasserbad bei 37 ° C für 2 min und pipettieren Sie die Organoide bis zu 20x, wobei Sie die Organoide regelmäßig unter dem Mikroskop überprüfen, um sicherzustellen, dass sie nicht zu einzelnen Zellen verdaut werden.
- Fügen Sie dem 15 ml konischen Schlauch bis zu 12 ml BM hinzu und waschen Sie das Organoidpellet durch Pipettieren nach oben und unten. Zentrifuge bei 85 × g für 5 min bei 8 °C. Verwerfen Sie den Überstand und passen Sie die Endkonzentration auf 70% v/v ECM an, indem Sie dem Organoidpellet IEM und ECM hinzufügen.
- Beginnen Sie mit der Resuspension des Organoidpellets mit dem doppelten Volumen von IEM / ECM, das für den Durchgang gesammelt wurde, und säen Sie 5 μL der Suspension, um die Dichte zu überprüfen. Setzen Sie die Beschichtung fort, wenn die Dichte angemessen ist (Abbildung 2B); Fügen Sie weitere IEM/ECM-Lösungen hinzu, wenn die Dichte zu hoch ist. Fügen Sie 200 μL der Suspension zu jeder Vertiefung einer vorgewärmten 6-Well-Platte hinzu, wodurch separate Tropfen von 10 μL Volumen entstehen.
- Drehen Sie die Platte auf den Kopf und lassen Sie sie 5 Minuten in der Biosicherheitskabine. Übertragen Sie die Platte noch verkehrt herum in den 37 °C Inkubator und lassen Sie sie für weitere 30 Minuten stehen. Fügen Sie 2 ml IEM mit 10 μM ROCK-Inhibitor zu jeder Vertiefung hinzu und übertragen Sie die Platte in den Inkubator.
- Bild einen Tropfen regelmäßig, um das Wachstum zu überwachen, und aktualisieren Sie IEM alle 2-3 Tage, indem Sie das alte Medium absaugen und 2 ml frisches IEM hinzufügen.
- Passaging von Darmorganoiden zur epithelialen Monolayer-Präparation
- Passage Organoide 3 Tage vor der Ernte für die Monolayer-Vorbereitung, indem das gleiche Passaging-Protokoll wie in Abschnitt 2.2 beschrieben wird, mit einer Ausnahme. In Schritt 2.2.7 werden die Organoide im 1-1,5-fachen des Ausgangsvolumens von IEM/ECM resuspendiert, um eine höhere Dichte und ein höheres Expansionspotenzial zu haben, wenn sie für die Monolayer-Vorbereitung geerntet werden (Abbildung 3A).
3. Epithelische Monolayer-Zubereitung
- Kulturepitheliale Monoschichten auf 24-Well- und 96-Well-Membraneinsätzen mit einer Vielzahl von verfügbaren Plattentypen (Tabelle 1). Verwenden Sie HTS-Membraneinsätze (High-Throughput System) für beide Größen, da diese eine integrierte Schale mit den Membraneinsätzen und eine Empfängerplatte enthalten. Für das 24-Well-Format ist auch die Verwendung von Platten mit separat abnehmbaren Membraneinsätzen möglich.
HINWEIS: Verschiedene Membrantypen (Polyethylenterephthalat (PET) oder Polycarbonat) und Porengrößen (0,4-8,0 μm) sind verfügbar und können je nach experimentellem Bedarf verwendet werden. Monolayer können nur dann mit Hellfeldern abgebildet werden, wenn Einsätze mit PET-Membranen verwendet werden. Lichtdichte Membranen blockieren das Austreten von fluoreszierendem Licht vom apikalen zum basolateralen Kompartiment und können berücksichtigt werden, wenn der dynamische Transport oder die Permeabilität von fluoreszierend markierten Substraten untersucht wird. Das aktuelle Protokoll verwendet 24-Well-Membraneinsätze; Anpassungen für 96-Well-Membraneinsätze sind in Abschnitt 5 beschrieben. Abhängig von der Dichte, Morphologie und Größe der Organoide (Abbildung 3A) reichen 6 Vertiefungen einer 6-Well-Platte (wie in Abschnitt 2.3 gesetzt) aus, um eine volle 24-Well-Platte mit Membraneinsätzen zu säen. - Beschichtung von Membraneinsätzen mit ECM
HINWEIS: Wenn es Zweifel gibt, genügend Zellen zu haben, beschichten Sie die Einsätze nach dem Zählen der Zellen. Dies soll unnötige Beschichtungen und den Verlust der teuren Membraneinsätze vermeiden.- Legen Sie die Membraneinsätze in die Trägerplatte in der Biosicherheitswerkbank. Verdünnen Sie das ECM 40x in der phosphatgepufferten Kochsalzlösung (DPBS) von Dulbecco mit Ca 2+ und Mg2+ und pipettieren Sie 150 μL des verdünnten ECM in das apikale Kompartiment jedes Einsatzes. Bebrüten Sie die Platte bei 37 °C für mindestens 1 h.
- Vorbereitung der Zellen für die Aussaat
- Vorgewärmte Aliquoten des Zelldissoziationsreagenzes 2 im Wasserbad (37 °C). Bereiten Sie 2 ml des Reagenzes für jede Vertiefung einer 6-Well-Platte vor.
- Das Kulturschild, das die (in Abschnitt 2.3 hergestellten) Organoide enthält, wird vom Inkubator in die Biosicherheitswerkbank überführt. Verarbeiten Sie die Organoide, wie in den Schritten 2.2.1.-2.2.4 beschrieben. Poolen Sie nicht mehrere Röhren in einer Röhre.
- Füllen Sie das Röhrchen, das Organoide aus maximal 3 Vertiefungen einer 6-Well-Platte enthält, bis zu 12 ml mit DPBS (ohne Ca 2 + und Mg2 +), und pipettieren Sie 10x mit einer 10 ml Pipette auf und ab. Bei 85 × g 5 min bei 8 °C zentrifugieren und den Überstand absaugen, ohne das Organoidpellet zu stören.
- Fügen Sie 2 ml des vorgewärmten Zelldissoziationsreagenzes 2 pro Vertiefung einer 6-Well-Platte hinzu, die als Ausgangsmaterial verwendet wird, und resuspendieren Sie. Die Röhrchen diagonal oder horizontal für 5 min im Wasserbad bei 37 °C inkubieren, um ein Absinken der Organoide auf den Boden des Rohres zu verhindern.
- Pipettieren Sie 10x mit einer 5 ml sterilen Kunststoffpipette oder einer P1000-Pipette auf und ab, abhängig vom Gesamtvolumen des Zelldissoziationsreagenzes. Überprüfen Sie die Organoidsuspension unter dem Mikroskop, um zu sehen, ob sich eine Mischung aus Einzelzellen und einigen Zellklumpen, bestehend aus 2-4 Zellen, gebildet hat (Abbildung 3B). Falls erforderlich, setzen Sie den Aufschluss fort, indem Sie die Schritte 3.3.4-3.3.5 wiederholen (Volumen des Zelldissoziationsreagenzes nicht erhöhen), bis die Mischung ähnlich wie in Abbildung 3B aussieht.
HINWEIS: Vermeiden Sie es, die Organoide vollständig auf einzelne Zellen zu verdauen. Es ist notwendig, einige kleine Gruppen von Zellen zu haben (dh Gruppen von 2-4 Zellen). - Stoppen Sie die Zelldissoziation, indem Sie bis zu 12 ml BM einschließlich 10 μM ROCK-Inhibitor zur Zellsuspension hinzufügen. Bei 450 × g 5 min bei 8 °C zentrifugieren und den Überstand abspritzen, ohne das Zellpellet zu stören. Wenn Sie die gleiche Organoidkultur in mehreren konischen 15-ml-Röhrchen handhaben, sammeln Sie die Zellpellets und resuspendieren Sie sie in 12 ml BM.
- Filtern Sie die Zellsuspension durch ein 40-μm-Sieb, das mit BM vorbenetzt ist, und ernten Sie den Durchfluss in einem konischen 50-ml-Rohr. Waschen Sie das Sieb mit 10 ml BM und ernten Sie den Durchfluss in das gleiche 50 ml konische Rohr.
- Übertragen Sie die belastete Zellsuspension in zwei neue 15 ml konische Röhrchen. Bei 450 × g 5 min bei 8 °C zentrifugieren und den Überstand abspritzen, ohne das Zellpellet zu stören. Resuspendieren Sie die Zellen in 4 ml IEM, ergänzt mit 10 μM ROCK-Inhibitor pro voller Kulturplatte, die als Ausgangsmaterial verwendet wird.
- Mischen Sie eine kleine Menge Zellsuspension im Verhältnis 1: 1 mit Trypanblau zum Zählen. Zählen Sie die lebenden, nicht blauen Zellen (Abbildung 3C), und berechnen Sie die Gesamtzahl der lebenden Zellen. Zählen Sie in kleinen Klumpen jede einzelne Zelle.
- Bereiten Sie eine Zellsuspension vor, die 3 ×10 6 lebende Zellen pro ml IEM enthält, ergänzt mit einem 10 μM ROCK-Inhibitor.
- Aussaatzellen auf Polyester-Membraneinsätzen
- Saugen Sie DPBS vorsichtig von den ECM-beschichteten Einsätzen ab (Schritt 3.2.1), während die Platte horizontal gehalten wird. Pipette 800 μL IEM ergänzt mit ROCK-Inhibitor in jedes basolaterale Kompartiment. 150 μL der in Schritt 3.3.10 vorbereiteten Zellsuspension werden tropfenweise auf die ECM-beschichtete Membran im apikalen Kompartiment pipettiert. Stellen Sie sicher, dass Sie pro Platte mindestens einen "leeren" Brunnen mit nur BM haben.
- Sobald die Zellen auf der Membran sedimentiert sind, messen Sie den transepithelialen elektrischen Widerstand (TEER), wie in Abschnitt 4.1 beschrieben, und bilden Sie die Membraneinsätze mit einem Mikroskop ab. Stellen Sie die Platte bei 37 °C und 5% CO2 in den Inkubator. Messen Sie TEER jeden Tag und erfassen Sie regelmäßig Bilder, um die Monolayer-Bildung zu überwachen (Abbildung 4A-D).
- Erfrischende Monolayer
HINWEIS: Erfrischen Sie das Medium alle 2-3 Tage und halten Sie sich an die folgende Reihenfolge, um einen positiven hydrostatischen Druck über den Zellen aufrechtzuerhalten und zu verhindern, dass Zellen von der Membran abgestoßen werden. Achten Sie beim Auffrischen des Mediums darauf, dass die Monolayer, die beim Absaugen des Mediums sichtbar ist, nicht durch die Pipettenspitze beschädigt wird.- Entfernen Sie das Medium aus den basolateralen Kompartimenten der Platte, die die Membraneinsätze enthält. Saugen Sie dann das Medium vorsichtig aus den apikalen Kompartimenten der Membraneinsätze ab.
- Fügen Sie 150 μL frisches IEM tropfenweise zu jedem apikalen Fach hinzu und fügen Sie dann 800 μL frisches IEM zu jedem basolateralen Kompartiment hinzu.
- Anreicherung der Monoschicht für gewünschte Darmepithelzelltypen
- Lassen Sie zu, dass die Monoschicht im IEM konfluent wird, was einem TEER-Wert von etwa 100 Ω·cm² entspricht (wie in Schritt 4.1.1.4 berechnet). Überprüfen Sie unter dem Mikroskop, ob sich die Monoschichten vollständig gebildet haben (Abbildung 4D) und ob keine Löcher vorhanden sind (siehe Abbildung 4B,C).
- Entfernen Sie die IEM vorsichtig aus den basolateralen und apikalen Kompartimenten der Membraneinsätze und ersetzen Sie sie entweder durch eDM oder cDM, wie in Abschnitt 1.4 vorbereitet. Kultivieren Sie die Monoschicht für weitere 3-4 Tage in dem spezifischen Differenzierungsmedium, um die Organoidzellen mit dem gewünschten spezifischen Zelltyp anzureichern. Aktualisieren Sie das Medium alle 2-3 Tage, wie in Abschnitt 3.4 beschrieben.
- Messen Sie TEER täglich und erfassen Sie auf Wunsch regelmäßig Bilder (Abbildung 5A-C).
HINWEIS: Der TER-Wert, der eine vollständig organisierte, angereicherte Monoschicht angibt, variiert je nach Organoidkultur. Typischerweise steigen die TEER-Werte auf 600 und können nach 3 Tagen in Differenzierungsmedien bis zu 1000 Ω·cm 2 (wie in Schritt 4.1.1.4 berechnet) ansteigen und sind für 3-5 Tage stabil.
4. Epithel-Monolayer-Assay-Auslesungen
- Messung des transepithelialen elektrischen Widerstands (TEER)
HINWEIS: TEER-Messungen werden weithin als Methode zur Analyse der Tight-Junction-Dynamik und der Integrität der Barrierefunktion in biologischen Modellen physiologischer Barrieren, wie z.B. epithelialen Monoschichten28,29, akzeptiert. Der Anstieg des TEER nach der Differenzierung aufgrund erhöhter zellulärer Interaktion an Engstellen kann mit einem manuellen TEER-Messgerät oder einem automatisierten TEER-Messroboter gemessen werden.- Messung von TEER mit einem manuellen TEER-Messgerät
- Reinigen Sie die Elektrode mit 70% Ethanol und lassen Sie sie in der Biosicherheitskabine an der Luft trocknen. Legen Sie die Elektrode in ein Rohr, das BM enthält. Schließen Sie die Elektrode an das manuelle TEER-Messgerät an. Drehen Sie den Funktionsschalter , um in Ohm (Ω) zu messen. Schalten Sie den Netzschalter ein.
- Platzieren Sie die kurze Elektrode im apikalen Fach des Einsatzes, während die lange Elektrode im basolateralen Kompartiment positioniert ist (Abbildung 6A). Vermeiden Sie es, die Monoschicht zu berühren.
- Messen Sie den Widerstand in der Rohbohrung (R-Rohling) und messen Sie dann die verbleibenden Proben (R-Probe) auf die gleiche Weise. Waschen Sie die Elektrode mit BM zwischen Proben mit unterschiedlichen Bedingungen. Reinigen Sie die Elektrode zuerst mit Demi-Wasser und dann mit 70% Ethanol und lassen Sie sie an der Luft trocknen.
- TEER berechnen (Ω·cm 2): [R-Probe (Ω) -R-Rohling (Ω)] × Membranfläche (cm2) (Tabelle 1 und Abbildung 6B).
- Messung von TEER mit einem automatisierten TEER-Messroboter (Table of Materials)
- Führen Sie automatisierte TER-Messungen durch, wenn Sie HTS-Systeme für 96-Well- und 24-Well-HTS-Platten mit Membraneinsätzen verwenden. Verwenden Sie unterschiedliche Elektroden für die TEER-Messung für beide Typen (24- und 96- HTS-Membraneinsätze). Um TEER mit einem automatisierten TER-Messroboter zu messen, befolgen Sie die Anweisungen des Herstellers.
- Messung von TEER mit einem manuellen TEER-Messgerät
- Messung der Integrität und Permeabilität der Epithelbarriere
HINWEIS: Dieses Protokoll führt die Luzifergelb-Permeabilität vom apikalen zum basolateralen Kompartiment als Hinweis auf die Integrität der Monoschicht ein. Dieser Abschnitt beschreibt die Fluoreszenzmessung im basolateralen Kompartiment nach einem 1-stündigen Inkubationsschritt zur Bewertung der Monolayer-Permeabilität und damit der Barriereintegrität. Diese Messung ist ein Endpunkt-Assay und ist besonders nützlich, wenn Verbindungen auf ihre Wirkung auf die Barriereintegrität getestet werden.- Tauen Sie Luzifer Yellow auf Eis auf und lassen Sie BM zu RT gleichen. Für eine 24-Well-Platte mit Membraneinsätzen bereiten Sie 5 ml Arbeitslösung von 60 μM Lucifer Yellow in BM vor.
HINWEIS: Luzifergelb ist lichtempfindlich. Bereiten Sie Verdünnungen in dunklen 1,5 mL sterilen Röhrchen vor und führen Sie alle Schritte mit ausgeschaltetem Licht der Biosicherheitswerkbank durch. - Das Medium wird vorsichtig aus den basolateralen und apikalen Kompartimenten der Membraneinsätze entfernt, wie in Schritt 3.5.1 beschrieben. Falls gewünscht, kratzen Sie eine unbehandelte Monoschicht mit einer Pipettenspitze als Positivkontrolle für Lucifer Yellow-Leckagen durch eine beschädigte Barriere.
- Fügen Sie 150 μL BM mit 60 μM Lucifer Yellow zu jedem apikalen Kompartiment hinzu und fügen Sie 800 μL BM ohne Lucifer Yellow zu jedem basolateralen Kompartiment hinzu. Legen Sie die Platte auf einen Shaker bei 37 °C, 50 U/min für 60 min.
- In der Zwischenzeit ist eine Standardkurve von Luzifergelb in BM vorzubereiten, beginnend mit der in Schritt 4.2.1 vorbereiteten Arbeitslösung. In jedem Schritt 1:3 verdünnen, bis eine Konzentration von 3 nM erreicht ist. Schließen Sie eine Negativkontrolle ein (nur BM).
- Übertragen Sie 100 μL jedes Standards in dreifacher Ausfertigung auf eine transparente 96-Well-Platte. Nach 60-minütiger Inkubation werden die Membraneinsätze entfernt und 100 μL aus jeder basolateralen Vertiefung (Schritt 4.2.3) dreifach auf die transparente 96-Well-Platte übertragen. Messen Sie die Fluoreszenz der Platte mit einem Plattenleser bei einer Anregungswellenlänge von 430 nm und einer Emissionswellenlänge von 530 nm.
- Nach der Korrektur des negativen Kontrollwerts (nur BM) verwenden Sie die Standardkurvenwerte, um die Luzifergelbkonzentration im basolateralen Kompartiment (Endempfängerkonzentration (μM)) zu berechnen.
- Berechnen Sie den scheinbaren Permeabilitätskoeffizienten (Papp) nach folgender Formel (Abbildung 6C):

- Verwenden Sie für eine 24-Well-Platte mit Membraneinsätzen die folgende Formel:
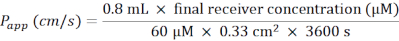
- Tauen Sie Luzifer Yellow auf Eis auf und lassen Sie BM zu RT gleichen. Für eine 24-Well-Platte mit Membraneinsätzen bereiten Sie 5 ml Arbeitslösung von 60 μM Lucifer Yellow in BM vor.
- Fixierung von Monolayern und Vorbereitung von Paraffinblöcken für die Histologie
HINWEIS: Epithel-Monoschichten können für die histologische Färbung zur Bewertung ihrer zellulären Zusammensetzung, Polarität und Expression verschiedener Proteine von Interesse wie Sperrproteine, Proliferation oder Differenzierungsmarker verwendet werden. In diesem Abschnitt wird die Vorbereitung von Paraffinblöcken für die histologische Färbung beschrieben.- Das Medium wird vorsichtig aus den basolateralen und apikalen Kompartimenten der Membraneinsätze entfernt, wie in den Schritten 3.5.1 beschrieben.
- Waschen Sie die Monoschichten, indem Sie 150 μL DPBS (ohne Ca 2+ und Mg2+) zu jedem apikalen Kompartiment und 800 μL zu jedem basolateralen Kompartiment hinzufügen. Saugen Sie das DPBS vorsichtig erneut ab, zuerst aus dem basolateralen Kompartiment und dann aus dem apikalen Fach.
HINWEIS: Das basolaterale Fach bleibt ab diesem Schritt leer. - In einem Abzug 150 μL 4% Paraformaldehyd in jedes apikale Kompartiment geben und 30 min bei RT inkubieren.
HINWEIS: Führen Sie ab diesem Schritt alle Aktionen in diesem Abschnitt in einem Abzug aus, da Paraformaldehyd giftig ist. - Saugen Sie das Fixiermittel vorsichtig aus den apikalen Kompartimenten der Membraneinsätze ab und entsorgen Sie es als flüssigen Halogenabfall.
HINWEIS: Entsorgen Sie ab diesem Schritt alle flüssigen Abfälle als flüssigen Halogenabfall. - Waschen Sie die Monoschichten, indem Sie 200 μL DPBS (ohne Ca 2+ und Mg2+) in jedes apikale Fach geben, und saugen Sie das DPBS erneut vorsichtig ab. Wiederholen Sie diesen Schritt noch einmal.
- 200 μL 25% Ethylalkohol (EtOH) in jedes apikale Kompartiment geben und 15 min bei RT inkubieren. Nach 15 min die 25% EtOH vorsichtig aus den apikalen Kompartimenten der Membraneinsätze absaugen. Wiederholen Sie dies mit 50% EtOH-Lösung und anschließend mit 70% EtOH-Lösung.
- Fügen Sie 200 μL 70% EtOH zu jedem apikalen Fach hinzu und wickeln Sie die Platte mit Parafilm um. Lagern Sie es bei 4 °C bis zum weiteren Gebrauch.
- Saugen Sie die 70% EtOH vorsichtig ab und verwenden Sie ein Skalpell, um die Monolayer-Membranen vorsichtig von den Einsätzen zu schneiden. Von der basolateralen Seite um den Rand des Einsatzes schneiden.
- Bereiten Sie Paraffinblöcke nach dem Standardverfahren vor.
- Wenn das Paraffin noch warm ist, nehmen Sie die Monoschicht mit einer Pinzette aus dem Paraffin und legen Sie sie auf eine vorgekühlte Oberfläche.
- Achten Sie darauf, die Monoschicht nicht zu beschädigen. Schneiden Sie die Monoschicht mit einer einzigen Kantenklinge in zwei Hälften.
- Wenn das Paraffin im Boden der Kassette zu erstarren beginnt, verwenden Sie eine beheizte Pinzette, um die beiden Monolayer-Teile in das Paraffin zu legen, nebeneinander mit der geraden Seite nach unten und in vertikaler Richtung, um sicherzustellen, dass die Monoschicht im Coupé vertikal ist.
- Wenn die Paraffinblöcke fertig sind, schneiden Sie die Blöcke mit einem Mikrotom ab und machen Sie nach dem Standardverfahren Objektträger mit 4 μm dicken Abschnitten. Stellen Sie sicher, dass die Monolayer vertikal im Coupé landen.
- Histologische Flecken wie zuvor beschriebendurchführen 7,9. Verwenden Sie Hämatoxylin und Eosin (H & E), Ki67, Mucin-2 (MUC2) und Alcian Blue, um die allgemeine Morphologie, proliferative Zellen, Schleimproduktion und Becherzellen anzuzeigen (Abbildung 6E).
HINWEIS: Zusätzliche Differenzierungsmarker, wie Lysozym für Paneth-Zellen, können ebenfalls verwendet werden. Dieser Marker ist in Abbildung 6E nicht dargestellt, da Paneth-Zellen im Dünndarmepithel und nicht im Dickdarmepithel vorhanden sind.
- Sekretierte Proteinmessung im mittleren Überstand
- Messen Sie den Lysozymgehalt im apikalen Überstand der ilealen Monoschichten (siehe Abbildung 6D) mit dem in der Materialtabelle aufgeführten Kit. Messen Sie auf Wunsch die Spiegel verschiedener Zytokine und anderer interessanter Proteine.
- Genexpressionsanalyse
- Quantifizierung der Auswirkungen der Differenzierungsmedien auf die Expression von Epithelzellmarkergenen mittels quantitativer Reverse-Transkriptions-Polymerase-Kettenreaktion (qRT-PCR).
- Lyse der Monoschichten in 350 μL RNA-Lysepuffer gefolgt von RNA-Isolierung gemäß den Anweisungen des Herstellers. Führen Sie cDNA-Synthese und qPCRs durch, wie zuvorbeschrieben 7,9, unter Verwendung der in der Materialtabelle aufgeführten cDNA-Synthesekits, Master-Mix und Oligonukleotide.
- Quantifizierung der Auswirkungen der Differenzierungsmedien auf die Expression von Epithelzellmarkergenen mittels quantitativer Reverse-Transkriptions-Polymerase-Kettenreaktion (qRT-PCR).
5. Hochskalierung auf 96-Well-Platten mit Membraneinsätzen
HINWEIS: Bereiten Sie epitheliale Monoschichten für Arzneimittelscreenings mit höherem Durchsatz oder mehrere mittlere Bedingungen mit HTS 96-Well-Platten vor, die Membraneinsätze enthalten.
- Anpassungen bei der Vorbereitung von Monolayern im 96-Well-Format
- Befolgen Sie alle in diesem Protokoll beschriebenen Schritte für 24-Well-Platten, die Membraneinsätze enthalten, Volumen und Zellnummern zu den in Tabelle 1 beschriebenen ändern. Für die Herstellung von Monoschichten auf 96-Well-Platten mit Membraneinsätzen gehen Sie wie in Abschnitt 3 beschrieben mit den folgenden Unterschieden vor.
- Ungefähr 9 Vertiefungen einer 6-Well-Kulturplatte mit Organoiddichte, dargestellt in Abbildung 3A, werden benötigt, um eine vollständige 96-Well-Platte mit Membraneinsätzen zu säen. In Schritt3.2.1 beschichten Sie die Membranen mit 67 μL 40x verdünntem ECM in DPBS (mit Ca 2+ und Mg2+).
- In Abschnitt 3.5 wird zunächst die integrierte Platte der Membraneinsätze auf eine andere 96-Well-Platte übertragen, um eine mittlere Erfrischung sowohl der apikalen als auch der basolateralen Kompartimente zu ermöglichen.
- Befolgen Sie alle in diesem Protokoll beschriebenen Schritte für 24-Well-Platten, die Membraneinsätze enthalten, Volumen und Zellnummern zu den in Tabelle 1 beschriebenen ändern. Für die Herstellung von Monoschichten auf 96-Well-Platten mit Membraneinsätzen gehen Sie wie in Abschnitt 3 beschrieben mit den folgenden Unterschieden vor.
Ergebnisse
Abbildung 1A zeigt ein repräsentatives Hellfeldbild von Darmorganoiden nach dem Auftauen aus einem Kryovia. Es ist wichtig, Organoide mit hoher Dichte aufzutauen, um eine optimale Erholung zu gewährleisten. Organoide sind in 24- oder 6-Well-Platten in ECM-Domes von etwa 10 μL plattiert (Abbildung 1B). Die meisten normalen Darmorganoide haben eine zystische Morphologie. Nach der Erholung vom Auftauprozess wachsen die Organoide zu einer größeren Größe heran...
Diskussion
Dieses Protokoll beschreibt die allgemeine Manipulation und Aufrechterhaltung von Darmorganoiden sowie die Herstellung und mögliche Anwendungen von epithelialen Monoschichten, die von diesen Organoiden abgeleitet sind. Bisher wurden Monoschichten erfolgreich aus dem Zwölffingerdarm, dem Ileum und verschiedenen Regionen von Dickdarmorganoiden hergestellt, die sowohl aus normalem als auch zuvor und aktiv entzündetem Darmgewebe stammen (unveröffentlichte Daten). Die Anwendung von patientenabgeleiteten organoiden Monosch...
Offenlegungen
Die Autoren erklären keinen Interessenkonflikt.
Danksagungen
Diese Arbeit wird unterstützt durch das Topsector Life Sciences & Health - Topconsortium voor Kennis en Innovatie Health~Holland (LSH-TKI) Public-Private Partnerships (PPP) Allowance des niederländischen LSH-Sektors mit der Projektnummer LSHM16021 Organoids als neuartiges Werkzeug für die toxikologische Modellierung der Hubrecht Organoid Technology (HUB) und der HUB-internen Finanzierung für die Abteilung Disease Modeling and Toxicology. Wir danken den Labors von Sabine Middendorp (Abteilung für Pädiatrische Gastroenterologie, Wilhelmina Children's Hospital, UMC, Utrecht) und Hugo R. de Jonge und Marcel J.C. Bijvelds (Abteilung für Gastroenterologie und Hepatologie, Erasmus MC, Rotterdam) für die erste technische Unterstützung beim Aufbau von Monoschichten auf Membraneinsätzen.
Materialien
| Name | Company | Catalog Number | Comments |
| 100% ethanol | Fisher Emergo | 10644795 | |
| 1250, 300, and 20 µL low-retention filter-tips | Greiner bio-one | 732-1432 / 732-1434 / 732-2383 | |
| 15 mL conical tubes | Greiner bio-one | 188271 | |
| 24-well cell culture plates | Greiner bio-one | 662160 | |
| 24-well HTS Fluoroblok Transwell plate (light-tight) | Corning | 351156 | |
| 24-well HTS Transwell plates (Table 1) | Corning | 3378 | |
| 24-well plate with Transwell inserts | Corning | 3470 | |
| 40 µm cell strainer | PluriSelect | 43-50040-01 | |
| 50 mL conical tubes | Greiner bio-one | 227261 | |
| 6-well cell culture plates | Greiner bio-one | 657160 | |
| 96-well black plate transparent bottom | Greiner bio-one | 655090 | |
| 96-well fast thermal cycling plates | Life Technologies Europe BV | 4346907 | |
| 96-well HTS Fluoroblok Transwell plate | Corning | 351162 | |
| 96-well HTS Transwell plates (Table 1) | Corning | 7369 | |
| 96-well transparent culture plate | Greiner bio-one | 655180 | |
| A83-01 | Bio-Techne Ltd | 2939 | |
| Accutase Cell Dissociation Reagent | Life Technologies Europe BV | A11105-01 | Cell dissociation reagent 2 |
| Advanced DMEM/F-12 | Life Technologies Europe BV | 12634028 | |
| B27 supplement | Life Technologies Europe BV | 17504001 | |
| Cell culture microscope (light / optical microscope) | Leica | ||
| CellTiter-Glo | Promega | G9683 | |
| Centrifuge | Eppendorf | ||
| CO2 incubator | PHCBI | ||
| DAPT | Sigma-Aldrich | D5942 | |
| DEPC treated H2O | Life Technologies Europe BV | 750024 | |
| Dulbecco's phosphate-buffered saline (DPBS) with Ca2+ and Mg2+ | Life Technologies Europe BV | 14040091 | |
| DPBS, powder, no calcium, no magnesium | Life Technologies Europe BV | 21600069 | |
| EnzChek Lysozyme Assay Kit | Life Technologies Europe BV | E22013 | |
| EVOM2 meter with STX electrode | WTI | ||
| Gastrin | Bio-Techne Ltd | 3006 | |
| Glass pipettes | Volac | ||
| GlutaMAX | Life Technologies Europe BV | 35050038 | |
| hEGF | Peprotech | AF-100-15 | |
| HEPES | Life Technologies Europe BV | 15630056 | |
| Human Noggin | Peprotech | 120-10C | |
| Human Rspo3 | Bio-Techne Ltd | 3500-RS/CF | |
| IWP-2 | Miltenyi Biotec | 130-105-335 | |
| Ki67 primary antibody | Sanbio | BSH-7302-100 | |
| Ki67 secondary antibody | Agilent | K400111-2 | |
| Kova International Glasstic Slide with Counting grids | Fisher Emergo | 10298483 | |
| Laminar flow hood | Thermo scientific | ||
| Lucifer Yellow CH dilithium salt | Sigma-Aldrich | L0259 | |
| Matrigel, Growth Factor Reduced (GFR) | Corning | 356231 | extracellular matrix (ECM) |
| MicroAmp Fast 8-Tube Strip, 0.1 mL | Life Technologies Europe BV | 4358293 | |
| MicroAmp Optical 8-Cap Strips | Life Technologies Europe BV | 4323032 | |
| Microcentrifuge tubes | Eppendorf | 0030 120 086 | |
| Micropipettes (1000, 200, and 20 µL) | Gilson | ||
| Microtome | Leica | ||
| MUC2 primary antibody | Santa Cruz Biotechnology | sc-15334 | |
| MUC2 secondary antibody | VWR | VWRKS/DPVR-HRP | |
| Multichannel pipette (200 µL) | Gilson | ||
| N-acetylcysteine | Sigma-Aldrich | A9165 | |
| NGS Wnt | U-Protein Express | N001-0.5mg | |
| Nicotinamide | Sigma-Aldrich | N0636 | |
| Oligonucleotide ALPI1/Forward | Custom-made | GGAGTTATCCTGCTCCCCAC | |
| Oligonucleotide ALPI1/Reverse | Custom-made | CTAGGAGGTGAAGGTCCAACG | |
| Oligonucleotide LGR5/Forward | Custom-made | ACACGTACCCACAGAAGCTC | |
| Oligonucleotide LGR5/Reverse | Custom-made | GGAATGCAGGCCACTGAAAC | |
| Oligonucleotide MUC2/Forward | Custom-made | AGGATCTGAAGAAGTGTGTCACTG | |
| Oligonucleotide MUC2/Reverse | Custom-made | TAATGGAACAGATGTTGAAGTGCT | |
| Oligonucleotide TBP/Forward | Custom-made | ACGCCGAATATAATCCCAAGCG | |
| Oligonucleotide TBP/Reverse | Custom-made | AAATCAGTGCCGTGGTTCGTG | |
| Optical adhesive covers | Life Technologies Europe BV | 4311971 | |
| PD0325901 | Stemcell Technologies | 72184 | |
| Penicillin/streptomycin | Life Technologies Europe BV | 15140122 | |
| Plate shaker | Panasonic | ||
| PowerUp SYBR Green Master Mix | Fisher Emergo | A25776 | |
| Primocin | InvivoGen | ANT-PM-2 | antimicrobial formulation for primary cells |
| Qubit RNA HS Assay Kit | Life Technologies Europe BV | Q32852 | |
| Reagent reservoir for multichannel pipet | Sigma-Aldrich | CLS4870 | |
| REMS AutoSampler with 24-probe or 96C-probe | WTI | ||
| Richard-Allan Scientific Alcian Blue/PAS Special Stain Kit | Thermo scientific | 87023 | |
| RNase-Free DNase Set | Qiagen | 79254 | |
| RNeasy Mini Kit | Qiagen | 74106 | |
| SB202190 | Sigma-Aldrich | S7076 | |
| Serological pipettes | Greiner bio-one | 606180 / 607180 / 760180 | |
| Serological pipettor (Pipet-Aid) | Drummond | ||
| Single edge razor blade | GEM Scientific | ||
| Superscript 1st strand system for RT-PCR | Life Technologies Europe BV | 11904018 | |
| Tecan Spark 10M plate reader | Tecan | ||
| Trypan Blue Solution, 0.4% | Life Technologies Europe BV | 15250-061 | |
| TrypLE Express Enzyme (1x) | Life Technologies Europe BV | 12605-010 | Cell dissociation reagent 1 |
| Water bath | Grant | ||
| Y27632 (ROCK inhibitor) | AbMole | M1817 |
Referenzen
- Haegebarth, A., Clevers, H. Wnt signaling, lgr5, and stem cells in the intestine and skin. The American Journal of Pathology. 174 (3), 715-721 (2009).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. V. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9 (8), 1909 (2020).
- Martínez-Maqueda, D., Miralles, B., Recio, I., Verhoeckx, K. HT29 Cell Line. The Impact of Food Bio-Actives on Gut Health: In Vitro and Ex Vivo Models. , 113-124 (2015).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Huch, M., et al. In vitro expansion of single Lgr5(+) liver stem cells induced by Wnt-driven regeneration. Nature. 11 (2), 179-194 (2013).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 1-20 (2019).
- Karthaus, W. R., et al. Identification of multipotent luminal progenitor cells in human prostate organoid cultures. Cell. 159 (1), 163-175 (2014).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Van De Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Driehuis, E., et al. Pancreatic cancer organoids recapitulate disease and allow personalized drug screening. Proceedings of the National Academy of Sciences of the United States of America. 116 (52), 26580-26590 (2019).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- d'Aldebert, E., et al. Characterization of human colon organoids from inflammatory bowel disease patients. Frontiers in Cell and Developmental Biology. 8, 363 (2020).
- Dotti, I., et al. Alterations in the epithelial stem cell compartment could contribute to permanent changes in the mucosa of patients with ulcerative colitis. Gut. 66 (12), 2069-2079 (2017).
- VanDussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. 64 (6), 911-920 (2015).
- Noel, G., et al. A primary human macrophage-enteroid co-culture model to investigate mucosal gut physiology and host-pathogen interactions. Scientific Reports. 7, 45270 (2017).
- Bartfeld, S., et al. In vitro expansion of human gastric epithelial stem cells and their responses to bacterial infection. Gastroenterology. 148 (1), 126-136 (2015).
- van Es, J. H., et al. Wnt signalling induces maturation of Paneth cells in intestinal crypts. Nature Cell Biology. 7 (4), 381-386 (2005).
- van Es, J. H., et al. Dll1 marks early secretory progenitors in gut crypts that can revert to stem cells upon tissue damage. Nature Cell Biology. 14 (10), 1099-1104 (2012).
- de Lau, W. B. M., Snel, B., Clevers, H. C. The R-spondin protein family. Genome Biology. 13 (3), 1-10 (2012).
- Basak, O., Beumer, J., Wiebrands, K., Seno, H., van Oudenaarden, A., Clevers, H. Induced quiescence of Lgr5+ stem cells in intestinal organoids enables differentiation of hormone-producing enteroendocrine cells. Cell Stem Cell. 20 (2), 177-190 (2017).
- Beumer, J., et al. Enteroendocrine cells switch hormone expression along the crypt-to-villus BMP signalling gradient. Nature Cell Biology. 20 (8), 909-916 (2018).
- Yin, X., Farin, H. F., van Es, J. H., Clevers, H., Langer, R., Karp, J. M. Niche-independent high-purity cultures of Lgr5+ intestinal stem cells and their progeny. Nature Methods. 11 (1), 106-112 (2014).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: An in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments. (120), (2017).
- Miao, Y., et al. Next-generation surrogate Wnts support organoid growth and deconvolute Frizzled pleiotropy in vivo. Cell Stem Cell. 27 (5), 840-851 (2020).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- Blume, L. -. F., Denker, M., Gieseler, F., Kunze, T. Temperature corrected transepithelial electrical resistance (TEER) measurement to quantify rapid changes in paracellular permeability. Die Pharmazie. 65 (1), 19-24 (2010).
- Lea, T., Verhoeckx, K., et al. Caco-2 cell line. The Impact of Food Bio-Actives on Gut Health: In Vitro and Ex Vivo Models. , 103-111 (2015).
- Heo, I., et al. Modelling Cryptosporidium infection in human small intestinal and lung organoids. Nature Microbiology. 3 (7), 814-823 (2018).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten