A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
A المقايسة المستندة إلى لوحة لقياس إطلاق مونوامين الذاتية في شرائح الدماغ الحادة
* These authors contributed equally
In This Article
Summary
هذه الطريقة يقدم تقنية بسيطة للكشف عن إطلاق مونوامين الذاتية باستخدام شرائح الدماغ الحادة. يستخدم الإعداد لوحة من 48 بئرا تحتوي على حامل نسيج لإطلاق مونوامين. يتم تحليل مونوامين الصادرة من قبل HPLC إلى جانب الكشف عن الكهروكيميائية. بالإضافة إلى ذلك، توفر هذه التقنية طريقة فحص لاكتشاف المخدرات.
Abstract
ترتبط الناقلات العصبية مونوامين مع العديد من الأمراض العصبية والنفسية. وقد أظهرت النماذج الحيوانية من هذه الظروف التعديلات في إطلاق الناقل العصبي مونوامين وديناميات امتصاص. هناك حاجة إلى طرق معقدة تقنيا مثل الفيزيولوجيا الكهربية ، المسح السريع Cyclic Voltammetry (FSCV) ، والتصوير ، في التحليل الدقيق في الجسم الحي ، optogenetics ، أو استخدام النشاط الإشعاعي لدراسة وظيفة مونوامين. الطريقة المعروضة هنا هي نهج محسن من خطوتين للكشف عن إطلاق مونوامين في شرائح الدماغ الحادة باستخدام لوحة من 48 بئرا تحتوي على حاملات الأنسجة لفحص إطلاق مونوامين ، والكروماتوغرافيا السائلة عالية الأداء إلى جانب الكشف الكهروكيميائية (HPLC-ECD) لقياس إطلاق مونوامين. باختصار، تم الحصول على أقسام دماغ الفئران التي تحتوي على مناطق ذات أهمية، بما في ذلك قشرة الجبهي، قرن آمون، والمرحلة الظهرية باستخدام تقطيع الأنسجة أو الهزاز. تم تشريح هذه المناطق ذات الاهتمام من الدماغ كله واحتضانها في عازل فسيولوجي أكسجين. تم فحص الجدوى طوال الدورة الزمنية التجريبية ، من قبل 3-(4،5-dimethylthiazol-2-yl)-2،5-ديبينيلتيترازوليوم بروميد (MTT) المقايسة. تم احتضان مناطق الدماغ تشريح حاد في ظروف المخدرات المختلفة التي من المعروف أن تحفز إطلاق مونوامين من خلال الناقل (الأمفيتامين) أو من خلال تفعيل إطلاق المركبات الخارجية (KCl). بعد الحضانة ، تم جمع المنتجات الصادرة في الناتات وتحليلها من خلال نظام HPLC-ECD. هنا ، يتم الكشف عن إطلاق أحادي الأمين القاعدي من قبل HPLC من شرائح الدماغ الحادة. تدعم هذه البيانات النتائج السابقة في الجسم الحي وفي المختبر التي تظهر أن AMPH و KCl يحفزان إطلاق أحادي الأمين. وهذه الطريقة مفيدة بشكل خاص لدراسة الآليات المرتبطة بإطلاق سراح أحادي الأمين يعتمد على الناقل، وتوفر فرصة لفحص المركبات التي تؤثر على إطلاق مونوامين بطريقة سريعة ومنخفضة التكلفة.
Introduction
ويرتبط عدد كبير من الأمراض العصبية والنفسية مع dysregulation أو الصيانة غير كافية من الناقل العصبي مونوامين (الدوبامين [DA], السيروتونين [5-HT], النورادرينالين [NE]) homeostasis1,2,3. وتشمل هذه الشروط، على سبيل المثال لا الحصر، الاكتئاب1،2، الفصام2، القلق2، الإدمان4، انقطاع الطمث5،6،7، pain8، ومرض باركنسون3. على سبيل المثال، أظهرت العديد من نماذج الفئران من انقطاع الطمث أن خلل التنظيم أو الحد من مونوامين داخل قرن آمون، قشرة الجبهي، والمزمع قد تكون مرتبطة مع كل من الاكتئاب والتدهور المعرفي، والذي ينظر إليه في النساء اللواتي يعانين من انقطاع الطمث. وقد تم فحص خلل تنظيم مونوامين في هذه النماذج على نطاق واسع باستخدام HPLC-ECD, على الرغم من أن الدراسات لم تميز بين محتوى الناقل العصبي المقاس مقابل الافراج عن الناقل العصبي 5,6,7. يتم إطلاق مونوامينات كلاسيكيا في الفضاء خارج الخلية من خلال Ca2 + تعتمد على الافراج عن المركبات9، ويتم إعادة تدويرها مرة أخرى من خلال نظام إعادة امتصاص غشاء البلازما الخاصة بهم (ناقل الدوبامين، DAT؛ الناقل السيروتونين، SERT؛ ناقل النورادرينالين، NET)10،11. وعلى العكس من ذلك، تشير البيانات إلى أن هؤلاء الناقلين قادرون على إطلاق أو إطلاق مونوامينات الإيفلاكس، حيث أن المخدرات التي تتعاطى مثل الأمفيتامين (AMPH) و 3,4-Methylenedioxymethamphetamine (MDMA) معروفة بإطلاق DA و 5-HT، على التوالي من خلال أنظمة النقل الخاصة بهم12,13,14,15,16,17 . وبالتالي ، فإن الفهم الآلي السليم لديناميكيات إطلاق أحادي الأمين أمر بالغ الأهمية لتطوير علاجات دوائية محددة ومستهدفة.
وقد استخدمت مجموعة واسعة من التقنيات لدراسة إطلاق أحادي الأمين مثل المسح السريع Cyclic Voltammetry (FSCV)18، في التحليل الدقيق في الجسم الحي13، والتصوير19، والتنبيب المسبق مع مونوامينات 20 ذات السمية الإشعاعية، وعلم البصريات، ومؤخرا، أجهزة الاستشعار الفلورية المشفرة وراثيا وقياس الفوتومتر21،22 . FSCV وفي الغسيل المجهري في الجسم الحي هي التقنيات الأولية المستخدمة لدراسة إطلاق مونوامين. يستخدم FSCV لدراسة إطلاق الإكسيتوتيك المحفز ، في المقام الأول ، DA في شرائح الدماغ الحادة وفي vivo23. لأن FSCV يستخدم الأقطاب الكهربائية لتحفيز أو استحضار الإفراج, المصدر الرئيسي لإطلاق الناقل العصبي هو Ca2 +تعتمد على الافراج عن المركبات18,24,25,26,27,28,29,30,31 . في التحليل الدقيق في الجسم الحي إلى جانب تدابير HPLC التغيرات في مستويات الناقل العصبي خارج الخلية باستخدام مسبار وضعت في منطقة الدماغ من الفائدة13,32. على غرار FSCV ، هناك قيد كبير على غسيل الكلى الدقيق في الجسم الحي هو صعوبة تحديد مصدر إطلاق الناقل العصبي: إطلاق المركبات المعتمدة Ca2 + أو الناقل التابع. والجدير بالذكر أن كلا الأسلوبين يسمحان بالقياس المباشر لإطلاق أحادي الأمين. من خلال التقدم الأخير في علم الوراثة البصرية ، تظهر الأبحاث الكشف عن إصدار 5-HT و DA في فترة زمنية قصيرة مع خصوصية رائعة من نوع الخلية21،22. ومع ذلك، تتطلب هذه الاستراتيجيات تقنيات ومعدات معقدة ومكلفة، وتقيس بشكل غير مباشر إطلاق مونوامين، وتحديدا من خلال ربط أحادي الأمين بالمستقبلات. وعلاوة على ذلك، تستخدم مونوامينات ذات علامات إشعاعية أيضا لدراسة ديناميات مونوامين. قد يتم تحميلها مسبقا مونوامينات ذات العلامات المشعة في مختلف النظم النموذجية مثل خلايا heterologous الإفراط في التعبير عن كل ناقل مونوامين20,33,34,35,36,37,38,39,40, الخلايا العصبية الأولية20, synaptosomes3,39,41, 42، وشرائح الدماغ الحادة43,44. ومع ذلك ، فإن النشاط الإشعاعي يشكل ضررا محتملا للمجرب ، وقد لا يقوم التحليل المسمى بالتريتيوم بتلخيص ديناميكيات مونوامين الذاتية 4545.46 بأمانة. وقد سمحت أنظمة التخسين الفائقة جنبا إلى جنب مع أساليب الكشف خارج الخط مثل HPLC-ECD للكشف عن مونوامينات من مصادر أنسجة متعددة. هنا، يوفر هذا البروتوكول كطريقة محسنة ومنخفضة التكلفة وبسيطة ودقيقة باستخدام شرائح الدماغ الحادة لقياس مباشرة القاعدية الذاتية وتحفيز إطلاق مونوامين.
شرائح الدماغ الحادة تسمح لاختبار الفرضيات الميكانيكية، في المقام الأول لأنها تحافظ على البيئة الدقيقة التشريحية في الجسم الحي، والحفاظ على نقاط الاشتباك العصبي سليمة47،48،49،50،51،52. في عدد قليل من الدراسات، تم استخدام شرائح الدماغ الحادة أو أنسجة الدماغ المفرومة بالتزامن مع تقنية التغميس الفائق باستخدام KCl لتحفيز إطلاق Ca2+ بوساطة53,54,55,56. وكانت أنظمة التخسين الفائق حاسمة لتعزيز فهم الميدان لآليات إطلاق الناقل العصبي، بما في ذلك مونوامينات. ومع ذلك ، فإن هذه الأنظمة مكلفة نسبيا ، ويتراوح عدد الغرف المتاحة لتحليل الأنسجة من 4 إلى 12. وبالمقارنة، فإن الطريقة المعروضة هنا غير مكلفة، وتسمح بقياس 48 عينة من الأنسجة، ويمكن صقلها لاستخدام ما يصل إلى 96 عينة من الأنسجة. يحتوي كل بئر داخل اللوحة ذات ال 48 بئرا على حاملات أنسجة تستخدم مرشحات لفصل المنتج الصادر عن الأنسجة ، ثم يتم جمع مونوامينات تم إطلاقها وتحليلها من قبل HPLC-ECD. الأهم من ذلك، تسمح هذه الطريقة للقياس المتزامن لإطلاق سراح 5-HT، DA، وNE من مناطق الدماغ المختلفة مثل قشرة الجبهي، والحصين، والمزمع الظهري بعد العلاج مع العوامل الدوائية التي تعدل إطلاق مونوامين. وهكذا، يمكن للمجرب الإجابة على أسئلة متعددة باستخدام نظام متعدد الآبار غير مكلفة أن يزيد من عدد العينات التي تم اختبارها، وبالتالي تقليل عدد الحيوانات المستخدمة.
Protocol
وقد أجريت جميع التجارب، بما في ذلك مناولة الحيوانات وجمع الأنسجة، وفقا لجامعة فلوريدا ولجنة رعاية الحيوانات واستخدامها المؤسسية التابعة لكلية مدينة نيويورك، وذلك في أعقاب البروتوكول المعتمد 201508873 (UF) و 1071 (CCNY). للكواشف و المخزن المؤقت الرجاء الرجوع إلى الملف التكميلي.
1. إعداد شرائح الدماغ الفئران الحادة
ملاحظة: في هذه التجربة تم استخدام الفئران الذكور البالغين (250-350 غرام). ومع ذلك ، فإن هذا الإعداد وظيفي لنقاط النمو المختلفة ، والجرذان الإناث ، والأنواع الأخرى. إذا كنت تستخدم حيوانا أصغر، مثل الفئران، فقد يعدل المجرب لتحسين البروتوكول باستخدام عدد مختلف من شرائح الدماغ أو اللكمات لكل حالة. سيتم الإشارة إلى المخزن المؤقت Dissection باسم المخزن المؤقت 1; سيتم الإشارة إلى المخزن المؤقت efflux ك المخزن المؤقت 2.
- تحضير المخزن المؤقت 1 كما هو مذكور في الملف التكميلي. تشبع العازلة 1 مع الأكسجين عن طريق محتدما مع 95٪ / 5٪ (O2/CO2) لمدة 20 دقيقة على الجليد. إزالة 50 مل من العازلة 1، والبرد على الجليد في كوب صغير أو طبق بيتري. يستخدم هذا العازلة لعقد الدماغ كله حصادها بشكل حاد.
- تخدير واحد أو اثنين من الفئران الكبار (250-350 غرام) مع 1٪ -2٪ isoflurane، وقطع رؤوسهم باستخدام المقصلة، وإزالة أدمغتهم بسرعة. ضع الدماغ على الفور في العازلة المؤسجة الباردة الجليدية 1 في الحاوية من الخطوة 1.1.
ملاحظة: تأكد من استخدام الأيزوفلوران والمقصلة بأمان. فتح ايزوفلوران تحت غطاء الدخان. - باستخدام هزاز أو ضغط، قطع 300 ميكرومتر أقسام الدماغ التاجي من كل منطقة من مناطق الاهتمام (الشكل 1). يجب أن يكون المخزن المؤقت 1 محتدما أثناء إجراء المقاطع. باستخدام ملعقة الفولاذ المقاوم للصدأ، بعناية وعلى الفور نقل شرائح الدماغ إلى طبق بيتري جديدة مليئة الجليد الباردة المؤوكسجين العازلة 1 (الشكل 2).
- مزيد من تشريح شرائح الدماغ (على سبيل المثال، اللكمات، وقطع) عن طريق تحريك بعناية شرائح إلى الشرائح الزجاجية (الشكل 1G) باستخدام أطلس الدماغ الفئران57. على سبيل المثال، حدد المخطط الظهري القائم على بنيته المظلمة المخططة، وحدد قرن آمون القائم على قربه من القشرة والهيكل الحلزوني الفريد. ويمكن فصل نصفي الكرة الأرضية الأيمن والأيسار لاستخدامها كشرائح التحكم والتجريبية (الأرقام 2G - H). هنا، تم تشريح المخطط الظهري إلى لكمات 2 مم (الشكل 1G).
- باستخدام ماصة نقل البلاستيك مع قطع طرف، نقل شرائح أو اللكمات الدماغ في حاويات صغيرة مغمورة في الأوكسجين الجليد الباردة العازلة 1 مع الأكسجين محتدما. قد تكون هذه الحاويات شبكة الفولاذ المقاوم للصدأ، أو أطباق بيتري الصغيرة مليئة العازلة (الشكل 1H).
2. السابقين فيفو الإفراج أحادية المنشأ الذاتية من شرائح الدماغ أو اللكمات
ملاحظة: يتكون الجهاز المستخدم لهذا القسم من لوحة من 48 بئرا وحامل نسيج مصنوع من ست وحدات فلتر للطرد المركزي الدقيق بدون مرشحات داخلية متصلة بخط كاربوجين (الشكل 2). لجعل حامل، استخدم قضيب بلاستيكي قوي (على سبيل المثال، من كاشط الخلية) والغراء السوبر وحدات تصفية الطرد الدقيق دون inset-مرشحات لذلك. السماح لها الجافة لمدة 1-2 أيام. الوقت اللازم لتجربة إطلاق أحادي الأمين الذاتية وتركيزات الأمفيتامين والفلوكسيتين والكوكايين تستند إلى الأدبيات الحالية والبروتوكولات السابقة13,20,58.
-
تنشيط الأنسجة
- نقل أنسجة الدماغ من الخطوة 1.1.5 إلى كل بئر من غرفة efflux والسماح للتعافي لمدة 30-50 دقيقة في 37 درجة مئوية على شريحة أكثر دفئا في 0.5-1 مل من العازلة المؤوكسجين 2، مع ثابت، محتدما لطيف (الشكل 2B1).
- خلال هذا الحضانة ، تمييع الأدوية إلى التركيز المطلوب للتجربة. يجب حل جميع الأدوية في العازلة 2 ، وتستند التركيزات من الأدبيات الحالية.
-
الحضانة الأولى
- نقل حامل الأنسجة مع أنسجة الدماغ إلى الآبار التي تحتوي على 500 ميكرولتر من العازلة المؤوكسجين 2 واحتضان لمدة 20 دقيقة في 37 درجة مئوية. تأكد من نقل الحد الأدنى إلى أي حاجز عن طريق النقر على حامل على حافة البئر حتى لا يوجد حاجز زائد في الحامل.
- في التجارب التي أجريت على العوامل الدوائية مثل مثبطات ناقل أحادي الأمين، احتضن عينات الأنسجة بالأدوية المخففة في العازلة المؤكسية 2 (على سبيل المثال، 10 ميكرومتر فلوكستين، 40 ميكرومتر كوكايين؛ انظر الشكل 2B2). وسيكون الحجم النهائي في كل بئر 500 ميكرولتر.
-
الحضانة الثانية
- نقل حامل مع الأنسجة إلى مجموعة جديدة من الآبار التي تحتوي على 500 ميكرولتر مجموع العازلة 2 مع أو بدون التركيز المطلوب من كل دواء. تأكد من عدم وجود بقايا المخزن المؤقت الزائد. يمثل كل بئر n = 1 للظروف التجريبية. يتم تنفيذ كل حالة تجريبية في ثلاثية.
- وتشمل إحدى الالآبار المخزن المؤقت المؤسج 2، و10-30 ميكرومتر AMPH القادمة، ويشمل البئر النهائي 10-30 ميكرومتر AMPH بالإضافة إلى مثبطات ناقل مونوامين. يذوب كل دواء في العازلة المؤسجة 2.
- احتضان الأنسجة لمدة 20 دقيقة في 37 درجة مئوية مع 500 ميكرولتر من حالة الدواء.
ملاحظة: قد تتضمن الآبار الإضافية مثبطات ناقل أحادي الأمين عالية المؤوكسجين K+ Buffer 2. حل كل دواء في العازلة المؤسجة 2 (500 ميكرولتر). - خلال هذا الحضانة الثانية من 20 دقيقة، وجمع الحل من الآبار من الحضانة الأولى في الخطوة 2.2.1 ونقلها إلى أنابيب الطرد المركزي الدقيق التي تحتوي على 50 ميكرولتر من 1 N حمض بيركلوريك أو حمض الفوسفوريك (تعتمد على نوع HPLC، التركيز النهائي 0.1 N). وسيكون الحجم النهائي للعينة 550 ميكرولتر.
- بعد الحضانة الثانية من 20 دقيقة، نقل حامل الأنسجة مع أقسام الدماغ أو اللكمات إلى بئر فارغة والحفاظ على لوحة على الجليد. نقل supernatant إلى أنابيب الطرد المركزي الدقيق التي تحتوي على 50 ميكرولتر من 1 N حمض بيركلوريك أو حمض الفوسفوريك. سيكون الحجم النهائي للعينة 550 ميكرولتر.
- أضف 1 مل من العازلة الباردة الجليدية 1 إلى كل بئر يحتوي على أنسجة. جمع كل من الأنسجة باستخدام ملاقط صغيرة، ونقل لتنظيف أنابيب الطرد المركزي الدقيق.
- الحفاظ على أنابيب مع أنسجة الدماغ في -80 درجة مئوية. تجاهل 1 مل من المخزن المؤقت 1 (الشكل 2B4).
- حلول التصفية التي تم الحصول عليها من كل حضانة باستخدام أنابيب فلتر الطرد الدقيق (0.22 ميكرومتر) عند 2500 × غرام لمدة دقيقتين. استخدم الخيوط لتحديد محتوى مونوامين باستخدام HPLC مع الكشف الكهروكيميائية (الشكل 2B5).
3. صلاحية الأنسجة
- MTT المقايسة
ملاحظة: هناك قلق كبير بشأن هذا الإعداد التجريبي هو صلاحية الأنسجة حيث يمكن استخدام الأنسجة لعدة ساعات59. يتم استخدام المقايسة MTT60,61 لتحديد صلاحية الأنسجة بحلول نهاية التجربة. ويستند هذا المقايسة على تحويل الملح الأصفر رباعي الزيوم MTT (3-(4,5-dimethylthiazol-2-yl)-2,5-ديفينيلتيترازوليوم بروميد) إلى بلورات معادن أرجوانية بواسطة خلايا قابلة للحياة مع التمثيل الغذائي الكافي.- بعد التجربة الحفاظ على مجموعة منفصلة من عينات الأنسجة وفصلها إلى مجموعتين.
- احتضان مجموعة واحدة لمدة 20 دقيقة في 37 درجة مئوية في تريتون X-100 (1٪) حلها في العازلة 2 كعنصر تحكم. تريتون X-100 نتائج العلاج في موت الخلايا. الحفاظ على المجموعة الثانية في المخزن المؤقت 2، ولا تحتضن في تريتون X-100 (التحكم في صلاحية الأنسجة).
- إضافة MTT (محلول المخزون 5 ملغم/مل في برنامج تلفزيوني، pH 7.4) لكلا المجموعتين في المخزن المؤقت المؤوكسجين 2 إلى تركيز نهائي قدره 0.5 ملغم/مل.
- احتضان عينات الأنسجة لمدة 20 دقيقة عند 37 درجة مئوية، وغسل مع برنامج تلفزيوني، ونقلها إلى أنابيب الطرد المركزي الدقيق التي تحتوي على 250 ميكروغرام من خليط من SDS (10٪، ث / الخامس)، DMF (25٪، v/v)، والماء لإذابة بلورات فورمازان.
- احتضان العينات لمدة 24 ساعة.
- طاردة مركزية الأنابيب في 10،000 س ز لمدة 10 دقيقة وقياس امتصاص الفائقة (200 ميكرولتر) في 562 نانومتر و 690 نانومتر باستخدام قارئ microplate. يتم حساب صلاحية الأنسجة على النحو التالي: (A562-A690) / وزن الأنسجة.
4. تحليل HPLC من مونوامينات
- قياس إطلاق مونوامين من كل حالة تجريبية باستخدام HPLC-ECD وفقا للبروتوكولات السابقة13,44، وذلك باستخدام عمود المرحلة العكسية.
- إعداد المرحلة المتنقلة المطلوبة للكشف. هذا يتكون من حمض الفوسفوريك 100 مللي متر، 100 mM حمض الستريك، 0.1 mM EDTA-Na2، 600 ملغم/ لتر حمض أوكتانسولفونيك، 8٪ v/v أسيتونيتريل (درجة الحموضة النهائية 6.0). يعتمد تكوين المرحلة المتنقلة على نوع HPLC والعمود المستخدم.
- تعيين إمكانات الكاشف الكهروكيميائية (2 مم قطب الكربون زجاجي،) إلى 0.46 V، وتعيين معدل التدفق إلى 0.05 مل / دقيقة.
- تحميل 5 ميكرولتر من كل عينة، بما في ذلك معايير الناقل العصبي في HPLC للتشخيص التلقائي والكشف. تعتمد كمية كل عينة مضافة على نوع HPLC المستخدم.
- بمجرد الانتهاء من تشغيل HPLC ، استخدم برنامج تحليل HPLC المحدد للحصول على بيانات الكروماتوغرافيا وتحليلها.
- تحليل محتوى مونوامين باستخدام منحنى قياسي يتألف من كل مونوامين (الدوبامين: DA, النورادرينالين: NE, والسيروتونين: 5-HT; الشكل 2C). استخدم اللونيات الناتجة للحصول على المنطقة تحت المنحنى (AUC) استنادا إلى إرشادات الشركة المصنعة.
5. إعداد lysates الأنسجة لتكميم البروتين
-
فحص البروتين
- إضافة الجليد الباردة تحلل العازلة بالإضافة إلى مثبطات البروتيز (0.1 غرام / 1 مل) إلى كل أنبوب الطرد المركزي الدقيق التي تحتوي على أقسام الدماغ / اللكمات والتجانس باستخدام متجانس الحشرات. يجب الحفاظ على أنابيب الطرد الدقيق على الجليد مع التجانس لمنع تدهور البروتين.
- احتضان الأنسجة متجانسة لمدة 1 ساعة في 4 درجة مئوية مع دوران الضوء.
- تجانس أنسجة الطرد المركزي في 16000 x ز لمدة 15 دقيقة في 4 درجة مئوية واستعادة supernatant.
- تحديد تركيز البروتين في المضادات، مع الألبومين مصل البقر (BSA) كمعيار.
- تطبيع محتوى مونوامين في كل عينة الدماغ إلى المحتوى الإجمالي للبروتين (ميكروغرام) تقاس في 250 ميكرولتر من أنسجة الدماغ lysed. استخدم الصيغة التالية لتحديد بروتين مونوامين/غرام النمول. df = عامل التخفيف.
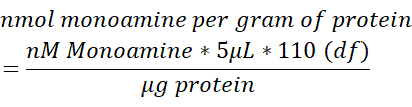
6. التحليل الإحصائي
- تحليل إطلاق مونوامين (nmol/g) باستخدام ANOVA أحادي الاتجاه يليه اختبار المقارنات المتعددة ل Sidak للمقارنات اللاحقة.
- تحليل صلاحية الأنسجة باستخدام اختبار T للطالب غير المدفوع للمجموعات المستقلة (Control مقابل 1٪ Triton X-100).
- بالنسبة لجميع التحليلات الإحصائية، حدد مستوى ألفا إلى ≤ 0.05.
النتائج
تصف هذه التقنية استخدام شرائح الدماغ لقياس إطلاق مونوامينات داخلية باستخدام HPLC مع الكشف الكهروكيميائية القائمة في لوحة 48 جيدا مع حامل الأنسجة الداخلية. يتم تصوير الإعداد التجريبي في الشكل 1 والشكل 2. في البداية ، لضمان بقاء الأنسجة بحلول ?...
Discussion
وقد أجريت قياسات إطلاق مونوامين لسنوات في عدد من النظم مثل خلايا heterologous, الثقافات العصبية, التنابتوسومات الدماغ, شرائح الدماغ الحادة في الجسم الحي السابق, والحيوانات كلها13,20,41,42,58,64,65,66,67,68
Disclosures
ولا يوجد لدى صاحبي البلاغ أي إفصاحات.
Acknowledgements
وقد تم دعم هذا العمل من خلال منح صندوق بدء Fondecyt N 11191049 إلى J.A.P. ومنحة المعاهد القومية للصحة DA038598 إلى G.E.T.
Materials
| Name | Company | Catalog Number | Comments |
| 48 Well plate | NA | NA | Assay |
| Acetonitrile | Fischer Scientific | A998-1 | Mobile Phase |
| Calcium Chloride Ahydrous | Sigma Aldrich | C1016 | Modified Artifical Cerebrospinal Fluid OR Efflux Buffer |
| Clarity Software | Anetc | ||
| Citric Acid | Sigma Aldrich | Mobile Phase | |
| D-(+)-Glucose | Sigma | 1002608421 | Dissection Buffer |
| DMF | Sigma Aldrich | D4551 | MTT Assay |
| EDTA-Na2 | Sigma Aldrich | Mobile Phase | |
| GraphPad Software | Graphpad Software, Inc | Statistical Analysis | |
| Glycerol | Sigma Aldrich | G5516 | Lysis buffer |
| HEPES | Sigma Aldrich | H3375 | Lysis buffer |
| HPLC, Decade Amperometric | Anetc | HPLC, LC-EC system | |
| HPLC | Amuza | HPLC HTEC-510. | |
| L-Asrobic Acid | Sigma Aldrich | A5960 | Dissection Buffer |
| Magnesium Sulfate | Sigma | 7487-88-9 | KH Buffer |
| Microcentrifuge Filter Units UltraFree | Millipore | C7554 | Assay - 6 to fit in 48 well plate |
| MTT | Thermo Fisher | M6494 | MTT Assay |
| Nanosep | VWR | 29300-606 | Assay; protein assay |
| Octanesulfonic acid | Sigma Aldrich | V800010 | Mobile Phase |
| Pargyline Clorohydrate | Sigma Aldrich | P8013 | Modified Artifical Cerebrospinal Fluid OR Efflux Buffer |
| Phosphoric Acid | Sigma Aldrich | Mobile Phase | |
| Potassium Chloride | Sigma | 12636 | KH Buffer |
| Potassium Phosphate Monobasic | Sigma | 1001655559 | KH Buffer |
| Precisonary VF-21-0Z | Precissonary | Compresstome | |
| Protease Inhibitor Cocktail | Sigma Aldrich | P2714 | Lysis buffer. |
| Sodium Bicarbonate | Sigma | S5761 | Dissection Buffer |
| Sodium Bicarbonate | Sigma Aldrich | S5761 | Dissection Buffer |
| Sodium Chloride | Sigma | S3014 | KH Buffer |
| Sodium Dodecyl Sulfate | Sigma Aldrich | L3771 | Lysis buffer |
| Triton X-100 | Sigma Aldrich | T8787 | MTT Assay / Lysis buffer |
References
- Jesulola, E., Micalos, P., Baguley, I. J. Understanding the pathophysiology of depression: From monoamines to the neurogenesis hypothesis model - are we there yet. Behavioural Brain Research. 341, 79-90 (2018).
- Krystal, J. H., D'Souza, D. C., Sanacora, G., Goddard, A. W., Charney, D. S. Current perspectives on the pathophysiology of schizophrenia, depression, and anxiety disorders. Medical Clinics of North America. 85 (3), 559-577 (2001).
- Barone, P. Neurotransmission in Parkinson's disease: beyond dopamine. European Journal of Neurology. 17 (3), 364-376 (2010).
- Howell, L. L., Kimmel, H. L. Monoamine transporters and psychostimulant addiction. Biochemical Pharmacology. 75 (1), 196-217 (2008).
- Kirshner, Z. Z., et al. Impact of estrogen receptor agonists and model of menopause on enzymes involved in brain metabolism, acetyl-CoA production and cholinergic function. Life Sciences. 256, 117975 (2020).
- Long, T., et al. Comparison of transitional vs surgical menopause on monoamine and amino acid levels in the rat brain. Molecular and Cellular Endocrinology. 476, 139-147 (2018).
- Long, T., et al. Estradiol and selective estrogen receptor agonists differentially affect brain monoamines and amino acids levels in transitional and surgical menopausal rat models. Molecular and Cellular Endocrinology. 496, 110533 (2019).
- Burke, N. N., et al. Enhanced nociceptive responding in two rat models of depression is associated with alterations in monoamine levels in discrete brain regions. Neuroscience. 171 (4), 1300-1313 (2010).
- Lane, J. D., Aprison, M. H. Calciumm-dependent release of endogenous serotonin, dopamine and norepinephrine from nerve endings. Life Sciences. 20 (4), 665-671 (1977).
- Ramamoorthy, S., Shippenberg, T. S., Jayanthi, L. D. Regulation of monoamine transporters: Role of transporter phosphorylation. Pharmacology and Therapeutics. 129 (2), 220-238 (2011).
- Torres, G. E., Gainetdinov, R. R., Caron, M. G. Plasma membrane monoamine transporters: structure, regulation and function. Nature Reviews. Neuroscience. 4 (1), 13-25 (2003).
- Hilber, B., et al. Serotonin-transporter mediated efflux: A pharmacological analysis of amphetamines and non-amphetamines. Neuropharmacology. 49 (6), 811-819 (2005).
- Mauna, J. C., et al. G protein βγ subunits play a critical role in the actions of amphetamine. Translational Psychiatry. 9 (1), 81 (2019).
- Sitte, H. H., Freissmuth, M. Amphetamines, new psychoactive drugs and the monoamine transporter cycle. Trends in Pharmacological Sciences. 36 (1), 41-50 (2015).
- Johnson, L. A., Guptaroy, B., Lund, D., Shamban, S., Gnegy, M. E. Regulation of amphetamine-stimulated dopamine efflux by protein kinase C β. Journal of Biological Chemistry. 280 (12), 10914-10919 (2005).
- Kahlig, K. M., et al. Amphetamine induces dopamine efflux through a dopamine transporter channel. Proceedings of the National Academy of Sciences of the United States of America. 102 (9), 3495-3500 (2005).
- Kantor, L., Hewlett, G. H. K., Gnegy, M. E. Enhanced amphetamine- and K+ -mediated dopamine release in rat striatum after repeated amphetamine: differential requirements for Ca 2+ - and calmodulin-dependent phosphorylation and synaptic vesicles. The Journal of Neuroscience. 19 (10), 3801-3808 (2018).
- Brodnik, Z. D., et al. Susceptibility to traumatic stress sensitizes the dopaminergic response to cocaine and increases motivation for cocaine. Neuropharmacology. 125, 295-307 (2017).
- Henke, A., et al. Toward serotonin fluorescent false neurotransmitters: development of fluorescent dual serotonin and vesicular monoamine transporter substrates for visualizing serotonin neurons. ACS Chemical Neuroscience. 9 (5), 925-934 (2018).
- Garcia-Olivares, J., et al. Gβγ subunit activation promotes dopamine efflux through the dopamine transporter. Molecular Psychiatry. 22 (12), 1673-1679 (2017).
- Xiao, N., Privman, E., Venton, B. J. Optogenetic control of serotonin and dopamine release in Drosophila larvae. ACS Chemical Neuroscience. 5 (8), 666-673 (2014).
- Bass, C. E., et al. Optogenetic control of striatal dopamine release in rats. Journal of Neurochemistry. 114 (5), 1344-1352 (2010).
- Stamford, J. A. Fast cyclic voltammetry: measuring transmitter release in "real time". Journal of Neuroscience Methods. 34 (1-3), 67-72 (1990).
- Brodnik, Z. D., Ferris, M. J., Jones, S. R., España, R. A. Reinforcing doses of intravenous cocaine produce only modest dopamine uptake inhibition. ACS Chemical Neuroscience. 8 (2), 281-289 (2017).
- Brodnik, Z. D., España, R. A. Dopamine uptake dynamics are preserved under isoflurane anesthesia. Neuroscience Letters. 606, 129-134 (2015).
- Ferris, M. J., Calipari, E. S., Yorgason, J. T., Jones, S. R. Examining the complex regulation and drug-induced plasticity of dopamine release and uptake using voltammetry in brain slices. ACS Chemical Neuroscience. 4 (5), 693-703 (2013).
- Siciliano, C. A., Calipari, E. S., Ferris, M. J., Jones, S. R. Biphasic mechanisms of amphetamine action at the dopamine terminal. The Journal of Neuroscience The Official Journal of the Society for Neuroscience. 34 (16), 5575-5582 (2014).
- Rice, M. E., et al. Direct monitoring of dopamine and 5-HT release in substantia nigra and ventral tegmental area in vitro. Experimental Brain Research. 100 (3), 395-406 (1994).
- Bunin, M. A., Prioleau, C., Mailman, R. B., Wightman, R. M. Release and uptake rates of 5-hydroxytryptamine in the dorsal raphe and substantia nigra reticulata of the rat brain. Journal of Neurochemistry. 70 (3), 1077-1087 (1998).
- Park, J., Takmakov, P., Wightman, R. M. In vivo comparison of norepinephrine and dopamine release in rat brain by simultaneous measurements with fast-scan cyclic voltammetry. Journal of Neurochemistry. 119 (5), 932-944 (2011).
- Park, J., Bhimani, R. V., Bass, C. E. In vivo electrochemical measurements of norepinephrine in the brain: current status and remaining challenges. Journal of the Electrochemical Society. 165 (12), 3051-3056 (2018).
- Butcher, S. P., Fairbrother, I. S., Kelly, J. S., Arbuthnott, G. W. Amphetamine-induced dopamine release in the rat striatum: an in vivo microdialysis study. Journal of Neurochemistry. 50 (2), 346-355 (1988).
- Garcia-Olivares, J., et al. Inhibition of dopamine transporter activity by G protein βγ subunits. PLoS One. 8 (3), 1-9 (2013).
- Carneiro, A. M. D., Blakely, R. D. Serotonin-, protein kinase C-, and Hic-5-associated redistribution of the platelet serotonin transporter. Journal of Biological Chemistry. 281 (34), 24769-24780 (2006).
- Rajamanickam, J., et al. Akt-mediated regulation of antidepressant-sensitive serotonin transporter function, cell-surface expression and phosphorylation. The Biochemical Journal. 468 (1), 177-190 (2015).
- Egaña, L. A., et al. Physical and functional interaction between the dopamine transporter and the synaptic vesicle protein synaptogyrin-3. The Journal of Neuroscience The Official Journal of the Society for Neuroscience. 29 (14), 4592-4604 (2009).
- Guptaroy, B., Fraser, R., Desai, A., Zhang, M., Gnegy, M. E. Site-directed mutations near transmembrane domain 1 alter conformation and function of norepinephrine and dopamine transporters. Molecular Pharmacology. 79 (3), 520-532 (2011).
- Ordway, G. A., et al. Norepinephrine transporter function and desipramine: Residual drug effects versus short-term regulation. Journal of Neuroscience Methods. 143 (2), 217-225 (2005).
- Steinkellner, T., et al. Amphetamine action at the cocaine- and antidepressant-sensitive serotonin transporter is modulated by CaMKII. Journal of Neuroscience. 35 (21), 8258-8271 (2015).
- Guptaroy, B., et al. A juxtamembrane mutation in the N terminus of the dopamine transporter induces preference for an inward-facing conformation. Molecular Pharmacology. 75 (3), 514-524 (2009).
- Carpenter, C., et al. Direct and systemic administration of a CNS-permeant tamoxifen analog reduces amphetamine-induced dopamine release and reinforcing effects. Neuropsychopharmacology. 42 (10), 1940-1949 (2017).
- Aquino-Miranda, G., Escamilla-Sánchez, J., González-Pantoja, R., Bueno-Nava, A., Arias-Montaño, J. -. A. Histamine H3 receptor activation inhibits dopamine synthesis but not release or uptake in rat nucleus accumbens. Neuropharmacology. 106, 91-101 (2016).
- Reddy, I. A., et al. Glucagon-like peptide 1 receptor activation regulates cocaine actions and dopamine homeostasis in the lateral septum by decreasing arachidonic acid levels. Translational Psychiatry. 6 (5), 809 (2016).
- Koutzoumis, D. N., et al. Alterations of the gut microbiota with antibiotics protects dopamine neuron loss and improve motor deficits in a pharmacological rodent model of Parkinson's disease. Experimental Neurology. 325, 113159 (2020).
- Herdon, H., Strupish, J., Nahorski, S. R. Differences between the release of radiolabelled and endogenous dopamine from superfused rat brain slices: Effects of depolarizing stimuli, amphetamine and synthesis inhibition. Brain Research. 348 (2), 309-320 (1985).
- Thongsaard, W., Kendall, D. A., Bennett, G. W., Marsden, C. A. A simple method for measuring dopamine release from rat brain slices. Journal of Pharmacological and Toxicological Methods. 37 (3), 143-148 (1997).
- Dorris, D. M., Hauser, C. A., Minnehan, C. E., Meitzen, J. An aerator for brain slice experiments in individual cell culture plate wells. Journal of Neuroscience Methods. 238, 1-10 (2014).
- Humpel, C. Organotypic brain slice cultures: a review. Neuroscience. 305, 86-98 (2015).
- Papouin, T., Haydon, P. Obtaining acute brain slices. BIO-PROTOCOL. 8 (2), 477-491 (2018).
- Collingridge, G. L. The brain slice preparation: a tribute to the pioneer Henry McIlwain. Journal of Neuroscience Methods. 59 (1), 5-9 (1995).
- Yamamoto, C., McIlwain, H. Electrical activities in thin sections from the mammalian brain maintained in chemically-defined media in vitro. Journal of Neurochemistry. 13 (12), 1333-1343 (1966).
- Buskila, Y., et al. Extending the viability of acute brain slices. Scientific Reports. 4, 4-10 (2014).
- Kako, H., Fukumoto, S., Kobayashi, Y., Yokogoshi, H. Effects of direct exposure of green odour components on dopamine release from rat brain striatal slices and PC12 cells. Brain Research Bulletin. 75 (5), 706-712 (2008).
- McBride, W. J., Murphy, J. M., Lumeng, L., Li, T. -. K. Effects of ethanol on monoamine and amino acid release from cerebral cortical slices of the alcohol-preferring P line of rats. Alcoholism: Clinical and Experimental Research. 10 (2), 205-208 (1986).
- Chen, J. C., Turiak, G., Galler, J., Volicer, L. Effect of prenatal malnutrition on release of monoamines from hippocampal slices. Life Sciences. 57 (16), 1467-1475 (1995).
- Becker, J. B., Castañeda, E., Robinson, T. E., Beer, M. E. A simple in vitro technique to measure the release of endogenous dopamine and dihydroxyphenylacetic acid from striatal tissue using high performance liquid chromatography with electrochemical detection. Journal of Neuroscience Methods. 11 (1), 19-28 (1984).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2007).
- Dailey, J. W., Reith, M. E. A., Steidley, K. R., Milbrandt, J. C., Jobe, P. C. Carbamazepine-induced release of serotonin from rat hippocampus in vitro. Epilepsia. 39 (10), 1054-1063 (1998).
- Buskila, Y., et al. Extending the viability of acute brain slices. Scientific Reports. 4, 5309 (2014).
- Mewes, A., Franke, H., Singer, D. Organotypic brain slice cultures of adult transgenic P301S mice-A model for tauopathy studies. PLoS One. 7 (9), (2012).
- Rönicke, R., et al. AB mediated diminution of MTT reduction - An artefact of single cell culture. PLoS One. 3 (9), (2008).
- Ihalainen, J. A., Riekkinen, P., Feenstra, M. G. P. Comparison of dopamine and noradrenaline release in mouse prefrontal cortex, striatum and hippocampus using microdialysis. Neuroscience Letters. 277 (2), 71-74 (1999).
- Richards, D. A., Obrenovitch, T. P., Symon, L., Curzon, G. Extracellular dopamine and serotonin in the rat striatum during transient ischaemia of different severities: a microdialysis study. Journal of Neurochemistry. 60 (1), 128-136 (1993).
- Fog, J. U., et al. Calmodulin kinase II interacts with the dopamine transporter C terminus to regulate amphetamine-induced reverse transport. Neuron. 51 (4), 417-429 (2006).
- Balázsa, T., Bíró, J., Gullai, N., Ledent, C., Sperlágh, B. CB1-cannabinoid receptors are involved in the modulation of non-synaptic [3H]serotonin release from the rat hippocampus. Neurochemistry International. 52 (1), 95-102 (2008).
- Schechter, L. E. The potassium channel blockers 4-aminopyridine and tetraethylammonium increase the spontaneous basal release of [3H]5-hydroxytryptamine in rat hippocampal slices. The Journal of Pharmacology and Experimental Therapeutics. 282 (1), 262-270 (1997).
- Boudanova, E., Navaroli, D. M., Stevens, Z., Melikian, H. E. Dopamine transporter endocytic determinants: carboxy terminal residues critical for basal and PKC-stimulated internalization. Molecular and Cellular Neuroscience. 39 (2), 211-217 (2008).
- Bowyer, J. F., et al. Interactions of MK-801 with glutamate-, glutamine- and methamphetamine-evoked release of [3H]dopamine from striatal slices. The Journal of Pharmacology and Experimental Therapeutics. 257 (1), 262-270 (1991).
- Perszyk, R. E., et al. GluN2D-containing N-methyl-D-aspartate receptors mediate synaptic transmission in hippocampal interneurons and regulate interneuron activity. Molecular Pharmacology. 90 (6), 689-702 (2016).
- Jones, S. R., et al. Profound neuronal plasticity in response to inactivation of the dopamine transporter. Proceedings of the National Academy of Sciences of the United States of America. 95 (7), 4029-4034 (1998).
- Jedema, H. P., Narendran, R., Bradberry, C. W. Amphetamine-induced release of dopamine in primate prefrontal cortex and striatum: striking differences in magnitude and timecourse. Journal of Neurochemistry. 130, 490-497 (2014).
- Buchmayer, F., et al. Amphetamine actions at the serotonin transporter rely on the availability of phosphatidylinositol-4,5-bisphosphate. Proceedings of the National Academy of Sciences. 110 (28), 11642-11647 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved