Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un test sur plaque pour la mesure de la libération endogène de monoamine dans les tranches cérébrales aiguës
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cette méthode introduit une technique simple pour la détection de la libération endogène de monoamine à l’aide de tranches cérébrales aiguës. La configuration utilise une plaque de 48 puits contenant un support de tissu pour la libération de monoamine. La monoamine libérée est analysée par CLHP couplée à une détection électrochimique. De plus, cette technique fournit une méthode de dépistage pour la découverte de médicaments.
Résumé
Les neurotransmetteurs monoamines sont associés à de nombreuses affections neurologiques et psychiatriques. Des modèles animaux de telles conditions ont montré des altérations de la libération de neurotransmetteurs monoamines et de la dynamique d’absorption. Des méthodes techniquement complexes telles que l’électrophysiologie, la voltampérométrie cyclique à balayage rapide (FSCV), l’imagerie, la microdialyse in vivo, l’optogénétique ou l’utilisation de la radioactivité sont nécessaires pour étudier la fonction de la monoamine. La méthode présentée ici est une approche optimisée en deux étapes pour détecter la libération de monoamine dans les tranches cérébrales aiguës à l’aide d’une plaque de 48 puits contenant des supports de tissu pour examiner la libération de monoamine, et la chromatographie liquide à haute performance couplée à la détection électrochimique (HPLC-ECD) pour la mesure de la libération de monoamine. En bref, des coupes cérébrales de rats contenant des régions d’intérêt, y compris le cortex préfrontal, l’hippocampe et le striatum dorsal, ont été obtenues à l’aide d’un slicer tissulaire ou d’un vibratome. Ces régions d’intérêt ont été disséquées de tout le cerveau et incubées dans un tampon physiologique oxygéné. La viabilité a été examinée tout au long de la période expérimentale, par un essai de bromure de 3-(4,5-diméthylthiazol-2-yl)-2,5-diphényltétrazolium (MTT). Les régions cérébrales disséquées de manière aiguë ont été incubées dans diverses conditions médicamenteuses connues pour induire la libération de monoamine par le transporteur (amphétamine) ou par l’activation de la libération vésiculeuse exocytotique (KCl). Après l’incubation, les produits libérés dans le surnageant ont été collectés et analysés à l’aide d’un système HPLC-ECD. Ici, la libération de monoamine basale est détectée par HPLC à partir de tranches cérébrales aiguës. Ces données corroborent les résultats in vivo et in vitro antérieurs montrant que l’AMPH et le KCl induisent la libération de monoamines. Cette méthode est particulièrement utile pour étudier les mécanismes associés à la libération dépendante du transporteur de monoamine et offre la possibilité de filtrer les composés affectant la libération de monoamine de manière rapide et peu coûteuse.
Introduction
Une pléthore de maladies neurologiques et psychiatriques sont associées à un dérèglement ou à un entretien insuffisant du neurotransmetteur monoamine (dopamine [DA], sérotonine [5-HT], noradrénaline [NE]) homéostasie1,2,3. Ces conditions comprennent, sans toutefois s’y limiter, la dépression1,2, la schizophrénie2, l’anxiété2, la dépendance4, la ménopause5,6,7, la douleur8 et la maladie de Parkinson3. Par exemple, plusieurs modèles de ménopause chez le rat ont montré que le dérèglement ou la réduction des monoamines dans l’hippocampe, le cortex préfrontal et le striatum peut être associé à la dépression et au déclin cognitif, ce qui est observé chez les femmes ménopausées. La dérégulation des monoamines dans ces modèles a été largement examinée à l’aide de HPLC-ECD, bien que les études n’aient pas fait de distinction entre la teneur mesurée en neurotransmetteurs et la libération de neurotransmetteurs5,6,7. Les monoamines sont classiquement libérées dans l’espace extracellulaire par libération vésiculeuse dépendante du Ca2+9 et sont recyclées par leur système de recapture de la membrane plasmique respectif (transporteur de dopamine, DAT; transporteur de sérotonine, SERT; transporteur de noradrénaline, NET)10,11. Inversement, les données suggèrent que ces transporteurs sont capables de libérer ou d’efflux des monoamines, puisque les drogues d’abus telles que l’amphétamine (AMPH) et la 3,4-méthylènedioxyméthamphétamine (MDMA) sont connues pour libérer du DA et du 5-HT, respectivement par le biais de leurs systèmes de transport12,13,14,15,16,17 . Ainsi, une bonne compréhension mécaniste de la dynamique de libération de monoamine est cruciale pour développer des pharmacothérapies spécifiques et ciblées.
Un large éventail de techniques ont été utilisées pour étudier la libération de monoamines telles que la voltampérométrie cyclique à balayage rapide (FSCV)18, la microdialyse in vivo13, l’imagerie19, la préincubation avec des monoamines radiomarquées20, l’optogénétique et, plus récemment, les capteurs fluorescents et la photométrie génétiquement codés21,22 . Le FSCV et la microdialyse in vivo sont les principales techniques utilisées pour étudier la libération de monoamines. Le FSCV est utilisé pour étudier la libération exocytotique stimulée de DA principalement dans les tranches cérébrales aiguës et in vivo23. Étant donné que le FSCV utilise des électrodes pour stimuler ou évoquer la libération, la principale source de libération de neurotransmetteurs est la libération vésiculeuse dépendante du Ca2+18,24,25,26,27,28,29,30,31 . La microdialyse in vivo couplée à la CLHP mesure les changements dans les niveaux de neurotransmetteurs extracellulaires à l’aide d’une sonde placée dans une zone d’intérêt cérébral13,32. Comme pour le FSCV, une limitation majeure de la microdialyse in vivo est la difficulté de déterminer la source de libération de neurotransmetteurs: libération vésiculeuse dépendante de Ca2+ ou dépendante du transporteur. Il convient de noter que les deux méthodes permettent de mesurer directement la libération de monoamine. Grâce aux progrès récents de l’optogénétique, la recherche démontre la détection de la libération de 5-HT et de DA dans un court laps de temps avec une spécificité de type cellulaire exquise21,22. Cependant, ces stratégies nécessitent des techniques et de l’équipement complexes et coûteux, et mesurent indirectement la libération de monoamine, en particulier par la liaison de la monoamine aux récepteurs. En outre, les monoamines radiomarquées sont également utilisées pour étudier la dynamique des monoamines. Les monoamines radiomarquées peuvent être préchargées dans divers systèmes modèles tels que les cellules hétérologues surexprimant chaque transporteur de monoamine20,33,34,35,36,37,38,39,40, les neurones primaires20, les synaptosomes33,39,41, 42, et des tranches de cerveau aiguës43,44. Cependant, la radioactivité présente des dommages potentiels pour l’expérimentateur, et les analytes marqués au tritium peuvent ne pas récapituler fidèlement la dynamique endogène de la monoamine45,46. Les systèmes de superfusion combinés à des méthodes de détection hors ligne telles que HPLC-ECD ont permis la détection de monoamines provenant de sources tissulaires multiples. Ici, ce protocole fournit une méthode optimisée et peu coûteuse, simple et précise utilisant des tranches cérébrales aiguës pour mesurer directement la libération endogène basale et stimulée de monoamine.
Les tranches cérébrales aiguës permettent de tester des hypothèses mécanistes, principalement car elles préservent le microenvironnement anatomique in vivo et maintiennent intactes les synapses47,48,49,50,51,52. Dans quelques études, des tranches cérébrales aiguës ou du tissu cérébral haché ont été utilisés en conjonction avec une technique de superfusion utilisant KCl pour stimuler la libération médiée par Ca2+53,54,55,56. Les systèmes de superfusion ont été essentiels pour faire progresser la compréhension du domaine des mécanismes de libération de neurotransmetteurs, y compris les monoamines. Cependant, ces systèmes sont relativement coûteux et le nombre de chambres disponibles pour l’analyse des tissus varie de 4 à 12. En comparaison, la méthode présentée ici est peu coûteuse, permet la mesure de 48 échantillons de tissus et peut être affinée pour utiliser jusqu’à 96 échantillons de tissus. Chaque puits dans la plaque de 48 puits contient des porte-tissus qui utilisent des filtres pour séparer le produit libéré du tissu, et les monoamines libérées sont ensuite collectées et analysées par HPLC-ECD. Il est important de noter que cette méthode permet de mesurer simultanément la libération de 5-HT, DA et NE de différentes zones du cerveau telles que le cortex préfrontal, l’hippocampe et le striatum dorsal après traitement avec des agents pharmacologiques qui modulent la libération de monoamine. Ainsi, l’expérimentateur peut répondre à plusieurs questions à l’aide d’un système multi-puits peu coûteux qui augmente le nombre d’échantillons testés et réduit ainsi le nombre d’animaux utilisés.
Protocole
Toutes les expériences, y compris la manipulation des animaux et la collecte de tissus, ont été menées conformément à l’Université de Floride et au City College of New York Institutional Animal Care and Use Committee (IACUC), conformément aux protocoles approuvés 201508873 (UF) et 1071 (CCNY). Pour les réactifs et la mémoire tampon, reportez-vous au fichier supplémentaire.
1. Préparez des tranches de cerveau de rat aiguës
REMARQUE: Dans cette expérience, des rats mâles adultes (250-350 g) ont été utilisés. Cependant, cette configuration est fonctionnelle pour différents points de développement, les rats femelles et d’autres espèces. Si vous utilisez un animal plus petit, comme des souris, l’expérimentateur peut s’ajuster pour optimiser le protocole en utilisant un nombre différent de tranches de cerveau ou de coups de poing par condition. Le tampon de dissection sera appelé tampon 1; Le tampon d’efflux sera appelé tampon 2.
- Préparez le tampon 1 comme indiqué dans le fichier supplémentaire. Saturer le tampon 1 avec de l’oxygène en bouillonnant à 95%/5% (O2/CO2) pendant 20 min sur glace. Retirer 50 mL de tampon 1 et laisser refroidir sur la glace dans un petit bécher ou une boîte de Pétri. Ce tampon est utilisé pour maintenir le cerveau entier récolté de manière aiguë.
- Anesthésiez un ou deux rats adultes (250-350 g) avec 1% à 2% d’isoflurane, décapitez-les à l’aide d’une guillotine et retirez rapidement leur cerveau. Placez immédiatement le cerveau dans le tampon oxygéné 1 glacé dans le récipient à partir de l’étape 1.1.
REMARQUE: Assurez-vous que l’isoflurane et la guillotine sont utilisés en toute sécurité. Ouvrez l’isoflurane sous une hotte aspirante. - À l’aide d’un vibratome ou d’un compresstome, coupez 300 μm de sections coronales du cerveau de chaque région d’intérêt (Figure 1). Le tampon bouillonnant 1 doit être présent pendant la fabrication des sections. À l’aide d’une spatule en acier inoxydable, transférez soigneusement et immédiatement les tranches de cerveau dans une nouvelle boîte de Pétri remplie de tampon 1 oxygéné glacé (Figure 2).
- Disséquez davantage les tranches de cerveau (p. ex., poinçons, découpes) en déplaçant soigneusement les tranches sur des lames de verre (figure 1G) à l’aide de l’atlas du cerveau de rat57. Par exemple, identifiez le striatum dorsal en fonction de sa structure sombre et striée, et identifiez l’hippocampe en fonction de sa proximité avec le cortex et de sa structure spirale unique. Les hémisphères droit et gauche peuvent être séparés pour être utilisés comme tranches témoins et expérimentales (figures 2G - H). Ici, le striatum dorsal a ensuite été disséqué en poinçons de 2 mm (Figure 1G).
- À l’aide d’une pipette de transfert en plastique avec la pointe coupée, transférez des tranches ou des poinçons cérébraux dans de petits récipients immergés dans le tampon 1 oxygéné glacé avec bouillonnement d’oxygène. Ces récipients peuvent être en treillis d’acier inoxydable ou de petites boîtes de Petri remplies de tampon (Figure 1H).
2. Libération ex-vivo de monoamine endogène à partir de tranches de cerveau ou de poinçons
REMARQUE : Le dispositif utilisé pour cette section se compose d’une plaque de 48 puits et d’un porte-tissu composé de six unités de filtre de microcentrifugation sans les filtres encastrés reliés à une ligne de carbogène (Figure 2). Pour fabriquer le support, utilisez une tige en plastique robuste (par exemple, d’un grattoir à cellules) et super collez les unités de filtre de microcentrifugation sans les filtres encastrés. Laissez sécher pendant 1-2 jours. Le temps nécessaire à l’expérience de libération endogène de monoamine et les concentrations d’amphétamine, de fluoxétine et de cocaïne sont basés sur la littérature actuelle et les protocoles précédents13,20,58.
-
Activation tissulaire
- Transférer le tissu cérébral de l’étape 1.1.5 à chaque puits de la chambre d’efflux et permettre la récupération pendant 30 à 50 min à 37 °C sur un slide warmer dans 0,5-1 mL de tampon oxygéné 2, avec un bouillonnement constant et doux (Figure 2B1).
- Au cours de cette incubation, diluer les médicaments à la concentration souhaitée pour l’expérience. Tous les médicaments doivent être dissous dans le tampon 2, et les concentrations sont basées sur la littérature actuelle.
-
Première incubation
- Déplacez le porte-tissu avec du tissu cérébral vers des puits contenant 500 μL de tampon oxygéné 2 et incubez pendant 20 min à 37 °C. Assurez-vous que peu ou pas de tampon est transporté en tapotant le support sur le bord du puits jusqu’à ce qu’aucun tampon excédentaire ne soit dans le support.
- Dans les expériences avec des agents pharmacologiques tels que les inhibiteurs du transporteur de monoamine, incuber les échantillons de tissus avec les médicaments dilués dans le tampon oxygéné 2 (par exemple, 10 μM de fluoxétine, 40 μM de cocaïne; voir la figure 2B2). Le volume final dans chaque puits sera de 500 μL.
-
Deuxième incubation
- Déplacez le support avec le tissu vers un nouvel ensemble de puits contenant 500 μL de tampon 2 total avec ou sans la concentration souhaitée de chaque médicament. Assurez-vous qu’il ne reste pas de tampon en excès. Chaque puits représente un n = 1 pour les conditions expérimentales. Chaque condition expérimentale est réalisée en trois exemplaires.
- Un puits comprend un tampon oxygéné 2, le prochain AMPH de 10 à 30 μM et le puits final comprend un AMPH de 10 à 30 μM plus des inhibiteurs de transporteur de monoamine. Chaque médicament est dissous dans le tampon oxygéné 2.
- Incuber le tissu pendant 20 min à 37 °C avec 500 μL de la condition médicamenteuse.
REMARQUE: Des puits supplémentaires peuvent inclure un tampon K + élevé oxygéné 2 avec ou sans les inhibiteurs du transporteur de monoamine. Dissoudre chaque médicament dans le tampon oxygéné 2 (500 μL). - Au cours de cette deuxième incubation de 20 min, prélever la solution des puits de la première incubation à l’étape 2.2.1 et la transférer dans des tubes microcentrifuges contenant 50 μL d’acide perchlorique 1 N ou d’acide phosphorique (selon le type de CLHP, concentration finale 0,1 N). Le volume final de l’échantillon sera de 550 μL. Maintenir les tubes de microcentrifugation sur la glace et étiqueter les tubes #1.
- Après la deuxième incubation de 20 min, déplacez le porte-tissu avec des sections cérébrales ou des poinçons vers un puits vide et maintenez la plaque sur de la glace. Transférer le surnageant dans des tubes de microcentrifugation contenant 50 μL d’acide perchlorique 1 N ou d’acide phosphorique. Le volume final de l’échantillon sera de 550 μL. Maintenir les tubes de microcentrifugation sur la glace et étiqueter les tubes #2.
- Ajouter 1 mL de tampon glacé 1 à chaque puits contenant du tissu. Prélever tout le tissu à l’aide d’une petite pince à épiler et le transférer dans des tubes de microcentrifugation propres.
- Maintenir les tubes avec du tissu cérébral à -80 °C. Jetez les 1 mL de tampon 1 (Figure 2B4).
- Solutions filtrantes obtenues à partir de chaque incubation à l’aide de tubes filtrants en microcentrifugeuse (0,22 μm) à 2 500 x g pendant 2 min. Utilisez le filtrat pour déterminer la teneur en monoamine à l’aide de la CLHP avec détection électrochimique (Figure 2B5).
3. Viabilité des tissus
- Essai MTT
REMARQUE: Une préoccupation importante concernant cette configuration expérimentale est la viabilité des tissus, car le tissu peut être utilisé jusqu’à plusieurs heures59. Un test MTT60,61 est utilisé pour déterminer la viabilité des tissus à la fin de l’expérimentation. Ce dosage est basé sur la conversion du sel de tétrazolium jaune MTT (3-(4,5-diméthylthiazol-2-yl)-2,5-bromure de diphényltétrazolium) en cristaux de formazan violet par des cellules viables ayant un métabolisme adéquat.- Après l’expérience, maintenez un groupe distinct d’échantillons de tissus et séparez-les en deux groupes.
- Incuber un groupe pendant 20 min à 37 °C dans du Triton X-100 (1 %) dissous dans le tampon 2 comme témoin. Le traitement par Triton X-100 entraîne la mort cellulaire. Maintenir le deuxième groupe dans le tampon 2 et ne pas incuber dans Triton X-100 (contrôle de la viabilité tissulaire).
- Ajouter mtT (solution mère 5 mg/mL dans pbS, pH 7,4) aux deux groupes dans le tampon oxygéné 2 jusqu’à une concentration finale de 0,5 mg/mL.
- Incuber les échantillons de tissus pendant 20 min à 37 °C, laver avec du PBS et transférer dans des tubes de microcentrifugation contenant 250 μL d’un mélange de FDS (10 %, p/v), de DMF (25 %, v/v) et d’eau pour dissoudre les cristaux de formazan.
- Incuber les échantillons pendant 24 h.
- Centrifuger les tubes à 10 000 x g pendant 10 min et mesurer l’absorbance du surnageant (200 μL) à 562 nm et 690 nm à l’aide d’un lecteur de microplaques. La viabilité tissulaire est calculée comme suit : (A562-A690)/poids des tissus.
4. Analyse CLHP des monoamines
- Quantifier les rejets de monoamine de chaque condition expérimentale à l’aide de HPLC-ECD selon les protocoles précédents13,44, à l’aide d’une colonne de phase inverse.
- Préparez la phase mobile requise pour la détection. Il s’agit de 100 mM d’acide phosphorique, 100 mM d’acide citrique, 0,1 mM d’EDTA-Na2, 600 mg/L d’acide octanesulfonique, 8 % v/v d’acétonitrile (pH final de 6,0). La composition de la phase mobile dépend du type de CLHP et de la colonne utilisée.
- Réglez le potentiel du détecteur électrochimique (électrode de carbone vitreuse de 2 mm) sur 0,46 V et réglez le débit à 0,05 mL/ min.
- Chargez 5 μL de chaque échantillon, y compris les étalons de neurotransmetteurs, dans la CLHP pour l’auto-injection et la détection. La quantité de chaque échantillon ajouté dépend du type de CLHP utilisé.
- Une fois l’exécution de la CLHP terminée, utilisez le logiciel d’analyse HPLC donné pour acquérir et analyser les données du chromatographe.
- Analyser la teneur en monoamine à l’aide d’une courbe standard composée de chaque monoamine (Dopamine: DA, Noradrénaline: NE et Sérotonine: 5-HT; Figure 2C). Utilisez les chromatogrammes résultants pour obtenir l’aire sous la courbe (ASC) en fonction des directives du fabricant.
5. Préparation des lysats tissulaires pour la quantification des protéines
-
Dosage des protéines
- Ajouter un tampon de lyse glacé et des inhibiteurs de la protéase (0,1 g/1 mL) à chaque tube de microcentrifugation contenant des sections cérébrales / poinçons et homogénéiser à l’aide d’un homogénéisateur de pilon. Les tubes de microcentrifugation doivent être maintenus sur la glace tout en homogénéisant pour éviter la dégradation des protéines.
- Incuber les homogénats tissulaires pendant 1 h à 4 °C avec une légère rotation.
- Le tissu centrifuge homogénéise à 16 000 x g pendant 15 min à 4 °C et récupère le surnageant.
- Déterminer la concentration en protéines dans les surnageants, avec l’albumine sérique bovine (BSA) comme norme.
- Normaliser la teneur en monoamine de chaque échantillon de cerveau à la teneur totale en protéines (μg) mesurée dans 250 μL de tissu cérébral lysé. Utilisez la formule ci-dessous pour déterminer la monoamine nmol / g de protéine. df = facteur de dilution.
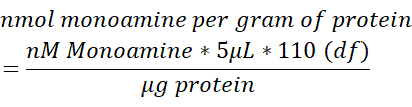
6. Analyse statistique
- Analyser la libération de monoamine (nmol / g) à l’aide d’ANOVA unidirectionnelle, suivie du test de comparaisons multiples de Sidak pour les comparaisons post-hoc.
- Analyser la viabilité des tissus à l’aide d’un test t de Unpaired Student pour des groupes indépendants (Contrôle vs 1% Triton X-100).
- Pour toutes les analyses statistiques, définissez le niveau alpha sur ≤ 0,05.
Résultats
Cette technique décrit l’utilisation de tranches cérébrales pour mesurer la libération de monoamines endogènes à l’aide de la CLHP avec détection électrochimique basée sur une plaque de 48 puits avec un support de tissu interne. La configuration expérimentale est illustrée à la figure 1 et à la figure 2. Initialement, pour assurer la viabilité des tissus à la fin de l’expérimentation, un essai MTT (3-(4,5-di...
Discussion
Des mesures de libération de monoamine ont été effectuées pendant des années dans un certain nombre de systèmes tels que les cellules hétérologues, les cultures neuronales, les synaptosomes cérébraux, les tranches cérébrales aiguës ex vivo et les animaux entiers13,20,41,42,58,64,65,66,67,68
Déclarations de divulgation
Les auteurs n’ont aucune divulgation.
Remerciements
Ce travail a été soutenu par des subventions Fondecyt Initiation Fund N 11191049 à J.A.P. et niH grant DA038598 à G.E.T.
matériels
| Name | Company | Catalog Number | Comments |
| 48 Well plate | NA | NA | Assay |
| Acetonitrile | Fischer Scientific | A998-1 | Mobile Phase |
| Calcium Chloride Ahydrous | Sigma Aldrich | C1016 | Modified Artifical Cerebrospinal Fluid OR Efflux Buffer |
| Clarity Software | Anetc | ||
| Citric Acid | Sigma Aldrich | Mobile Phase | |
| D-(+)-Glucose | Sigma | 1002608421 | Dissection Buffer |
| DMF | Sigma Aldrich | D4551 | MTT Assay |
| EDTA-Na2 | Sigma Aldrich | Mobile Phase | |
| GraphPad Software | Graphpad Software, Inc | Statistical Analysis | |
| Glycerol | Sigma Aldrich | G5516 | Lysis buffer |
| HEPES | Sigma Aldrich | H3375 | Lysis buffer |
| HPLC, Decade Amperometric | Anetc | HPLC, LC-EC system | |
| HPLC | Amuza | HPLC HTEC-510. | |
| L-Asrobic Acid | Sigma Aldrich | A5960 | Dissection Buffer |
| Magnesium Sulfate | Sigma | 7487-88-9 | KH Buffer |
| Microcentrifuge Filter Units UltraFree | Millipore | C7554 | Assay - 6 to fit in 48 well plate |
| MTT | Thermo Fisher | M6494 | MTT Assay |
| Nanosep | VWR | 29300-606 | Assay; protein assay |
| Octanesulfonic acid | Sigma Aldrich | V800010 | Mobile Phase |
| Pargyline Clorohydrate | Sigma Aldrich | P8013 | Modified Artifical Cerebrospinal Fluid OR Efflux Buffer |
| Phosphoric Acid | Sigma Aldrich | Mobile Phase | |
| Potassium Chloride | Sigma | 12636 | KH Buffer |
| Potassium Phosphate Monobasic | Sigma | 1001655559 | KH Buffer |
| Precisonary VF-21-0Z | Precissonary | Compresstome | |
| Protease Inhibitor Cocktail | Sigma Aldrich | P2714 | Lysis buffer. |
| Sodium Bicarbonate | Sigma | S5761 | Dissection Buffer |
| Sodium Bicarbonate | Sigma Aldrich | S5761 | Dissection Buffer |
| Sodium Chloride | Sigma | S3014 | KH Buffer |
| Sodium Dodecyl Sulfate | Sigma Aldrich | L3771 | Lysis buffer |
| Triton X-100 | Sigma Aldrich | T8787 | MTT Assay / Lysis buffer |
Références
- Jesulola, E., Micalos, P., Baguley, I. J. Understanding the pathophysiology of depression: From monoamines to the neurogenesis hypothesis model - are we there yet. Behavioural Brain Research. 341, 79-90 (2018).
- Krystal, J. H., D'Souza, D. C., Sanacora, G., Goddard, A. W., Charney, D. S. Current perspectives on the pathophysiology of schizophrenia, depression, and anxiety disorders. Medical Clinics of North America. 85 (3), 559-577 (2001).
- Barone, P. Neurotransmission in Parkinson's disease: beyond dopamine. European Journal of Neurology. 17 (3), 364-376 (2010).
- Howell, L. L., Kimmel, H. L. Monoamine transporters and psychostimulant addiction. Biochemical Pharmacology. 75 (1), 196-217 (2008).
- Kirshner, Z. Z., et al. Impact of estrogen receptor agonists and model of menopause on enzymes involved in brain metabolism, acetyl-CoA production and cholinergic function. Life Sciences. 256, 117975 (2020).
- Long, T., et al. Comparison of transitional vs surgical menopause on monoamine and amino acid levels in the rat brain. Molecular and Cellular Endocrinology. 476, 139-147 (2018).
- Long, T., et al. Estradiol and selective estrogen receptor agonists differentially affect brain monoamines and amino acids levels in transitional and surgical menopausal rat models. Molecular and Cellular Endocrinology. 496, 110533 (2019).
- Burke, N. N., et al. Enhanced nociceptive responding in two rat models of depression is associated with alterations in monoamine levels in discrete brain regions. Neuroscience. 171 (4), 1300-1313 (2010).
- Lane, J. D., Aprison, M. H. Calciumm-dependent release of endogenous serotonin, dopamine and norepinephrine from nerve endings. Life Sciences. 20 (4), 665-671 (1977).
- Ramamoorthy, S., Shippenberg, T. S., Jayanthi, L. D. Regulation of monoamine transporters: Role of transporter phosphorylation. Pharmacology and Therapeutics. 129 (2), 220-238 (2011).
- Torres, G. E., Gainetdinov, R. R., Caron, M. G. Plasma membrane monoamine transporters: structure, regulation and function. Nature Reviews. Neuroscience. 4 (1), 13-25 (2003).
- Hilber, B., et al. Serotonin-transporter mediated efflux: A pharmacological analysis of amphetamines and non-amphetamines. Neuropharmacology. 49 (6), 811-819 (2005).
- Mauna, J. C., et al. G protein βγ subunits play a critical role in the actions of amphetamine. Translational Psychiatry. 9 (1), 81 (2019).
- Sitte, H. H., Freissmuth, M. Amphetamines, new psychoactive drugs and the monoamine transporter cycle. Trends in Pharmacological Sciences. 36 (1), 41-50 (2015).
- Johnson, L. A., Guptaroy, B., Lund, D., Shamban, S., Gnegy, M. E. Regulation of amphetamine-stimulated dopamine efflux by protein kinase C β. Journal of Biological Chemistry. 280 (12), 10914-10919 (2005).
- Kahlig, K. M., et al. Amphetamine induces dopamine efflux through a dopamine transporter channel. Proceedings of the National Academy of Sciences of the United States of America. 102 (9), 3495-3500 (2005).
- Kantor, L., Hewlett, G. H. K., Gnegy, M. E. Enhanced amphetamine- and K+ -mediated dopamine release in rat striatum after repeated amphetamine: differential requirements for Ca 2+ - and calmodulin-dependent phosphorylation and synaptic vesicles. The Journal of Neuroscience. 19 (10), 3801-3808 (2018).
- Brodnik, Z. D., et al. Susceptibility to traumatic stress sensitizes the dopaminergic response to cocaine and increases motivation for cocaine. Neuropharmacology. 125, 295-307 (2017).
- Henke, A., et al. Toward serotonin fluorescent false neurotransmitters: development of fluorescent dual serotonin and vesicular monoamine transporter substrates for visualizing serotonin neurons. ACS Chemical Neuroscience. 9 (5), 925-934 (2018).
- Garcia-Olivares, J., et al. Gβγ subunit activation promotes dopamine efflux through the dopamine transporter. Molecular Psychiatry. 22 (12), 1673-1679 (2017).
- Xiao, N., Privman, E., Venton, B. J. Optogenetic control of serotonin and dopamine release in Drosophila larvae. ACS Chemical Neuroscience. 5 (8), 666-673 (2014).
- Bass, C. E., et al. Optogenetic control of striatal dopamine release in rats. Journal of Neurochemistry. 114 (5), 1344-1352 (2010).
- Stamford, J. A. Fast cyclic voltammetry: measuring transmitter release in "real time". Journal of Neuroscience Methods. 34 (1-3), 67-72 (1990).
- Brodnik, Z. D., Ferris, M. J., Jones, S. R., España, R. A. Reinforcing doses of intravenous cocaine produce only modest dopamine uptake inhibition. ACS Chemical Neuroscience. 8 (2), 281-289 (2017).
- Brodnik, Z. D., España, R. A. Dopamine uptake dynamics are preserved under isoflurane anesthesia. Neuroscience Letters. 606, 129-134 (2015).
- Ferris, M. J., Calipari, E. S., Yorgason, J. T., Jones, S. R. Examining the complex regulation and drug-induced plasticity of dopamine release and uptake using voltammetry in brain slices. ACS Chemical Neuroscience. 4 (5), 693-703 (2013).
- Siciliano, C. A., Calipari, E. S., Ferris, M. J., Jones, S. R. Biphasic mechanisms of amphetamine action at the dopamine terminal. The Journal of Neuroscience The Official Journal of the Society for Neuroscience. 34 (16), 5575-5582 (2014).
- Rice, M. E., et al. Direct monitoring of dopamine and 5-HT release in substantia nigra and ventral tegmental area in vitro. Experimental Brain Research. 100 (3), 395-406 (1994).
- Bunin, M. A., Prioleau, C., Mailman, R. B., Wightman, R. M. Release and uptake rates of 5-hydroxytryptamine in the dorsal raphe and substantia nigra reticulata of the rat brain. Journal of Neurochemistry. 70 (3), 1077-1087 (1998).
- Park, J., Takmakov, P., Wightman, R. M. In vivo comparison of norepinephrine and dopamine release in rat brain by simultaneous measurements with fast-scan cyclic voltammetry. Journal of Neurochemistry. 119 (5), 932-944 (2011).
- Park, J., Bhimani, R. V., Bass, C. E. In vivo electrochemical measurements of norepinephrine in the brain: current status and remaining challenges. Journal of the Electrochemical Society. 165 (12), 3051-3056 (2018).
- Butcher, S. P., Fairbrother, I. S., Kelly, J. S., Arbuthnott, G. W. Amphetamine-induced dopamine release in the rat striatum: an in vivo microdialysis study. Journal of Neurochemistry. 50 (2), 346-355 (1988).
- Garcia-Olivares, J., et al. Inhibition of dopamine transporter activity by G protein βγ subunits. PLoS One. 8 (3), 1-9 (2013).
- Carneiro, A. M. D., Blakely, R. D. Serotonin-, protein kinase C-, and Hic-5-associated redistribution of the platelet serotonin transporter. Journal of Biological Chemistry. 281 (34), 24769-24780 (2006).
- Rajamanickam, J., et al. Akt-mediated regulation of antidepressant-sensitive serotonin transporter function, cell-surface expression and phosphorylation. The Biochemical Journal. 468 (1), 177-190 (2015).
- Egaña, L. A., et al. Physical and functional interaction between the dopamine transporter and the synaptic vesicle protein synaptogyrin-3. The Journal of Neuroscience The Official Journal of the Society for Neuroscience. 29 (14), 4592-4604 (2009).
- Guptaroy, B., Fraser, R., Desai, A., Zhang, M., Gnegy, M. E. Site-directed mutations near transmembrane domain 1 alter conformation and function of norepinephrine and dopamine transporters. Molecular Pharmacology. 79 (3), 520-532 (2011).
- Ordway, G. A., et al. Norepinephrine transporter function and desipramine: Residual drug effects versus short-term regulation. Journal of Neuroscience Methods. 143 (2), 217-225 (2005).
- Steinkellner, T., et al. Amphetamine action at the cocaine- and antidepressant-sensitive serotonin transporter is modulated by CaMKII. Journal of Neuroscience. 35 (21), 8258-8271 (2015).
- Guptaroy, B., et al. A juxtamembrane mutation in the N terminus of the dopamine transporter induces preference for an inward-facing conformation. Molecular Pharmacology. 75 (3), 514-524 (2009).
- Carpenter, C., et al. Direct and systemic administration of a CNS-permeant tamoxifen analog reduces amphetamine-induced dopamine release and reinforcing effects. Neuropsychopharmacology. 42 (10), 1940-1949 (2017).
- Aquino-Miranda, G., Escamilla-Sánchez, J., González-Pantoja, R., Bueno-Nava, A., Arias-Montaño, J. -. A. Histamine H3 receptor activation inhibits dopamine synthesis but not release or uptake in rat nucleus accumbens. Neuropharmacology. 106, 91-101 (2016).
- Reddy, I. A., et al. Glucagon-like peptide 1 receptor activation regulates cocaine actions and dopamine homeostasis in the lateral septum by decreasing arachidonic acid levels. Translational Psychiatry. 6 (5), 809 (2016).
- Koutzoumis, D. N., et al. Alterations of the gut microbiota with antibiotics protects dopamine neuron loss and improve motor deficits in a pharmacological rodent model of Parkinson's disease. Experimental Neurology. 325, 113159 (2020).
- Herdon, H., Strupish, J., Nahorski, S. R. Differences between the release of radiolabelled and endogenous dopamine from superfused rat brain slices: Effects of depolarizing stimuli, amphetamine and synthesis inhibition. Brain Research. 348 (2), 309-320 (1985).
- Thongsaard, W., Kendall, D. A., Bennett, G. W., Marsden, C. A. A simple method for measuring dopamine release from rat brain slices. Journal of Pharmacological and Toxicological Methods. 37 (3), 143-148 (1997).
- Dorris, D. M., Hauser, C. A., Minnehan, C. E., Meitzen, J. An aerator for brain slice experiments in individual cell culture plate wells. Journal of Neuroscience Methods. 238, 1-10 (2014).
- Humpel, C. Organotypic brain slice cultures: a review. Neuroscience. 305, 86-98 (2015).
- Papouin, T., Haydon, P. Obtaining acute brain slices. BIO-PROTOCOL. 8 (2), 477-491 (2018).
- Collingridge, G. L. The brain slice preparation: a tribute to the pioneer Henry McIlwain. Journal of Neuroscience Methods. 59 (1), 5-9 (1995).
- Yamamoto, C., McIlwain, H. Electrical activities in thin sections from the mammalian brain maintained in chemically-defined media in vitro. Journal of Neurochemistry. 13 (12), 1333-1343 (1966).
- Buskila, Y., et al. Extending the viability of acute brain slices. Scientific Reports. 4, 4-10 (2014).
- Kako, H., Fukumoto, S., Kobayashi, Y., Yokogoshi, H. Effects of direct exposure of green odour components on dopamine release from rat brain striatal slices and PC12 cells. Brain Research Bulletin. 75 (5), 706-712 (2008).
- McBride, W. J., Murphy, J. M., Lumeng, L., Li, T. -. K. Effects of ethanol on monoamine and amino acid release from cerebral cortical slices of the alcohol-preferring P line of rats. Alcoholism: Clinical and Experimental Research. 10 (2), 205-208 (1986).
- Chen, J. C., Turiak, G., Galler, J., Volicer, L. Effect of prenatal malnutrition on release of monoamines from hippocampal slices. Life Sciences. 57 (16), 1467-1475 (1995).
- Becker, J. B., Castañeda, E., Robinson, T. E., Beer, M. E. A simple in vitro technique to measure the release of endogenous dopamine and dihydroxyphenylacetic acid from striatal tissue using high performance liquid chromatography with electrochemical detection. Journal of Neuroscience Methods. 11 (1), 19-28 (1984).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2007).
- Dailey, J. W., Reith, M. E. A., Steidley, K. R., Milbrandt, J. C., Jobe, P. C. Carbamazepine-induced release of serotonin from rat hippocampus in vitro. Epilepsia. 39 (10), 1054-1063 (1998).
- Buskila, Y., et al. Extending the viability of acute brain slices. Scientific Reports. 4, 5309 (2014).
- Mewes, A., Franke, H., Singer, D. Organotypic brain slice cultures of adult transgenic P301S mice-A model for tauopathy studies. PLoS One. 7 (9), (2012).
- Rönicke, R., et al. AB mediated diminution of MTT reduction - An artefact of single cell culture. PLoS One. 3 (9), (2008).
- Ihalainen, J. A., Riekkinen, P., Feenstra, M. G. P. Comparison of dopamine and noradrenaline release in mouse prefrontal cortex, striatum and hippocampus using microdialysis. Neuroscience Letters. 277 (2), 71-74 (1999).
- Richards, D. A., Obrenovitch, T. P., Symon, L., Curzon, G. Extracellular dopamine and serotonin in the rat striatum during transient ischaemia of different severities: a microdialysis study. Journal of Neurochemistry. 60 (1), 128-136 (1993).
- Fog, J. U., et al. Calmodulin kinase II interacts with the dopamine transporter C terminus to regulate amphetamine-induced reverse transport. Neuron. 51 (4), 417-429 (2006).
- Balázsa, T., Bíró, J., Gullai, N., Ledent, C., Sperlágh, B. CB1-cannabinoid receptors are involved in the modulation of non-synaptic [3H]serotonin release from the rat hippocampus. Neurochemistry International. 52 (1), 95-102 (2008).
- Schechter, L. E. The potassium channel blockers 4-aminopyridine and tetraethylammonium increase the spontaneous basal release of [3H]5-hydroxytryptamine in rat hippocampal slices. The Journal of Pharmacology and Experimental Therapeutics. 282 (1), 262-270 (1997).
- Boudanova, E., Navaroli, D. M., Stevens, Z., Melikian, H. E. Dopamine transporter endocytic determinants: carboxy terminal residues critical for basal and PKC-stimulated internalization. Molecular and Cellular Neuroscience. 39 (2), 211-217 (2008).
- Bowyer, J. F., et al. Interactions of MK-801 with glutamate-, glutamine- and methamphetamine-evoked release of [3H]dopamine from striatal slices. The Journal of Pharmacology and Experimental Therapeutics. 257 (1), 262-270 (1991).
- Perszyk, R. E., et al. GluN2D-containing N-methyl-D-aspartate receptors mediate synaptic transmission in hippocampal interneurons and regulate interneuron activity. Molecular Pharmacology. 90 (6), 689-702 (2016).
- Jones, S. R., et al. Profound neuronal plasticity in response to inactivation of the dopamine transporter. Proceedings of the National Academy of Sciences of the United States of America. 95 (7), 4029-4034 (1998).
- Jedema, H. P., Narendran, R., Bradberry, C. W. Amphetamine-induced release of dopamine in primate prefrontal cortex and striatum: striking differences in magnitude and timecourse. Journal of Neurochemistry. 130, 490-497 (2014).
- Buchmayer, F., et al. Amphetamine actions at the serotonin transporter rely on the availability of phosphatidylinositol-4,5-bisphosphate. Proceedings of the National Academy of Sciences. 110 (28), 11642-11647 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon