É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um ensaio baseado em placas para a medição da liberação de monoamina endógena em fatias cerebrais agudas
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este método introduz uma técnica simples para a detecção de liberação endógena de monoamina usando fatias cerebrais agudas. A configuração usa uma placa de 48 poços contendo um suporte de tecido para liberação de monoamina. A monoamina liberada é analisada pelo HPLC juntamente com a detecção eletroquímica. Além disso, esta técnica fornece um método de triagem para a descoberta de drogas.
Resumo
Neurotransmissores de monoamina estão associados a inúmeras doenças neurológicas e psiquiátricas. Modelos animais de tais condições têm mostrado alterações na liberação e dinâmica de absorção de neurotransmissores de monoamina. Métodos tecnicamente complexos como eletrofisiologia, Voltammetry Ciclílica de Varredura Rápida (FSCV), imagem, microdiálise in vivo, optogenética ou uso de radioatividade são necessários para estudar a função monoamina. O método aqui apresentado é uma abordagem otimizada em duas etapas para detectar a liberação de monoamina em fatias cerebrais agudas usando uma placa de 48 poços contendo suportes teciduais para examinar a liberação de monoamina, e cromatografia líquida de alto desempenho, juntamente com a detecção eletroquímica (HPLC-ECD) para medição de liberação de monoamina. Resumidamente, seções cerebrais de ratos contendo regiões de interesse, incluindo córtex pré-frontal, hipocampo e estriado dorsal foram obtidas usando um cortador de tecido ou vibratome. Essas regiões de interesse foram dissecadas de todo o cérebro e incubadas em um tampão fisiológico oxigenado. A viabilidade foi examinada ao longo do curso de tempo experimental, por 3-(4,5-dimetilthiazol-2-yl)-2,5-diphenyltetrazolium brometo (MTT). As regiões cerebrais dissecadas agudamente foram incubadas em diferentes condições de drogas que são conhecidas por induzir a liberação de monoamina através do transportador (anfetamina) ou através da ativação da liberação vesicular exociótica (KCl). Após a incubação, os produtos liberados no supernasciente foram coletados e analisados por meio de um sistema HPLC-ECD. Aqui, a liberação de monoamina basal é detectada pelo HPLC a partir de fatias cerebrais agudas. Esses dados suportam resultados in vivo e in vitro anteriores mostrando que a versão de amph e kcl induzem a liberação de monoamina. Este método é particularmente útil para estudar mecanismos associados à liberação dependente de transporte de monoamina e oferece uma oportunidade de triagem de compostos que afetam a liberação de monoamina de forma rápida e de baixo custo.
Introdução
Uma infinidade de doenças neurológicas e psiquiátricas estão associadas à desregulação ou à manutenção insuficiente do neurotransmissor de monoamina (dopamina [DA], serotonina [5-HT], norrepinefrina [NE]) homeostasis1,2,3. Essas condições incluem, mas não se limitam a, depressão1,2, esquizofrenia2, ansiedade2, vício4, menopausa5,6,7, dor8 e doença de Parkinson3. Por exemplo, vários modelos de ratos da menopausa mostraram que a desregulação ou redução de monoaminas dentro do hipocampo, córtex pré-frontal e estriato podem estar associados tanto à depressão quanto ao declínio cognitivo, que é visto em mulheres que experimentam a menopausa. A desregulação das monoaminas nesses modelos tem sido extensivamente examinada por meio do HPLC-ECD, embora os estudos não discriminaram o conteúdo medido do neurotransmissor versus a liberação de neurotransmissores5,6,7. As monoaminas são liberadas clássicamente no espaço extracelular através da liberação vesicular dependente de Ca2+, e são recicladas de volta através de seu respectivo sistema de recaptação de membrana plasmática (transportador de dopamina, DAT; transportador de serotonina, SERT; transportador de norepinefrina, NET)10,11. Por outro lado, os dados sugerem que esses transportadores são capazes de liberar ou monoaminas efflux, uma vez que drogas de abuso como anfetamina (ANFE) e 3,4-Methylenedioximethamfetamina (MDMA) são conhecidas por liberar DA e 5-HT, respectivamente através de seus sistemas de transporte12,13, 14,15,16,17 . Assim, uma compreensão mecanicista adequada da dinâmica de liberação de monoaminas é crucial para o desenvolvimento de farmacoterapeias específicas e direcionadas.
Uma ampla gama de técnicas foram empregadas para estudar a liberação de monoaminas como a Voltammetry Ciálica de Varredura Rápida (FSCV)18, in vivo microdiálise13, imagem19, pré-inincubtação com monoaminas radiolabeled20, optogenética e, mais recentemente, sensores fluorescentes geneticamente codificados e fotometria21,22 . A microdiálise FSCV e in vivo são as principais técnicas utilizadas para o estudo da liberação de monoaminas. O FSCV é usado para estudar a liberação exocitomática estimulada de, principalmente, DA em fatias cerebrais agudas e in vivo23. Como o FSCV usa eletrodos para estimular ou evocar a liberação, a principal fonte de liberação de neurotransmissores é a liberação vesicular dependente de Ca218,24,25,26,27,28,29,30,31 . A microdiálise in vivo juntamente com o HPLC mede mudanças nos níveis de neurotransmissor extracelular usando uma sonda colocada em uma área cerebral de interesse13,32. Semelhante ao FSCV, uma grande limitação à microdiálise in vivo é a dificuldade em determinar a fonte de liberação de neurotransmissores: liberação vesicular dependente de Ca2+ ou dependente de transporte. Vale ressaltar que ambos os métodos permitem a medição direta da liberação de monoamina. Através do recente avanço da optogenética, pesquisas demonstram a detecção da liberação de 5-HT e DA em um curto espaço de tempo com especificidade requintada do tipo celular21,22. No entanto, essas estratégias requerem técnicas e equipamentos complexos e caros, e medem indiretamente a liberação de monoamina, especificamente através da monoamina que liga aos receptores. Além disso, as monoaminas radiolabeladas também são usadas para estudar a dinâmica da monoamina. As monoaminas radiolabeladas podem ser pré-carregadas em vários sistemas de modelo, como células heterólogas que superexpressam cada transporte monoamina20,33,34,35,36,37,38,39,40, neurônios primários20, sinapstos33,39,41, 42, e cortes cerebrais agudas43,44. No entanto, a radioatividade representa danos potenciais ao experimentador, e os analitos rotulados com trítio podem não recapitular fielmente a dinâmica endógena da monoamina45,46. Sistemas de superfusão combinados com métodos de detecção off-line, como o HPLC-ECD, permitiram a detecção de monoaminas de múltiplas fontes de tecido. Aqui, este protocolo fornece como um método otimizado e de baixo custo, simples e preciso usando fatias cerebrais agudas para medir diretamente a liberação de basal endógeno e estimulada.
As fatias cerebrais agudas permitem testar hipóteses mecanicistas, principalmente porque preservam o microambiente anatômico in vivo, e mantêm sinapses intactas47,48,49,50,51,52. Em alguns estudos, fatias cerebrais agudas ou tecido cerebral picado têm sido usados em conjunto com uma técnica de superfusão usando KCl para estimular a liberação mediada ca2+53,54,55,56. Os sistemas de superfusão têm sido fundamentais para avançar a compreensão do campo sobre os mecanismos de liberação de neurotransmissores, incluindo as monoaminas. No entanto, esses sistemas são relativamente caros, e o número de câmaras disponíveis para análise de tecidos varia de 4 a 12. Em comparação, o método aqui apresentado é barato, permite a medição de 48 amostras de tecido, podendo ser refinado para usar até 96 amostras de tecido. Cada poço dentro da placa de 48 poços contém suportes de tecido que usam filtros para separar o produto liberado do tecido, e as monoaminas liberadas são então coletadas e analisadas pelo HPLC-ECD. É importante ressaltar que este método permite a medição simultânea de 5-HT, DA e NE de diferentes áreas cerebrais, como o córtex pré-frontal, o hipocampo e o estriado dorsal após o tratamento com agentes farmacológicos que modulam a liberação de monoamina. Assim, o experimentador pode responder a várias perguntas usando um sistema multi-poço barato que aumenta o número de amostras testadas e, assim, reduzindo o número de animais utilizados.
Protocolo
Todos os experimentos, incluindo manejo de animais e coleta de tecidos, foram realizados de acordo com a Universidade da Flórida e o Comitê Institucional de Cuidados e Uso de Animais (IACUC), seguindo o protocolo aprovado 201508873 (UF) e 1071 (CCNY). Para reagentes e tampão, consulte o Arquivo Suplementar.
1. Prepare fatias agudas do cérebro de ratos
NOTA: Neste experimento foram utilizados ratos machos adultos (250-350 g). No entanto, essa configuração é funcional para diferentes pontos de desenvolvimento, ratos fêmeas e outras espécies. Se usar um animal menor, como ratos, o experimentador pode ajustar-se para otimizar o protocolo usando um número diferente de fatias cerebrais ou socos por condição. O buffer de dissecção será referido como Buffer 1; o buffer efflux será referido como Buffer 2.
- Prepare o Buffer 1 conforme mencionado no Arquivo Suplementar. Tampão saturado 1 com oxigênio borbulhando com 95%/5% (O2/CO2) por 20 min no gelo. Remova 50 mL de Buffer 1 e esfrie no gelo em um pequeno béquer ou uma placa de Petri. Este tampão é usado para segurar o cérebro inteiro colhido agudamente.
- Anestesiar um ou dois ratos adultos (250-350 g) com 1%-2% de isoflurane, decapitá-los usando uma guilhotina e remover rapidamente seus cérebros. Coloque imediatamente o cérebro no tampão oxigenado gelado 1 no recipiente a partir do passo 1.1.
NOTA: Certifique-se de que isoflurano e guilhotina sejam usados com segurança. Isoflurano aberto sob um capô de fumaça. - Usando um vibratome ou compresstome, corte 300 μm de seções cerebrais coronais de cada região de interesse (Figura 1). Tampão borbulhante 1 deve estar presente enquanto as seções estão sendo feitas. Usando uma espátula de aço inoxidável, transfira cuidadosamente e imediatamente fatias cerebrais em uma nova placa de Petri cheia de tampão oxigenado gelado 1 (Figura 2).
- Mais dissecar fatias cerebrais (por exemplo, socos, corte) movendo cuidadosamente as fatias para lâminas de vidro (Figura 1G) usando atlas cerebral de rato57. Por exemplo, identifique o estriado dorsal baseado em sua estrutura escura e estriada, e identifique o hipocampo com base em sua proximidade com o córtex e estrutura espiral única. Os hemisférios direito e esquerdo podem ser separados para usar como controle e fatias experimentais (Figuras 2G - H). Aqui, o estriado dorsal foi ainda dissecado em socos de 2 mm (Figura 1G).
- Usando uma pipeta de transferência de plástico com a ponta cortada, transfira fatias ou socos cerebrais em pequenos recipientes imersos em buffer 1 gelado oxigenado com borbulhante de oxigênio. Estes recipientes podem ser de malha de aço inoxidável, ou pequenas placas de Petri cheias de tampão (Figura 1H).
2. Liberação de monoamina endógena ex-vivo de fatias cerebrais ou socos
NOTA: O dispositivo utilizado para esta seção consiste em uma placa de 48 poços e um suporte de tecido feito de seis unidades de filtro de microcentrifuuagem sem os filtros de inset conectados a uma linha de carbogen (Figura 2). Para fazer o suporte, use uma haste de plástico resistente (por exemplo, de um raspador de célula) e super cole as unidades do filtro de microcentrifuagem sem os filtros de entrada para ele. Deixe secar por 1-2 dias. O tempo necessário para o experimento de liberação endógena da monoamina e concentrações de anfetamina, fluoxetina e cocaína são baseados na literatura atual e protocolos anteriores13,20,58.
-
Ativação tecidual
- Transfira o tecido cerebral da etapa 1.1.5 para cada poço da câmara efflux e permita a recuperação por 30-50 min a 37 °C em um aquecedor de slides em 0,5-1 mL de Buffer 2 oxigenado, com borbulhamento constante e suave (Figura 2B1).
- Durante esta incubação, diluir as drogas à concentração desejada para o experimento. Todas as drogas devem ser dissolvidas no Buffer 2, e as concentrações são baseadas na literatura atual.
-
Primeira incubação
- Mova o suporte tecidual com tecido cerebral para poços contendo 500 μL de Buffer oxigenado 2 e incubar por 20 min a 37 °C. Certifique-se de que o mínimo para nenhum buffer seja transportado tocando no suporte na borda do poço até que não haja excesso de buffer no suporte.
- Em experimentos com agentes farmacológicos, como inibidores de transporte de monoamina, incubar as amostras de tecido com as drogas diluídas no Buffer 2 oxigenado (por exemplo, 10 μM fluoxetina, 40 μM de cocaína; ver Figura 2B2). O volume final em cada poço será de 500 μL.
-
Segunda incubação
- Mova o suporte com o tecido para um novo conjunto de poços contendo 500 μL total Buffer 2 com ou sem a concentração desejada de cada droga. Certifique-se de que não há excesso de sobra de buffer. Cada poço representa um n = 1 para condições experimentais. Cada condição experimental é realizada em triplicado.
- Um poço inclui um Buffer 2 oxigenado, o próximo 10-30 μM AMPH, e o poço final inclui 10-30 μM AMPH mais inibidores de transporte de monoamina. Cada droga é dissolvida em Buffer 2 oxigenado.
- Incubar o tecido por 20 min a 37 °C com 500 μL da condição da droga.
NOTA: Poços adicionais podem incluir um buffer K+ alto Oxigenado com ou sem os inibidores do transporte de monoamina. Dissolva cada droga no Buffer oxigenado 2 (500 μL). - Durante esta segunda incubação de 20 min, colete a solução dos poços da primeira incubação na etapa 2.2.1 e transfira para tubos de microcentrifuuge contendo 50 μL de ácido polelorico de 1 N ou ácido fosfórico (dependente do tipo de HPLC, concentração final 0.1 N). O volume final da amostra será de 550 μL. Mantenha tubos de microcentrifuuge no gelo e rotule os tubos #1.
- Após a segunda incubação de 20 minutos, mova o suporte de tecido com seções cerebrais ou socos para um poço vazio e mantenha a placa no gelo. Transfira o supernatante para tubos de microcentrifuuge contendo 50 μL de ácido per polemérico de 1 N ou ácido fosfórico. O volume final da amostra será de 550 μL. Mantenha tubos de microcentrifuuge no gelo e rotule os tubos #2.
- Adicione 1 mL de tampão gelado 1 a cada tecido que contenha poços. Colete todo o tecido usando pinças pequenas e transfira para limpar tubos de microcentrifuuuagem.
- Mantenha tubos com tecido cerebral a -80 °C. Descarte os 1 mL de Tampão 1 (Figura 2B4).
- Soluções de filtro obtidas a partir de cada incubação utilizando tubos de filtro de microcentrifuuge (0,22 μm) a 2.500 x g por 2min. Use o filtrado para determinar o teor de monoamina usando HPLC com detecção eletroquímica (Figura 2B5).
3. Viabilidade tecidual
- Ensaio MTT
NOTA: Uma preocupação significativa em relação a esta configuração experimental é a viabilidade tecidual, pois o tecido pode ser usado por até várias horas59. Um ensaio MTT60,61 é usado para determinar a viabilidade tecidual até o final da experimentação. Este ensaio baseia-se na conversão do sal de tetrazolium amarelo MTT (3-(4,5-dimetilthiazol-2-yl)-2,5-difeniltetrazolium brometo) em cristais de formazan roxo por células viáveis com metabolismo adequado.- O experimento pós-experimento mantém um grupo separado de amostras de tecido e as separa em dois grupos.
- Incubar um grupo por 20 min a 37 °C em Tritão X-100 (1%) dissolvido no Buffer 2 como controle. O tratamento triton X-100 resulta em morte celular. Mantenha o segundo grupo no Buffer 2 e não incubar em Triton X-100 (controle de viabilidade tecidual).
- Adicionar MTT (solução de estoque 5 mg/mL em PBS, pH 7.4) a ambos os grupos no Buffer oxigenado 2 a uma concentração final de 0,5 mg/mL.
- Incubar as amostras de tecido por 20 min a 37 °C, lavar com PBS e transferir para tubos de microcentrifuuge contendo 250 μL de uma mistura de SDS (10%, w/v), DMF (25%, v/v) e água para dissolver os cristais formazan.
- Incubar as amostras por 24 h.
- Centrifugar os tubos a 10.000 x g por 10 min e medir a absorvência do supernante (200 μL) a 562 nm e 690 nm usando um leitor de microplape. A viabilidade tecidual é calculada da seguinte forma: (A562-A690)/peso tecidual.
4. Análise HPLC de monoaminas
- Quantifique a liberação de monoamina de cada condição experimental usando o HPLC-ECD de acordo com protocolos anteriores13,44, usando uma coluna de fase inversa.
- Prepare a fase móvel necessária para detecção. Este é composto por ácido fosfórico de 100 mM, ácido cítrico de 100 mM, 0,1 mM EDTA-Na2, 600 mg/L ácido octanesulfônico, 8% v/v acetonitrila (pH final 6.0). A composição da fase móvel depende do tipo de HPLC e coluna utilizada.
- Defina o potencial do detector eletroquímico (eletrodo de carbono de 2 mm glassy,) para 0,46 V, e defina a vazão para 0,05 mL/min.
- Carregar 5 μL de cada amostra, incluindo padrões de neurotransmissores no HPLC para autoinjeção e detecção. A quantidade de cada amostra adicionada depende do tipo de HPLC utilizado.
- Uma vez que o HPLC tenha concluído a execução, use o software de análise HPLC dado para adquirir e analisar os dados do cromatógrafo.
- Analise o teor de monoamina usando uma curva padrão composta por cada monoamina (Dopamina: DA, Norepinephrine: NE e Serotonina: 5-HT; Figura 2C). Use os cromatógrafos resultantes para obter a área sob a curva (AUC) com base nas diretrizes do fabricante.
5. Preparar tecidos para quantificação de proteínas
-
Ensaio de proteína
- Adicione tampão de lise gelada mais inibidores de protease (0,1 g/1 mL) a cada tubo de microcentrífuga contendo seções/socos cerebrais e homogeneize usando um homogeneizador de pilão. Os tubos de microcentrifuuge devem ser mantidos no gelo enquanto homogeneizam para evitar a degradação da proteína.
- Incubar o tecido homogeneiza por 1h a 4 °C com rotação de luz.
- O tecido centrífuga homogeneiza a 16.000 x g por 15 min a 4 °C e recupera o sobrenante.
- Determine a concentração de proteínas nos supernantes, com albumina de soro bovino (BSA) como padrão.
- Normalize o teor de monoamina em cada amostra cerebral para o teor total de proteína (μg) medido em 250 μL de tecido cerebral lysed. Use a fórmula abaixo para determinar a proteína nmol monoamina/g. df = fator de diluição.
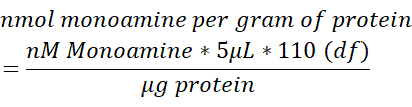
6. Análise estatística
- Analise a liberação de monoamina (nmol/g) usando ANOVA unidirecional seguido do teste de comparações múltiplas de Sidak para comparações pós-hoc.
- Analise a viabilidade do tecido usando o teste t de um aluno não remunerado para grupos independentes (Controle vs. 1% Triton X-100).
- Para todas as análises estatísticas, coloque o nível alfa para ≤ 0,05.
Resultados
Esta técnica descreve o uso de fatias cerebrais para medir a liberação de monoaminas endógenas usando HPLC com detecção eletroquímica baseada em uma placa de 48 poços com um suporte interno de tecido. A configuração experimental é retratada na Figura 1 e Figura 2. Inicialmente, para garantir a viabilidade tecidual até o final da experimentação, foi realizado um ensaio de MTT (4-(4,5-dimetilthiazol-2-yl)-2,5-difenilt...
Discussão
As medidas de liberação de monoaminas têm sido realizadas durante anos em vários sistemas como células heterólogas, culturas neuronais, sinapstosas cerebrais, fatias cerebrais agudas ex vivo e animais inteiros13,20,41,42,58,64,65,66,67,68
Divulgações
Os autores não têm revelações.
Agradecimentos
Este trabalho foi apoiado por subsídios do Fondecyt Initiation Fund N 11191049 a J.A.P. e NIH grant DA038598 à G.E.T.
Materiais
| Name | Company | Catalog Number | Comments |
| 48 Well plate | NA | NA | Assay |
| Acetonitrile | Fischer Scientific | A998-1 | Mobile Phase |
| Calcium Chloride Ahydrous | Sigma Aldrich | C1016 | Modified Artifical Cerebrospinal Fluid OR Efflux Buffer |
| Clarity Software | Anetc | ||
| Citric Acid | Sigma Aldrich | Mobile Phase | |
| D-(+)-Glucose | Sigma | 1002608421 | Dissection Buffer |
| DMF | Sigma Aldrich | D4551 | MTT Assay |
| EDTA-Na2 | Sigma Aldrich | Mobile Phase | |
| GraphPad Software | Graphpad Software, Inc | Statistical Analysis | |
| Glycerol | Sigma Aldrich | G5516 | Lysis buffer |
| HEPES | Sigma Aldrich | H3375 | Lysis buffer |
| HPLC, Decade Amperometric | Anetc | HPLC, LC-EC system | |
| HPLC | Amuza | HPLC HTEC-510. | |
| L-Asrobic Acid | Sigma Aldrich | A5960 | Dissection Buffer |
| Magnesium Sulfate | Sigma | 7487-88-9 | KH Buffer |
| Microcentrifuge Filter Units UltraFree | Millipore | C7554 | Assay - 6 to fit in 48 well plate |
| MTT | Thermo Fisher | M6494 | MTT Assay |
| Nanosep | VWR | 29300-606 | Assay; protein assay |
| Octanesulfonic acid | Sigma Aldrich | V800010 | Mobile Phase |
| Pargyline Clorohydrate | Sigma Aldrich | P8013 | Modified Artifical Cerebrospinal Fluid OR Efflux Buffer |
| Phosphoric Acid | Sigma Aldrich | Mobile Phase | |
| Potassium Chloride | Sigma | 12636 | KH Buffer |
| Potassium Phosphate Monobasic | Sigma | 1001655559 | KH Buffer |
| Precisonary VF-21-0Z | Precissonary | Compresstome | |
| Protease Inhibitor Cocktail | Sigma Aldrich | P2714 | Lysis buffer. |
| Sodium Bicarbonate | Sigma | S5761 | Dissection Buffer |
| Sodium Bicarbonate | Sigma Aldrich | S5761 | Dissection Buffer |
| Sodium Chloride | Sigma | S3014 | KH Buffer |
| Sodium Dodecyl Sulfate | Sigma Aldrich | L3771 | Lysis buffer |
| Triton X-100 | Sigma Aldrich | T8787 | MTT Assay / Lysis buffer |
Referências
- Jesulola, E., Micalos, P., Baguley, I. J. Understanding the pathophysiology of depression: From monoamines to the neurogenesis hypothesis model - are we there yet. Behavioural Brain Research. 341, 79-90 (2018).
- Krystal, J. H., D'Souza, D. C., Sanacora, G., Goddard, A. W., Charney, D. S. Current perspectives on the pathophysiology of schizophrenia, depression, and anxiety disorders. Medical Clinics of North America. 85 (3), 559-577 (2001).
- Barone, P. Neurotransmission in Parkinson's disease: beyond dopamine. European Journal of Neurology. 17 (3), 364-376 (2010).
- Howell, L. L., Kimmel, H. L. Monoamine transporters and psychostimulant addiction. Biochemical Pharmacology. 75 (1), 196-217 (2008).
- Kirshner, Z. Z., et al. Impact of estrogen receptor agonists and model of menopause on enzymes involved in brain metabolism, acetyl-CoA production and cholinergic function. Life Sciences. 256, 117975 (2020).
- Long, T., et al. Comparison of transitional vs surgical menopause on monoamine and amino acid levels in the rat brain. Molecular and Cellular Endocrinology. 476, 139-147 (2018).
- Long, T., et al. Estradiol and selective estrogen receptor agonists differentially affect brain monoamines and amino acids levels in transitional and surgical menopausal rat models. Molecular and Cellular Endocrinology. 496, 110533 (2019).
- Burke, N. N., et al. Enhanced nociceptive responding in two rat models of depression is associated with alterations in monoamine levels in discrete brain regions. Neuroscience. 171 (4), 1300-1313 (2010).
- Lane, J. D., Aprison, M. H. Calciumm-dependent release of endogenous serotonin, dopamine and norepinephrine from nerve endings. Life Sciences. 20 (4), 665-671 (1977).
- Ramamoorthy, S., Shippenberg, T. S., Jayanthi, L. D. Regulation of monoamine transporters: Role of transporter phosphorylation. Pharmacology and Therapeutics. 129 (2), 220-238 (2011).
- Torres, G. E., Gainetdinov, R. R., Caron, M. G. Plasma membrane monoamine transporters: structure, regulation and function. Nature Reviews. Neuroscience. 4 (1), 13-25 (2003).
- Hilber, B., et al. Serotonin-transporter mediated efflux: A pharmacological analysis of amphetamines and non-amphetamines. Neuropharmacology. 49 (6), 811-819 (2005).
- Mauna, J. C., et al. G protein βγ subunits play a critical role in the actions of amphetamine. Translational Psychiatry. 9 (1), 81 (2019).
- Sitte, H. H., Freissmuth, M. Amphetamines, new psychoactive drugs and the monoamine transporter cycle. Trends in Pharmacological Sciences. 36 (1), 41-50 (2015).
- Johnson, L. A., Guptaroy, B., Lund, D., Shamban, S., Gnegy, M. E. Regulation of amphetamine-stimulated dopamine efflux by protein kinase C β. Journal of Biological Chemistry. 280 (12), 10914-10919 (2005).
- Kahlig, K. M., et al. Amphetamine induces dopamine efflux through a dopamine transporter channel. Proceedings of the National Academy of Sciences of the United States of America. 102 (9), 3495-3500 (2005).
- Kantor, L., Hewlett, G. H. K., Gnegy, M. E. Enhanced amphetamine- and K+ -mediated dopamine release in rat striatum after repeated amphetamine: differential requirements for Ca 2+ - and calmodulin-dependent phosphorylation and synaptic vesicles. The Journal of Neuroscience. 19 (10), 3801-3808 (2018).
- Brodnik, Z. D., et al. Susceptibility to traumatic stress sensitizes the dopaminergic response to cocaine and increases motivation for cocaine. Neuropharmacology. 125, 295-307 (2017).
- Henke, A., et al. Toward serotonin fluorescent false neurotransmitters: development of fluorescent dual serotonin and vesicular monoamine transporter substrates for visualizing serotonin neurons. ACS Chemical Neuroscience. 9 (5), 925-934 (2018).
- Garcia-Olivares, J., et al. Gβγ subunit activation promotes dopamine efflux through the dopamine transporter. Molecular Psychiatry. 22 (12), 1673-1679 (2017).
- Xiao, N., Privman, E., Venton, B. J. Optogenetic control of serotonin and dopamine release in Drosophila larvae. ACS Chemical Neuroscience. 5 (8), 666-673 (2014).
- Bass, C. E., et al. Optogenetic control of striatal dopamine release in rats. Journal of Neurochemistry. 114 (5), 1344-1352 (2010).
- Stamford, J. A. Fast cyclic voltammetry: measuring transmitter release in "real time". Journal of Neuroscience Methods. 34 (1-3), 67-72 (1990).
- Brodnik, Z. D., Ferris, M. J., Jones, S. R., España, R. A. Reinforcing doses of intravenous cocaine produce only modest dopamine uptake inhibition. ACS Chemical Neuroscience. 8 (2), 281-289 (2017).
- Brodnik, Z. D., España, R. A. Dopamine uptake dynamics are preserved under isoflurane anesthesia. Neuroscience Letters. 606, 129-134 (2015).
- Ferris, M. J., Calipari, E. S., Yorgason, J. T., Jones, S. R. Examining the complex regulation and drug-induced plasticity of dopamine release and uptake using voltammetry in brain slices. ACS Chemical Neuroscience. 4 (5), 693-703 (2013).
- Siciliano, C. A., Calipari, E. S., Ferris, M. J., Jones, S. R. Biphasic mechanisms of amphetamine action at the dopamine terminal. The Journal of Neuroscience The Official Journal of the Society for Neuroscience. 34 (16), 5575-5582 (2014).
- Rice, M. E., et al. Direct monitoring of dopamine and 5-HT release in substantia nigra and ventral tegmental area in vitro. Experimental Brain Research. 100 (3), 395-406 (1994).
- Bunin, M. A., Prioleau, C., Mailman, R. B., Wightman, R. M. Release and uptake rates of 5-hydroxytryptamine in the dorsal raphe and substantia nigra reticulata of the rat brain. Journal of Neurochemistry. 70 (3), 1077-1087 (1998).
- Park, J., Takmakov, P., Wightman, R. M. In vivo comparison of norepinephrine and dopamine release in rat brain by simultaneous measurements with fast-scan cyclic voltammetry. Journal of Neurochemistry. 119 (5), 932-944 (2011).
- Park, J., Bhimani, R. V., Bass, C. E. In vivo electrochemical measurements of norepinephrine in the brain: current status and remaining challenges. Journal of the Electrochemical Society. 165 (12), 3051-3056 (2018).
- Butcher, S. P., Fairbrother, I. S., Kelly, J. S., Arbuthnott, G. W. Amphetamine-induced dopamine release in the rat striatum: an in vivo microdialysis study. Journal of Neurochemistry. 50 (2), 346-355 (1988).
- Garcia-Olivares, J., et al. Inhibition of dopamine transporter activity by G protein βγ subunits. PLoS One. 8 (3), 1-9 (2013).
- Carneiro, A. M. D., Blakely, R. D. Serotonin-, protein kinase C-, and Hic-5-associated redistribution of the platelet serotonin transporter. Journal of Biological Chemistry. 281 (34), 24769-24780 (2006).
- Rajamanickam, J., et al. Akt-mediated regulation of antidepressant-sensitive serotonin transporter function, cell-surface expression and phosphorylation. The Biochemical Journal. 468 (1), 177-190 (2015).
- Egaña, L. A., et al. Physical and functional interaction between the dopamine transporter and the synaptic vesicle protein synaptogyrin-3. The Journal of Neuroscience The Official Journal of the Society for Neuroscience. 29 (14), 4592-4604 (2009).
- Guptaroy, B., Fraser, R., Desai, A., Zhang, M., Gnegy, M. E. Site-directed mutations near transmembrane domain 1 alter conformation and function of norepinephrine and dopamine transporters. Molecular Pharmacology. 79 (3), 520-532 (2011).
- Ordway, G. A., et al. Norepinephrine transporter function and desipramine: Residual drug effects versus short-term regulation. Journal of Neuroscience Methods. 143 (2), 217-225 (2005).
- Steinkellner, T., et al. Amphetamine action at the cocaine- and antidepressant-sensitive serotonin transporter is modulated by CaMKII. Journal of Neuroscience. 35 (21), 8258-8271 (2015).
- Guptaroy, B., et al. A juxtamembrane mutation in the N terminus of the dopamine transporter induces preference for an inward-facing conformation. Molecular Pharmacology. 75 (3), 514-524 (2009).
- Carpenter, C., et al. Direct and systemic administration of a CNS-permeant tamoxifen analog reduces amphetamine-induced dopamine release and reinforcing effects. Neuropsychopharmacology. 42 (10), 1940-1949 (2017).
- Aquino-Miranda, G., Escamilla-Sánchez, J., González-Pantoja, R., Bueno-Nava, A., Arias-Montaño, J. -. A. Histamine H3 receptor activation inhibits dopamine synthesis but not release or uptake in rat nucleus accumbens. Neuropharmacology. 106, 91-101 (2016).
- Reddy, I. A., et al. Glucagon-like peptide 1 receptor activation regulates cocaine actions and dopamine homeostasis in the lateral septum by decreasing arachidonic acid levels. Translational Psychiatry. 6 (5), 809 (2016).
- Koutzoumis, D. N., et al. Alterations of the gut microbiota with antibiotics protects dopamine neuron loss and improve motor deficits in a pharmacological rodent model of Parkinson's disease. Experimental Neurology. 325, 113159 (2020).
- Herdon, H., Strupish, J., Nahorski, S. R. Differences between the release of radiolabelled and endogenous dopamine from superfused rat brain slices: Effects of depolarizing stimuli, amphetamine and synthesis inhibition. Brain Research. 348 (2), 309-320 (1985).
- Thongsaard, W., Kendall, D. A., Bennett, G. W., Marsden, C. A. A simple method for measuring dopamine release from rat brain slices. Journal of Pharmacological and Toxicological Methods. 37 (3), 143-148 (1997).
- Dorris, D. M., Hauser, C. A., Minnehan, C. E., Meitzen, J. An aerator for brain slice experiments in individual cell culture plate wells. Journal of Neuroscience Methods. 238, 1-10 (2014).
- Humpel, C. Organotypic brain slice cultures: a review. Neuroscience. 305, 86-98 (2015).
- Papouin, T., Haydon, P. Obtaining acute brain slices. BIO-PROTOCOL. 8 (2), 477-491 (2018).
- Collingridge, G. L. The brain slice preparation: a tribute to the pioneer Henry McIlwain. Journal of Neuroscience Methods. 59 (1), 5-9 (1995).
- Yamamoto, C., McIlwain, H. Electrical activities in thin sections from the mammalian brain maintained in chemically-defined media in vitro. Journal of Neurochemistry. 13 (12), 1333-1343 (1966).
- Buskila, Y., et al. Extending the viability of acute brain slices. Scientific Reports. 4, 4-10 (2014).
- Kako, H., Fukumoto, S., Kobayashi, Y., Yokogoshi, H. Effects of direct exposure of green odour components on dopamine release from rat brain striatal slices and PC12 cells. Brain Research Bulletin. 75 (5), 706-712 (2008).
- McBride, W. J., Murphy, J. M., Lumeng, L., Li, T. -. K. Effects of ethanol on monoamine and amino acid release from cerebral cortical slices of the alcohol-preferring P line of rats. Alcoholism: Clinical and Experimental Research. 10 (2), 205-208 (1986).
- Chen, J. C., Turiak, G., Galler, J., Volicer, L. Effect of prenatal malnutrition on release of monoamines from hippocampal slices. Life Sciences. 57 (16), 1467-1475 (1995).
- Becker, J. B., Castañeda, E., Robinson, T. E., Beer, M. E. A simple in vitro technique to measure the release of endogenous dopamine and dihydroxyphenylacetic acid from striatal tissue using high performance liquid chromatography with electrochemical detection. Journal of Neuroscience Methods. 11 (1), 19-28 (1984).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2007).
- Dailey, J. W., Reith, M. E. A., Steidley, K. R., Milbrandt, J. C., Jobe, P. C. Carbamazepine-induced release of serotonin from rat hippocampus in vitro. Epilepsia. 39 (10), 1054-1063 (1998).
- Buskila, Y., et al. Extending the viability of acute brain slices. Scientific Reports. 4, 5309 (2014).
- Mewes, A., Franke, H., Singer, D. Organotypic brain slice cultures of adult transgenic P301S mice-A model for tauopathy studies. PLoS One. 7 (9), (2012).
- Rönicke, R., et al. AB mediated diminution of MTT reduction - An artefact of single cell culture. PLoS One. 3 (9), (2008).
- Ihalainen, J. A., Riekkinen, P., Feenstra, M. G. P. Comparison of dopamine and noradrenaline release in mouse prefrontal cortex, striatum and hippocampus using microdialysis. Neuroscience Letters. 277 (2), 71-74 (1999).
- Richards, D. A., Obrenovitch, T. P., Symon, L., Curzon, G. Extracellular dopamine and serotonin in the rat striatum during transient ischaemia of different severities: a microdialysis study. Journal of Neurochemistry. 60 (1), 128-136 (1993).
- Fog, J. U., et al. Calmodulin kinase II interacts with the dopamine transporter C terminus to regulate amphetamine-induced reverse transport. Neuron. 51 (4), 417-429 (2006).
- Balázsa, T., Bíró, J., Gullai, N., Ledent, C., Sperlágh, B. CB1-cannabinoid receptors are involved in the modulation of non-synaptic [3H]serotonin release from the rat hippocampus. Neurochemistry International. 52 (1), 95-102 (2008).
- Schechter, L. E. The potassium channel blockers 4-aminopyridine and tetraethylammonium increase the spontaneous basal release of [3H]5-hydroxytryptamine in rat hippocampal slices. The Journal of Pharmacology and Experimental Therapeutics. 282 (1), 262-270 (1997).
- Boudanova, E., Navaroli, D. M., Stevens, Z., Melikian, H. E. Dopamine transporter endocytic determinants: carboxy terminal residues critical for basal and PKC-stimulated internalization. Molecular and Cellular Neuroscience. 39 (2), 211-217 (2008).
- Bowyer, J. F., et al. Interactions of MK-801 with glutamate-, glutamine- and methamphetamine-evoked release of [3H]dopamine from striatal slices. The Journal of Pharmacology and Experimental Therapeutics. 257 (1), 262-270 (1991).
- Perszyk, R. E., et al. GluN2D-containing N-methyl-D-aspartate receptors mediate synaptic transmission in hippocampal interneurons and regulate interneuron activity. Molecular Pharmacology. 90 (6), 689-702 (2016).
- Jones, S. R., et al. Profound neuronal plasticity in response to inactivation of the dopamine transporter. Proceedings of the National Academy of Sciences of the United States of America. 95 (7), 4029-4034 (1998).
- Jedema, H. P., Narendran, R., Bradberry, C. W. Amphetamine-induced release of dopamine in primate prefrontal cortex and striatum: striking differences in magnitude and timecourse. Journal of Neurochemistry. 130, 490-497 (2014).
- Buchmayer, F., et al. Amphetamine actions at the serotonin transporter rely on the availability of phosphatidylinositol-4,5-bisphosphate. Proceedings of the National Academy of Sciences. 110 (28), 11642-11647 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados