Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Пластинчатый анализ для измерения эндогенного высвобождения моноаминов в острых срезах мозга
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот метод вводит простую технику обнаружения эндогенного высвобождения моноаминов с использованием острых срезов мозга. Установка использует 48-луночную пластину, содержащую держатель ткани для высвобождения моноамина. Высвобождаемый моноамин анализируется методом ВЭЖХ в сочетании с электрохимическим обнаружением. Кроме того, этот метод обеспечивает метод скрининга для обнаружения лекарств.
Аннотация
Моноаминовые нейротрансмиттеры связаны с многочисленными неврологическими и психическими заболеваниями. Животные модели таких состояний показали изменения в динамике высвобождения и поглощения моноаминных нейротрансмиттеров. Технически сложные методы, такие как электрофизиология, циклическая вольтаметрия быстрого сканирования (FSCV), визуализация, микродиализ in vivo, оптогенетика или использование радиоактивности, необходимы для изучения функции моноаминов. Метод, представленный здесь, представляет собой оптимизированный двухэтапный подход к обнаружению высвобождения моноаминов в острых срезах мозга с использованием 48-луночной пластины, содержащей тканевые держатели для изучения высвобождения моноаминов, и высокоэффективной жидкостной хроматографии в сочетании с электрохимическим обнаружением (ВЭЖХ-ECD) для измерения высвобождения моноамина. Вкратце, участки мозга крыс, содержащие области, представляющие интерес, включая префронтальную кору, гиппокамп и дорсальный стриатум, были получены с использованием тканевого слайсера или вибратома. Эти области, представляющие интерес, были рассечены из всего мозга и инкубированы в насыщенном кислородом физиологическом буфере. Жизнеспособность исследовали на протяжении всего экспериментального временного хода с помощью анализа 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромида (МТТ). Остро рассеченные области мозга инкубировали в различных условиях наркотиков, которые, как известно, индуцируют высвобождение моноамина через транспортер (амфетамин) или через активацию экзоцитотического везикулярного высвобождения (KCl). После инкубации высвобождаемые продукты в супернатанте собирали и анализировали через систему ВЭЖХ-ЭТП. Здесь базальное высвобождение моноамина обнаруживается методом ВЭЖХ из острых срезов мозга. Эти данные подтверждают предыдущие результаты in vivo и in vitro, показывающие, что AMPH и KCl индуцируют высвобождение моноаминов. Этот метод особенно полезен для изучения механизмов, связанных с моноаминным транспортер-зависимым высвобождением, и дает возможность быстро и недорого экранировать соединения, влияющие на высвобождение моноаминов.
Введение
Множество неврологических и психиатрических заболеваний связано с дисрегуляцией или недостаточным поддержанием моноаминового нейромедиатора (дофамин [DA], серотонин [5-HT], норадреналин [NE]) гомеостаза1,2,3. Эти состояния включают, но не ограничиваются ими, депрессию1,2, шизофрению2, беспокойство2, зависимость4, менопаузу5,6,7, боль8 и болезнь Паркинсона3. Например, несколько крысиных моделей менопаузы показали, что дисрегуляция или уменьшение моноаминов в гиппокампе, префронтальной коре и полосатом теле может быть связана как с депрессией, так и с когнитивным снижением, что наблюдается у женщин, испытывающих менопаузу. Дисрегуляция моноаминов в этих моделях была широко изучена с использованием ВЭЖХ-ECD, хотя в исследованиях не проводилось различия между измеренным содержанием нейротрансмиттеров и высвобождением нейротрансмиттеров5,6,7. Моноамины классически высвобождаются во внеклеточное пространство через Ca2+-зависимое везикулярное высвобождение9 и рециркулируются обратно через соответствующую систему обратного захвата плазматической мембраны (транспортер дофамина, DAT; транспортер серотонина, SERT; транспортер норадреналина, NET)10,11. И наоборот, данные свидетельствуют о том, что эти транспортеры способны высвобождать или выбрасывать моноамины, поскольку наркотики злоупотребления, такие как амфетамин (AMPH) и 3,4-метилендиоксиметамфетамин (MDMA), как известно, высвобождают DA и 5-HT, соответственно, через их транспортные системы12,13,14,15,16,17 . Таким образом, правильное механистическое понимание динамики высвобождения моноаминов имеет решающее значение для разработки конкретных и целевых фармакотерапий.
Для изучения высвобождения моноаминов был использован широкий спектр методов, таких как циклическая вольтамперметрия с быстрым сканированием (FSCV)18, микродиализ in vivo13, визуализация19, преинкубация с радиомаркированными моноаминами20, оптогенетика и, в последнее время, генетически закодированные флуоресцентные датчики и фотометрия21,22 . FSCV и микродиализ in vivo являются основными методами, используемыми для изучения высвобождения моноаминов. FSCV используется для изучения стимулированного экзоцитотического высвобождения, в первую очередь, DA в острых срезах мозга и in vivo23. Поскольку FSCV использует электроды для стимуляции или вызова высвобождения, основным источником высвобождения нейротрансмиттера является Ca2+-зависимое везикулярное высвобождение18,24,25,26,27,28,29,30,31 . Микродиализ in vivo в сочетании с ВЭЖХ измеряет изменения уровней внеклеточных нейротрансмиттеров с помощью зонда, помещенного в интересующую область мозга13,32. Подобно FSCV, основным ограничением микродиализа in vivo является трудность определения источника высвобождения нейротрансмиттера: Ca2+ зависимое везикулярное высвобождение или транспортер-зависимый. Примечательно, что оба метода позволяют проводить прямое измерение высвобождения моноаминов. Благодаря недавнему прогрессу оптогенетики исследования демонстрируют обнаружение высвобождения 5-HT и DA за короткий промежуток времени с изысканной специфичностью клеточного типа21,22. Однако эти стратегии требуют сложных и дорогостоящих методов и оборудования и косвенно измеряют высвобождение моноаминов, в частности, через связывание моноаминов с рецепторами. Кроме того, радиомаркированные моноамины также используются для изучения динамики моноаминов. Радиомаркированные моноамины могут быть предварительно загружены в различные модельные системы, такие как гетерологичные клетки, сверхэкспрессирующие каждый транспортер моноаминов20,33,34,35,36,37,38,39,40, первичные нейроны20, синаптосомы33,39,41, 42, и острые мозговые срезы43,44. Однако радиоактивность представляет потенциальный вред для экспериментатора, и меченые тритием аналиты могут не точно повторять эндогенную динамику моноаминов45,46. Суперфузионные системы в сочетании с автономными методами обнаружения, такими как ВЭЖХ-ECD, позволили обнаруживать моноамины из нескольких тканевых источников. Здесь этот протокол обеспечивает как оптимизированный и недорогой, простой и точный метод с использованием острых срезов мозга для непосредственного измерения эндогенного базального и стимулированного высвобождения моноаминов.
Острые срезы мозга позволяют проверять механистические гипотезы, прежде всего потому, что они сохраняют in vivo анатомическую микросреду и поддерживают неповрежденные синапсы47,48,49,50,51,52. В нескольких исследованиях острые срезы мозга или измельченная мозговая ткань использовались в сочетании с техникой суперфузии с использованием KCl для стимуляции опосредованного высвобождения Ca2+53,54,55,56. Суперфузионные системы имеют решающее значение для продвижения понимания в этой области механизмов высвобождения нейротрансмиттеров, включая моноамины. Однако эти системы относительно дороги, а количество камер, доступных для анализа тканей, колеблется в пределах 4-12. Для сравнения, метод, представленный здесь, является недорогим, позволяет измерять 48 образцов тканей и может быть усовершенствован для использования до 96 образцов тканей. Каждая скважина в 48-луночной пластине содержит тканевые держатели, которые используют фильтры для отделения высвобождаемого продукта от ткани, а высвобождаемые моноамины затем собираются и анализируются с помощью ВЭЖХ-ECD. Важно отметить, что этот метод позволяет одновременно измерять высвобождение 5-HT, DA и NE из различных областей мозга, таких как префронтальная кора, гиппокамп и дорсальное полосатое тело после лечения фармакологическими агентами, которые модулируют высвобождение моноаминов. Таким образом, экспериментатор может ответить на несколько вопросов, используя недорогую многолуночную систему, которая увеличивает количество тестируемых образцов и тем самым уменьшает количество используемых животных.
протокол
Все эксперименты, включая обращение с животными и сбор тканей, проводились в соответствии с Университетом Флориды и Комитетом по институциональному уходу и использованию животных Городского колледжа Нью-Йорка (IACUC) в соответствии с утвержденными протоколами 201508873 (UF) и 1071 (CCNY). Для реагентов и буфера, пожалуйста, обратитесь к Дополнительному файлу.
1. Подготовьте острые срезы мозга крысы
ПРИМЕЧАНИЕ: В этом эксперименте использовались взрослые самцы крыс (250-350 г). Тем не менее, эта установка функциональна для различных точек развития, самок крыс и других видов. При использовании более мелкого животного, такого как мыши, экспериментатор может настроиться на оптимизацию протокола, используя различное количество срезов мозга или ударов по каждому условию. Буфер рассечения будет называться Буфером 1; буфер efflux будет называться буфером 2.
- Подготовьте буфер 1, как указано в дополнительном файле. Насытить буфер 1 кислородом путем пузырьков с 95%/5% (O2/CO2) в течение 20 мин на льду. Удалите 50 мл Buffer 1 и охладите на льду в небольшом стакане или чашке Петри. Этот буфер используется для удержания остро собранного всего мозга.
- Обезболить одну или двух взрослых крыс (250-350 г) 1%-2% изофлураном, обезглавить их с помощью гильотины и быстро удалить их мозг. Немедленно поместите мозг в ледяной насыщенный кислородом буфер 1 в контейнере с шага 1.1.
ПРИМЕЧАНИЕ: Убедитесь, что изофлуран и гильотина используются безопасно. Открытый изофлуран под дымовым капотом. - Используя вибратом или компресстом, вырежьте 300 мкм корональные участки мозга из каждой интересующей области (рисунок 1). Пузырьковый буфер 1 должен присутствовать во время создания секций. Используя шпатель из нержавеющей стали, аккуратно и немедленно переложите срезы мозга в новую чашку Петри, наполненную ледяным кислородом буфером 1 (рисунок 2).
- Далее рассекайте срезы мозга (например, удары, вырезание), осторожно перемещая срезы на стеклянные слайды (рисунок 1G) с использованием атласа мозга крысы57. Например, определите дорсальный стриатум на основе его темной, полосатой структуры и идентифицируйте гиппокамп на основе его близости к коре и уникальной спиральной структуры. Правое и левое полушария могут быть разделены для использования в качестве контрольных и экспериментальных срезов (рис. 2G - H). Здесь дорсальный стриатум был дополнительно рассечен на 2 мм перфораторы (рисунок 1G).
- Используя пластиковую передаточную пипетку с отрезанным наконечником, переложите срезы или мозговые пунши в небольшие контейнеры, погруженные в насыщенный кислородом ледяной буфер 1 с пузырьками кислорода. Эти контейнеры могут представлять собой сетку из нержавеющей стали или небольшие чашки Петри, заполненные буфером (рисунок 1H).
2. Высвобождение эндогенного моноамина Ex-vivo из мозговых срезов или ударов
ПРИМЕЧАНИЕ: Устройство, используемое для этой секции, состоит из 48-луночной пластины и тканевого держателя, изготовленного из шести фильтрующих блоков микроцентрифуги без вставок-фильтров, соединенных с карбогенной линией (рисунок 2). Чтобы изготовить держатель, используйте прочный пластиковый стержень (например, из скребка ячеек) и супер приклейте к нему фильтрующие блоки микроцентрифуги без вставок-фильтров. Дайте высохнуть в течение 1-2 дней. Время, необходимое для эксперимента по эндогенному высвобождению моноаминов, и концентрации амфетамина, флуоксетина и кокаина основаны на текущей литературе и предыдущих протоколах13,20,58.
-
Активация тканей
- Перенесите ткань мозга со стадии 1.1.5 в каждую лунку эффлюксной камеры и обеспечьте восстановление в течение 30-50 мин при 37 °C на слайд-грелке в 0,5-1 мл насыщенного кислородом буфера 2, с постоянным, мягким пузырьком (рисунок 2B1).
- Во время этой инкубации разбавьте препараты до нужной для эксперимента концентрации. Все препараты должны быть растворены в буфере 2, а концентрации основаны на текущей литературе.
-
Первая инкубация
- Переместите тканевый держатель с мозговой тканью в колодцы, содержащие 500 мкл насыщенного кислородом буфера 2 и инкубируйте в течение 20 мин при 37 °C. Убедитесь, что буфер перевозится минимально или вообще отсутствует, постукивая держателем по краю скважины до тех пор, пока в держателе не окажется лишний буфер.
- В экспериментах с фармакологическими агентами, такими как ингибиторы переносчика моноаминов, инкубировали образцы тканей с препаратами, разбавленными в оксигенированном буфере 2 (например, 10 мкМ флуоксетина, 40 мкМ кокаина; см. Фиг.2В2). Конечный объем в каждой скважине составит 500 мкл.
-
Вторая инкубация
- Переместите держатель с тканью в новый набор лунок, содержащих 500 мкл общего буфера 2 с желаемой концентрацией каждого лекарственного средства или без нее. Убедитесь, что не осталось лишних остатков буфера. Каждая скважина представляет собой n = 1 для экспериментальных условий. Каждое экспериментальное условие выполняется в трех экземплярах.
- Одна скважина включает в себя оксигенированный буфер 2, следующая 10-30 мкМ AMPH, а конечная скважина включает 10-30 мкМ AMPH плюс ингибиторы переносчика моноаминов. Каждый препарат растворяют в насыщенном кислородом буфере 2.
- Инкубируют ткань в течение 20 мин при 37 °C при 500 мкл лекарственного состояния.
ПРИМЕЧАНИЕ: Дополнительные скважины могут включать оксигенированный буфер 2 с высоким содержанием K+ с ингибиторами переносчика моноаминов или без них. Растворить каждый препарат в насыщенном кислородом буфере 2 (500 мкл). - Во время этой второй инкубации в течение 20 мин собирают раствор из скважин из первой инкубации на стадии 2.2.1 и переносят в микроцентрифужные трубки, содержащие 50 мкл 1 Н хлорной кислоты или фосфорной кислоты (в зависимости от типа ВЭЖХ, конечная концентрация 0,1 Н). Конечный объем образца составит 550 мкл. Поддерживайте микроцентрифужные трубки на льду и маркируйте трубки No1.
- После второй инкубации через 20 мин переместите держатель ткани с участками мозга или ударами в пустой колодец и выдержите пластину на льду. Перенесите супернатант в микроцентрифужные трубки, содержащие 50 мкл 1 Н хлорной кислоты или фосфорной кислоты. Конечный объем образца составит 550 мкл. Поддерживайте микроцентрифужные трубки на льду и маркируйте трубки No2.
- Добавьте 1 мл ледяного буфера 1 к каждой лунке, содержащей ткань. Соберите всю ткань с помощью небольшого пинцета и переложите в чистые микроцентрифужные трубки.
- Поддерживать трубки с мозговой тканью при -80 °C. Отбросьте 1 мл буфера 1 (рисунок 2B4).
- Фильтрующие растворы получают из каждой инкубации с использованием микроцентрифужных фильтрующих трубок (0,22 мкм) при 2 500 х г в течение 2 мин. Используют фильтрат для определения содержания моноаминов с помощью ВЭЖХ с электрохимическим детектированием (рисунок 2В5).
3. Жизнеспособность тканей
- Анализ МТТ
ПРИМЕЧАНИЕ: Существенным беспокойством в отношении этой экспериментальной установки является жизнеспособность ткани, поскольку ткань может использоваться до нескольких часов59. Анализ MTT60,61 используется для определения жизнеспособности тканей к концу эксперимента. Данный анализ основан на превращении желтой тетразолиевой соли МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид) в фиолетовые кристаллы формазана жизнеспособными клетками с адекватным метаболизмом.- После эксперимента поддерживают отдельную группу образцов тканей и разделяют их на две группы.
- Инкубируют одну группу в течение 20 мин при 37 °C в Triton X-100 (1%), растворенном в буфере 2 в качестве контроля. Лечение Triton X-100 приводит к гибели клеток. Поддерживают вторую группу в буфере 2 и не инкубируют в Тритоне Х-100 (контроль жизнеспособности тканей).
- Добавьте MTT (стоковый раствор 5 мг/мл в PBS, рН 7,4) в обе группы в насыщенном кислородом буфере 2 до конечной концентрации 0,5 мг/мл.
- Инкубируют образцы тканей в течение 20 мин при 37 °C, промывают PBS и переносят в микроцентрифужные трубки, содержащие 250 мкл смеси SDS (10%, мас./об.), DMF (25%, v/v) и воды для растворения кристаллов формазана.
- Инкубировать образцы в течение 24 ч.
- Центрифугируйте трубки при 10 000 х г в течение 10 мин и измеряйте поглощение супернатанта (200 мкл) при 562 нм и 690 нм с помощью считывателя микропластин. Жизнеспособность ткани рассчитывается следующим образом: (A562-A690)/масса ткани.
4. ВЭЖХ-анализ моноаминов
- Количественная оценка высвобождения моноаминов из каждого экспериментального состояния с использованием ВЭЖХ-ECD в соответствии с предыдущими протоколами13,44, используя столбец обратной фазы.
- Подготовьте мобильную фазу, необходимую для обнаружения. Он состоит из 100 мМ фосфорной кислоты, 100 мМ лимонной кислоты, 0,1 мМ ЭДТА-Na2, октансульфоновой кислоты 600 мг/л, 8% v/v ацетонитрила (конечный рН 6,0). Состав подвижной фазы зависит от типа ВЭЖХ и используемой колонны.
- Установите потенциал электрохимического детектора (2 мм стеклоуглеродистого электрода) на 0,46 В, а расход составит 0,05 мл/мин.
- Загрузите 5 мкл каждого образца, включая стандарты нейротрансмиттеров, в ВЭЖХ для автоинъекции и обнаружения. Количество каждого добавленного образца зависит от типа используемой ВЭЖХ.
- После того, как ВЭЖХ завершит запуск, используйте данное программное обеспечение для анализа ВЭЖХ для получения и анализа данных хроматографа.
- Анализ содержания моноаминов с использованием стандартной кривой, состоящей из каждого моноамина (дофамин: DA, норадреналин: NE и серотонин: 5-HT; Рисунок 2С). Используйте полученные хроматограммы для получения площади под кривой (AUC) на основе рекомендаций производителя.
5. Подготовка тканевых лизатов для количественной оценки белка
-
Анализ белка
- Добавьте буфер ледяного лизиса плюс ингибиторы протеазы (0,1 г/1 мл) в каждую микроцентрифужную трубку, содержащую участки мозга/удары, и гомогенизируйте с помощью гомогенизатора пестика. Микроцентрифужные трубки должны поддерживаться на льду во время гомогенизации для предотвращения деградации белка.
- Инкубировать тканевые гомогенаты в течение 1 ч при 4 °C с легким вращением.
- Ткани центрифуги гомогенируют при 16 000 х г в течение 15 мин при 4 °C и восстанавливают супернатант.
- Определить концентрацию белка в супернатантах, с бычьим сывороточным альбумином (BSA) в качестве стандарта.
- Нормализуйте содержание моноаминов в каждом образце мозга до общего содержания белка (мкг), измеренного в 250 мкл лизированной ткани мозга. Используйте приведенную ниже формулу для определения белка nmol monoamine/g. df = коэффициент разрежения.
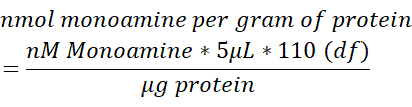
6. Статистический анализ
- Анализ высвобождения моноаминов (нмоль/г) с использованием одностороннего ANOVA с последующим множественным сравнительным тестом Сидака для пост-специальных сравнений.
- Анализ жизнеспособности тканей с помощью t-теста Непарного Студента для независимых групп (Контроль против 1% Тритона X-100).
- Для всех статистических анализов установите альфа-уровень равным ≤ 0,05.
Результаты
Этот метод описывает использование срезов мозга для измерения высвобождения эндогенных моноаминов с использованием ВЭЖХ с электрохимическим обнаружением на основе 48-луночной пластины с внутренним тканевым держателем. Экспериментальная установка показана на
Обсуждение
Измерения высвобождения моноаминов проводились в течение многих лет в ряде систем, таких как гетерологичные клетки, нейронные культуры, синаптосомы мозга, острые срезы мозга ex vivo и целые животные13,20,41,42,58,64,65,66,67,68
Раскрытие информации
Авторы не раскрывают информацию.
Благодарности
Эта работа была поддержана грантами Fondecyt Initiation Fund N 11191049 для J.A.P. и грантом NIH DA038598 для G.E.T.
Материалы
| Name | Company | Catalog Number | Comments |
| 48 Well plate | NA | NA | Assay |
| Acetonitrile | Fischer Scientific | A998-1 | Mobile Phase |
| Calcium Chloride Ahydrous | Sigma Aldrich | C1016 | Modified Artifical Cerebrospinal Fluid OR Efflux Buffer |
| Clarity Software | Anetc | ||
| Citric Acid | Sigma Aldrich | Mobile Phase | |
| D-(+)-Glucose | Sigma | 1002608421 | Dissection Buffer |
| DMF | Sigma Aldrich | D4551 | MTT Assay |
| EDTA-Na2 | Sigma Aldrich | Mobile Phase | |
| GraphPad Software | Graphpad Software, Inc | Statistical Analysis | |
| Glycerol | Sigma Aldrich | G5516 | Lysis buffer |
| HEPES | Sigma Aldrich | H3375 | Lysis buffer |
| HPLC, Decade Amperometric | Anetc | HPLC, LC-EC system | |
| HPLC | Amuza | HPLC HTEC-510. | |
| L-Asrobic Acid | Sigma Aldrich | A5960 | Dissection Buffer |
| Magnesium Sulfate | Sigma | 7487-88-9 | KH Buffer |
| Microcentrifuge Filter Units UltraFree | Millipore | C7554 | Assay - 6 to fit in 48 well plate |
| MTT | Thermo Fisher | M6494 | MTT Assay |
| Nanosep | VWR | 29300-606 | Assay; protein assay |
| Octanesulfonic acid | Sigma Aldrich | V800010 | Mobile Phase |
| Pargyline Clorohydrate | Sigma Aldrich | P8013 | Modified Artifical Cerebrospinal Fluid OR Efflux Buffer |
| Phosphoric Acid | Sigma Aldrich | Mobile Phase | |
| Potassium Chloride | Sigma | 12636 | KH Buffer |
| Potassium Phosphate Monobasic | Sigma | 1001655559 | KH Buffer |
| Precisonary VF-21-0Z | Precissonary | Compresstome | |
| Protease Inhibitor Cocktail | Sigma Aldrich | P2714 | Lysis buffer. |
| Sodium Bicarbonate | Sigma | S5761 | Dissection Buffer |
| Sodium Bicarbonate | Sigma Aldrich | S5761 | Dissection Buffer |
| Sodium Chloride | Sigma | S3014 | KH Buffer |
| Sodium Dodecyl Sulfate | Sigma Aldrich | L3771 | Lysis buffer |
| Triton X-100 | Sigma Aldrich | T8787 | MTT Assay / Lysis buffer |
Ссылки
- Jesulola, E., Micalos, P., Baguley, I. J. Understanding the pathophysiology of depression: From monoamines to the neurogenesis hypothesis model - are we there yet. Behavioural Brain Research. 341, 79-90 (2018).
- Krystal, J. H., D'Souza, D. C., Sanacora, G., Goddard, A. W., Charney, D. S. Current perspectives on the pathophysiology of schizophrenia, depression, and anxiety disorders. Medical Clinics of North America. 85 (3), 559-577 (2001).
- Barone, P. Neurotransmission in Parkinson's disease: beyond dopamine. European Journal of Neurology. 17 (3), 364-376 (2010).
- Howell, L. L., Kimmel, H. L. Monoamine transporters and psychostimulant addiction. Biochemical Pharmacology. 75 (1), 196-217 (2008).
- Kirshner, Z. Z., et al. Impact of estrogen receptor agonists and model of menopause on enzymes involved in brain metabolism, acetyl-CoA production and cholinergic function. Life Sciences. 256, 117975 (2020).
- Long, T., et al. Comparison of transitional vs surgical menopause on monoamine and amino acid levels in the rat brain. Molecular and Cellular Endocrinology. 476, 139-147 (2018).
- Long, T., et al. Estradiol and selective estrogen receptor agonists differentially affect brain monoamines and amino acids levels in transitional and surgical menopausal rat models. Molecular and Cellular Endocrinology. 496, 110533 (2019).
- Burke, N. N., et al. Enhanced nociceptive responding in two rat models of depression is associated with alterations in monoamine levels in discrete brain regions. Neuroscience. 171 (4), 1300-1313 (2010).
- Lane, J. D., Aprison, M. H. Calciumm-dependent release of endogenous serotonin, dopamine and norepinephrine from nerve endings. Life Sciences. 20 (4), 665-671 (1977).
- Ramamoorthy, S., Shippenberg, T. S., Jayanthi, L. D. Regulation of monoamine transporters: Role of transporter phosphorylation. Pharmacology and Therapeutics. 129 (2), 220-238 (2011).
- Torres, G. E., Gainetdinov, R. R., Caron, M. G. Plasma membrane monoamine transporters: structure, regulation and function. Nature Reviews. Neuroscience. 4 (1), 13-25 (2003).
- Hilber, B., et al. Serotonin-transporter mediated efflux: A pharmacological analysis of amphetamines and non-amphetamines. Neuropharmacology. 49 (6), 811-819 (2005).
- Mauna, J. C., et al. G protein βγ subunits play a critical role in the actions of amphetamine. Translational Psychiatry. 9 (1), 81 (2019).
- Sitte, H. H., Freissmuth, M. Amphetamines, new psychoactive drugs and the monoamine transporter cycle. Trends in Pharmacological Sciences. 36 (1), 41-50 (2015).
- Johnson, L. A., Guptaroy, B., Lund, D., Shamban, S., Gnegy, M. E. Regulation of amphetamine-stimulated dopamine efflux by protein kinase C β. Journal of Biological Chemistry. 280 (12), 10914-10919 (2005).
- Kahlig, K. M., et al. Amphetamine induces dopamine efflux through a dopamine transporter channel. Proceedings of the National Academy of Sciences of the United States of America. 102 (9), 3495-3500 (2005).
- Kantor, L., Hewlett, G. H. K., Gnegy, M. E. Enhanced amphetamine- and K+ -mediated dopamine release in rat striatum after repeated amphetamine: differential requirements for Ca 2+ - and calmodulin-dependent phosphorylation and synaptic vesicles. The Journal of Neuroscience. 19 (10), 3801-3808 (2018).
- Brodnik, Z. D., et al. Susceptibility to traumatic stress sensitizes the dopaminergic response to cocaine and increases motivation for cocaine. Neuropharmacology. 125, 295-307 (2017).
- Henke, A., et al. Toward serotonin fluorescent false neurotransmitters: development of fluorescent dual serotonin and vesicular monoamine transporter substrates for visualizing serotonin neurons. ACS Chemical Neuroscience. 9 (5), 925-934 (2018).
- Garcia-Olivares, J., et al. Gβγ subunit activation promotes dopamine efflux through the dopamine transporter. Molecular Psychiatry. 22 (12), 1673-1679 (2017).
- Xiao, N., Privman, E., Venton, B. J. Optogenetic control of serotonin and dopamine release in Drosophila larvae. ACS Chemical Neuroscience. 5 (8), 666-673 (2014).
- Bass, C. E., et al. Optogenetic control of striatal dopamine release in rats. Journal of Neurochemistry. 114 (5), 1344-1352 (2010).
- Stamford, J. A. Fast cyclic voltammetry: measuring transmitter release in "real time". Journal of Neuroscience Methods. 34 (1-3), 67-72 (1990).
- Brodnik, Z. D., Ferris, M. J., Jones, S. R., España, R. A. Reinforcing doses of intravenous cocaine produce only modest dopamine uptake inhibition. ACS Chemical Neuroscience. 8 (2), 281-289 (2017).
- Brodnik, Z. D., España, R. A. Dopamine uptake dynamics are preserved under isoflurane anesthesia. Neuroscience Letters. 606, 129-134 (2015).
- Ferris, M. J., Calipari, E. S., Yorgason, J. T., Jones, S. R. Examining the complex regulation and drug-induced plasticity of dopamine release and uptake using voltammetry in brain slices. ACS Chemical Neuroscience. 4 (5), 693-703 (2013).
- Siciliano, C. A., Calipari, E. S., Ferris, M. J., Jones, S. R. Biphasic mechanisms of amphetamine action at the dopamine terminal. The Journal of Neuroscience The Official Journal of the Society for Neuroscience. 34 (16), 5575-5582 (2014).
- Rice, M. E., et al. Direct monitoring of dopamine and 5-HT release in substantia nigra and ventral tegmental area in vitro. Experimental Brain Research. 100 (3), 395-406 (1994).
- Bunin, M. A., Prioleau, C., Mailman, R. B., Wightman, R. M. Release and uptake rates of 5-hydroxytryptamine in the dorsal raphe and substantia nigra reticulata of the rat brain. Journal of Neurochemistry. 70 (3), 1077-1087 (1998).
- Park, J., Takmakov, P., Wightman, R. M. In vivo comparison of norepinephrine and dopamine release in rat brain by simultaneous measurements with fast-scan cyclic voltammetry. Journal of Neurochemistry. 119 (5), 932-944 (2011).
- Park, J., Bhimani, R. V., Bass, C. E. In vivo electrochemical measurements of norepinephrine in the brain: current status and remaining challenges. Journal of the Electrochemical Society. 165 (12), 3051-3056 (2018).
- Butcher, S. P., Fairbrother, I. S., Kelly, J. S., Arbuthnott, G. W. Amphetamine-induced dopamine release in the rat striatum: an in vivo microdialysis study. Journal of Neurochemistry. 50 (2), 346-355 (1988).
- Garcia-Olivares, J., et al. Inhibition of dopamine transporter activity by G protein βγ subunits. PLoS One. 8 (3), 1-9 (2013).
- Carneiro, A. M. D., Blakely, R. D. Serotonin-, protein kinase C-, and Hic-5-associated redistribution of the platelet serotonin transporter. Journal of Biological Chemistry. 281 (34), 24769-24780 (2006).
- Rajamanickam, J., et al. Akt-mediated regulation of antidepressant-sensitive serotonin transporter function, cell-surface expression and phosphorylation. The Biochemical Journal. 468 (1), 177-190 (2015).
- Egaña, L. A., et al. Physical and functional interaction between the dopamine transporter and the synaptic vesicle protein synaptogyrin-3. The Journal of Neuroscience The Official Journal of the Society for Neuroscience. 29 (14), 4592-4604 (2009).
- Guptaroy, B., Fraser, R., Desai, A., Zhang, M., Gnegy, M. E. Site-directed mutations near transmembrane domain 1 alter conformation and function of norepinephrine and dopamine transporters. Molecular Pharmacology. 79 (3), 520-532 (2011).
- Ordway, G. A., et al. Norepinephrine transporter function and desipramine: Residual drug effects versus short-term regulation. Journal of Neuroscience Methods. 143 (2), 217-225 (2005).
- Steinkellner, T., et al. Amphetamine action at the cocaine- and antidepressant-sensitive serotonin transporter is modulated by CaMKII. Journal of Neuroscience. 35 (21), 8258-8271 (2015).
- Guptaroy, B., et al. A juxtamembrane mutation in the N terminus of the dopamine transporter induces preference for an inward-facing conformation. Molecular Pharmacology. 75 (3), 514-524 (2009).
- Carpenter, C., et al. Direct and systemic administration of a CNS-permeant tamoxifen analog reduces amphetamine-induced dopamine release and reinforcing effects. Neuropsychopharmacology. 42 (10), 1940-1949 (2017).
- Aquino-Miranda, G., Escamilla-Sánchez, J., González-Pantoja, R., Bueno-Nava, A., Arias-Montaño, J. -. A. Histamine H3 receptor activation inhibits dopamine synthesis but not release or uptake in rat nucleus accumbens. Neuropharmacology. 106, 91-101 (2016).
- Reddy, I. A., et al. Glucagon-like peptide 1 receptor activation regulates cocaine actions and dopamine homeostasis in the lateral septum by decreasing arachidonic acid levels. Translational Psychiatry. 6 (5), 809 (2016).
- Koutzoumis, D. N., et al. Alterations of the gut microbiota with antibiotics protects dopamine neuron loss and improve motor deficits in a pharmacological rodent model of Parkinson's disease. Experimental Neurology. 325, 113159 (2020).
- Herdon, H., Strupish, J., Nahorski, S. R. Differences between the release of radiolabelled and endogenous dopamine from superfused rat brain slices: Effects of depolarizing stimuli, amphetamine and synthesis inhibition. Brain Research. 348 (2), 309-320 (1985).
- Thongsaard, W., Kendall, D. A., Bennett, G. W., Marsden, C. A. A simple method for measuring dopamine release from rat brain slices. Journal of Pharmacological and Toxicological Methods. 37 (3), 143-148 (1997).
- Dorris, D. M., Hauser, C. A., Minnehan, C. E., Meitzen, J. An aerator for brain slice experiments in individual cell culture plate wells. Journal of Neuroscience Methods. 238, 1-10 (2014).
- Humpel, C. Organotypic brain slice cultures: a review. Neuroscience. 305, 86-98 (2015).
- Papouin, T., Haydon, P. Obtaining acute brain slices. BIO-PROTOCOL. 8 (2), 477-491 (2018).
- Collingridge, G. L. The brain slice preparation: a tribute to the pioneer Henry McIlwain. Journal of Neuroscience Methods. 59 (1), 5-9 (1995).
- Yamamoto, C., McIlwain, H. Electrical activities in thin sections from the mammalian brain maintained in chemically-defined media in vitro. Journal of Neurochemistry. 13 (12), 1333-1343 (1966).
- Buskila, Y., et al. Extending the viability of acute brain slices. Scientific Reports. 4, 4-10 (2014).
- Kako, H., Fukumoto, S., Kobayashi, Y., Yokogoshi, H. Effects of direct exposure of green odour components on dopamine release from rat brain striatal slices and PC12 cells. Brain Research Bulletin. 75 (5), 706-712 (2008).
- McBride, W. J., Murphy, J. M., Lumeng, L., Li, T. -. K. Effects of ethanol on monoamine and amino acid release from cerebral cortical slices of the alcohol-preferring P line of rats. Alcoholism: Clinical and Experimental Research. 10 (2), 205-208 (1986).
- Chen, J. C., Turiak, G., Galler, J., Volicer, L. Effect of prenatal malnutrition on release of monoamines from hippocampal slices. Life Sciences. 57 (16), 1467-1475 (1995).
- Becker, J. B., Castañeda, E., Robinson, T. E., Beer, M. E. A simple in vitro technique to measure the release of endogenous dopamine and dihydroxyphenylacetic acid from striatal tissue using high performance liquid chromatography with electrochemical detection. Journal of Neuroscience Methods. 11 (1), 19-28 (1984).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2007).
- Dailey, J. W., Reith, M. E. A., Steidley, K. R., Milbrandt, J. C., Jobe, P. C. Carbamazepine-induced release of serotonin from rat hippocampus in vitro. Epilepsia. 39 (10), 1054-1063 (1998).
- Buskila, Y., et al. Extending the viability of acute brain slices. Scientific Reports. 4, 5309 (2014).
- Mewes, A., Franke, H., Singer, D. Organotypic brain slice cultures of adult transgenic P301S mice-A model for tauopathy studies. PLoS One. 7 (9), (2012).
- Rönicke, R., et al. AB mediated diminution of MTT reduction - An artefact of single cell culture. PLoS One. 3 (9), (2008).
- Ihalainen, J. A., Riekkinen, P., Feenstra, M. G. P. Comparison of dopamine and noradrenaline release in mouse prefrontal cortex, striatum and hippocampus using microdialysis. Neuroscience Letters. 277 (2), 71-74 (1999).
- Richards, D. A., Obrenovitch, T. P., Symon, L., Curzon, G. Extracellular dopamine and serotonin in the rat striatum during transient ischaemia of different severities: a microdialysis study. Journal of Neurochemistry. 60 (1), 128-136 (1993).
- Fog, J. U., et al. Calmodulin kinase II interacts with the dopamine transporter C terminus to regulate amphetamine-induced reverse transport. Neuron. 51 (4), 417-429 (2006).
- Balázsa, T., Bíró, J., Gullai, N., Ledent, C., Sperlágh, B. CB1-cannabinoid receptors are involved in the modulation of non-synaptic [3H]serotonin release from the rat hippocampus. Neurochemistry International. 52 (1), 95-102 (2008).
- Schechter, L. E. The potassium channel blockers 4-aminopyridine and tetraethylammonium increase the spontaneous basal release of [3H]5-hydroxytryptamine in rat hippocampal slices. The Journal of Pharmacology and Experimental Therapeutics. 282 (1), 262-270 (1997).
- Boudanova, E., Navaroli, D. M., Stevens, Z., Melikian, H. E. Dopamine transporter endocytic determinants: carboxy terminal residues critical for basal and PKC-stimulated internalization. Molecular and Cellular Neuroscience. 39 (2), 211-217 (2008).
- Bowyer, J. F., et al. Interactions of MK-801 with glutamate-, glutamine- and methamphetamine-evoked release of [3H]dopamine from striatal slices. The Journal of Pharmacology and Experimental Therapeutics. 257 (1), 262-270 (1991).
- Perszyk, R. E., et al. GluN2D-containing N-methyl-D-aspartate receptors mediate synaptic transmission in hippocampal interneurons and regulate interneuron activity. Molecular Pharmacology. 90 (6), 689-702 (2016).
- Jones, S. R., et al. Profound neuronal plasticity in response to inactivation of the dopamine transporter. Proceedings of the National Academy of Sciences of the United States of America. 95 (7), 4029-4034 (1998).
- Jedema, H. P., Narendran, R., Bradberry, C. W. Amphetamine-induced release of dopamine in primate prefrontal cortex and striatum: striking differences in magnitude and timecourse. Journal of Neurochemistry. 130, 490-497 (2014).
- Buchmayer, F., et al. Amphetamine actions at the serotonin transporter rely on the availability of phosphatidylinositol-4,5-bisphosphate. Proceedings of the National Academy of Sciences. 110 (28), 11642-11647 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены