È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un test basato su piastre per la misurazione del rilascio di monoamina endogena in fette cerebrali acute
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo metodo introduce una semplice tecnica per il rilevamento del rilascio endogeno di monoammina utilizzando fette di cervello acute. La configurazione utilizza una piastra a 48 pozzetti contenente un supporto in tessuto per il rilascio di monoammina. La monoammina rilasciata viene analizzata mediante HPLC accoppiato con il rilevamento elettrochimico. Inoltre, questa tecnica fornisce un metodo di screening per la scoperta di farmaci.
Abstract
I neurotrasmettitori monoamminici sono associati a numerosi disturbi neurologici e psichiatrici. Modelli animali di tali condizioni hanno mostrato alterazioni nel rilascio di neurotrasmettitori monoamminici e nelle dinamiche di assorbimento. Metodi tecnicamente complessi come l'elettrofisiologia, la voltammetria ciclica a scansione rapida (FSCV), l'imaging, la microdialisi in vivo, l'optogenetica o l'uso della radioattività sono necessari per studiare la funzione della monoammina. Il metodo qui presentato è un approccio ottimizzato in due fasi per rilevare il rilascio di monoammina in fette cerebrali acute utilizzando una piastra a 48 pozzetti contenente supporti tissutali per esaminare il rilascio di monoammina e cromatografia liquida ad alte prestazioni accoppiata con rilevamento elettrochimico (HPLC-ECD) per la misurazione del rilascio di monoammina. In breve, le sezioni cerebrali di ratto contenenti regioni di interesse, tra cui la corteccia prefrontale, l'ippocampo e lo striato dorsale sono state ottenute utilizzando un'affettatrice di tessuto o vibratoma. Queste regioni di interesse sono state sezionate da tutto il cervello e incubate in un tampone fisiologico ossigenato. La vitalità è stata esaminata durante il corso del tempo sperimentale, mediante il test 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolio bromuro (MTT). Le regioni cerebrali acutamente sezionate sono state incubate in diverse condizioni farmacologiche che sono note per indurre il rilascio di monoammina attraverso il trasportatore (anfetamina) o attraverso l'attivazione del rilascio vescicolare esocitotico (KCl). Dopo l'incubazione, i prodotti rilasciati nel surnatante sono stati raccolti e analizzati attraverso un sistema HPLC-ECD. Qui, il rilascio basale di monoammina viene rilevato dall'HPLC da fette di cervello acute. Questi dati supportano i precedenti risultati in vivo e in vitro che mostrano che AMPH e KCl inducono il rilascio di monoammina. Questo metodo è particolarmente utile per studiare i meccanismi associati al rilascio dipendente dal trasportatore di monoammine e offre l'opportunità di esaminare i composti che influenzano il rilascio di monoammina in modo rapido e a basso costo.
Introduzione
Una pletora di malattie neurologiche e psichiatriche sono associate a disregolazione o insufficiente mantenimento del neurotrasmettitore monoamminico (dopamina [DA], serotonina [5-HT], noradrenalina [NE]) omeostasi1,2,3. Queste condizioni includono, ma non sono limitate a, depressione1,2, schizofrenia2, ansia2, dipendenza4, menopausa5,6,7, dolore8 e morbo di Parkinson3. Ad esempio, diversi modelli di menopausa su ratti hanno dimostrato che la disregolazione o la riduzione delle monoammine all'interno dell'ippocampo, della corteccia prefrontale e dello striato può essere associata sia alla depressione che al declino cognitivo, che si osserva nelle donne in menopausa. La disregolazione delle monoammine in questi modelli è stata ampiamente esaminata utilizzando HPLC-ECD, sebbene gli studi non abbiano discriminato tra il contenuto di neurotrasmettitori misurato rispetto al rilascio di neurotrasmettitori5,6,7. Le monoammine vengono rilasciate classicamente nello spazio extracellulare attraverso il rilascio vescicolare Ca2+-dipendente9 e vengono riciclate attraverso il rispettivo sistema di ricaptazione della membrana plasmatica (trasportatore della dopamina, DAT; trasportatore della serotonina, SERT; trasportatore della noradrenalina, NET)10,11. Al contrario, i dati suggeriscono che questi trasportatori sono in grado di rilasciare o efflussare monoammine, poiché le droghe d'abuso come l'anfetamina (AMPH) e la 3,4-metilendiossimetanfetamina (MDMA) sono note per rilasciare DA e 5-HT, rispettivamente attraverso i loro sistemi di trasporto12,13,14,15,16,17 . Pertanto, una corretta comprensione meccanicistica delle dinamiche di rilascio delle monoammine è cruciale per lo sviluppo di farmacoterapie specifiche e mirate.
Una vasta gamma di tecniche è stata impiegata per studiare il rilascio di monoammine come la voltammetria ciclica a scansione rapida (FSCV)18, la microdialisi in vivo13, l'imaging19, la preincubazione con monoammine radiomarcate20, l'optogenetica e, più recentemente, i sensori fluorescenti geneticamente codificati e la fotometria21,22 . FSCV e microdialisi in vivo sono le tecniche primarie utilizzate per studiare il rilascio di monoammine. FSCV è usato per studiare il rilascio esocitotico stimolato di, principalmente, DA in fette cerebrali acute e in vivo23. Poiché FSCV utilizza elettrodi per stimolare o evocare il rilascio, la fonte primaria di rilascio di neurotrasmettitori è il rilascio vescicolare Ca2+-dipendente18,24,25,26,27,28,29,30,31 . La microdialisi in vivo abbinata all'HPLC misura i cambiamenti nei livelli di neurotrasmettitori extracellulari utilizzando una sonda posizionata in un'area cerebrale di interesse13,32. Simile a FSCV, una delle principali limitazioni alla microdialisi in vivo è la difficoltà nel determinare la fonte di rilascio del neurotrasmettitore: rilascio vescicolare dipendente da Ca2 + o trasportatore dipendente. Degno di nota, entrambi i metodi consentono la misurazione diretta del rilascio di monoammina. Attraverso il recente progresso dell'optogenetica, la ricerca dimostra il rilevamento del rilascio di 5-HT e DA in un breve lasso di tempo con una squisita specificità del tipo cellulare21,22. Tuttavia, queste strategie richiedono tecniche e attrezzature complesse e costose e misurano indirettamente il rilascio di monoammina, in particolare attraverso il legame della monoammina ai recettori. Inoltre, le monoammine radiomarcate sono utilizzate anche per lo studio della dinamica delle monoammine. Le monoammine radiomarcate possono essere precaricate in vari sistemi modello come cellule eterologhe che sovraesprimono ogni trasportatore di monoammine20,33,34,35,36,37,38,39,40, neuroni primari20, sinaptosomi33,39,41, 42, e fette di cervello acute43,44. Tuttavia, la radioattività rappresenta un potenziale danno per lo sperimentatore e gli analiti marcati con trizio potrebbero non ricapitolare fedelmente la dinamica endogena delle monoammine45,46. I sistemi di superfusione combinati con metodi di rilevamento off-line come HPLC-ECD hanno permesso il rilevamento di monoammine da più fonti tissutali. Qui, questo protocollo fornisce come metodo ottimizzato e a basso costo, semplice e preciso utilizzando fette di cervello acute per misurare direttamente il rilascio basale endogeno e stimolato di monoammina.
Le fette di cervello acute consentono di testare ipotesi meccanicistiche, principalmente in quanto preservano il microambiente anatomico in vivo e mantengono intatte le sinapsi47,48,49,50,51,52. In alcuni studi, fette di cervello acute o tessuto cerebrale tritato sono stati utilizzati in combinazione con una tecnica di superfusione che utilizza KCl per stimolare il rilascio mediato da Ca2+53,54,55,56. I sistemi di superfusione sono stati fondamentali per far progredire la comprensione del campo dei meccanismi di rilascio dei neurotrasmettitori, comprese le monoammine. Tuttavia, questi sistemi sono relativamente costosi e il numero di camere disponibili per l'analisi dei tessuti varia da 4 a 12. In confronto, il metodo qui presentato è economico, consente la misurazione di 48 campioni di tessuto e può essere raffinato per utilizzare fino a 96 campioni di tessuto. Ogni pozzetto all'interno della piastra a 48 pozzetti contiene supporti per tessuti che utilizzano filtri per separare il prodotto rilasciato dal tessuto e le monoammine rilasciate vengono quindi raccolte e analizzate da HPLC-ECD. È importante sottolineare che questo metodo consente la misurazione simultanea del rilascio di 5-HT, DA e NE da diverse aree cerebrali come la corteccia prefrontale, l'ippocampo e lo striato dorsale dopo il trattamento con agenti farmacologici che modulano il rilascio di monoammine. Pertanto, lo sperimentatore può rispondere a più domande utilizzando un sistema multi-pozzo economico che aumenta il numero di campioni testati e quindi riduce il numero di animali utilizzati.
Protocollo
Tutti gli esperimenti, compresa la manipolazione degli animali e la raccolta dei tessuti, sono stati condotti in conformità con l'Università della Florida e il City College of New York Institutional Animal Care and Use Committee (IACUC), seguendo il protocollo approvato 201508873 (UF) e 1071 (CCNY). Per i reagenti e il tampone, fare riferimento al file supplementare.
1. Preparare fette di cervello di ratto acuto
NOTA: In questo esperimento sono stati utilizzati ratti maschi adulti (250-350 g). Tuttavia, questa configurazione è funzionale per diversi punti di sviluppo, ratti femmina e altre specie. Se si utilizza un animale più piccolo, come i topi, lo sperimentatore può adattarsi per ottimizzare il protocollo utilizzando un numero diverso di fette di cervello o pugni per condizione. Il buffer di dissezione sarà indicato come Buffer 1; efflux buffer sarà indicato come Buffer 2.
- Preparare il Buffer 1 come indicato nel file supplementare. Saturate Buffer 1 con ossigeno gorgogliando con il 95%/5% (O2/CO2) per 20 min su ghiaccio. Rimuovere 50 ml di Buffer 1 e raffreddare sul ghiaccio in un piccolo becher o in una capsula di Petri. Questo tampone viene utilizzato per trattenere l'intero cervello raccolto acutamente.
- Anestetizzare uno o due ratti adulti (250-350 g) con l'1%-2% di isoflurano, decapitarli usando una ghigliottina e rimuovere rapidamente il loro cervello. Posizionare immediatamente il cervello nel tampone ossigenato ghiacciato 1 nel contenitore dal passaggio 1.1.
NOTA: Assicurarsi che l'isoflurano e la ghigliottina siano usati in modo sicuro. Aprire l'isoflurano sotto una cappa aspirante. - Usando un vibratoma o un compresstome, tagliare sezioni cerebrali coronali da 300 μm da ciascuna regione di interesse (Figura 1). Bubbling Buffer 1 deve essere presente durante la creazione di sezioni. Utilizzando una spatola in acciaio inossidabile, trasferire con cura e immediatamente le fette di cervello in una nuova capsula di Petri riempita con Tampone 1 ossigenato ghiacciato (Figura 2).
- Sezionare ulteriormente le fette di cervello (ad esempio, pugni, ritagliare) spostando attentamente le fette su vetrini di vetro (Figura 1G) utilizzando l'atlante del cervello di ratto57. Ad esempio, identifica lo striato dorsale in base alla sua struttura scura e striata e identifica l'ippocampo in base alla sua vicinanza alla corteccia e alla struttura a spirale unica. Gli emisferi destro e sinistro possono essere separati per essere utilizzati come fette di controllo e sperimentali (Figure 2G - H). Qui, lo striato dorsale è stato ulteriormente sezionato in punzoni da 2 mm (Figura 1G).
- Utilizzando una pipetta di trasferimento in plastica con la punta tagliata, trasferire fette o punzoni cerebrali in piccoli contenitori immersi in Buffer 1 ghiacciato ossigenato con gorgogliamento di ossigeno. Questi contenitori possono essere in rete di acciaio inossidabile o piccole piastre di Petri riempite con tampone (Figura 1H).
2. Rilascio di monoamina endogena ex-vivo da fette di cervello o pugni
NOTA: Il dispositivo utilizzato per questa sezione è costituito da una piastra a 48 pozzetti e da un supporto in tessuto costituito da sei unità filtranti microcentrifuga senza i filtri di incasso collegati a una linea di carbogeno (Figura 2). Per realizzare il supporto, utilizzare una robusta asta di plastica (ad esempio, da un scrapper a celle) e super incollare le unità filtranti microcentrifuga senza i filtri incorporati. Lasciare asciugare per 1-2 giorni. Il tempo necessario per l'esperimento di rilascio endogeno di monoammina e le concentrazioni di anfetamine, fluoxetina e cocaina si basano sulla letteratura attuale e sui protocolli precedenti13,20,58.
-
Attivazione tissutale
- Trasferire il tessuto cerebrale dal passo 1.1.5 a ciascun pozzetto della camera di efflusso e consentire il recupero per 30-50 minuti a 37 °C su un riscaldatore a vetrino in 0,5-1 mL di Tampone ossigenato 2, con costante e delicato gorgogliamento (Figura 2B1).
- Durante questa incubazione, diluire i farmaci alla concentrazione desiderata per l'esperimento. Tutti i farmaci devono essere sciolti nel Buffer 2 e le concentrazioni sono basate sulla letteratura corrente.
-
Prima incubazione
- Spostare il supporto del tessuto con tessuto cerebrale in pozzetti contenenti 500 μL di Tampone ossigenato 2 e incubare per 20 minuti a 37 °C. Assicurarsi che il buffer minimo o nullo venga trasportato toccando il supporto sul bordo del pozzo fino a quando non è presente alcun buffer in eccesso nel supporto.
- Negli esperimenti con agenti farmacologici come gli inibitori del trasportatore di monoammine, incubare i campioni di tessuto con i farmaci diluiti in tampone ossigenato 2 (ad esempio, 10 μM di fluoxetina, 40 μM di cocaina; vedere Figura 2B2). Il volume finale in ogni pozzo sarà di 500 μL.
-
Seconda incubazione
- Spostare il supporto con il tessuto in una nuova serie di pozzetti contenenti 500 μL di Tampone 2 totale con o senza la concentrazione desiderata di ciascun farmaco. Assicurarsi che non vi sia alcun residuo di buffer in eccesso. Ogni pozzo rappresenta un n = 1 per le condizioni sperimentali. Ogni condizione sperimentale viene eseguita in triplice copia.
- Un pozzo include un tampone ossigenato 2, il successivo AMPH da 10-30 μM e il pozzo finale include 10-30 μM AMPH più inibitori del trasportatore monoamminico. Ogni farmaco viene disciolto nel Tampone ossigenato 2.
- Incubare il tessuto per 20 minuti a 37 °C con 500 μL della condizione del farmaco.
NOTA: Ulteriori pozzetti possono includere un elevato K+ Buffer 2 ossigenato con o senza gli inibitori del trasportatore monoamminico. Sciogliere ogni farmaco nel tampone ossigenato 2 (500 μL). - Durante questa seconda incubazione di 20 min, raccogliere la soluzione dai pozzetti dalla prima incubazione nella fase 2.2.1 e trasferirla in tubi microcentrifuga contenenti 50 μL di acido perclorico 1 N o acido fosforico (a seconda del tipo di HPLC, concentrazione finale 0,1 N). Il volume finale del campione sarà di 550 μL. Mantenere i tubi di microcentrifuga sul ghiaccio ed etichettare i tubi #1.
- Dopo la seconda incubazione di 20 minuti, spostare il supporto del tessuto con sezioni cerebrali o pugni in un pozzo vuoto e mantenere la piastra sul ghiaccio. Trasferire il surnatante in tubi microcentrifuga contenenti 50 μL di acido perclorico 1 N o acido fosforico. Il volume finale del campione sarà di 550 μL. Mantenere i tubi di microcentrifuga sul ghiaccio ed etichettare i tubi #2.
- Aggiungere 1 mL di Tampone 1 ghiacciato a ciascun pozzo contenente tessuto. Raccogliere tutto il tessuto utilizzando piccole pinzette e trasferirlo per pulire i tubi microcentrifuga.
- Mantenere i tubi con tessuto cerebrale a -80 °C. Eliminare 1 mL del Buffer 1 (Figura 2B4).
- Soluzioni filtranti ottenute da ogni incubazione utilizzando tubi filtranti microcentrifuga (0,22 μm) a 2.500 x g per 2 minuti. Utilizzare il filtrato per determinare il contenuto di monoammina utilizzando HPLC con rilevamento elettrochimico (Figura 2B5).
3. Vitalità dei tessuti
- Saggio MTT
NOTA: Una preoccupazione significativa per quanto riguarda questa configurazione sperimentale è la vitalità tissutale in quanto il tessuto può essere utilizzato per un massimo di diverse ore59. Un test MTT60,61 viene utilizzato per determinare la vitalità dei tessuti entro la fine della sperimentazione. Questo saggio si basa sulla conversione del sale di tetrazolio giallo MTT (3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolio bromuro) in cristalli di formazan viola da cellule vitali con metabolismo adeguato.- Dopo l'esperimento mantenere un gruppo separato di campioni di tessuto e separarli in due gruppi.
- Incubare un gruppo per 20 minuti a 37 °C in Triton X-100 (1%) disciolto nel Tampone 2 come controllo. Il trattamento con Triton X-100 provoca la morte cellulare. Mantenere il secondo gruppo nel Tampone 2 e non incubare in Triton X-100 (controllo della vitalità dei tessuti).
- Aggiungere MTT (soluzione madre 5 mg/mL in PBS, pH 7,4) a entrambi i gruppi nel tampone ossigenato 2 fino ad una concentrazione finale di 0,5 mg/mL.
- Incubare i campioni di tessuto per 20 minuti a 37 °C, lavare con PBS e trasferirli in provette di microcentrifuga contenenti 250 μL di una miscela di SDS (10%, p/v), DMF (25%, v/v) e acqua per sciogliere i cristalli formazan.
- Incubare i campioni per 24 ore.
- Centrifugare i tubi a 10.000 x g per 10 min e misurare l'assorbanza del surnatante (200 μL) a 562 nm e 690 nm utilizzando un lettore di micropiastre. La vitalità tissutale è calcolata come segue: (A562-A690)/peso del tessuto.
4. Analisi HPLC delle monoammine
- Quantificare il rilascio di monoammina da ogni condizione sperimentale utilizzando HPLC-ECD secondo i protocolli precedenti13,44, utilizzando una colonna di fase inversa.
- Preparare la fase mobile necessaria per il rilevamento. Questo è costituito da 100 mM di acido fosforico, 100 mM di acido citrico, 0,1 mM di EDTA-Na2, 600 mg/L di acido ottanosolfonico, 8% v/v acetonitrile (pH finale 6,0). La composizione della fase mobile dipende dal tipo di HPLC e dalla colonna utilizzata.
- Impostare il potenziale del rivelatore elettrochimico (elettrodo di carbonio vetroso da 2 mm) a 0,46 V e impostare la portata a 0,05 ml/min.
- Caricare 5 μL di ciascun campione, compresi gli standard dei neurotrasmettitori nell'HPLC per l'autoiniezione e il rilevamento. La quantità di ciascun campione aggiunto dipende dal tipo di HPLC utilizzato.
- Una volta che l'HPLC ha completato l'esecuzione, utilizzare il software di analisi HPLC fornito per acquisire e analizzare i dati del cromatografo.
- Analizzare il contenuto di monoammina utilizzando una curva standard composta da ogni monoammina (dopamina: DA, noradrenalina: NE e serotonina: 5-HT; Figura 2C). Utilizzare i cromatogrammi risultanti per ottenere l'area sotto la curva (AUC) in base alle linee guida del produttore.
5. Preparazione dei lisati tissutali per la quantificazione delle proteine
-
Saggio proteico
- Aggiungere il tampone di lisi ghiacciato più gli inibitori della proteasi (0,1 g / 1 mL) a ciascun tubo di microcentrifuga contenente sezioni / punzoni cerebrali e omogeneizzare usando un omogeneizzatore di pestelli. I tubi microcentrifuga devono essere mantenuti sul ghiaccio durante l'omogeneizzazione per prevenire la degradazione delle proteine.
- Incubare gli omogeneizzati tissutali per 1 ora a 4 °C con rotazione leggera.
- Centrifugare l'omogeneizzazione tissutale a 16.000 x g per 15 min a 4 °C e recuperare il surnatante.
- Determinare la concentrazione proteica nei supernatanti, con l'albumina sierica bovina (BSA) come standard.
- Normalizzare il contenuto di monoammina in ciascun campione di cervello al contenuto totale di proteine (μg) misurato in 250 μL di tessuto cerebrale lisato. Utilizzare la formula seguente per determinare la proteina nmol monoammina / g. df = fattore di diluizione.
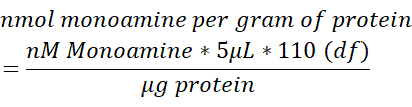
6. Analisi statistica
- Analizza il rilascio di monoammina (nmol / g) utilizzando ANOVA unidirezionale seguito dal test di confronto multiplo di Sidak per confronti post-hoc.
- Analizza la vitalità dei tessuti utilizzando un t-test di uno studente spaiato per gruppi indipendenti (controllo rispetto all'1% di Triton X-100).
- Per tutte le analisi statistiche, impostare il livello alfa su ≤ 0,05.
Risultati
Questa tecnica descrive l'uso di fette di cervello per misurare il rilascio di monoammine endogene utilizzando HPLC con rilevamento elettrochimico basato su una piastra a 48 pozzetti con un supporto tissutale interno. L'impostazione sperimentale è illustrata nella Figura 1 e nella Figura 2. Inizialmente, per garantire la vitalità dei tessuti entro la fine della sperimentazione, è stato eseguito un test MTT (3-(4,5-dimetiltiazo...
Discussione
Le misurazioni del rilascio di monoammine sono state eseguite per anni in un certo numero di sistemi come cellule eterologhe, colture neuronali, sinaptosomi cerebrali, fette di cervello acute ex vivo e animali interi13,20,41,42,58,64,65,66,67,68<...
Divulgazioni
Gli autori non hanno divulgazioni.
Riconoscimenti
Questo lavoro è stato supportato dalle sovvenzioni Fondecyt Initiation Fund N 11191049 a J.A.P. e dalla sovvenzione NIH DA038598 a G.E.T.
Materiali
| Name | Company | Catalog Number | Comments |
| 48 Well plate | NA | NA | Assay |
| Acetonitrile | Fischer Scientific | A998-1 | Mobile Phase |
| Calcium Chloride Ahydrous | Sigma Aldrich | C1016 | Modified Artifical Cerebrospinal Fluid OR Efflux Buffer |
| Clarity Software | Anetc | ||
| Citric Acid | Sigma Aldrich | Mobile Phase | |
| D-(+)-Glucose | Sigma | 1002608421 | Dissection Buffer |
| DMF | Sigma Aldrich | D4551 | MTT Assay |
| EDTA-Na2 | Sigma Aldrich | Mobile Phase | |
| GraphPad Software | Graphpad Software, Inc | Statistical Analysis | |
| Glycerol | Sigma Aldrich | G5516 | Lysis buffer |
| HEPES | Sigma Aldrich | H3375 | Lysis buffer |
| HPLC, Decade Amperometric | Anetc | HPLC, LC-EC system | |
| HPLC | Amuza | HPLC HTEC-510. | |
| L-Asrobic Acid | Sigma Aldrich | A5960 | Dissection Buffer |
| Magnesium Sulfate | Sigma | 7487-88-9 | KH Buffer |
| Microcentrifuge Filter Units UltraFree | Millipore | C7554 | Assay - 6 to fit in 48 well plate |
| MTT | Thermo Fisher | M6494 | MTT Assay |
| Nanosep | VWR | 29300-606 | Assay; protein assay |
| Octanesulfonic acid | Sigma Aldrich | V800010 | Mobile Phase |
| Pargyline Clorohydrate | Sigma Aldrich | P8013 | Modified Artifical Cerebrospinal Fluid OR Efflux Buffer |
| Phosphoric Acid | Sigma Aldrich | Mobile Phase | |
| Potassium Chloride | Sigma | 12636 | KH Buffer |
| Potassium Phosphate Monobasic | Sigma | 1001655559 | KH Buffer |
| Precisonary VF-21-0Z | Precissonary | Compresstome | |
| Protease Inhibitor Cocktail | Sigma Aldrich | P2714 | Lysis buffer. |
| Sodium Bicarbonate | Sigma | S5761 | Dissection Buffer |
| Sodium Bicarbonate | Sigma Aldrich | S5761 | Dissection Buffer |
| Sodium Chloride | Sigma | S3014 | KH Buffer |
| Sodium Dodecyl Sulfate | Sigma Aldrich | L3771 | Lysis buffer |
| Triton X-100 | Sigma Aldrich | T8787 | MTT Assay / Lysis buffer |
Riferimenti
- Jesulola, E., Micalos, P., Baguley, I. J. Understanding the pathophysiology of depression: From monoamines to the neurogenesis hypothesis model - are we there yet. Behavioural Brain Research. 341, 79-90 (2018).
- Krystal, J. H., D'Souza, D. C., Sanacora, G., Goddard, A. W., Charney, D. S. Current perspectives on the pathophysiology of schizophrenia, depression, and anxiety disorders. Medical Clinics of North America. 85 (3), 559-577 (2001).
- Barone, P. Neurotransmission in Parkinson's disease: beyond dopamine. European Journal of Neurology. 17 (3), 364-376 (2010).
- Howell, L. L., Kimmel, H. L. Monoamine transporters and psychostimulant addiction. Biochemical Pharmacology. 75 (1), 196-217 (2008).
- Kirshner, Z. Z., et al. Impact of estrogen receptor agonists and model of menopause on enzymes involved in brain metabolism, acetyl-CoA production and cholinergic function. Life Sciences. 256, 117975 (2020).
- Long, T., et al. Comparison of transitional vs surgical menopause on monoamine and amino acid levels in the rat brain. Molecular and Cellular Endocrinology. 476, 139-147 (2018).
- Long, T., et al. Estradiol and selective estrogen receptor agonists differentially affect brain monoamines and amino acids levels in transitional and surgical menopausal rat models. Molecular and Cellular Endocrinology. 496, 110533 (2019).
- Burke, N. N., et al. Enhanced nociceptive responding in two rat models of depression is associated with alterations in monoamine levels in discrete brain regions. Neuroscience. 171 (4), 1300-1313 (2010).
- Lane, J. D., Aprison, M. H. Calciumm-dependent release of endogenous serotonin, dopamine and norepinephrine from nerve endings. Life Sciences. 20 (4), 665-671 (1977).
- Ramamoorthy, S., Shippenberg, T. S., Jayanthi, L. D. Regulation of monoamine transporters: Role of transporter phosphorylation. Pharmacology and Therapeutics. 129 (2), 220-238 (2011).
- Torres, G. E., Gainetdinov, R. R., Caron, M. G. Plasma membrane monoamine transporters: structure, regulation and function. Nature Reviews. Neuroscience. 4 (1), 13-25 (2003).
- Hilber, B., et al. Serotonin-transporter mediated efflux: A pharmacological analysis of amphetamines and non-amphetamines. Neuropharmacology. 49 (6), 811-819 (2005).
- Mauna, J. C., et al. G protein βγ subunits play a critical role in the actions of amphetamine. Translational Psychiatry. 9 (1), 81 (2019).
- Sitte, H. H., Freissmuth, M. Amphetamines, new psychoactive drugs and the monoamine transporter cycle. Trends in Pharmacological Sciences. 36 (1), 41-50 (2015).
- Johnson, L. A., Guptaroy, B., Lund, D., Shamban, S., Gnegy, M. E. Regulation of amphetamine-stimulated dopamine efflux by protein kinase C β. Journal of Biological Chemistry. 280 (12), 10914-10919 (2005).
- Kahlig, K. M., et al. Amphetamine induces dopamine efflux through a dopamine transporter channel. Proceedings of the National Academy of Sciences of the United States of America. 102 (9), 3495-3500 (2005).
- Kantor, L., Hewlett, G. H. K., Gnegy, M. E. Enhanced amphetamine- and K+ -mediated dopamine release in rat striatum after repeated amphetamine: differential requirements for Ca 2+ - and calmodulin-dependent phosphorylation and synaptic vesicles. The Journal of Neuroscience. 19 (10), 3801-3808 (2018).
- Brodnik, Z. D., et al. Susceptibility to traumatic stress sensitizes the dopaminergic response to cocaine and increases motivation for cocaine. Neuropharmacology. 125, 295-307 (2017).
- Henke, A., et al. Toward serotonin fluorescent false neurotransmitters: development of fluorescent dual serotonin and vesicular monoamine transporter substrates for visualizing serotonin neurons. ACS Chemical Neuroscience. 9 (5), 925-934 (2018).
- Garcia-Olivares, J., et al. Gβγ subunit activation promotes dopamine efflux through the dopamine transporter. Molecular Psychiatry. 22 (12), 1673-1679 (2017).
- Xiao, N., Privman, E., Venton, B. J. Optogenetic control of serotonin and dopamine release in Drosophila larvae. ACS Chemical Neuroscience. 5 (8), 666-673 (2014).
- Bass, C. E., et al. Optogenetic control of striatal dopamine release in rats. Journal of Neurochemistry. 114 (5), 1344-1352 (2010).
- Stamford, J. A. Fast cyclic voltammetry: measuring transmitter release in "real time". Journal of Neuroscience Methods. 34 (1-3), 67-72 (1990).
- Brodnik, Z. D., Ferris, M. J., Jones, S. R., España, R. A. Reinforcing doses of intravenous cocaine produce only modest dopamine uptake inhibition. ACS Chemical Neuroscience. 8 (2), 281-289 (2017).
- Brodnik, Z. D., España, R. A. Dopamine uptake dynamics are preserved under isoflurane anesthesia. Neuroscience Letters. 606, 129-134 (2015).
- Ferris, M. J., Calipari, E. S., Yorgason, J. T., Jones, S. R. Examining the complex regulation and drug-induced plasticity of dopamine release and uptake using voltammetry in brain slices. ACS Chemical Neuroscience. 4 (5), 693-703 (2013).
- Siciliano, C. A., Calipari, E. S., Ferris, M. J., Jones, S. R. Biphasic mechanisms of amphetamine action at the dopamine terminal. The Journal of Neuroscience The Official Journal of the Society for Neuroscience. 34 (16), 5575-5582 (2014).
- Rice, M. E., et al. Direct monitoring of dopamine and 5-HT release in substantia nigra and ventral tegmental area in vitro. Experimental Brain Research. 100 (3), 395-406 (1994).
- Bunin, M. A., Prioleau, C., Mailman, R. B., Wightman, R. M. Release and uptake rates of 5-hydroxytryptamine in the dorsal raphe and substantia nigra reticulata of the rat brain. Journal of Neurochemistry. 70 (3), 1077-1087 (1998).
- Park, J., Takmakov, P., Wightman, R. M. In vivo comparison of norepinephrine and dopamine release in rat brain by simultaneous measurements with fast-scan cyclic voltammetry. Journal of Neurochemistry. 119 (5), 932-944 (2011).
- Park, J., Bhimani, R. V., Bass, C. E. In vivo electrochemical measurements of norepinephrine in the brain: current status and remaining challenges. Journal of the Electrochemical Society. 165 (12), 3051-3056 (2018).
- Butcher, S. P., Fairbrother, I. S., Kelly, J. S., Arbuthnott, G. W. Amphetamine-induced dopamine release in the rat striatum: an in vivo microdialysis study. Journal of Neurochemistry. 50 (2), 346-355 (1988).
- Garcia-Olivares, J., et al. Inhibition of dopamine transporter activity by G protein βγ subunits. PLoS One. 8 (3), 1-9 (2013).
- Carneiro, A. M. D., Blakely, R. D. Serotonin-, protein kinase C-, and Hic-5-associated redistribution of the platelet serotonin transporter. Journal of Biological Chemistry. 281 (34), 24769-24780 (2006).
- Rajamanickam, J., et al. Akt-mediated regulation of antidepressant-sensitive serotonin transporter function, cell-surface expression and phosphorylation. The Biochemical Journal. 468 (1), 177-190 (2015).
- Egaña, L. A., et al. Physical and functional interaction between the dopamine transporter and the synaptic vesicle protein synaptogyrin-3. The Journal of Neuroscience The Official Journal of the Society for Neuroscience. 29 (14), 4592-4604 (2009).
- Guptaroy, B., Fraser, R., Desai, A., Zhang, M., Gnegy, M. E. Site-directed mutations near transmembrane domain 1 alter conformation and function of norepinephrine and dopamine transporters. Molecular Pharmacology. 79 (3), 520-532 (2011).
- Ordway, G. A., et al. Norepinephrine transporter function and desipramine: Residual drug effects versus short-term regulation. Journal of Neuroscience Methods. 143 (2), 217-225 (2005).
- Steinkellner, T., et al. Amphetamine action at the cocaine- and antidepressant-sensitive serotonin transporter is modulated by CaMKII. Journal of Neuroscience. 35 (21), 8258-8271 (2015).
- Guptaroy, B., et al. A juxtamembrane mutation in the N terminus of the dopamine transporter induces preference for an inward-facing conformation. Molecular Pharmacology. 75 (3), 514-524 (2009).
- Carpenter, C., et al. Direct and systemic administration of a CNS-permeant tamoxifen analog reduces amphetamine-induced dopamine release and reinforcing effects. Neuropsychopharmacology. 42 (10), 1940-1949 (2017).
- Aquino-Miranda, G., Escamilla-Sánchez, J., González-Pantoja, R., Bueno-Nava, A., Arias-Montaño, J. -. A. Histamine H3 receptor activation inhibits dopamine synthesis but not release or uptake in rat nucleus accumbens. Neuropharmacology. 106, 91-101 (2016).
- Reddy, I. A., et al. Glucagon-like peptide 1 receptor activation regulates cocaine actions and dopamine homeostasis in the lateral septum by decreasing arachidonic acid levels. Translational Psychiatry. 6 (5), 809 (2016).
- Koutzoumis, D. N., et al. Alterations of the gut microbiota with antibiotics protects dopamine neuron loss and improve motor deficits in a pharmacological rodent model of Parkinson's disease. Experimental Neurology. 325, 113159 (2020).
- Herdon, H., Strupish, J., Nahorski, S. R. Differences between the release of radiolabelled and endogenous dopamine from superfused rat brain slices: Effects of depolarizing stimuli, amphetamine and synthesis inhibition. Brain Research. 348 (2), 309-320 (1985).
- Thongsaard, W., Kendall, D. A., Bennett, G. W., Marsden, C. A. A simple method for measuring dopamine release from rat brain slices. Journal of Pharmacological and Toxicological Methods. 37 (3), 143-148 (1997).
- Dorris, D. M., Hauser, C. A., Minnehan, C. E., Meitzen, J. An aerator for brain slice experiments in individual cell culture plate wells. Journal of Neuroscience Methods. 238, 1-10 (2014).
- Humpel, C. Organotypic brain slice cultures: a review. Neuroscience. 305, 86-98 (2015).
- Papouin, T., Haydon, P. Obtaining acute brain slices. BIO-PROTOCOL. 8 (2), 477-491 (2018).
- Collingridge, G. L. The brain slice preparation: a tribute to the pioneer Henry McIlwain. Journal of Neuroscience Methods. 59 (1), 5-9 (1995).
- Yamamoto, C., McIlwain, H. Electrical activities in thin sections from the mammalian brain maintained in chemically-defined media in vitro. Journal of Neurochemistry. 13 (12), 1333-1343 (1966).
- Buskila, Y., et al. Extending the viability of acute brain slices. Scientific Reports. 4, 4-10 (2014).
- Kako, H., Fukumoto, S., Kobayashi, Y., Yokogoshi, H. Effects of direct exposure of green odour components on dopamine release from rat brain striatal slices and PC12 cells. Brain Research Bulletin. 75 (5), 706-712 (2008).
- McBride, W. J., Murphy, J. M., Lumeng, L., Li, T. -. K. Effects of ethanol on monoamine and amino acid release from cerebral cortical slices of the alcohol-preferring P line of rats. Alcoholism: Clinical and Experimental Research. 10 (2), 205-208 (1986).
- Chen, J. C., Turiak, G., Galler, J., Volicer, L. Effect of prenatal malnutrition on release of monoamines from hippocampal slices. Life Sciences. 57 (16), 1467-1475 (1995).
- Becker, J. B., Castañeda, E., Robinson, T. E., Beer, M. E. A simple in vitro technique to measure the release of endogenous dopamine and dihydroxyphenylacetic acid from striatal tissue using high performance liquid chromatography with electrochemical detection. Journal of Neuroscience Methods. 11 (1), 19-28 (1984).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2007).
- Dailey, J. W., Reith, M. E. A., Steidley, K. R., Milbrandt, J. C., Jobe, P. C. Carbamazepine-induced release of serotonin from rat hippocampus in vitro. Epilepsia. 39 (10), 1054-1063 (1998).
- Buskila, Y., et al. Extending the viability of acute brain slices. Scientific Reports. 4, 5309 (2014).
- Mewes, A., Franke, H., Singer, D. Organotypic brain slice cultures of adult transgenic P301S mice-A model for tauopathy studies. PLoS One. 7 (9), (2012).
- Rönicke, R., et al. AB mediated diminution of MTT reduction - An artefact of single cell culture. PLoS One. 3 (9), (2008).
- Ihalainen, J. A., Riekkinen, P., Feenstra, M. G. P. Comparison of dopamine and noradrenaline release in mouse prefrontal cortex, striatum and hippocampus using microdialysis. Neuroscience Letters. 277 (2), 71-74 (1999).
- Richards, D. A., Obrenovitch, T. P., Symon, L., Curzon, G. Extracellular dopamine and serotonin in the rat striatum during transient ischaemia of different severities: a microdialysis study. Journal of Neurochemistry. 60 (1), 128-136 (1993).
- Fog, J. U., et al. Calmodulin kinase II interacts with the dopamine transporter C terminus to regulate amphetamine-induced reverse transport. Neuron. 51 (4), 417-429 (2006).
- Balázsa, T., Bíró, J., Gullai, N., Ledent, C., Sperlágh, B. CB1-cannabinoid receptors are involved in the modulation of non-synaptic [3H]serotonin release from the rat hippocampus. Neurochemistry International. 52 (1), 95-102 (2008).
- Schechter, L. E. The potassium channel blockers 4-aminopyridine and tetraethylammonium increase the spontaneous basal release of [3H]5-hydroxytryptamine in rat hippocampal slices. The Journal of Pharmacology and Experimental Therapeutics. 282 (1), 262-270 (1997).
- Boudanova, E., Navaroli, D. M., Stevens, Z., Melikian, H. E. Dopamine transporter endocytic determinants: carboxy terminal residues critical for basal and PKC-stimulated internalization. Molecular and Cellular Neuroscience. 39 (2), 211-217 (2008).
- Bowyer, J. F., et al. Interactions of MK-801 with glutamate-, glutamine- and methamphetamine-evoked release of [3H]dopamine from striatal slices. The Journal of Pharmacology and Experimental Therapeutics. 257 (1), 262-270 (1991).
- Perszyk, R. E., et al. GluN2D-containing N-methyl-D-aspartate receptors mediate synaptic transmission in hippocampal interneurons and regulate interneuron activity. Molecular Pharmacology. 90 (6), 689-702 (2016).
- Jones, S. R., et al. Profound neuronal plasticity in response to inactivation of the dopamine transporter. Proceedings of the National Academy of Sciences of the United States of America. 95 (7), 4029-4034 (1998).
- Jedema, H. P., Narendran, R., Bradberry, C. W. Amphetamine-induced release of dopamine in primate prefrontal cortex and striatum: striking differences in magnitude and timecourse. Journal of Neurochemistry. 130, 490-497 (2014).
- Buchmayer, F., et al. Amphetamine actions at the serotonin transporter rely on the availability of phosphatidylinositol-4,5-bisphosphate. Proceedings of the National Academy of Sciences. 110 (28), 11642-11647 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon