このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
急性脳スライスにおける内因性モノアミン放出測定用プレートベースアッセイ
要約
急性脳スライスを用いた内因性モノアミン放出の検出に関する簡単な手法を紹介する。セットアップはモノアミン放出のためのティッシュホールダーを含んでいる48ウェル版を使用する。放出されたモノアミンは、HPLCによって電気化学的検出と結合して分析される。さらに、この技術は、創薬のためのスクリーニング方法を提供する。
要約
モノアミン神経伝達物質は、多数の神経疾患と精神医学的疾患に関連付けられている.このような状態の動物モデルは、モノアミン神経伝達物質の放出および取り込みダイナミクスの変化を示している。電気生理学、高速スキャン環状ボルタンメトリー(FSCV)、イメージング、生体内ミクロジアル、光遺伝学、または放射能の使用などの技術的に複雑な方法は、モノアミン機能を研究するために必要とされる。ここで紹介する方法は、モノアミン放出を調べる組織ホルダーを含む48ウェルプレートを用いて急性脳スライス中のモノアミン放出を検出するための最適化された2段階のアプローチであり、モノアミン放出測定のための電気化学的検出(HPLC-ECD)と組み合わせた高性能液体クロマトグラフィーである。簡単に言えば、前頭前野、海馬、および側頭線を含む目的の領域を含むラット脳切片は、組織スライサーまたはビブラートームを用いて得られた。これらの関心領域は、脳全体から解剖され、酸素化された生理学的緩衝液中にインキュベートされた。実験時間を通じて、3-(4,5-ジメチルチアゾール-2-yl)-2,5-ジフェニルテトラゾリウム(MTT)アッセイによって生存率を調べた。急性解剖された脳領域は、トランスポーター(アンフェタミン)を介してモノアミン放出を誘導することが知られている様々な薬物条件で、またはexocttic小胞体放出(KCl)の活性化を通じてインキュベートされた。インキュベーション後、上清中の放出物を収集し、HPLC-ECDシステムを介して分析した。ここで、基礎モノアミン放出は、急性脳スライスからHPLCによって検出される。このデータは、AMPHおよびKClがモノアミン放出を誘導することを示すインビボおよびインビトロの結果をサポートする。この方法は、モノアミン輸送体依存性放出に関連するメカニズムを研究するのに特に有用であり、迅速かつ低コストでモノアミン放出に影響を及ぼす化合物をスクリーニングする機会を提供する。
概要
多くの神経疾患および精神疾患は、単アミン神経伝達物質(ドーパミン[DA]、セロトニン[5-HT]、ノルエピネフリン[NE])恒常性1,2,3の調節不全または不十分な維持に関連している。これらの状態は、うつ病1、2、統合失調症2、不安2、中毒4、更年期5、6,7、疼痛8、およびパーキンソン病3を含むが、これらに限定されない。例えば、更年期のいくつかのラットモデルは、海馬、前頭前野、線条体内のモノアミンの調節不全または減少が、更年期障害を経験している女性に見られるうつ病と認知機能の両方に関連している可能性があることを示している。これらのモデルにおけるモノアミンの調節異常はHPLC-ECDを用いて広範囲に検討されてきたが、この研究は測定された神経伝達物質の含有量と神経伝達物質の放出を区別しなかった5,6,7.モノアミンは、Ca2+依存性のvesicular release9を介して古典的に細胞外空間に放出され、それぞれの原形質膜再取り込みシステム(ドーパミントランスポーター、DAT;セロトニントランスポーター、SERT;ノルエピネフリントランスポーター、NET)10,11を介してリサイクルされる。逆に、アンフェタミン(AMPH)や3,4-メチレンジオキシメタンフェタミン(MDMA)などの乱用薬がトランスポーターシステムを介してDAおよび5-HTをそれぞれ放出することが知られているため、これらのトランスポーターはモノアミンを放出または流出させ得ることを示唆している。.したがって、モノアミン放出ダイナミクスの適切な機械学的理解は、特定の標的薬物療法を開発するために重要である。
高速スキャン環状ボルタンメトリー(FSCV)18、生体内マイクロダイアルシス13、イメージング19、放射性標識モノアミン20のプレインキュベーション、光遺伝学、さらに最近では遺伝子組み換え蛍光センサーとフォトメトリクス21,22などのモノアミン放出を研究するために幅広い技術が採用されています。.FSCVおよび生体内マイクロ透析は、モノアミン放出の研究に使用される主要な技術である。FSCVは、急性脳スライスおよびin vivo23におけるDAを中心に刺激された興奮性放出を研究するために使用される。FSCVは電極を使用して放出を刺激または誘発するため、神経伝達物質放出の主な原因はCa2+依存性の小胞放出18、24、25、26、27、28、29、30、31である.生体内のミクロジアル症とHPLCを併用すると、関心のある脳領域に配置されたプローブを用いて細胞外神経伝達物質レベルの変化を測定する13,32。FSCVと同様に、生体内のミクロジアルシスに対する大きな制限は、神経伝達物質放出源の決定における困難である:Ca2+依存性の小胞放出またはトランスポーター依存性である。注目に値する、両方の方法は、モノアミン放出の直接測定を可能にする。光遺伝学の最近の進歩を通じて、研究は、絶妙な細胞型特異性21,22と短い時間スパンでの5-HTおよびDA放出の検出を実証する。しかし、これらの戦略は、複雑で高価な技術と機器を必要とし、間接的にモノアミン放出を測定し、特に受容体にモノアミン結合を介して。また、放射線標識モノアミンは、モノアミンのダイナミクスの研究にも使用されます。放射性標識モノアミンは、各モノアミントランスポーター20、33、34、35、36、37、38、39、40、一次ニューロン20、シナプトソーム33、39、41、異種細胞などの様々なモデルシステムにプリロードされ得る、42、および急性脳スライス43,44。しかし、放射能は実験者に潜在的な害をもたらし、トリチウム標識された検体は内因性モノアミンダイナミクス45,46を忠実に再現しない可能性がある。HPLC-ECDなどのオフライン検出法と組み合わせたスーパーフュージョンシステムは、複数の組織源からのモノアミンの検出を可能にしました。ここでは、このプロトコルは、急性脳スライスを使用して、内因性基底および刺激されたモノアミン放出を直接測定するための最適化された低コスト、シンプル、および正確な方法として提供される。
急性脳スライスは、主に生体内の解剖学的微小環境を維持し、無傷のシナプス47,48,49,50,51,52を維持するため、機械学的仮説をテストすることを可能にする。いくつかの研究では、急性脳スライスまたは切り刻まれた脳組織は、Ca2+媒介放出53,54,55,56を刺激するためにKClを使用したスーパーフュージョン技術と組み合わせて使用されてきた。超灌流システムは、モノアミンを含む神経伝達物質放出機構の分野の理解を進めるために重要であった。しかし、これらのシステムは比較的高価であり、組織分析に利用可能なチャンバーの数は4〜12の範囲です。これに対し、ここで提示する方法は安価であり、48の組織サンプルの測定を可能にし、そして96までの組織サンプルを使用するように精製され得る。48ウェルプレート内の各ウェルには、フィルターを使用して放出された製品を組織から分離する組織ホルダーが含まれ、放出されたモノアミンをHPLC-ECDによって収集して分析します。重要なことに、この方法は、モノアミン放出を調節する薬理学的薬剤による治療後に、前頭前野、海馬、および後方線条体などの異なる脳領域からの5-HT、DA、およびNE放出の同時測定を可能にする。これにより、実験者は、試験するサンプル数を増加させ、使用する動物の数を減らす安価なマルチウェルシステムを用いて複数の質問に答えることができる。
プロトコル
動物の取り扱いと組織の収集を含むすべての実験は、承認されたプロトコル201508873(UF)と1071(CCNY)に従って、フロリダ大学とニューヨーク市立動物の世話と使用委員会(IACUC)に従って行われました。試薬および緩衝液については 、補足ファイルを参照してください。
1. 急性ラット脳スライスを準備する
注:この実験では、成人雄ラット(250〜350g)を使用しました。しかし、このセットアップは、異なる発達点、雌ラット、および他の種のために機能する。マウスのようなより小さな動物を使用する場合、実験者は、条件ごとに異なる数の脳スライスまたはパンチを使用してプロトコルを最適化するように調整することができる。解剖バッファはバッファ1と呼ばれます。流出バッファーは、バッファー 2 と呼ばれます。
- 補足ファイルに記載されているとおりに、バッファー 1 を準備します。95%/5%(O2/CO2)を氷上で20分間泡立て、酸素で飽和バッファー1。バッファー1の50 mLを取り出し、小さなビーカーまたはペトリ皿で氷の上で冷やします。このバッファーは、急性収穫全脳を保持するために使用されます。.
- 1~2%のイオフルランで1匹または2匹の成虫ラット(250~350g)を麻酔し、ギロチンを使って切断し、脳を迅速に取り除きます。すぐにステップ1.1から容器の中の氷冷酸素化緩衝液1に脳を置く。
注:イオブルランとギロチンが安全に使用されていることを確認してください。ヒュームフードの下にオープンイオブルラン。 - ビブラートメまたはコンプレトムを使用して、対象領域ごとに300μmのコロナ脳切片を切り取ります(図1)。バブリングバッファ1は、セクションが作成されている間に存在する必要があります。ステンレス製のヘラを使用して、慎重かつすぐに氷冷酸素化緩衝液1で満たされた新しいペトリ皿に脳スライスを移します(図2)。
- さらに、ラット脳atlas57を用いて慎重にスライスをガラススライド(図1G)に移動させることにより脳スライス(例えば、パンチ、切り出し)を解剖する。例えば、その暗い、縞状の構造に基づいて、側側線条体を識別し、皮質と独特の螺旋構造への近接性に基づいて海馬を識別します。左右半球は、制御スライスと実験スライスとして使用するために分離されてもよい(図2G-H)。ここで、後回線を2mmのパンチに更に解剖した(図1G)。
- 先端を切り落としたプラスチック転写ピペットを使用して、酸素バブリングで酸素化された氷冷バッファー1に浸した小さな容器にスライスまたは脳パンチを移します。これらの容器は、ステンレスメッシュ、またはバッファーで満たされた小さなペトリ皿(図1H)であってもよい。
2. 脳のスライスまたはパンチからの元生体内因性モノアミン放出
注:このセクションで使用されるデバイスは、48ウェルプレートと、カルボーゲンラインに接続されたインセットフィルタのない6つのマイクロ遠心分離フィルタユニットで構成された組織ホルダーで構成されています(図2)。ホルダーを作るためには、頑丈なプラスチック棒(例えば、セルスクレーパーから)を使用し、それにインセットフィルターなしでマイクロ遠心フィルターユニットをスーパー接着します。1~2日間乾燥させます。内因性モノアミン放出実験に要する時間およびアンフェタミン、フルオキセチンおよびコカインの濃度は、現在の文献および以前のプロトコル13,20,58に基づいている。
-
組織活性化
- ステップ1.1.5から流出チャンバーの各ウェルに脳組織を移し、一定の穏やかな泡立ちを伴う0.5-1 mLの酸素化緩衝液2のスライドウォーマーで37°Cで30〜50分間回復することを可能にする(図2B1)。
- このインキュベーションの間に、実験のために所望の濃度に薬剤を希釈する。すべての薬物は、バッファー 2 に溶解する必要があり、濃度は、現在の文献に基づいています。
-
最初のインキュベーション
- 脳組織を含む組織ホルダーを500 μLの酸素化緩衝液2を含むウェルに移動し、37°Cで20分間インキュベートします。 ホルダーに余分なバッファが入らなくなるまで、ウェルの端にあるホルダーをタップして、バッファを最小限から無くして転送します。
- モノアミントランスポーター阻害剤などの薬理学的薬剤を用いた実験では、酸素化緩衝液2で希釈した薬物で組織サンプルをインキュベートする(例えば、10μMフルオキセチン、40μMコカイン; 図2B2参照)。各ウェルの最終ボリュームは500 μLになります。
-
第二のインキュベーション
- 各薬剤の所望の濃度の有無にかかわらず500 μL合計緩衝液2を含む新しいウェルのセットにティッシュとホルダーを移動させる。余分なバッファが残っていないか確認してください。各ウェルは、実験条件のn = 1を表します。各実験条件は三重で行われる。
- 1つの井戸には酸素化された緩衝液2、次の10-30 μM AMPHが含まれ、最終井戸には10-30 μM AMPHとモノアミントランスポーター阻害剤が含まれています。各薬剤は、酸素化緩衝液2に溶解される。
- 薬物条件の500 μLで37°Cで20分間組織をインキュベートします。
注:追加のウェルは、モノアミントランスポーター阻害剤の有無にかかわらず酸素化高K+ バッファ2を含む可能性があります。各薬剤を酸素化緩衝液2(500μL)に溶解します。 - 20分のこの第二のインキュベーションの間に、ステップ2.2.1の最初のインキュベーションからウェルから溶液を集め、1Nの過塩素酸またはリン酸の50 μLを含むマイクロ遠心チューブに移す(HPLCの種類に依存して、最終濃度0.1N)。サンプルの最終容積は550 μLです。
- 20分の2回目のインキュベーションの後、脳切片またはパンチを含む組織ホルダーを空の井戸に移動させ、氷の上のプレートを維持します。上清を1Nの過塩素酸またはリン酸の50μLを含むマイクロ遠心分離管に移します。サンプルの最終容積は550 μLです。
- 組織を含む各ウェルに氷冷緩衝液1の1mLを加える。小さなピンセットを使用して組織のすべてを収集し、きれいなマイクロ遠心チューブに転送します。
- 脳組織を用いたチューブを-80 °Cに維持する。 バッファ1の1mLを捨てます(図2B4)。
- マイクロ遠心分離機フィルターチューブ(0.22 μm)を2,500 x g で各インキュベーションから得たフィルター溶液。この濾液を使用して、電気化学的検出を伴うHPLCを用いてモノアミン含有量を決定します(図2B5)。
3. 組織の生存率
- MTTアッセイ
注:この実験的なセットアップに関する重要な懸念は、組織が数時間59まで使用することができるように組織の生存率です。MTTアッセイ60,61は、実験の終わりまでに組織の生存率を決定するために使用される。このアッセイは、適切な代謝を有する生細胞による黄色のテトラゾリウム塩MTT(3-(4,5-ジメチルチアゾール-2-イイル)-2,5-ジフェニルテトラゾリウム臭化)の紫色のフォルマザン結晶への変換に基づいています。- 実験後は、組織サンプルの別々のグループを維持し、それらを2つのグループに分けます。
- トリトンX-100で37°Cで1基を20分間インキュベートし、コントロールとして緩衝液2に溶解する。トリトンX-100治療は細胞死をもたらす。第2群を緩衝2内に維持し、トリトンX-100(組織生存率制御)でインキュベートしない。
- 0.5 mg/mLの最終濃度に酸素化緩衝液2の両方のグループにMTT(PBSの5mg/mL、pH 7.4)を加えます。
- 組織サンプルを37°Cで20分間インキュベートし、PBSで洗浄し、SDS(10%、w/v)、DMF(25%、v/v)、水の混合物250μLを含むマイクロ遠心チューブに移し、フォルマザン結晶を溶解します。
- サンプルを24時間インキュベートする。
- チューブを10,000 x gで10分間遠心し、マイクロプレートリーダーを使用して562 nmおよび690 nmで上清(200 μL)の吸光度を測定します。組織生存率は次のように計算されます: (A562-A690)/組織重量.
4. モノアミンのHPLC分析
- 前のプロトコル13,44に従ってHPLC-ECDを用いて各実験条件からモノアミン放出を定量し、逆相カラムを用いた。
- 検出に必要な移動フェーズを準備します。これは、100 mMリン酸、100 mMクエン酸、0.1 mM EDTA-Na2、600 mg/Lオクタンスルホン酸、8%対/vアセトニトリル(最終pH 6.0)で構成されています。移動相の組成は、使用するHPLCおよびカラムの種類によって異なります。
- 電気化学検出器(2mmガラス状炭素電極)の電位を0.46Vに設定し、流量を0.05mL/minに設定します。
- 各サンプルの5 μLをロードし、自動注入および検出のためにHPLCに神経伝達物質標準を含む。各サンプルの添加量は、使用するHPLCの種類によって異なります。
- HPLCの実行が完了したら、所定のHPLC分析ソフトウェアを使用してクロマトグラフデータを取得および分析します。
- 各モノアミンから構成される標準的な曲線を使用してモノアミンの含有量を分析 (ドーパミン: DA, ノルエピネフリン: NE, セロトニン: 5-HT; 図2C)。結果のクロマトグラムを使用して、メーカーのガイドラインに基づいてカーブ(AUC)の下の領域を取得します。
5. タンパク質定量のための組織のライセートを準備する
-
タンパク質アッセイ
- 脳切片/パンチを含む各マイクロ遠心分離管に氷冷リシスバッファーとプロテアーゼ阻害剤(0.1 g/1 mL)を加え、害虫ホモジナイザーを使用してホモジナイズします。マイクロ遠心チューブは、タンパク質の分解を防ぐために均質化しながら氷の上に維持する必要があります。
- 4 °Cで1時間、軽い回転で組織の均質化をインキュベートする。
- 遠心分離機組織は、4°Cで15分間16,000xgで均質化し、上清を回収する。
- 上清中のタンパク質濃度を、ウシ血清アルブミン(BSA)を標準として定めます。
- 各脳サンプル中のモノアミン含有量を、脳組織の 250 μL で測定したタンパク質の総含量(μg)に正規化します。以下の式を使用して、nmolモノアミン/gタンパク質を決定します。df = 希釈係数。
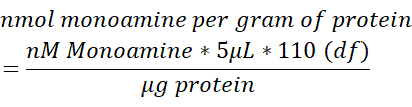
6. 統計分析
- 一方向のANOVAを使用してモノアミン放出(nmol/g)を分析し、続いてシダックの多重比較テストを行い、ポストホック比較を行います。
- 独立したグループのための非対の学生の t検定を使用して組織の生存率を分析します(コントロール対1%Triton X-100)。
- すべての統計分析で、アルファレベルを 0.05 ≤に設定します。
結果
この技術は、内部組織ホルダーを備えた48ウェルプレートに基づく電気化学的検出を用いたHPLCを用いた内因性モノアミンの放出を測定するための脳スライスの使用を説明する。実験用セットアップは 図1 および 図2に示されている。最初に、実験の終わりまでに組織の生存率を確保するために、MTT(3-(4,5-ジメチルチアゾール...
ディスカッション
モノアミン放出測定は、異種細胞、神経細胞培養、脳シナプトソーム、エキソウビボ急性脳スライス、および動物全体で長年にわたって行われてきた13,20,41,42,58,64,65,66,67,68
開示事項
著者は開示を持っていません。
謝辞
この作品は、フォンデサイト開始基金N 11191049をJ.A.P.に付与し、NIHはG.E.TにDA038598を付与することによって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 48 Well plate | NA | NA | Assay |
| Acetonitrile | Fischer Scientific | A998-1 | Mobile Phase |
| Calcium Chloride Ahydrous | Sigma Aldrich | C1016 | Modified Artifical Cerebrospinal Fluid OR Efflux Buffer |
| Clarity Software | Anetc | ||
| Citric Acid | Sigma Aldrich | Mobile Phase | |
| D-(+)-Glucose | Sigma | 1002608421 | Dissection Buffer |
| DMF | Sigma Aldrich | D4551 | MTT Assay |
| EDTA-Na2 | Sigma Aldrich | Mobile Phase | |
| GraphPad Software | Graphpad Software, Inc | Statistical Analysis | |
| Glycerol | Sigma Aldrich | G5516 | Lysis buffer |
| HEPES | Sigma Aldrich | H3375 | Lysis buffer |
| HPLC, Decade Amperometric | Anetc | HPLC, LC-EC system | |
| HPLC | Amuza | HPLC HTEC-510. | |
| L-Asrobic Acid | Sigma Aldrich | A5960 | Dissection Buffer |
| Magnesium Sulfate | Sigma | 7487-88-9 | KH Buffer |
| Microcentrifuge Filter Units UltraFree | Millipore | C7554 | Assay - 6 to fit in 48 well plate |
| MTT | Thermo Fisher | M6494 | MTT Assay |
| Nanosep | VWR | 29300-606 | Assay; protein assay |
| Octanesulfonic acid | Sigma Aldrich | V800010 | Mobile Phase |
| Pargyline Clorohydrate | Sigma Aldrich | P8013 | Modified Artifical Cerebrospinal Fluid OR Efflux Buffer |
| Phosphoric Acid | Sigma Aldrich | Mobile Phase | |
| Potassium Chloride | Sigma | 12636 | KH Buffer |
| Potassium Phosphate Monobasic | Sigma | 1001655559 | KH Buffer |
| Precisonary VF-21-0Z | Precissonary | Compresstome | |
| Protease Inhibitor Cocktail | Sigma Aldrich | P2714 | Lysis buffer. |
| Sodium Bicarbonate | Sigma | S5761 | Dissection Buffer |
| Sodium Bicarbonate | Sigma Aldrich | S5761 | Dissection Buffer |
| Sodium Chloride | Sigma | S3014 | KH Buffer |
| Sodium Dodecyl Sulfate | Sigma Aldrich | L3771 | Lysis buffer |
| Triton X-100 | Sigma Aldrich | T8787 | MTT Assay / Lysis buffer |
参考文献
- Jesulola, E., Micalos, P., Baguley, I. J. Understanding the pathophysiology of depression: From monoamines to the neurogenesis hypothesis model - are we there yet. Behavioural Brain Research. 341, 79-90 (2018).
- Krystal, J. H., D'Souza, D. C., Sanacora, G., Goddard, A. W., Charney, D. S. Current perspectives on the pathophysiology of schizophrenia, depression, and anxiety disorders. Medical Clinics of North America. 85 (3), 559-577 (2001).
- Barone, P. Neurotransmission in Parkinson's disease: beyond dopamine. European Journal of Neurology. 17 (3), 364-376 (2010).
- Howell, L. L., Kimmel, H. L. Monoamine transporters and psychostimulant addiction. Biochemical Pharmacology. 75 (1), 196-217 (2008).
- Kirshner, Z. Z., et al. Impact of estrogen receptor agonists and model of menopause on enzymes involved in brain metabolism, acetyl-CoA production and cholinergic function. Life Sciences. 256, 117975 (2020).
- Long, T., et al. Comparison of transitional vs surgical menopause on monoamine and amino acid levels in the rat brain. Molecular and Cellular Endocrinology. 476, 139-147 (2018).
- Long, T., et al. Estradiol and selective estrogen receptor agonists differentially affect brain monoamines and amino acids levels in transitional and surgical menopausal rat models. Molecular and Cellular Endocrinology. 496, 110533 (2019).
- Burke, N. N., et al. Enhanced nociceptive responding in two rat models of depression is associated with alterations in monoamine levels in discrete brain regions. Neuroscience. 171 (4), 1300-1313 (2010).
- Lane, J. D., Aprison, M. H. Calciumm-dependent release of endogenous serotonin, dopamine and norepinephrine from nerve endings. Life Sciences. 20 (4), 665-671 (1977).
- Ramamoorthy, S., Shippenberg, T. S., Jayanthi, L. D. Regulation of monoamine transporters: Role of transporter phosphorylation. Pharmacology and Therapeutics. 129 (2), 220-238 (2011).
- Torres, G. E., Gainetdinov, R. R., Caron, M. G. Plasma membrane monoamine transporters: structure, regulation and function. Nature Reviews. Neuroscience. 4 (1), 13-25 (2003).
- Hilber, B., et al. Serotonin-transporter mediated efflux: A pharmacological analysis of amphetamines and non-amphetamines. Neuropharmacology. 49 (6), 811-819 (2005).
- Mauna, J. C., et al. G protein βγ subunits play a critical role in the actions of amphetamine. Translational Psychiatry. 9 (1), 81 (2019).
- Sitte, H. H., Freissmuth, M. Amphetamines, new psychoactive drugs and the monoamine transporter cycle. Trends in Pharmacological Sciences. 36 (1), 41-50 (2015).
- Johnson, L. A., Guptaroy, B., Lund, D., Shamban, S., Gnegy, M. E. Regulation of amphetamine-stimulated dopamine efflux by protein kinase C β. Journal of Biological Chemistry. 280 (12), 10914-10919 (2005).
- Kahlig, K. M., et al. Amphetamine induces dopamine efflux through a dopamine transporter channel. Proceedings of the National Academy of Sciences of the United States of America. 102 (9), 3495-3500 (2005).
- Kantor, L., Hewlett, G. H. K., Gnegy, M. E. Enhanced amphetamine- and K+ -mediated dopamine release in rat striatum after repeated amphetamine: differential requirements for Ca 2+ - and calmodulin-dependent phosphorylation and synaptic vesicles. The Journal of Neuroscience. 19 (10), 3801-3808 (2018).
- Brodnik, Z. D., et al. Susceptibility to traumatic stress sensitizes the dopaminergic response to cocaine and increases motivation for cocaine. Neuropharmacology. 125, 295-307 (2017).
- Henke, A., et al. Toward serotonin fluorescent false neurotransmitters: development of fluorescent dual serotonin and vesicular monoamine transporter substrates for visualizing serotonin neurons. ACS Chemical Neuroscience. 9 (5), 925-934 (2018).
- Garcia-Olivares, J., et al. Gβγ subunit activation promotes dopamine efflux through the dopamine transporter. Molecular Psychiatry. 22 (12), 1673-1679 (2017).
- Xiao, N., Privman, E., Venton, B. J. Optogenetic control of serotonin and dopamine release in Drosophila larvae. ACS Chemical Neuroscience. 5 (8), 666-673 (2014).
- Bass, C. E., et al. Optogenetic control of striatal dopamine release in rats. Journal of Neurochemistry. 114 (5), 1344-1352 (2010).
- Stamford, J. A. Fast cyclic voltammetry: measuring transmitter release in "real time". Journal of Neuroscience Methods. 34 (1-3), 67-72 (1990).
- Brodnik, Z. D., Ferris, M. J., Jones, S. R., España, R. A. Reinforcing doses of intravenous cocaine produce only modest dopamine uptake inhibition. ACS Chemical Neuroscience. 8 (2), 281-289 (2017).
- Brodnik, Z. D., España, R. A. Dopamine uptake dynamics are preserved under isoflurane anesthesia. Neuroscience Letters. 606, 129-134 (2015).
- Ferris, M. J., Calipari, E. S., Yorgason, J. T., Jones, S. R. Examining the complex regulation and drug-induced plasticity of dopamine release and uptake using voltammetry in brain slices. ACS Chemical Neuroscience. 4 (5), 693-703 (2013).
- Siciliano, C. A., Calipari, E. S., Ferris, M. J., Jones, S. R. Biphasic mechanisms of amphetamine action at the dopamine terminal. The Journal of Neuroscience The Official Journal of the Society for Neuroscience. 34 (16), 5575-5582 (2014).
- Rice, M. E., et al. Direct monitoring of dopamine and 5-HT release in substantia nigra and ventral tegmental area in vitro. Experimental Brain Research. 100 (3), 395-406 (1994).
- Bunin, M. A., Prioleau, C., Mailman, R. B., Wightman, R. M. Release and uptake rates of 5-hydroxytryptamine in the dorsal raphe and substantia nigra reticulata of the rat brain. Journal of Neurochemistry. 70 (3), 1077-1087 (1998).
- Park, J., Takmakov, P., Wightman, R. M. In vivo comparison of norepinephrine and dopamine release in rat brain by simultaneous measurements with fast-scan cyclic voltammetry. Journal of Neurochemistry. 119 (5), 932-944 (2011).
- Park, J., Bhimani, R. V., Bass, C. E. In vivo electrochemical measurements of norepinephrine in the brain: current status and remaining challenges. Journal of the Electrochemical Society. 165 (12), 3051-3056 (2018).
- Butcher, S. P., Fairbrother, I. S., Kelly, J. S., Arbuthnott, G. W. Amphetamine-induced dopamine release in the rat striatum: an in vivo microdialysis study. Journal of Neurochemistry. 50 (2), 346-355 (1988).
- Garcia-Olivares, J., et al. Inhibition of dopamine transporter activity by G protein βγ subunits. PLoS One. 8 (3), 1-9 (2013).
- Carneiro, A. M. D., Blakely, R. D. Serotonin-, protein kinase C-, and Hic-5-associated redistribution of the platelet serotonin transporter. Journal of Biological Chemistry. 281 (34), 24769-24780 (2006).
- Rajamanickam, J., et al. Akt-mediated regulation of antidepressant-sensitive serotonin transporter function, cell-surface expression and phosphorylation. The Biochemical Journal. 468 (1), 177-190 (2015).
- Egaña, L. A., et al. Physical and functional interaction between the dopamine transporter and the synaptic vesicle protein synaptogyrin-3. The Journal of Neuroscience The Official Journal of the Society for Neuroscience. 29 (14), 4592-4604 (2009).
- Guptaroy, B., Fraser, R., Desai, A., Zhang, M., Gnegy, M. E. Site-directed mutations near transmembrane domain 1 alter conformation and function of norepinephrine and dopamine transporters. Molecular Pharmacology. 79 (3), 520-532 (2011).
- Ordway, G. A., et al. Norepinephrine transporter function and desipramine: Residual drug effects versus short-term regulation. Journal of Neuroscience Methods. 143 (2), 217-225 (2005).
- Steinkellner, T., et al. Amphetamine action at the cocaine- and antidepressant-sensitive serotonin transporter is modulated by CaMKII. Journal of Neuroscience. 35 (21), 8258-8271 (2015).
- Guptaroy, B., et al. A juxtamembrane mutation in the N terminus of the dopamine transporter induces preference for an inward-facing conformation. Molecular Pharmacology. 75 (3), 514-524 (2009).
- Carpenter, C., et al. Direct and systemic administration of a CNS-permeant tamoxifen analog reduces amphetamine-induced dopamine release and reinforcing effects. Neuropsychopharmacology. 42 (10), 1940-1949 (2017).
- Aquino-Miranda, G., Escamilla-Sánchez, J., González-Pantoja, R., Bueno-Nava, A., Arias-Montaño, J. -. A. Histamine H3 receptor activation inhibits dopamine synthesis but not release or uptake in rat nucleus accumbens. Neuropharmacology. 106, 91-101 (2016).
- Reddy, I. A., et al. Glucagon-like peptide 1 receptor activation regulates cocaine actions and dopamine homeostasis in the lateral septum by decreasing arachidonic acid levels. Translational Psychiatry. 6 (5), 809 (2016).
- Koutzoumis, D. N., et al. Alterations of the gut microbiota with antibiotics protects dopamine neuron loss and improve motor deficits in a pharmacological rodent model of Parkinson's disease. Experimental Neurology. 325, 113159 (2020).
- Herdon, H., Strupish, J., Nahorski, S. R. Differences between the release of radiolabelled and endogenous dopamine from superfused rat brain slices: Effects of depolarizing stimuli, amphetamine and synthesis inhibition. Brain Research. 348 (2), 309-320 (1985).
- Thongsaard, W., Kendall, D. A., Bennett, G. W., Marsden, C. A. A simple method for measuring dopamine release from rat brain slices. Journal of Pharmacological and Toxicological Methods. 37 (3), 143-148 (1997).
- Dorris, D. M., Hauser, C. A., Minnehan, C. E., Meitzen, J. An aerator for brain slice experiments in individual cell culture plate wells. Journal of Neuroscience Methods. 238, 1-10 (2014).
- Humpel, C. Organotypic brain slice cultures: a review. Neuroscience. 305, 86-98 (2015).
- Papouin, T., Haydon, P. Obtaining acute brain slices. BIO-PROTOCOL. 8 (2), 477-491 (2018).
- Collingridge, G. L. The brain slice preparation: a tribute to the pioneer Henry McIlwain. Journal of Neuroscience Methods. 59 (1), 5-9 (1995).
- Yamamoto, C., McIlwain, H. Electrical activities in thin sections from the mammalian brain maintained in chemically-defined media in vitro. Journal of Neurochemistry. 13 (12), 1333-1343 (1966).
- Buskila, Y., et al. Extending the viability of acute brain slices. Scientific Reports. 4, 4-10 (2014).
- Kako, H., Fukumoto, S., Kobayashi, Y., Yokogoshi, H. Effects of direct exposure of green odour components on dopamine release from rat brain striatal slices and PC12 cells. Brain Research Bulletin. 75 (5), 706-712 (2008).
- McBride, W. J., Murphy, J. M., Lumeng, L., Li, T. -. K. Effects of ethanol on monoamine and amino acid release from cerebral cortical slices of the alcohol-preferring P line of rats. Alcoholism: Clinical and Experimental Research. 10 (2), 205-208 (1986).
- Chen, J. C., Turiak, G., Galler, J., Volicer, L. Effect of prenatal malnutrition on release of monoamines from hippocampal slices. Life Sciences. 57 (16), 1467-1475 (1995).
- Becker, J. B., Castañeda, E., Robinson, T. E., Beer, M. E. A simple in vitro technique to measure the release of endogenous dopamine and dihydroxyphenylacetic acid from striatal tissue using high performance liquid chromatography with electrochemical detection. Journal of Neuroscience Methods. 11 (1), 19-28 (1984).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2007).
- Dailey, J. W., Reith, M. E. A., Steidley, K. R., Milbrandt, J. C., Jobe, P. C. Carbamazepine-induced release of serotonin from rat hippocampus in vitro. Epilepsia. 39 (10), 1054-1063 (1998).
- Buskila, Y., et al. Extending the viability of acute brain slices. Scientific Reports. 4, 5309 (2014).
- Mewes, A., Franke, H., Singer, D. Organotypic brain slice cultures of adult transgenic P301S mice-A model for tauopathy studies. PLoS One. 7 (9), (2012).
- Rönicke, R., et al. AB mediated diminution of MTT reduction - An artefact of single cell culture. PLoS One. 3 (9), (2008).
- Ihalainen, J. A., Riekkinen, P., Feenstra, M. G. P. Comparison of dopamine and noradrenaline release in mouse prefrontal cortex, striatum and hippocampus using microdialysis. Neuroscience Letters. 277 (2), 71-74 (1999).
- Richards, D. A., Obrenovitch, T. P., Symon, L., Curzon, G. Extracellular dopamine and serotonin in the rat striatum during transient ischaemia of different severities: a microdialysis study. Journal of Neurochemistry. 60 (1), 128-136 (1993).
- Fog, J. U., et al. Calmodulin kinase II interacts with the dopamine transporter C terminus to regulate amphetamine-induced reverse transport. Neuron. 51 (4), 417-429 (2006).
- Balázsa, T., Bíró, J., Gullai, N., Ledent, C., Sperlágh, B. CB1-cannabinoid receptors are involved in the modulation of non-synaptic [3H]serotonin release from the rat hippocampus. Neurochemistry International. 52 (1), 95-102 (2008).
- Schechter, L. E. The potassium channel blockers 4-aminopyridine and tetraethylammonium increase the spontaneous basal release of [3H]5-hydroxytryptamine in rat hippocampal slices. The Journal of Pharmacology and Experimental Therapeutics. 282 (1), 262-270 (1997).
- Boudanova, E., Navaroli, D. M., Stevens, Z., Melikian, H. E. Dopamine transporter endocytic determinants: carboxy terminal residues critical for basal and PKC-stimulated internalization. Molecular and Cellular Neuroscience. 39 (2), 211-217 (2008).
- Bowyer, J. F., et al. Interactions of MK-801 with glutamate-, glutamine- and methamphetamine-evoked release of [3H]dopamine from striatal slices. The Journal of Pharmacology and Experimental Therapeutics. 257 (1), 262-270 (1991).
- Perszyk, R. E., et al. GluN2D-containing N-methyl-D-aspartate receptors mediate synaptic transmission in hippocampal interneurons and regulate interneuron activity. Molecular Pharmacology. 90 (6), 689-702 (2016).
- Jones, S. R., et al. Profound neuronal plasticity in response to inactivation of the dopamine transporter. Proceedings of the National Academy of Sciences of the United States of America. 95 (7), 4029-4034 (1998).
- Jedema, H. P., Narendran, R., Bradberry, C. W. Amphetamine-induced release of dopamine in primate prefrontal cortex and striatum: striking differences in magnitude and timecourse. Journal of Neurochemistry. 130, 490-497 (2014).
- Buchmayer, F., et al. Amphetamine actions at the serotonin transporter rely on the availability of phosphatidylinositol-4,5-bisphosphate. Proceedings of the National Academy of Sciences. 110 (28), 11642-11647 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved